Claves para el manejo anestésico en cirugía endoscópica en el perro y el gato
Resumen breve
La cirugía endoscópica ha mejorado la exploración y capacidad diagnóstica y terapéutica, con menor trauma quirúrgico, menor estrés, mejor recuperación y menor dolor posoperatorio en comparación con la cirugía abierta. Sin embargo, conlleva desafíos anestésicos, especialmente por el neumoperitoneo, que puede causar alteraciones hemodinámicas y respiratorias debido al aumento de la presión intraabdominal (PIA). En definitiva, la anestesia en cirugía endoscópica demanda un enfoque meticuloso…Índice de contenidos
Resumen
La cirugía endoscópica ha transformado la medicina veterinaria ya que, al mejorar la exploración y capacidad diagnóstica y terapéutica con menor trauma quirúrgico, ofrece menor estrés, mejor recuperación y menor dolor posoperatorio en comparación con la cirugía abierta. Sin embargo, conlleva desafíos anestésicos, especialmente por el neumoperitoneo, que puede causar alteraciones hemodinámicas y respiratorias debido al aumento de la presión intraabdominal (PIA).
El incremento de la PIA puede reducir el gasto cardíaco, comprometer la ventilación, aumentar la presión intracraneal y afectar la función renal. Por ello, la evaluación preanestésica es fundamental, incluyendo estabilización cardiovascular, respiratoria e hidratación.
El manejo anestésico debe optimizar la analgesia mediante opioides o técnicas locorregionales. La sedación e inducción anestésica debe considerar fármacos que minimicen la esplenomegalia y el impacto cardiovascular. Se recomienda ventilación mecánica para evitar hipercapnia por atelectasia, con ajustes según la respuesta del paciente.
La monitorización continua es esencial, incluyendo ECG, presión arterial, pulsioximetría, capnometría y temperatura corporal. Complicaciones como embolia gaseosa o capnoneumotórax requieren intervención inmediata.
En la toracoscopia se provoca un neumotórax para poder tener adecuada visualización. La ventilación unipulmonar, mediante tubos de doble lumen o bloqueadores bronquiales, mejora la visibilidad quirúrgica, pero implica desafíos fisiológicos, como alteraciones en la relación ventilación/perfusión. Es fundamental realizar ventilación por presión positiva intermitente, monitorizar la oxigenación y el CO₂, idealmente mediante gasometría arterial. Al finalizar, la reexpansión pulmonar debe realizarse de forma controlada. En el posoperatorio, la analgesia multimodal y la monitorización estrecha son claves para una recuperación segura.
En definitiva, la anestesia en cirugía endoscópica demanda un enfoque meticuloso para minimizar riesgos y garantizar la seguridad del paciente.
Introducción
La cirugía endoscópica ha revolucionado la medicina veterinaria. Frente a procedimientos más invasivos que producen un mayor trauma quirúrgico, como la celiotomía o la toracotomía, esta técnica ofrece beneficios evidentes como una menor respuesta al estrés, mejor recuperación, menor dolor posoperatorio y una estancia hospitalaria más corta. Sin embargo, no está exenta de desafíos, desde una visualización limitada del campo quirúrgico hasta cambios fisiológicos causados por la insuflación de gas en la cavidad abdominal. Si bien algunos procedimientos endoscópicos son electivos, como la ovariectomía en animales jóvenes y sanos, otros requieren intervenciones en pacientes con comorbilidades, como la adrenalectomía o la colecistectomía. En estos casos, la tasa de complicaciones es mayor, y el manejo anestésico se vuelve más complejo. Independientemente del estado del paciente, comprender los cambios sistémicos que puede inducir la cirugía endoscópica y sus implicaciones en el manejo anestésico es esencial para garantizar la seguridad del paciente.
El impacto del neumoperitoneo: un desafío hemodinámico y respiratorio
Para mejorar la visibilidad en la cirugía laparoscópica, se introduce gas en la cavidad abdominal, un procedimiento conocido como neumoperitoneo. El CO₂ es el gas más utilizado debido a que se disuelve rápidamente en sangre, lo que permite almacenar grandes cantidades sin aumentar el riesgo de tromboembolismo por CO₂, por su rápida eliminación a nivel pulmonar y baja toxicidad, además de ser un gas no comburente y económico. No obstante, su insuflación eleva la presión intraabdominal (PIA), lo que desencadena una serie de cambios en el organismo. En cualquier caso, se debe monitorizar y ajustar cuidadosamente la PIA y la velocidad de flujo de gas para evitar presiones elevadas. Idealmente la técnica se debe realizar con una PIA igual o inferior a 8-10 mmHg. Las consecuencias del incremento de la PIA son:
- Una PIA alta induce vasoconstricción periférica y aumenta la presión arterial. Esta vasoconstricción es causada por la liberación de factores neurohormonales como la vasopresina y las catecolaminas.
- A medida que la PIA aumenta, se comprime el sistema venoso abdominal y el retorno venoso se reduce, disminuyendo el gasto cardíaco hasta en un 42 % en humanos.
- La compresión diafragmática compromete la distensibilidad pulmonar, disminuyendo la capacidad residual funcional y aumentando el riesgo de hipoventilación.
- La PIA incrementa la presión sobre el estómago, e incrementa el riesgo de regurgitación intraoperatoria.
- El CO₂ difunde a través del peritoneo hacia los vasos sanguíneos, donde es absorbido por la sangre, lo que provoca un aumento en la presión parcial de CO₂ en sangre arterial (PaCO₂) y puede causar acidemia. Normalmente esto no supone un problema, pero si ocurre daño microvascular en el peritoneo o si se lesionan vasos sanguíneos en la cavidad peritoneal durante la inserción de los puertos o la manipulación de órganos, el CO₂ puede difundirse directamente a la sangre e inducir una acidemia severa.
- A nivel cerebral, el aumento de la presión arterial de CO₂ provoca vasodilatación, aumentando el flujo sanguíneo cerebral (FSC) y eleva la presión intracraneal (PIC), un riesgo significativo en pacientes con comorbilidades que puedan incrementar la PIC.
- La función renal también puede verse afectada, reduciendo el flujo sanguíneo renal y la tasa de filtración glomerular. Esto puede reducir la producción de orina, aunque esta se normaliza al reducirse la PIA.
- Una PIA alta puede aumentar el tono vagal y predisponer a bradiarritmias.
- El CO2 insuflado está frío reduciendo la temperatura del paciente.
Por estas razones, en pacientes con hipovolemia, enfermedad renal, hipertensión intracraneal o enfermedades pulmonares, la cirugía endoscópica con neumoperitoneo puede no ser la mejor opción, y una laparotomía o una laparoscopia sin insuflación de gas podría ser más segura.
Preparación prequirúrgica: optimizando las condiciones del paciente
Dado el impacto del neumoperitoneo en la función respiratoria y cardiovascular, la evaluación preanestésica es clave. Se debe realizar una anamnesis, un exhaustivo examen clínico y examen laboratorial que ayude a detectar posibles alteraciones y estabilizar al paciente previo a la anestesia.
- Un ayuno adecuado (8-12 horas sin alimento, pero con acceso al agua hasta 2-3 horas antes) reduce el riesgo de aspiración.
- Si se sospecha o se identifica algún problema en el sistema respiratorio o cardiovascular, se recomienda realizar las pruebas pertinentes. Cualquier enfermedad cardíaca debe manejarse médicamente y estabilizarse antes del procedimiento, a menos que se trate de una cirugía de emergencia. Si el paciente está estable con su medicación cardíaca, esta debe continuarse incluso el día de la anestesia. Si el paciente presenta derrame pleural o neumotórax, debe drenarse antes de la anestesia y si se reacumula rápidamente, debe colocarse un tubo torácico.
- La rehidratación también es crucial en animales deshidratados, ya que el estado de volumen afecta los cambios hemodinámicos inducidos por el neumoperitoneo.
- Finalmente, vaciar la vejiga con un catéter urinario previene lesiones durante la inserción de trócares en zonas media y caudal del abdomen.
Estrategias anestésicas: minimizando riesgos y optimizando la analgesia
Aunque la cirugía endoscópica se considera menos invasiva que la cirugía abierta, sigue generando trauma tisular y respuesta al estrés. Dependiendo del tipo de procedimiento, se seleccionan diferentes estrategias analgésicas:
- Para cirugías completamente endoscópicas, buprenorfina (10-20 µg/kg) o petidina (2-5 mg/kg) pueden ser una opción adecuada.
- Para procedimientos asistidos con incisión adicional, se prefieren agonistas puros del receptor µ, como morfina o metadona (0.1-0.4 mg/kg), que se pueden administrar por vía intramuscular junto con el sedante en premedicación. Tener en cuenta el efecto emético de la morfina si consideramos la necesidad de evitar el vómito. El fentanilo, con su rápida acción, es útil en bolo antes de la inducción por vía intravenosa y puede continuarse su administración en infusión continua durante el procedimiento (IC 10-30 µg/kg/h).
El uso de técnicas locorregionales está cada vez más extendido en perros y gatos, debido al incremento de bibliografía en los últimos años, y a la oferta de formación que han facilitado su incorporación al manejo analgésico-anestésico de nuestros pacientes. Se han descrito diferentes técnicas locorregionales guiadas por ecografía y/o neuroestimulación que resultan apropiadas para el abordaje abdominal y torácico:
- Abdominal.
- Bloqueo del músculo transverso del abdomen: aproximación interfascial que produce bloqueo de la pared abdominal.
- Bloqueo del músculo cuadrado lumbar: bloqueo visceral del abdomen y de la cadena simpática a nivel abdominal.
- Torácico.
- Bloqueo paravertebral torácico: bloqueo somático, visceral y simpático de la cavidad torácica.
- Bloqueo de los nervios intercostales: bloqueo de la pared torácica
Se recomienda la lectura de libros o artículos específicos sobre este tema (bibliografía).
Si no se realiza una de las técnicas descritas, la infiltración de anestésico local en los lugares de ubicación de los puertos de abordaje laparoscópico puede contribuir a mejorar el control del dolor.
En cuanto a la elección de un sedante en premedicación o un anestésico inyectable para la inducción anestésica, hay que tener en cuenta las consideraciones del paciente determinadas en el examen preanestésico. Con respecto a las consideraciones asociadas al procedimiento, un aspecto crucial en la anestesia para cirugía endoscópica es el riesgo de esplenomegalia inducida por fármacos, que puede aumentar el peligro de lesión esplénica al insertar la aguja de Veress o un trócar en el abdomen. Aunque se han publicado resultados contradictorios, estudios han demostrado que acepromacina, propofol y tiopental aumentan el volumen esplénico, mientras que la dexmedetomidina tiene un impacto mínimo.
En cuanto a su repercusión a nivel cardiovascular, tener en cuenta que los opioides incrementan el tono vagal, efecto que puede añadirse al de la PIA y propiciar la aparición de bradiarritmias sobre todo durante la insuflación. Para inducir la anestesia, propofol y alfaxalona son opciones seguras, mientras que la ketamina, debido a su efecto simpaticomimético, aumenta la liberación de catecolaminas y puede no ser ideal en pacientes con enfermedad cardiovascular. En cualquier caso, la administración lenta y a dosis-efecto del anestésico, minimiza el riesgo de apnea, hipotensión o bradicardia durante la inducción.
Recordar preoxigenar con mascarilla al paciente durante 3-5 minutos previo a la inducción anestésica.
Una vez bajo anestesia general, todos los pacientes deben ser intubados para garantizar una ventilación adecuada.
Los anestésicos inhalatorios como el isoflurano y el sevoflurano son preferibles para el mantenimiento. Deben ser vehiculados en oxígeno o en oxígeno y aire (oxígeno al 60 %), pero evitar utilizar óxido nitroso, ya que puede expandirse en espacios llenos de gas y agravar posibles complicaciones.
En ciertos casos, el uso de bloqueantes neuromusculares como el atracurio permite reducir la PIA necesaria para una adecuada visualización quirúrgica, minimizando los cambios hemodinámicos y ventilatorios asociados con el neumoperitoneo. Sin embargo, su administración requiere ventilación mecánica y monitorización específica, así como la reversión del fármaco previo a la recuperación.
Monitorización
Durante la cirugía endoscópica, el estado del paciente puede cambiar en cualquier momento. Por ello, la monitorización debe ser constante, asegurando un manejo anestésico óptimo y reduciendo el riesgo de complicaciones. Se debe monitorizar:
- Electrocardiograma (ECG): el neumoperitoneo y la manipulación de órganos cercanos al corazón pueden desencadenar arritmias. Un ECG continuo permite detectar y tratar cualquier alteración en el ritmo cardíaco de manera temprana.
- Presión arterial: puede medirse de manera no invasiva mediante manguito, con controles cada tres o cinco minutos en pacientes sanos. Sin embargo, en animales con patologías cardíacas o respiratorias, se recomienda la monitorización invasiva mediante un catéter arterial, colocado generalmente en la arteria metatarsiana. Esto facilita también la toma de muestras para análisis de gases sanguíneos en caso necesario.
- Pulsioximetría (SpO2): los procedimientos endoscópicos pueden comprometer la ventilación, aumentando el riesgo de hipoxemia. La pulsioximetría permite detectar esta alteración y tomar medidas correctivas antes de que se convierta en un problema mayor.
- ETCO₂ y función ventilatoria: la monitorización mediante capnometría del ETCO₂ es clave en estos procedimientos, ya que la insuflación de CO₂ puede aumentar la PaCO₂ y afectar la ventilación. Ajustar los parámetros del ventilador es esencial para mantener un equilibrio adecuado y prevenir hipoventilación. El ETCO2 monitorizado mediante capnometría mide la presión parcial de CO2 (PCO2) al final de la espiración, lo que representa la PACO2 en los alvéolos. Debido a que se supone que la PACO2 es la misma que la PaCO2, el ETCO2 puede utilizarse para estimar la PaCO2 y la función ventilatoria. La laparoscopia aumenta la PaCO2 debido a la insuflación de CO2 y a la depresión ventilatoria asociada con una alta PIA. La toracoscopia también induce un neumotórax, lo que deprime la ventilación. Por lo tanto, la monitorización del ETCO2 para detectar hipoventilación es muy importante. Además, el ETCO2 guía el ajuste de los parámetros del ventilador para tratar eficazmente la hipoventilación durante la anestesia general.
- Análisis de gases sanguíneos: normalmente no se realiza en pacientes sanos, pero dependiendo de las comorbilidades y su estado cardiorrespiratorio, puede ser fundamental para evaluar la función pulmonar, comparando la PaCO₂ con el CO₂ al final de la espiración (ETCO₂). Un aumento repentino en el espacio muerto alveolar (incremento de la diferencia PaCO₂ - ETCO₂ por reducción brusca del ETCO2) podría ser una señal de embolia pulmonar. En sangre arterial también se puede determinar la PaO2, para conocer la presión de oxígeno disuelto en sangre.
- Temperatura corporal: durante la laparoscopia, el gas insuflado puede enfriar los órganos abdominales y provocar hipotermia. En toracoscopia, el aire ambiente que ingresa a la cavidad torácica también puede reducir la temperatura esofágica. Para una monitorización precisa, la temperatura debe medirse en el recto en toracoscopia y en el esófago en laparoscopia.
Laparoscopia: consideraciones anestésicas especiales
Durante la inducción del neumoperitoneo, es común observar un aumento en la presión arterial media y una disminución del gasto cardíaco. Estos cambios no suelen ser significativos si la presión intraabdominal (IAP) se mantiene por debajo de 12 mmHg. Sin embargo, una insuflación demasiado rápida puede generar alteraciones importantes, especialmente en pacientes con hipovolemia o enfermedad cardiaca (Figura 1A-B).
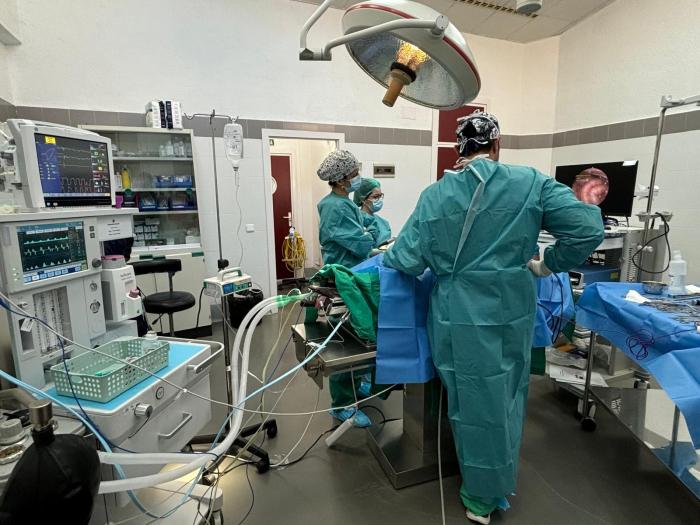
Figura 1. Perro anestesiado para realización de ovariohisterectomía mediante laparoscopia. Obsérvese el animal (A) anestesiado y monitorizado, y (B) el posicionamiento durante el procedimiento.

► Consejo práctico: la administración de un bolo de cristaloides (10–20 ml/kg) 10-15 minutos antes del neumoperitoneo puede minimizar estos efectos.
Ajustes en la ventilación
La insuflación de CO₂ puede elevar la PaCO₂, requiriendo ajustes en la ventilación minuto. Si estos cambios afectan la estabilidad cardiovascular, reduciendo la presión arterial, es aceptable mantener una PaCO₂ en torno a 50 mmHg, siempre que el pH sanguíneo no baje de 7.3. En pacientes con riesgo de incremento de la PIC, mantener la normocapnia.
Debido al desplazamiento del diafragma por la IAPse reduce la capacidad pulmonar y dificulta la ventilación. Para contrarrestarlo, se recomienda utilizar ventilación por presión positiva intermitente (VPPI):
- El modo de ventilación controlada por volumen parece ser más efectivo para garantizar la administración de un volumen corriente adecuado al paciente, a riesgo de alcanzar presiones más altas en la vía aérea. Si no hay ninguna afectación pulmonar, en estos pacientes se aceptan presiones en vía aérea de 20-30 mmHg.
- Ajustar los parámetros del ventilador para normalizar la PaCO2 puede ser un desafío. Parece que volúmenes corrientes mayores con una FR más baja proporciona una ventilación más eficaz que el uso de volúmenes menores con FR alta. Se recomienda un volumen corriente de 6-10 ml/kg.
- Aplicar presión positiva al final de la espiración (PEEP) de 5 cm H₂O para prevenir atelectasia. Puede ser más necesario en pacientes de gran tamaño y/o cirugías prolongadas.
Complicaciones potenciales y su manejo
Embolia gaseosa
Aunque rara, la embolia gaseosa puede ocurrir por punción errónea con la aguja de Veress en un órgano parenquimatoso durante la introducción del gas o si se desarrolla enfisema subcutáneo. Una disminución abrupta del ETCO₂, acompañada de hipotensión y desaturación, puede ser indicativa.
Manejo inmediato:
- Suspender la insuflación de gas y desinflar el abdomen.
- Colocar al paciente en posición de Trendelenburg (cabeza abajo) para evitar que el gas se desplace hacia corazón.
- En casos graves, aspirar el gas con un catéter venoso central.
Capnoneumotórax
Si la insuflación de CO₂ provoca neumotórax, debido a una lesión diafragmática accidental, se observará un aumento del ETCO₂ y de la presión de la vía aérea inspiratoria. Se debe suspender la insuflación y monitorizar hasta su resolución, ya que se resuelve rápidamente (30-60 minutos), evitando la toracocentesis a menos que haya signos clínicos graves. Puede requerir soporte ventilatorio como el aumento de la ventilación minuto y/o la aplicación de PEEP.
Enfisema subcutáneo
Debido a una insuflación extraperitoneal accidental. Se produce un aumento de ETCO2 sin cambios de presión de la vía aérea. Suspender la insuflación y monitorizar hasta su resolución.
Bradiarritmias y taquiarritmias
Las bradiarritmias suelen ser secundarias a la estimulación vagal y, en la mayoría de los casos, no requieren tratamiento. En la experiencia del autor, en el momento de la insuflación del abdomen se incrementa el riesgo de respuesta vagal. Se minimiza con una insuflación paulatina. Sin embargo, si hay bradiarritmia e hipotensión, se puede administrar atropina (0.02 mg/kg IV).
En caso de taquiarritmia asociada con la liberación de catecolaminas, el manejo depende del tipo de arritmia:
- Supraventricular: esmolol (0.25-0.5 mg/kg IV lentamente).
- Ventricular: lidocaína (2 mg/kg IV perro; 0.75-1 mg/kg gato).
Si el procedimiento quirúrgico requiere inclinar la mesa en posición de Trendelenburg, como en la ovariectomía, realizar la maniobra lentamente para evitar cambios hemodinámicos y respiratorios bruscos. Debe asegurarse siempre y especialmente durante los cambios de posición, la permeabilidad de la vía aérea y la conexión del tubo endotraqueal al sistema respiratorio.
Toracoscopia: consideraciones anestésicas y quirúrgicas
La cirugía toracoscópica ha revolucionado la manera en que abordamos ciertos procedimientos diagnósticos y quirúrgicos que afectan a la cavidad torácica. Sin embargo, su éxito depende en gran medida de una planificación anestésica cuidadosa y de la comprensión de los efectos fisiológicos asociados. La anestesia para cirugía toracoscópica en pacientes veterinarios implica una serie de desafíos que van más allá del procedimiento quirúrgico en sí. La ventilación con presión positiva es indispensable, y el control riguroso de la oxigenación y la ventilación es clave para evitar complicaciones (Figura 2A-B).
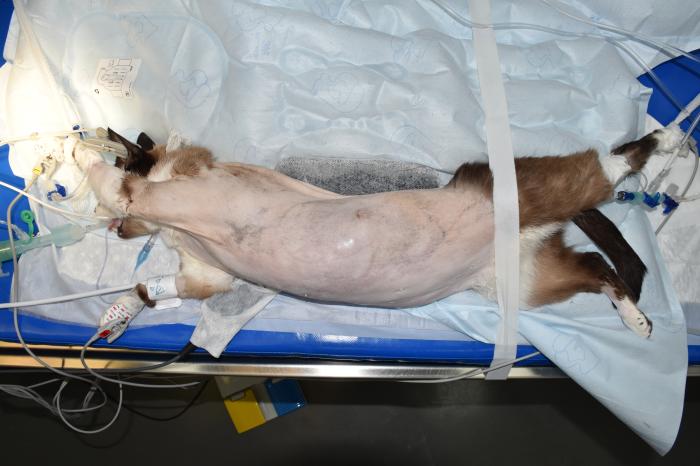
Figura 2. (A) Gato bajo anestesia general posicionado para realización de toracoscopia. (B) Realización de toracoscopia para ligar el conducto torácico en gato con quilotórax.
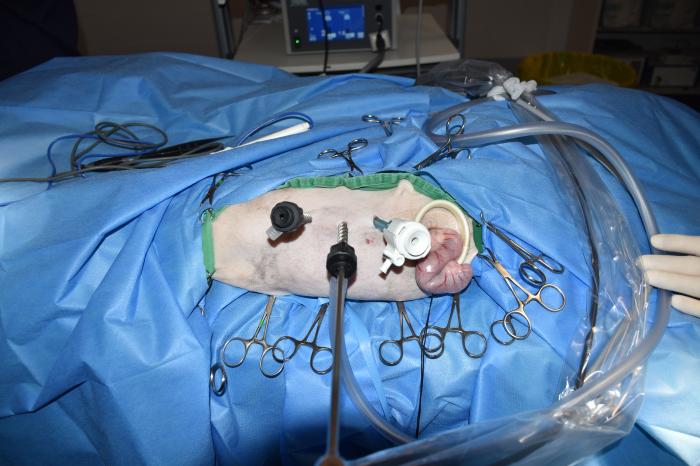
A diferencia de la laparoscopia, donde se utiliza una insuflación controlada para expandir el abdomen, la toracoscopia requiere la inducción de un neumotórax tras la colocación de los trócares o insuflación a presiones muy bajas (1-3 mm Hg) según la preferencia del cirujano. Tras la colocación del primer trócar, se introduce una pequeña cantidad de gas o simplemente aire ambiente en la cavidad torácica. Este neumotórax intencionado facilita la retracción pulmonar, creando un campo quirúrgico seguro y reduciendo el riesgo de lesiones pulmonares durante la colocación de trócares en puertos adicionales que, además, ya se insertan con control visual de óptica.
Una estrategia para optimizar la visibilidad quirúrgica es la ventilación unipulmonar. Mediante el uso de un tubo endotraqueal especializado o un bloqueador bronquial, se ocluye selectivamente un bronquio, permitiendo que un solo pulmón permanezca ventilado mientras el otro colapsa progresivamente. Esto proporciona una mejor exposición de las estructuras intratorácicas, aunque también conlleva desafíos anestésicos importantes.
Existen dos dispositivos principales para realizar la ventilación unipulmonar:
- Tubo endotraqueal de doble lumen: diseñado para humanos, este dispositivo posee dos conductos y dos manguitos inflables. Su diseño permite seleccionar qué pulmón se ventila y cuál se colapsa. Sin embargo, su uso en perros presenta limitaciones debido a diferencias anatómicas, como la mayor longitud traqueal y la falta de tamaños adecuados para razas pequeñas.
- Bloqueador bronquial: este dispositivo flexible se introduce a través de un tubo endotraqueal estándar hasta el bronquio objetivo, donde se infla un manguito para ocluir la ventilación de un pulmón. Es más versátil y ampliamente utilizado en medicina veterinaria, ya que se adapta mejor a distintas especies y tamaños de pacientes.
La correcta colocación de cualquiera de estos dispositivos es fundamental para evitar complicaciones. Aunque la auscultación torácica puede ser útil, se recomienda el uso de un broncoscopio para confirmar la ubicación adecuada.
Se puede ventilar en modo controlado por volumen o por presión. En cualquier caso, se debe reducir el volumen corriente a 5-6 ml/kg y ajustar la FR para conseguir normocapnia. Es recomendable el uso de PEEP (presión al final de la espiración) de 3-5 cm H2O.
Desafíos anestésicos y manejo de complicaciones
- La OLV altera la relación ventilación/perfusión (V/Q), ya que solo un lado del pulmón recibe aire mientras la perfusión sanguínea continúa en ambos. Aunque la eliminación de CO₂ suele mantenerse dentro de parámetros aceptables, la oxigenación puede verse comprometida. Por ello, la saturación de oxígeno (SpO₂) debe monitorizarse constantemente. Es muy recomendable la realización de gasometrías arteriales para monitorizar la oxigenación. Si se detecta hipoxemia leve a moderada, ajustes en el ventilador, como la reducción del volumen corriente y el aumento de la frecuencia respiratoria, pueden mejorar la oxigenación. En casos graves, debe suspenderse la OLV de inmediato.
- Otro desafío es el riesgo de alteraciones en el ritmo cardíaco, particularmente durante procedimientos como la pericardiectomía. La estimulación directa del corazón o la inducción de un neumotórax pueden desencadenar arritmias ventriculares, muchas de las cuales responden bien a un bolo de lidocaína.
- Al finalizar la cirugía, es crucial revertir el neumotórax para evitar complicaciones respiratorias en la recuperación. Para ello se han descrito diferentes maniobras de reclutamiento alveolar. Debe reexpandirse el pulmón poco a poco por ejemplo haciendo una ventilación hasta alcanzar una presión en vía aérea de 20-25 cm H2O y aplicar PEEP incrementando de 2 en 2 cmH2O hasta alcanzar 10-15 cmH2O, manteniéndolo 2-3 minutos en cada incremento. Antes de cerrar el tórax asegurarse de que el pulmón se ha reexpandido. Si persiste la acumulación de gas o líquido, la colocación de un tubo torácico puede ser necesaria (Figura 3).
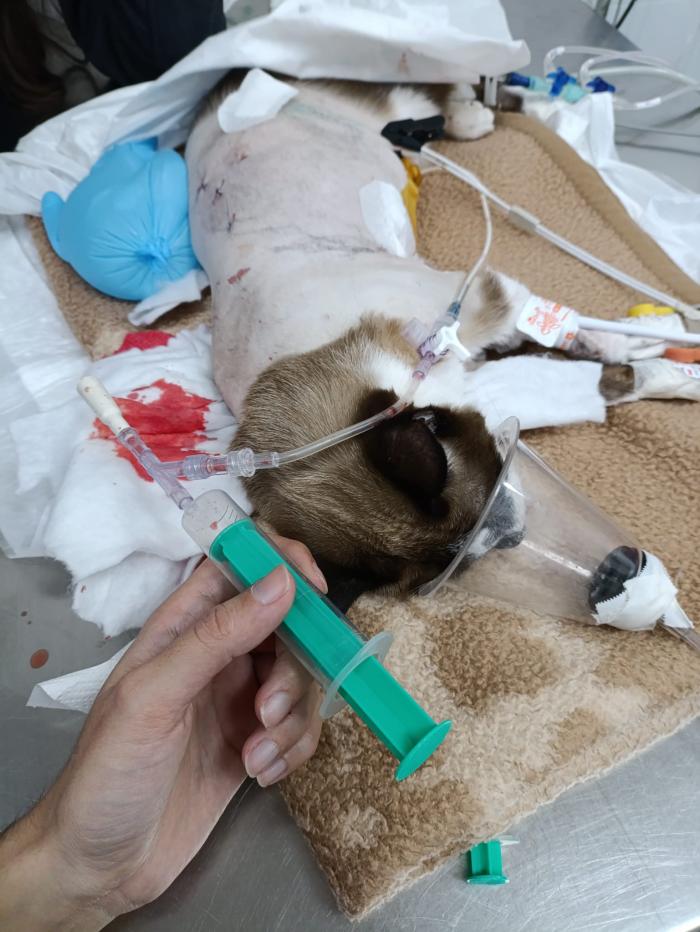
Figura 3. Recuperación anestésica de gato tras toracoscopia. Extracción de aire del tórax a través de tubo de toracostomía.
- Durante la recuperación, evaluar la función pulmonar antes de la extubación es clave. Observar la SpO₂ mientras el paciente respira aire ambiente, permite determinar si es capaz de mantener una saturación adecuada. Si la SpO₂ cae por debajo del 92 %, debe administrarse oxígeno suplementario y descartarse la presencia de complicaciones como atelectasias, embolismo pulmonar o acumulación de gas residual en la cavidad torácica.
- La monitorización del CO₂ al final de la espiración (ETCO₂) también es fundamental para detectar hipoventilación o problemas de obstrucción de la vía aérea. Durante la fase de recuperación, es común observar depresión respiratoria inducida por fármacos anestésicos y analgésicos.
- En pacientes con enfermedades cardíacas preexistentes, la monitorización posoperatoria debe extenderse al menos 24 horas, ya que son más propensos a desarrollar complicaciones cardiovasculares. Además, si se sospecha edema pulmonar, es recomendable realizar una radiografía torácica en lugar de basarse únicamente en la auscultación.
- Aunque la toracoscopia es una técnica mínimamente invasiva, sigue siendo fundamental garantizar una analgesia adecuada en el postoperatorio. Para procedimientos con incisiones pequeñas, una combinación de AINE, paracetamol, opioides como petidina, buprenorfina o tramadol suele ser suficiente. En cirugías más invasivas, donde se generan heridas de mayor tamaño, se recomienda el uso de opioides más potentes durante las primeras 24 horas, seguido de una transición a analgésicos más suaves, así como la realización de técnicas de anestesia locorregional.
Conclusión
La cirugía endoscópica ha abierto nuevas oportunidades de diagnóstico y tratamiento en la medicina veterinaria, ofreciendo una alternativa menos invasiva con múltiples beneficios para los pacientes. Sin embargo, la insuflación de CO₂ y el aumento de la presión intraabdominal durante la laparoscopia, pueden desencadenar cambios sistémicos que afectan la función cardiovascular, respiratoria, cerebral y renal.
Un adecuado manejo anestésico es clave para reducir riesgos y garantizar una recuperación segura. Desde la selección de fármacos hasta la monitorización intraoperatoria, cada decisión cuenta para optimizar el bienestar del paciente. Con una evaluación cuidadosa y estrategias anestésicas adaptadas a cada caso, la cirugía endoscópica seguirá consolidándose como una herramienta fundamental en la práctica veterinaria.
Bibliografía
- Arulpragasam SP, Case JB, Ellison GW. Evaluation of costs and time required for laparoscopic-assisted versus open cystotomy for urinary cystolith removal in dogs: 43 cases (2009-2012). J Am Vet Med Assoc 2013;243:703–8.
- Asakawa Makoto. Anesthesia for endoscopy. Vet Clin Small Anim 2016; 46: 31-44.
- Fors D, Eiriksson K, Arvidsson D, et al. Gas embolism during laparoscopic liver resection in a pig model: frequency and severity. Br J Anaesth 2010;105:282–8.
- Gutt CN, Oniu T, Mehrabi A, et al. Circulatory and respiratory complications of carbon dioxide insufflation. Dig Surg 2004;21:95–105.
- Johannsen G, Andersen M, Juhl B. The effect of general anaesthesia on the haemodynamic events during laparoscopy with CO2-insufflation. Acta Anaesthesiol Scand 1989;33:132–6.
- Joris JL. Anesthesia for laparoscopic surgery. In: Miller RD, editor. Miller’s anesthesia. 6th edition. Philadelphia: Elsevier; 2005. p. 2285–306.
- Portela D, Romano M, Otero PE. Locoregional anesthesia of the thoracic limbs and thorax in small animals. Vet Clin Amall Anim 2019; 49:1063-1083.
- Portela DA, Verdier N, Otero PE. Regional anesthetic techniques for the pelvic limb and abdominal wall in small animals: A review of the literature and technique description. Vet J 2018; 238; 27-40.
- Rist M, Hemmerling TM, Rauh R, et al. Influence of pneumoperitoneum and patient positioning on preload and splanchnic blood volume in laparoscopic surgery of the lower abdomen. J Clin Anesth 2001;13:244–9.
- Safran DB, Orlando R 3rd. Physiologic effects of pneumoperitoneum. Am J Surg 1994;167:281–6.
- Staffieri F, Lacitignola L, De Siena R, et al. A case of spontaneous venous embolism with carbon dioxide during laparoscopic surgery in a pig. Vet Anaesth Analg 2007;34:63–6.
- Wilson DV, Evans AT, Carpenter RA, et al. The effect of four anesthetic protocols on splenic size in dogs. Vet Anaesth Analg 2004;31:102–8.
 by Multimédica
by Multimédica