¿Es posible reducir los efectos cardiovasculares de los agonistas α-2?: Herramientas y estrategias
Resumen breve
Los agonistas de los receptores α-2 adrenérgicos se emplea principalmente por sus efectos sedantes y analgésicos durante el periodo perioperatorio. Sin embargo, aunque este grupo de fármacos tienen unos marcados efectos cardiovasculares, hoy en día existen algunas herramientas y estrategias que pueden ser empleadas para reducir este impacto hemodinámico. El empleo de dosis bajas y la administración muy lenta de un bolo de carga deben ser consideradas cuando se requiera el empleo de estos fármacos…Índice de contenidos
Resumen
Los agonistas de los receptores α-2 adrenérgicos se emplea principalmente por sus efectos sedantes y analgésicos durante el periodo perioperatorio. Sin embargo, aunque este grupo de fármacos tienen unos marcados efectos cardiovasculares, hoy en día existen algunas herramientas y estrategias que pueden ser empleadas para reducir este impacto hemodinámico. El empleo de dosis bajas y la administración muy lenta de un bolo de carga deben ser consideradas cuando se requiera el empleo de estos fármacos en animales geriátricos, con enfermedad cardiovascular o pacientes críticos. Y, si aun así aparecen efectos adversos derivados de la vasoconstricción periférica, pueden emplearse fármacos vasodilatadores, como los anestésicos generales u otros fármacos con acción directa sobre los adrenoceptores como el labetalol.
Introducción
Los agonistas de los receptores α-2 adrenérgicos se emplea principalmente por sus efectos sedantes y analgésicos durante el periodo perioperatorio (Figura 1). Existen diversos fármacos de este grupo, siendo los más empleados en la actualidad, la medetomidina y su isómero activo (dextrógiro), la dexmedetomidina, que presenta una alta especificidad sobre los receptores α-2 (ratio α-1/α-2 de 1/1620). Su utilización disminuye el estrés del paciente y reduce las dosis de otros agentes utilizados en protocolos de anestesia equilibrada.
Receptores α-2 en el organismo y efectos sistémicos
Este grupo de fármacos, actúan principalmente sobre los receptores α-2 adrenérgicos produciendo una inhibición de la liberación y circulación de noradrenalina a nivel presináptico. Tienen acción a nivel de sistema nervioso central (sedación y ansiolísis), sistema cardiovascular (vasoconstricción y bradicardia), sistema digestivo (disminución de la motilidad y de secreción) y sistema endocrino (inhibición en la liberación de insulina). Produce también relajación muscular y analgesia (somática y visceral).
Todos estos efectos pueden ser dosis y velocidad-dependiente. Dentro de los receptores α-2 existen varios subtipos como son los α-2 A, B y C. La unión a cada uno de ellos tiene diferentes acciones y pueden existir diferentes proporciones de receptores α-2 entre especies y entre individuos. Esto podría explicar que un mismo agonista α-2 tenga diferentes efectos clínicos en diferentes individuos. Para el estudio de estas diferencias podría emplearse la farmacogenética, tal como se está haciendo en la especie humana con estos fármacos1.
El efecto de sedación se produce principalmente por la acción sobre los receptores localizados en estructuras supra-espinales, más concretamente en el locus cerúleo, produciendo una sedación muy similar al sueño natural.
La medetomidina y la dexmedetomidina, además de unirse a los receptores α-2, se ha demostrado que pueden unirse a receptores α-1, produciendo parte de los efectos adversos cardiovasculares. También se unen a receptores imadazólicos tipo 1 produciendo efectos anti-arrítmicos y a receptores imadazólicos tipo 2 produciendo efectos neuroprotectores.
Estos fármacos se están empleando actualmente medicina humana en pacientes críticos debido a que además de los efectos de sedación y analgesia ya conocidos, tienen otros efectos beneficiosos durante el proceso quirúrgico como el efecto anti-inflamatorio o el efecto protector sobre diversos órganos, debido en gran medida al bloqueo del sistema simpático2.
Sin embargo, también posee algunos efectos cardiovasculares que han hecho que este grupo de fármacos esté contraindicado en animales con patología cardiaca. En el estudio publicado por B.C. Bloor en el año 1992 estudiaron los efectos de la dexmedetomidina a 20 mcg/kg por vía IV y vieron un aumento de la PAM de 67 mmHg tras un minuto de la administración, que se mantenía durante 4 horas, aunque no con la misma intensidad.
De forma simultánea la FC caía de 129 a 60 lpm y el gasto cardiaco de 3,5 a 0,9 L/min, mientras que las resistencias vasculares sistémicas subían de 2460 a 14.700 dynas/seg/cm-5 (Figuras 2-4). En el año 2015, S.C. Grasso publica otro estudio comparando las premedicaciones con acepromacina y dexmedetomidina en el perro. En esta ocasión las dosis estudiadas fueron de 15 mcg/kg de dexmedetomidina y los resultados mostraban unos cambios hemodinámicos en el grupo de dexmedetomidina muy similares que se vieron en el estudio de Bloor.
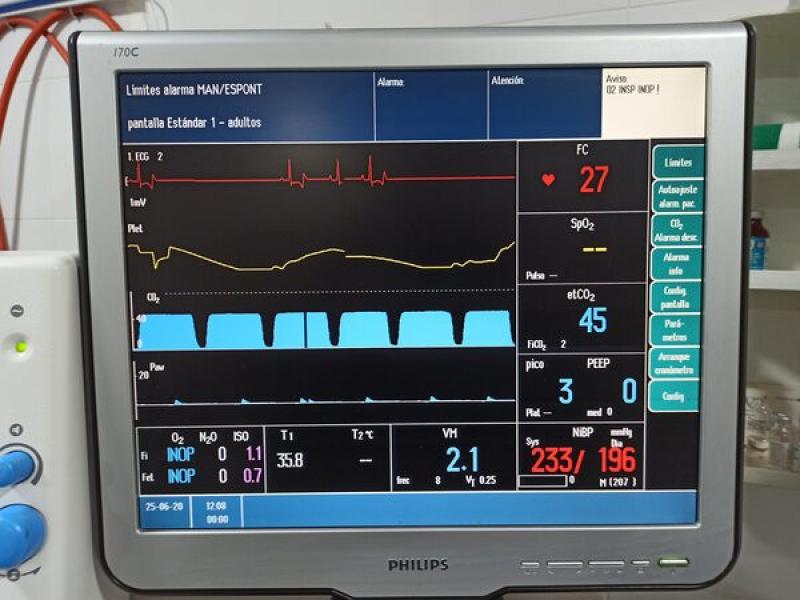
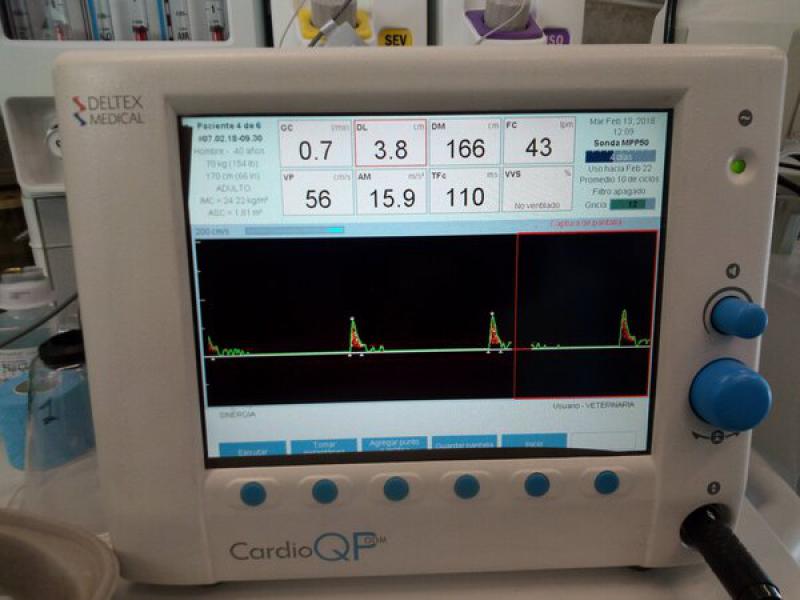
| Figura 4. Bajada del gasto cardiaco tras la administración de dexmedetomidina a 1 mcg kg. |
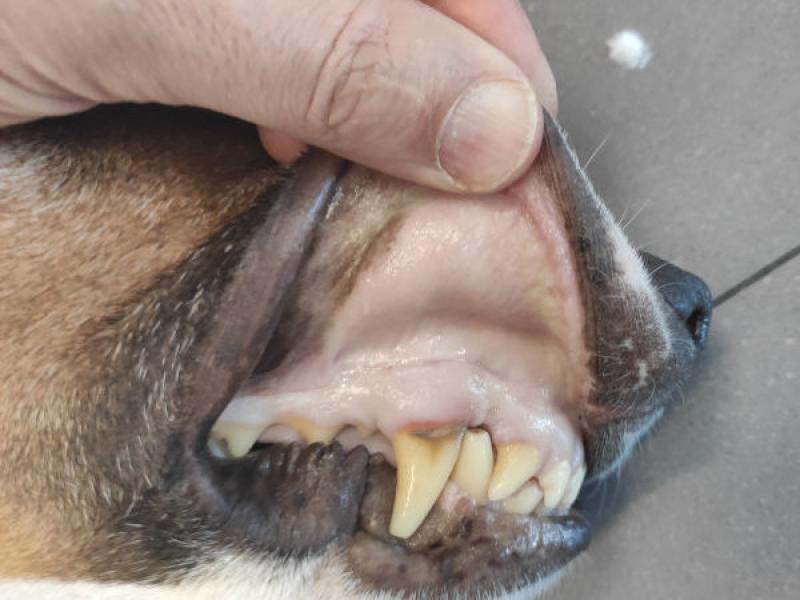
Durante esta fase inicial de vasoconstricción periférica y reducción del volumen de eyección es frecuente encontrar mucosas pálidas o incluso ligeramente azuladas, no por hipoxia sino por la marcada vasoconstricción periférica (Figura 5). Pasada esta fase inicial la presión arterial se reduce y puede incluso llegar a producir una ligera hipotensión (especialmente los agonistas α-2 más antiguos como la xilacina).
Reversión de los efectos adversos
Para tratar de evitar la bradicardia que se producía hubo varios estudios que valoraban la combinación de agonistas α-2 junto con fármacos anticolinérgicos como la atropina o el glicopirrolato. Si bien, algunos autores veían una ventaja a la administración previa de atropina (20 minutos antes de la administración del agonista α-2), ya que la frecuencia cardiaca se reducía en menor medida que cuando no se administraba, son muchos los trabajos que concluyen que la administración conjunta de estos dos fármacos puede producir un aumento muy importante de la presión arterial (especialmente de la presión arterial sistólica, llegando a valores de más de 200 mmHg) e incluso alteraciones a nivel pulmonar con aparición de edema agudo de pulmón3.
También se han desarrollado varios fármacos que pueden revertir total o parcialmente los efectos de los agonistas α-2. En este sentido, el primer fármaco que se empleó fue la yohimbina (comercializado como antagonista de la xilacina) y posteriormente el atipamezol (comercializado como antagonista de la medetomidina y de la dexmedetomidina).
Estos dos fármacos son realmente “antídotos” completos de los agonistas α-2 y por tanto pueden revertir tanto sus efectos adversos (cardiovasculares) como sus efectos beneficiosos (analgésicos y sedantes). En el entorno de cirugía y anestesia van a ser empleados en el caso de una situación de emergencia, principalmente, ya que los animales pueden despertarse y comenzar a sentir dolor. Sin embargo, en el caso de sedaciones para procedimientos diagnósticos no doloroso, estos fármacos pueden resultar muy útiles, ya que aceleran la recuperación de los animales.
Tratando de encontrar un fármaco que puede revertir solo los efectos adversos de los agonistas α-2 se ha desarrollado el fármaco MK-467 (Vatinoxan) que puede revertir los efectos de vasoconstricción periférica y por tanto la bradicardia refleja que conlleva. Este fármaco aún se encuentra en fase de investigación y aún no está comercializado para su uso en animales en España, pero ha demostrado que cuando se administra de forma conjunta con la medetomidina y la dexmedetomidina puede reducir los efectos de vasoconstricción tanto en perros como en gatos, aunque parece que la bradicardia no se revierte completamente (al menos en la especie felina)4.
El objetivo principal de los fármacos para revertir los efectos adversos de los agonistas α-2 es producir una vasodilatación, para que no se produzca el aumento de la poscarga y la consiguiente bajada del volumen de eyección y del gasto cardiaco. Por esta razón muchos de los efectos vasculares de estos fármacos se reducen cuando se administran fármacos anestésicos como el propofol, alfaxalona, isoflurano o sevoflurano. Estos anestésicos generales son potentes vasodilatadores y, por tanto, potencialmente, puede revertir estos efectos adversos.
Nuevas estrategias para prevenir los efectos adversos
Los primeros estudios con medetomidina y dexmedetomidina recomendaban unas dosis mucho más altas que las que se emplean actualmente en la clínica (15-20 mcg/kg vs 0,5-2 mcg/kg), pero es importante conocer que todos los efectos de los agonistas α-2 podrían ser dosis dependiente. Sin embargo, un estudio con medetomidina realizado por B. Pypendop en el año 1998 determinó que esta tenía prácticamente los mismos efectos cardiovasculares a 1 que a 20 mcg/kg, al menos en los primeros 30 minutos.
Aunque, por otro lado, varios estudios previos y posteriores con dexmedetomidina pudieron demostrar que este fármaco tiene unos efectos dosis-dependiente a nivel de las resistencias vasculares sistémicas y coronarias, así como sobre el índice cardiaco5,6.
También la velocidad de administración puede ser un factor determinante en la gravedad del impacto hemodinámico. Desde que la dexmedetomidina fue aprobada para medicina humana la velocidad de administración recomendada para su dosis de carga inicial era de 5 a 10 minutos, sin embargo, en la mayoría de los estudios en veterinaria, la velocidad de administración era mucho mayor (entre 30 y 60 segundos) (Figura 6).
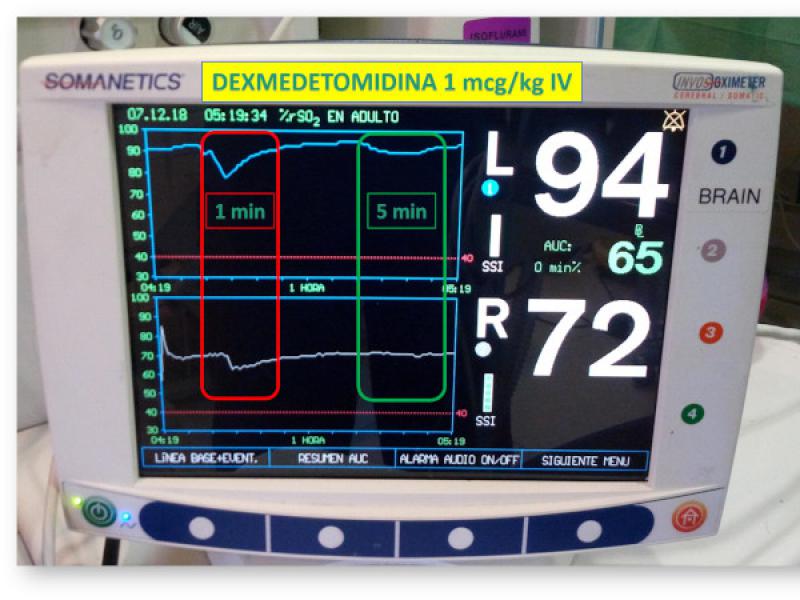
Esta podría ser una de las razones por la que los efectos adversos aparezcan descritos en menor medida en medicina veterinaria que en veterinaria (la incidencia de bradicardia en el paciente pediátrico humano es del 3 %)7.
Otra línea diferente de trabajo para tratar de reducir los efectos adversos de los agonistas α-2 es emplear rutas de administración alternativas. La administración nasal de la dexmedetomidina ha demostrado tener unos efectos más sedantes que la administración por vía intramuscular (con unos niveles en el líquido cefalorraquídeo más altos, probablemente debido a una absorción más directa) y por lo tanto podría tratar de reducirse la dosis total administrada y de esta manera los efectos adversos8.
También cuando la dexmedetomidina se administra en el acupunto GV-20 tiene unos efectos más potentes y duraderos, lo que podría sugerir que una dosis más baja administrada en un determinado acupunto podría tener los mismos efectos sedantes con menores efectos cardiovasculares9.
Sin embargo, estas vías de administración alternativas tienen que ser más estudiadas en animales para confirmar estos resultados.
Otra opción disponible en el mercado actualmente es usar un fármaco con acción bloqueante del sistema adrenérgico, y más concretamente que tengan la capacidad producir un bloqueo de los α-adrenoceptores. En este sentido pueden ser usado algunos de los fármacos β-bloqueantes más antiguos, ya que también tienen también acción sobre receptores α.
En concreto el labetalol es un fármaco con un ratio α/β bloqueo predominantemente β en la especie humana, sin embargo cuando se administra en perros y gatos se produce un α bloqueo importante, provocando una bajada de la poscarga, de la presión arterial y de las resistencias vasculares sin producir una reducción muy importante de la frecuencia cardiaca.
También es sabido que el labetalol no bloquea los receptores α-2 sino los α-1 fundamentalmente, y por esta razón podría ser empleado para revertir parte de los efectos adversos que tienen los agonistas α-2 en animales, sin revertir los efectos de sedación y analgesia.
Las primeras publicaciones del labetalol son de los años 70, donde se empleaba este fármaco en perros como animales de experimentación en modelos de hipotensión controlada para anestesia. De estas primeras publicaciones se saben que los efectos del labetalol por vía IV son de vasodilatación principalmente y que las dosis en la especie canina son de 0,1 a 0,5 mg/kg. La duración del fármaco es mucho mayor en la especie humana que en el perro, donde tiene una duración clínica de unos 30-40 min.
En la experiencia del autor, cuando se administra el labetalol por vía IV a una dosis de 0,1-0,2 en animales que han recibido dexmedetomidina, se reduce de forma muy rápida la presión arterial (debido a una reducción de la poscarga), sube el volumen sistólico, la presión de pulso (diferencial entre PAS y PAD) y el gasto cardiaco.
La frecuencia cardiaca tras la administración del labetalol sube de forma significativa, debido a que se pierda la vasoconstricción del agonista α-2, siendo esta la principal responsable de la bradicardia que se produce. Esto es algo controvertido, ya que el labetalol tiene también una acción β-bloqueante, y por esta razón tiene la capacidad de producir una bajada de la FC. Sin embargo, en la experiencia del autor, el efecto observado es un aumento de la FC, ya que los animales vienen de un estado de vasoconstricción muy potente y una consecuente bradicardia.
Estos efectos del labetalol pueden verse tanto en perros como en gatos, y son especialmente evidentes cuando se monitoriza el volumen de eyección de forma continua. El labetalol comienza a hacer efectos menos de 1 minuto tras su administración y tiene su acción máxima a los 3-4 minutos (apreciación clínica del autor). La duración de los efectos clínicos es variable, en función de la dosis del labetalol y del agonista α-2 (Figuras 7 y 8).
| Figura 7. Gato con dexmedetomidina. Se puede observar una FC baja y una vasoconstricción marcada con hipertensión. |
| Figura 8. Mismo gato tras la admininstración de labetalol IV. |
Los posibles efectos adversos del empleo del labetalol en perros y gatos se derivan de su acción sobre los receptores α y β y son: vasodilatación excesiva con hipotensión marcada (especialmente si se usa a dosis altas y junto con otros vasodilatadores potentes) y bradicardia. Sin embargo, aunque potencialmente tiene capacidad de producir bradicardia en el perro, realmente es muy improbable que este aparezca si se emplea para revertir una vasoconstricción excesiva.
Otra posibilidad para tratar de reducir los efectos de vasoconstricción de los agonistas α-2 es administrar de forma conjunta acepromacina, ya que esta posee efectos de bloqueo sobre receptores α-1 y podría evitar o reducir los efectos adversos de los agonistas α-2. Esto, aunque teóricamente podría ser una buena alternativa, no ha demostrado tener unas grandes ventajas clínicas y pueden aparecer periodos de hipotensiones debido, probablemente, a que los efectos de vasoconstricción de los agonistas α-2 tiene una duración inferior a una hora, pero sin embargo los efectos de bloqueo del sistema simpático pueden ser más duraderos, solapándose con los efectos de la acepromacina, que tiene una duración de entre 4 y 8 horas (dependiendo de la dosis empleada)10.
Por tanto, si se van a emplear de forma conjunta, se debe monitorizar de forma muy estrecha la presión arterial durante todo el procedimiento, especialmente a partir de los 60 minutos de su administración conjunta. Otra potencial desventaja del empleo de la acepromacina en esta situación es que tiene efectos centrales, y va a producir una hipnosis más profunda en los animales y una recuperación más prolongada.
Quizá un abordaje muy racional es valorar los efectos que tienen los agonistas α-2 en conjunto con los anestésicos generales, ya que estos (halogenados, propofol y alfaxalona) tienen una capacidad de producir una vasodilatación muy potente (dosis-dependiente) y por tanto, como habitualmente los agonistas α-2 se van a emplear para el entorno de anestesia general, los efectos cardiovasculares resultantes de los dos fármacos actuando de simultánea serán mucho menores que cuando se administra solo el agonista α-2 o sólo el agente halogenado.
Así se vio en el estudio de S.C. Grasso, donde el gasto cardiaco bajaba de 3,2 l/min a 1,3 l/min a los pocos minutos de administrar la dexmedetomidina, pero cuando se realizaba la intubación y comenzaba la administración del isoflurano, el gasto cardiaco iba subiendo paulatinamente hasta 2,5 l/min durante los siguientes 30 minutos.
En función de estos resultados podríamos decir que la administración de anestesia general soluciona gran parte de los problemas hemodinámicos que origina la dexmedetomidina. Sin embargo, dar una dosis elevada de anestésicos generales para tratar de revertir los efectos de vasoconstricción tiene como contraindicación que estamos profundizando el plano de hipnosis de forma excesiva y esto podría tener efectos directos sobre el sistema nervioso central (teoría de la apoptosis neuronal), sobre el riñón y sobre el hígado.
Por último, cabe destacar que cuando se habla de los efectos cardiovasculares de los agonistas α-2 se suele hablar de los efectos sobre la macrohemodinamia. Sin embargo, cuando se han realizado estudios sobre la microhemodinamia en animales de investigación se ha visto que la dexmedetomidina previene las alteraciones sobre la microcirculación que se origina por el estrés quirúrgico11.
También, cuando se estudió la oxigenación directa del miocardio, se vio que no se alteraba tras la administración de una dosis de 1 mcg/kg de dexmedetomidina en el perro12. Y, por otro lado, cuando se estudió la entrega de oxigeno y el consumo de oxígeno a nivel sistémico (DO2 y VO2) en animales premedicados con acepromacina o dexmedetomidina tampoco se vieron diferencias clínicamente significativas, a pesar de que en los animales del grupo de acepromacina tenían un gasto cardiaco mayor, y una menor resistencia vascular sistémica.
Conclusiones
A pesar de que los agonistas α-2 son fármacos con unos marcados efectos cardiovasculares, hoy en día existen estrategias que pueden ser empleadas para reducir este impacto hemodinámico. El empleo de dosis bajas y la administración muy lenta de un bolo de carga deben ser consideradas cuando se requiera el empleo de estos fármacos en animales geriátricos, con enfermedad cardiovascular o pacientes críticos.
Si, a pesar de haber empleado una dosis muy baja y a una velocidad de administración aparecen efectos adversos derivados de la vasoconstricción periférica, pueden emplearse fármacos vasodilatadores, como pueden ser los anestésicos generales u otros fármacos con acción directa sobre los adrenoceptores.
En el futuro inmediato aparecerán en el mercado fármacos específicos para revertir los efectos cardiovasculares de los agonistas α-2, pero en la actualidad puede ser usado el labetalol para la reversión de los efectos vasculares o el atipamezol para antagonizar todos los efectos de los agonistas α-2.
Bibliografía
- Talke P, Stapelfeldt C, Lobo E, Brown R, Scheinin M, Snapir A. Alpha-2B adrenoceptor polymorphism and peripheral vasoconstriction. Pharmacogenet Genomics. 2005;15(5):357-363. doi:10.1097/01213011-200505000-00012
- Dong W, Chen MH, Yang YH, et al. The effect of dexmedetomidine on expressions of inflammatory factors in patients with radical resection of gastric cancer. Eur Rev Med Pharmacol Sci. 2017;21(15):3510-3515.
- Congdon JM, Marquez M, Niyom S, Boscan P. Evaluation of the sedative and cardiovascular effects of intramuscular administration of dexmedetomidine with and without concurrent atropine administration in dogs. J Am Vet Med Assoc. 2011;239(1):81-89. doi:10.2460/javma.239.1.81
- Martin-Flores M, Sakai DM, Honkavaara J, Campoy L, Portela DA, Gleed RD. Hemodynamic effects of MK-467 following intravenous administration to isoflurane-anesthetized cats concurrently receiving dexmedetomidine. Am J Vet Res. 2018;79(7):711-717. doi:10.2460/ajvr.79.7.711
- Flacke WE, Flacke JW, Bloor BC, McIntee DF, Sagan M. Effects of dexmedetomidine on systemic and coronary hemodynamics in the anesthetized dog. J Cardiothorac Vasc Anesth. 1993;7(1):41-49. doi:10.1016/1053-0770(93)90117-4
- Pascoe PJ. The cardiopulmonary effects of dexmedetomidine infusions in dogs during isoflurane anesthesia. Vet Anaesth Analg. 2015;42(4):360-368. doi:10.1111/vaa.12220
- Gong M, Man Y, Fu Q. Incidence of bradycardia in pediatric patients receiving dexmedetomidine anesthesia: a meta-analysis. Int J Clin Pharm. 2017;39(1):139-147. doi:10.1007/s11096-016-0411-5
- Santangelo B, Harel M, Fourel I, et al. Intranasal dexmedetomidine in healthy beagles: An echocardiographic and pharmacokinetic/pharmacodynamic study. Vet J. 2019;251:105346. doi:10.1016/j.tvjl.2019.105346
- Pons A, Canfrán S, Benito J, Cediel-Algovia R, Gómez de Segura IA. Effects of dexmedetomidine administered at acupuncture point GV20 compared to intramuscular route in dogs. J Small Anim Pract. 2017;58(1):23-28. doi:10.1111/jsap.12601
- Alvaides RK, Neto FJ, Aguiar AJ, Campagnol D, Steagall PV. Sedative and cardiorespiratory effects of acepromazine or atropine given before dexmedetomidine in dogs. Vet Rec. 2008;162(26):852-856. doi:10.1136/vr.162.26.852
- Yeh YC, Sun WZ, Ko WJ, et al. Dexmedetomidine prevents alterations of intestinal microcirculation that are induced by surgical stress and pain in a novel rat model. Anesth Analg. 2012;115(1):46-53. doi:10.1213/ANE.0b013e318253631c
- Willigers HM, Prinzen FW, Roekaerts PM. Comparison of the effects of dexmedetomidine and esmolol on myocardial oxygen consumption in dogs. Eur J Anaesthesiol. 2004;21(12):957-966. doi:10.1017/s0265021504000341
- Baum T, Sybertz EJ. Pharmacology of labetalol in experimental animals. Am J Med. 1983 Oct 17;75(4A):15-23
- Bloor BC, Frankland M, Alper G, Raybould D, Weitz J, Shurtliff M. Hemodynamic and sedative effects of dexmedetomidine in dog. J Pharmacol Exp Ther. 1992;263(2):690-697.
- Dardalas I, Stamoula E, Rigopoulos P, et al. Dexmedetomidine effects in different experimental sepsis in vivo models. Eur J Pharmacol. 2019;856:172401. doi:10.1016/j.ejphar.2019.05.030
- Grasso SC, Ko JC, Weil AB, Paranjape V, Constable PD. Hemodynamic influence of acepromazine or dexmedetomidine premedication in isoflurane-anesthetized dogs. J Am Vet Med Assoc. 2015;246(7):754-764. doi:10.2460/javma.246.7.754
- Saito D, Abe Y, Tani H, Kusachi S, Takeda K, Hyodo T, Haraoka S, Nagashima H. Hemodynamic effects of labetalol in the dog. Comparative study in the anesthetized open-chest dog and in the conscious dog. Arzneimittelforschung. 1986;36(1):88-91.
 by Multimédica
by Multimédica