Uso de marcapasos externo transtorácico en un perro sometido a cirugía oftalmológica
Resumen breve
Se expone a continuación un caso sobre el manejo anestésico en un perro con úlceras corneales bilaterales que requirió la utilización de un marcapasos externo para poder implantar un injerto de membrana amniótica en el ojo izquierdo y realizar la enucleación del ojo derecho, bajo anestesia general.Índice de contenidos
Resumen
Se expone a continuación un caso sobre el manejo anestésico en un perro con úlceras corneales bilaterales que requirió la utilización de un marcapasos externo. Durante las pruebas prequirúrgicas se observó una bradicardia marcada con un bloqueo auriculoventricular de tercer grado. Inicialmente se decidió priorizar la implantación de un marcapasos bajo anestesia general para la corrección de la patología cardíaca, pero debido a la evolución desfavorable del problema ocular fue necesaria la colocación un marcapasos externo para poder implantar un injerto de membrana amniótica en el ojo izquierdo y realizar la enucleación del ojo derecho, bajo anestesia general.
Introducción
El bloqueo auriculoventricular de tercer grado (BAVIII) es una alteración de la conducción eléctrica del corazón que implica una disociación eléctrica entre las aurículas y los ventrículos, pudiendo provocar ritmos de escape ventricular junto con una frecuencia cardíaca (FC) baja (40 - 60 lpm), que limita el mantenimiento de un gasto cardíaco adecuado. Los síntomas pueden ser, desde inexistentes o leves como la intolerancia al ejercicio, hasta graves como la insuficiencia cardíaca congestiva, los síncopes o la muerte1.
Durante la anestesia en pacientes con BAVIII se pueden administrar fármacos parasimpaticolíticos como atropina o glicopirrolato para aumentar la FC; sin embargo, la respuesta no siempre es la esperada y el aumento de la FC puede no ser significativo2, por lo tanto, el tratamiento de elección para corregir esta alteración en la conducción es la implantación de un marcapasos interno1,3.
Los marcapasos son dispositivos electrónicos que generan impulsos eléctricos de baja energía para controlar la frecuencia y el ritmo cardíacos. Constan de dos elementos principales: un generador de impulsos que contiene la batería y los componentes electrónicos, y las derivaciones o cables, que se sitúan desde el generador hasta entrar en contacto con el paciente para detectar la actividad cardíaca intrínseca y emitir un impulso despolarizante.
Según el tipo de estimulación, los marcapasos pueden ser temporales o permanentes. Los primeros se suelen emplear para tratar bradiarritmias graves transitorias en unidades de cuidados intensivos, durante la colocación de marcapasos permanentes bajo anestesia general o como soporte durante la anestesia de pacientes con bradicardia grave, sometidos a cirugías no cardíacas, como el presente caso. A su vez, los marcapasos temporales se pueden clasificar en transtorácicos o transvenosos. La implantación de los marcapasos transvenosos es invasiva, ya que las derivaciones se sitúan en el ventrículo derecho a través de un acceso vascular venoso, mientras que la colocación de los marcapasos transtorácicos es más sencilla y no invasiva, mediante electrodos situados en el pecho del paciente4.
Durante el uso del marcapasos hay que evitar cualquier tipo de interferencia electromagnética (electrocauterios, radioterapia, cardioversión o desfibrilación, neuroestimuladores, resonancia magnética, monitores de potenciales evocados, teléfonos móviles, etc.) que podrían alterar su funcionamiento normal6. También se ha comprobado que algunos factores químicos como la hipoxia miocárdica, la administración de fármacos antiarrítmicos y las alteraciones del pH y los electrolitos, pueden modificar el umbral de estimulación y provocar un fallo del marcapasos5.
El empleo de dispositivos transtorácicos permite reducir las complicaciones asociadas a los marcapasos transvenosos como flebitis, arritmias, neumotórax o perforación cardiaca4; además, su colocación es más sencilla, rápida y requiere menos habilidad técnica.
Los marcapasos permanentes se emplean en pacientes con bradiarritmias que pueden provocar sintomatología, como BAVIII, síndrome de seno enfermo o parada auricular persistente. Su colocación se realiza bajo anestesia general, situando las derivaciones directamente en el corazón y el generador de impulso en el subcutáneo2,6.
Caso clínico
Acudió a consulta oftalmológica un perro Shih-tzu, macho, de 2 años y 7.3 kg, con una perforación corneal profunda en el ojo derecho (OD) que requería tratamiento quirúrgico urgente. El paciente no presentó antecedentes clínicos reseñables. En la exploración física, la auscultación fue normal, pero se detectó una FC reducida (40 latidos por minuto, lpm). Posteriormente, se realizó un electrocardiograma (ECG) en el que se confirmó la bradicardia y la presencia de BAVIII. Como consecuencia de dichos hallazgos, se decidió tratar la perforación corneal con medicación ambulatoria (enrofloxacino, prednisona y metamizol por vía parenteral y, tobramicina, moxifloxacino, ciclopentolato, atropina y dorzolamida, por vía tópica) y posponer la cirugía oftalmológica hasta la realización de pruebas complementarias para explorar con mayor profundidad la afectación cardíaca, que se consideraba prioritaria. Por consiguiente, el paciente se remitió a un servicio de cardiología veterinaria en donde se le realizó una ecocardiografía. Los principales hallazgos fueron la presencia de insuficiencia mitral leve con dilatación excéntrica moderada del ventrículo y del atrio izquierdos. En el momento de la realización de la ecocardiografía, se observaron BAVIII y un ritmo de escape ventricular, con FC entre 40 y 45 lpm. El equipo de cardiología recomendó la colocación de un marcapasos interno y pautó la administración de pimobendan (0.25 mg/kg/12 h) junto con furosemida (2 mg/kg/12 h) por vía oral.
La úlcera del OD evolucionó rápidamente de forma desfavorable hasta provocar la perforación corneal y, en el ojo izquierdo (OI), se produjo una úlcera estromal superficial. Ante el riesgo de sufrir un desenlace similar en el único ojo visual, se tomó la decisión conjunta entre los equipos de oftalmología, cardiología y anestesiología, de programar la enucleación del OD y colocar un injerto de membrana amniótica en el OI, bajo anestesia general, con la colocación temporal de un marcapasos externo transtorácico. Se mantuvo el tratamiento prescrito con pimobendan, furosemida, prednisona y metamizol por vía oral, hasta la realización de la cirugía.
Durante la exploración física previa al procedimiento anestésico, el paciente presentó cierto estado de agitación; sin embargo, se observó una FC de 40 lpm (Figura 1).

Figura 1. Imagen del EGC donde se puede apreciar el bloqueo atrioventricular de tercer grado antes de la colocación del marcapasos externo.
Se consideró un riesgo anestésico ASA III. En primer lugar, se colocó un catéter de 22G en una vena cefálica y se premedicó con butorfanol a 0.2 mg/kg por vía intravenosa (IV). El efecto de la sedación fue leve, pero permitió la monitorización del ECG y la preoxigenación del paciente con oxígeno al 100 %, con mascarilla y un flujo de 2 l/min con un circuito semicerrado circular de reinspiración durante 5 minutos. Se inició la fluidoterapia a una velocidad de 3 ml/kg/h con Ringer lactato. A continuación, la anestesia general se indujo con alfaxalona a 2 mg/kg y midazolam a 0.2 mg/kg vía IV, y se intubó con un tubo endotraqueal con balón de pneumotaponamiento y diámetro de 6.5 mm que se conectó con el mismo circuito anestésico de reinspiración a una estación de anestesia (Primus, Draeger). El mantenimiento anestésico se realizó con isoflurano vaporizado al 1.5 %, en una mezcla de aire y oxígeno al 50 %, con un flujo entre 0.5 y 1 l/min. La monitorización se llevó a cabo con ECG, pulsioximetría, presión arterial (PA) no invasiva oscilométrica, capnografía y temperatura esofágica. Para completar la monitorización de la PA de forma invasiva se colocó un catéter de 22 G en una arteria dorsopedal, pero los valores observados se consideraron anormalmente elevados y no coincidían con la impresión clínica del anestesista. Por lo tanto, se consideró un artefacto causado por mal funcionamiento del transductor. Sin embargo, ante la indisponibilidad de un transductor nuevo, el registro de la PA se continuó mediante el método no invasivo. No obstante, la monitorización invasiva se siguió monitorizando durante el procedimiento para valorar la tendencia, aunque no se obtuvieran valores precisos (Figuras 2 - 3).
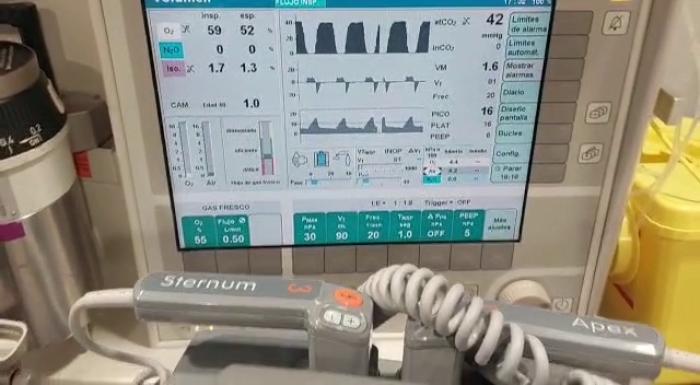
Figura 2. Imagen de la monitorización ventilatoria durante la anestesia.
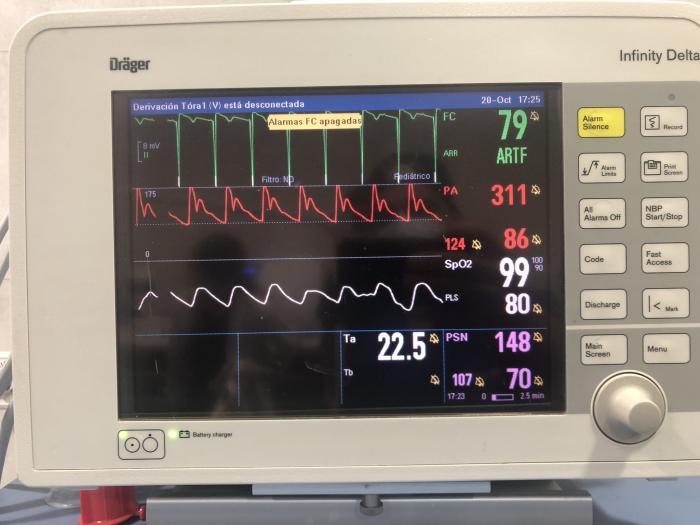
Figura 3. Imagen de la monitorización de la presión arterial invasiva (en rojo) y no invasiva (en rosa) durante la anestesia en la que se aprecia la diferencia entre ambas. En el electrocardiograma se pueden observar los complejos generados por el marcapasos externo.
Al inicio de la anestesia general se situaron los dos parches para los electrodos del marcapasos externo en ambos hemitórax sobre la zona precordial, previamente rasurados. Los electrodos se mantuvieron en su lugar con venda cohesiva mediante un vendaje que rodeaba el pecho del paciente (Figura 4).
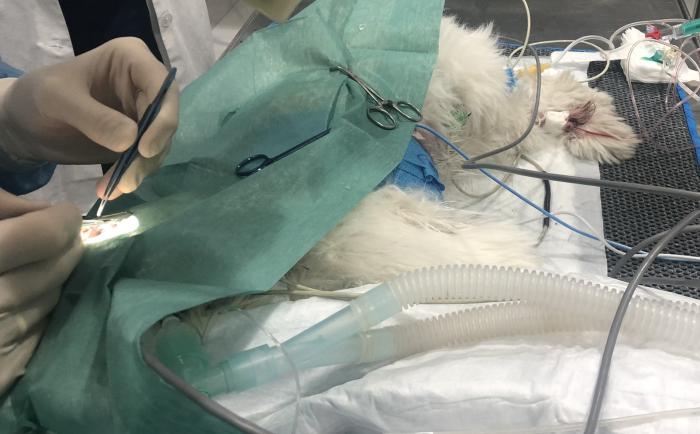
Figura 4. Imagen del paciente durante la cirugía del ojo izquierdo. Se puede observar una derivación del marcapasos (cable azul) y la venda cohesiva alrededor del tórax del paciente para sujetar los electrodos del mismo.
Una vez puesto en marcha el marcapasos, se seleccionó el modo fijo o asincrónico, programando una FC de 80 lpm y una corriente de salida de 35 mA. El dispositivo empleado es un desfibrilador que también incluye la función de marcapasos (BeneHeart D3, Mindray). Los parámetros que se pueden programar son la FC y la intensidad eléctrica (mA) y dispone de dos formas de programación: una a demanda en la que el marcapasos sólo administra estímulos cuando la FC del paciente es inferior a la frecuencia de estimulación seleccionada y otra con un modo fijo o asincrónico en la que el marcapasos administra pulsos fijos a la frecuencia seleccionada. En este caso, se configuró directamente como modo fijo ya que la FC del paciente fue siempre inferior a 80 lpm. Por tanto, se seleccionó una frecuencia de 80 lpm y una intensidad de 35 mA que se fue incrementando de manera progresiva hasta lograr que todos los estímulos del marcapasos fueran seguidos de un complejo QRS en el ECG. A dicho valor se le denomina umbral de captura (Figura 5).
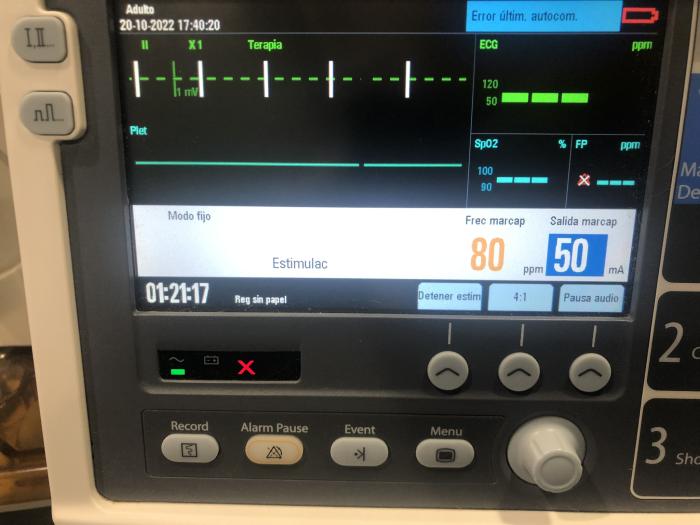
Figura 5. Imagen del marcapasos externo en funcionamiento durante la anestesia, con la frecuencia cardíaca (80 lpm) y la intensidad (50 mA) seleccionadas.
Al comienzo de la intervención se administró, como antibioterapia preventiva, amoxicilina y ácido clavulánico a 20 mg/kg por vía subcutánea (SC) y se realizó un bloqueo anestésico retrobulbar e infiltración de los bordes palpebrales con bupivacaína 0.5 % (2 mg/kg, dosis total). Para centrar el globo ocular y facilitar el abordaje quirúrgico del OI, se administró un bloqueante neuromuscular, cisatracurio a 0.1 mg/kg IV. A continuación, se inició ventilación mecánica controlada por volumen, con un volumen corriente entre 10 y 12 ml/kg, frecuencia respiratoria (FR) de 20 rpm, presión pico entre 13 y 17 cmH2O y presión al final de la espiración entre 5 y 7 cmH2O.
Cuando el paciente recuperó la ventilación espontánea se finalizó la ventilación mecánica y se mantuvo así durante el resto de la intervención del OD hasta el final de la cirugía. Cuando terminó el procedimiento quirúrgico se desconectó al paciente del marcapasos y se produjo un desacoplamiento sin complicaciones. La duración total de la anestesia fue de 90 minutos, y durante su transcurso el animal se mantuvo estable. Tras la extubación, se le administró buprenorfina a 15 µg/kg IV y robenacoxib a 2 mg/kg SC. Durante el posoperatorio inmediato, la recuperación fue tranquila y se mantuvieron monitorizados el ECG, la FR, la temperatura rectal y la PA no invasiva, sin presentar ninguna alteración más allá de su bradicardia sinusal.
Tras una recuperación total, la colocación del marcapasos interno se retrasó hasta 6 semanas después de la primera intervención por la aparición de una fístula en el área quirúrgica de la enucleación del OD que se resolvió con tratamiento médico. El paciente siguió acudiendo a revisión oftalmológica hasta recibir el alta dos meses y medio tras la cirugía de enucleación del OD y colocación de un injerto membrana amniótica en el OI.
Discusión
Los pacientes con BAVIII sometidos a una anestesia general pueden desarrollar una bradiarritmia severa, shock e incluso parada cardiorrespiratoria, por la incapacidad de compensar la disminución del gasto cardiaco provocado por dicha enfermedad, agravada por la acción de ciertos fármacos depresores del sistema cardiovascular como los opioides o los anestésicos (isofluorano, propofol). Por este motivo es necesaria la colocación de un marcapasos interno permanente3. En este caso no fue posible porque las lesiones oculares empeoraron rápidamente y se decidió emplear un marcapasos temporal transtorácico para poder realizar la cirugía oftalmológica con mayor seguridad.
La exploración física y las pruebas complementarias preanestésicas realizadas en el presente caso permitieron detectar la bradicardia mediante la auscultación del paciente y, junto con el ECG, permitió el diagnóstico de una patología que habría incrementado considerablemente el riesgo anestésico para el paciente de no haberse diagnosticado previamente.
Se ha demostrado la eficacia de los marcapasos transtorácicos en el ámbito clínico para el tratamiento de emergencia de BAVIII hemodinámicamente inestables o para el mantenimiento de la FC, ya sea durante la anestesia general para la implantación de un marcapasos permanente o bien, durante la cirugía4,7. El protocolo anestésico en estos pacientes tiene como objetivo principal mantener la estabilidad cardiovascular, evitando agravar la bradicardia o producir hipotensión8. Los opioides son analgésicos, sedantes y producen efectos mínimos sobre la contractilidad miocárdica. No obstante, especialmente a dosis más elevadas, pueden provocar una bradicardia moderada, especialmente los agonistas puros como el fentanilo o la metadona. Un agonista puro que podría emplearse alternativamente es la petidina, que no produce tal efecto parasimpaticomimético9; sin embargo, en ocasiones, se ha observado la aparición de edema facial normalmente autolimitante, pero que hubiera comprometido el desarrollo de la intervención en el presente caso10. Además, se han descrito aumentos de la presión intraocular tras el uso de petidina en la premedicación11, que en este animal sería contraproducente ya que podría empeorar el pronóstico de la úlcera ocular. Otra opción es la administración de opioides agonistas parciales como la buprenorfina o del agonista/antagonista butorfanol cuyo impacto cardiovascular es mucho menor. En este caso, se administró butorfanol, agonista de los receptores κ y antagonista de los receptores µ, que produce una sedación aceptable y menor depresión respiratoria, aunque el efecto analgésico sea menos potente o más variable que los anteriores12.
Como agente inductor se empleó una combinación de alfaxalona y midazolam. La alfaxalona es un esteroide neuroactivo que produce una inducción suave, excelente relajación muscular y depresión cardiovascular muy leve y de forma dosis dependiente13, además presenta una acción rápida y tiene corta duración, lo que lo convierte en un inductor ideal14. Una ventaja sobre el propofol que se emplea como inductor anestésico habitual es que la alfaxalona mantiene mejor el gasto cardíaco porque produce cierto aumento de la FC y reducción de la resistencia vascular, al contrario de lo que ocurre con el propofol que puede provocar hipotensión sin que se incremente la FC de manera compensatoria15,16. Las benzodicepinas provocan escasos efectos cardiovasculares y permiten reducir la dosis de alfaxalona durante la inducción15. Otra alternativa adecuada como inductor sería el etomidato, ya que produce mínimos efectos a nivel cardiovascular; sin embargo, puede producir excitación, mioclonias y vómitos13, además de producir recuperaciones de peor calidad y más prolongadas17, sobre todo, en el presente caso en el que el grado de sedación previo a la inducción fue leve y las dosis de inducción hubieran sido elevadas.
La administración de fármacos anticolinérgicos en la premedicación se ha descrito previamente en pacientes con bradiarritmias graves como en el presente caso18. El uso de atropina o glicopirrolato puede aumentar la frecuencia sinusal en animales con BAV sensibles, llegando a desarrollar taquiarritmias en las que la frecuencia cardíaca supere el límite superior del marcapasos, lo que puede dificultar el acoplamiento con el marcapasos externo. También pueden provocar un aumento transitorio inicial del tono vagal que podría causar un empeoramiento temporal de la bradicardia preexistente antes de observar una respuesta beneficiosa2.
Como parte de un abordaje analgésico multimodal, se realizó un bloqueo retrobulbar junto con una infiltración palpebral con un anestésico local en el OD. Las técnicas locorregionales ayudan a reducir el uso posoperatorio de opioides19-21. Además, el bloqueo retrobulbar, comparado con la infiltración intraoperatoria con bupivacaína en el área quirúrgica tras la retirada del globo ocular, ha demostrado ser más eficaz para controlar la nocicepción intra y posoperatoria, y reduce la incidencia de hemorragia intraoperatoria, hematoma e hinchazón postoperatorios22. Esta técnica no está exenta de riesgos, como la hemorragia retrobulbar, la inyección IV inadvertida, la miopatía del músculo extraocular o la inyección intratecal21, pero la frecuencia de complicaciones reportadas es escasa frente a los beneficios de su realización. Por ejemplo, se reducen, tanto el uso de opioides intra- y posoperatorios como los requerimientos anestésicos22-23, y se previene la sensibilización central y, por tanto, el dolor crónico posoperatorio. Recientemente, se ha comprobado que el uso de técnicas locorregionales reduce la mortalidad anestésica24. Por otra parte, el empleo de bloqueantes neuromusculares facilitó el correcto posicionamiento del globo ocular y evitó el movimiento del paciente provocado por los impulsos del marcapasos, que podría dificultar el acto quirúrgico8.
La medición de la PA de forma invasiva es el método más exacto y preciso que permite una monitorización constante y la detección de cambios latido a latido, por eso se considera el método de referencia25. Sin embargo, la medición invasiva de la PA no fue fiable debido al mal funcionamiento del transductor. Por lo tanto, se cometió un error por la falta de comprobación previa del equipo y no disponer de un transductor nuevo que hubiera permitido una monitorización más precisa de la PA, especialmente indicada en el presente caso.
Las principales dificultades que pueden presentarse con el uso de marcapasos externos incluyen el mal funcionamiento del dispositivo por la colocación incorrecta de los electrodos en el tórax del paciente o determinadas situaciones como neumotórax, efusión pericárdica o pleural, obesidad, nocicepción, contracciones musculares o arritmias4; sin embargo, no se observó ninguna de ellas en el presente caso.
La colocación de los electrodos del marcapasos directamente sobre la zona precordial en ambos hemitórax permite establecer el ritmo ventricular usando menos energía y parece dar lugar a menos fallos de acoplamiento que cuando se colocan en otras zonas como el esternón o en dirección desde la base hasta el ápex cardiaco26-27. Se han observado respuestas compatibles con dolor, movimientos voluntarios y aumentos de FC y FR en perros despiertos con marcapasos externos, así como en pacientes anestesiados con un plano superficial2,7. Por lo tanto, la colocación de un marcapasos externo debe realizarse con el paciente bajo sedación profunda o anestesia general.
Conclusiones
La literatura relacionada con el manejo anestésico en perros sometidos a cirugía no cardíaca en los que es necesaria la utilización de un marcapasos externo transtorácico es escasa. El uso de estos dispositivos es poco habitual en la práctica clínica, por lo tanto, es fundamental saber elegir el tipo más adecuado y conocer su modo de funcionamiento y programación.
El manejo anestésico en estos pacientes se centra en mantener la estabilidad cardiovascular, siendo fundamental la elección de un protocolo anestésico multimodal que permita reducir dosis de fármacos y con ello, los posibles efectos adversos a nivel cardiovascular.
Por último, es muy importante la comunicación de los diferentes servicios implicados en el manejo de este tipo de casos. La buena comunicación y coordinación es esencial para reducir las posibles complicaciones y procurar una óptima evolución del paciente.
Agradecimientos
Los autores quieren agradecer especialmente a los compañeros/as del Centro Oftalmológico Veterinario Ocaña (Madrid), con su director clínico Javier Esteban a la cabeza, tanto por su implicación y dedicación como por el manejo clínico del caso. Además, agradecemos al servicio de cardiología del Centro Veterinario de Referencia Diagnosfera (San Sebastián de los Reyes, Madrid) y, en especial, a su director Pedro Esteve, tanto el asesoramiento en la consulta cardiológica, como la cesión desinteresada del marcapasos.
Bibliografía
- Santilli RA, Giacomazzi F, Porteiro Vázquez DM, Perego M. Indications for permanent pacing in dogs and cats. Vol. 22, Journal of Veterinary Cardiology. 2019;22:20-39.
- Bulmer BJ. Cardiac Pacemakers and Anesthesia. En: Grimm KA, Lamont LA, Tranquilli WJ, Greene SA, Robertson SA, editores. Lumb and Jones Veterinary Anesthesia and Analgesia. 5ª ed. 2015. p. 490-5.
- Johnson MS, Martin MWS, Henley W. Results of pacemaker implantation in 104 dogs. Journal of Small Animal Practice. 2007;48(1):4-11.
- Noomanová N, Perego M, Perini A, Santilli RA. Use of transcutaneous external pacing during transvenous pacemaker implantation in dogs. Veterinary Record. 2010;167(7):241-4.
- Costa A, Richman DC. Implantable Devices. Assessment and Perioperative Management. Anesthesiology Clinics. 2016;34(1):185-99.
- de Carellán Mateo AG, Casamián-Sorrosal D. The perioperative management of small animals with previously implanted pacemakers undergoing anaesthesia. Veterinary Anaesthesia and Analgesia. 2022;49(1):7-17.
- DeFrancesco TC, Hansen BD, Atkins CE, Sidley JA, Keene BW. Noninvasive Transthoracic Temporary Cardiac Pacing in Dogs. journal of veterinary internal medicine. 2003;17(5):663-7.
- Sanchis-Mora S, Viscasillas J, Mathis A, Palacios C, Brodbelt DC, Alibhai HI. Anaesthetic management and complications of pacemaker implantation in dogs. Veterinary Record. 2014;175(12):303.
- Cummings III K, Naguib MA. Opioid agonists and antagonists. En: Flood P, Rathmell JP, Shafer S, editores. Stoeilting’s Pharmacology & physiology in anesthetic practice. 5ª ed. 2015. p. 217-56.
- Sández Cordero I, Cabezas Salamanca MÁ. Manual clínico de farmacología y complicaciones en la anestesia de pequeños animales. Multimédica Ediciones Veterinarias. 2014. p. 155-157.
- Tamura EY, De Moraes Barros PS, Gaido Cortopassi SR, Magalhaes Ambrósio A, Tabacchi Fantoni D. Effects of two preanesthetic regimens for ophthalmico surgery on intraocular pressure and cardiovascular measurements in dogs. Veterinary Therapeutics. 2002;3(1):81-7.
- Carolyn LK. Tratamiento del dolor I: analgésicos sistémicos. En: Duke-Novakovski T, De Vries M, Seymour C, editores. BSAVA Manual de anestesia y analgesia en pequeños animales. 2017. p. 195-210.
- Kästner SBR. Anestésicos inyectables. En: Duke-Novakovski T, De Vries M, Seymour C, editores. BSAVA Manual de anestesia y analgesia en pequeños animales. 2017. p. 309-37.
- Ferré PJ, Pasloske K, Whittem T, Ranasinghe MG, Li Q, Lefebvre HP. Plasma pharmacokinetics of alfaxalone in dogs after an intravenous bolus of Alfaxan-CD RTU. Veterinay Anaesthesia and Analgesia. 2006;33(4):229-36.
- Miller C, Hughes E, Gurney M. Co-induction of anaesthesia with alfaxalone and midazolam in dogs: a randomized, blinded clinical trial. Veterinay Anaesthesia and Analgesia. 2019;46(5):613-9.
- Muir W, Lerche P, Wiese A, Nelson L, Pasloske K, Whittem T. Cardiorespiratory and anesthetic effects of clinical and supraclinical doses of alfaxalone in dogs. Veterinay Anaesthesia and Analgesia. 2008;35(6):451-62.
- Sams L, Braun C, Allman D, Hofmeister E. A comparison of the effects of propofol and etomidate on the induction of anesthesia and on cardiopulmonary parameters in dogs. Veterinay Anaesthesia and Analgesia. 2008;35(6):488-94.
- Petrie JP. Permanent transvenous cardiac pacing. Clinical Techniques in Small Animal Practice. 2005;20(3):164-72.
- Myrna KE, Bentley E, Smith LJ. Effectiveness of injection of local anesthetic into the retrobulbar space for postoperative analgesia following eye enucleation in dogs. Journal of the American Veterinary Medical Association. 2010;237(2):174-7.
- Shilo-Benjamini Y. A review of ophthalmic local and regional anesthesia in dogs and cats. Veterinay Anaesthesia and Analgesia. 2019;46(1):14-27.
- Accola PJ, Bentley E, Smith LJ, Forrest LJ, Baumel CA, Murphy CJ. Development of a retrobulbar injection technique for ocular surgery and analgesia in dogs. Journal of the American Veterinary Medical Association. 2006;229(2):220-5.
- Zibura AE, Posner LP, Ru H, Westermeyer HD. A preoperative bupivacaine retrobulbar block offers superior antinociception compared with an intraoperative splash block in dogs undergoing enucleation. Veterinay Ophthalmoly. 2020;23(2):225-33.
- Savitha K, Dhanpal R, Shilpa J. The effect of multimodal analgesia on minimum alveolar concentration of isoflurane for skin incision at constant bispectral index. Anesthesia Essays and Reseaches. 2016;10(3):473-77.
- Redondo JI, Otero PE, Martínez-Taboada F, Doménech L, Hernández-Magaña EZ, Viscasillas J. Anaesthetic mortality in dogs: A worldwide analysis and risk assessment. Veterinary Record. 2023; 13:e3604.
- Wagner AE, Brodbelt DC. Clinical Update Arterial blood pressure monitoring in anesthetized animals. Journal of the American Veterinary Medical Association.1997;210(9):1279-85.
- Aguilera R, Sinclair M, Valverde A, Bateman S, Hanna B. Dose and cardiopulmonary effects of propofol alone or with midazolam for induction of anesthesia in critically ill dogs. Veterinay Anaesthesia and Analgesia. 2020;47(4):472-80.
- Lee S, Nam SJ, Hyun C. The optimal size and placement of transdermal electrodes are critical for the efficacy of a transcutaneous pacemaker in dogs. Veterinary Journal. 2010;183(2):196-200.
 by Multimédica
by Multimédica