Cardiomiopatías felinas: revisión clínica (parte 1)
Resumen breve
Hay tres tipos principales de cardiomiopatías en los gatos: cardiomiopatía hipertrófica (HCM), cardiomiopatía restrictiva (RCM) y cardiomiopatía dilatada (DCM). En febrero de 2020 el American College of Veterinary Internal Medicine (ACVIM) publicó un consenso en el que se fijan las guías para la clasificación, el diagnóstico y el tratamiento de las cardiomiopatías en gatos.Índice de contenidos
Introducción
Las cardiomiopatías fueron definidas inicialmente en 1980 por la Organización Mundial de la Salud (OMS) como enfermedades del músculo cardiaco, de causa desconocida, en las que la característica dominante es la cardiomegalia y la insuficiencia cardiaca. La definición actualizada de la OMS en 1995 fue "enfermedades del miocardio asociadas con disfunción cardiaca", e incluyó por primera vez la cardiomiopatía arritmogénica del ventrículo derecho (ARVC) y la cardiomiopatía restrictiva (RCM).
En medicina felina, la clasificación de las enfermedades del miocardio ha seguido tradicionalmente las definiciones de la OMS, encontrándose bien descritas en la literatura las guías para el diagnóstico estandarizado de estas patologías. Hay tres tipos principales de cardiomiopatías en los gatos: cardiomiopatía hipertrófica (HCM), cardiomiopatía restrictiva (RCM) y cardiomiopatía dilatada (DCM). Sin embargo, esta clasificación presenta importantes limitaciones debido a que mezcla la denominación anatómica (hipertrófica y dilatada) con la denominación funcional (restrictiva). Esta circunstancia puede llegar a generar confusión, ya que la misma enfermedad podría aparecer en dos categorías diferentes (p. ej., cardiomiopatía hipertrófica con patrón transmitral restrictivo). Además, los cambios secundarios a patologías valvulares, condiciones isquémicas o procesos inflamatorios, pueden llegar a presentar características fenotípicas similares a una cardiomiopatía primaria.
Hay que tener también en cuenta que la remodelación cardiaca puede provocar que algunas de estas formas de cardiomiopatías evolucionen hacia otras durante su curso clínico natural. Por ejemplo, la HCM puede progresar desde un estadio no dilatado e hiperdinámico, a una forma dilatada con disfunción sistólica.
En un estudio retrospectivo de 106 gatos, la HCM fue la cardiomiopatía más frecuente (57.5 %), la RCM la segunda más frecuente (20.7 %) y la DCM la tercera más frecuente (10.4 %). Se identificaron también algunas cardiomiopatías atípicas, como las cardiomiopatías indeterminadas (ICM), aquellas asociadas con bandas moderadoras excesivas o la cardiomiopatía arritmogénica del ventrículo derecho (ARVC).
En febrero de 2020 el American College of Veterinary Internal Medicine (ACVIM) publicó un consenso en el que se fijan las guías para la clasificación, el diagnóstico y el tratamiento de las cardiomiopatías en gatos, que debería ser accesible tanto para los veterinarios generalistas, como para los especialistas. El consenso define la cardiomiopatía como un trastorno del miocardio en el cual el músculo cardiaco es estructural y funcionalmente anormal, en ausencia de cualquier otra enfermedad cardiovascular suficiente para causar la anormalidad observada del miocardio. Las cardiomiopatías en gatos son un grupo heterogéneo de trastornos miocárdicos, de etiología en su mayoría desconocida y con consecuencias potencialmente mortales.
Clasificación
La clasificación de las cardiomiopatías en los gatos se basó anteriormente en esquemas que se aplicaron de las cardiomiopatías humanas. Un sistema de clasificación ideal estandarizaría la terminología y facilitaría el manejo clínico, pero todos los sistemas de clasificación tienen limitaciones, y esto es particularmente cierto cuando se desconocen las causas subyacentes de la enfermedad. En los humanos, la causa de la cardiomiopatía a menudo se puede determinar, pero esto rara vez se consigue en los gatos. El consenso propone una adaptación de la clasificación de las cardiomiopatías de la Sociedad Europea de Cardiología (ESC) para su uso en gatos (Figura 1).
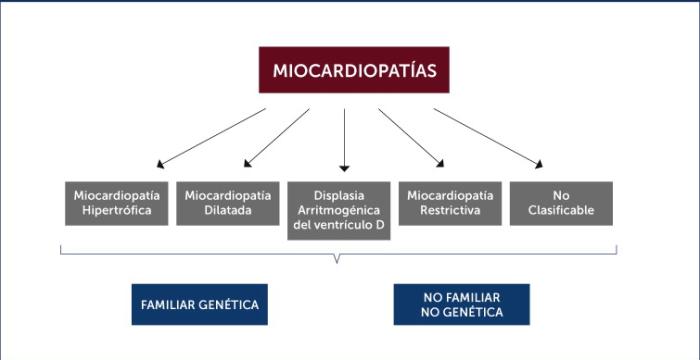
Figura 1. Clasificación de las cardiomiopatías de la Sociedad Europea de Cardiología.
La clasificación de la ESC se basa en las categorías fenotípicas tradicionales de cardiomiopatía hipertrófica (HCM), cardiomiopatía restrictiva (RCM), cardiomiopatía dilatada (DCM), cardiomiopatía no clasificada (UCM) y cardiomiopatía arritmogénica del ventrículo derecho (ARVC). El consenso recomienda mantener estas categorías como marco básico (con la excepción de UCM), al tiempo que reconoce sus limitaciones. Por ejemplo, y como ya se comentó anteriormente, en algunos gatos el fenotipo de cardiomiopatía cambia con el tiempo, debido a la progresión de la enfermedad, a determinadas comorbilidades o a factores desconocidos.
El consenso propone una clasificación de las cardiomiopatías de los gatos basada en características estructurales y funcionales, o fenotipo. Cada categoría fenotípica incluye tanto gatos con cardiomiopatía de causa conocida (p. ej., hipertiroidismo, hipertensión arterial sistémica), como pacientes con cardiomiopatía de causa desconocida (la mayoría de los gatos con un fenotipo de cardiomiopatía). Hasta que se encuentre una causa subyacente, se dice que el gato tiene un "fenotipo de cardiomiopatía hipertrófica" o un "fenotipo de cardiomiopatía dilatada". Si no se encuentra una causa subyacente, se dice que un gato tiene "cardiomiopatía hipertrófica (HCM)" o "cardiomiopatía dilatada (DCM)", según corresponda. Por lo tanto, la clasificación propuesta no define entidades de enfermedad específicas, sino categorías fenotípicas. La descripción en cualquier gato individual se puede afinar aún más con detalles de la causa subyacente, cuando se conoce. Por lo tanto, se dice que un gato con hipertrofia ventricular izquierda e hipertiroidismo tiene un fenotipo de HCM junto con hipertiroidismo.
Algunos gatos tienen enfermedad miocárdica que no encaja bien en ninguna de las categorías propuestas anteriormente. Así, en lugar de describir estos casos como "cardiomiopatía no clasificada", como propone la ESC, se debe describir que estos gatos tienen cardiomiopatía con un "fenotipo no específico". Este término siempre debe ir acompañado de una descripción de las características morfológicas y funcionales para caracterizar el fenotipo con más detalle.
Estadiaje
Para describir el impacto clínico de la cardiomiopatía en los gatos afectados, el consenso propone un sistema de estadificación adaptado de los sistemas de estadificación de enfermedades cardiacas de la American Heart Association (AHA) y del American College of Veterinary Internal Medicine (ACVIM), con el objetivo de proporcionar un marco para el pronóstico y la toma de decisiones terapéuticas.
- La etapa A incluye gatos que están predispuestos a la cardiomiopatía, pero que no tienen evidencia de enfermedad miocárdica.
- La etapa B describe gatos con cardiomiopatía, pero sin signos clínicos de insuficiencia cardiaca congestiva (CHF) o tromboembolismo arterial (ATE). Esta etapa se divide en dos subetapas, según el riesgo inminente de los pacientes a desarrollar CHF o ATE. El tamaño de la aurícula izquierda es un marcador pronóstico importante, de forma que cuanto más dilatada esté, mayor será el riesgo de desarrollar signos clínicos. Otros factores que también deben tenerse en cuenta al estadificar gatos con cardiomiopatía subclínica, son la función sistólica de la aurícula izquierda, la función sistólica del ventrículo izquierdo, y la hipertrofia extrema del ventrículo izquierdo, entre otros.
- Etapa B1: gatos con bajo riesgo de CHF o ATE inminentes. Presentan una aurícula izquierda de tamaño normal o levemente dilatada.
- Etapa B2: gatos con mayor riesgo de CHF o ATE inminentes. Presentan una aurícula izquierda con dilatación moderada a grave.
- Los gatos que ya han desarrollado signos clínicos de CHF o ATE se clasifican como estadio C, incluso si los signos clínicos se han resuelto con el tratamiento.
- Los gatos con signos clínicos de CHF refractaria al tratamiento se clasifican en estadio D.
Prevalencia
El fenotipo de cardiomiopatía más común es la HCM, con una prevalencia estimada de aproximadamente el 15 % de la población general felina. En los gatos mayores, la prevalencia es mucho mayor, con hasta un 29 % de individuos afectados, incluso excluyendo aquellos con hipertensión e hipertiroidismo. La insuficiencia cardiaca congestiva (CHF) es la causa más común de signos clínicos en gatos con HCM, seguida del tromboembolismo arterial (ATE). Una minoría de gatos muere repentinamente sin signos clínicos previos.
La prevalencia de otros fenotipos de cardiomiopatía en la población general de gatos no se conoce, pero un fenotipo hipertrófico parece predominar en gatos con cardiomiopatía subclínica.
Los gatos con HCM tienen más probabilidades de ser mayores, machos y tener un soplo sistólico fuerte, aunque la HCM se puede ver también en gatos jóvenes, hembras y en animales sin soplo. La edad media de los gatos en el momento del diagnóstico es de 5.5 años, con un rango de 4 meses a 16 años.
La mayoría de los gatos con HCM son gatos comunes, pero se cree que algunas razas tienen un mayor riesgo, incluyendo Mainecoon, Ragdoll, British shorthair, Persa, Bengalí, Sphynx, Bosque de Noruega y Birmano. Sin embargo, faltan datos completos de prevalencia para los gatos de las diferentes razas (Figura 2).

Figura 2. El Fold escocés, cruce de British shorthair.
Las mutaciones genéticas sarcoméricas son comunes en personas con HCM, pero tradicionalmente solo se han identificado 2 mutaciones en gatos, ambas en el gen de la proteína de unión a miosina C (MYBPC3). La prevalencia estimada de la mutación MYBPC3-A31P en gatos Maine coon es aproximadamente del 35 % al 42 %, que es sustancialmente mayor que la prevalencia del fenotipo HCM en esta raza. Los gatos Maine coon homocigotos para esta mutación, así como los gatos Ragdoll homocigotos para la mutación MYBPC3-R820W, y los parientes de primer grado de los gatos afectados, tienen mayor riesgo de desarrollar HCM.
Más recientemente, se identificó y correlacionó una mutación en el gen ALMS1, que afecta al desarrollo de las células cardiacas y a la regulación del ciclo celular, con la HCM en la raza de gatos Sphynx. La mutación en el gen ALMS1 muestra una penetración variable de la enfermedad y no explica todos los casos de HCM que se observan en esta raza.
Pronóstico
Algunos gatos con fenotipo de HCM permanecen subclínicos, mientras que otros desarrollan signos clínicos de CHF o ATE. La juventud y la ausencia de signos clínicos se han asociado con una supervivencia más prolongada. Algunos marcadores de mayor riesgo de CHF o ATE son la presencia de arritmias o sonidos de galope en el examen físico, la dilatación moderada a grave de la aurícula izquierda, la reducción de la fracción de acortamiento de la aurícula izquierda, la hipertrofia extrema del ventrículo izquierdo, la disminución de la función sistólica del ventrículo izquierdo, la detección de ecocontraste espontáneo o trombo intracardiaco, el adelgazamiento regional de la pared del ventrículo izquierdo con hipocinesia, así como el patrón de llenado diastólico restrictivo.
La muerte súbita también puede ocurrir en gatos con HCM. Se sabe menos sobre los factores de riesgo de muerte súbita, pero estos pueden incluir antecedentes de síncope, arritmias ventriculares, dilatación de la aurícula izquierda e hipocinesia regional de la pared del ventrículo izquierdo.
Los tiempos medios de supervivencia son sustancialmente más cortos en gatos con HCM que han desarrollado CHF o ATE, en comparación con aquellos con cardiomiopatía subclínica. Los gatos que desarrollan CHF asociada con estrés, terapia de fluidos intravenosos, anestesia general o tratamiento con corticosteroides de liberación prolongada, pueden tener tiempos de supervivencia más largos en comparación con los gatos que desarrollan CHF en ausencia de estos factores.
A diferencia de la HCM en personas, en quienes la obstrucción dinámica del tracto de salida del ventrículo izquierdo (DLVOTO) se ha asociado con un aumento de la morbilidad y la mortalidad, la DLVOTO no parece ser un factor pronóstico negativo en los gatos.
Diagnóstico
Establecer el diagnóstico de cardiomiopatía en gatos puede ser un desafío, particularmente en la práctica clínica general. La ecocardiografía realizada por un experto es la prueba diagnóstica de elección, aunque la diferenciación de las diversas categorías fenotípicas a veces puede ser un desafío.
Afortunadamente, con respecto a la toma de decisiones terapéuticas, el requerimiento de diuréticos en gatos con CHF y el enfoque para el tratamiento de ATE son similares independientemente de la forma de cardiomiopatía. Un nivel básico de habilidad ecocardiográfica (p. ej., la capacidad de detectar el agrandamiento auricular izquierdo de moderado a grave) puede ser suficiente para identificar las etapas más avanzadas de la cardiomiopatía.
Otras pruebas de diagnóstico pueden facilitar la estadificación de la enfermedad, la identificación de comorbilidades importantes y el establecimiento del pronóstico. Es importante destacar que, en gatos con un fenotipo de HCM, se recomienda realizar pruebas para detectar una posible causa subyacente, como la concentración sérica de tiroxina para la detección de hipertiroidismo, o la medición de la presión arterial para la detección de hipertensión sistémica.
Tests genéticos
Se recomienda realizar pruebas genéticas para la mutación MYBPC3-A31P y la mutación MYBPC3-R820W en gatos Maine coon y Ragdoll, respectivamente, destinados a la reproducción, con el objetivo de disminuir la incidencia de estas mutaciones y la HCM en estas razas. Se recomienda que los gatos homocigotos para cualquiera de las mutaciones no se usen para la reproducción, aunque los gatos heterocigotos pueden criarse con gatos negativos si tienen otras características sobresalientes.
No se recomiendan las pruebas genéticas para las mutaciones MYBPC3-A31P y MYBPC3-R820W en gatos de otras razas, ya que estas dos mutaciones son casi completamente específicas de los gatos Maine coon y Ragdoll.
Historia clínica
La historia clínica no es llamativa en muchos gatos con cardiomiopatía, particularmente en aquellos con HCM.
El signo clínico de presentación más común es la disnea, aunque algunos gatos solo muestran signos inespecíficos, como ocultación o inapetencia. La HCF parece ser la causa más común de disnea en los gatos. La paresia o parálisis asociada con ATE también es un signo de presentación común. El síncope es un signo de aparición menos común. En algunos gatos con cardiomiopatía, como ya se ha comentado, la muerte súbita puede ocurrir sin síntomas previos.
Examen físico
Cardiomiopatía subclínica
Se ha informado un soplo cardiaco sistólico paraesternal en hasta el 80 % de los gatos con HCM subclínica, en comparación con el 30-45 % de los gatos sanos sin HCM, con lo que se recomienda siempre realizar investigaciones adicionales si se detecta un soplo cardiaco en un gato. Se han reportado sonidos de galope en 2.6-19 % de los gatos con HCM subclínica, que rara vez están presentes en gatos sanos. Las arritmias también pueden asociarse con cardiomiopatías. Un dato importante a tener en cuenta es que muchos gatos afectados no presentan anormalidades en la auscultación.
Un soplo sistólico fuerte (grado 3-4/6) es más común en gatos con HCM que en gatos sanos. Un soplo con frémito palpable (grado 5-6/6) rara vez se asocia con cardiomiopatía en gatos, y es más probable que se asocie con una malformación congénita. Los gatos con enfermedad más avanzada, o aquellos con fenotipos restrictivos o dilatados, pueden no tener un soplo audible.
Cardiomiopatía asociada a CHF
La taquipnea, la disnea o ambas son los hallazgos típicos del examen físico de gatos con CHF (Vídeo 1). En comparación con los gatos que tienen HCM subclínica, los sonidos de galope o las arritmias son más comunes en los gatos con CHF, mientras que los soplos son menos comunes. Se pueden escuchar crepitaciones pulmonares cuando hay edema pulmonar, y los sonidos respiratorios a menudo aparecen atenuados ventralmente cuando hay derrame pleural.
Vídeo 1.
Radiografías
Se puede sospechar de cardiomiopatía en un gato cuando hay cardiomegalia grave radiográficamente visible, especialmente cuando hay un agrandamiento auricular izquierdo en las vistas dorsoventral, ventrodorsal, o ambas. La radiografía torácica es poco sensible para la identificación de cambios cardiacos leves o moderados asociados con la cardiomiopatía. En algunos gatos la silueta cardiaca puede parecer normal, incluso cuando la enfermedad es lo suficientemente grave como para causar CHF (Figura 3).
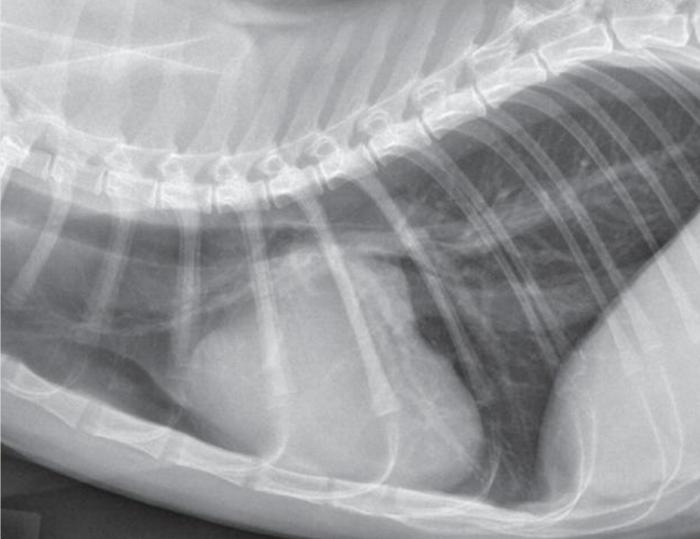
Figura 3. Radiografía torácica de un gato asintomático con cardiomegalia global y agrandamiento auricular izquierdo.
Además, es difícil identificar el fenotipo de cardiomiopatía a partir de la forma de la silueta cardiaca, y el clásico “corazón de san Valentín" no es específico para la HCM, como se pensaba anteriormente.
Aunque la radiografía se considera el gold standard para confirmar la presencia de edema pulmonar cardiogénico, si no se pueden obtener radiografías de manera segura, se debe considerar retrasar la radiografía torácica. A diferencia de los perros, el patrón radiográfico asociado con el edema pulmonar cardiogénico en los gatos es muy variable (Figura 4).
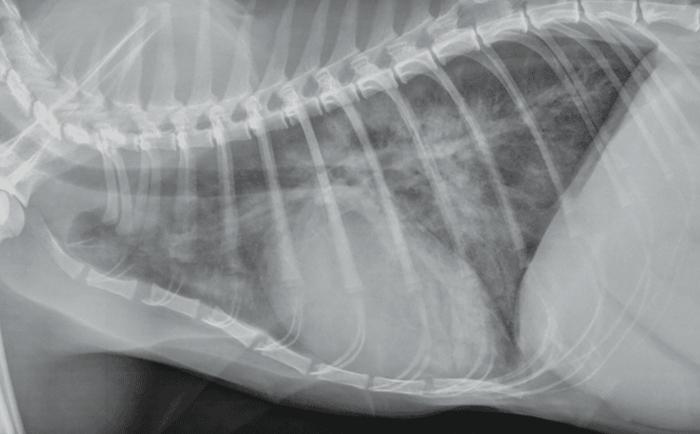
Figura 4. Radiografía torácica de un gato disneico con cardiomegalia global e infiltrados pulmonares compatibles con edema pulmonar.
Una combinación de examen físico, ecografía T-FAST y valoración del biomarcador NT-proBNP a menudo puede ser útil para decidir si la CHF es la causa más probable de la disnea en un gato.
Biomarcadores
NT-proBNP
La determinación del biomarcador NT-proBNP felino a partir de muestras de plasma o líquido pleural tiene una buena precisión diagnóstica para discriminar entre gatos con causas cardiacas y no cardiacas de dificultad respiratoria.
El análisis cuantitativo no se recomienda para guiar la toma de decisiones terapéuticas en gatos con dificultad respiratoria, debido al retraso a la hora recibir los resultados del laboratorio externo. Sin embargo, cuando se investiga a un gato con sospecha de cardiomiopatía subclínica, hay menos urgencia para los resultados de la prueba, por lo que el análisis cuantitativo de NT-proBNP se puede considerar en situaciones en las que la ecocardiografía no esté disponible.
El análisis cuantitativo de NT-proBNP no se recomienda para diferenciar gatos sanos de gatos con HCM leve a moderada.
El uso de tests cualitativos de NT-proBNP debe considerarse en pacientes con dificultad respiratoria, cuando el examen T-FAST no esté disponible. Pueden utilizarse también en gatos con sospecha de cardiomiopatía subclínica, aunque su valor principal es diferenciar a los gatos con cardiomiopatía subclínica grave de los gatos sanos o con enfermedad leve.
Troponina I
La medición de las concentraciones circulantes de troponina I cardiaca (cTnI) puede ayudar a discriminar entre causas cardiacas y no cardiacas de dificultad respiratoria, pero solo cuando los resultados se puedan obtener de forma rápida.
La valoración de cTnI puede llegar a emplearse también en algunas situaciones para diferenciar entre gatos sanos y gatos con HCM subclínica, cuando se sospecha enfermedad cardiaca. Además, la medición de las concentraciones de cTnI también podrían considerarse por su valor pronóstico, ya que un aumento de su concentración circulante se asocia con un mayor riesgo de muerte cardiovascular, independientemente del tamaño de la aurícula izquierda.
Electrocardiograma
Los gatos con cardiomiopatía pueden presentar una gran variedad de arritmias, que pueden contribuir a diferentes signos clínicos como debilidad episódica, síncope y convulsiones. Se recomienda que los gatos que experimenten esta sintomatología se sometan a una evaluación cardiovascular completa que incluya ecocardiografía, electrocardiograma (ECG) y monitorización Holter de ECG si fuera necesario.
La sensibilidad de un ECG de 6 derivaciones para detectar hipertrofia del ventrículo izquierdo o agrandamiento de la aurícula izquierda es baja, con lo que el ECG no se recomienda como método de detección de cardiomiopatías en gatos (Figura 5), a pesar de su uso en la detección de HCM en personas.
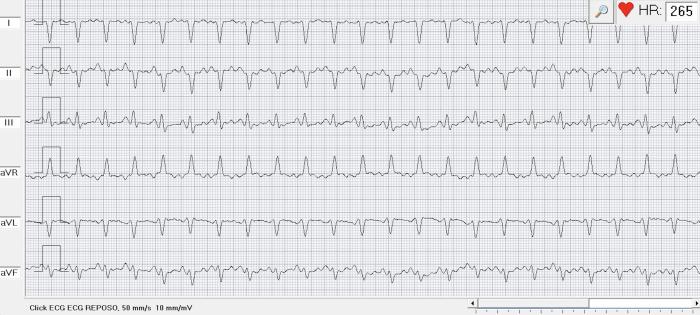
Figura 5.
La monitorización Holter de ECG suele ser bien tolerada por los gatos, y a menudo se emplea para identificar arritmias que de otro modo no se detectarían (Vídeo 2).
Vídeo 2.
Los registradores implantables también deben considerarse para gatos con signos clínicos intermitentes que podrían atribuirse a arritmias.
Otras opciones para registrar el ritmo cardiaco en el entorno doméstico del gato incluyen el uso de dispositivos portátiles asociados a un smartphone (Vídeo 3).
Vídeo 3.
Presión arterial
La hipertrofia difusa o segmentaria del ventrículo izquierdo es común en gatos con hipertensión arterial sistémica, y se observa en hasta el 85 % de los casos, aunque la HCM y la hipertensión arterial sistémica pueden existir simultáneamente. Para muchos gatos hipertensos, la hipertrofia del ventrículo izquierdo es solo de leve a moderada. Se debe considerar la determinación de la presión arterial para todos los gatos con un aumento del grosor de la pared del ventrículo izquierdo (Figura 6).

Figura 6.
Determinación de tiroxina sérica
El hipertiroidismo es común en gatos mayores y se asocia con anormalidades en la auscultación (soplo, galope, arritmias), remodelación cardiaca (hipertrofia del ventrículo izquierdo o aumento de los diámetros de la cámara cardiaca), y en algunos casos CHF o ATE. A veces se observan gatos hipertiroideos con hipertrofia grave del ventrículo izquierdo, pero se sospecha que esta asociación es el resultado del hipertiroidismo que exacerba la HCM preexistente de leve a moderada.
Se recomienda que las concentraciones séricas de tiroxina se midan en todos los gatos de ≥6 años con hallazgos anormales en la auscultación cardiaca, presenten o no hipertrofia del ventrículo izquierdo en ecocardiografía.
Ecocardiografía
La ecocardiografía es la prueba gold standard para el diagnóstico de cardiomiopatías en gatos (Tabla 1).
| Historia clínica |
|
| Examen físico |
|
| Gatos de 9 años o mayores que van a someterse a procedimientos que pueden precipitar CHF |
|
Tabla 1. Situaciones clínicas y hallazgos del examen físico en los gatos, en los que está indicado programar una ecocardiografía, ante la sospecha de cardiomiopatía.
La ecocardiografía idealmente debe ser realizada por operadores entrenados, en gatos no sedados y en condiciones tranquilas, y los gatos deben manejarse con la mínima sujeción. Cuando sea necesario, se puede considerar la sedación del gato para el examen ecocardiográfico.
Las mediciones del grosor de la pared del ventrículo izquierdo se han realizado tradicionalmente a partir de imágenes ecocardiográficas en modo M guiadas en bidimensional (2D). Debido a la heterogeneidad regional de la hipertrofia del ventrículo izquierdo en muchos gatos con HCM, las mediciones con ecocardiografía en modo M pueden pasar por alto engrosamientos focales de la pared. La medición por error de los músculos papilares también es posible como resultado del movimiento traslacional del corazón. La ecocardiografía bidimensional permite medir el grosor de la pared del ventrículo izquierdo en múltiples puntos. En la actualidad, las mediciones del grosor de la pared del ventrículo izquierdo se realizan utilizando el modo 2D, el modo M o ambos, pero las dos técnicas pueden generar valores diferentes para el grosor de la pared y no son intercambiables. Se recomienda siempre medir el grosor de la pared del ventrículo izquierdo al final de la diástole.
Si se utiliza la ecocardiografía en modo M, se recomienda que se guíe por una vista 2D paraesternal derecha de eje corto. Se recomienda medir el grosor del septo y de la pared libre utilizando una técnica leading-edge-to-leading edge, de modo que para el tabique se excluya la capa endocárdica del ventrículo izquierdo, y para la pared libre se excluya el pericardio (Figura 7).
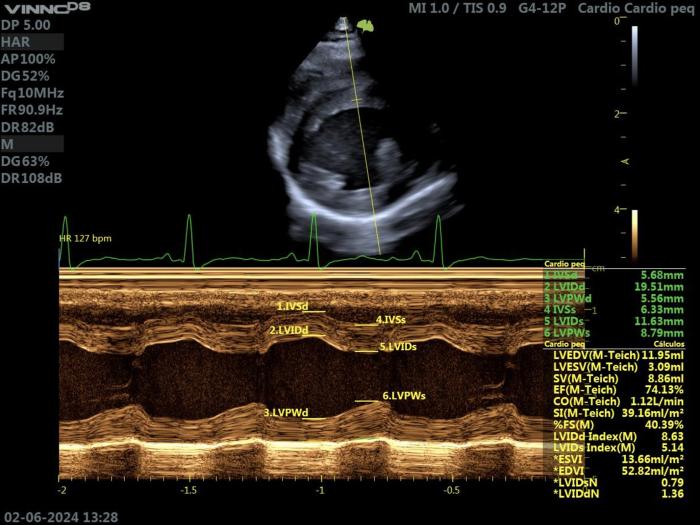
Figura 7.
Con la ecocardiografía 2D, se recomienda medir el grosor de la pared del ventrículo izquierdo en las vistas paraesternal derecha de eje largo (Figura 8A) y de eje corto (Figura 8B), midiendo la parte más gruesa del tabique y de la pared libre en cada vista.
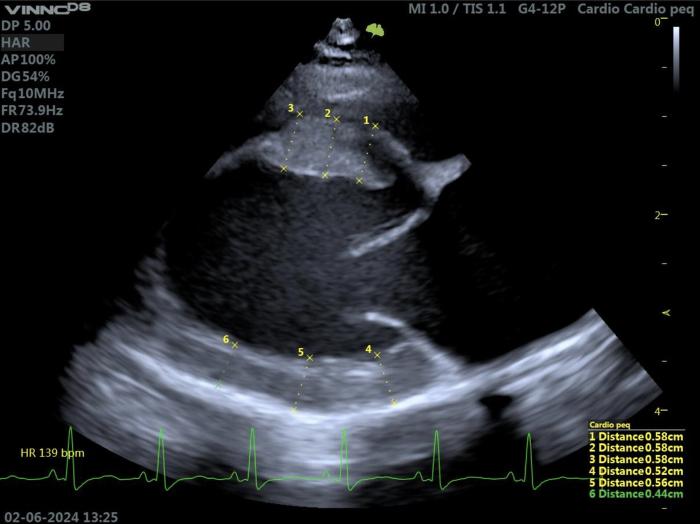
Figura 8.
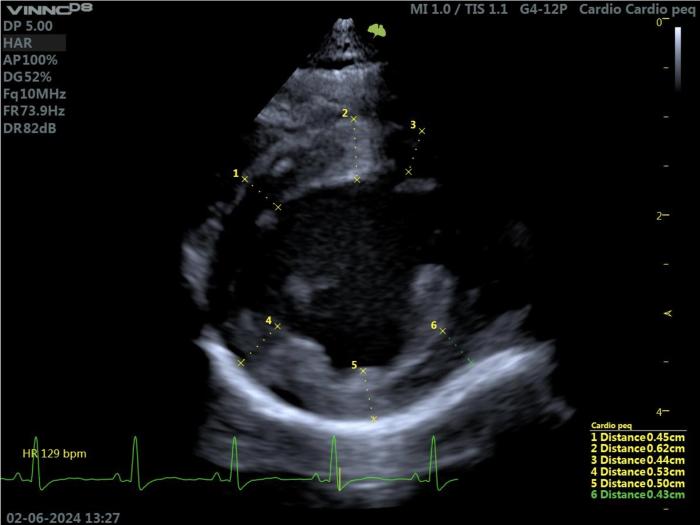
Al utilizar la ecocardiografía 2D, se debe considerar una técnica leading-edge-to-trailing-edge para medir el tabique, incluyendo en la medida ambas capas endocárdicas, y una técnica leading-edge-to-leading-edge, excluyendo el pericardio, para medir la pared libre del ventrículo izquierdo. En las regiones donde se produce un marcado engrosamiento endocárdico, se recomienda excluir la capa endocárdica de las mediciones.
Los diámetros diastólico y sistólico del ventrículo izquierdo al final de la diástole se han medido tradicionalmente utilizando el modo M, empleando una técnica leading edge-to-leading edge, pero también se pueden medir a partir de imágenes bidimensionales, usando una técnica trailing edge-to-leading edge, sin incluir en la medida ninguna de las dos capas endocárdicas.
Además de medir las dimensiones de la cámara ventricular izquierda, se recomienda evaluar la presencia o ausencia de obstrucción dinámica del tracto de salida del ventrículo izquierdo (DOLVOT). La evaluación de la DOLVOT se puede realizar utilizando una combinación de ecocardiografía 2D, modo M y Doppler. La ecocardiografía 2D del tracto de salida del ventrículo izquierdo (LVOT) debería permitir la identificación del movimiento anterior sistólico (SAM) de la válvula mitral, donde la valva septal de la válvula mitral se desplaza hacia el tabique durante la sístole, obstruyendo el LVOT. El SAM de la válvula mitral también se puede visualizar mediante ecocardiografía en modo M (Figura 9A). El Doppler color puede usarse para identificar la turbulencia característica de la obstrucción del LVOT, así como el chorro de regurgitación mitral asociado al SAM, y el Doppler espectral puede emplearse para estimar el gradiente máximo de la DOLVOT desde las vistas apicales izquierdas (Figura 9B).
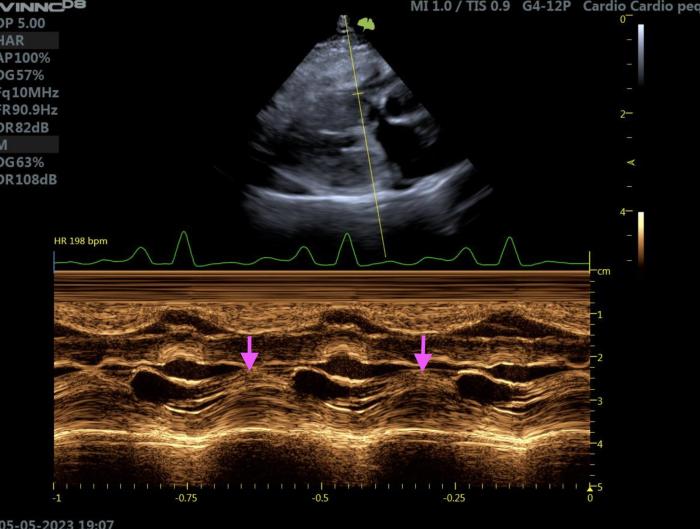
Figura 9. (A) Imagen ecocardiográfica en modo M de un gato, en la que se muestra el movimiento anterior sistólico de la válvula mitral. Se trata de una vista paraesternal derecha de eje largo, optimizada para el tracto de salida del ventrículo izquierdo, en la que el velo anterior de la válvula mitral contacta con el tabique interventricular durante la sístole (flechas rosas). (B) Imagen ecocardiográfica con Doppler espectral de un gato, en la que se muestra la obstrucción dinámica del tracto de salida del ventrículo izquierdo. Se trata de una vista paraesternal izquierda apical de cinco cámaras, obteniendo a este nivel un gradiente máximo de 58.34 mmHg.

Se recomienda también en estos pacientes evaluar la función diastólica y asignar una clase de disfunción diastólica mediante una combinación de Doppler espectral y Doppler tisular (Tabla 2).
| Parámetro | Normal | Relajación anormal con presiones de llenado normales (estadio Ia) | Relajación anormal con presiones de llenado elevadas (estadio Ib) | Pseudonormal (estadio II) | Restrictivo (estadio III) |
|---|---|---|---|---|---|
| E/A | 1.12 ± 0.22 | <1 | <1 | ≈1 | >2 |
| IVRT (ms) | 43 ± 9 | >60 | >60 | 37-60 | <37 |
| E/e’ | <10 | <10 | ≥10 | ≥10 | ≥10 |
Tabla 2. Estadios de disfunción diastólica en los gatos. Desde función diastólica normal, pasando por las dos subetapas de disfunción diastólica leve o patrón de relajación anormal (Ia y Ib), la disfunción diastólica moderada o patrón pseudonormal (estadio II), y finalizando con la disfunción diastólica grave o patrón restrictivo (estadio III). E/A: relación entre la velocidad máxima de las dos ondas del flujo transmitral, E y A; IVRT: tiempo de relajación isovolumétrica; E/e’: relación entre la velocidad máxima de la onda E del flujo transmitral y la onda e’ del Doppler tisular del anillo mitral lateral.
Protocolo ecocardiográfico para el screening de cardiomiopatías en gatos reproductores
Para el screening de estos gatos, se debe realizar al menos una ecocardiografía estándar, que consiste en una evaluación cuantitativa de las dimensiones de la cámaras cardiacas izquierdas, incluyendo el tamaño de la aurícula izquierda, el grosor de la pared del ventrículo izquierdo y el diámetro del ventrículo izquierdo, así como la fracción de acortamiento de la aurícula izquierda y del ventrículo izquierdo, una evaluación cualitativa de las anormalidades en la geometría de la cámara ventricular izquierda y la presencia o ausencia de SAM de la válvula mitral (Tabla 3).
| Nivel técnico | Medidas | Evaluación cualitativa |
|---|---|---|
| T- FAST | - |
|
| Ecocardiografía estándar | Modo M - IVSd, LVFWd - LVIDd, LVIDs, LV FS% - LA FS% Bidimensional - IVSd, LVFWd - LVIDd, LVIDs - LA/Ao - Diámetro LA desde la vista paraesternal derecha de eje largo |
|
| Ecocardiografía de experto | Modo M y bidimensional igual que en ecocardiografía estándar Doppler espectral - Velocidades del flujo de llenado mitral - Tiempo de relajación isovolumétrica - Velocidad del tracto de salida del ventrículo izquierdo - Velocidad del tracto de salida del ventrículo derecho - Velocidades del flujo de sangre en el apéndice auricular izquierdo Doppler tisular - Velocidades del anillo mitral septal y lateral | Igual que para ecocardiografía estándar |
Tabla 3. Protocolos ecocardiográficos para un gato con sospecha de cardiomiopatía según el nivel (desde el nivel más básico, que se corresponde con la T-FAST; pasando por el nivel intermedio, representando por la ecocardiografía estándar; hasta la ecocardiografía más avanzada, realizada por un experto).
Ecografía T-FAST: examen ecocardiográfico abreviado realizado debido a la inestabilidad del paciente, porque el operador tiene capacitación limitada en ecocardiografía, o ambas cosas; Ecocardiografía estándar: examen ecocardiográfico que incluye el contenido considerado estándar por un observador competente y capacitado; Ecocardiografía de experto: examen ecocardiográfico realizado por un cardiólogo con experiencia en ecocardiografía. IVSd: grosor del tabique interventricular telediastólico, LA: aurícula izquierda, LA FS %: fracción de acortamiento de la aurícula izquierda, LA/Ao: relación entre aurícula izquierda y diámetro aórtico, LAA: apéndice auricular izquierdo, LV: ventrículo izquierdo, LV FS%: fracción de acortamiento del ventrículo izquierdo, LVFWd: grosor de la pared libre del ventrículo izquierdo al final de la diástole, LVIDd: diámetro del ventrículo izquierdo al final de la diástole, LVIDs: diámetro del ventrículo izquierdo al final de la sístole, LVOT: tracto de salida del ventrículo izquierdo, RVOT: tracto de salida del ventrículo derecho, SAM: movimiento anterior sistólico de la válvula mitral.
En comparación con los gatos que tienen HCM subclínica, los sonidos de galope o las arritmias son más comunes en los gatos con CHF, mientras que los soplos son menos comunes. Se pueden escuchar crepitaciones pulmonares cuando hay edema pulmonar, y los sonidos respiratorios a menudo aparecen atenuados ventralmente cuando hay derrame pleural.
Se puede sospechar de cardiomiopatía en un gato cuando hay cardiomegalia grave radiográficamente visible, especialmente cuando hay un agrandamiento auricular izquierdo en las vistas dorsoventral, ventrodorsal, o ambas. La radiografía torácica es poco sensible para la identificación de cambios cardiacos leves o moderados asociados con la cardiomiopatía. En algunos gatos la silueta cardiaca puede parecer normal, incluso cuando la enfermedad es lo suficientemente grave como para causar CHF.
Protocolo ecocardiográfico para un gato con sospecha de cardiomiopatía
Se recomiendan investigaciones adicionales cuando los antecedentes, los hallazgos del examen físico, o ambos, sugieren que un gato podría tener cardiomiopatía. También se deben considerar investigaciones adicionales en gatos mayores cuando se planifica una anestesia, una fluidoterapia intravenosa o un tratamiento con corticosteroides de liberación prolongada. Idealmente, se realizará en este tipo de pacientes estables una ecocardiografía de experto. En caso de no estar disponible, podría ser suficiente para confirmar o descartar la presencia de cardiomiopatía la realización de una ecocardiografía estándar. Si tampoco fuera posible una evaluación estándar, un examen T-FAST aún podría proporcionar cierta información sobre la presencia de enfermedad y acerca del riesgo de CHF o ATE.
Protocolo ecocardiográfico para un gato con sospecha de insuficiencia cardiaca congestiva
Para gatos clínicamente inestables, o donde la ecocardiografía a nivel de experto no está disponible, se puede usar un examen T-FAST para identificar la presencia de líquido pleural o pericárdico, o ambos, la presencia de líneas B en los pulmones, y proporcionar una estimación subjetiva del tamaño de la aurícula izquierda y de la función sistólica del ventrículo izquierdo. Se recomienda que este examen sea completado posteriormente por una ecocardiografía de experto o, al menos, por una ecocardiografía estándar, una vez que el gato esté más estable (Figura 10).
Figura 10.
Aproximación al diagnóstico de cardiomiopatía subclínica
Los gatos con cardiomiopatía subclínica pueden ser difíciles de identificar. Se debe considerar la evaluación cardiaca para los gatos con antecedentes sospechosos o hallazgos del examen físico que incluyan un sonido de galope, soplo o arritmia, y en gatos que se considera que tienen un alto riesgo de insuficiencia cardiaca congestiva si se someten a intervenciones como anestesia o terapia de fluidos intravenosos.
La ecocardiografía es, actualmente, la prueba clínica más precisa para el diagnóstico de cardiomiopatía en gatos, y también es la mejor técnica para estimar el pronóstico, pero es tremendamente operador-dependiente. Sin embargo, con el entrenamiento y la experiencia adecuados, el examen T-FAST es factible en la práctica generalista y puede ser utilizado para mejorar la precisión del diagnóstico de cardiomiopatía por parte de profesionales no expertos, particularmente en gatos con enfermedad más avanzada. Se recomienda que el examen T-FAST se realice solo después del entrenamiento y la práctica apropiados, y que vaya seguido de un examen ecocardiográfico estándar, o idealmente de experto, para caracterizar el fenotipo de la cardiomiopatía (Figura 11).

Figura 11.
Cuando la ecocardiografía no esté disponible, se puede considerar la evaluación de las concentraciones de NT-proBNP, que se incrementarán de forma significativa en gatos asintomáticos con mayor gravedad clínica. Así, la medición de NT-proBNP puede considerarse como una prueba de detección inicial para identificar aquellos pacientes con cardiomiopatía avanzada. Los resultados normales de NT-proBNP no aseguran que un gato esté libre de cardiomiopatía, especialmente cuando hay una enfermedad cardiaca leve, ni garantizan que un gato permanecerá libre de cardiomiopatía más adelante a lo largo de su vida; sin embargo, indican una baja probabilidad de cardiomiopatía clínicamente dañina. Se recomienda que una prueba de NT-proBNP positiva siempre sea seguida por un examen ecocardiográfico de experto. También se recomienda una ecocardiografía de experto en gatos sospechosos de cardiomiopatía, aunque los resultados iniciales de NT-proBNP se encuentren dentro de los intervalos de referencia normales.
Aproximación al diagnóstico en gatos con sospecha de insuficiencia cardiaca congestiva
Existen diferentes hallazgos en el examen físico, como taquipnea, disnea, crepitaciones pulmonares, hipotermia y sonidos de galope que son altamente sugestivos de CHF, pero en algunos gatos la taquipnea con disnea podría ser la única anomalía detectada (Vídeo 4). Aunque la radiografía torácica tradicionalmente se ha considerado la prueba de elección para detectar el edema pulmonar cardiogénico, se debe tener cuidado para minimizar el estrés al obtener radiografías de gatos con dificultad respiratoria. Los infiltrados pulmonares y la cardiomegalia son los hallazgos clave para el diagnóstico de CHF, pero las características radiográficas clásicas de CHF, como el agrandamiento de la aurícula izquierda y los vasos pulmonares distendidos, no se identifican con facilidad en todos los gatos afectados.
Vídeo 4.
Si no se pueden obtener radiografías de manera segura, debe considerarse la realización de un examen T-FAST o una prueba de NT-proBNP. Con el examen T-FAST, la presencia de derrame pleural o líneas B, en asociación con un agrandamiento grave de la aurícula izquierda es altamente sugestivo de CHF. Un resultado negativo en una prueba de NT-proBNP sugiere que es más probable que la causa de la dificultad respiratoria sea una enfermedad respiratoria que una enfermedad cardiaca. Una vez que un gato con CHF se ha estabilizado, se debe considerar siempre un examen ecocardiográfico estándar o de experto.
Bibliografía
- Adin DB, Diley-Poston L. Papillary muscle measurements in cats with normal echocardiograms and cats with concentric left ventricular hypertrophy. J Vet Intern Med. 2007;21:737-741.
- Abbott JA, MacLean HN. Two-dimensional echocardiographic assessment of the feline left atrium. J Vet Intern Med. 2006;20: 111-119.
- Atkins CE, Gallo AM, Kurzman ID, Cowen P. Risk factors, clinical signs, and survival in cats with a clinical diagnosis of idiopathic hypertrophic cardiomyopathy: 74 cases (1985-1989). J Am Vet Med Assoc. 1992;201:613-618.
- Bartoszuk U, Keene BW, Baron Toaldo M, et al. Holter monitoring demonstrates that ventricular arrhythmias are common in cats with decompensated and compensated hypertrophic cardiomyopathy. Vet J. 2019;243:21-25.
- Baty CJ, Malarkey DE, Atkins CE, DeFrancesco TC, Sidley J, Keene BW. Natural history of hypertrophic cardiomyopathy and aortic thromboembolism in a family of domestic shorthair cats. J Vet Intern Med. 2001;15:595-599.
- Benigni L, Morgan N, Lamb CR. Radiographic appearance of cardiogenic pulmonary oedema in 23 cats. J Small Anim Pract. 2009;50: 9-14.
- Bonagura JD. Feline echocardiography. J Feline Med Surg. 2000;2:147-151.
- Bond BR, Fox PR, Peterson ME, Skavaril RV. Echocardiographic findings in 103 cats with hyperthyroidism. J Am Vet Med Assoc. 1988; 192:1546-1549.
- Borgeat K, Wright J, Garrod O, Payne JR, Fuentes VL. Arterial thromboembolism in 250 cats in general practice: 2004-2012. J Vet Intern Med. 2014;28:102-108.
- Borgeat K, Casamian-Sorrosal D, Helps C, Luis Fuentes V, Connolly DJ. Association of the myosin binding protein C3 mutation (MYBPC3 R820W) with cardiac death in a survey of 236 Ragdoll cats. J Vet Cardiol. 2014;16:73-80.
- Borgeat K, Sherwood K, Payne J, et al. Plasma cardiac troponin I concentration and cardiac death in cats with hypertrophic cardiomyopathy. J Vet Intern Med. 2014;28:1731-1737.
- Borgeat K, Stern J, Meurs KM, et al. The influence of clinical and genetic factors on left ventricular wall thickness in Ragdoll cats. J Vet Cardiol. 2015;17(Supplement 1):S258-S267.
- Borgeat K, Connolly DJ, Luis FV. Cardiac biomarkers in cats. J Vet Cardiol. 2015;17:S74-S86.
- Brizard D, Amberger C, Hartnack S et al. Phenotypes and echocardiographic characteristics of a European population of domestic shorthair cats with idiopathic hypertrophic cardiomyopathy. Schweiz Arch Tierheilk. Nov 2009:529-538.
- Brown DJ, Rush JE, MacGregor J et al. M-Mode echocardiographic ratio indices in normal dogs, cats, and horses: a novel quantitative method. J Vet Intern Med. 2003;17:653-662.
- Carlos Sampedrano C, Chetboul V, Gouni V et al. Systolic and diastolic myocardial dysfunction in cats with hypertrophic cardiomyopathy or systemic hypertension. J Vet Intern Med. 2006;20:1106-1115.
- Carlos Sampedrano C, Chetboul V, Mary J, et al. Prospective echocardiographic and tissue Doppler imaging screening of a population of Maine coon cats tested for the A31P mutation in the myosin- binding protein C gene: a specific analysis of the heterozygous status. J Vet Intern Med. 2009;23:91-99.
- Chetboul V, Lefebvre HP, Pinhas C, Clerc B, Boussouf M, Pouchelon JL. Spontaneous feline hypertension: clinical and echocardiographic abnormalities, and survival rate. J Vet Intern Med. 2003;17:89-95.
- Chetboul V, Petit A, Gouni V, et al. Prospective echocardiographic and tissue Doppler screening of a large Sphynx cat population: reference ranges, heart disease prevalence and genetic aspects. J Vet Cardiol. 2012;14:497-509.
- Chetboul V, Passavin P, Trehiou-Sechi E, et al. Clinical, epidemiological and echocardiographic features and prognostic factors in cats with restrictive cardiomyopathy: a retrospective study of 92 cases (2001-2015). J Vet Intern Med. 2019;33:1222-1231.
- Cote E, Manning AM, Emerson D, Laste NJ, Malakoff RL, Harpster NK. Assessment of the prevalence of heart murmurs in overtly healthy cats. J Am Vet Med Assoc. 2004;225:384-388.
- Cote E, Jaeger R. Ventricular tachyarrhythmias in 106 cats: associated structural cardiac disorders. J Vet Intern Med. 2008;22: 1444-1446.
- Dickson D, Little CJL, Harris J, Rishniw M. Rapid assessment with physical examination in dyspnoeic cats: the RAPID CAT study. J Small Anim Pract. 2018;59:75-84.
- Elliott P, Andersson B, Arbustini E, et al. Classification of the cardiomyopathies: a position statement from the European Society of Cardiology Working Group on myocardial and pericardial diseases. Eur Heart J. 2008;29:270-276.
- Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35:2733-2779.
- Ferasin L. Feline myocardial disease. 1: Classification, pathophysiology and clinical presentation. J Feline Med Surg. 2009;11:3-13.
- Ferasin L. Feline myocardial disease. 2: Diagnosis, prognosis and clinical management. J Feline Med Surg. 2009;11:183-194.
- Ferasin L, DeFrancesco T. Management of acute heart failure in cats. J Vet Cardiol. 2015;17:S173-S1789.
- Ferasin L, Sturgess CP, Cannon MJ, Caney SMA, Gruffydd-Jones TJ, Wotton PR. Feline idiopathic cardiomyopathy: a retrospective study of 106 cats (1994-2001). J Feline Med Surg. 2003;5:151-159.
- Fox PR, Liu SK, Maron BJ. Echocardiographic assessment of spontaneously occurring feline hypertrophic cardiomyopathy. An animal model of human disease. Circulation. 1995;92:2645-2651.
- Fox PR, Maron BJ, Basso C, Liu SK, Thiene G. Spontaneously occurring arrhythmogenic right ventricular cardiomyopathy in the domestic cat: a new animal model similar to the human disease. Circulation. 2000;102:1863-1870.
- Fox PR, Oyama MA, Reynolds C, et al. Utility of plasma N-terminal pro-brain natriuretic peptide (NT-proBNP) to distinguish between congestive heart failure and non-cardiac causes of acute dyspnea in cats. J Vet Cardiol. 2009;11(Suppl 1):S51-S61.
- Fox PR, Rush JE, Reynolds CA, et al. Multicenter evaluation of plasma N-terminal pro-brain natriuretic peptide (NT-pro BNP) as a biochemical screening test for asymptomatic (occult) cardiomyopathy in cats. J Vet Intern Med. 2011;25:1010-1016.
- Fox PR, Keene BW, Lamb K, et al. International collaborative study to assess cardiovascular risk and evaluate long-term health in cats with preclinical hypertrophic cardiomyopathy and apparently healthy cats: the REVEAL study. J Vet Intern Med. 2018;32:930-943.
- Fries R, Heaney AM, Meurs KM. Prevalence of the myosin-binding protein C mutation in Maine coon cats. J Vet Intern Med. 2008;22: 893-896.
- Gavaghan BJ, Kittleson MD, Fisher KJ, Kass PH, Gavaghan MA. Quantification of left ventricular diastolic wall motion by Doppler tissue imaging in healthy cats and cats with cardiomyopathy. Am J Vet Res. 1999;60:1478-1486.
- Goodwin JK, Lombard CW, Ginex DD. Results of continuous ambulatory electrocardiography in a cat with hypertrophic cardiomyopathy. J Am Vet Med Assoc. 1992;200:1352-1354.
- Guglielmini C, Diana A. Thoracic radiography in the cat: identification of cardiomegaly and congestive heart failure. J Vet Cardiol. 2015;17:S87-S101.
- Guillaumin J, Gibson RM, Goy-Thollot I, et al. Thrombolysis with tissue plasminogen activator (TPA) in feline acute aortic thromboembolism: a retrospective study of 16 cases. J Feline Med Surg. 2019; 21:340-346.
- Haggstrom J, Luis Fuentes V, Wess G. Screening for hypertrophic cardiomyopathy in cats. J Vet Cardiol. 2015;17(Suppl 1):S134-S149.
- Haggstrom J, Andersson AO, Falk T, et al. Effect of body weight on echocardiographic measurements in 19,866 pure-bred cats with or without heart disease. J Vet Intern Med. 2016;30:1601-1611.
- Hambrook LE, Bennett PF. Effect of pimobendan on the clinical outcome and survival of cats with non-taurine responsive dilated cardiomyopathy. J Feline Med Surg. 2012;14:233-239.
- Hassdenteufel E, Henrich E, Hildebrandt N, Stosic A, Schneider M. Assessment of circulating N-terminal pro B-type natriuretic peptide concentration to differentiate between cardiac from noncardiac causes of pleural effusion in cats. J Vet Emerg Crit Care. 2013;23: 416-422.
- Henik RA, Stepien RL, Bortnowski HB. Spectrum of M-mode echocardiographic abnormalities in 75 cats with systemic hypertension. J Am Anim Hosp Assoc. 2004;40:359-363.
- Hertzsch S, Roos A, Wess G. Evaluation of a sensitive cardiac troponin I assay as a screening test for the diagnosis of hypertrophic cardiomyopathy in cats. J Vet Intern Med. 2019;33:1242-1250.
- Hezzell MJ, Rush JE, Humm K, et al. Differentiation of cardiac from noncardiac pleural effusions in cats using second-generation quantitative and point-of-care NT-proBNP measurements. J Vet Intern Med. 2016;30:536-542.
- Hogan DF, Fox PR, Jacob K, et al. Secondary prevention of cardiogenic arterial thromboembolism in the CAT: the double-blind, randomized, positive-controlled feline arterial thromboembolism; clopidogrel vs. aspirin trial (FAT CAT). J Vet Cardiol. 2015;17(Suppl 1):S306-S317.
- Hori Y, Iguchi M, Heishima Y, et al. Diagnostic utility of cardiac troponin I in cats with hypertrophic cardiomyopathy. J Vet Intern Med. 2018;32:922-929.
- Hsu A, Kittleson MD, Paling A. Investigation into the use of plasma NT-proBNP concentration to screen for feline hypertrophic cardiomyopathy. J Vet Cardiol. 2009;11:S63-S70.
- Humm K, Hezzell M, Sargent J, Connolly DJ, Boswood A. Differentiating between feline pleural effusions of cardiac and non-cardiac origin using pleural fluid NT-proBNP concentrations. J Small Anim Pract. 2013;54:656-661.
- Jackson BL, Lehmkuhl LB, Adin DB. Heart rate and arrhythmia frequency of normal cats compared to cats with asymptomatic hypertrophic cardiomyopathy. J Vet Cardiol. 2014;16:215-225.
- Jackson BL, Adin DB, Lehmkuhl LB. Effect of atenolol on heart rate, arrhythmias, blood pressure, and dynamic left ventricular outflow tract obstruction in cats with subclinical hypertrophic cardiomyopathy. J Vet Cardiol. 2015;17(Suppl 1):S296-S305.
- James R, Guillot E, Garelli-Paar C, Huxley J, Grassi V, Cobb M. The SEISICAT study: a pilot study assessing efficacy and safety of spironolactone in cats with congestive heart failure secondary to cardiomyopathy. J Vet Cardiol. 2018;20:1-12.
- King JN, Martin M, Chetboul V, et al. Evaluation of benazepril in cats with heart disease in a prospective, randomized, blinded, placebo-controlled clinical trial. J Vet Intern Med. 2019;33:2559-2571.
- Kittleson MD, Meurs KM, Munro MJ, et al. Familial hypertrophic cardiomyopathy in Maine coon cats: an animal model of human disease. Circulation. 1999;99:3172-3180.
- Kraus MS, Calvert CA, Jacobs GJ. Hypertrophic cardiomyopathy in a litter of five mixed-breed cats. J Am Anim Hosp Assoc. 1999;35: 293-296.
- Le Boedec K, Arnaud C, Chetboul V, et al. Relationship between paradoxical breathing and pleural diseases in dyspneic dogs and cats: 389 cases (2001-2009). J Am Vet Med Assoc. 2012;240:1095-1099.
- Ljungvall I, Rishniw M, Porciello F, Haggstroom J, Ohad D. Sleeping and resting respiratory rates in healthy adult cats and cats with subclinical heart disease. J Feline Med Surg. 2014;16:281-290.
- Locatelli C, Pradelli D, Campo G, et al. Survival and prognostic factors in cats with restrictive cardiomyopathy: a review of 90 cases. J Feline Med Surg 2018;20:1138-1143.
- Longeri M, Ferrari P, Knafelz P, et al. Myosin-binding protein C DNA variants in domestic cats (A31P, A74T, R820W) and their association with hypertrophic cardiomyopathy. J Vet Intern Med. 2013;27:275-285.
- Loughran KA, Rush JE, Rozanski EA, Oyama MA, Larouche-Lebel É, Kraus MS. The use of focused cardiac ultrasound to screen for occult heart disease in asymptomatic cats. J Vet Intern Med. 2019; 33:1892-1901.
- Luis Fuentes V, Abbott J, Chetboul V et al. ACVIMconsensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J Vet Intern Med, 2020; 34:1062-1077.
- Luis Fuentes V. Diastolic function - is this the key to successful management of many feline cardiomyopathies? J Feline Med Surg. 2003;5:51.56.
- MacDonald KA, Kittleson MD, Larson RF, et al. The effect of ramipril on left ventricular mass, myocardial fibrosis, diastolic function, and plasma neurohormones in Maine coon cats with familial hypertrophic cardiomyopathy without heart failure. J Vet Intern Med. 2006; 20:1093-1105.
- MacDonald KA, Kass PH, Kittleson MD. Effect of spironolactone on diastolic function and left ventricular mass in Maine coon cats with familial hypertrophic cardiomyopathy. J Vet Intern Med. 2007;21: 611-611.
- Mary J, Chetboul V, Sampedrano CC, et al. Prevalence of the MYBPC3-A31P mutation in a large European feline population and association with hypertrophic cardiomyopathy in the Maine coon breed. J Vet Cardiol. 2010;12:155-161.
- Meurs et al. A deleterious mutation in the ALMS1 gene in a naturally occurring model of hypertrophic cardiomyopathy in the Sphynx cat. Orphanet J Rare Dis (2021) 16:108.
- Moise NS, Dietze AE, Mezza LE, Strickland D, Erb HN, Edwards NJ. Echocardiography, electrocardiography, and radiography of cats with dilatation cardiomyopathy, hypertrophic cardiomyopathy, and hyperthyroidism. Am J Vet Res. 1986;47:1476-1486.
- Moise NS, Dietze AE. Echocardiographic, electrocardiographic, and radiographic detection of cardiomegaly in hyperthyroid cats. Am J Vet Res. 1986;47:1487-1494.
- Moore KE, Morris N, Dhupa N, Murtaugh R, Rush J. Retrospective study of streptokinase administration in 46 cats with arterial thromboembolism. J Vet Emerg Crit Care. 2000;10:245-257.
- Nelson L, Reidesel E, Ware WA, et al. Echocardiographic and radiographic changes associated with systemic hypertension in cats. J Vet Intern Med. 2002;16:418-425.
- Novo Matos J, Pereira N, Glaus T, et al. Transient myocardial thickening in cats associated with heart failure. J Vet Intern Med. 2018; 32:48-56.
- Oura TJ, Young AN, Keene BW, Robertson ID, Jennings DE, Thrall DE. A valentine-shaped cardiac silhouette in feline thoracic radiographs is primarily due to left atrial enlargement. Vet Radiol Ultrasound. 2015;56:245-250.
- Paige CF, Abbott JA, Fo E, et al. Prevalence of cardiomyopathy in apparently healthy cats. J Am Vet Med Assoc. 2009;234:1398-1403.
- Payne J, Luis Fuentes V, Boswood A, Connolly D, Koffas H, Brodbelt D. Population characteristics and survival in 127 referred cats with hypertrophic cardiomyopathy (1997 to 2005). J Small Anim Pract. 2010;51:540-547.
- Payne JR, Borgeat K, Connolly DJ, et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. J Vet Intern Med. 2013;27:1427- 1436.
- Payne JR, Borgeat K, Brodbelt DC, et al. Risk factors associated with sudden death vs. congestive heart failure or arterial thromboembolism in cats with hypertrophic cardiomyopathy. J Vet Cardiol. 2015; 17(Supplement 1):S318-S328.
- Payne JR, Brodbelt DC, Luis FV. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J Vet Cardiol. 2015;17(Supplement 1):S244-S257.
- Pierce KV, Rush JE, Freeman LM, Cunningham SM, Yang VK. Association between survival time and changes in NT-proBNP in cats treated for congestive heart failure. J Vet Intern Med. 2017;31:678-684.
- Pion PD, Kittleson MD, Rogers QR, Morris J. Myocardial failure in cats associated with low plasma taurine: a reversible cardiomyopathy. Science. 1987;237:764-768.
- Reina-Doreste Y, Stern JA, Keene BW, et al. Case-control study of the effects of pimobendan on survival time in cats with hypertrophic cardiomyopathy and congestive heart failure. J Am Vet Med Assoc. 2014;245:534-539.
- Romito G, Guglielmini C, Mazzarella MO, et al. Diagnostic and prognostic utility of surface electrocardiography in cats with left ventricular hypertrophy. J Vet Cardiol. 2018;20:364-375.
- Rush JE, Freeman LM, Fenollosa NK, Brown DJ. Population and survival characteristics of cats with hypertrophic cardiomyopathy: 260 cases (1990-1999). J Am Vet Med Assoc. 2002;220:202-207.
- Schober KE, Maerz I. Assessment of left atrial appendage flow velocity and its relation to spontaneous echocardiographic contrast in 89 cats with myocardial disease. J Vet Intern Med. 2006;20: 120-130.
- Schober KE, Maerz I, Ludewig E, Stern JA. Diagnostic accuracy of electrocardiography and thoracic radiography in the assessment of left atrial size in cats: comparison with transthoracic 2-dimensional echocardiography. J Vet Intern Med. 2007;21:709-718.
- Schober K, Todd A. Echocardiographic assessment of left ventricular geometry and the mitral valve apparatus in cats with hypertrophic cardiomyopathy. J Vet Cardiol. 2010;12:1-16.
- Schober KE, Zientek J, Li X, Luis Fuentes V, Bonagura JD. Effect of treatment with atenolol on 5-year survival in cats with preclinical (asymptomatic) hypertrophic cardiomyopathy. J Vet Cardiol. 2013; 15:93-104.
- Schober KE, Wetli E, Drost WT. Radiographic and echocardiographic assessment of left atrial size in 100 cats with acute left-sided congestive heart failure. Vet Radiol Ultrasound. 2014;55:359-367.
- Schober KE, Chetboul V. Echocardiographic evaluation of left ventricular diastolic function in cats: hemodynamic determinants and pattern recognition. J Vet Cardiol. 2015;17(Suppl 1):S102-S133.
- Schober KE, Savino S, Vedat Y. Reference intervals and allometric scaling of two-dimensional echocardiographic measurements in 150 healthy cats. J Vet Med Sci. 2017:79(11):1764-1771.
- Silva AC, Muzzi RAL, Oberlender G et al. Feline hypertrophic cardiomyopathy: an echocardiographic approach. Arch Med Vet. 2013;45:1-6.
- Sleeper MM, Roland R, Drobatz KJ. Use of the vertebral heart scale for differentiation of cardiac and noncardiac causes of respiratory distress in cats: 67 cases (2002-2003). J Am Vet Med Assoc. 2013; 242:366-371.
- Smith SA, Tobias AH, Jacob KA, Fine DM, Grumbles PL. Arterial thromboembolism in cats: acute crisis in 127 cases (1992-2001) and long-term management with low-dose aspirin in 24 cases. J Vet Intern Med. 2003;17:73-83.
- Smith S, Dukes-McEwan J. Clinical signs and left atrial size in cats with cardiovascular disease in general practice. J Small Anim Pract. 2012;53:27-33.
- Spalla I, Locatelli C, Riscazzi G, Santagostino S, Cremaschi E, Brambilla P. Survival in cats with primary and secondary cardiomyopathies. J Feline Med Surg. 2016;18:501-509.
- Swift S, Dukes-McEwan J, Fonfara S, Loureiro JF, Burrow R. Aetiology and outcome in 90 cats presenting with dyspnoea in a referral population. J Small Anim Pract. 2009;50:466-473.
- Trehiou-Sechi E, Tissier R, Gouni V, et al. Comparative echocardiographic and clinical features of hypertrophic cardiomyopathy in 5 breeds of cats: a retrospective analysis of 344 cases (2001–2011). J Vet Intern Med. 2012;26:532-541.
- Wagner T, Fuentes VL, Payne JR, McDermott N, Brodbelt D. Comparison of auscultatory and echocardiographic findings in healthy adult cats. J Vet Cardiol. 2010;12:171-182.
- Ward JL, Schober K, Luis-Fuentes V, et al. Effects of sedation on echocardiographic variables of left atrial and left ventricular function in healthy cats. J Feline Med Surg. 2012;14:678-685.
- Ward JL, Lisciandro GR, Keene BW, Tou SP, DeFrancesco TC. Accuracy of point-of-care lung ultrasonography for the diagnosis of cardiogenic pulmonary edema in dogs and cats with acute dyspnea. J Am Vet Med Assoc. 2017;250:666-675.
- Ward JL, Lisciandro GR, Ware WA, et al. Evaluation of point-of-care thoracic ultrasound and NT-proBNP for the diagnosis of congestive heart failure in cats with respiratory distress. J Vet Intern Med. 2018; 32:1530-1540.
- Welch KM, Rozanski EA, Freeman LM, Rush JE. Prospective evaluation of tissue plasminogen activator in 11 cats with arterial thrombo- embolism. J Feline Med Surg. 2010;12:122-128.
- Wess G, Daisenberger P, Mahling M, Hirschberger J, Hartmann K. Utility of measuring plasma N-terminal pro-brain natriuretic peptide in detecting hypertrophic cardiomyopathy and differentiating grades of severity in cats. Vet Clin Pathol. 2011;40:237-244.
- Wilkie LJ, Smith K, Luis FV. Cardiac pathology findings in 252 cats presented for necropsy; a comparison of cats with unexpected death versus other deaths. J Vet Cardiol. 2015;17(Suppl 1):S329-
- Willis R, McLeod K, Cusack J, Wotton P. Use of an implantable loop recorder to investigate syncope in a cat. J Small Anim Pract. 2003; 44:181-183.
- Winter MD, Giglio RF, Berry CR, Reese DJ, Maisenbacher HW, Hernandez JA. Associations between ‘valentine’ heart shape, atrial enlargement and cardiomyopathy in cats. J Feline Med Surg. 2015; 17:447-452.
 by Multimédica
by Multimédica