Cardiomiopatías felinas: revisión clínica (parte 2)
Resumen breve
En el anterior artículo publicado en Clincardiovet 18 (Mayo 2024), abordamos las cardiomiopatías felinas desde un punto de vista integral, atendiendo a su clasificación, estadiaje, prevalencia, pronóstico y diagnóstico. Hablaremos en el presente texto de las distintas posibilidades terapéuticas de estos pacientes, y describiremos también las características de las diferentes cardiomiopatías que pueden padecer los gatos.Índice de contenidos
Introducción
En el anterior artículo publicado en Clincardiovet 18 (Mayo 2024), abordamos las cardiomiopatías felinas desde un punto de vista integral, atendiendo a su clasificación, estadiaje, prevalencia, pronóstico y diagnóstico. Hablaremos en el presente texto de las distintas posibilidades terapéuticas de estos pacientes, y describiremos también las características de las diferentes cardiomiopatías que pueden padecer los gatos.
Tratamiento
Etapa B1
El tratamiento de los gatos con cardiomiopatía subclínica es controvertido, porque faltan pruebas. Aunque la mayoría de los gatos con cardiomiopatía en etapa B1 no desarrollarán signos clínicos hasta fases más avanzadas de la enfermedad, se recomienda que los pacientes en esta etapa se controlen anualmente para detectar el aumento de tamaño moderado a grave de la aurícula izquierda (AI), que se correspondería con la progresión a la etapa B2. Los gatos con cardiomiopatía en etapa B1 se consideran de bajo riesgo de insuficiencia cardíaca congestiva (CHF) o tromboembolismo arterial (ATE), y en general no se recomienda el tratamiento (Vídeo 1).
Vídeo 1. Ecocardiografía 2D en un gato con HCM en etapa B1. Proyección paraesternal izquierda apical 4 cámaras.
No hay evidencia de que la obstrucción dinámica del tracto de salida del ventrículo izquierdo (DLVOTO) esté asociada con un aumento de morbilidad o mortalidad en gatos, y no se ha demostrado que el atenolol tenga ningún efecto sobre la tasa de supervivencia a 5 años en felinos con cardiomiopatía hipertrófica (HCM) subclínica. Sin embargo, se espera que el atenolol disminuya el gradiente de la DLVOTO, así como la frecuencia cardíaca, y se puede considerar su uso en gatos con cardiomiopatía en estadio B1 y DLVOTO grave, siempre que se pueda administrar de manera sencilla.
Etapa B2
Los gatos con HCM en etapa B2 tienen un mayor riesgo de desarrollar CHF o ATE. No se ha estudiado la prevención primaria del ATE en gatos con cardiomiopatía subclínica, pero se recomienda la tromboprofilaxis por vía oral (PO) cuando existen factores de riesgo conocidos para ATE. El clopidogrel fue más efectivo que la aspirina en gatos que habían sobrevivido a un episodio previo de ATE, y no han sido reportados otros estudios randomizados y controlados. Por lo tanto, se recomienda el uso de clopidogrel (18.75 mg/gato/24 h PO, con comida) en gatos considerados en riesgo de ATE (aumento de tamaño moderado a grave de la AI, fracción de acortamiento de la AI baja, velocidades bajas de la sangre en el apéndice de la AI, presencia de ecocontraste espontáneo). El clopidogrel no elimina el riesgo de ATE, por lo que se pueden considerar otros fármacos antitrombóticos PO, además de clopidogrel, en gatos que se cree tengan un riesgo muy alto de ATE (p. ej., clopidogrel + aspirina, clopidogrel + un inhibidor del factor Xa o clopidogrel + aspirina + un inhibidor del factor Xa) (Vídeo 2).
Vídeo 2. Ecocardiografía 2D en un gato con HCM en etapa B2. Proyección paraesternal derecha de eje largo 4 cámaras. Nótese la marcada hipertrofia concéntrica difusa del VI, así como la dilatación moderada-grave de la AI.
Los gatos con cardiomiopatía en etapa B2 deben controlarse para detectar la progresión de la enfermedad y el desarrollo de signos clínicos, pero también deben tenerse en cuenta los efectos del estrés causado por la reexaminación. Si se vuelve a examinar un gato en etapa B2, es importante prestar atención al manejo adecuado y a minimizar los estímulos estresantes. Si estas medidas son (o es probable que sean) insuficientes, se puede considerar la administración PO de productos farmacéuticos apropiados (p. ej., gabapentina), la aplicación de feromonas felinas sintéticas, o ambas.
Una vez que la AI presenta una dilatación de moderada a grave, y se inicia el tratamiento antitrombótico, es poco probable que el tratamiento cambie hasta que se desarrollen los signos clínicos, pero, como mínimo, se recomienda que los tutores controlen la frecuencia respiratoria del gato durante el sueño, con el objetivo de que se mantenga <30 respiraciones/min (Vídeo 3).
Vídeo 3. Ecocardiografía 2D en un gato con HCM en etapa B2. Proyección paraesternal derecha de eje corto a nivel de la base cardíaca. Nótese la grave dilatación de la AI.
En dos estudios randomizados, con placebo controlado, ni un inhibidor de la enzima convertidora de angiotensina (ramiprilo), ni la espironolactona, tuvieron efectos sobre la masa del ventrículo izquierdo (VI) o sobre la función diastólica en gatos con HCM subclínica, pero las poblaciones de estudio eran pequeñas y limitadas a gatos de una sola raza que tenían cardiomiopatía hereditaria. De manera similar, el benazeprilo no tuvo ningún efecto en comparación con el placebo en un estudio randomizado, con placebo controlado, que incluyó gatos con enfermedad cardíaca subclínica. No se han informado estudios sobre el uso de pimobendan en gatos con cardiomiopatía subclínica.
La ectopia ventricular es común en gatos con HCM y cardiomiopatía arritmogénica del ventrículo derecho (ARVC), y se asocia con muerte súbita en personas con estas cardiomiopatías. Las opciones de tratamiento en gatos son limitadas, pero se ha demostrado que el atenolol disminuye la ectopia ventricular en gatos con HCM. Se recomienda que los gatos con ectopia ventricular compleja sean tratados con atenolol (6.25 mg/gato/12 h PO) o sotalol (10 - 20 mg/gato/12 h PO).
Se observa un aumento notable de la frecuencia cardíaca en una minoría de gatos con fibrilación auricular (FA), pero la FA ocurre con frecuencia en el contexto de una cardiomiopatía avanzada, donde la taquicardia es poco tolerada. Diltiazem, atenolol o sotalol pueden considerarse en gatos con FA y una tasa de respuesta ventricular rápida (Vídeo 4).
A
Vídeo 4 (A-C). Ecocardiografía 2D en un gato con HCM en etapa B2. El electrocardiograma simultáneo muestra fibrilación auricular con bloqueo de rama.
B
C
Etapa C - Insuficiencia cardíaca descompensada
Los gatos con edema pulmonar o derrame pleural causado por CHF, generalmente se presentan con taquipnea y disnea. El tratamiento con diuréticos debe considerarse inmediatamente cuando el índice de sospecha de CHF es alto, por ejemplo, si la hipotermia y el sonido de galope están presentes, especialmente cuando la ecocardiografía o la radiografía torácica no están disponibles o el riesgo del manejo para la evaluación diagnóstica parece exceder los beneficios. Se recomienda la administración de oxígeno a cualquier gato con dificultad respiratoria, y también se debe considerar la sedación con un ansiolítico (p. ej., butorfanol). El estrés debe minimizarse aún más mediante un manejo suave, un ambiente tranquilo y la provisión de una caja escondite (Figura 1, Vídeo 5).
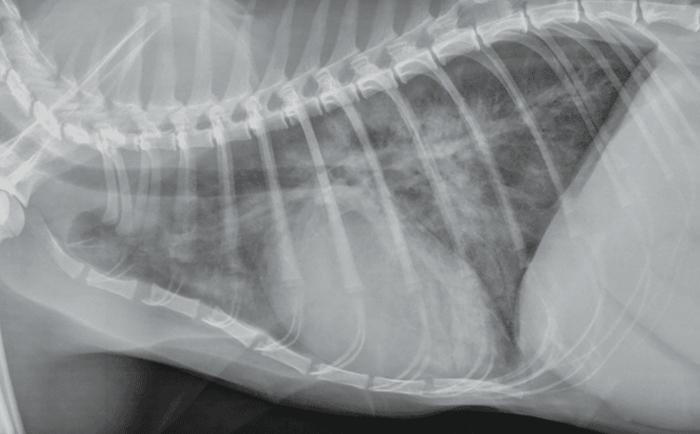
Figura 1. Radiografía torácica de un gato disneico con cardiomegalia global e infiltrados pulmonares compatibles con edema pulmonar.
Vídeo 5. Paciente felino con HCM que presenta disnea marcada asociada a CHF.
Para tratar la CHF, y en particular el edema pulmonar, se recomienda la administración intravenosa de furosemida, ya sea en forma bolos múltiples de 1 a 2 mg/kg, o como una infusión continua. La toracocentesis debe realizarse cuando la dificultad respiratoria se deba a derrame pleural. La fluidoterapia intravenosa está contraindicada en gatos con edema pulmonar o derrame pleural clínicamente relevantes, ya que puede exacerbar los signos de CHF, incluso si los diuréticos se administran simultáneamente. Idealmente se puede realizar una bioquímica sanguínea antes del tratamiento, si se pueden obtener muestras sin comprometer la seguridad del paciente, pero se recomienda siempre el tratamiento diurético para la insuficiencia cardíaca aguda, independientemente de la presencia de azotemia (Figura 2).
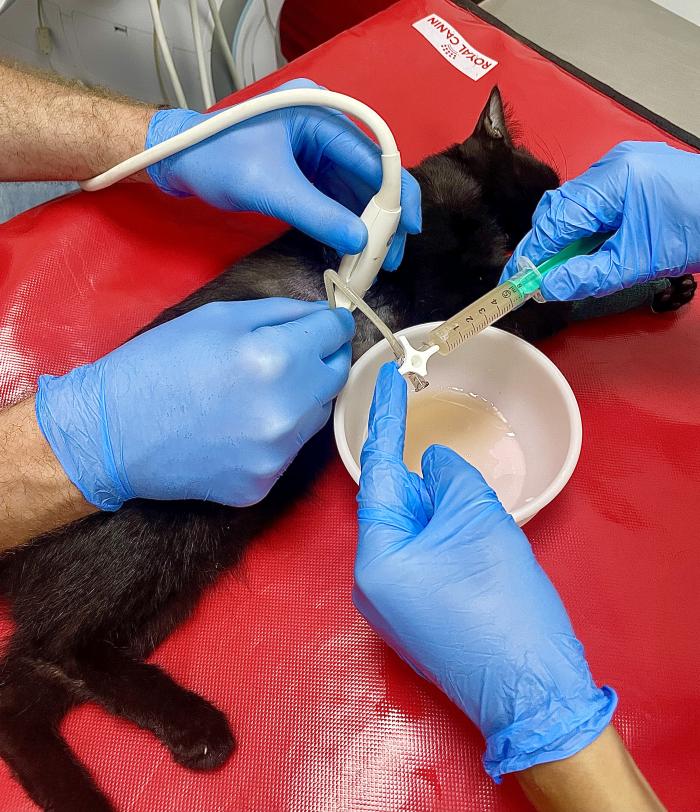
Figura 2. Toracocentesis en un gato con derrame pleural asociado a CHF en estadio C (insuficiencia cardíaca descompensada).
En gatos con signos de bajo gasto cardíaco (p. ej., hipotensión, hipotermia, bradicardia), se podría considerar el tratamiento PO con pimobendan, siempre que DLVOTO esté ausente. En gatos con insuficiencia cardíaca aguda y signos de bajo gasto cardíaco que no muestran mejoría clínica después de la administración de pimobendan, se puede considerar una infusión continua con dobutamina. No hay evidencia de la eficacia de la administración transdérmica de nitroglicerina en gatos, con lo que no se recomienda su uso. El tratamiento con inhibidores de la enzima convertidora de angiotensina no está indicado durante la descompensación aguda de gatos con cardiomiopatía. En estos pacientes se recomienda controlar la temperatura corporal, la frecuencia respiratoria, el peso corporal, la presión arterial y la producción de orina.
Una vez estabilizados, se recomienda que los gatos sean dados de alta al cuidado de sus tutores lo antes posible. Se recomienda la revisión del paciente de 3 a 7 días después del alta, para evaluar la resolución de la CHF, así como la función renal y las concentraciones séricas de electrolitos. Se recomienda que los tutores controlen la frecuencia respiratoria del gato durante el sueño, con el objetivo de que se mantenga <30 respiraciones/min.
Etapa C - Insuficiencia cardíaca crónica
La furosemida es el fármaco principal utilizado para controlar el edema pulmonar y los derrames en gatos con CHF. Típicamente, el tratamiento consiste en furosemida 0.5 a 2 mg/kg/8 - 12 h PO, dependiendo de la severidad de los signos clínicos. Una dosis inicial común es de 1 a 2 mg/kg/12 h PO. Se prefiere la administración intravenosa en gatos con dificultad respiratoria marcada por edema pulmonar (ver tratamiento de insuficiencia cardíaca descompensada aguda, más arriba). La dosis de mantenimiento de furosemida debe ajustarse para mantener una frecuencia respiratoria durante el sueño de <30 respiraciones/min. Se recomienda medir las concentraciones séricas de creatinina, BUN y electrolitos 3 - 7 días después de iniciar el tratamiento con furosemida. El uso de inhibidores de la enzima convertidora de angiotensina, como el benazeprilo, no se ha demostrado eficaz en gatos con CHF, aunque algunos cardiólogos todavía los usan. Se recomienda el tratamiento antitrombótico profiláctico con clopidogrel (18.75 mg/gato/24 h PO, con comida) en cualquier gato con antecedentes de insuficiencia cardíaca congestiva y una dilatación de la AI de moderada a grave. Algunos gatos reaccionan al clopidogrel con salivación y arcadas o vómitos, que pueden minimizarse administrando el medicamento en una cápsula de gelatina vacía, seguida de agua. El uso de pimobendan puede considerarse en gatos sin DLVOTO clínicamente relevante; una dosis comúnmente utilizada es de 0.625 a 1.25 mg/gato/12 h PO.
Se recomienda que los gatos con cardiomiopatía en etapa C se vuelvan a examinar a intervalos de aproximadamente 2 a 4 meses, o según sea necesario. Se deben considerar de forma individual los efectos del estrés causado por el reexamen. La frecuencia respiratoria registrada por el tutor puede proporcionar información útil para ajustar la medicación por teléfono, sin necesidad de visitas a la clínica, aunque la presencia de otras enfermedades concomitantes, y el riesgo de progresión de la enfermedad, pueden requerir reexaminaciones periódicas (Figura 3).
Figura 3. Auscultación de un gato con CHF en estadio C (insuficiencia cardíaca crónica), en uno de sus seguimientos rutinarios.
Para los gatos con un fenotipo de cardiomiopatía dilatada (DCM), se recomienda realizar consultas sobre el historial dietético, así como determinar las concentraciones plasmáticas de taurina, administrando suplementos y realizando cambios en la dieta según sea necesario.
Etapa D
Se puede considerar la torasemida en lugar de la furosemida en gatos con CHF refractario, a pesar del uso de altas dosis de furosemida (>6 mg/kg/día PO), a una dosis inicial de 0.1 a 0.2 mg/kg/24 h PO. La espironolactona a dosis de 1 a 2 mg/kg/12 - 24 h PO también puede considerarse para el tratamiento de la CHF crónica. Se han notificado reacciones adversas (p. ej., dermatitis ulcerosa) en gatos Maine coon tratados con espironolactona con una dosis de 2 mg/kg/12 h. En gatos con disfunción sistólica global del VI, se recomienda el uso de pimobendan. La suplementación con taurina a dosis de 250 mg/gato/12 h PO también se recomienda para gatos con disfunción sistólica global del VI, a menos que las concentraciones plasmáticas de taurina estén en el rango normal. Deben evitarse los alimentos con alto contenido en sodio. A medida que aumenta el número de medicamentos, es probable que disminuya el cumplimiento del tutor, y se deben evitar los medicamentos innecesarios.
La caquexia cardíaca, definida como pérdida de masa muscular o masa corporal magra asociada con CHF, puede estar presente en gatos con cardiomiopatía en etapa D. En estos pacientes, se debe priorizar en la alimentación el consumo de calorías sobre la restricción del consumo de sodio. Se debe evaluar en cada visita a la clínica tanto el peso del animal, como su índice de condición corporal. Se recomienda controlar también en cada visita la concentración sérica de potasio y, si se identifica hipokalemia, la dieta debe suplementarse con potasio de fuentes naturales o comerciales.
Manejo del tromboembolismo arterial (ATE)
La mayoría de los gatos con ATE que se presentan en las consultas generalistas son sacrificados. Este enfoque es justificable en términos del bienestar del gato y el mal pronóstico general, pero si la analgesia es adecuada y hay factores pronósticos favorables (p. ej., normotermia, solo un miembro afectado, ausencia de CHF), se puede considerar un intento de tratamiento, siempre que el tutor esté completamente informado de los riesgos y del mal pronóstico general (Vídeo 6).
Vídeo 6. Paciente felino con HCM que presenta paraparesia bilateral grave asociada a ATE.
La analgesia es una prioridad para el tratamiento del ATE agudo en las primeras 24 horas, y se recomienda el tratamiento con un agonista opioide de los receptores mu como fentanilo, hidromorfona o metadona. Se recomienda iniciar lo antes posible el tratamiento anticoagulante por vía parenteral con heparina de bajo peso molecular (HBPM) o heparina no fraccionada, o por vía oral con un inhibidor del factor Xa. El tratamiento trombolítico no se recomienda para gatos con ATE. Si CHF está presente con ATE, se recomienda el manejo con furosemida y oxígeno, según sea necesario, pero es importante tener en cuenta que el dolor también puede causar taquipnea, y esto no debe confundirse con la presencia de CHF. Se recomienda iniciar el tratamiento con clopidogrel tan pronto como el gato pueda tolerar medicamentos PO, con una dosis de carga inicial de 75 mg/gato PO, seguido de 18.75 mg/gato/24 h PO. La heparina se puede reemplazar por un inhibidor del factor Xa PO, como el rivaroxaban (2.5 mg/gato/24 h), en combinación con el clopidogrel.
Se recomienda la reexaminación 3 - 7 días después del alta hospitalaria, así como 1 - 2 semanas después del evento tromboembólico. El examen debe incluir la evaluación de las extremidades distales en busca de evidencia de necrosis, el estado electrolítico, el apetito y el cumplimiento del tratamiento, así como el grado de mejora en la función neuromuscular. La resolución de la disfunción de la neurona motora inferior puede llevar semanas o meses en algunos gatos, y la reexaminación debe plantearse cada 1 - 3 meses, considerando de forma individual en cada paciente los efectos derivados del estrés. Se recomienda que el tutor continúe monitorizando la frecuencia respiratoria durante el sueño.
Cardiomiopatía hipertrófica
Los cambios miocárdicos debidos a HCM pueden aparecer a cualquier edad, aunque la mayoría de los animales afectados son adultos jóvenes. Ciertas razas (particularmente Persa, British shorthair, Ragdoll y Maine coon) están predispuestas a HCM. La HCM en gatos, como en humanos, tiene un patrón familiar y se sospecha que tiene un origen genético. Se ha identificado una mutación genética del gen MyBPC3 (proteína de unión a miosina C3) en Maine coon y Ragdoll.
La HCM se caracteriza por una hipertrofia miocárdica que afecta principalmente al VI y, a veces, al ventrículo derecho (VD). Esta hipertrofia puede tomar aspectos muy diversos, y conduce a anomalías diastólicas que resultan en CHF. Estas anomalías diastólicas empeoran con la progresión de la enfermedad. Finalmente, los gatos con HCM pueden desarrollar trombos intracardíacos, y evaluar este riesgo es un objetivo importante del examen ecocardiográfico.
Ecocardiografía bidimensional y modo M
Hipertrofia del ventrículo izquierdo
Modo Bidimensional
Variabilidad de la hipertrofia
La hipertrofia del VI puede adquirir muchas apariencias, lo que hace que el grupo de pacientes afectados por HCM sea altamente heterogéneo. De hecho, esta hipertrofia puede ser simétrica o asimétrica, focal o generalizada, afectando en diversos grados el tabique interventricular, la pared libre del VI o los músculos papilares. También puede afectar a la base o al ápex del VI. Algunos gatos tienen hipertrofia limitada en la región basal del tabique (Vídeo 7).
A
Vídeo 7 (A-B). Ecocardiografía 2D en un gato con HCM en etapa B1. Se aprecia moderada hipertrofia concéntrica difusa del VI, así como leve afectación asociada del VD.El electrocardiograma simultáneo muestra bloqueo de rama, con un ritmo sinusal.
B
Un estudio realizado en 15 gatos con HCM confirmó esta heterogeneidad fenotípica. La hipertrofia fue segmentaria en 11 gatos, difusa en 3 y mínima con movimiento anterior sistólico (SAM) de la válvula mitral en 1 gato. La pared libre se vio afectada en el 53 % de los casos, el tabique basal en el 60 %, el segmento anteromedial en el 27 % y el segmento anterolateral en el 7 %. La hipertrofia involucró dos regiones diferentes en el 27 % de los casos y más de dos regiones en el 7 %.
Por lo tanto, el examen bidimensional (2D) del VI debe ser exhaustivo y completo, con evaluación de sus ejes largos y cortos, de las regiones basales y apicales, y de los músculos papilares. En el gato, un segmento de pared ventricular izquierda con un grosor diastólico final ≥6 mm es un criterio ampliamente aceptado de hipertrofia. Esta hipertrofia puede ir acompañada de una ecogenicidad miocárdica heterogénea, que se corresponde con fibrosis focal (Figuras 4 - 5).
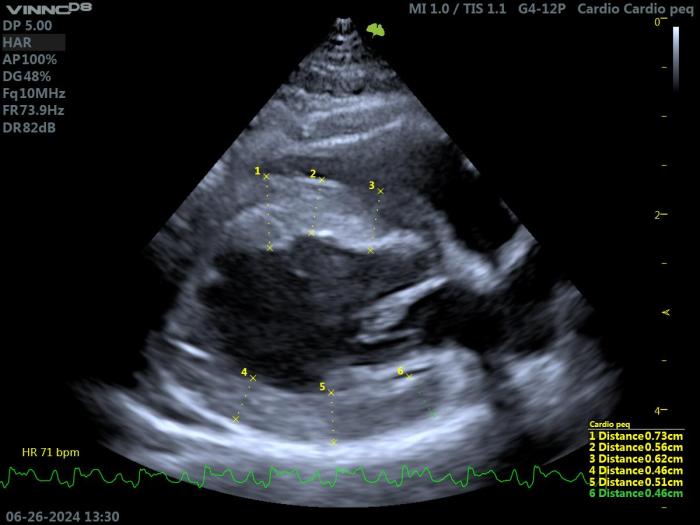
Figura 4. Ecocardiografía 2D en un gato con HCM. Proyección paraesternal derecha de eje largo 4 cámaras. Valoración del grosor del septo y de la pared libre (grosor máximo obtenido 7.3 mm).
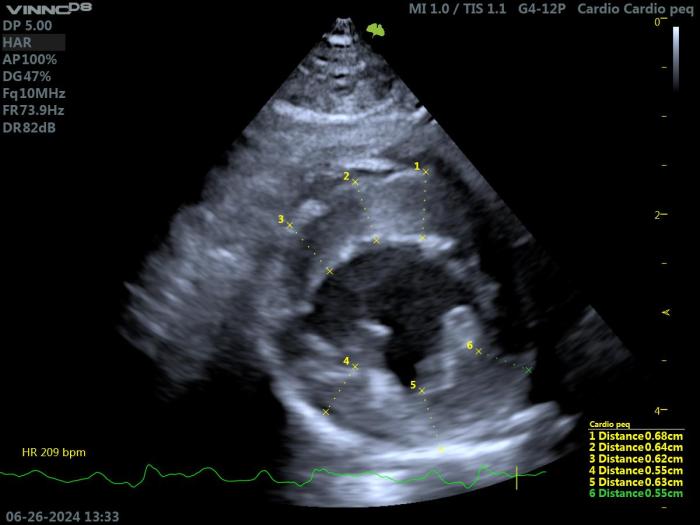
Figura 5. Ecocardiografía 2D en un gato con HCM. Proyección paraesternal derecha de eje corto a nivel del VI. Valoración del grosor del septo y de la pared libre (grosor máximo obtenido 6.8 mm).
En estos pacientes, la cámara ventricular izquierda es normal, o de diámetro reducido, y se contrae normalmente. En casos raros, se puede observar una dilatación aneurismática del ápex ventricular izquierdo.
Un estudio realizado en 18 gatos con HCM informó hipertrofia concomitante de la pared libre del ventrículo derecho en el 11 % de los casos.
En el caso particular de la HCM asociada con la distrofia muscular hipertrófica felina (resultante de la mutación del gen que codifica la distrofina), el miocardio parece engrosado y difusamente hipoecoico, generalmente con múltiples focos hiperecoicos que indican áreas de mineralización.
Remodelado miocárdico
En humanos, la HCM avanzada (5 % a 10 % de los pacientes) se caracteriza por un espesor reducido de la pared, dilatación de la cámara ventricular izquierda, reducción de la fracción de acortamiento y progresión hacia la insuficiencia cardíaca congestiva.
Un estudio documentó una progresión similar en cuatro gatos con HCM seguidos durante un período de 8 años. Se observó dilatación progresiva del VI y de la AI, así como reducción de la fracción de acortamiento. La fibrosis subendocárdica y miocárdica, así como los infartos multifocales, estuvieron presentes en tres de estos gatos, lo que indica que los fenómenos isquémicos estuvieron involucrados en el proceso de remodelación. Ecográficamente, la presencia de áreas de miocardio delgadas e hipocontráctiles adyacentes a segmentos todavía hipertrofiados caracterizaba la remodelación.
Movimiento anterior sistólico (SAM) de la válvula mitral
Entre el 33 % y el 42 % de los gatos con HCM presenta SAM de la válvula mitral, proceso por el cual la valva anterior hace contacto con el tabique durante la sístole final. Este movimiento anormal causa DLVOTO, que puede conducir a gradientes de presión significativos entre el VI y la aorta. Este SAM mitral es el resultado de factores hemodinámicos (aspiración durante la sístole de la valva anterior de la válvula mitral contra el tabique, debido a un efecto Venturi creado por las corrientes de Foucault), así como mecánico (alargamiento de la valva mitral y desplazamiento anterior de los músculos papilares, lo que lleva a la pérdida del soporte de la valva) y factores geométricos (ángulo entre el tabique interventricular y el eje aórtico).
Derrame pericárdico y pleural
En el 7 % de los gatos con HCM, se observa un leve derrame pericárdico, especialmente cuando la hipertrofia es marcada. El derrame pleural también se puede observar cuando hay insuficiencia cardíaca congestiva (Vídeo 8)
Vídeo 8. Ecocardiografía 2D en un gato con HCM en etapa C. Proyección paraesternal derecha de eje corto a nivel del VI. Nótese la presencia de derrame pleural moderado.
Dilatación de la aurícula izquierda
La dilatación de la aurícula izquierda está presente en la HCM con disfunción diastólica significativa. Se puede evaluar midiendo los tres diámetros auriculares izquierdos: LAM, LA2D y LAmax (diámetro septolateral), utilizando las vistas paraesternal derecha de eje largo 4 y 5 cámaras, y la vista transaórtica de eje corto (Figuras 6 - 8).
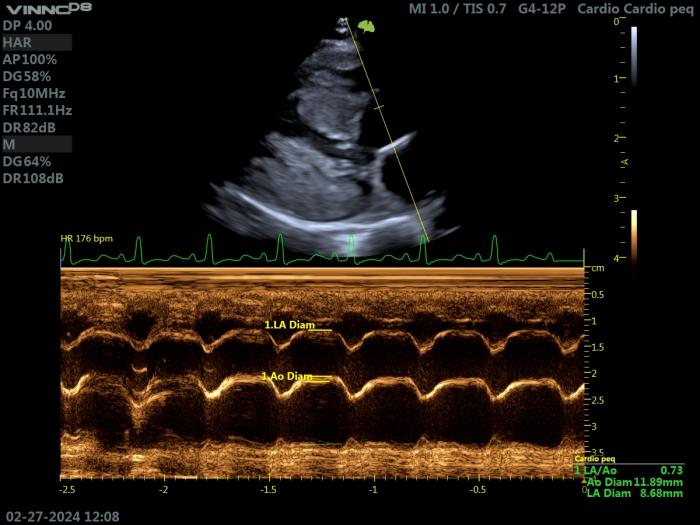
Figura 6. Ecocardiografía modo M en un gato con HCM. Proyección paraesternal derecha de eje largo 5 cámaras. Valoración del diámetro de la AI (LAM), y de su relación con la aorta (LAM/Ao = 0.73)
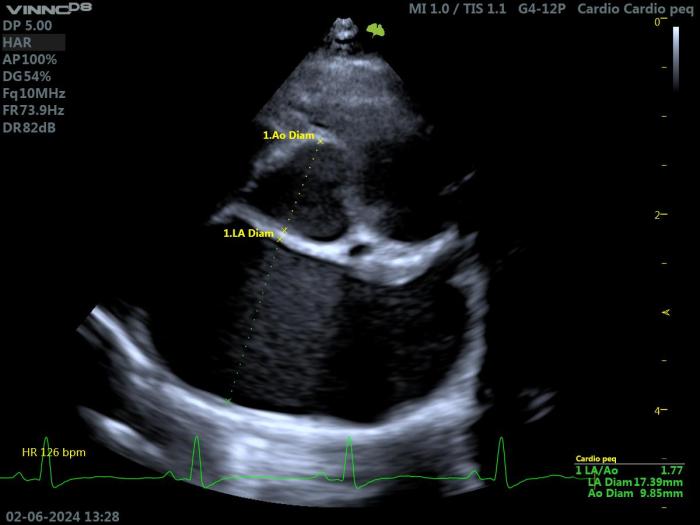
Figura 7. Ecocardiografía 2D en un gato con HCM. Proyección paraesternal derecha de eje corto a nivel de la base cardiaca. Valoración del diámetro de la AI (LA2D), y de su relación con la aorta (LA2D/Ao = 1.77).
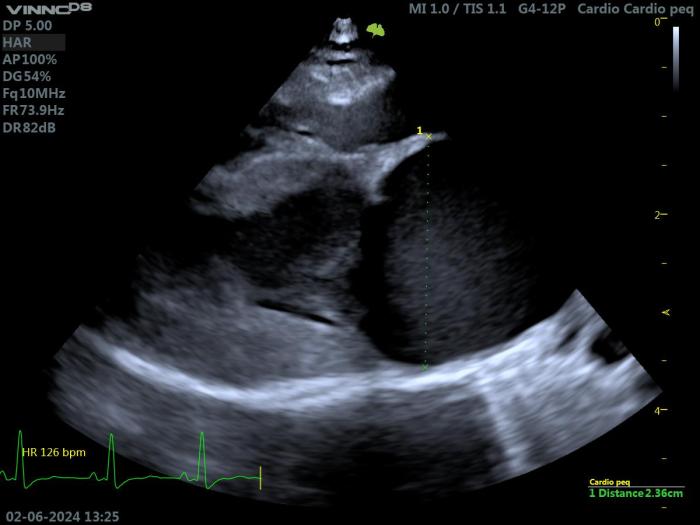
Figura 8. Ecocardiografía 2D en un gato con HCM. Proyección paraesternal derecha de eje largo 4 cámaras. Valoración del diámetro septolateral de la AI (LAmax= 23.6 mm).
La presencia de ecocontraste espontáneo en el interior de la aurícula izquierda se trata un marcador de riesgo trombótico, y debe buscarse sistemáticamente. Esta hiperecogenicidad sanguínea, observada en el 11.5 % de los casos con HCM, es el resultado de la reflexión de los ultrasonidos sobre los agregados de glóbulos rojos que giran en la luz de la aurícula izquierda. Estas espirales hiperecoicas (también llamadas smoke) deben buscarse asimismo en el apéndice auricular izquierdo. Para lograr esto, se debe usar una vista oblicua del eje corto paraesternal derecho. Puede también llegar a observarse en algunos pacientes un trombo intraauricular, especialmente cuando hay dilatación auricular izquierda marcada. Más raramente se puede observar un trombo intraventricular, que a veces puede llegar a obstruir el tracto de salida (Vídeo 9).
A
Vídeo 9. Ecocardiografía 2D en un gato con HCM en etapa C, optimizada para la visualización del apéndice auricular izquierdo. (A) Nótese la presencia de ecocontraste espontáneo. (B) Nótese la presencia de un gran trombo intraauricular.
B
Modo M
El Modo M permite documentar y cuantificar objetivamente la hipertrofia ventricular, siempre que afecte a la parte media del VI. Como ya se ha indicado anteriormente, un grosor diastólico septal o de la pared libre del ventrículo izquierdo ≥6 mm es un criterio de hipertrofia miocárdica (Figura 9).
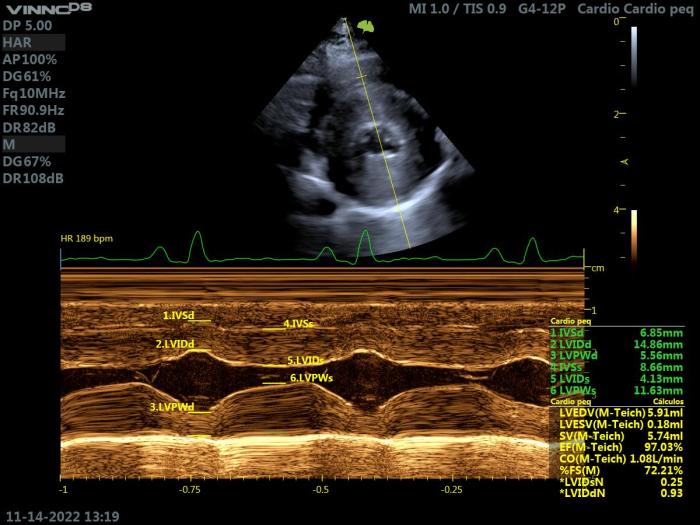
Figura 9. Ecocardiografía modo M en un gato con HCM. Proyección paraesternal derecha de eje corto a nivel del VI. Se identifica un claro aumento de grosor del septo, con una cámara ventricular de volumen normal y FS normal.
Sin embargo, para interpretar de manera óptima el grosor de la pared ventricular, se recomienda tener en cuenta el peso corporal del gato, y comparar los espesores medidos con los valores alométricos teóricos normales y las relaciones aórticas.
En pacientes con HCM, el diámetro interno diastólico final del VI presenta valores normales o reducidos, y la fracción de acortamiento valores normales o aumentados.
El SAM mitral, si está presente, se detecta fácilmente en modo M (Figura 10).
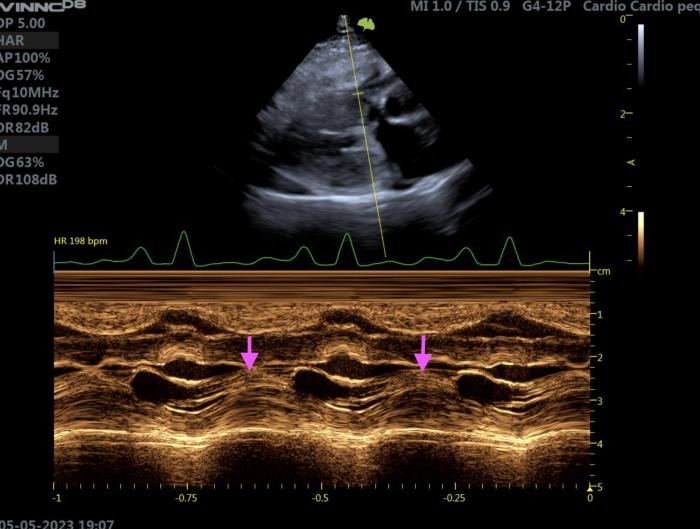
Figura 10. Ecocardiografía modo M en un gato con HCM. Proyección paraesternal derecha de eje corto a nivel de la válvula mitral. Se identifica la presencia de SAM, al apreciarse el velo anterior de la válvula mitral abierto durante la sístole (flechas rosas).
Doppler color
Obstrucción dinámica
El SAM mitral conduce a DLVOTO, con un aumento del gradiente de presión sistólica entre el VI y la aorta. En estos casos se dice entonces que la HCM es obstructiva. Se trata de una obstrucción dinámica, lo que significa que su grado es variable (dependiendo de la fase sistólica, la contractilidad y las condiciones de carga). Puede que no esté necesariamente presente en reposo. Esta obstrucción también puede verse exacerbada por el aumento de la frecuencia cardíaca.
Un estudio realizado en pacientes humanos con HCM o cardiopatía hipertensiva ha revelado que la DLVOTO no se correlacionó con el grosor del tabique basal, sino con el ángulo formado por el tabique interventricular y el eje de la raíz aórtica. Cuanto mayor es el ángulo, mayores son las posibilidades de DLVOTO.
En casos de obstrucción dinámica asociada con HCM, el Doppler color revela un mosaico turbulento sistólico en el tracto de salida del VI. La aspiración de la válvula mitral contra el tabique durante la sístole puede causar insuficiencia mitral, generalmente leve y con un jet excéntrico (Vídeo 10).
A
Vídeo 10 (A-B). Ecocardiografía Doppler en dos gatos con HCM en etapa B1. Proyección paraesternal derecha de eje largo 5 cámaras. Nótese la presencia de DLVOTO, así como un pequeño jet de regurgitación mitral excéntrico asociado a SAM de la válvula.
B
En el caso de una marcada hipertrofia concéntrica del ventrículo izquierdo, la obstrucción dinámica también puede ocurrir a nivel de los músculos papilares, causando obstrucción intraventricular izquierda al final de la sístole.
También se puede observar una obstrucción dinámica del tracto de salida del ventrículo derecho (DRVOTO), pero no es específica de la HCM y también se puede encontrar en gatos sanos.
Doppler espectral
Obstrucción dinámica del tracto de salida del ventrículo izquierdo
En caso de que la DLVOTO esté presente, el Doppler espectral documentará la presencia de un flujo transaórtico turbulento de alta velocidad. Típicamente, el flujo transaórtico de alta velocidad asociado con la HCM obstructiva es asimétrico, alcanzando su velocidad máxima al final de la sístole. Esta velocidad máxima puede variar de una sístole a otra, dependiendo de la frecuencia cardíaca (Figura 11).
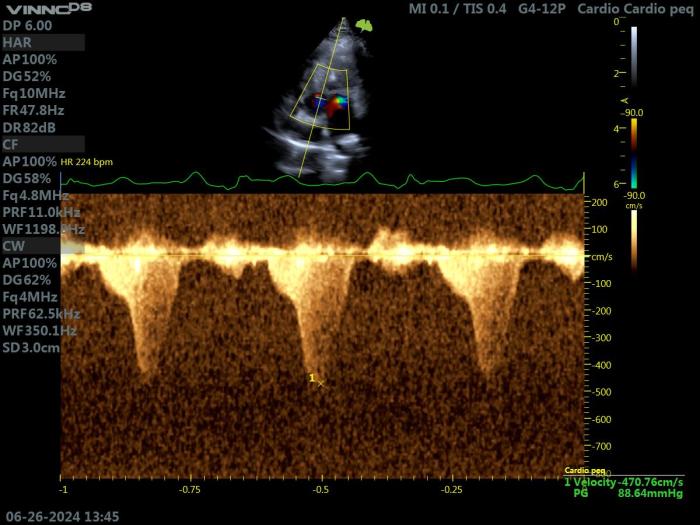
Figura 11. Ecocardiografía Doppler en un gato con HCM obstructiva. Proyección paraesternal izquierda apical 5 cámaras. Doppler continuo que muestra un flujo transaórtico turbulento de alta velocidad, con un perfil asimétrico típico de obstrucción dinámica.
En la HCM obstructiva, el gradiente de presión entre la aorta y el VI puede variar de 20 mmHg a más de 120 mmHg. Este aumento en la presión intraventricular izquierda puede conducir a una isquemia subendocárdica, y a un mayor consumo de oxígeno miocárdico, e incluso puede estimular la hipertrofia miocárdica.
En humanos, la presencia de DLVOTO puede provocar muerte súbita. El riesgo es particularmente alto en pacientes con un gradiente significativo en reposo. Esta correlación no se ha confirmado en gatos.
Evaluación de la función diastólica
Las anomalías diastólicas asociadas con la HCM son de origen multifactorial, debiéndose principalmente a la combinación de la desorganización de los cardiomiocitos, y a la aparición de lesiones de fibrosis e isquemia miocárdica. Es interesante observar que la disfunción diastólica no se limita a los segmentos de miocardio hipertrofiados.
El tipo de disfunción diastólica depende de la etapa de la enfermedad. Por lo tanto, una función diastólica inicialmente normal evolucionará a relajación anormal con presión de llenado normal, y luego a relajación anormal con presión de llenado elevada. El aumento de la presión auricular, junto con una pérdida de la elasticidad del VI, conducirá a la siguiente fase, llamada pseudonormal. Finalmente, la remodelación miocárdica y la fibrosis conducirán a la etapa restrictiva (Tabla 1).
| Parámetro | Normal | Relajación anormal con presiones de llenado normales (estadio Ia) | Relajación anormal con presiones de llenado elevadas (estadio Ib) | Pseudonormal (estadio II) | Restrictivo (estadio III) |
|---|---|---|---|---|---|
| E/A | 1.12 ± 0.22 | <1 | <1 | ≈1 | >2 |
| IVRT (ms) | 43 ± 9 | >60 | >60 | 37 - 60 | <37 |
| E/e’ | <10 | <10 | ≥10 | ≥10 | ≥10 |
Tabla 1. Estadios de disfunción diastólica en los gatos. Desde función diastólica normal, pasando por las dos subetapas de disfunción diastólica leve o patrón de relajación anormal (Ia y Ib), la disfunción diastólica moderada o patrón pseudonormal (estadio II), y finalizando con la disfunción diastólica grave o patrón restrictivo (estadio III).
E/A: relación entre la velocidad máxima de las dos ondas del flujo transmitral, E y A; IVRT: tiempo de relajación isovolumétrica; E/e’: relación entre la velocidad máxima de la onda E del flujo transmitral y la onda e’ del Doppler tisular del anillo mitral lateral.
La medición del tiempo de relajación isovolumétrica (IVRT) es crucial para evaluar el grado de disfunción diastólica asociada con la HCM en los gatos, porque las ondas E y A, así como las ondas e' y a', a menudo aparecen fusionadas en esta especie, debido a su elevada frecuencia cardíaca. Sin embargo, el valor IVRT por sí solo a veces puede ser engañoso. De hecho, la disfunción diastólica podría estar presente (y confirmada por Doppler tisular) con un IVRT todavía normal (Figura 12).
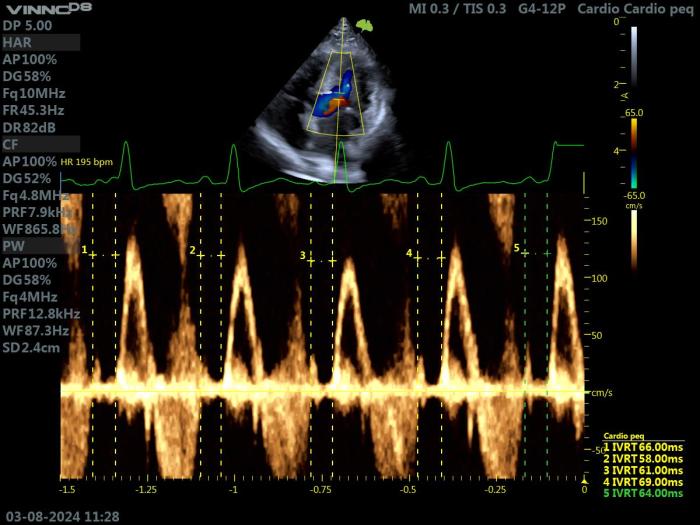
Figura 12. Ecocardiografía Doppler en un gato con HCM. Proyección paraesternal izquierda apical 5 cámaras. Doppler pulsado a nivel del tracto de salida del VI. Valoración del IVTR en varios puntos.
Doppler tisular
Doppler tisular pulsado del anillo mitral
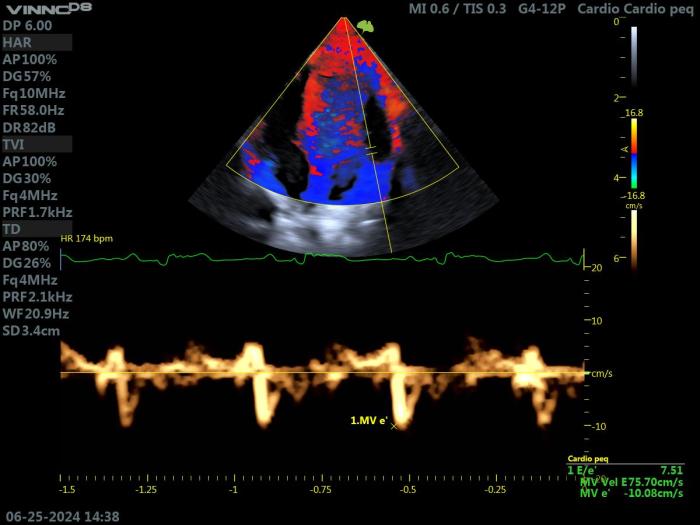
La amplitud de la onda e' del anillo mitral lateral, o de las ondas fusionadas e' y a' (e'a'fus), medidas a partir de una vista apical izquierda de 4 cámaras, disminuye en HCM debido a la alteración de la relajación ventricular.
Estas anomalías en el Doppler tisular del anillo pueden estar presentes desde fases muy precoces de la enfermedad, incluso antes de la aparición de hipertrofia. Esto se ha documentado en gatos Maine coon con un genotipo anormal (mutación MyBPC3), cuando todavía no se había detectado hipertrofia miocárdica mediante el examen ecocardiográfico convencional.
Una relación E/e'≥10 es compatible con presión auricular izquierda elevada (Figura 13).
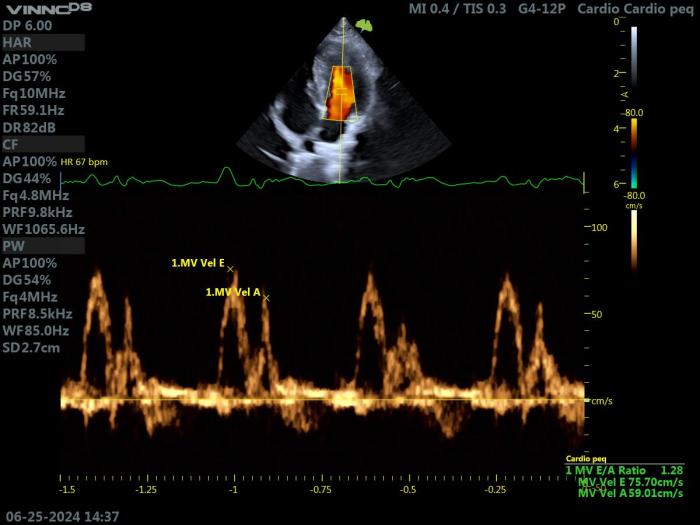
Figura 13. Ecocardiografía Doppler en un gato con HCM. Proyección paraesternal izquierda apical 4 cámaras. (A) Doppler pulsado a nivel de la válvula mitral y (B) Doppler tisular a nivel del anillo lateral de dicha válvula. Los parámetros obtenidos indican un patrón de función diastólica normal.
Cardiomiopatía restrictiva
La cardiomiopatía restrictiva (RCM) representa del 7 % al 24 % de las cardiomiopatías felinas, y puede aparecer de dos formas: miocárdica y endomiocárdica.
La forma miocárdica en los gatos es idiopática y no infiltrativa (sin depósitos de amiloide, a diferencia de los humanos). La fibrosis del endocardio es discreta y multifocal.
En la forma endomiocárdica, la fibrosis del endocardio es predominante, y a menudo se localiza en el ápex del VI. La cámara ventricular aparece deformada, a veces con obliteración de su área apical y estenosis intraventricular. El aparato mitral puede fusionarse y deformarse. La etiología de esta forma incluye síndrome hipereosinofílico, endomiocarditis y fibrosis endomiocárdica del VI.
Ecocardiografía bidimensional y modo M
En ambas formas de RCM, el grosor de las paredes del VI es típicamente normal o se encuentra en los límites superiores del rango normal. La cámara del VI es normal o está ligeramente dilatada, con una fracción de acortamiento normal o ligeramente reducida. A veces se observa discinesia regional.
En la forma endomiocárdica, se puede observar hiperecogenicidad focal del endocardio, asociado con placas endomiocárdicas.
En el caso de la endomiocarditis o fibroelastosis endocárdica, el endocardio a menudo aparece hiperecoico y engrosado difusamente. A veces se pueden observar también bandas intraventriculares que deforman la cavidad ventricular.
En pacientes con RCM suele haber dilatación marcada de las aurículas. El contraste espontáneo está presente en el interior de la AI en el 22.7 % de los gatos con RCM (Vídeo 11).
Se puede observar un pequeño derrame pericárdico en el 9.1 % de los casos.
Vídeo 11. Ecocardiografía 2D en un gato con RCM en etapa C. Proyección paraesternal derecha de eje largo 4 cámaras. Nótese la grave dilatación de ambas aurículas. Las cámaras ventriculares aparecen también dilatadas, mostrando un importante déficit contráctil. Se aprecia leve derrame pericárdico.
Doppler color
La RCM generalmente no está asociada con DLVOTO ni DRVOTO. Sin embargo, puede observarse una turbulencia sistólica en casos de estenosis intraventricular. A veces es posible observar un pequeño jet de regurgitación mitral.
Doppler espectral
El Doppler espectral permite la documentación de una disfunción diastólica con características predominantemente restrictivas. De hecho, la fibrosis miocárdica, una característica destacada de la RCM, conduce a un aumento de la rigidez del miocardio ventricular, lo que se suma a los trastornos de relajación ventricular ya presentes. Esta pérdida de complianza o distensibilidad, reducirá en gran medida el llenado diastólico final. El debilitamiento de la contractilidad auricular agrava esta situación. Al mismo tiempo, las presiones auriculares izquierdas están elevadas, exagerando el llenado diastólico temprano.
Por lo tanto, el flujo de transmisión se caracteriza por una onda E incrementada, una onda A reducida y una relación E/A incrementada. El IVRT disminuye, y las ondas e'y a' también disminuyen.
Cardiomiopatía dilatada
La cardiomiopatía dilatada (DCM) se ha vuelto rara en la especie felina desde la suplementación con taurina de los alimentos procesados para gatos. La prevalencia de DCM es actualmente del 10.4 %. Las hembras son las más afectadas. La edad promedio de los gatos afectados es de 9 años. Los siameses y los abisinios parecen estar predispuestos.
Ecocardiografía bidimensional y modo M
En su forma típica, la DCM se caracteriza por reducción del inotropismo, con dilatación de las cámaras izquierdas, o de las cuatro cavidades cardíacas. El VI se vuelve esférico y los índices de función sistólica disminuyen notablemente. Las paredes ventriculares izquierdas suelen ser más delgadas de lo normal (Vídeo 12).
Vídeo 12. Ecocardiografía 2D en un gato con DCM en etapa B2. La cámara ventricular izquierda aparece dilatada, con un importante déficit contráctil.
La válvula mitral se abre solo ligeramente en la diástole debido al bajo flujo, lo que resulta en un incremento de la distancia del punto E mitral al septo (EPSS). A veces se observa un retraso en el cierre de la válvula mitral debido a las presiones atrial y ventricular izquierdas incrementadas al final de la diástole.
El derrame pericárdico y el ecocontraste espontáneo intraauricular están presentes en el 18.2 % de los casos.
Doppler color y espectral
El Doppler color permite la detección de cualquier regurgitación mitral o tricúspide funcional secundaria a la dilatación anular.
El Doppler espectral revela flujos de eyección aórtica y pulmonar de baja velocidad. La disfunción diastólica acompaña, y a veces precede, a la disfunción sistólica. Puede variar desde relajación anómala, hasta patrón restrictivo.
Cardiomiopatías atípicas
Cardiomiopatía no específica
Algunos gatos tienen anomalías ecocardiográficas que no corresponden a ninguna de las categorías anteriores. Por lo general, hay una combinación de hipertrofia focal del VI con hipoquinesia regional, dilatación auricular marcada y regurgitación mitral. Estas se denominan cardiomiopatías no específicas (NCM). La prevalencia de NCM es del 10.4 %.
Es posible que la mayoría de estas NCM sean de hecho HCM avanzadas con remodelación significativa del VI (Vídeo 13).
A
Vídeo 13 (A-B). Ecocardiografía 2D en un gato con NCM en etapa B2. La cámara ventricular izquierda aparece dilatada, con un grosor asimétrico de sus paredes, hipoquinesia generalizada (más marcada en algunas regiones) y presencia de bandas moderadoras excesivas.
B
Cardiomiopatía con bandas moderadoras excesivas
Las bandas moderadoras o pseudotendones son bandas fibrosas intraventriculares. Ecográficamente aparecen como bandas hiperecoicas que conectan la pared libre del VI, o uno de los músculos papilares, al tabique interventricular. Las bandas discretas y aisladas no afectan la hemodinámica del VI, y a menudo se encuentran en gatos normales. Sin embargo, la presencia de bandas moderadoras gruesas o excesivas pueden afectar el llenado diastólico y causar disfunción diastólica restrictiva, lo que resulta en la dilatación de la AI. Estas bandas también pueden alterar la eyección ventricular. También en estos pacientes se puede observar hipertrofia ventricular moderada.
Cardiomiopatía arritmogénica del ventrículo derecho
Las cardiomiopatías del ventrículo derecho representan del 2 % al 4 % de todas las cardiomiopatías felinas. Están relacionadas con la cardiomiopatía arritmogénica del ventrículo derecho (ARVC) descrita en el Bóxer, con infiltración fibroadiposa del miocardio.
El examen ecocardiográfico revela dilatación segmentaria o difusa del VD, a veces con aneurismas localizados, dilatación auricular derecha significativa, morfología anormal de las trabéculas, movimiento paradójico del tabique interventricular, y una regurgitación tricúspide a menudo significativa. En algunos casos, también se puede observar dilatación de la AI y disfunción sistólica del VI. Las arritmias también pueden estar presentes (Vídeo 14).
A
Vídeo 14 (A-B). Ecocardiografía 2D en un gato con ARVC en etapa B2 (confirmada mediante biopsia miocárdica post mortem). Nótese la grave dilatación de las cámaras derechas, así como el aplanamiento del septo durante la diástole.
B
Evaluación del riesgo trombótico
El tromboembolismo arterial es una complicación grave de las cardiomiopatías felinas, que conduce a una morbilidad y mortalidad significativas. Esta complicación se observa en 36 % a 48 % de los casos de HCM, 29 % de los casos de RCM, 25 % de los casos de DCM y en el 14 % de cardiomiopatías asociadas con bandas moderadoras excesivas.
El trombo generalmente se forma en la AI. Uno de los primeros signos es la presencia de ecocontraste espontáneo a este nivel. Los factores contribuyentes son: la estasis sanguínea intraauricular, como resultado de la dilatación auricular, la contractilidad auricular izquierda deteriorada y las lesiones endoteliales, que provocan la adhesión de las plaquetas y la liberación de factores procoagulantes.
La identificación del riesgo trombótico es importante, ya que afectará la toma de decisiones con respecto a la prescripción de anticoagulantes.
Dilatación auricular
Los gatos con ecocontraste intraauricular espontáneo (SEC) tienden a tener una aurícula izquierda más dilatada que aquellos sin indicios de smoke (LAmaxsyst>2.4 cm) (Tabla 2).
| Parámetro | SEC+ | SEC- |
|---|---|---|
| LAmax (mm) | 2.4 (1.34 - 3.1) | 1.9 (1.36 - 3.25) |
| LASF% | 10 (0 - 37) | 20 (1 - 45) |
| LAFAC% | 9 (0 - 42) | 30 (0 - 61) |
| LAA Vmax (m/s) | 0.15 (0.07 - 0.23) | 0.33 (0.08 - 1.35) |
Tabla 2. Parámetros diferenciales en gatos con ecocontraste intraauricular espontáneo (SEC).
Función auricular
En los pacientes con HCM la función auricular disminuye, y esto puede conducir a la estasis sanguínea, preparando el escenario para la formación de trombos. La función auricular en los gatos con ecocontraste espontáneo intraauricular es significativamente menor que en los gatos sin indicios de smoke (Figura 14).
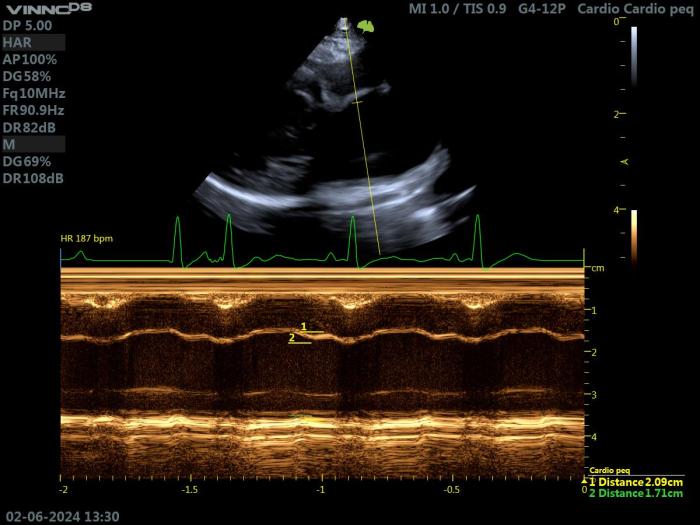
Figura 14. Ecocardiografía 2D en un gato con HCM. Proyección paraesternal derecha de eje largo 4 cámaras. Valoración de la fracción de acortamiento de la AI. LAmaxsyst 20.9 mm, LAmaxdiast17.1 mm. LASF = 18.18 %, que indica disfunción importante de la AI.
En un estudio de Schober y Maerz, se utilizaron dos parámetros para evaluar esta función: la fracción de acortamiento de la aurícula izquierda (LASF) y el cambio del área fraccional de la aurícula izquierda (LAFAC).
El cálculo de la LASF utiliza los diámetros sistólicos y diastólicos septolaterales de la aurícula izquierda (LAmaxsyst y LAmaxdiast), obtenidos utilizando la vista paraesternal derecha de eje largo de 4 cámaras:
LASF% = (LAmaxsyst - LAmaxdiast) / LAmaxsyst× 100
Las áreas sistólica y diastólica de la aurícula izquierda (LAareasysty LAareadiast) se obtienen a partir de la misma vista, y el LAFAC se calcula usando la siguiente ecuación:
LAFAC% = (LAareasyst- LAareadiast) / LAareasyst× 100
Velocidades intraauriculares
La medición de las velocidades de la sangre en el apéndice auricular izquierdo (LAA Vmax) permite la documentación de la estasis sanguínea y la identificación de gatos con riesgo de trombosis.
Estas velocidades se miden con Doppler pulsado, colocando el volumen de muestra en la entrada del apéndice auricular izquierdo, utilizando una vista oblicua del eje corto paraesternal derecho. Si el acceso al apéndice auricular izquierdo fuera imposible desde esta vista, el acceso debe realizarse desde el lado izquierdo, obteniendo un corte oblicuo desde la vista paraesternal izquierda apical.
El flujo así obtenido se caracteriza por dos ondas: la onda 1, negativa y diastólica final, correspondiente al vaciamiento diastólico final de la AI, y la onda 2, positiva y sistólica temprana, correspondiente al llenado auricular (Figura 15).
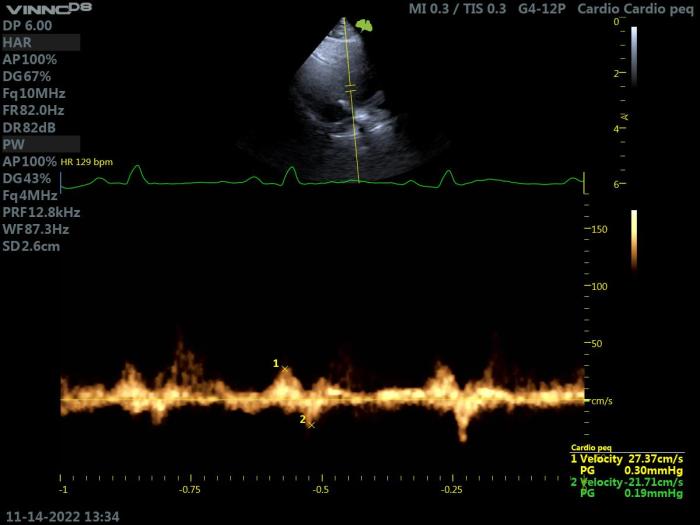
Figura 15. Ecocardiografía Doppler en un gato con HCM. Proyección paraesternal izquierda apical 4 cámaras, corte oblicuo. Valoración de las velocidades de la sangre en el apéndice auricular izquierdo, obteniendo valores > 20 cm/s, que indican un menor riesgo trombótico.
Las velocidades máximas de las ondas del apéndice auricular izquierdo en los gatos con ecocontraste espontáneo tienden a ser mucho más bajas que en los gatos sin evidencia de smoke. Un valor máximo de estas velocidades <0.20 cm/s predice la presencia de ecocontraste espontáneo e indica un mayor riesgo de formación de trombos.
Bibliografía
- Borgeat K, Wright J, Garrod O, Payne JR, Fuentes VL. Arterial thromboembolism in 250 cats in general practice: 2004-2012. J Vet Intern Med. 2014;28:102-108.
- Chadwin RM, Bain MJ, Kass PH. Effect of a synthetic feline facial pheromone product on stress scores and incidence of upper respiratory tract infection in shelter cats. J Am Vet Med Assoc. 2017;251:413-420.
- Conti LM, Champion T, Guberman UC, et al. Evaluation of environment and a feline facial pheromone analogue on physiologic and behavioral measures in cats. J Feline Med Surg. 2017;19:165-170.
- Fox PR, Maron BJ, Basso C, Liu SK, Thiene G. Spontaneously occurring arrhythmogenic right ventricular cardiomyopathy in the domestic cat: a new animal model similar to the human disease. Circulation. 2000;102:1863-1870.
- Griffiths IR, Duncan ID. Ischaemic neuromyopathy in cats. Vet Rec. 1979;104:518-522.
- Guillaumin J, Gibson RM, Goy-Thollot I, et al. Thrombolysis with tissue plasminogen activator (TPA) in feline acute aortic thromboembolism: a retrospective study of 16 cases. J Feline Med Surg. 2019; 21:340-346.
- Hambrook LE, Bennett PF. Effect of pimobendan on the clinical outcome and survival of cats with non-taurine responsive dilated cardiomyopathy. J Feline Med Surg. 2012;14:233-239.
- Hogan DF, Fox PR, Jacob K, et al. Secondary prevention of cardiogenic arterial thromboembolism in the CAT: the double-blind, randomized, positive-controlled feline arterial thromboembolism; clopidogrel vs. aspirin trial (FAT CAT). J Vet Cardiol. 2015;17(Suppl 1):S306-S317.
- Jackson BL, Adin DB, Lehmkuhl LB. Effect of atenolol on heart rate, arrhythmias, blood pressure, and dynamic left ventricular outflow tract obstruction in cats with subclinical hypertrophic cardiomyopathy. J Vet Cardiol. 2015;17(Suppl 1):S296-S305.
- James R, Guillot E, Garelli-Paar C, Huxley J, Grassi V, Cobb M. The SEISICAT study: a pilot study assessing efficacy and safety of spironolactone in cats with congestive heart failure secondary to cardiomyopathy. J Vet Cardiol. 2018;20:1-12.
- King JN, Martin M, Chetboul V, et al. Evaluation of benazepril in cats with heart disease in a prospective, randomized, blinded, placebo-controlled clinical trial. J Vet Intern Med. 2019;33:2559-2571.
- Kronen PW, Ludders JW, Erb HN, Moon PF, Gleed RD, Koski S. A synthetic fraction of feline facial pheromones calms but does not reduce struggling in cats before venous catheterization. Vet Anaesth Analg. 2006;33:258-265.
- Ljungvall I, Rishniw M, Porciello F, Häggström J, Ohad D. Sleeping and resting respiratory rates in healthy adult cats and cats with subclinical heart disease. J Feline Med Surg. 2014;16:281-290.
- MacDonald KA, Kass PH, Kittleson MD. Effect of spironolactone on diastolic function and left ventricular mass in Maine coon cats with familial hypertrophic cardiomyopathy. J Vet Intern Med. 2007;21: 611-611.
- MacDonald KA, Kittleson MD, Larson RF, et al. The effect of ramipril on left ventricular mass, myocardial fibrosis, diastolic function, and plasma neurohormones in Maine coon cats with familial hypertrophic cardiomyopathy without heart failure. J Vet Intern Med. 2006; 20:1093-1105.
- Marcus FI, McKenna WJ, Sherrill D, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia proposed modification of the task force criteria. Circulation. 2010;121: 1533-U1118.
- Moore KE, Morris N, Dhupa N, Murtaugh R, Rush J. Retrospective study of streptokinase administration in 46 cats with arterial thromboembolism. J Vet Emerg Crit Care. 2000;10:245-257.
- Pankratz KE, Ferris KK, Griffith EH, Sherman BL. Use of single-dose oral gabapentin to attenuate fear responses in cage-trap confined community cats: a double-blind, placebo-controlled field trial. J Feline Med Surg. 2018;20:535-543.
- Pion PD, Kittleson MD, Rogers QR, Morris J. Myocardial failure in cats associated with low plasma taurine: a reversible cardiomyopathy. Science. 1987;237:764-768.
- Reina-Doreste Y, Stern JA, Keene BW, et al. Case-control study of the effects of pimobendan on survival time in cats with hypertrophic cardiomyopathy and congestive heart failure. J Am Vet Med Assoc. 2014;245:534-539.
- Schober KE, Zientek J, Li X, Fuentes VL, Bonagura JD. Effect of treatment with atenolol on 5-year survival in cats with preclinical (asymptomatic) hypertrophic cardiomyopathy. J Vet Cardiol. 2013; 15:93-104.
- Sen-Chowdhry S, McKenna WJ. Sudden death from genetic and acquired cardiomyopathies. Circulation. 2012;125:1563- 1576.
- Smith SA, Tobias AH, Jacob KA, Fine DM, Grumbles PL. Arterial thromboembolism in cats: acute crisis in 127 cases (1992-2001) and long-term management with low-dose aspirin in 24 cases. J Vet Intern Med. 2003;17:73-83.
- Van der Leij WJR, Selman L, Vernooij JCM, et al. The effect of a hiding box on stress levels and body weight in Dutch shelter cats; a randomized controlled trial. PLoS One. 2019;14:e0223492.
- Van Haaften KA, Forsythe LRE, Stelow EA, Bain MJ. Effects of a single preappointment dose of gabapentin on signs of stress in cats during transportation and veterinary examination. J Am Vet Med Assoc. 2017;251:1175-1181.
- Welch KM, Rozanski EA, Freeman LM, Rush JE. Prospective evaluation of tissue plasminogen activator in 11 cats with arterial thrombo- embolism. J Feline Med Surg. 2010;12:122-128.
 by Multimédica
by Multimédica