Cierre de conducto arterioso persistente (CAP) con dispositivo AVPII en un gato con patología combinada con estenosis subaórtica
Resumen breve
Se remite para la valoración quirúrgica, un gato Común europeo, macho esterilizado, de un año de edad, 4 kilos de peso, con soplo de alta intensidad en base de corazón y de posible componente continuo a la auscultación. Se realiza un estudio preoperatorio en el que se confirma el CAP y se plantea el cierre del mismo mediante técnicas de mínima invasión con dispositivo implantado por vía vascular.Índice de contenidos
Introducción
Las patologías cardiacas congénitas en gatos son relativamente poco frecuentes. En estudios de recopilación de casos clínicos publicados anteriormente citan una cifra de 0.2 % de gatos con patología cardiaca congénita y del 8 % con patología cardiaca1. De la población descrita de 162 casos con patología cardiaca congénita, el defecto del septo ventricular era el más numeroso (50 %), seguida de la displasia de la válvula tricúspide (11 %), la estenosis pulmonar (10 %), la comunicación interauricular (10 %), la estenosis aórtica (9 %), la displasia valvular (9 %), tetralogía de Fallot (5 %), conducto arterioso persistente (3 %), canal auriculoventricular común (2 %) y los siguientes defectos que representaron cada uno el 0.6 % de los gatos: ventrículo derecho de doble cámara, doble salida del ventrículo derecho, fibroelastosis endocárdica, dextroposición de la aorta, arco aórtico derecho persistente y atresia pulmonar.
En caso que se presenta se produce la combinación de dos patologías como son la persistencia del conducto arterioso junto con la estenosis subaórtica.
Un reciente artículo publicado con 50 casos de gatos con conducto arterioso persistente mostraba que se observaron anomalías cardiacas concurrentes en el 54.5 % de los casos y con hipertensión pulmonar en el 45.7 % de los mismos.
Caso clínico
Se remite un gato Común europeo de 12 meses, macho esterilizado en la protectora de acogida, que había comenzado con signos de taquipnea. Se detectó soplo de alta intensidad por lo que se recomendó la realización de un estudio ecocardiográfico.
El estudio ecocardiográfico completo realizado mostraba signos de sobrecarga de volumen del ventrículo izquierdo y dilatación de aurícula izquierda, junto con hipertrofia de la pared del ventrículo izquierdo. Se observaba, en la proyección longitudinal derecha y en la proyección apical izquierda, la presencia de una banda hiperecogénica subaórtica, sin presencia de defecto septal asociado, con flujo turbulento en la eyección y regurgitación diastólica asociada. La morfología valvular aórtica mostraba las tres cúspides aórticas bien formadas con forma ligeramente ovalada debido a la estenosis subvalvular (Figura 1, Vídeo 1 y 2).
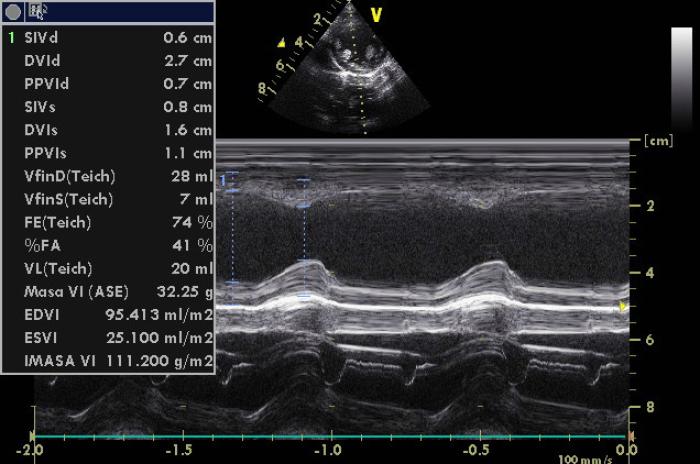
Figura 1. Medición en modo M del ventrículo izquierdo, con los valores de diámetros diastólicos y sistólicos.
Vídeo 1. Secuencia de video donde se observa dilatación del ventrículo izquierdo, de la aurícula izquierda y la válvula mitral.
Vídeo 2. Secuencia de video Doppler color, donde se observa estenosis subaórtica y la turbulencia en el tracto de salida del ventrículo izquierdo
La medición del flujo aórtico desde ventanas subcostal y apical izquierda eran coincidentes, con flujo medido mediante Doppler continuo con valores de estenosis subaórtica severa (Valores de velocidad máxima: 4.70 m/s equivalente a gradiente de presión de: 88.29 mmHg, con valoración de severa según los parámetros de la ESVC superiores a 80 mmHg) (Figura 2).
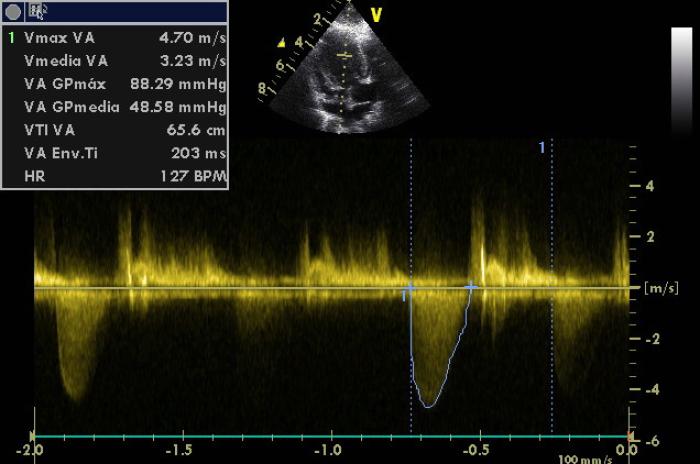
Figura 2. Medición de la velocidad de eyección en tracto de salida del ventrículo izquierdo con valores de velocidad máxima de 4.7 m/s y 88.29 mm Hg de gradiente de presión.
El estudio Doppler color de la proyección paraesternal transversal derecha en la base del corazón y tronco pulmonar se observaba flujo turbulento, continuo, de alta velocidad, compatible con conducto arterioso persistente con flujo izquierda a derecha, identificándolo con ampolla ductal de 5 mm y longitud de 10 mm aproximadamente (Figura 3, Vídeo 3).
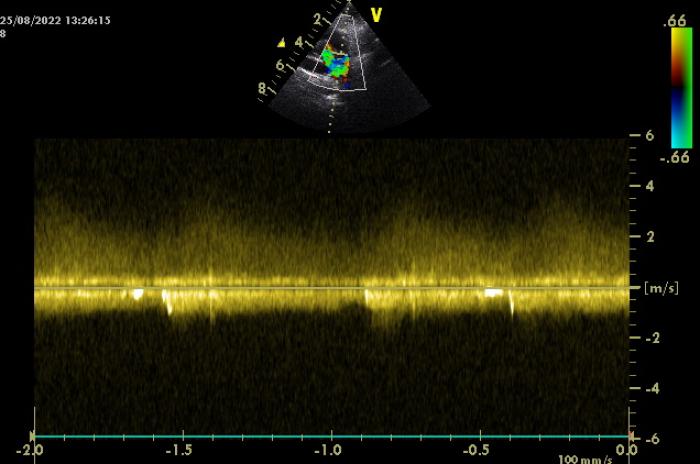
Figura 3. Imagen del Doppler continuo en el tracto de salida del ventrículo derecho donde se observa el perfil continuo típico de conducto arterioso persistente (CAP) con flujo izquierda a derecha.
Vídeo 3. Secuencia de video Doppler color donde se observa la turbulencia y el flujo continuo procedente del CAP.
Se observaron datos compatibles con elevada presión en la aurícula izquierda y taquicardia sinusal marcada, con valores de frecuencia cardiaca superiores a 240 lpm, asociada. En el momento de nuestra valoración, se observaron signos de congestión pulmonar inicial con escasas líneas B (ya en tratamiento previo con furosemida en el momento de valoración para intervención desde su clínica de origen). No se observaron datos de hipertensión pulmonar en el momento de la ecocardiografía de valoración. El ventrículo izquierdo presentaba diámetro diastólico de 2.7 cm con valores de EDVI de 95 ml/m2 y ESVI de 25 ml/m2.
El abordaje inicial consistió en la estabilización del paciente previo a la intervención del cierre del CAP, con la prescripción de atenolol 0.5 mg/kg cada 24 h y furosemida 2 mg/kg cada 8 h durante 3 días y una vez estabilizada la frecuencia respiratoria, cada 12 h hasta intervención, mejorando en varios días hasta valores de frecuencia cardiaca de 190 lpm y con leve reducción del volumen del ventrículo izquierdo.
Se planteó realizar el cierre del CAP mediante abordaje de mínima invasión, con intervencionismo vascular, con dispositivo de tipo Amplatzer Vascular Plug II (AVP II; Abbott, Aga). La preparación anestésica se realizó mediante premediación con alfaxolona, propofol, e intubación en plano. Se premedicó con heparina 80 UI/kg, furosemida a 2 mg/kg IV para reducción del volumen y antibioterapia de cobertura. El abordaje quirúrgico se realizó desde la vena yugular externa derecha, rasurando para abordaje quirúrgico desde la base de la mandíbula hasta la entrada del tórax. Se realizó un abordaje quirúrgico tipo cut-down, aislando la vena yugular externa y canalizándola mediante la técnica de Seldinger. Para ello se usó un introductor de angiografía con diámetro 5F, guía teflonada 0.035 pulgadas y se guió mediante arco fluoroscópico hacia el ventrículo derecho y el tracto de salida del mismo. Se procedió a la administración inicial de contraste yodado para la valoración del tracto de salida del ventrículo derecho. Posteriormente, se deslizó la guía a través de la ampolla del conducto arterioso persistente hasta la aorta, así como el catéter de angiografía donde se procedió a la administración de una segunda dosis de contraste para la valoración del CAP. Una vez situados en el CAP, se introdujo el dispositivo Amplatzer AVP II de 6 mm, guiándolo hasta el CAP, donde se comenzó a desplegar en el interior del CAP. En el momento del cierre se produjeron cambios momentáneos en la presión arterial y reducción de la frecuencia cardiaca hasta que hemodinámicamente se observaron estables, momento en el que se procedió a la liberación completa del mismo. Una vez liberado, se procedió a la extracción del resto del material, cerrando la vena yugular externa con sutura reabsorbible del 6/0 permaneciendo de ese modo permeable y el tejido subcutáneo y la piel de forma rutinaria (Vídeo 4).
Vídeo 4. Secuencia de fluoroscopia donde se observa el dispositivo Amplatzer AV II en el CAP y en el momento de ser liberado del cable de anclaje.
El posoperatorio posterior no presentó alteraciones relevantes salvo leve seroma en la zona de intervención y reacción frente a la sutura subcutánea que precisó de reintervenciones posteriores para su cicatrización completa.
Las revisiones posteriores ecocardiográficas mostraron reducción del volumen del ventrículo izquierdo, así como reducción de la velocidad máxima a través de la aorta, obteniéndose valores de estenosis leve: velocidad máxima: 3.37 m/s; gradiente de presión de 45 mmHg; inferior a 50 mmHg por lo que se considera en grado leve. Este hecho es un dato hemodinámico importante, pues indicaba que los valores iniciales tenían cierto componente asociado a la elevada sobrecarga de volumen del ventrículo izquierdo. El dispositivo se encuentra con óptima implantación, presentando muy leve flujo residual, sin sobrecarga de volumen y con administración de atenolol cada 24 h para el control de la frecuencia cardiaca y de furosemida cada 48 h para el control de la sobrecarga de volumen. En la actualidad, el paciente hace vida activa, normal en función de su edad sin limitación de actividad, juegos, sin que se observen signos clínicos asociados. Los valores de velocidad y gradiente máximo debido a la estenosis subaórtica permanecen estables. Los valores del ventrículo izquierdo en diástole se redujeron a 2.4 cm con valores de EDVI de 66 ml/m2 y ESVI de 14 ml/m2 (Figura 4-9; Vídeo 5 y 6).
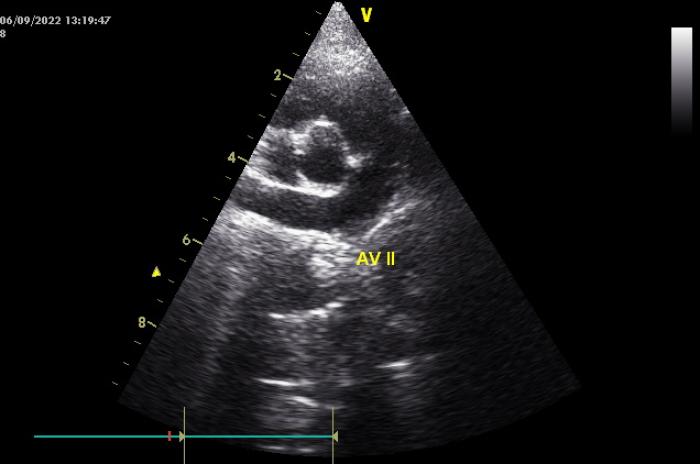
Figura 4. Imagen ecográfica en la que se observa el dispositivo implantado en el CAP con el perfil hiperecogénico típico de los dispositivos.
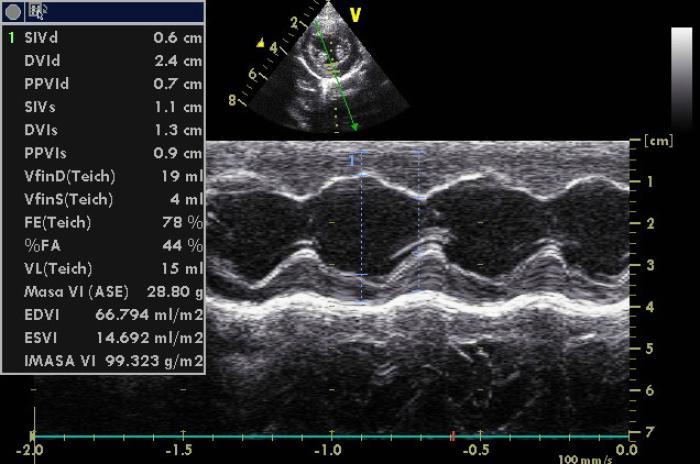
Figura 5. Medición en modo M del ventrículo izquierdo, con los valores de diámetros diastólicos y sistólicos posintervención.
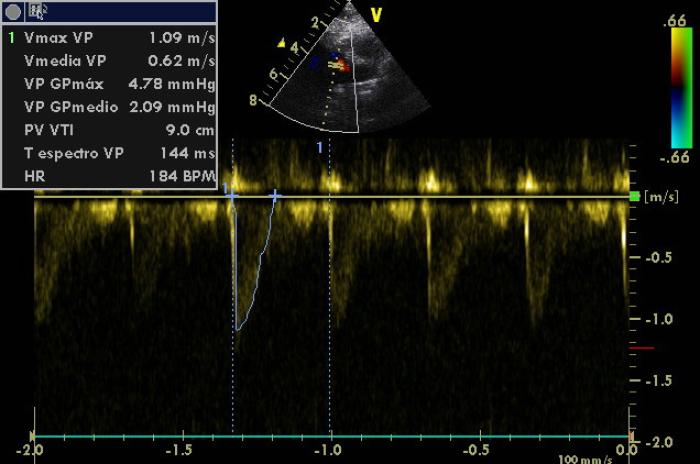
Figura 6. Imagen del Doppler pulsado posválvula pulmonar con el perfil típico y normal del flujo pulmonar, sin el flujo turbulento del CAP, ya ocluido.
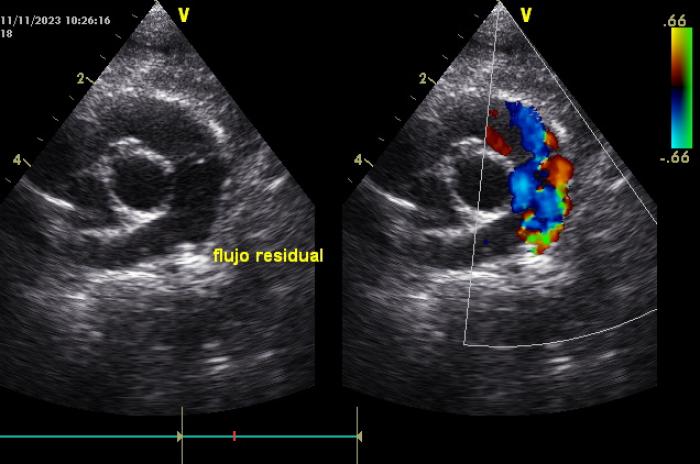
Figura 7. Imagen Doppler color del flujo residual periférico al borde del dispositivo.
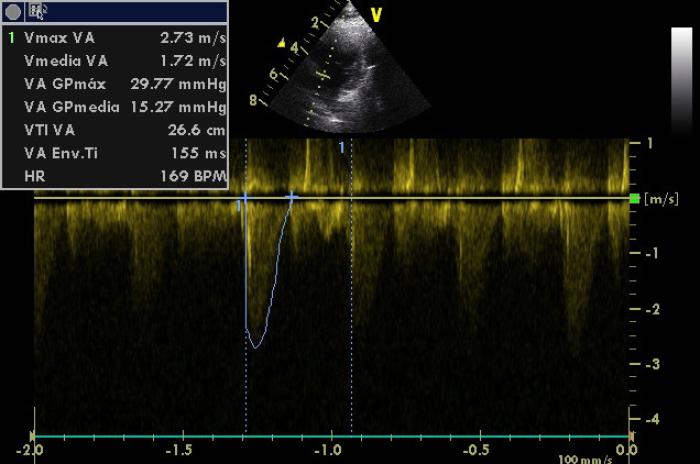
Figura 8. Medición de la velocidad de eyección en tracto de salida del ventrículo izquierdo con valores de velocidad máxima de 2.73 m/s y 29.77 mmHg de gradiente de presión.
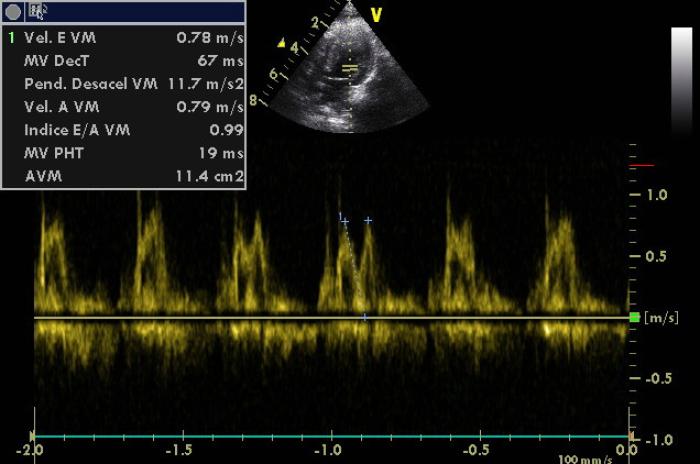
Figura 9. Medición de flujo transmitral con patrón típico de relajación anómala (disfunción diastólica leve). Indicativo de presión normal en el llenado del ventrículo izquierdo.
Vídeo 5. Secuencia donde se observa el ventrículo izquierdo, la hipertrofia y la obstrucción del tracto de salida del ventrículo izquierdo, la aurícula izquierda y la válvula mitral.
Vídeo 6. Secuencia ecocardiográfica en la que se observa el dispositivo implantado en el CAP con el perfil hiperecogénico típico de los dispositivos.
Discusión
En la evaluación inicial del caso, se planteó la posibilidad del cierre del conducto arterioso persistente mediante cirugía torácica tradicional versus mediante intervencionismo vascular por mínima invasión. El hecho de presentar la sobrecarga de volumen marcada del ventrículo izquierdo y la estenosis subaórtica hacían que hubiese mayor riesgo quirúrgico en el planteamiento de la intervención a tórax abierto durante el cierre del conducto arterioso persistente, por lo que se optó por reducir ese riesgo mediante el uso de técnicas de mínima invasión, apoyándonos en la posibilidad del uso de los dispositivos Amplatzer AVP tipo II. Por el contrario, el coste en la intervención por mínima invasión es superior a la cirugía tradicional debido además al coste del dispositivo y del material accesorio necesario para la intervención.
La elección de la técnica se debió a que el dispositivo Amplatzer AVP tipo II tiene un perfil menor que el dispositivo Amplatzer ACDO (Infiniti medical), así como su morfología, siendo más adecuado para su implantación por vía venosa. Esta vía permite acceder en animales muy pequeños, ya que la vena yugular externa presenta mayor diámetro, mayor adaptación y menos reactividad que la arteria femoral. Es relativamente frecuente que en pacientes de menos de 2 kilos no sea posible el acceso por vía arterial, debido a que el diámetro máximo de la arteria femoral es inferior al diámetro de los catéteres necesarios. Además, por el tamaño del ACDO es necesario el uso de catéteres, llamados de liberación, que permiten que el dispositivo se pueda deslizar plegado desde la vaina en la que viene de fábrica hasta el conducto arterioso persistente.
Por ese motivo, en este tipo de pacientes, la elección del dispositivo está encaminada hacia el uso de dispositivos de menor perfil que requieran catéteres e introductores de menor diámetro. Además, al acceder mediante la vena yugular externa, está presenta mayor distensibilidad y menor reacción que la arteria femoral, lo que permite el uso de dilatadores hasta conseguir el diámetro suficiente para el empleo de los catéteres de angiografía y de liberación necesarios para llevar el dispositivo hasta el conducto arterioso persistente.
Las posibles complicaciones que pueden ocurrir en este tipo de intervenciones están asociados a la posibilidad de fuga o dislocación del dispositivo, raro debido a la morfología en tres partes que presenta el dispositivo AV II frente al dispositivo ACDO que presenta morfología en dos partes principales. Aun así, la implantación y liberación debe ser cuidadosa, prestando especial atención, primero a la elección del diámetro correcto del dispositivo y, segundo, a la implantación y liberación del dispositivo, siendo este el momento más delicado en la intervención pues el dispositivo está unido al cable de liberación mediante rosca, y una vez desplegado y liberado, no es posible su recuperación. Otro dato esencial a la hora de la liberación del dispositivo es la vigilancia de los parámetros hemodinámicos para comprobar que en todo momento el paciente está estable, a pesar de los cambios bruscos que se producen, tanto en el volumen cardiaco y vascular en el momento del cierre del CAP, como los cambios en presiones y frecuencia cardiaca asociados a los mismos.
Conclusión
Como conclusión, la elección de dispositivos que permiten el acceso por vía venosa hace que sea posible su uso en el cierre del conducto arterioso persistente en pacientes, que bien por peso, o por tamaño vascular no es posible hacerlo por vía arterial, teniendo numerosas ventajas respecto a la cirugía convencional por tórax abierto.
Bibliografía
- Tidholm A, Ljungvall I, Michal J, Häggström J, Höglund K. Congenital heart defects in cats: A retrospective study of 162 cats (1996-2013). J Vet Cardiol. 2015 Dec;17 Suppl 1:S215-9. doi: 10.1016/j.jvc.2014.09.004. PMID: 26776580.
- Schorpe, Donald P, Prevalence of congenital heart disease in 76301 mixed-breed dogs and 57025 mixed-breed cats. J Vet Cardiol. 2015 Sep; 17, issue3, 191-202. https://doi.org/10.1016/j.jvc.2015.06.001
- Jeraj K, Ogburn P, Lord PF, Wilson JW.Patent ductus arteriosus with pulmonary hypertension in a cat. J Am Vet Med Assoc. 1978 Jun 15;172(12):1432-6.PMID:670047
- Bates PD.Patent ductus arteriosus in a catJ Am Vet Med Assoc. 1978 Oct 1;173(7):799-800.PMID:711601
- Schneider M, Hildebrandt N.Transvenous embolization of a patent ductus arteriosus with detachable coils in 2 cats. J Vet Intern Med. 2003 May-Jun;17(3):349-53.PMID:12774978
- A Bascuñán1,K M Thieman Mankin2,A B Saunders1,J M Bright3,V Scharf4,A Singh5,L O'Sullivan5,B Brisson5,A H Estrada6,S P Tou4,C Ruoff. Patent ductus arteriosus in cats (Felis catus): 50 cases (2000-2015). Vet Sci.2022 Oct 13;9(10):564.doi: 10.3390/vetsci9100564
- Luca Ferasin12,Heidi Ferasin12,Altin Cala12,Naomi CreelmanPrevalence and clinical significance of heart murmurs detected on cardiac auscultation in 856 cats
 by Multimédica
by Multimédica