Enfermedad degenerativa de la válvula mitral (estadio C) en un Cavalier king Charles spaniel: diagnóstico y tratamiento
Resumen breve
En este trabajo, presentamos un caso de EDVM en estadio C avanzado, que se atribuye a aquellos pacientes que se encuentran en una fase de fallo cardiaco congestivo, abordando aspectos fundamentales como su diagnóstico radiológico y ecocardiográfico, así como el tratamiento y las posibles complicaciones.Índice de contenidos
Resumen
La enfermedad degenerativa/mixomatosa de la válvula mitral (EDVM) es la patología cardíaca de mayor prevalencia en el perro. El término mixomatoso hace referencia a las características histológicas que presenta el tejido degenerado asociado al aparato valvular. La válvula más comúnmente afectada es la mitral, pero puede afectar a cualquiera de las cuatro. La EDVM representa en torno al 75-80 % de los problemas cardíacos en perros, y se puede encontrar en todas las razas, presentando una mayor predisposición aquellas de tamaño pequeño y mediano. Su prevalencia, incrementa con la edad, siendo algo mayor en machos que en hembras. La morbilidad y mortalidad de la EDVM en las razas predispuestas es alta, siendo la principal causa de insuficiencia cardíaca congestiva (ICC) en perros.
Gracias al consenso del American College of Veterinary Internal Medicine (ACVIM) en el 2019, podemos clasificar esta patología, en función de sus características y riesgos para el paciente, en 4 estadios: A, B (B1/B2), C y D.
En este trabajo, presentamos un caso de EDVM en estadio C avanzado, que se atribuye a aquellos pacientes que se encuentran en una fase de fallo cardiaco congestivo, abordando aspectos fundamentales como su diagnóstico radiológico y ecocardiográfico, así como el tratamiento y las posibles complicaciones.
Introducción
La EDVM es la patología cardíaca más frecuente en el perro, afectando principalmente a las razas pequeñas y medianas de edad media y avanzada1. Aunque su etiología no está del todo esclarecida, se ha demostrado su componente hereditario. En los Cavalier king Charles spaniel (CKCS), los loci ubicados en los cromosomas 13 y 14 están asociados con una EDVM de presentación temprana EDVM2. el nivel de ejercicio del animal, la obesidad o la dieta, no están directamente relacionados con la patología.
En las primeras fases de la enfermedad (A, B1), las dimensiones de las cámaras cardíacas, en especial del atrio izquierdo (AI) y del ventrículo izquierdo (VI) son normales, pero a medida que la enfermedad progresa, la regurgitación mitral (RM) también suele hacerlo, lo cual conlleva a la dilatación del AI y del VI junto con hipertrofia excéntrica. En los animales con EDVM en fases avanzadas (C y D) y con RM severa, suelen observarse lesiones endocárdicas frente al orificio mitral, correspondientes a fibrosis, conocidas como jet lesions en la pared del AI. Estos animales presentan un alto riesgo de ruptura del AI, con el consecuente hemopericardio y la formación de defectos septales interatriales adquiridos, observándose con frecuencia a nivel del foramen oval3. Cuando el AI y el VI se dilatan, la mala coaptación de las valvas se acrecienta, lo cual genera una mayor RM secundaria. Cuando las cuerdas tendinosas se lesionan y se rompen de forma parcial o completa, la RM se puede agravar al causar un prolapso parcial o completo de las valvas hacia el AI, conocido como flail valve4.
En las etapas iniciales de la enfermedad, las cuales pueden durar varios años, los pacientes no presentan signos clínicos. Como la EDVM suele afectar a perros de raza pequeña y edad avanzada, los pacientes pueden presentar episodios de tos debido a otros problemas respiratorios como colapso traqueobronquial o bronquitis crónica5. Los pacientes con ICC descompensada de forma aguda suelen estar más inactivos y pueden presentar diversos grados de inapetencia y/o caquexia cardíaca en diferentes grados. Otros pacientes se muestran intranquilos por las noches y prefieren tumbarse en posición esternal. Un signo clínico comúnmente observado es el aumento de la frecuencia respiratoria en reposo o durante el sueño (FRR), con resultados superiores a 30 respiraciones por minuto (rpm). También pueden ser audibles ruidos respiratorios anormales como sibilancias y/o estertores. En casos más severos, algunos pacientes pueden llegar incluso a presentar episodios ocasionales de síncopes.
Como se ha comentado previamente, la EDVM se clasifica en diferentes fases o estadios según el consenso ACVIM: A, B1/B2, C y D6. La fase A agrupa a aquellos pacientes que presentan predisposición racial a EDVM, pero no presentan un trastorno estructural cardíaco identificable2. La fase B hace referencia a los perros asintomáticos que presentan ruidos sistólicos auscultables (etapas tempranas) y/o murmullos sistólicos. A su vez, esta fase puede dividirse en una fase B1, atribuida a perros que presentan evidencia de RM leve (murmullo cardíaco y signos ecocardiográficos de regurgitación) pero sin cardiomegalia asociada; y fase B2, agrupando a los perros asintomáticos que presentan RM hemodinámicamente significativa con cardiomegalia asociada. Los criterios de inclusión en esta fase B2 son: murmullo de grado >3/6, relación ecocardiográfica entre el AI y la raíz aórtica (ratio LA/Ao) (vista de eje corto paraesternal derecha en diástole temprana) > 1.67, diámetro interno del VI en diástole normalizado para el peso corporal (LVIDdN) > 1.76, y un valor del vertebral heart score (VHS) > 10.5 cuerpos vertebrales8. En el estadio C se incluye a aquellos pacientes con signos clínicos previos o actuales de ICC asociada a enfermedad cardíaca estructural. La gravedad de los signos clínicos de ICC puede variar de leve a severa, siendo los casos más graves aquellos que requieren una terapia más agresiva. Por último, la etapa D se reserva a aquellos pacientes en fase terminal que presentan signos clínicos de ICC refractarios al tratamiento. Estos pacientes requieren estrategias de tratamiento avanzadas o especializadas para mantenerse clínicamente estables.
Caso clínico
Kira es una hembra de CKCS esterilizada, de 11 años de edad, que fue diagnosticada de EDVM hace 5 años. Por aquel entonces, la paciente mostraba un soplo sistólico izquierdo leve de 2/6, y su examen ecocardiográfico mostraba una RM moderada con una velocidad de 5.07 m/s, pero sin cambios a nivel del AI, por lo que su clasificación fue de EDVM en fase B1. La paciente se mantuvo asintomática durante cuatro años, realizándose estudios ecocardiográficos seriados de forma anual. Hace un año, en una de sus revisiones ecocardiográficas, se evidenció un aumento severo del AI, con un valor de ratio LA/Ao de 1.88 y una RM mantenida a una velocidad de 5.46 m/s. Además, el LVIDdN aumentó a un valor de 2.0. En ese momento, se produjo el avance de la EDVM de la fase B1 a B2 y se instauró un tratamiento con pimobendan a dosis de 0.3 mg/kg/12 h. La paciente se mantuvo estable en esta fase con el tratamiento pautado durante 6 meses, hasta su siguiente revisión ecocardiográfica. Además, en ese momento se realizó una revisión de la función renal, mostrando valores de creatinina de 0.7 mg/dl y una ratio creatinina/proteínas en orina (UPC) de < 0.20. También se realizó un estudio radiográfico de tórax que sirviera como referencia de la evolución de la enfermedad, así como de los cambios cardíacos originados de forma secundaria. Ya en ese momento, Kira presentaba un VHS de 11.7v y un considerable aumento de la silueta del AI, con un valor de vertebral left atrial size (VLAS) de 3.3v (valor de referencia < 2.3v)9 y de radiographic left atrial dimension(RLAD) de 3.2v (valor de referencia < 1.8v)10. Todos estos valores radiográficos eran indicativos de cardiomegalia y dilatación marcada del AI, acorde a lo observado en el estudio ecocardiográfico (Figuras 1 y 2).
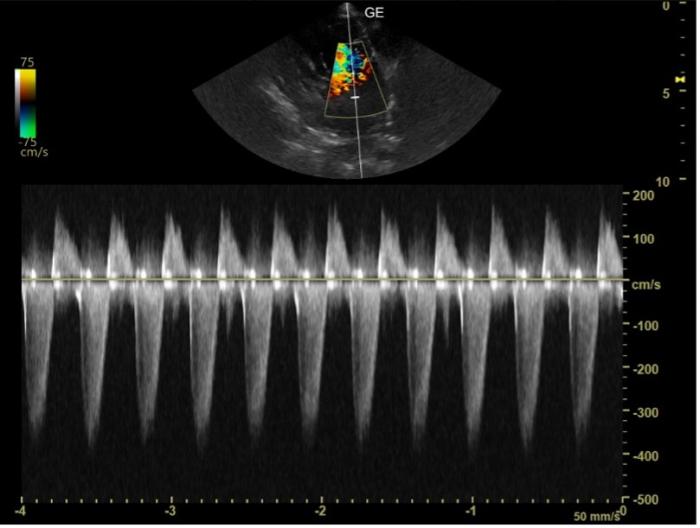
Figura 1. Imagen ecográfica obtenida mediante una proyección paraesternal izquierda apical de cuatro cámaras optimizada para la visualización del anillo mitral. Mediante el Doppler continuo (CW) se puede obtener la velocidad máxima de regurgitación a nivel de la válvula mitral (RM).
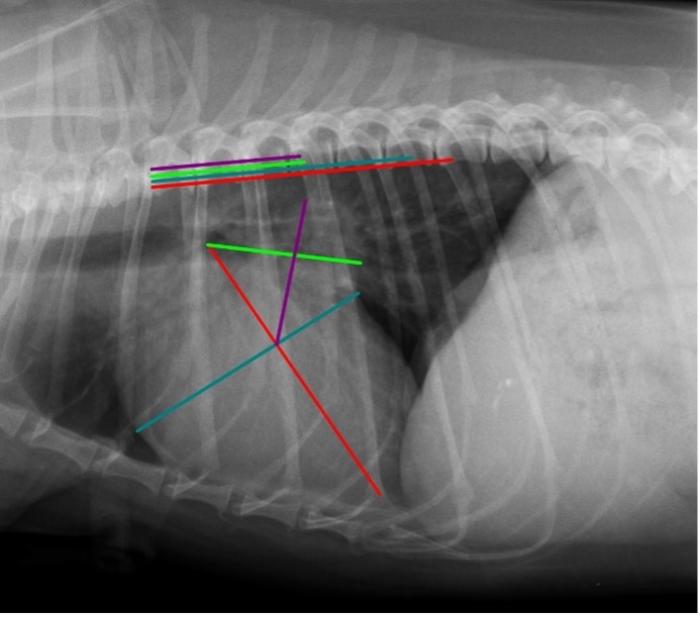
Figura 2. Proyección radiográfica lateral derecha de tórax de Kira (estadio B2 de EDVM). Las líneas roja y azul representan los ejes largo y corto del VHS, obtenido como en la publicación original (Buchanan y Bücheler 1995). La línea verde representa la VLAS, trazándose una línea desde el aspecto ventral de la carina hasta el borde más caudal del AI en el punto de intersección con el borde dorsal de la vena cava caudal (VCC). La línea morada es la RLAD, trazándose la bisectriz desde la intersección entre el eje largo y el eje corto del VHS hasta el borde dorsal del atrio izquierdo. Posteriormente, estas medidas se transponen, de forma paralela a la columna, al inicio del cuerpo vertebral de la cuarta vertebra torácica (T4), y se cuantifica el número de cuerpos vertebrales que ocupa la suma de los ejes del VHS y el número de cuerpos vertebrales que ocupa la RLAD y la VLAS. Se obtuvieron los siguientes valores: VHS 11.7v, VLAS 3.3v y RLAD 3.2v, indicando cardiomegalia y dilatación marcada del AI.
Se descartaron otros problemas concomitantes como hipertensión arterial sistémica o hipotiroidismo y se recomendó la siguiente revisión ecocardiográfica a los 6 meses. Se pudo reevaluar a la paciente 10 meses después. En ese momento, el animal presentaba signos de ICC como tos, inapetencia e intolerancia al ejercicio, letargia y episodios transitorios de disnea. Además, los tutores registraron en las últimas semanas aumentos de la FRR alcanzando valores superiores a 50 rpm. Se realizó un estudio radiográfico de tórax detectándose un empeoramiento de la cardiomegalia (Figura 3) con un valor de VHS de 13.1v y valores de VLAS y RLAD indicativos de aumento severo del atrio izquierdo (3.7v y 4.2v respectivamente).
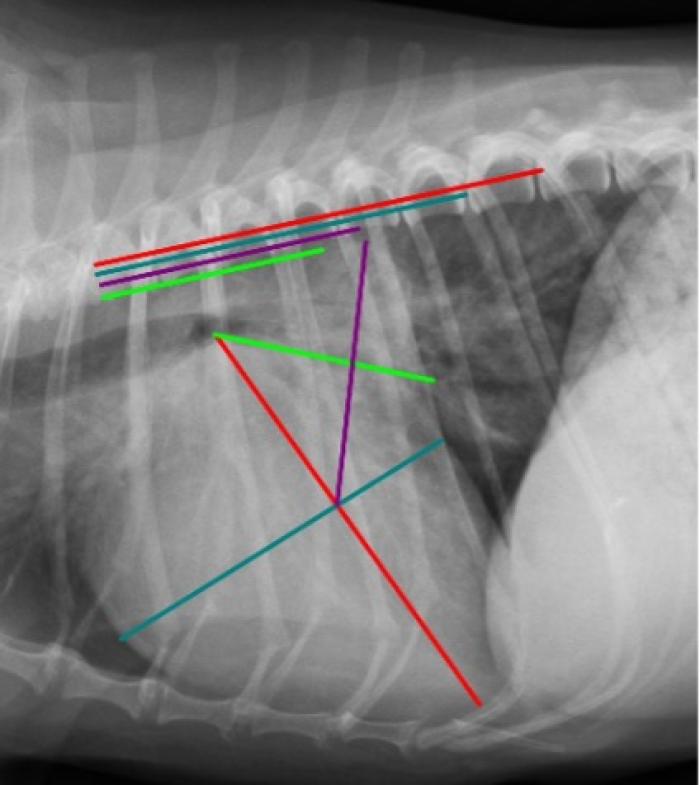
Figura 3. Proyección radiográfica lateral derecha de tórax obtenida 10 meses después de la Figura 1. Se observa el aumento de los valores de VHS, VLAS y RLAD (13.1v, 3.7v y 4.2v, respectivamente). También se observa patrón pulmonar intersticial no estructurado localizado en la región perihiliar y patrón vascular, ambos confirmando el diagnóstico de ICC.
También se identificó patrón pulmonar intersticial no estructurado, de localización perihiliar, sugestivo de edema pulmonar cardiogénico y patrón vascular, confirmando el diagnóstico de ICC. El estudio electrocardiográfico mostró valores dentro de la normalidad, sin observarse arritmias. Posteriormente, se llevó a cabo un estudio ecocardiográfico, para reevaluar el estado hemodinámico de la paciente, en el que se puso de manifiesto un empeoramiento severo de la insuficiencia mitral con un valor de ratio LA/Ao de 2.34. Por otro lado, el valor de volumen diastólico final indexado (EDVI) fue de 110.89 ml/m2, siendo compatible con una sobrecarga de volumen en el VI4. Otras medidas de la función diastólica como la relación E/A mitral, la velocidad de onda E a nivel mitral de 1.61 m/s y una relación E/e’ de 15.23 sugerían una disfunción diastólica moderada, con un patrón de llenado diastólico pseudonormal. Los indicadores de función sistólica, sin embargo, arrojaron valores dentro de la normalidad. También se detectó una regurgitación a nivel de la válvula tricúspide (RT), con un valor de velocidad máxima de 3.10 m/s y un gradiente de presión máxima (PGmáx) de 38.94 mmHg, compatible con hipertensión pulmonar moderada11. En este momento la EDVM de Kira pasó de una fase B2 a C según el consenso ACVIM 2019, y se decidió añadir al tratamiento ya pautado: furosemida a dosis de 2 mg/kg/12 h, benazeprilo a dosis de 0.25 mg/kg/12 h y espironolactona a dosis de 2 mg/kg/24 h.
El benazeprilo ayudo a reducir la poscarga y, la furosemida y la espironolactona permitieron aumentar la diuresis de la paciente mejorando los signos clínicos asociados al edema pulmonar. En la siguiente revisión, dos semanas después, los tutores comentaron que no habían observado poliuria/polidipsia (PU/PD) ni signos de incontinencia urinaria durante el tratamiento. Kira se encontraba más animada, con mayor tolerancia al ejercicio y más apetito. Se realizó un estudio radiográfico de tórax de control para valorar la evolución del parénquima pulmonar tras la instauración del tratamiento: se pudo comprobar que el edema perihiliar se había resuelto por completo y el patrón vascular había mejorado notablemente. La monitorización de la función renal arrojó valores dentro de la normalidad. Se propuso una revisión ecocardiográfica, analítica y radiográfica en 3 meses.
Tras haber transcurrido solo dos meses, Kira acudió de nuevo a la consulta presentando distrés respiratorio leve-moderado (picos de 35-40 rpm en reposo), letargia y apatía. En la exploración clínica, la paciente se mostraba alerta, con una frecuencia respiratoria dentro de la normalidad (28 rpm), mucosas rosadas y un tiempo de relleno capilar (TRC) < 2 s. A la auscultación, se identificaron ruidos pulmonares anómalos, en la región perihiliar de ambos hemitórax, compatibles con crepitaciones. En este momento, el soplo asociado a la RM era de grado 5/6, holosistólico izquierdo. En el estudio de hematología y bioquímica, Kira presentaba azotemia con valores de creatinina de 2.6 mg/dl y de BUN de 108 mg/dl. Además, el valor de SDMA también estaba elevado (28 µg/dl). A su vez, Kira presentaba hiponatremia e hipocloremia leves y una ligera hiperfosfatemia sin afectación de los niveles sanguíneos de calcio. Se realizó de nuevo un estudio radiográfico de tórax, observándose un patrón pulmonar intersticial no estructurado de distribución perihiliar indicativo de edema pulmonar cardiogénico (Figuras 4-6).
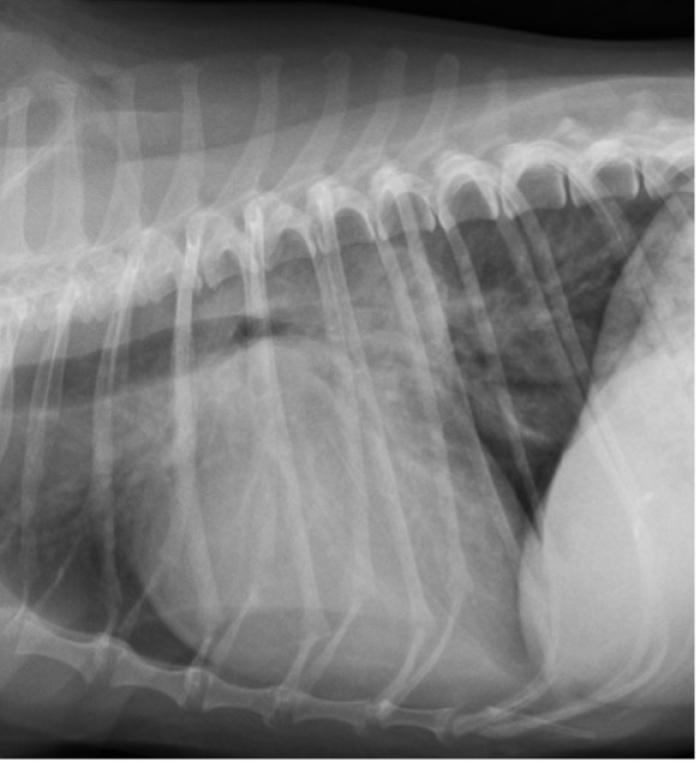
Figura 4. Proyección radiográfica lateral derecha de tórax donde se observa la progresión del patrón pulmonar intersticial no estructurado tras dos semanas de tratamiento con furosemida y su empeoramiento tras dos meses de tratamiento. Esta imagen fue obtenida al inicio de los signos clínicos de ICC (misma imagen que Figura 3).
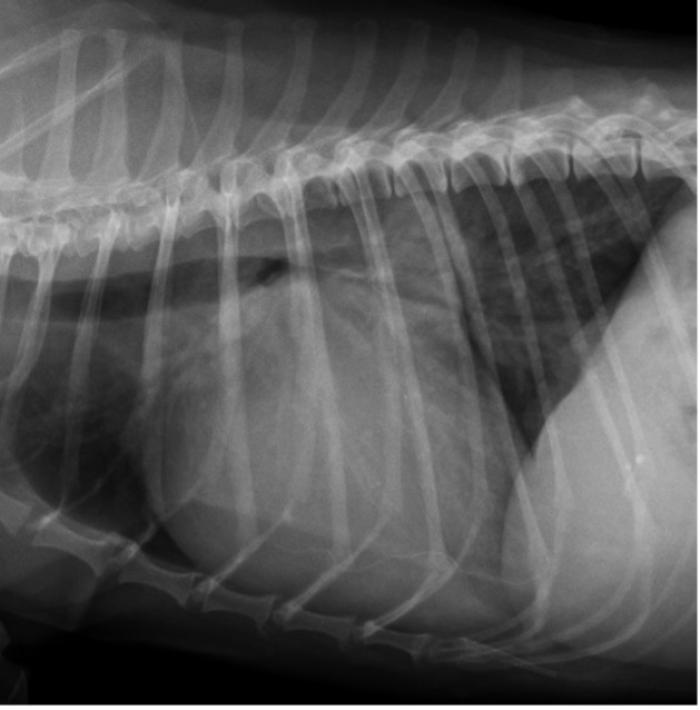
Figura 5. Proyección radiográfica lateral derecha de tórax del mismo caso que la Figura 4, que muestra la mejora tanto del edema pulmonar como del patrón vascular después de instaurar el tratamiento.
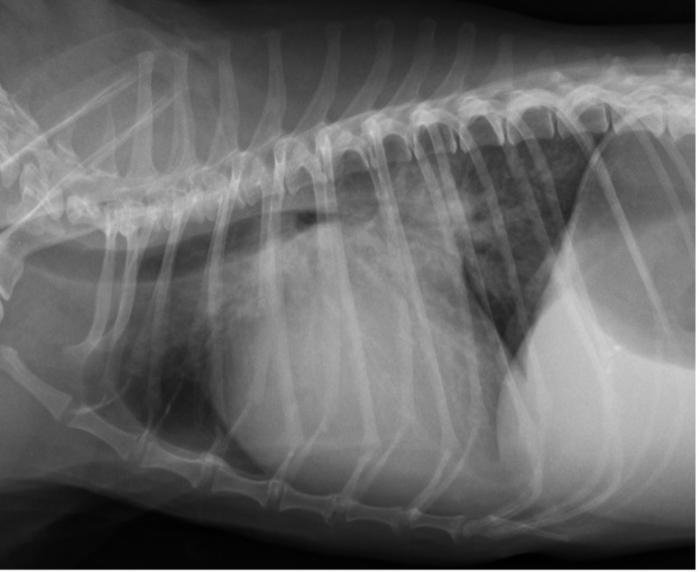
Figura 6. Proyección radiográfica lateral derecha de tórax del mismo caso que la Figura 4, obtenida dos meses después, donde se observa el empeoramiento del patrón intersticial perihiliar.
Se repitió también el estudio ecocardiográfico, en el cual se evidenció un empeoramiento severo de la remodelación cardíaca de la paciente con un valor de ratio LA/Ao de 2.86 (Figura 7), afectación de la funcionalidad sistólica del corazón izquierdo (valor de EVDI 134.92 ml/m2 y ESVI de 35.04 ml/m2) y de la funcionalidad diastólica (ratio E/A mitral de 1.24 y ratio E/e’ de 21.94, correspondientes a un patrón pseudonormal de relajación diastólica).
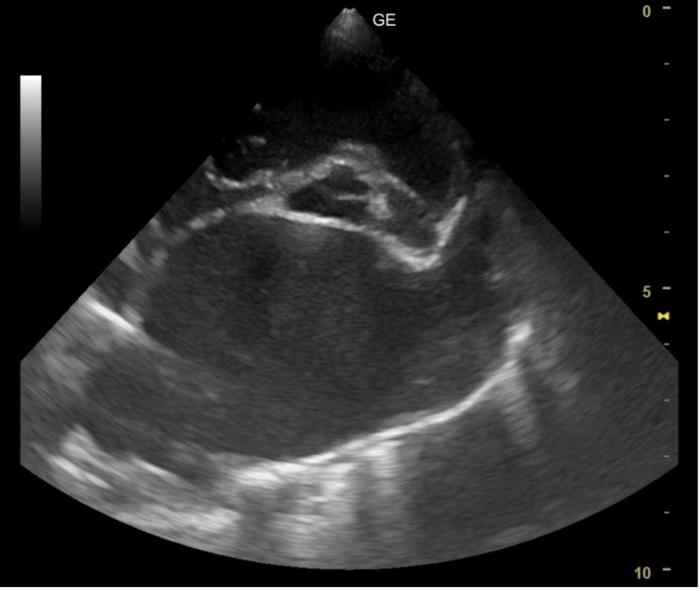
Figura 7. Imagen ecográfica obtenida mediante una proyección paraesternal derecha en eje corto a nivel de la base cardíaca en la que puede visualizarse una marcada dilatación del AI.
Se evidenció una dilatación del VI y un compromiso en su funcionalidad secundario a la sobrecarga de volumen por insuficiencia mitral y dilatación severa del AI. Además, se puso de manifiesto una rotura parcial de una cuerda tendinosa de la valva septal mitral, pudiendo visualizarse el prolapso de la porción anular hacia el AI durante la sístole, agravando de esta manera la RM (Vídeo 1).
Vídeo 1. Estudio ecocardiográfico obtenido mediante una proyección paraesternal derecha en eje largo de cuatro cámaras en el que se evidenció una dilatación del VI y un compromiso en su funcionalidad secundario a la sobrecarga de volumen por insuficiencia mitral y dilatación severa del AI. Además, se puso de manifiesto una rotura parcial de una cuerda tendinosa de la valva septal mitral, pudiendo visualizarse el prolapso de la porción anular hacia el AI durante la sístole (flecha verde), agravando de esta manera la RM.
En este momento, se decidió hospitalizar a Kira para intentar reducir la azotemia y compensar los electrolitos afectados. Inicialmente se asoció la azotemia al tratamiento diurético y a la cronicidad de su patología valvular. La hiponatremia y la hipocloremia siguieron empeorando (123.8 mmol/l y 84.7 mmol/l, respectivamente). Con el fin de descartar otras causas de azotemia, se realizó una ecografía abdominal, identificándose alteraciones de la pelvis renal izquierda compatibles con pielonefritis, congestión venosa hepática y una moderada cantidad de líquido libre abdominal. Se obtuvo una muestra de orina por cistocentesis para su cultivo microbiológico y se analizó de forma cuantitativa y cualitativa, observándose hematuria marcada, proteinuria moderada y la presencia de células polimorfonucleadas (PMN) y bacterias cocoides intracelulares. Con tal de conocer la causa primaria de la congestión hepática y la ascitis, se realizó de nuevo un examen ecocardiográfico, en el que, además de los cambios estructurales y hemodinámicos ya comentados, se observó la formación de un defecto del septo interatrial a nivel de la fosa oval, que permitía un flujo prevalentemente sistólico de velocidad moderada (4.1 m/s). Este fenómeno, conocido como septotomía espontánea del foramen oval, se desarrolló secundariamente a las elevadas presiones en el atrio izquierdo y actuaba como un mecanismo compensatorio, aliviando parcialmente dicha presión a expensas de sobrecargar las cámaras derechas del corazón. Como consecuencia de este desvío de flujo y la hipertensión pulmonar preexistente, Kira desarrolló signos clínicos de insuficiencia cardíaca derecha, incluyendo congestión hepática y una moderada cantidad de líquido libre abdominal (Figuras 8 y 9).
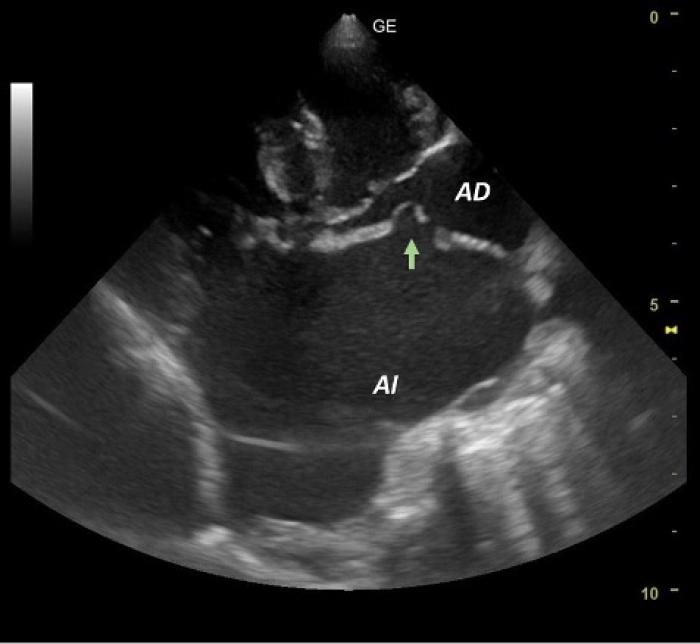
Figura 8. Imagen ecográfica obtenida mediante una proyección paraesternal derecha en eje largo de cuatro cámaras donde puede visualizarse un defecto en el septo interatrial a nivel del foramen oval de 6.4 mm (flecha verde).
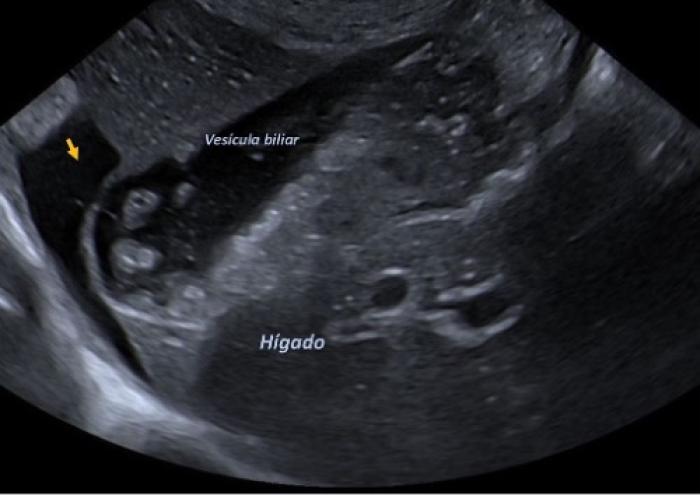
Figura 9. Imagen ecográfica abdominal donde puede visualizarse el parénquima hepático, la vesícula biliar (con concreciones biliares en su interior), y la presencia de líquido libre adyacente (flecha amarilla).
Estos hallazgos se sumaron a las complicaciones sistémicas, como una posible pielonefritis en el riñón izquierdo y alteraciones metabólicas. El tratamiento inicial tuvo como objetivo controlar simultáneamente la insuficiencia cardíaca congestiva, aliviar la sobrecarga atrial izquierda y manejar las complicaciones renales. Se administró furosemida intravenosa en bolos de 2 mg/kg/6 h, pimobendan a 0.3 mg/kg/8 h VO para mejorar la contractilidad cardíaca, y amlodipino a 0.1 mg/kg/12 h con el fin de reducir la poscarga y el volumen en el atrio izquierdo. Además, se utilizó espironolactona a 2 mg/kg/12 h VO y benazeprilo a 0.3 mg/kg/24 h VO para optimizar la función cardíaca y controlar las presiones vasculares. La pielonefritis se trató con marbofloxacino intravenoso a 3 mg/kg/24 h. La analgesia se logró mediante paracetamol (1 ml de suspensión oral a 100 mg/ml/8 h) y metamizol (0.4 ml de suspensión oral a 500 mg/ml/8 h).
Durante la hospitalización, la mejoría clínica fue evidente. Se observó una reducción progresiva de la creatinina (de 2.6 mg/dl a 1.81 mg/dl), la resolución parcial del edema pulmonar y estabilización del volumen urinario. El paso de furosemida IV a oral dosis de 2 mg/kg/8 h no generó buenos resultados en el control del edema pulmonar, por lo que fue sustituida por torasemida a 2 mg/12 h VO. También se ajustaron las dosis de amlodipino, incrementándolo a 0.15 mg/kg/12 h. El manejo médico permitió una estabilización hemodinámica con disminución del líquido abdominal y mejoría de la congestión hepática, aunque el defecto del septo interatrial permaneció funcional.
En el momento del alta médica, se instauró el siguiente tratamiento: torasemida a 2 mg/12 h VO, pimobendan a 0.3 mg/kg/8 h, amlodipino a 0.15 mg/kg/12 h, espironolactona a 2 mg/kg/12 h y benazeprilo a 0.3 mg/kg/24 h. Adicionalmente, se continuó con amoxicilina/ácido clavulánico a 12.5 mg/kg/12 h hasta la obtención de los resultados del cultivo urinario, los cuales fueron negativos. Actualmente, Kira presenta unos niveles medios de creatinina de 1.7 mg/dl, no presenta distrés respiratorio ni tos, su tolerancia al ejercicio ha mejorado, presentando apetito y un nivel de actividad normal.
Discusión
La EDVM es una de las principales causas de ICC en perros de razas pequeñas, especialmente en el CKCS12. En este caso, Kira evolucionó de un estadio B1 a B2 en un lapso de 4 años, momento en que comenzó su tratamiento con pimobendan. En solo 10 meses, desarrolló signos de ICC, clasificándose como estadio C, pasando a una fase avanzada en tan solo 2 meses, momento en que consiguieron controlarse los signos de ICC. La transición desde la etapa asintomática hasta la insuficiencia cardíaca descompensada resalta la naturaleza progresiva de esta patología y las complicaciones asociadas en fases terminales13.
En primer lugar, fue fundamental obtener una buena historia clínica y realizar una exploración física completa con el fin de determinar que la paciente con EDVM presentaba signos compatibles con ICC. Típicamente los perros con EDVM en fase C presentan signos clínicos de ICC izquierda, como taquipnea, inquietud, dificultad respiratoria y/o tos. Este era el caso de Kira, que acudió a consulta en diferentes momentos presentando taquipnea y/o tos. De acuerdo con el consenso ACVIM, el diagnóstico de EDVM debe basarse en una combinación de auscultación cardíaca, radiología torácica y ecocardiografía. En el caso de Kira, el ecocardiograma reveló una dilatación significativa del atrio izquierdo (ratio LA/Ao: 2.86) y RM severa, compatibles con estadios C/D. En pacientes con EDVM en fases tempranas, se pueden observar ondas E de baja velocidad antes de la instauración de tratamientos médicos4. Sin embargo, en la mayoría de los animales en estadios C y D se observan ondas de llenado ventricular rápido de alta velocidad, como fue el caso de Kira, que presentaba una onda E mitral de 2.2 m/s (valores de normalidad de 0.6-1 m/s)14. Además, en este caso, la ruptura parcial de una cuerda tendinosa de la válvula mitral exacerbó la regurgitación, un evento crítico que contribuyó a la rápida descompensación clínica observada15. Cabe destacar que, aunque no es el método diagnóstico de elección, la radiología torácica nos permitió valorar la progresión de la cardiomegalia. Los valores de VHS, VLAS y RLAD fueron aumentando conforme empeoraba el estado clínico de la paciente. Por otro lado, la radiología torácica fue fundamental durante todo el proceso diagnóstico y de monitorización para confirmar o descartar la presencia de edema pulmonar. Sin embargo, la ecocardiografía es la técnica de elección para el diagnóstico y obtención de toda la información hemodinámica relacionada con la cardiopatía de la paciente.
La septotomía espontánea del foramen oval, condición rara en EDVM avanzada, es una comunicación interatrial secundaria a la elevación de la presión atrial izquierda que permitió una descarga parcial hacia el atrio derecho, pero a expensas de sobrecargar el lado derecho y contribuir al desarrollo de congestión sistémica, manifestada como ascitis y hepatomegalia.
En cuanto al tratamiento, el primer punto a tener en cuenta es la elección del fármaco diurético y su pauta de administración. En el caso de Kira, la administración de furosemida a una dosis de 2 mg/kg/12 h VO ofreció un tiempo relativamente corto de estabilidad con respecto a los síntomas de ICC (apenas 2 meses). Esto pudo deberse a una disminución de la perfusión renal por hipovolemia o bajo gasto cardíaco, lo cual puede limitar la cantidad de fármaco efectivo que llega al lecho vascular. Por otro lado, la presencia de insuficiencia renal por daño renal y azotemia, como era el caso de Kira, puede originar una respuesta diurética más limitada13. Así mismo, la sobrecarga de volumen en el atrio izquierdo que presentaba la paciente y la progresión tan avanzada de la enfermedad mitral llegaron a exceder la capacidad diurética de la furosemida. Por último, es importante destacar que en situaciones de hipocloremia, típico en pacientes con insuficiencia cardíaca, se puede reducir la eficacia del diurético al alterar la retroalimentación tubuloglomerular16. En este caso, la estrategia más exitosa para estabilizar los signos de ICC fue el cambio de diurético de asa por torasemida, la cual presenta una acción diurética más prolongada y consistente que la furosemida17,18.
Otro punto crítico del tratamiento de la paciente fue la inclusión de un vasodilatador sistémico como el amlodipino para la estabilización y el control de los síntomas de ICC. La administración de amlodipino reduce el volumen de RM en perros con EDVM ya que reduce la poscarga19. En el caso de Kira, con una dilatación tan severa del AI (ratio LA/Ao de 2.87), la poscarga pulmonar se vio severamente aumentada por el aumento de presión atrial secundario a la RM. En este caso, parte del volumen sistólico es eyectado de vuelta hacia la AI durante la sístole. Esto significa que la resistencia real que enfrenta el VI para eyectar sangre hacia la aorta se reduce, porque una fracción significativa del trabajo ventricular se pierde en la regurgitación20. En última instancia, la RM severa provoca una sobrecarga de volumen en el ventrículo izquierdo, que debe manejar tanto el retorno venoso normal como el volumen regurgitado. Esto puede llevar a una mayor tensión de la pared ventricular, lo que, a su vez, contribuye a un aumento de la poscarga. En este caso, la administración de un vasodilatador como el amlodipino redujo la resistencia vascular sistémica y mejoró el flujo hemodinámico21.
En cuanto al uso combinado de un IECA (en este caso benazeprilo) y espironolactona, está documentado que es superior a la utilización única de benazeprilo en casos de ICC secundaria a EDVM22. Siguiendo las indicaciones del consenso ACVIM, se añadieron ambos fármacos con el objetivo de reducir la precarga, la poscarga y la remodelación cardíaca23-25. Su inclusión fue fundamental en la estabilización de Kira.
Por último, varios ensayos clínicos han demostrado que el pimobendan está indicado como tratamiento de primera línea junto con un diurético de asa en perros con ICC causada por EDVM26. En el caso de Kira, con afectación importante de la función sistólica, el aumento en la dosificación de pimobendan a 0.3 mg/kg/8 h se realizó con la intención de beneficiarnos de su efecto ionotrópico positivo, favoreciendo la contracción del miocardio, siendo fundamental en su estabilización clínica.
La progresión a estadio C avanzado de la EDVM marca un pronóstico reservado, con un riesgo elevado de descompensación y complicaciones adicionales. En el caso de Kira, la resolución parcial de la ascitis y la estabilización de la función renal tras el ajuste terapéutico ilustran la importancia de un manejo individualizado y dinámico de cada paciente. Aun así, algunos aspectos que podrían haberse mejorado pasan sobre todo por una evaluación periódica más estricta, lo cual habría permitido ajustar el tratamiento antes de que se produjeran complicaciones severas, como la ICC y posterior ruptura de la cuerda tendinosa o la formación del defecto septal interatrial. Por último, la medición periódica de NT-proBNP podría haber proporcionado información adicional sobre el estrés miocárdico y la carga cardíaca, permitiendo identificar episodios subclínicos de insuficiencia cardíaca27-29.
Además del tratamiento médico, hay un extenso número de antecedentes de pacientes con EDVM en diferentes fases que han sido intervenidos mediante cirugía reparativa de la VM con éxito, mejorando así su pronóstico, calidad y esperanza de vida30,31.
En conclusión, este caso detalla la complejidad, no solo de diagnosticar adecuadamente a los pacientes con EDVM en fases avanzadas (C y D) y sus complicaciones clínicas asociadas, si no que resalta también la importancia de seguir las recomendaciones del consenso ACVIM para optimizar el tratamiento de pacientes con EDVM en fases avanzadas. La combinación de terapias dirigidas permitió una estabilización clínica temporal en Kira, destacando la necesidad de un manejo integral e interdisciplinario en estas situaciones desafiantes. Por último, es fundamental resaltar que tanto el diagnóstico, como la monitorización y el tratamiento de este tipo de pacientes requiere una colaboración estrecha con los tutores. Seguir las pautas de medicación instauradas por el clínico, así como realizar los controles clínicos, radiográficos y ecocardiográficos estipulados, es una de las claves para el diagnóstico precoz y la esperanza de vida de los pacientes con EDVM.
Bibliografía
1. Bussadori C. Textbook of Cardiovascular medicine in dogs and cats. 2023.
2. Lewis T, Swift S, Woolliams JA, Blott S. Heritability of premature mitral valve disease in Cavalier King Charles spaniels. The Veterinary Journal[Internet]. abril de 2011;188(1):73-6. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1090023310000778
3. Ettinger SJ, Feldman EC, Côté E. Textbook of veterinary internal medicine: diseases of the dog and the cat. Eight. Vol. 2. 2017.
4. Kim Y, Choi G, Park C. Rate of left ventricular pressure change by Doppler echocardiography in dogs with chronic mitral valve disease at different stages of congestive heart failure. Veterinary Radiology & Ultrasound [Internet]. 5 de noviembre de 2018;59(6):758-66. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/vru.12664
5. Ferasin L, Crews L, Biller DS, Lamb KE, Borgarelli M. Risk Factors for Coughing in Dogs with Naturally Acquired Myxomatous Mitral Valve Disease. J Vet Intern Med. 9 de marzo de 2013;27(2):286-92.
6. Keene BW, Atkins CE, Bonagura JD, Fox PR, Häggström J, Fuentes VL, etal. ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. J Vet Intern Med [Internet]. 11 de mayo de 2019;33(3):1127-40. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/jvim.15488
7. Hansson K, Häggström J, Kvart C, Lord P. Left atrial to aortic root indices using two‐dimensional and m‐mode echocardiography in cavalier king charles spaniels with and without left atrial enlargement. Veterinary Radiology & Ultrasound [Internet]. 19 de noviembre de 2002;43(6):568-75. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1740-8261.2002.tb01051.x
8. Buchanan JW. Vertebral scale system to measure heart size in radiographs. Vet Clin North Am Small Anim Pract [Internet]. marzo de 2000;30(2):379-93, vii. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/10768239
9. Malcolm EL, Visser LC, Phillips KL, Johnson LR. Diagnostic value of vertebral left atrial size as determined from thoracic radiographs for assessment of left atrial size in dogs with myxomatous mitral valve disease. J Am Vet Med Assoc [Internet]. 15 de octubre de 2018;253(8):1038-45. Disponible en: https://avmajournals.avma.org/view/journals/javma/253/8/javma.253.8.1038.xml
10. Sánchez Salguero X, Prandi D, Llabrés-Díaz F, Manzanilla EG, Bussadori C. A radiographic measurement of left atrial size in dogs. Ir Vet J [Internet]. 17 de diciembre de 2018;71(1):25. Disponible en: https://irishvetjournal.biomedcentral.com/articles/10.1186/s13620-018-0137-x
11. Eriksson A, Hansson K, Häggström J, Järvinen AK, Lord P. Pulmonary Blood Volume in Mitral Regurgitation in Cavalier King Charles Spaniels. J Vet Intern Med [Internet]. noviembre de 2010;24(6):1393-9. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1939-1676.2010.0619.x
12. Beardow AW, Buchanan JW. Chronic mitral valve disease in cavalier King Charles spaniels: 95 cases (1987-1991). J Am Vet Med Assoc [Internet]. 1 de octubre de 1993;203(7):1023-9. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/8135932
13. Giorgi ME, Mochel JP, Yuan L, Adin DB, Ward JL. Retrospective evaluation of risk factors for development of kidney injury after parenteral furosemide treatment of left‐sided congestive heart failure in dogs. J Vet Intern Med [Internet]. 18 de noviembre de 2022;36(6):2042-52. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/jvim.16571
14. Höllmer M, Willesen JL, Tolver A, Koch J. Left atrial volume and function in dogs with naturally occurring myxomatous mitral valve disease. Journal of Veterinary Cardiology [Internet]. febrero de 2017;19(1):24-34. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1760273416300790
15. Serres F, Chetboul V, Tissier R, Sampedrano CC, Gouni V, Nicolle AP, etal. Chordae tendineae rupture in dogs with degenerative mitral valve disease: prevalence, survival, and prognostic factors (114 cases, 2001-2006). J Vet Intern Med. 2007;21(2):258-64.
16. Oyama MA, Adin D. Toward quantification of loop diuretic responsiveness for congestive heart failure. J Vet Intern Med [Internet]. 21 de enero de 2023;37(1):12-21. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/jvim.16590
17. Chetboul V, Pouchelon J ‐L., Menard J, Blanc J, Desquilbet L, Petit A, etal. Short‐Term Efficacy and Safety of Torasemide and Furosemide in 366 Dogs with Degenerative Mitral Valve Disease: The TEST Study. J Vet Intern Med [Internet]. 4 de noviembre de 2017;31(6):1629-42. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/jvim.14841
18. Besche B, Blondel T, Guillot E, Garelli‐Paar C, Oyama MA. Efficacy of oral torasemide in dogs with degenerative mitral valve disease and new onset congestive heart failure: The CARPODIEM study. J Vet Intern Med [Internet]. 7 de septiembre de 2020;34(5):1746-58. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/jvim.15864
19. Park SY, Oh W, Lee S. Amlodipine decreases mitral regurgitation volume in dogs over 7 days: A study of 24 dogs with myxomatous mitral valve degeneration. Vet Rec Open [Internet]. 5 de diciembre de 2022;9(1). Disponible en: https://bvajournals.onlinelibrary.wiley.com/doi/10.1002/vro2.33
20. Atkins Ce, Rausch Wp, Gardner Sy, Defrancesco Tc, Keene Bw, Levine Jf. The effect of amlodipine and the combination of amlodipine and enalapril on the renin‐angiotensin‐aldosterone system in the dog. J Vet Pharmacol Ther [Internet]. 17 de octubre de 2007;30(5):394-400. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1365-2885.2007.00894.x
21. Suzuki S, Fukushima R, Ishikawa T, Yamamoto Y, Hamabe L, Kim S, etal. Comparative effects of amlodipine and benazepril on Left Atrial Pressure in Dogs with experimentally-induced Mitral Valve Regurgitation. BMC Vet Res [Internet]. 18 de diciembre de 2012;8(1):166. Disponible en: https://bmcvetres.biomedcentral.com/articles/10.1186/1746-6148-8-166
22. Coffman M, Guillot E, Blondel T, Garelli‐Paar C, Feng S, Heartsill S, etal. Clinical efficacy of a benazepril and spironolactone combination in dogs with congestive heart failure due to myxomatous mitral valve disease: The BEnazepril Spironolactone STudy (BESST). J Vet Intern Med[Internet]. 24 de julio de 2021;35(4):1673-87. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/jvim.16155
23. Bernay F, Bland JM, Häggström J, Baduel L, Combes B, Lopez A, etal. Efficacy of Spironolactone on Survival in Dogs with Naturally Occurring Mitral Regurgitation Caused by Myxomatous Mitral Valve Disease. J Vet Intern Med [Internet]. marzo de 2010;24(2):331-41. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1939-1676.2009.0467.x
24. Boswood A, Häggström J, Gordon SG, Wess G, Stepien RL, Oyama MA, etal. Effect of Pimobendan in Dogs with Preclinical Myxomatous Mitral Valve Disease and Cardiomegaly: The EPIC Study-A Randomized Clinical Trial. J Vet Intern Med [Internet]. noviembre de 2016;30(6):1765-79. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/27678080
25. Borgarelli M, Ferasin L, Lamb K, Bussadori C, Chiavegato D, D’Agnolo G, etal. DELay of Appearance of sYmptoms of Canine Degenerative Mitral Valve Disease Treated with Spironolactone and Benazepril: the DELAY Study. Journal of Veterinary Cardiology [Internet]. febrero de 2020;27:34-53. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1760273419301560
26. Häggström J, Boswood A, O’Grady M, Jöns O, Smith S, Swift S, etal. Effect of Pimobendan or Benazepril Hydrochloride on Survival Times in Dogs with Congestive Heart Failure Caused by Naturally Occurring Myxomatous Mitral Valve Disease: The QUEST Study. J Vet Intern Med[Internet]. 25 de septiembre de 2008;22(5):1124-35. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1939-1676.2008.0150.x
27. Hezzell MJ, Boswood A, Chang Y ‐M., Moonarmart W, Souttar K, Elliott J. The Combined Prognostic Potential of Serum High‐Sensitivity Cardiac Troponin I and N‐Terminal pro‐B‐Type Natriuretic Peptide Concentrations in Dogs with Degenerative Mitral Valve Disease. J Vet Intern Med [Internet]. 28 de marzo de 2012;26(2):302-11. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1939-1676.2012.00894.x
28. Ljungvall I, Höglund K, Tidholm A, Olsen LH, Borgarelli M, Venge P, etal. Cardiac Troponin I Is Associated with Severity of Myxomatous Mitral Valve Disease, Age, and C‐Reactive Protein in Dogs. J Vet Intern Med [Internet]. 4 de enero de 2010;24(1):153-9. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1939-1676.2009.0428.x
29. Eriksson AS, Häggström J, Pedersen HD, Hansson K, Järvinen AK, Haukka J, etal. Increased NT-proANP predicts risk of congestive heart failure in Cavalier King Charles spaniels with mitral regurgitation caused by myxomatous valve disease. Journal of Veterinary Cardiology [Internet]. septiembre de 2014;16(3):141-54. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S1760273414000447
30. Mizuno T, Mizukoshi T, Uechi M. Long‐term outcome in dogs undergoing mitral valve repair with suture annuloplasty and chordae tendinae replacement. Journal of Small Animal Practice [Internet]. 12 de febrero de 2013;54(2):104-7. Disponible en: https://onlinelibrary.wiley.com/doi/10.1111/j.1748-5827.2012.01305.x
31. Uechi M, Mizukoshi T, Mizuno T, Mizuno M, Harada K, Ebisawa T, etal. Mitral valve repair under cardiopulmonary bypass in small-breed dogs: 48 cases (2006–2009). J Am Vet Med Assoc [Internet]. 15 de mayo de 2012;240(10):1194-201. Disponible en: https://avmajournals.avma.org/view/journals/javma/240/10/javma.240.10.1194.xml
 by Multimédica
by Multimédica
