Hemangiosarcoma cardíaco canino: manejo quirúrgico y quimioterapia adyuvante en un perro
Resumen breve
Presentamos un caso complejo de un perro con hemangiosarcoma en aurícula derecha y bazo, y carcinoma hepatocelular, que fue manejado mediante la resección quirúrgica de todos los tumores y quimioterapia adyuvante. A pesar de la gravedad del diagnóstico, el perro logró una supervivencia de 279 días y mantuvo una buena calidad de vida.Índice de contenidos
Resumen
El hemangiosarcoma (HSA) es un tumor maligno que surge del endotelio vascular o de las células precursoras endoteliales. El HSA es el tumor cardíaco más frecuente en el perro, y el corazón representa la segunda localización anatómica más común para este tipo de tumor después del bazo. En la mayoría de los casos, los HSA cardíacos primarios se localizan en el atrio derecho (AD) o en la aurícula derecha (AuD). Se trata de un tumor altamente maligno y en el momento del diagnóstico generalmente ya ha hecho metástasis, por lo que el pronóstico es extremadamente malo. El tratamiento de elección implica la resección quirúrgica del tumor, siempre que sea posible, junto con un protocolo de quimioterapia que puede incluir la doxorrubicina como agente único o en combinación con otros fármacos.
Presentamos un caso complejo de un perro con hemangiosarcoma en aurícula derecha y bazo, y carcinoma hepatocelular, que fue manejado mediante la resección quirúrgica de todos los tumores y quimioterapia adyuvante. A pesar de la gravedad del diagnóstico, el perro logró una supervivencia de 279 días y mantuvo una buena calidad de vida.
Introducción
El hemangiosarcoma (HSA) es un tumor maligno agresivo que surge del endotelio vascular o de las células precursoras endoteliales. Históricamente, se ha considerado que el HSA se origina en el endotelio vascular, sin embargo, cada vez hay más pruebas de que estos tumores pueden originarse en un progenitor pluripotente de la médula ósea. Estas células pueden residir en el endotelio vascular y posteriormente sufrir una transformación neoplásica o, alternativamente, pueden migrar a sitios de la vasculatura después de la transformación neoplásica1.
Los HSA primarios pueden desarrollarse en cualquier sitio vascularizado del cuerpo, pero los lugares de origen más frecuentes incluyen el bazo, el atrio y la aurícula derechos, tejidos subcutáneos y el hígado. El HSA es un tumor localmente invasivo de rápido crecimiento con alto potencial metastásico. Por lo general, las metástasis microscópicas se presentas a menudo en una etapa temprana de la enfermedad a través de la diseminación hematógena a otros órganos o la diseminación directa del tumor intracavitario después de la rotura del tumor, siendo los pulmones el sitio más frecuentemente afectado2.
Los tumores cardíacos ocurren con poca frecuencia en los perros, con una incidencia general del 0.19 %, según una encuesta de la base de datos. No obstante, el HSA cardíaco (HSAc) es el tipo más común de tumor cardíaco que afecta a los perros, representando el 69 % de todos los tumores cardíacos identificados según el tipo histológico. Su incidencia es aproximadamente 10 veces mayor que la del segundo tumor cardíaco más común, el tumor del cuerpo aórtico3. Al igual que la presentación esplénica, los Golden retriever, los Labrador retriever y los Pastor alemán suelen estar sobrerrepresentados en los informes de HSAc4. En la mayoría de los casos, los HSAc primarios se localizan en el atrio derecho (AD) o en el apéndice auricular derecho -aurícula derecha- (AuD), pero ocasionalmente el tumor puede surgir en las cámaras cardíacas izquierdas3,5.
Los HSA atriales o auriculares puede presentarse como un tumor solitario o concurrente con una masa esplénica. Existe una asociación bien documentada de HSA concurrente del atrio / aurícula derecha y la esplénica en perros, y se ha reportado que esta asociación ocurre en hasta el 25 % de los perros con HSA1,6.
Los signos de HSAc suelen estar relacionados con derrame pericárdico, taponamiento cardíaco y signos de insuficiencia cardíaca derecha, que incluyen letargo, colapso, distensión abdominal, intolerancia al ejercicio y disnea y tos7. La ecocardiografía es muy útil para identificar masas cardíacas en pacientes en los que hay derrame pericárdico y sospecha de HSAc2, mostrando una alta sensibilidad (82 %) y especificidad (100 %)8.
El tratamiento del HSAc en perros puede incluir opciones médicas y quirúrgicas, aunque un diagnóstico de HASc generalmente indica un pobre pronóstico. En el momento del diagnóstico, el tumor generalmente ya ha hecho metástasis, lo que puede llevar a los propietarios a optar por un tratamiento paliativo, como la pericardiocentesis repetida con o sin quimioterapia adyuvante. La pericardiocentesis generalmente se asocia con una mejoría clínica marcada, pero los signos clínicos de taponamiento cardíaco generalmente reaparecen a los pocos días. Los enfoques más agresivos para el tratamiento de la HSA cardíaca incluyen varias combinaciones de pericardiectomía, resección tumoral y quimioterapia7.
El enfoque terapéutico multimodal que combina la extirpación quirúrgica del tumor primario con quimioterapia basada en doxorrubicina está claramente indicado para el tratamiento HASc cardíaco canino9. Sin embargo, en el caso de tumores cardíacos inoperables, las opciones de quimioterapia sistémica que incluyen ciclofosfamida, doxorrubicina sola o terapias combinadas basadas en doxorrubicina se justifican como una alternativa razonable, aunque la eficacia puede ser limitada cuando la enfermedad es grave4.
Caso clínico
Nico es un Cócker macho no castrado de 9 años y 10 meses y 14.6 kg de peso, que fue consultado en su centro veterinario tras un período de inapetencia y apatía de 2 días. En ese momento, se constató una elevación de alanina aminotransferasa (ALT) 1306 U/L (IR: 10-125), creatinina 2.2 mg/dl (IR: 0.5 - 1.8) y leucocitosis 22.82 K/µl (IR: 5.05 - 16.76) con neutrofilia. Se realizó una ecografía de urgencia del tórax y el abdomen, donde se identificó un derrame pericárdico además de la presencia de una masa hepática. El derrame pericárdico fue drenado mediante pericardiocentesis, obteniendo 200 ml de líquido hemorrágico (Hct 38 %). Se instauró un manejo temporal con un protector hepático y se derivó a nuestro hospital para posteriores estudios.
A su llegada a nuestro centro, el animal se presentó estable, activo y alerta. La exploración física mostró una adecuada condición física, con una temperatura rectal de 38.5 ºC, mucosas rosáceas y un tiempo de relleno capilar menor de 2 segundos. La auscultación pulmonar fue normal. Durante la auscultación cardíaca, se percibió un ritmo sinusal regular con una frecuencia de 90 latidos por minuto, sin soplos y con sonidos cardíacos normales. El pulso femoral era fuerte y sincrónico. La palpación abdominal no reveló dolor. El resto de la exploración física no mostró alteraciones relevantes.
Se realizó una analítica sanguínea en la que se destacó una elevación significativa de los niveles de enzimas hepáticos: ALT 1420 U/L (IR: 10 - 125 U/L) y fosfatasa alcalina (ALKP) 413 U/L (IR: 23 - 212 U/L), mientras que el resto de los parámetros bioquímicos se encontraban dentro de la normalidad. El hemograma mostró un hematocrito del 40.9 % (IR: 37.3 - 61.7 %), y los valores de la serie blanca y plaquetas estaban dentro de la normalidad. Solo cabe destacar una muy discreta disminución del volumen corpuscular medio (60 fL, IR: 61.6 - 73.5 fL) y de la hemoglobina reticulocitaria (20.2 pg, IR: 22.3 - 29.6 pg).
La radiografía torácica realizada no reveló hallazgos significativos. La ecocardiografía, efectuada 15 días después del procedimiento de drenaje pericárdico, tampoco mostró anormalidades. Las dimensiones de las cámaras y paredes cardíacas se encontraban dentro de los parámetros normales, la funcionalidad miocárdica era adecuada y no se detectaron alteraciones valvulares ni estructurales. Además, no se observaron restos del derrame pericárdico anterior, ni indicios de masas en la base del corazón, asociadas al atrio derecho o a otras estructuras cardíacas que pudieran haber causado el derrame previo (Figura 1).
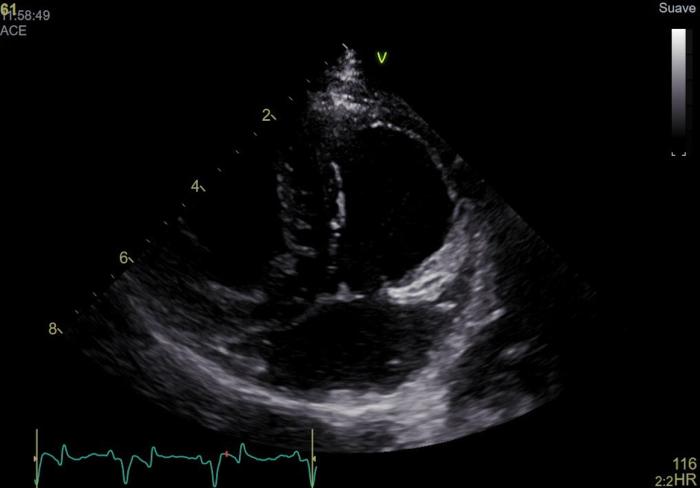
Figura 1. Ventana paraesternal izquierda vista craneal optimizado para la visualización de atrio y aurícula derecha, en la que no se aprecia ninguna masa asociada ni alteraciones estructurales visibles.
El electrocardiograma constató un ritmo sinusal regular, 90 lpm. Desviación de eje cardiaco hacia derecha (-130º), sin agrandamiento de ventrículo derecho visible en ecocardiografía y radiografía torácica, compatible con bloqueo de rama derecha (Figura 2).
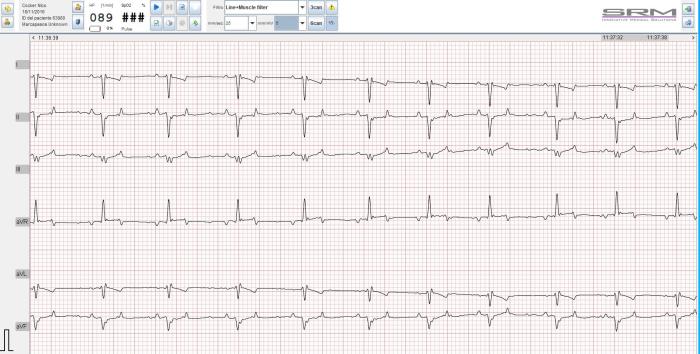
Figura 2. Electrocardiograma en el que se muestra desvío de eje cardíaco hacia derecha (patrón S1, S2, s3) compatible con bloqueo de rama derecha (ausencia de agrandamiento de ventrículo derecho en ecocardiografía ni radiografía torácica).
La ecografía abdominal mostró la presencia de una masa levemente hiperecogénica en el lóbulo hepático medio izquierdo, con un tamaño aproximado de 4.6 x 4 x 4.3 cm (DV x LL x CrCd) (Figura 3).
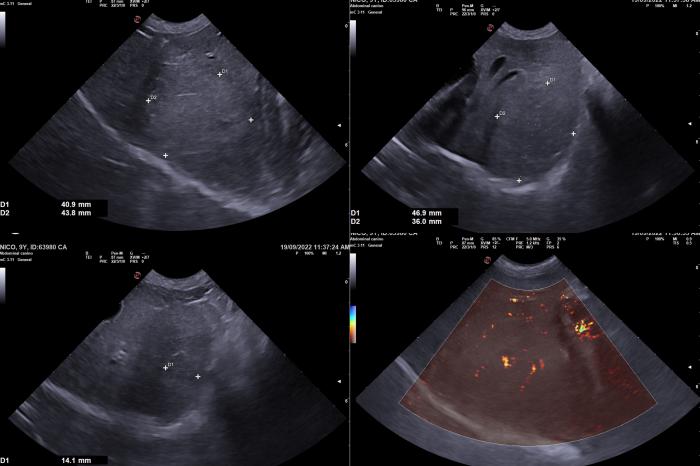
Figura 3. Ecografía hepática donde se identifica una masa levemente hiperecogénica en el lóbulo hepático medio izquierdo, 4.6 x 4 x 4.3 cm (DV x LL x CrCd). En su interior presentaba un área hipoecogénica de márgenes irregulares de 1.4 cm de diámetro. El patrón Doppler no presentaba signos de neovascularización y no se observa efusión peritoneal periférica.
Esta masa presentaba un área hipoecogénica de márgenes irregulares, pero bien definidos, de 1.4 cm de diámetro. No se apreció presencia de efusión peritoneal periférica. El patrón Doppler no presentó signos de neovascularización. El resto de la ecografía abdominal no reveló alteraciones significativas.
El estudio de tomografía computarizada bicavitario, realizado para la planificación quirúrgica, mostró los siguientes hallazgos : una masa hepática hipoatenuada de 10 cm en el lóbulo lateral izquierdo, con captación leve y heterogénea en fase de contraste y posible afectación del lóbulo medial; un nódulo hipoatenuado de 2 cm en la cabeza del bazo con realce periférico; ausencia de linfadenopatía hepática y abdominal y ausencia de masas en la base cardíaca o patrones pulmonares destacables que pudieran sugerir presencia de metástasis (Figura 4).
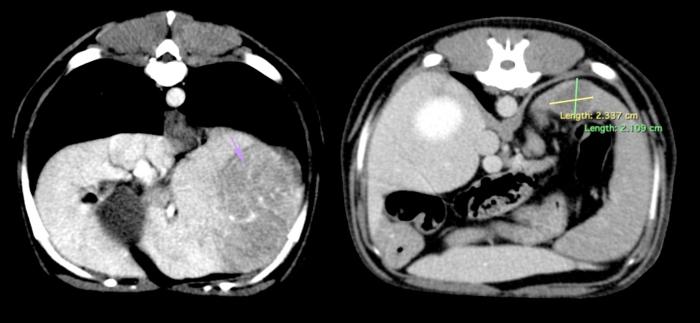
Figura 4. Estudio tomográfico del abdomen. Presencia de masa hepática localizada en lóbulo lateral izquierdo. Nódulo (hipoatenuado e hipocaptante) en la cabeza del bazo, con leve realce periférico.
El resultado del aspirado con aguja fina de la lesión hepática indicó una alta probabilidad de carcinoma hepatocelular (Figura 5).
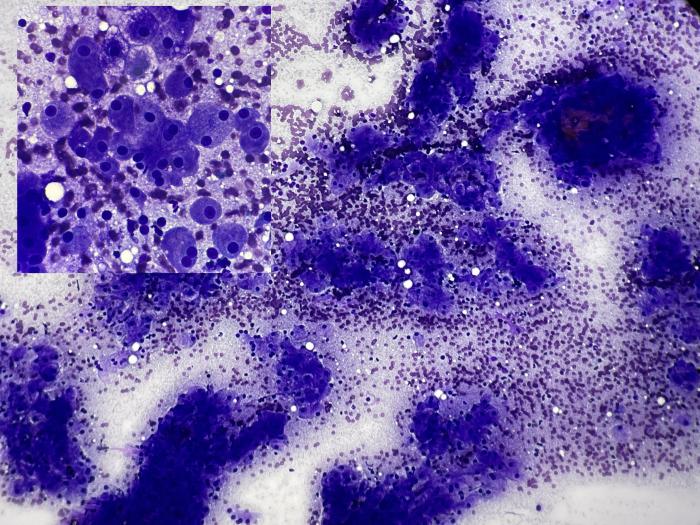
Figura 5. La muestra es altamente celular y está compuesta por una mezcla de hepatocitos bien diferenciados (núcleos redondeados y basofílicos, con nucléolos evidentes y citoplasma amplio, finamente granular y frecuentemente con un aspecto apolillado), junto con hepatocitos con citoplasma amplio y redondeado, mostrando binucleación frecuente. Estas características, en el contexto de una masa hepática, sugieren la presencia de un carcinoma hepatocelular bien diferenciado.
Por otro lado, el aspirado del bazo evidenció una marcada hemodilución, por lo que se consideró como muestra no diagnóstica.
Se propuso resección quirúrgica de la masa hepática y esplenectomía que fue realizada en la semana siguiente con evolución posquirúrgica satisfactoria.
El estudio histopatológico de las muestras remitidas confirmó la presencia de un carcinoma hepatocelular de células claras y un hemangiosarcoma esplénico.
Después de analizar los resultados obtenidos, se estableció el siguiente juicio clínico y se formuló una propuesta terapéutica. Respecto al carcinoma hepatocelular, se determinó que la cirugía podría ser curativa o, al menos, ofrecer largos períodos de supervivencia en una considerable proporción de casos. Por tanto, se decidió que el enfoque principal del tratamiento debería dirigirse al hemangiosarcoma. Inicialmente, se propuso un protocolo de quimioterapia adyuvante sistémica con doxorrubicina siguiendo la pauta de 30 mg/m2 intravenoso cada tres semanas, durante cinco dosis. Se reservaron otras opciones terapéuticas, como ciclofosfamida, clorambucilo, firocoxib y / o propanolol, en función de la evolución y la respuesta al tratamiento.
Quince días después de la intervención quirúrgica, se programó el inicio del protocolo de quimioterapia. Los análisis de sangre revelaron una disminución en los niveles de enzimas hepáticos desde la operación, con una alanina aminotransferasa de 466 U/l y una fosfatasa alcalina de 298 U/l, mientras que el resto de los parámetros se mantenían dentro de los rangos normales. En la ecocardiografía de control realizada, se detectó una masa adherida a la aurícula del atrio derecho, con dimensiones aproximadas de 2 x 2 cm (Figura 6).
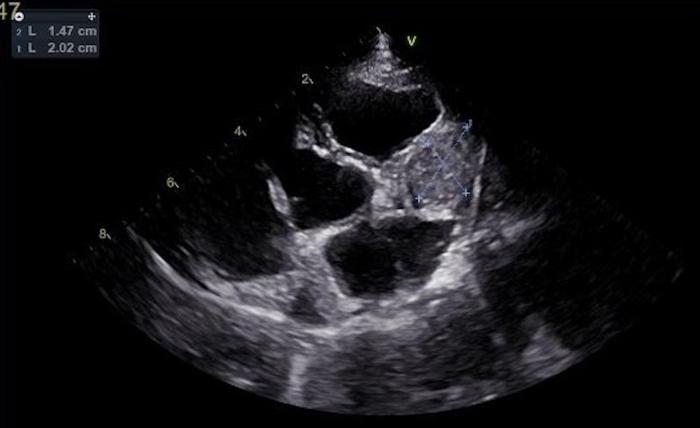
Figura 6. Ecocardiografía realizada dos semanas después de la esplenectomía. Se detectó una masa adherida a la aurícula derecha.
Teniendo en cuenta el historial clínico del paciente y la ubicación de la masa, se estableció un diagnóstico presuntivo de hemangiosarcoma cardíaco. Desde la perspectiva quirúrgica, la masa parecía estar aislada y confinada a la aurícula derecha, lo que sugería que podría ser resecable.
Se administró la primera dosis de doxorrubicina y se programó la intervención quirúrgica. De forma simultánea, se implementaron medidas preventivas en el domicilio del paciente para mitigar el riesgo de gastroenterocolitis, una posible reacción adversa a la doxorrubicina. Estas medidas incluyeron la administración oral de maropitant durante los cinco días siguientes al tratamiento con doxorrubicina, así como el uso de probióticos y la administración puntual de loperamida ante episodios de diarreas acuosas.
Dos semanas después del comienzo de la quimioterapia, se efectuó una toracotomía lateral para extirpar la aurícula derecha que contenía la masa, utilizando una grapadora quirúrgica lineal y asegurando un margen limpio de al menos 1 cm (Figuras 7 y 8).
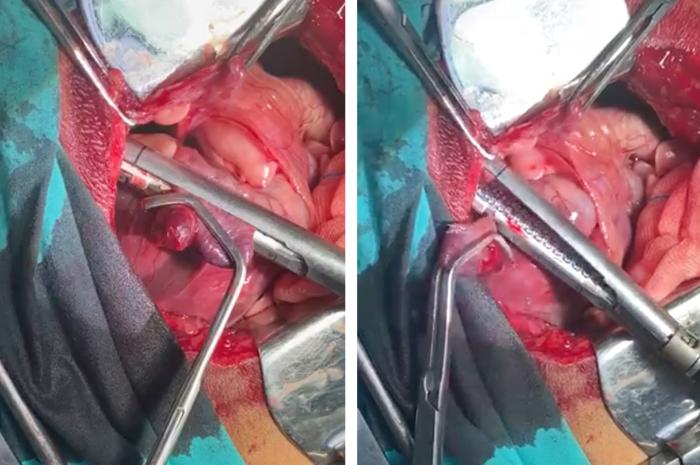
Figura 7. Imagen en la que se muestra el abordaje quirúrgico y la resección de la aurícula derecha que contenía la masa, utilizando una grapadora quirúrgica lineal y asegurando un margen limpio de al menos 1 cm.
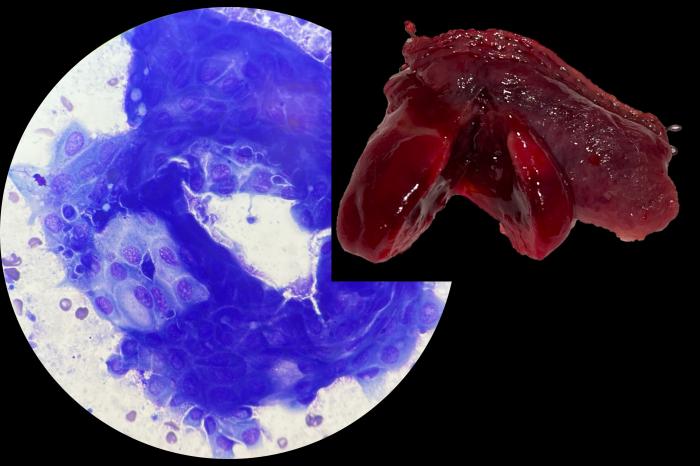
Figura 8. Detalle del tumor resecado y citología tomada mediante impronta.
Adicionalmente, se llevó a cabo una pericardiectomía subtotal. La recuperación posquirúrgica del paciente fue favorable y recibió el alta hospitalaria a las 48 horas, con un tratamiento de manejo antibiótico (cefalexina a 25 mg/kg/12 h) y tratamiento antiinflamatorio (firocoxib a 4 mg/kg/24 h). El estudio anatomopatológico de la masa auricular confirmó el diagnóstico de hemangiosarcoma.
Quince días después de la cirugía, se administró el segundo ciclo de doxorrubicina. Este ciclo, al igual que todos los administrados, fue bien tolerado por el paciente, con adecuados controles analíticos (hemograma y bioquímica sanguínea) que muestran además buena evolución de los parámetros hepáticos (ALT 232 U/l y ALKP 267 U/l). Posteriormente, se administraron dos ciclos más de doxorrubicina en intervalos de 21 días, sin incidencias destacables. Los controles ecográficos abdominales y ecocardiográficos no revelaron hallazgos significativos. Al concluir el cuarto ciclo de doxorrubicina, se inició una pauta de terapia metronómica coadyuvante que incluía firocoxib 57 mg/24 h oral y ciclofosfamida 10 - 15 mg/m2 (8 mg) oral cada 24 horas. Además, se comenzó la administración de propranolol 0.25 mg/kg/8 h, con la intención de incrementar la dosis cada dos semanas hasta alcanzar una pauta de mantenimiento de 1 mg/kg/8 h.
Una semana después de recibir la quinta y última dosis de doxorrubicina, se llevó a cabo una ecocardiografía de control. En ella, se detectó un nódulo de 1.91 x 2.1 cm en la pared del atrio izquierdo, que fue considerado como probable metástasis de hemangiosarcoma (Figura 9).
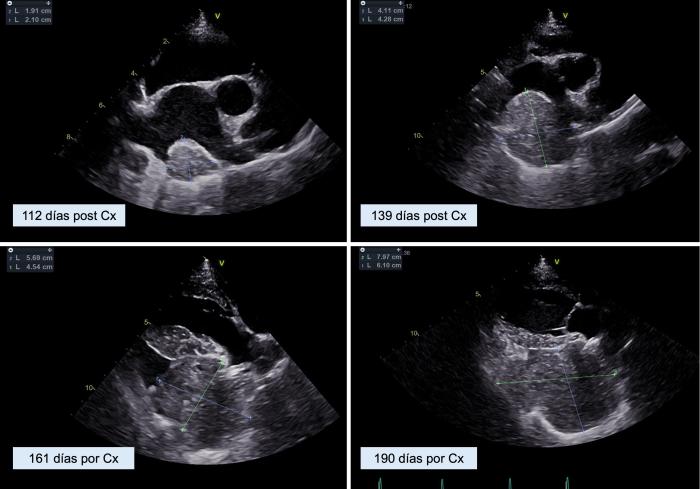
Figura 9. El seguimiento ecocardiográfico muestra un aumento progresivo del tamaño de la masa cardíaca en las sucesivas visitas de control.
Para corroborar este hallazgo, se realizó una radiografía torácica que mostró un aumento en el tamaño de la proyección lateral del atrio izquierdo, hallazgo que era más evidente en la vista dorsoventral y que coincidía con la posición de la masa identificada en la ecocardiografía. No se evidenciaron signos de metástasis pulmonar.
En ese momento, habían pasado seis meses desde el primer episodio de derrame pericárdico, casi cinco meses desde la primera intervención quirúrgica que incluyó una lobectomía hepática y esplenectomía, y cuatro meses desde la auriculectomía. Dada la situación, se descartó la posibilidad de realizar una nueva intervención quirúrgica. En su lugar, se optó por continuar con el tratamiento mediante la terapia metronómica, que incluía ciclofosfamida y firocoxib, junto con propranolol. Además, se añadió ácido tranexámico a una dosis de 10 - 20 mg/kg/12 h para controlar posibles episodios de sangrado.
Un mes después de la última revisión, el paciente se encontraba estable, activo y con apetito, aunque comenzó a experimentar episodios ocasionales de tos. En la ecocardiografía de seguimiento, se detectó un aumento significativo de la masa en la pared del atrio izquierdo, que ahora medía 4.1 x 4.2 cm (ver Figura 9). Este hallazgo se correspondía con un incremento en la densidad radiográfica de tejido blando sobre la silueta cardíaca, ventral a la carina, y con un leve efecto de masa sobre la bifurcación bronquial (Figura 10). No se encontraron evidencias de nódulos ni infiltrados pulmonares sugerentes de metastásis.
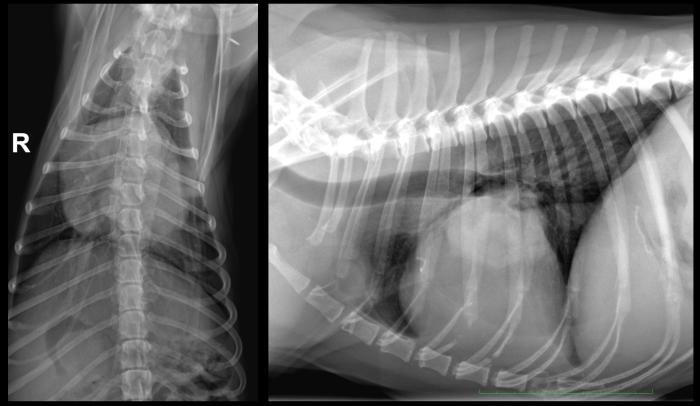
Figura 10. Radiografía torácica realizada en el día 112 tras resección de masa atrial: incremento de densidad sobre proyección silueta cardíaca, ventral a la carina, con densidad tejido blando. Leve efecto masa sobre bifurcación bronquial.
La ecografía abdominal mostró una masa hepática hiperecoica y heterogénea de 4 cm de diámetro en la región derecha hepática, que ejercía un leve efecto de masa sobre la vesícula biliar. Además, se observó otro nódulo similar, aunque de menor tamaño, de 1.5 cm, en una posición más medial (Figura 11).
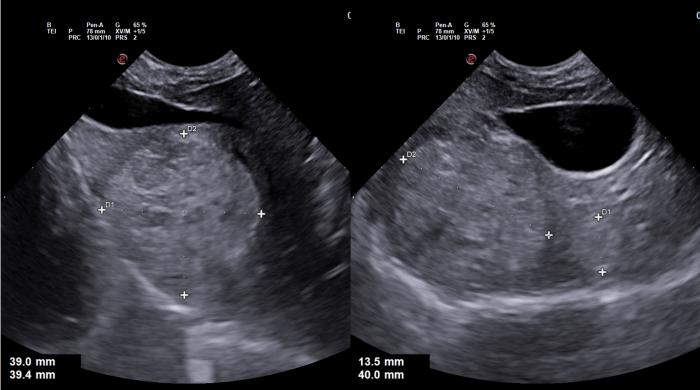
Figura 11. Ecografía abdominal que revela una masa hepática hiperecoica y heterogénea de 4 cm de diámetro en la región derecha del hígado. También se observa un nódulo similar, aunque más pequeño (1.5 cm), en una posición más medial.
Se decidió mantener el tratamiento previamente establecido, aunque se realizó un cambio en la medicación antiinflamatoria: el firocoxib fue sustituido por prednisona después de un período de lavado de 24 horas. La dosificación de prednisona se estableció en 1 mg/kg/24 h durante los primeros siete días, seguida de 0.5 mg/kg/24 h durante otros siete días, y finalmente, una dosis de mantenimiento de 0.5 mg/kg/48 h. Además, se incorporó toceranib al régimen terapéutico para el manejo de las masas hepáticas que fueron consideradas probables metástasis de naturaleza no confirmada (carcinoma vs hemangiosarcoma).
Tres semanas más tarde, durante una revisión debido a un leve deterioro caracterizado por apatía, inapetencia, nausea y un aumento en la frecuencia de la tos, se observó en la radiografía torácica una efusión pleural de moderada a grave en el hemitórax derecho (Figura 12).
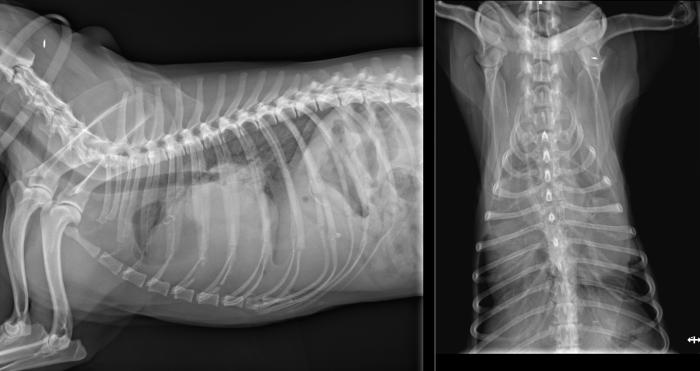
Figura 12. Radiografía tórax (161 días poscirugía): presencia de una efusión pleural moderada a grave en el hemitórax derecho, con un efecto de masa apreciable en la región dorsolateral derecha de la silueta cardíaca.
Esta efusión ejercía un efecto de masa notable en la región dorsolateral derecha de la silueta cardíaca. La ecocardiografía confirmó el crecimiento y la expansión de la masa cardíaca, que ahora medía 5.6 x 4.5 cm (ver Figura 9). A pesar de estos hallazgos, no se realizaron cambios en el tratamiento oncológico, pero se administró maropitant a una dosis de 2 mg/kg/24 h durante cinco días para controlar los síntomas digestivos.
Se llevó a cabo una revisión mensual, en la que se indicó que el paciente se encontraba estable, con buen ánimo y apetito, aunque con períodos cortos de inapetencia y apatía. La exploración física no reveló alteraciones notables. No obstante, la ecocardiografía mostró un aumento en el tamaño de la masa cardíaca, la cual ahora aparecía duplicada y creciendo en ambos lados de los atrios izquierdo y derecho (ver Figura 9). Como parte del tratamiento, se suspendió el uso de toceranib y se programó una disminución gradual de propanolol hasta su completa retirada, manteniendo el régimen previamente establecido de ciclofosfamida, ácido tranexámico y prednisona.
Dos semanas después de la última revisión, Nico había sufrido un episodio nocturno de disnea severa y se presentó en consulta en estado estuporoso con mucosas pálidas, pulso débil y una temperatura rectal de 36 ºC. La radiografía confirmó un derrame pleural severo y, de acuerdo con la voluntad del propietario, se procedió a la eutanasia del paciente.
El manejo clínico de este caso aquí presentado, que combinó cirugía con un régimen de quimioterapia, permitió extender su supervivencia durante 9 meses desde el primer episodio de derrame pericárdico, 8 meses desde la primera intervención quirúrgica (lobectomía hepática y esplenectomía) y 7 meses desde la auriculectomía, manteniendo una buena calidad de vida hasta su fallecimiento. El compromiso y dedicación del propietario, así como la confianza depositada en el equipo médico, jugaron un papel fundamental en la notable calidad de vida y supervivencia que Nico disfrutó durante su enfermedad (Figura 13).

Figura 13. En la imagen podemos ver a Nico en una de sus visitas, intentando atraer la atención de su propietario.
Discusión
La causa más común de derrame pericárdico en perros son las neoplasias o los derrames idiopáticos. Los dos lugares más comunes donde se localizan neoplasias en perros con derrame pericárdico son el atrio-aurícula derecha y la base del corazón (Vídeo1).
Vídeo 1. La ecocardiografía es el método preferido para la evaluación inicial de masas cardíacas debido a su alta sensibilidad, disponibilidad, resolución y fácil acceso en la práctica veterinaria. Al identificar una masa cardíaca, el primer paso es determinar su localización y luego analizar cómo las masas afectan las estructuras cardíacas adyacentes y su impacto en la función cardíaca. En estas secuencias podemos ver a la izquierda la localización a nivel de atrio derecho, sugerente de HSA, y a la derecha una masa en base cardíaca. En ambos casos se presentan como masas no pediculadas de fijación amplia con características invasivas.
Cuando se identifica una masa que se origina en el atrio o la aurícula derecha, el HSA es, con mucho, el diagnóstico histopatológico más común, aunque ocasionalmente se pueden identificar otras neoplasias10. De hecho, el HSA es el tumor cardíaco más frecuente en el perro, y el corazón representa la segunda localización anatómica más común para este tipo de tumor después del bazo4. Las masas de HSAc se localizan con mayor frecuencia (49 %) en la aurícula derecha (AuD) y el atrio derecho (AD) (41 %), aunque con menor frecuencia también pueden encontrarse en otras localizaciones cardíacas7.
El HSA es altamente maligno y la diseminación hematológica generalizada ocurre temprano en el curso de la enfermedad. Un estudio encontró enfermedad metastásica en 38 de 51 (75 %) perros con HSAc primario al realizar la necropsia. Los sitios afectados incluyeron los pulmones (33.87 %), el bazo (17.45 %), el hígado (16.42 %), otras partes del corazón, incluido el pericardio (8.21 %), el tejido subcutáneo (6.6 %), los riñones (5.13 %), el mesenterio (4.11 %), los intestinos (4.11 %), el epiplón (4.11 %), el cerebro (3.8 %), las glándulas suprarrenales (3.8 %), el peritoneo (2.5 %), los ganglios linfáticos viscerales (1.3 %) y el diafragma (1.3 %)7. Otro trabajo realizado en 107 perros con derrame pericárdico mostró que los sitios más comunes de metástasis en perros con HSAc fueron los pulmones (42.9 %), el bazo (28.6 %), el hígado (28.6 %) y los riñones (14.3 %)8.
Se ha documentado la asociación del HSA concurrente en el atrio-aurícula derecha y el bazo en perros, no obstante, la relación varía en función de donde se considera ubicado el tumor primario. Pacientes cuyo signo clínico inicial estaba asociado a un HSA esplénico, presentaron tasas de afectación del atrio-aurícula derecha que varía entre el 8.7 y el 25 %. Por otro lado, en perros que acudían al hospital por signos relacionados con un HSAc, la tasa de HSA esplénica concurrente es del 29 %. Curiosamente, el 42 % de estos perros presentaban metástasis no esplénicas en el momento de la presentación, por lo tanto, no está claro si estos pacientes tienen dos tumores primarios, o uno primario en el corazón y una lesión metastásica en el bazo5,6. La razón de la tasa más alta de concurrencia en ambos órganos (bazo y atrio-aurícula) cuando la afectación primaria se sospecha en el atrio-aurícula derecha es probablemente porque estos perros representan tanto casos de HSA del atrio-aurícula derecha que han hecho metástasis en el bazo por una vía hematógena como casos de enfermedad sincrónica. La tasa global de concurrencia, con independencia de si el tumor primario se ubica en bazo o en corazón, se situaría en torno al 25%, siendo la mayoría de estos casos HSA del atrio-aurícula derecha que presumiblemente hayan hecho metástasis en el bazo y otros sitios6.
La ecocardiografía es el medio más útil para identificar masas cardíacas en pacientes en los que hay derrame pericárdico y sospecha de HSAc2. Recientes estudios sugieren que esta técnica es mucho más eficaz para la detección de masas cardíacas de lo que se había considerado anteriormente. Los avances tecnológicos han dado lugar a una mejor resolución en escala de grises con la consiguiente mejora de la sensibilidad para la detección de masas al emplear instrumentación más moderna7. La sensibilidad y la especificidad de la ecocardiografía para la detección de una masa cardíaca en un estudio en perros con derrame pericárdico fueron del 80 % y el 100 %, respectivamente, y la ecocardiografía tuvo la misma sensibilidad y especificidad para distinguir las masas atriales/auriculares derechas de todas las demás causas (84 % y 100 %, respectivamente)8.
El diagnóstico preciso de una masa cardíaca y la definición de su ubicación pueden proporcionar información importante para la planificación terapéutica. En una serie de 51 casos de perros con HSAc primario, se detectó ecocardiográficamente una lesión sugestiva de masa cardíaca en 38 (75 %). La sensibilidad de la ecocardiografía bidimensional para la detección de una masa fue significativamente menor para los tumores de la AuD (60 %) que para las masas del AD (95 %) (Vídeo 2).
Vídeo 2. Secuencia de probable HSA en localización atrial derecha (imagen izquierda) y en localización auricular (derecha).
Por lo general, la AuD no se visualiza fácilmente en perros normales mediante técnicas ordinarias de imágenes de ultrasonido, lo que sugiere que los tumores relativamente pequeños en esta área pueden ser difíciles de detectar 7.
Otros estudios, sin embargo, minoran relativamente la capacidad de la ecografía para establecer un diagnóstico definitivo sobre las masas cardíacas, ya que, aunque la descripción ecocardiográfica de la localización de la masa cardíaca en la mayoría de los casos coincidía con la descripción patológica macroscópica de la ubicación de la masas (86 % de concordancia), el diagnóstico presuntivo solo coincidía con el diagnóstico definitivo en el 65 % de los casos. Y en particular, la presunción de que una masa auricular derecha representaba HSA solo fue correcta en el 50 %11.
El tratamiento para los HSAc en perros puede incluir opciones médicas y quirúrgicas, aunque un diagnóstico de HSA cardíaca generalmente indica un pronóstico extremadamente malo. En el momento del diagnóstico, el tumor generalmente ha hecho metástasis, lo que puede llevar a los propietarios a optar por un tratamiento paliativo, como la pericardiocentesis repetida con o sin quimioterapia adyuvante.
La escisión quirúrgica es el tratamiento de elección siempre que sea posible, pero solo será beneficiosa a corto plazo si se combina con quimioterapia sistémica adyuvante, ya que los pacientes invariablemente sucumben a la enfermedad metastásica. En 23 perros con HSAc, tratados quirúrgicamente mediante pericardiectomía y resección masiva, el tiempo de supervivencia medio (TMS) después de la cirugía sin quimioterapia osciló entre 43 y 46 días, mientras que el TMS fue de 164 días para los perros que también recibieron quimioterapia adyuvante9. Un estudio epidemiológico de 51 caninos con HSAc informó de un TMS significativamente más largo (189 días) para aquellos perros que recibieron quimioterapia adyuvante con doxorrubicina después de la pericardiectomía y resección tumoral en comparación con perros que habían sido operados, pero no recibieron quimioterapia adyuvante (86 días). En este estudio los perros con HSAc que no recibieron ningún tratamiento mostraron un TMS de 7 días7.
Los resultados de estos estudios sugieren que en los perros con HSA atrial / auricular la resección quirúrgica del tumor se asoció con una tasa baja de complicaciones y los problemas que surgieron generalmente fueron menores. Además, el uso de quimioterapia adyuvante después de la resección se relacionó con tiempos de supervivencia significativamente más largos, en comparación con la resección sola7,9.
La pericardiectomía es un procedimiento paliativo que puede proporcionar una supervivencia a largo plazo para los perros con tumores no vasculares de la base cardíaca, pero en el caso de los HSAc los tiempos de supervivencia se han quedado cortos y no se recomienda como procedimiento aislado en este tipo de tumores1.
En los casos de tumores cardíacos inoperables, o en aquellos pacientes para los que la cirugía es una opción desfavorable, se justifica la consideración de la terapia sistémica sola como una opción secundaria razonable. Un estudio comparó el resultado de 64 perros con un diagnóstico presuntivo de HSAc tratados con doxorrubicina (DOX) como agente único con una media de supervivencia de 116 días, que mejoró significativamente el tiempo medio de supervivencia de 12 días para los 76 perros de control no tratados4.
La doxorrubicina también se utilizó en un estudio sobre HSAc identificados mediante ecocardiografía en 16 perros, tratados solo con quimioterapia. En este estudio, se administró doxorrubicina sola o en combinación con otros agentes en un protocolo multiagente, logrando un tiempo medio de supervivencia de 139 días10.
La doxorrubicina es el agente quimioterapéutico más activo y ampliamente utilizado para el tratamiento de los HSAc. Como se ha comentado, se obtienen mejores resultados cuando se administra como adyuvante después de la resección quirúrgica del tumor, pero también se ha empleado en perros con masas cardíacas no resecables4,10.
En la literatura veterinaria se han descrito otros protocolos de quimioterapia para los HSA, aunque ningún protocolo se considera superior a otro siempre que se incluya doxorrubicina. La vincristina y la ciclofosfamida pueden administrarse juntas como protocolo de rescate para perros con HSA o junto con doxorrubicina (protocolo VAC) como parte del tratamiento de primera línea de los HSAc. La quimioterapia metronómica con ciclofosfamida en combinación con un fármaco antiinflamatorio no esteroideo es otra alternativa que puede administrarse después, simultáneamente o como alternativa a la doxorrubicina2.
El inhibidor de la tirosina quinasa (toceranib) no mostró efectividad en el tratamiento del HSA canino12. Sin embargo, si pueden ser de utilidad en el control del carcinoma hepatocelular13.
Datos emergentes sugieren que los angiosarcomas y hemangiosarcomas utilizan la señalización beta adrenérgica para impulsar su progresión, regulando el nicho de las células tumorales y ajustando las respuestas celulares dentro del microambiente tumoral. Estos hallazgos indican que la inhibición de la señalización beta adrenérgica podría servir como adyuvante en el manejo de estos tumores. El propranolol actúa como agente citostático, deteniendo el crecimiento de las células sin destruirlas, regulando las vías implicadas en la angiogénesis y provocando apoptosis de las células endoteliales. Además, cuando se combina con la doxorrubicina, puede potenciar los efectos del agente quimioterapéutico al aumentar las concentraciones del fármaco dentro de las células tumorales. Aunque se requieren más investigaciones, el uso de betabloqueantes podría proporcionar una terapia complementaria para los perros diagnosticados con ciertos tipos de hemangiosarcoma14.
Bibliografía
1. Griffin, M. A., Culp, W. T. N. & Rebhun, R. B. Canine and feline haemangiosarcoma. Veterinary Record 189, (2021).
2. Mullin, C. & Clifford, C. A. Histiocytic Sarcoma and Hemangiosarcoma Update. Veterinary Clinics of North America: Small Animal Practice 49, 855–879 (2019).
3. Ware, W. A. & Hopper, D. L. Cardiac Tumors in Dogs: 1982–1995. J Vet Intern Med 13, 95 (1999).
4. Mullin, C. M. et al. Doxorubicin chemotherapy for presumptive cardiac hemangiosarcoma in dogs †. Vet Comp Oncol 14, (2016).
5. Treggiari, E., Pedro, B., Dukes‐McEwan, J., Gelzer, A. R. & Blackwood, L. A descriptive review of cardiac tumours in dogs and cats. Vet Comp Oncol 15, 273–288 (2017).
6. Boston, S. E., Higginson, G. & Monteith, G. Concurrent Splenic and Right Atrial Mass at Presentation in Dogs with HSA: A Retrospective Study. J Am Anim Hosp Assoc 47, 336–341 (2011).
7. YAMAMOTO, S. et al. Epidemiological, Clinical and Pathological Features of Primary Cardiac Hemangiosarcoma in Dogs: A Review of 51 Cases. Journal of Veterinary Medical Science 75, 1433–1441 (2013).
8. MacDonald, K. A., Cagney, O. & Magne, M. L. Echocardiographic and clinicopathologic characterization of pericardial effusion in dogs: 107 cases (1985–2006). J Am Vet Med Assoc235, 1456–1461 (2009).
9. Weisse, C. et al. Survival times in dogs with right atrial hemangiosarcoma treated by means of surgical resection with or without adjuvant chemotherapy: 23 cases (1986–2000). J Am Vet Med Assoc 226, 575–579 (2005).
10. Ghaffari, S. et al. A retrospective evaluation of doxorubicin‐based chemotherapy for dogs with right atrial masses and pericardial effusion. Journal of Small Animal Practice 55, 254–257 (2014).
11. Rajagopalan, V., Jesty, S. A., Craig, L. E. & Gompf, R. Comparison of Presumptive Echocardiographic and Definitive Diagnoses of Cardiac Tumors in Dogs. J Vet Intern Med 27, 1092–1096 (2013).
12. Gardner, H. L. et al. Maintenance therapy with toceranib following doxorubicin-based chemotherapy for canine splenic hemangiosarcoma. BMC Vet Res 11, 131 (2015).
13. Heishima, K. et al. Short-Term Administration of Single-Agent Toceranib in Six Cases of Inoperable Massive Canine Hepatocellular Carcinoma. J Am Anim Hosp Assoc 55, 35–41 (2019).
14. Dickerson, E. & Bryan, B. Beta Adrenergic Signaling: A Targetable Regulator of Angiosarcoma and Hemangiosarcoma. Vet Sci 2, 270–292 (2015).
 by Multimédica
by Multimédica