Revisión hipertensión arterial sistémica en gatos
Resumen breve
La hipertensión arterial sistémica (hipertensión) es una enfermedad bien reconocida en los gatos, pero probablemente sigue estando significativamente infradiagnosticada. Las consecuencias clínicas de la hipertensión pueden ser graves, debido al daño en órganos diana que afecta a los ojos, al corazón, al cerebro y a los riñones; algunos de los cuales pueden ser irreversibles.Índice de contenidos
Introducción
La hipertensión arterial sistémica (hipertensión) es una enfermedad bien reconocida en los gatos, pero probablemente sigue estando significativamente infradiagnosticada. Las consecuencias clínicas de la hipertensión pueden ser graves, debido al daño en órganos diana que afecta a los ojos, al corazón, al cerebro y a los riñones; algunos de los cuales pueden ser irreversibles.
A menos que se detecte un daño en órganos diana marcado, es poco probable que la presencia de hipertensión sea evidente de inmediato. Por lo tanto, monitorizar de forma rutinaria la presión arterial sistémica (presión arterial) en los gatos, probablemente permitiría un diagnóstico más temprano de hipertensión y facilitaría la instauración rápida de una terapia eficaz para prevenir el daño en órganos diana y, con suerte, reducir la morbilidad asociada con la hipertensión.
Existen dos documentos indispensables para el estudio de la hipertensión felina. Por un lado, las guías publicadas en 2017 en la revisa Journal of Feline Medicine and Surgery, que tratan sobre el diagnóstico y manejo de la hipertensión en los gatos. Por otro, el consenso publicado en 2018 en la revista Journal of Veterinary Internal Medicine, que plantea las guías para la identificación, evaluación y manejo de la hipertensión en perros y gatos.
La valoración indirecta de la presión arterial en los gatos se puede realizar fácilmente, aunque es necesario tener cuidado tanto con la elección como con el uso del equipo, para asegurar que se obtengan resultados fiables (Figura 1).

Figura 1. Equipo para la valoración de presión arterial en perros y gatos basado en oscilometría de alta definición (HDO).
Se ha demostrado que la presión arterial aumenta con la edad en los gatos, al igual que el riesgo de hipertensión.
La mayoría de los gatos diagnosticados con hipertensión tienen otras patologías sistémicas que pueden causar o contribuir a dicha enfermedad, aunque hasta en un 20 % de los casos no se llega a encontrar una causa subyacente. En estos casos, es necesario tratar simultáneamente tanto la hipertensión como la patología subyacente.
La presión arterial es la fuerza ejercida por la sangre sobre las paredes de las arterias. Depende del gasto cardíaco y de la resistencia vascular periférica. El gasto cardiaco, a su vez, es el producto de la frecuencia cardíaca y el volumen sistólico, y el volumen sistólico está influenciado por la precarga, la poscarga y la contractilidad.
A pesar de los posibles cambios en el volumen sanguíneo, en el gasto cardíaco y en la resistencia vascular periférica, los complejos mecanismos homeostáticos neurohormonales que involucran el cerebro, el corazón, la vascularización y los riñones, se combinan con factores tisulares locales para mantener la presión arterial dentro de un rango relativamente estrecho.
Este mantenimiento de la presión arterial dentro de un rango adecuado es una de las funciones fisiológicas fundamentales del organismo. La presión arterial debe ser mantenida para perfundir los tejidos, asegurando así el suministro de nutrientes a órganos y tejidos, el intercambio y excreción de productos de degradación del metabolismo, y la oxigenación tisular.
¿Cuándo valorar la presión arterial en un gato?
La valoración de la presión arterial en un gato puede estar indicada en diferentes situaciones clínicas:
- Cuando aparecen lesiones en órganos diana o anomalías clínicas compatibles:
- A nivel ocular: lesiones vasculares, como congestión, edema o hemorragias en coroides o retina; hifema, etc.
- A nivel neurológico: signos clínicos compatibles con accidente cerebrovascular, déficits neurológicos, alteración del estado mental, convulsiones, etc.
- A nivel cardíaco: hipertrofia ventricular izquierda, arritmias, soplos, etc.
- A nivel renal: baja densidad urinaria, SDMA elevado, azotemia, proteinuria, etc.
- También en caso de signos inespecíficos que puedan ser de origen hipertensivo, como epistaxis.
- En el contexto clínico de chequeos de salud rutinarios (Figura 2).

Figura 2. Auscultación cardiopulmonar en el contexto de un chequeo rutinario de un gato geriátrico.
- Gatos de edad avanzada (especialmente a partir de 9 años).
- Gatos con enfermedades potencialmente hipertensivas: enfermedad renal crónica, hipertiroidismo, hiperaldosteronismo, etc.
- Gatos que reciben medicaciones potencialmente hipertensivas: corticoides, eritropoyetina, etc.
Clasificación de la hipertensión
La hipertensión es una patología crónica que consiste en la elevación de los niveles de presión arterial de forma sostenida. Se clasifica en hipertensión situacional o de bata blanca, hipertensión primaria o idiopática, e hipertensión secundaria:
- Hipertensión situacional:
- Incremento súbito de la presión arterial por causas externas.
- Principalmente debida a hiperexcitación del sistema nervioso simpático por ansiedad o estrés.
- Supone un riesgo de lesión aguda en órganos diana.
- Se aconseja adoptar las medidas adecuadas para evitar riesgos (ambientales, manejo, etc.).
- Hipertensión primaria:
- Un 13-20 % de los gatos hipertensos tienen hipertensión primaria.
- En estos pacientes no puede identificarse una causa que justifique la hipertensión (analíticas de sangre y orina normales).
- Habitualmente es consecuencia de estadios subclínicos de alguna enfermedad subyacente no detectada (principalmente enfermedad renal crónica).
- Hipertensión secundaria:
- Es la forma más común de hipertensión que se observa en los gatos.
- Existe una causa subyacente para la hipertensión. Puede ser una enfermedad (enfermedad renal crónica, hipertiroidismo, hiperaldosteronismo, etc.), o un agente terapéutico (corticoides, eritropoyetina, etc.).
- Al controlarse la causa primaria, la hipertensión puede ser controlada o puede mantenerse.
Órganos diana de la hipertensión
Es más probable que la hipertensión cause daño en tejidos con abundante irrigación arteriolar, así como en el sistema cardiovascular, como resultado de un aumento de la resistencia vascular periférica.
Por lo tanto, los ojos, el cerebro, los riñones y el corazón son particularmente vulnerables a la lesión hipertensiva (Tabla 1).
| Riñones | Sistema nervioso central | Corazón | Ojos |
|---|---|---|---|
|
|
|
|
Tabla 1. Consecuencias clínicas de la lesión hipertensiva en órganos diana.
Las manifestaciones clínicas de la lesión en órganos diana pueden ser llamativas y pueden tratarse del motivo de presentación en consulta. Sin embargo, no siempre están presentes, y en algunos gatos pueden predominar los signos clínicos de su enfermedad subyacente, o es posible que no haya signos clínicos evidentes.
Técnica de medida de la presión arterial
La presión arterial puede medirse tanto de forma invasiva (directa), como no invasiva (indirecta). La evaluación directa de la presión arterial se obtiene mediante cateterización de una arteria periférica, y mide con precisión la presión arterial sistólica (PAS), la presión arterial diastólica (PAD) y la presión arterial media (PAM), pero esta técnica no es práctica para su uso clínico en gatos.
En entornos clínicos y con gatos conscientes, la presión arterial se suele medir mediante técnicas indirectas como la esfigmomanometría Doppler y la oscilometría (Figura 3).

Figura 3. Valoración de la presión arterial en la cola de un gato empleando un equipo de oscilometría de alta definición (HDO).
La técnica Doppler se ha utilizado ampliamente en medicina felina, y los investigadores han demostrado una buena correlación y precisión en comparación con la evaluación directa de la presión arterial.
Se ha demostrado que la oscilometría tradicional es menos precisa que el Doppler, a menudo subestimando la presión arterial, y hay muchos gatos para los que es difícil o imposible lograr mediciones de presión arterial con estos equipos.
Los equipos más recientes de oscilometría de alta definición (HDO) superan los problemas de la oscilometría tradicional. Aunque hay menos informes sobre su uso en gatos, se ha comparado con la evaluación directa de la presión arterial en gatos conscientes mediante radio-telemetría, y ha demostrado proporcionar resultados bastante precisos. También hay menos gatos para los que es difícil obtener una lectura adecuada, en comparación con la oscilometría tradicional.
Aunque los equipos HDO aportan valores de PAS, PAD y PAM, se ha demostrado que en gatos conscientes es solo el valor de PAS el que tiene una precisión aceptable (las lecturas de PAD y PAM son menos precisas, y deberían ser descartadas) (Figura 4).

Figura 4. Los equipos HDO permiten obtener valores de PAS, PAD y PAM, aunque solo el valor de PAS tiene una precisión aceptable.
Los equipos Doppler aportan principalmente valores de PAS. Aunque con estos equipos también se puede medir la PAD, esta medición carece igualmente de una precisión y repetibilidad aceptables.
La hipertensión sistólica es la forma de hipertensión clínicamente más importante en los gatos. Y aunque la hipertensión diastólica aislada puede ocurrir también en estos pacientes, las limitaciones de las metodologías de medición actuales hacen que este diagnóstico sea un desafío y que su importancia clínica sea realmente incierta.
Clasificación de la presión arterial
El Colegio Americano de Medicina Interna Veterinaria (ACVIM) ha propuesto en sus guías publicadas en 2018 cuatro categorías de presión arterial sistólica en perros y gatos, basándose en el riesgo potencial de lesión en órganos diana:
- Valores de entre 120 y 140 mmHg se asocian a normotensión. En estos pacientes, el riesgo de lesión en órganos diana es mínimo.
- Valores de entre 140 y 160 mmHg se asocian a un estado prehipertensivo. Estos pacientes se encuentran predispuestos a sufrir hipertensión. En estos casos, el riesgo de lesión en órganos diana es bajo.
- Valores de entre 160 y 180 mmHg se asocian a hipertensión moderada. Existe ya en estos casos un riesgo medio de lesión en órganos diana.
- Valores superiores a 180 mmHg se asocian a hipertensión grave. Estos pacientes presentan un riesgo alto de lesión en órganos diana (Tabla 2).
| < 140 mmHg | 140-160 mmHg | 160-180 mmHg | > 180 mmHg |
|---|---|---|---|
|
|
|
|
Tabla 2. Clasificación de la presión arterial según las guías publicadas en 2018 por el Colegio Americano de Medicina Interna Veterinaria (ACVIM), y riesgo potencial asociado de lesión en órganos diana.
Protocolo de medida estandarizado
Hay una serie de recomendaciones en cuanto al manejo de estos pacientes que deben tenerse en cuenta cuando queremos valorar la presión arterial de forma adecuada:
- El gato debe estar en una habitación tranquila y silenciosa, lejos de otros animales. No debe entrar ni salir nadie de la habitación durante la valoración.
- El número de personas en la sala durante el procedimiento, debería ser el mínimo posible.
- Tener al tutor presente puede ser una buena idea, siempre que esté tranquilo y ayude a calmar al gato.
- Disponer de una persona capacitada y experimentada para medir la presión arterial mejora la reproducibilidad de los resultados. Debería tratarse, además, de alguien empático con los gatos.
- Se debe permitir que el gato permanezca en la habitación 5 o 10 minutos antes de empezar la valoración, para que pueda aclimatarse.
- Idealmente, el gato debería mantenerse en su propio transportín (con su propio olor). Se puede considerar el uso de una feromona facial sintética (Feliway®) en el ambiente o en el transportín, lo que puede ayudar a reducir el estrés (Figura 5).

Figura 5. Para la valoración de la presión arterial, idealmente, el gato debería mantenerse en su propio transportín, siempre en una posición tranquila, relajada y cómoda.
- El gato debe estar en una posición tranquila, relajada y cómoda. Es vital el uso de una sujeción mínima y suave.
- Si el gato se agita, es mejor parar y dejarlo reposar, en lugar de usar una sujeción más firme.
- Se debe tratar de mantener al gato en la misma posición durante todo el procedimiento.
- Evitar medir la presión arterial mientras el gato se está moviendo.
El lugar para la medición de la presión arterial dependerá en parte de lo que el gato tolere mejor. Puede utilizarse la extremidad anterior, la cola o la extremidad posterior. La extremidad anterior puede ser mejor para las mediciones Doppler, mientras que la cola es mejor para la técnica HDO (Figura 6).

Figura 6. Colocación del manguito inflable en la cola de un gato, para determinar la presión arterial mediante un equipo HDO.
El ancho del manguito inflable para los gatos debe ser del el 30-40 % de la circunferencia de la extremidad o de la cola donde se vaya a aplicar.
La correcta colocación del manguito, y del tubo que lleva integrado, es esencial para una lectura adecuada.
El manguito debe colocarse alrededor de la extremidad o de la cola. Vigilar que el tubo se encuentre encima de la arteria que se va a ocluir, ya que esto maximiza la sensibilidad del equipo:
- Medial en la extremidad anterior (arteria radial).
- Lateral en la extremidad posterior (arteria safena).
- Ventral en la cola (arteria coccígea).
Si se utiliza la extremidad anterior, cuando usemos el Doppler, se debe colocar el manguito por debajo del codo; pero si usamos el HDO, el manguito debe colocarse por encima del codo. De la misma manera, si se utiliza la extremidad posterior, cuando usemos el Doppler, se debe colocar el manguito por debajo del tarso; pero si usamos el HDO, el manguito debe colocarse por encima del tarso.
Los manguitos generalmente se aseguran con un cierre de velcro. Deben colocarse con cierta firmeza, pero sin apretar, evitando restringir el flujo sanguíneo.
Siempre que sea posible, el lugar en el que se realiza la medición de la presión arterial debe estar aproximadamente en el mismo plano horizontal que el corazón.
Técnica Doppler
Con esta técnica es posible detectar el flujo sanguíneo arterial utilizando un transductor de ultrasonidos, conectado a un amplificador y a un altavoz o auriculares. Con la técnica Doppler, se debe usar preferentemente una extremidad anterior, colocando el manguito siempre por debajo del codo, como ya hemos comentado.
El transductor se colocará sobre una arteria periférica, por debajo del manguito inflable, que estará conectado a un manómetro ameroide. Normalmente se coloca en la cara palmar de la región metacarpiana (arteria cubital); o en la superficie dorsal de la región metatarsiana (arteria podal dorsal), si usamos una extremidad posterior.
La detección del flujo sanguíneo requiere un buen contacto entre el transductor y la piel. Esto se logra humedeciendo con alcohol el pelo y la piel de la zona, y usando gel de ultrasonidos. Por lo general no es necesario recortar el pelo, pero, si la detección del flujo sanguíneo es difícil, se puede considerar el uso de maquinillas silenciosas para rasurar el pelo de la zona, y dejar posteriormente que el gato se tranquilice antes de realizar la medición.
El transductor debe colocarse con una presión suave, para evitar restringir el flujo sanguíneo, e ir ajustando su posición lentamente hasta que se escuche el flujo sanguíneo pulsátil. En este momento se procederá a inflar lentamente el manguito, unos 20-40 mmHg por encima del punto donde ya no se escuche el flujo sanguíneo. Posteriormente, dejaremos que el aire salga lentamente, y la PAS será el punto en el que se detecta nuevamente el flujo sanguíneo pulsátil.
Inflar y desinflar el brazalete varias veces antes de realizar las mediciones puede ayudar al gato a acostumbrarse a la sensación.
Se recomienda encarecidamente el uso de auriculares para evitar que el sonido de la unidad Doppler moleste al gato. Si no están disponibles, debemos asegurarnos de que el volumen esté bajo al comenzar el procedimiento, y ajustar el volumen más bajo posible que nos permita escuchar el flujo sanguíneo pulsátil.
Oscilometría de alta definición
Con los equipos HDO, se debe usar preferentemente la cola y asegurarse de que el gato esté lo más quieto posible, ya que el movimiento del paciente puede causar fácilmente lecturas falsas de PAS (Figura 7).
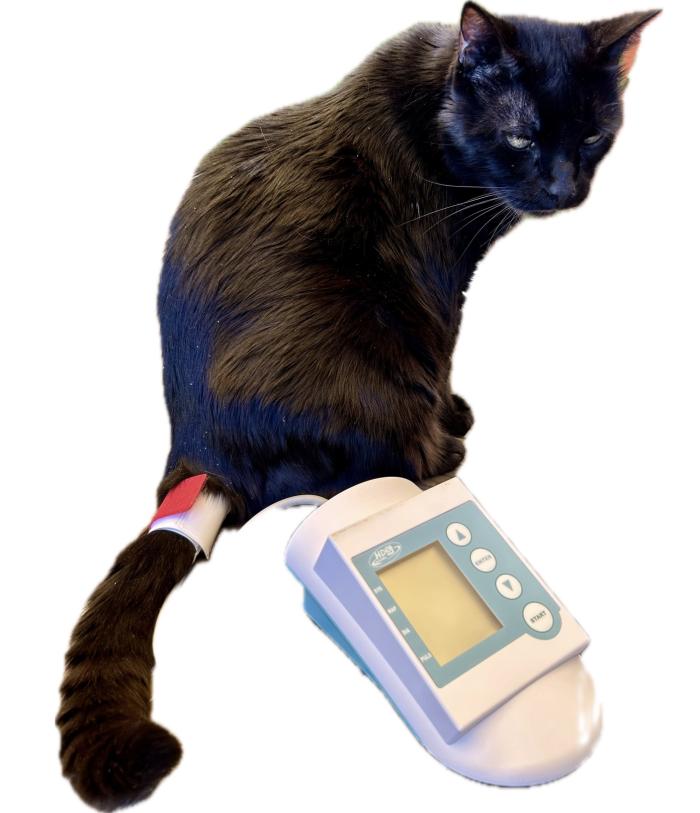
Figura 7. Con los equipos HDO, el manguito inflable debe colocarse preferentemente en la cola del gato.
Si se utiliza una extremidad anterior, se debe estirar bien la extremidad antes de colocar el manguito, siempre por encima del codo como ya hemos dicho. Y antes de empezar a hinchar el manguito, deberemos flexionar la extremidad.
Cuando se activa la máquina, el brazalete se inflará y desinflará automáticamente a un ritmo constante y se generarán diversos valores de presión arterial (PAS, PAD y PAM). Como hemos comentado, solo debe usarse el valor de PAS.
El dispositivo HDO siempre debe estar vinculado a un ordenador o a una tableta; esto permite confirmar que el desinflado del brazalete es constante y que las ondas del pulso son suaves, con un contorno que se aproxima a una curva en forma de campana. Si no se cumplen estos criterios, la lectura debe descartarse como poco confiable (p. ej.: debido a un artefacto de movimiento) (Figura 8).
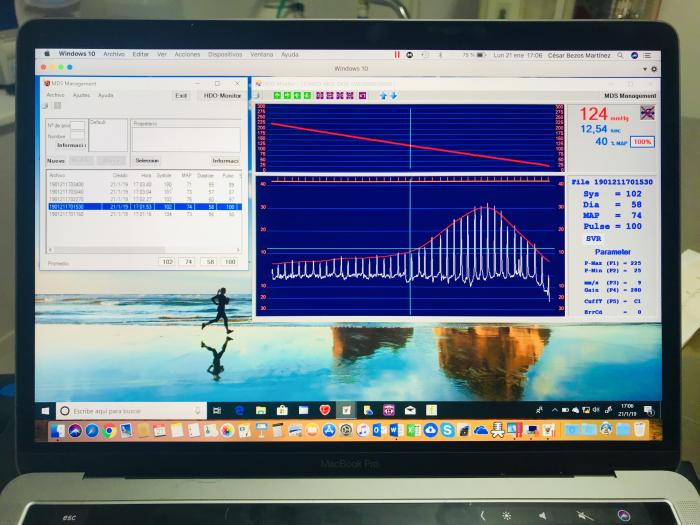
Figura 8. El dispositivo HDO siempre debe estar vinculado a un ordenador o una tableta, para asegurarnos de que las lecturas obtenidas son correctas (curva en forma de campana).
La primera medida de PAS suele descartarse. Posteriormente, de forma ideal se deben realizar de cinco a siete mediciones consecutivas y correlativas, de forma que la variabilidad entre ellas no supere el 20 %, y se debe calcular la PAS como la media de todas ellas.
Si hay una tendencia constante hacia abajo (o hacia arriba) en las lecturas, o una variación > 20 %, se deben realizar más mediciones hasta que se logren lecturas correlativas, usando solo estas para calcular la PAS promedio.
Si hay dudas sobre la validez de las lecturas obtenidas, se debe repetir el procedimiento, ya sea inmediatamente, después de una mayor aclimatación o en otro momento. Se puede considerar también cambiar la posición del manguito y reevaluar el entorno en busca de causas de estrés.
Para realizar comparaciones de PAS en un gato, la evaluación debe repetirse utilizando cada vez, en la medida de lo posible, el mismo equipo, personal y procedimientos.
Abordaje del paciente felino hipertenso
En pacientes normotensos (presión arterial 120-140 mmHg):
- En ausencia de enfermedad subyacente, únicamente se debe controlar de forma rutinaria la presión arterial con una periodicidad variable según la edad del paciente.
- Si está presente una enfermedad subyacente o un tratamiento médico potencialmente hipertensivos, se recomienda controlar periódicamente la presión arterial, según la evolución de la causa primaria (al menos semestralmente).
- Si existe alguna lesión en órganos diana, se deben investigar posibles causas para esta lesión, distintas a hipertensión arterial (Tabla 3).
Paciente normotenso (120-140 mmHg)
| Ausencia de enfermedad | Enfermedad o tratamiento potencialmente hipertensivo | Lesión en órgano diana |
|---|---|---|
|
|
|
Tabla 3. Abordaje del paciente felino normotenso.
En pacientes prehipertensos (presión arterial 140-160 mmHg):
- En ausencia de enfermedad subyacente, únicamente se debe controlar de forma rutinaria la presión arterial (al menos semestralmente).
- Si está presente una enfermedad subyacente o un tratamiento médico potencialmente hipertensivos, se recomienda controlar periódicamente la presión arterial, al menos trimestralmente, o cuando haya una variación significativa de la causa primaria.
- Si existe alguna lesión en órganos diana, y la presión arterial es inferior a 150 mmHg, se deben investigar posibles causas para esta lesión, distintas a hipertensión arterial. Si la presión arterial es superior a 150 mmHg, se debe iniciar terapia antihipertensiva (Tabla 4).
Paciente prehipertenso (140-160 mmHg)
| Ausencia de enfermedad | Enfermedad o tratamiento potencialmente hipertensivo | Lesión en órgano diana |
|---|---|---|
| Requiere acción:
| Requiere acción:
|
Tabla 4. Abordaje del paciente felino prehipertenso.
En pacientes hipertensos (presión arterial > 160 mmHg):
- En ausencia de enfermedad subyacente, si la presión arterial es inferior a 170 mmHg, se recomienda realizar controles trimestrales; aunque se puede valorar inicio de terapia antihipertensiva. Si la presión arterial es superior a 170 mmHg, se debe iniciar terapia antihipertensiva.
- Si está presente una enfermedad subyacente o un tratamiento médico potencialmente hipertensivos, se debe iniciar terapia antihipertensiva y vigilar la evolución de la causa primaria.
- Si existe alguna lesión en órganos diana, se debe iniciar terapia antihipertensiva y controlar la presión arterial en 24-48 horas (Tabla 5).
Paciente hipertenso (> 160 mmHg)
| Ausencia de enfermedad | Enfermedad o tratamiento potencialmente hipertensivo | Lesión en órgano diana |
|---|---|---|
|
|
|
Tabla 5. Abordaje del paciente felino hipertenso.
Siempre que se diagnostique hipertensión arterial en un gato, es importante buscar y tratar posibles enfermedades subyacentes, independientemente del tratamiento específico de la hipertensión.
El objetivo de la terapia antihipertensiva es disminuir el riesgo de lesión en órganos diana. Esto generalmente se logra con un objetivo inicial de mantener la PAS por debajo de 160 mmHg. Dado que la IRIS (Sociedad Internacional de Interés Renal) sugiere que el riesgo de lesión en órganos diana es mínimo si la PAS es inferior a 150 mmHg, un objetivo de mantener la PAS por debajo de 150 mmHg puede ser apropiado a largo plazo.
Amlodipino
Según los datos actuales, el amlodipino es el fármaco de elección para el tratamiento de la hipertensión en gatos. Se trata de un bloqueante de los canales de calcio con potente efecto vasodilatador a nivel de arterias periféricas, que actúa directamente sobre el músculo liso vascular, provocando una reducción de la resistencia vascular periférica y de la presión arterial con mínimos efectos cardíacos.
La reducción de la PAS después del tratamiento generalmente es de unos 30-70 mmHg, con un 60-100 % de gatos que responden al amlodipino como monoterapia, aunque en algunos casos es necesario ajustar la dosis (Figura 9).

Figura 9. Valoración de la presión arterial en la cola de un gato hipertenso tratado con amlodipino, empleando un equipo HDO.
También se ha demostrado que el amlodipino reduce la severidad de la proteinuria en gatos hipertensos con enfermedad renal crónica.
Los efectos adversos asociados al tratamiento con amlodipino son poco comunes. Aunque la hipotensión es una complicación rara, siempre se recomienda monitorizar la PAS una vez iniciado el tratamiento.
Otros tratamientos
Para tratar la hipertensión felina se han utilizado también inhibidores de la enzima convertidora de angiotensina (benazepril, enalapril, ramipril), bloqueantes de los receptores de angiotensina (telmisartán) y betabloqueantes.
Parecen tener una eficacia más pobre en la reducción de la presión arterial que el amlodipino (típicamente solo logran una reducción de la PAS de 10-20 mmHg, frente a los 30-70 mmHg que consigue el amlodipino) y, además, menos gatos responden adecuadamente a su uso como monoterapia.
Por lo tanto, es mejor considerar estos fármacos como segundos agentes para agregar a la terapia si el tratamiento con amlodipino no es suficiente para controlar la presión arterial, o si su uso está particularmente indicado por cualquier enfermedad concurrente o subyacente. Por lo general, estos medicamentos se combinan con amlodipino, y su dosis se ajusta según su efecto. Por ejemplo, los inhibidores de la enzima convertidora de angiotensina o el telmisartán pueden estar indicados en pacientes con enfermedad renal crónica para ayudar a controlar la proteinuria. Y el atenolol puede estar indicado en algunos gatos hipertiroideos para controlar la taquicardia.
Respuesta al tratamiento en el gato hipertenso
En los controles rutinarios de los gatos hipertensos se pueden llegar a tomar distintas decisiones respecto al tratamiento, según los valores de presión arterial que se obtengan:
- Si detectamos hipotensión (valores inferiores a 120 mmHg), se recomienda reducir la dosis un 50 %.
- Si detectamos normotensión (valores entre 120 y 140 mmHg), se recomienda mantener la misma dosis.
- Si detectamos hipertensión leve (valores entre 140 y 160 mmHg), se recomienda aumentar la dosis si se detecta lesión en órganos diana.
- Si persiste la hipertensión (valores entre 160 y 180 mmHg), se recomienda aumentar la dosis un 50 %
- Si detectamos hipertensión grave (valores de presión arterial superiores a 180 mmHg), se recomienda aumentar la dosis hasta alcanzar la dosis máxima, y añadir un segundo antihipertensivo si no se consigue respuesta con la dosis máxima (Tabla 6).
Respuesta al tratamiento paciente hipertenso
| Hipotensión < 120 mmHg | Normotensión 120-140 mmHg | Hipertensión leve 140-160 mmHg | Hipertensión persistente 160-180 mmHg | Hipertensión grave > 180 mmHg |
|---|---|---|---|---|
| Reducir dosis 50 % | Mantener dosis | Aumentar dosis si LOD | Aumentar dosis 50 % | Aumentar hasta dosis máxima o tratamiento combinado |
Tabla 6. Respuesta al tratamiento en el gato hipertenso.
Bibliografia
1. Ahn A. Hyperaldosteronism in cats. Semin Vet Med Surg (Small Anim). 1994;9:153-157.
2. Al-Ghazlat SA, Langston CE, Greco DS, et al. The prevalence of microalbuminuria and proteinuria in cats with diabetes mellitus. Top Companion Anim Med. 2011;26:154-157.
3. Ash AR, Harvey AM, Tasker S. Primary hyperaldosteronism in the cat: a series of 13 cases. J Feline Med Surg. 2005;7:173-182.
4. Belew AM, Barlett T, Brown SA. Evaluation of the white-coat effect in cats. J Vet Intern Med. 1999;13:134-142.
5. Bijsmans ES, Doig M, Jepson RE, et al. Factors influencing the relationship between the dose of amlodipine required for blood pressure control and change in blood pressure in hypertensive cats. J Vet Intern Med. 2016;30:1939-1676.
6. Bijsmans ES, Jepson RE, Chang YM, Syme HM, Elliott J. Changes in systolic blood pressure over time in healthy cats and cats with chronic kidney disease. J Vet Intern Med. 2015;29:855-861.
7. Binns SH, Sisson DD, Buoscio DA, Schaeffer DJ. Doppler ultrasonographic, oscillometric sphygmomanometric, and photoplethysmographic techniques for noninvasive blood pressure measurement in anesthetized cats. J Vet Intern Med. 1995;9:405-414.
8. Bodey AR, Sansom J. Epidemiological study of blood pressure in domestic cats. J Small Anim Pract. 1998;39:567-573.
9. Brown S, Atkins C, Bagley R, et al. Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. J Vet Intern Med. 2007;21:542-558.
10. Brown AL, Beatty JA, Lindsay SA, Barrs VR. Severe systemic hypertension in a cat with pituitarydependent hyperadrenocorticism. J Small Anim Pract. 2012;53:132-135.
11. Brown SA, Brown CA, Jacobs G, Stiles J, Hendi RS, Wilson S. Effects of the angiotensin converting enzyme inhibitor benazepril in cats with induced renal insufficiency. Am J Vet Res. 2001;62:375-383.
12. Brown S, Langford K, Tarver S. Effects of pharmacological agents on diurnal pattern of blood pressure, heart rate, and motor activity in cats. Am J Vet Res. 1997;58:647-652.
13. Buranakarl C, Mathur S, Brown SA. Effects of dietary sodium chloride intake on renal function and blood pressure in cats with normal and reduced renal function. Am J Vet Res. 2004;65:620-627.
14. Calsyn JDR, Green RA, Davis GJ, Reilly CM. Adrenal pheochromocytoma with contralateral adrenocortical adenoma in a cat. J Am Anim Hosp Assoc. 2010;46:36-42.
15. Carlos Sampedrano C, Chetboul V, Gouni V, et al. Systolic and diastolic myocardial dysfunction in cats with hypertrophic cardiomyopathy or systemic hypertension. J Vet Intern Med. 2006;20:1106-1115.
16. Chakrabarti S, Syme HM, Brown CA, Elliott J. Histomorphometry of feline chronic kidney disease and correlation with markers of renal dysfunction. Vet Pathol. 2013;50:147-155.
17. Chakrabarti S, Syme HM, Elliott J. Clinicopathological variables predicting progression of azotemia in cats with chronic kidney disease. J Vet Intern Med. 2012;26:275-281.
18. Chalhoub S, Langston CE, Farrelly J. The use of darbepoetin to stimulate erythropoiesis in anemia of chronic kidney disease in cats: 25 cases. J Vet Intern Med. 2012;26:363-369.
19. Chetboul V, Lefebvre HP, Pinhas C, Clerc B, Boussouf M, Pouchelon JL. Spontaneous feline hypertension: clinical and echocardiographic abnormalities, and survival rate. J Vet Intern Med. 2003; 17:89-95.
20. Chetboul V, Reynolds BS, Trehiou-Sechi E, et al. Cardiovascular effects of dietary salt intake in aged healthy cats: a 2-year prospective randomized, blinded, and controlled study. PLoS One. 2014;9: e97862.
21. Chun R, Jakovljevic S, Morrison WB. Apocrine gland adenocarcinoma and pheochromocytoma in a cat. J Am Anim Hosp Assoc. 1997;33: 33-36.
22. Cowgill LD, James KM, Levy JK, et al. Use of recombinant human erythropoietin for management of anemia in dogs and cats with renal failure. J Am Vet Med Assoc. 1998;212:521-528.
23. Crispin SM, Mould JR. Systemic hypertensive disease and the feline fundus. Vet Ophthalmol. 2001;4:131-140.
24. Dos Reis GF, Nogueira RB, Silva AC, et al. Spectral analysis of femoral artery blood flow waveforms of conscious domestic cats. J Feline Med Surg. 2014;16:972-978.
25. Eger CE, Robinson WF, Hustable CRR. Primary aldosteronism (Conn's syndrome) in a cat. J Small Anim Pract. 1983;24:293-307.
26. Elliott J, Barber PJ, Syme HM, Rawlings JM, Markwell PJ. Feline hypertension: clinical findings and response to antihypertensive treatment in 30 cases. J Small Anim Pract. 2001;42:122-129.
27. Elliott J, Fletcher M, Souttar K, et al. Effect of concomitant amlodipine and benazepril therapy in the management of feline hypertension (abstract). J Vet Intern Med. 2004;18:788.
28. Flood SM, Randolph JF, Gelzer AR, Refsal K. Primary hyperaldosteronism in two cats. J Am Anim Hosp Assoc. 1999;35:411-416.
29. Glaus A, Elliott J, Albrecht B. Efficacy of telmisartan in hypertensive cats: results of a large European Clinical Trial. 27th ECVIM-CA Congress. Malta: John Wiley & Sons, Ltd.; 2017.
30. Gouni V, Tissier R, Misbach C, et al. Influence of the observer's level of experience on systolic and diastolic arterial blood pressure measurements using Doppler ultrasonography in healthy conscious cats. J Feline Med Surg. 2015;17:94-100.
31. Gregory CR, Mathews KG, Aronson LR, et al. Central nervous system disorders after renal transplantation in cats. Vet Surg. 1997;26: 386-392.
32. Helms SR. Treatment of feline hypertension with transdermal amlodipine: a pilot study. J Am Anim Hosp Assoc. 2007;43:149-156.
33. Henik RA. Diagnosis and treatment of feline systemic hypertension. Compendium. 1997;19:163-178.
34. Henik RA, Snyder PS, Volk LM. Treatment of systemic hypertension in cats with amlodipine besylate. J Am Anim Hosp Assoc. 1997;33: 226-234.
35. Henik RA, Stepien RL, Bortnowski HB. Spectrum of m-mode echocardiographic abnormalities in 75 cats with systemic hypertension. J Am Anim Hosp Assoc. 2004;40:359-363.
36. Henik RA, Stepien RL, Wenholz LJ, Dolson MK. Efficacy of atenolol as a single antihypertensive agent in hyperthyroid cats. J Feline Med Surg. 2008;10:577-582.
37. Henry CJ, Brewer WG, Montgomery RD. Adrenal pheochromocytoma in a cat. J Vet Intern Med. 1993;7:199-203.
38. Huhtinen M, Derré G, Renoldi HJ, et al. Randomized placebo-controlled clinical trial of a chewable formulation of amlodipine for the treatment of hypertension in client-owned cats. J Vet Intern Med. 2015;29:786-793.
39. Javadi S, Djajadiningrat-Laanen SC, Kooistra HS, et al. Primary hyperaldosteronism, a mediator of progressive renal disease in cats. Domest Anim Endocrinol. 2005;28:85-104.
40. Jenkins TL, Coleman AE, Schmiedt CW, Brown SA. Attenuation of the pressor response to exogenous angiotensin by angiotensin receptor blockers and benazepril hydrochloride in clinically normal cats. Am J Vet Res. 2015;76:807-813.
41. Jensen J, Henik RA, Brownfield M, Armstrong J. Plasma renin activity and angiotensin I and aldosterone concentrations in cats with hypertension associated with chronic renal disease. Am J Vet Res. 1997;58: 535-540.
42. Jepson RE. Feline systemic hypertension: classification and pathogenesis. J Feline Med Surg 2011;13:25–34.
43. Jepson RE, Elliott J, Brodbelt D, Syme HM. Effect of control of systolic blood pressure on survival in cats with systemic hypertension. J Vet Intern Med. 2007;21:402-409.
44. Jepson RE, Syme HM, Elliott J. Plasma renin activity and aldosterone concentrations in hypertensive cats with and without azotemia and in response to treatment with amlodipine besylate. J Vet Intern Med. 2014;28:144-153.
45. King JN, Gunn-Moore DA, Tasker S, Gleadhill A, Strehlau G. Benazepril in Renal Insufficiency in Cats Study Group. Tolerability and efficacy of benazepril in cats with chronic kidney disease. J Vet Intern Med. 2006;20:1054-1064.
46. Kirk CA, Jewell DE, Lowry SR. Effects of sodium chloride on selected parameters in cats. Vet Ther. 2006;7:333-346.
47. Kobayashi DL, Peterson ME, Graves TK, Nichols CE, Lesser M. Hypertension in cats with chronic renal failure or hyperthyroidism. J Vet Intern Med. 1990;4:58-62.
48. Komaromy AM, Andrew SE, Denis HM, Brooks DE, Gelatt KN. Hypertensive retinopathy and choroidopathy in a cat. Vet Ophthalmol. 2004;7:3-9.
49. Kyles AE, Gregory CR, Wooldridge JD, et al. Management of hypertension controls postoperative neurologic disorders after renal transplantation in cats. Vet Surg. 1999;28:436-441.
50. Lavallee JO, Norsworthy GD, Huston CL, Chew DJ. Safety of benazepril in 400 azotemic and 110 non-azotemic client-owned cats (2001-2012). J Am Anim Hosp Assoc. 2017;53:119-127.
51. Lesser M, Fox PR, Bond BR. Assessment of hypertension in 40 cats with left ventricular hypertrophy by Doppler-shift sphygmomanometry. J Small Anim Pract. 1992;33:55-58.
52. Lin CH, Yan CJ, Lien YH, et al. Systolic blood pressure of clinically normal and conscious cats determined by an indirect Doppler method in a clinical setting. J Vet Med Sci. 2006;68:827-832.
53. Littman MP. Spontaneous systemic hypertension in 24 cats. J Vet Intern Med. 1994;8:79-86.
54. Littman MP, Drobatz KJ. Hypertensive and hypotensive disorders. In: Ettinger SJ, ed. Textbook of Veterinary Internal Medicine. Philadelphia, PA: W.B. Saunders; 1995:93-100.
55. Luckschander N, Iben C, Hosgood G, Gabler C, Biourge V. Dietary NaCl does not affect blood pressure in healthy cats. J Vet Intern Med. 2004;18:463-467.
56. MacDonald KA, Kittleson MD, Kass PH, White SD. Effect of spironolactone on diastolic function and left ventricular mass in Maine Coon cats with familial hypertrophic cardiomyopathy. J Vet Intern Med. 2008;22:335-341.
57. MacKay AD, Holt PE, Sparkes AH. Successful surgical treatment of a cat with primary aldosteronism. J Feline Med Surg. 1999;1:117-122.
58. Maggio F, DeFrancesco TC, Atkins CE, et al. Ocular lesions associated with systemic hypertension in cats: 69 cases (1985-1998). J Am Vet Med Assoc. 2000;217:695-702.
59. Maher ER Jr, McNiel EA. Pheochromocytoma in dogs and cats. Vet Clin North Am Small Anim Pract. 1997;27:359-380.
60. Mancia G, Fagard R, Narkiewicz K, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens. 2013;31:1281-1357.
61. Martel E, Egner B, Brown SA, et al. Comparison of high-definition oscillometry - a non-invasive technology for arterial blood pressure measurement - with a direct invasive method using radio-telemetry in awake healthy cats. J Feline Med Surg. 2013;15:1104-1113.
62. Mathews KG, Gregory CR. Renal transplants in cats: 66 cases (1987-1996). J Am Vet Med Assoc. 1997;211:1432-1436.
63. Mathur S, Syme H, Brown CA, et al. Effects of the calcium channel antagonist amlodipine in cats with surgically induced hypertensive renal insufficiency. Am J Vet Res. 2002;63:833-839.
64. McLeland SM, Cianciolo RE, Duncan CG, et al. A comparison of biochemical and histopathologic staging in cats with chronic kidney disease. Vet Pathol. 2015;52:524-534.
65. Miller RH, Lehmkuhl LB, Smeak DD, DiBartola S, Radin J. Effect of enalapril on blood pressure, renal function, and the renin-angiotensin-aldosterone system in cats with autosomal dominant polycystic kidney disease. Am J Vet Res. 1999;60:1516-1525.
66. Mishina M, Watanabe T, Fujii K, et al. Non-invasive blood pressure measurements in cats: clinical significance of hypertension associated with chronic renal failure. J Vet Med Sci. 1998;60:805-808.
67. Mixon W, Helms SR. Transdermal amlodipine besylate in lipoderm for the treatment of feline hypertension: a report of two cases. Int J Pharm Compd. 2008;12:392-397.
68. Mizutani H, Koyama H, Watanabe T, et al. Evaluation of the clinical efficacy of benazepril in the treatment of chronic renal insufficiency in cats. J Vet Intern Med. 2006;20:1074-1079.
69. Morgan RV. Systemic hypertension in four cats: ocular and medical findings. J Am Anim Hosp Assoc. 1986;22:615-621.
70. Morrow LD, Adams VJ, Elliott J et al. Hypertension in hyperthyroid cats: prevalence, incidence and predictors of its development. In: Proceedings of ACVIM forum 2009;699.
71. O'Neill J, Kent M, Glass EN, Platt SR. Clinicopathologic and MRI characteristics of presumptive hypertensive encephalopathy in two cats and two dogs. J Am Anim Hosp Assoc. 2013;49:412-420.
72. Paige CF, Abbott JA, Elvinger F, Pyle RL. Prevalence of cardiomyopathy in apparently healthy cats. J Am Vet Med Assoc. 2009;234: 1398-1403.
73. Payne JR, Brodbelt DC, Luis FV. Blood pressure measurements in 780 apparently healthy cats. J Vet Intern Med. 2017;31:15-21.
74. Pedersen KM, Pedersen HD, Haggstrom J, Koch J, Ersbøll AK. Increased mean arterial pressure and aldosterone-to-renin ratio in Persian cats with polycystic kidney disease. J Vet Intern Med. 2003; 17:21-27.
75. Quimby JM, Smith ML, Lunn KF. Evaluation of the effects of hospital visit stress on physiologic parameters in the cat. J Feline Med Surg. 2011;13:733-737.
76. Randolph JE, Scarlett JM, Stokol T, et al. Expression, bioactivity, and clinical assessment of recombinant feline erythropoietin. Am J Vet Res. 2004;65:1355-1366.
77. Reynolds BS, Chetboul V, Nguyen P, et al. Effects of dietary salt intake on renal function: a 2-year study in healthy aged cats. J Vet Intern Med. 2013;27:507-515.
78. Rijnberk A, Voorhout G, Kooistra HS, et al. Hyperaldosteronism in a cat with metastasised adrenocortical tumour. Vet Q. 2001;23:38-43.
79. Sander C, Horauf A, Reusch C. Indirect blood pressure measurement in cats with diabetes mellitus, chronic nephropathy and hypertrophic cardiomyopathy. Tierarztl Prax Ausg K Kleintiere Heimtiere. 1998;26: 110-118.
80. Sansom J, Barnett K, Dunn K, et al. Ocular disease associated with hypertension in 16 cats. J Small Anim Pract. 1994;35:604-611.
81. Sansom J, Rogers K, Wood JL. Blood pressure assessment in healthy cats and cats with hypertensive retinopathy. Am J Vet Res. 2004;65: 245-252.
82. Sennello KA, Schulman RL, Prosek R, Siegel AM. Systolic blood pressure in cats with diabetes mellitus. J Am Vet Med Assoc. 2003;223: 198-201.
83. Sent U, Gössl R, Elliott J, Syme HM, Zimmering T. Comparison of efficacy of long-term oral treatment with telmisartan and benazepril in cats with chronic kidney disease. J Vet Intern Med. 2015;29: 1479-1487.
84. Simmons JP, Wohl JS, Schwartz DD, Edwards HG, Wright JC. Diuretic effects of fenoldopam in healthy cats. J Vet Emerg Crit Care. 2006;16:96-103.
85. Simpson KM, De Risio L, Theobald A, et al. Feline ischaemic myelopathy with a predilection for the cranial cervical spinal cord in older cats. J Feline Med Surg. 2014;16:1001-1006.
86. Slingerland LI, Robben JH, Schaafsma I, Kooistra HS. Response of cats to familiar and unfamiliar human contact using continuous direct arterial blood pressure measurement. Res Vet Sci. 2008;85:575-582.
87. Snyder PS. Amlodipine: a randomized, blinded clinical trial in 9 cats with systemic hypertension. J Vet Intern Med. 1998;12:157-162.
88. Snyder PS, Sadek D, Jones GL. Effect of amlodipine on echocardiographic variables in cats with systemic hypertension. J Vet Intern Med. 2001;15:52-56.
89. Sparkes AH, Caney SM, King MC, Gruffydd-Jones TJ. Inter- and intraindividual variation in Doppler ultrasonic indirect blood pressure measurements in healthy cats. J Vet Intern Med. 1999;13:314-318.
90. Steele JL, Henik RA, Stepien RL. Effects of angiotensin-converting enzyme inhibition on plasma aldosterone concentration, plasma renin activity, and blood pressure in spontaneously hypertensive cats with chronic renal disease. Vet Ther. 2002;3:157-166.
91. Stepien RL. Feline systemic hypertension: diagnosis and management. J Feline Med Surg 2011;13:35–43.
92. Syme HM. Proteinuria in cats. J Feline Med Surg. 2009;11:211-218.
93. Syme HM, Barber PJ, Markwell PJ, Elliott J. Prevalence of systolic hypertension in cats with chronic renal failure at initial evaluation. J Am Vet Med Assoc. 2002;220:1799-1804.
94. Syme HM, Elliott J. Prevalence of hypertension in hyperthyroid cats at diagnosis and following treatment. J Vet Intern Med. 2003;17: 754A.
95. Syme HM, Markwell PJ, Pfeiffer D, Elliott J. Survival of cats with naturally occurring chronic renal failure is related to severity of proteinuria. J Vet Intern Med. 2006;20:528-535.
96. Taffin ER, Paepe D, Ghys LF, et al. Systolic blood pressure, routine kidney variables and renal ultrasonographic findings in cats naturally infected with feline immunodeficiency virus. J Feline Med Surg. 2017; 19:672-679.
97. Taugner F, Baatz G, Nobiling R. The renin-angiotensin system in cats with chronic renal failure. J Comp Pathol. 1996;115:239-252.
98. Taylor SS, Sparkes AH, Briscoe K, et al. ISFM Consensus Guidelines
on the Diagnosis and Management of Hypertension in Cats. J Feline Med Surg. 2017;19:288-303.
99. Turner JL, Brogdon JD, Lees GE, et al. Idiopathic hypertension in a cat with secondary hypertensive retinopathy associated with a high-salt diet. J Am Anim Hosp Assoc. 1990;26:647-651.
100. Vaden S, Elliott J. Management of proteinuria in dogs and cats with chronic kidney disease. Vet Clin North Am Small Anim Pract. 2016;46: 1115-1130.30.
101. Valentin SY, Cortright CC, Nelson RW, et al. Clinical findings, diagnostic test results, and treatment outcome in cats with spontaneous hyperadrenocorticism: 30 cases. J Vet Intern Med. 2014;28:481-487.
102. Van Boxtel SA. Hypertensive retinopathy in a cat. Can Vet J. 2003; 44:147-149.
103. Wey AC, Atkins CE. Aortic dissection and congestive heart failure associated with systemic hypertension in a cat. J Vet Intern Med. 2000;14:208-213.
104. Whittemore JC, Nystrom MR, Mawby DI. Effects of various factors on Doppler ultrasonographic measurements of radial and coccygeal arterial blood pressure in privately owned, conscious cats. J Am Vet Med Assoc. 2017;250:763-769.
105. Williams TL, Elliott J, Syme HM. Measurement of systolic blood pressure (SBP) in cats by the indirect Doppler technique is not altered by the use of headphones. ECVIM Congress 2010.
106. Williams TL, Elliott J, Syme HM. Renin-angiotensin-aldosterone system activity in hyperthyroid cats with and without concurrent hypertension. J Vet Intern Med. 2013;27:522-529.
107. Williams TL, Peak KJ, Brodbelt D, Elliott J, Syme HM. Survival and the development of azotemia after treatment of hyperthyroid cats. J Vet Intern Med. 2010;24:863-869.
108. Wimpole JA, Adagra CFM, Billson MF, Pillai DN, Foster DJ. Plasma free metanephrines in healthy cats, cats with non-adrenal disease and a cat with suspected phaeochromocytoma. J Feline Med Surg. 2010;12:435-440.
109. Zwijnenberg RJ, Del Rio CL, Cobb RM, Ueyama Y, Muir WW. Evaluation of oscillometric and vascular access port arterial blood pressure measurement techniques versus implanted telemetry in anesthetized cats. Am J Vet Res. 2011;72:1015-1021.
 by Multimédica
by Multimédica