Márgenes quirúrgicos en cirugía oncológica: tumores cutáneos y subcutáneos
Resumen breve
La cirugía es el tratamiento por excelencia en oncología, y cura más pacientes que cualquier otra modalidad. El éxito del tratamiento está basado en una buena comunicación con el propietario, en el examen clínico del paciente, en la estadificación tumoral y en una correcta técnica quirúrgica. Es necesario obtener información sobre el tipo y el grado histológico del tumor antes de plantear una cirugía más avanzada, para así adaptar la extensión de la cirugía a cada tipo de tumor y…Índice de contenidos

Resumen
La cirugía es el tratamiento por excelencia en oncología, y cura más pacientes que cualquier otra modalidad. El éxito del tratamiento está basado en una buena comunicación con el propietario, en el examen clínico del paciente, en la estadificación tumoral y en una correcta técnica quirúrgica. Es necesario obtener información sobre el tipo y el grado histológico del tumor antes de plantear una cirugía más avanzada, para así adaptar la extensión de la cirugía a cada tipo de tumor y a la finalidad que pretendamos conseguir con la intervención quirúrgica. La histología es la herramienta más utilizada para determinar el grado de escisión tumoral, por lo que de ella depende en gran medida la recomendación postquirúrgica de terapia adyuvante.
Introducción
El tratamiento del paciente oncológico involucra diferentes técnicas de diagnóstico, manejo médico y quirúrgico con el fin de obtener el mejor resultado clínico. La cirugía oncológica está considerada uno de los componentes más importantes a la hora de tratar el cáncer1. Varios estudios respaldan una menor recidiva tras la escisión completa del tumor y/o el aumento en la supervivencia del paciente2. La comunicación con el propietario es primordial antes de comenzar con el tratamiento para establecer el objetivo final de la terapia: curativa, paliativa o citorreductora3. El objetivo del tratamiento debe ser mejorar la calidad de vida del paciente y los resultados del tratamiento dependerán del estado general del paciente, enfermedades previas, extensión de la enfermedad y tipo del tumor.
En este artículo revisaremos los conceptos de márgenes quirúrgicos, resumiremos las recomendaciones actuales en los tumores cutáneos y subcutáneos más comunes, y discutiremos limitaciones de las técnicas de diagnóstico patológico.
Conceptos generales
El tratamiento quirúrgico en el paciente oncológico puede tener varias finalidades, y la extensión de la cirugía variará en función del objetivo final del tratamiento. La cirugía puede tener una finalidad diagnóstica, citorreductora, paliativa o curativa. Para obtener dicha finalidad la extensión de la intervención quirúrgica variará, pudiendo tratarse de cirugías intracapsulares, marginales, amplias o radicales.
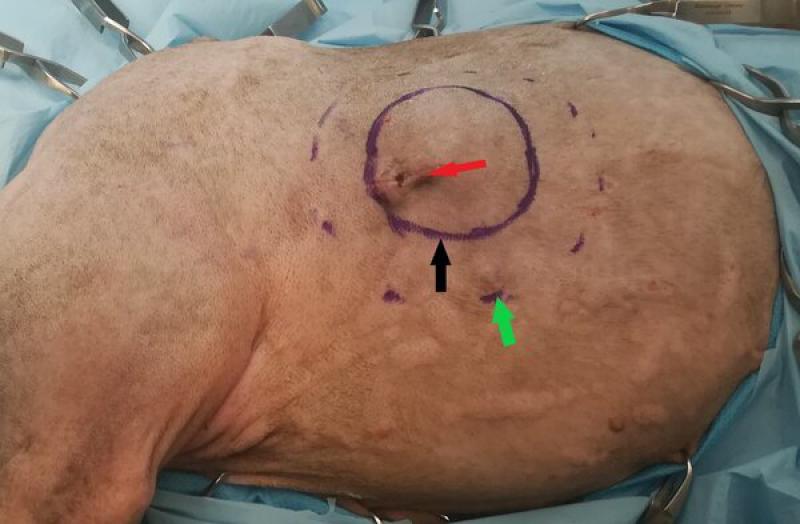
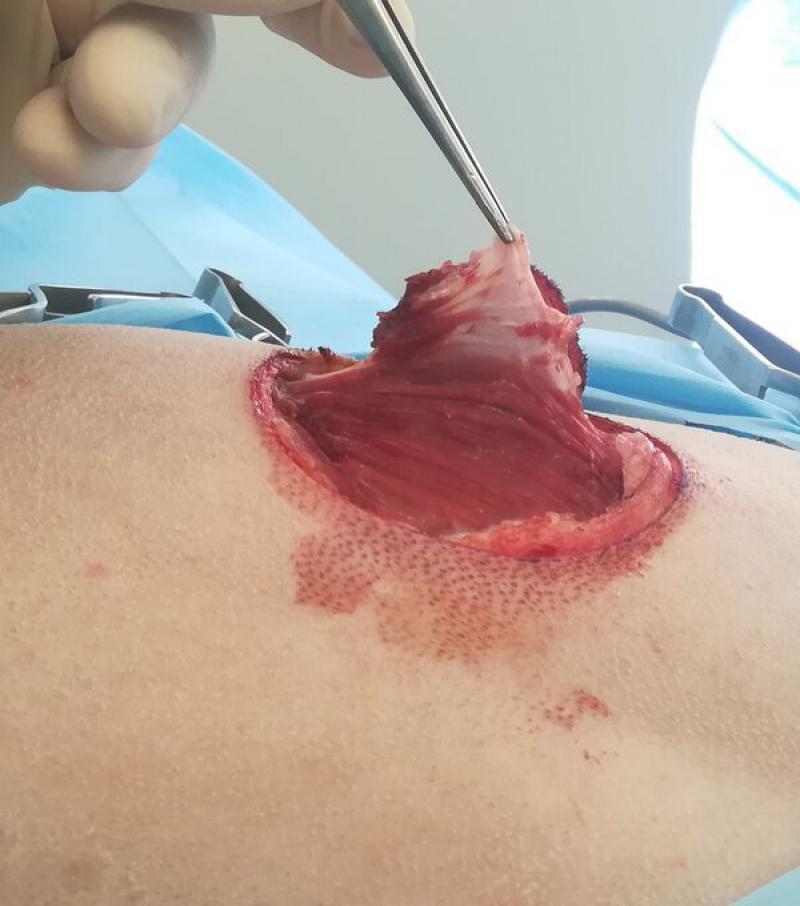
- Las cirugías intracapsulares consisten en resecar parte del tumor, dejando enfermedad macroscópica in situ. Este tipo de cirugías tienen un beneficio muy limitado en el tratamiento final del paciente oncológico, y su única indicación es como cirugía de intención diagnóstica (toma de biopsia para establecer el diagnóstico y grado histológico del tumor de cara a plantear tratamientos futuros). Cuando se realiza esta toma de biopsia es importante seleccionar la zona de toma de muestra de forma que el tracto de la biopsia esté incluido dentro de una futura zona de resección (en el caso de que se realice una cirugía futura con otra finalidad) (Figura 1).
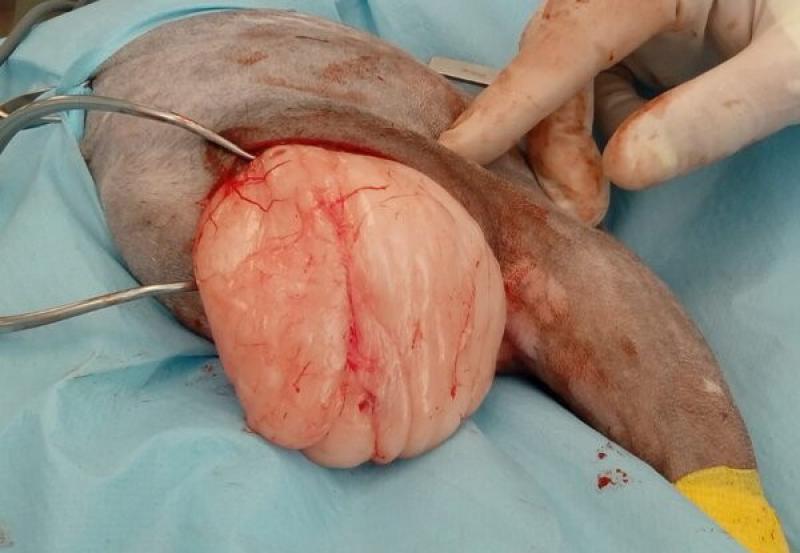
- Las cirugías marginales consisten en la resección del tumor inmediatamente alrededor del mismo (<1 cm de margen quirúrgico o alrededor de la pseudocápsula del tumor). Este tipo de cirugía se realiza en tumores benignos, como por ejemplo en lipomas (Figuras 2a, 2b). En tumores malignos, al realizar esta resección marginal se va a retirar la enfermedad macroscópica, pero no se van a retirar las proyecciones tumorales microscópica alrededor del tumor. Por tanto, la cirugía marginal se realiza en cirugías de intención curativa (tumores benignos y potencialmente en algunos tumores malignos de bajo grado histológico), en cirugías con intención citorreductora (tumores malignos en los que se vaya a aplicar tratamientos adyuvantes posteriores) y en cirugías con intención paliativa (tumores malignos en los que la cirugía no vaya a alterar el curso de la enfermedad, pero que vaya a mejorar la calidad de vida del paciente por cualquier otro motivo).
Las cirugías marginales no están aconsejadas como cirugías de intención diagnóstica, ya que en caso de diagnosticar un tumor maligno únicamente se habrá resecado la parte macroscópica del tumor dejando enfermedad microscópica in situ. En caso de ser necesaria una reintervención está será más compleja, ya que los planos quirúrgicos estarán alterados y se considerará toda la cicatriz de la cirugía anterior como potencialmente contaminada por células tumorales. Se deberán coger nuevos márgenes quirúrgicos alrededor de la cicatriz de la cirugía previa, por lo que reintervenciones quirúrgicas son más extensas que las cirugías iniciales, y tienen una tasa de éxito inferior en cirugías de intención curativa.
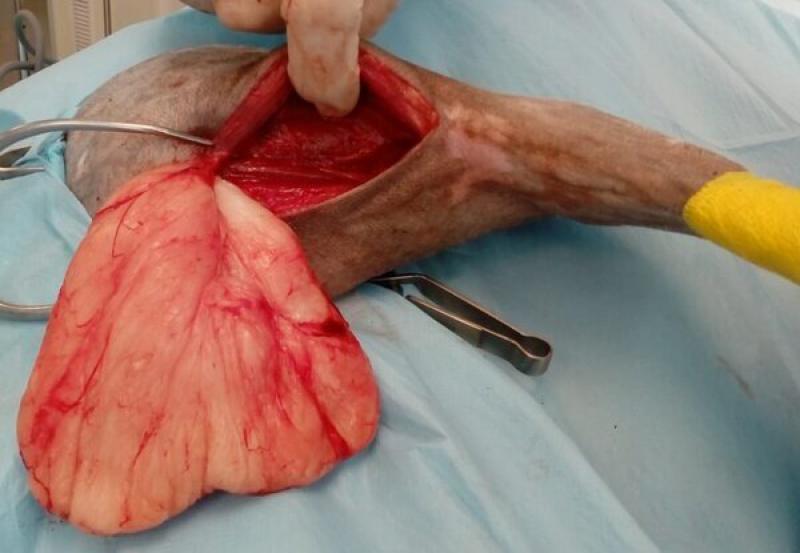
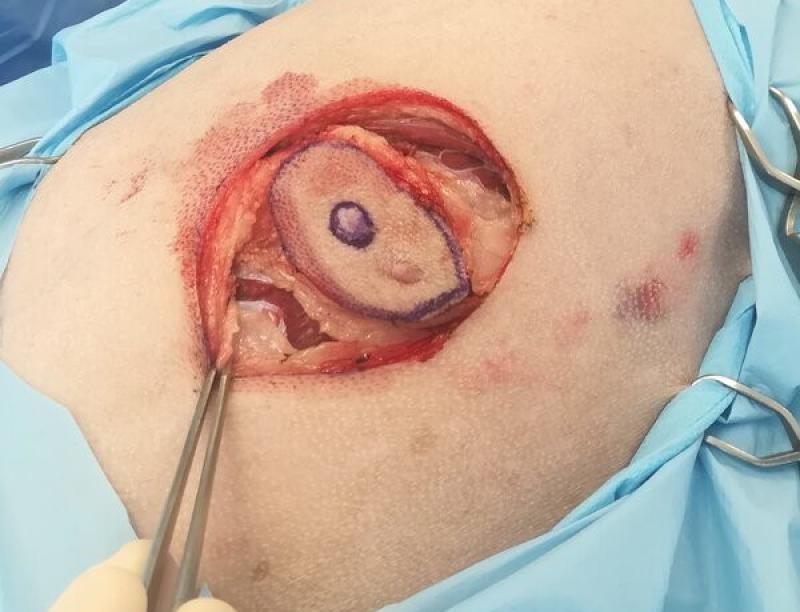
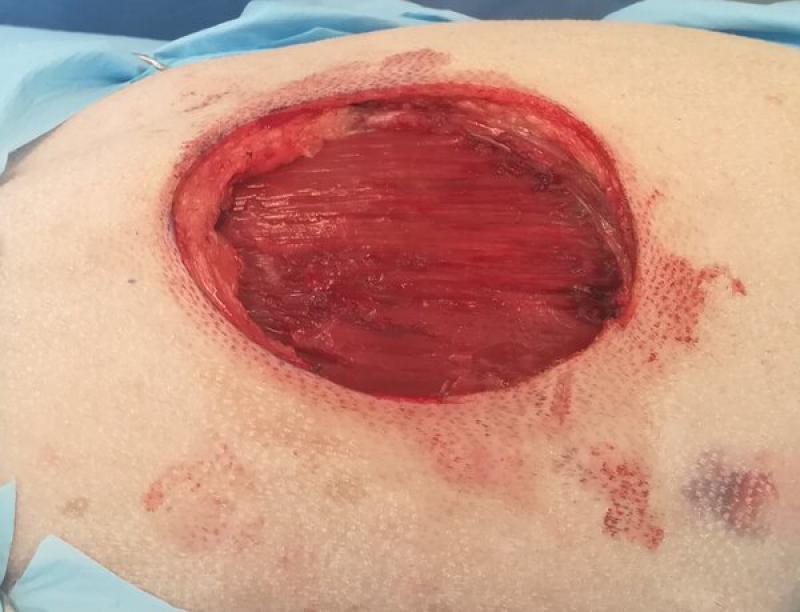
- Las cirugías amplias se realizan respetando los márgenes quirúrgicos recomendados para cada tipo de tumor (Figuras 3a y 3b). Estas resecciones amplias se realizan en tumores malignos, en cirugías de intención curativa.
En ocasiones esta cirugía se podrá realizar también como una cirugía de intención diagnóstica, siempre
que sea posible obtener márgenes quirúrgicos amplios (3 cm laterales y un plano fascial en profundidad). De esta forma se estará realizando una cirugía que potencialmente podrá ser diagnóstica y curativa al mismo tiempo en el caso de algunos tumores malignos (como por ejemplo un sarcoma de tejidos blandos subcutáneo), pero que en caso de diagnosticar un tumor con comportamiento benigno se habrá aplicado una cirugía más extensa de la necesaria.
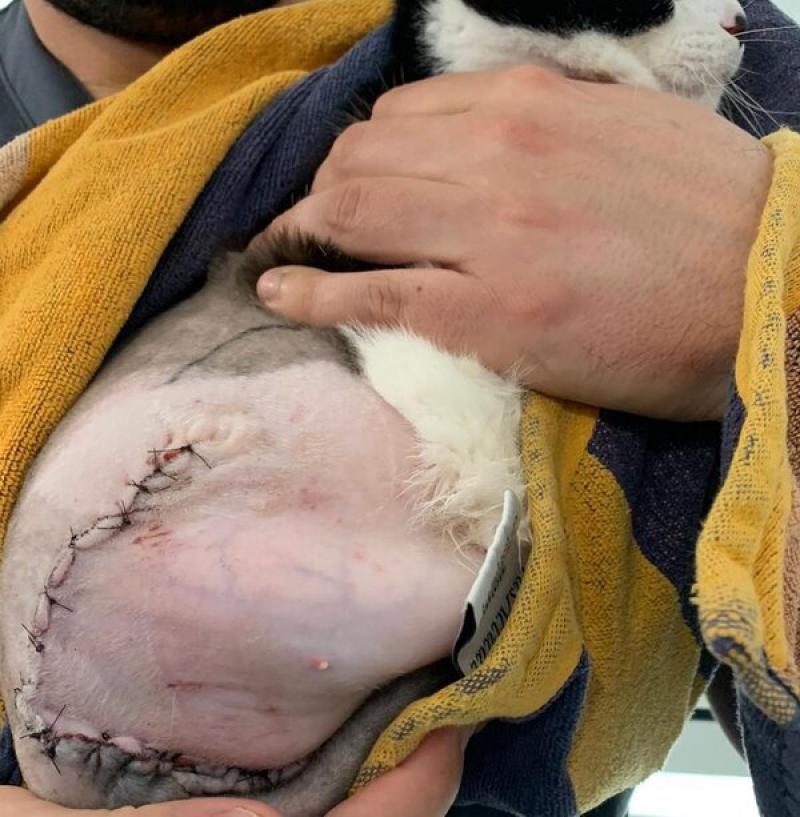
- Las cirugías radicales consisten en la resección de un compartimento anatómico para el tratamiento de un tumor. Este tipo de cirugías puede tener una finalidad curativa o una finalidad paliativa dependiendo de la localización del tumor y su comportamiento biológico. Un ejemplo de este tipo de cirugía es la amputación de una extremidad (Figura 4).
La planificación de la intervención quirúrgica se basará en el tipo de tumor, su grado histológico y su estadificación (la posible existencia de metástasis regionales o distantes). De esta forma, se debe conocer la naturaleza del tumor y su comportamiento biológico antes de realizar una intervención quirúrgica, y esta información se obtendrá mediante una biopsia previa (una PAAF podrá realizar un diagnóstico definitivo en ciertos tumores, pero normalmente no establecerá el grado histológico del tumor). La excepción a esta regla son los tumores en los que un diagnóstico preciso no vaya a cambiar el tratamiento quirúrgico (por ejemplo, en un hemoabdomen activo por rotura de una masa esplénica).
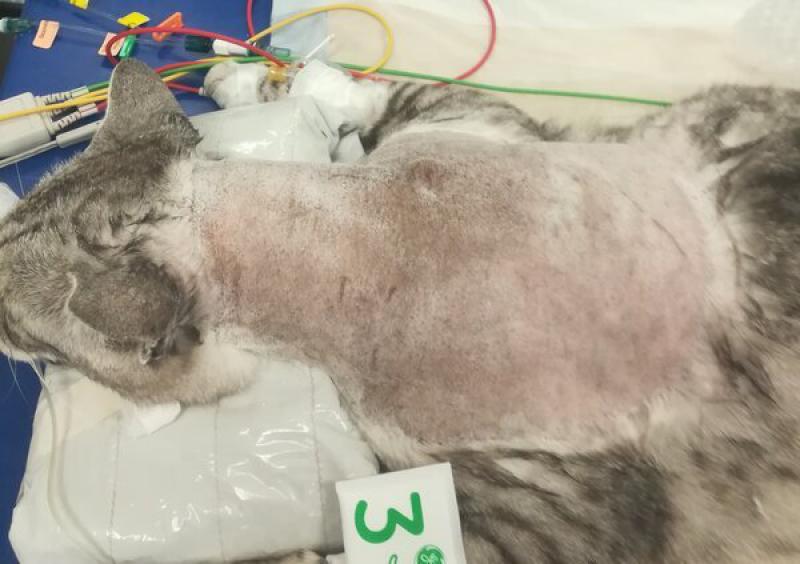
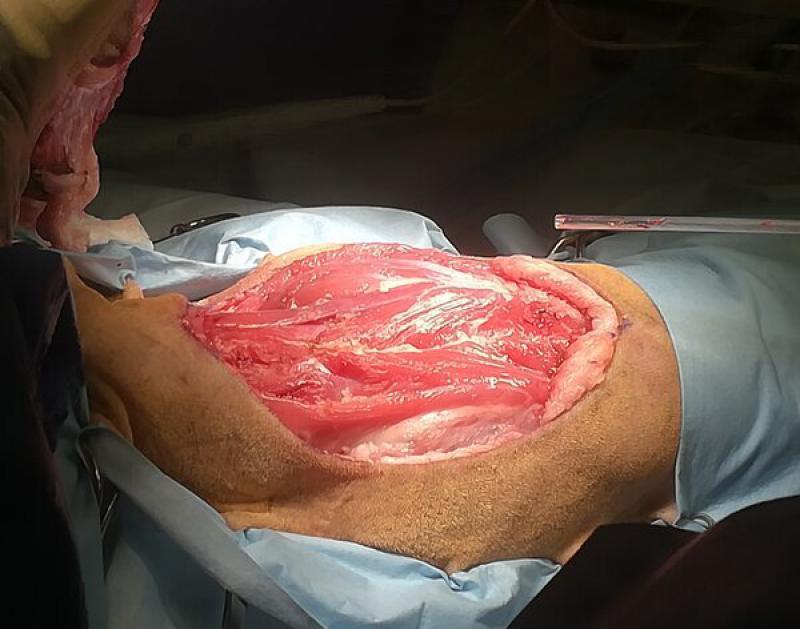
El concepto de márgenes quirúrgicos tiene mayor importancia en las cirugías de intención curativa, en las que se hacen resecciones amplias alrededor del tumor. Respetar los márgenes quirúrgicos recomendados para cada tipo de tumor hará que tengamos una mayor probabilidad de obtener una resección completa del tumor, y por tanto de conseguir nuestra finalidad en las cirugías de intención curativa. Las resecciones amplias deben realizarse en bloque, tomando varios centímetros de tejido sano alrededor del tumor en todas las direcciones. Los márgenes quirúrgicos recomendados para cada tipo de tumor nos indicarán cuantos centímetros de tejido sano deberemos incluir en nuestra resección en bloque (Figura 1, 3a y 3b). Así, se recomiendan márgenes quirúrgicos que pueden variar entre 1 cm en algunos carcinomas, hasta 5 cm en neoplasias muy agresivas como los sarcomas felinos asociados a inyecciones. En tumores cutáneos y subcutáneos es posible obtener márgenes quirúrgicos lateralmente, pero la mayoría de las veces no es posible conseguir los mismos márgenes quirúrgicos en profundidad. Por ello, en estos tumores se aplica el concepto de “plano fascial” o barreras naturales. Mientras que las células tumorales son capaces de avanzar sin dificultad por ciertos tejidos (por ejemplo, grasa y músculo), existen estructuras anatómicas que dificultan el avance del tumor a través de ellas, y en las cirugías de intención curativa se deben incluir estas estructuras anatómicas en la resección en bloque. La barrera más comúnmente utilizada es la fascia muscular que se encuentre en profundidad al tumor a resecar, y que establece así el plano fascial en profundidad (Figura 5). Otras barreras naturales que dificultan el paso de células tumorales son los huesos, ligamentos, cartílago y tendones.
Recomendaciones en los tumores más comunes
Los tumores cutáneos y subcutáneos son los más frecuentes en perros y gatos, representando hasta un 43 % de los tumores diagnosticados en perros y un 29 % de los tumores diagnosticados en gatos4. Los tumores más frecuentes son:
- Mastocitoma (MCT) canino: los mastocitomas cutáneos son muy comunes en perros (incidencia de un 14-21 % de los tumores cutáneos) y menos comunes en gatos (incidencia de un 8-21 % de los tumores cutáneos). El comportamiento biológico de los mastocitomas cutáneos depende de su grado histológico. Tradicionalmente los mastocitomas cutáneos se han clasificado de acuerdo con sus características histológicas siguiendo la propuesta realizada por Patniak5. Así, los mastocitomas se han clasificado como bien diferenciados (grado 1), intermedios (grado 2) y mastocitomas no diferenciados (grado 3). Siguiendo esta clasificación se ha reportado una tasa de metastatización de hasta un 7 % en mastocitomas de grado 1, de hasta un 20 % en mastocitomas de grado 2 y una tasa de metastatización muy variable en mastocitomas de grado 3. De igual manera, siguiendo esta clasificación realizada por Patniak, los márgenes quirúrgicos que se han recomendado tradicionalmente para los mastocitomas han sido de 1-2 cm de márgenes laterales en mastocitomas de grado 1, 2 cm en mastocitomas de grado 2 y de 3 cm en mastocitomas de grado 3 que tengan un tamaño menor de 3 cm de diámetro. En todos los casos se recomienda un plano fascial en profundidad independientemente de su grado histológico6.
Siguiendo la clasificación propuesta por Patniak, se comprobó que algunos mastocitomas cutáneos no seguían el comportamiento biológico que les correspondería según su grado histológico, en especial algunos mastocitomas de grado 2. Por este motivo Kiupel propuso una nueva clasificación de mastocitomas cutáneos7, dividiendo a las mastocitomas en grado bajo (que incluirían los mastocitomas de grado 1 y el 85 % de los mastocitomas de grado 2 de la clasificación de Patniak), y mastocitomas de grado alto (que incluirían el 15 % de los mastocitomas de grado 2 y los mastocitomas de grado 3 de la clasificación de Patniak). Si bien la clasificación propuesta por Kiupel ha permitido diferenciar mejor el pronóstico de los pacientes con mastocitomas (tiempo medio de supervivencia del paciente menor a 4 meses en tumores de grado alto y superior a 2 años en pacientes con tumores de grado bajo)8, los márgenes quirúrgicos propuestos no han variado y son similares a los anteriormente descritos.
Se ha propuesto una resección proporcional en mastocitomas como forma de determinar los márgenes quirúrgicos9. De acuerdo con esta propuesta, los márgenes laterales de resección tendrán la misma longitud que el diámetro más largo del tumor, hasta un máximo de 4 cm. En el estudio original describiendo esta propuesta, el 90 % de los casos pertenecían a tumores de grado bajo siguiendo la clasificación de Kiupel, y se obtuvo una tasa de márgenes libres de tumor en histología del 85 %. Un segundo estudio evalúo esta forma proporcional de determinación de márgenes quirúrgicos en mastocitomas, hasta un máximo de 2 cm de márgenes laterales10, concluyendo que esta técnica era adecuada en mastocitomas cutáneos.
Por último, hay que destacar que la clasificación e información anteriormente expuesta es relativa a mastocitomas cutáneos, y no puede aplicarse a mastocitomas subcutáneos. Se ha considerado que los mastocitomas subcutáneos tienen un comportamiento biológico similar a los mastocitomas cutáneos de grado 28,11 y que la mayoría de los perros con mastocitomas subcutáneos tienen un buen pronóstico con tasas de supervivencia elevadas de más de 1199 días11,12,13. De hecho, un estudio12 comprobó que a pesar de que el 56 % de los tumores habían sido resecados de forma incompleta, la tasa de metastatización fue únicamente del 4 % y la tasa de recidiva local fue del 8 %. Dichas tasas de metastatización y de recidiva local son muy similares a las halladas en otros artículos evaluando mastocitomas subcutáneos en perros11,13. - Sarcoma de tejidos blandos: los sarcomas de tejidos blandos engloban varios tipos de tumores malignos con características biológicas similares. Esto tumores tienen un origen mesenquimal, e incluyen los fibrosarcomas, tumores de vaina nerviosa periféricos, liposarcomas, tumores perivasculares, histiocitomas fibrosos malignos, mesenquimomas, mixosarcomas y sarcomas no diferenciados14. Existen tumores de origen mesenquimal que no están incluidos dentro de esta categoría de “sarcoma de tejidos blandos” debido a que presentan un comportamiento biológico distinto. Estos tumores excluidos de esta categoría son los hemangiosarcomas, sarcomas sinoviales, los tumores estromales gastrointestinales, los fibrosarcomas orales y los tumores nerviosos periféricos originados en los plexos braquiales o lumbosacro14.
Los sarcomas de tejidos blandos tienen una incidencia alta en pequeños animales, representando hasta un 15 % y un 18 % de los tumores cutáneos y subcutáneos en perros y gatos respectivamente4. De forma general, estos tumores se caracterizan por tener un crecimiento lento, ser localmente invasivos y tener una tasa de metastatización baja. Es por ello que en este tipo de neoplasia la resección completa del tumor se ha considerado tradicionalmente una cirugía potencialmente curativa. Cabe recordar que estos pacientes pueden desarrollar metástasis (incluso un 41 % en pacientes con tumores de grado histológico alto), y que los pacientes tratados quirúrgicamente tienen una esperanza de vida de entre 480 y 1796 días con una tasa de supervivencia a los 5 años de un 70 %15. Cuando se realiza una cirugía de intención curativa hay que evitar la pseudocápsula que presentan estos tumores. La pseudocápsula está compuesta de células tumorales comprimidas y tejido reactivo, por lo que resecar el tumor alrededor de la misma implica que se estará realizando una resección marginal del tumor, resecando únicamente la enfermedad macroscópica. Por esto se recomienda realizar resecciones amplias cuando se realicen cirugías con intención curativa, y en el caso de los sarcomas de tejidos blandos se ha recomendado unos márgenes laterales de 3 cm y un plano fascial en profundidad (Figuras 3 y 5).
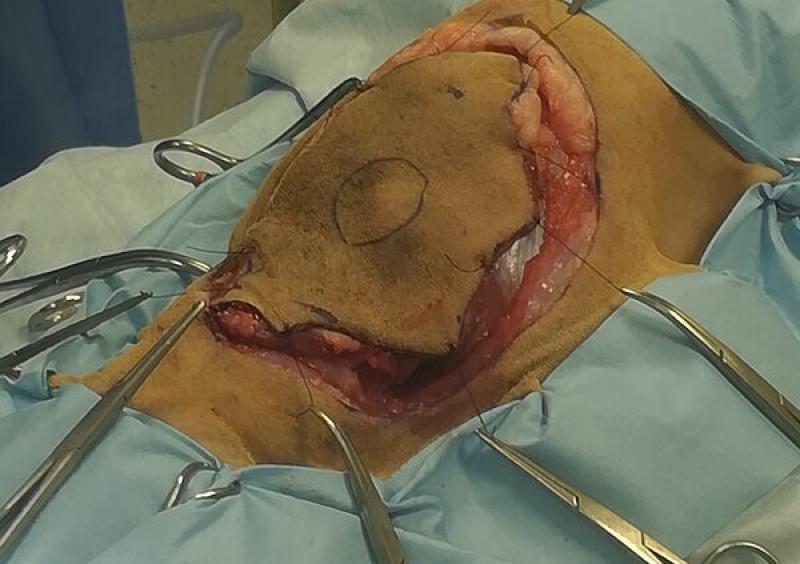
El comportamiento biológico de los sarcomas de tejidos blandos depende de su grado histológico, clasificándose en sarcomas de grado 1 (grado bajo), grado 2 (intermedio) y grado 3 (alto). Establecer el grado histológico mediante una biopsia previa a la cirugía es importante ya que la tasa de metastatización de estos tumores difiere significativamente, siendo menor del 13 % en perros con tumores de grados 1 y 2, y de hasta un 44 % en perros con sarcomas de tejidos blandos de grado 3. Esta tasa de metastatización en gatos es del 14-20 %4. - Sarcoma felino asociado a inyecciones: el sarcoma felino asociado a inyecciones es uno de los tumores más agresivos localmente, por lo que los márgenes quirúrgicos recomendados en la resección de este tipo de tumores son mayores (Figura 6a, 6b, 6c). La mayoría de estos sarcomas asociados a inyecciones son fibrosarcomas, y tienen una distribución de su grado histológico diferente a otros sarcomas de tejidos blandos, siendo el 20-50 % de grado 2 y el 25-75 % de grado 34. Asimismo, presentan una tasa de metastatización de hasta un 24 %4. La resección completa histológica está asociada con un mejor pronóstico a la hora de la recidiva y un mayor intervalo libre de la enfermedad. En la actualidad se recomienda la resección del tumor con 5 cm de margen lateral y dos planos fasciales en profundidad, que en ocasiones puede implicar una resección en profundidad que incluya el borde dorsal de las escápulas y/o de parte de las apófisis espinosas de las primeras vértebras torácicas.
- Carcinoma de células escamosas (SCC): este tumor cutáneo representa hasta un 15 % de los tumores cutáneos en perros y entre un 15-49 % de los tumores cutáneos en gatos4. Estos tumores se clasifican según su grado de diferenciación celular en pobre, moderado y bien diferenciados. El tipo de tratamiento recomendado para este tipo de tumor dependerá de su tamaño y de su grado de invasión local. Así, mientras en tumores de mayor tamaño se plantea principalmente un tratamiento quirúrgico, en tumores de pequeño tamaño se ha descrito también el tratamiento con técnicas no quirúrgicas (crioterapia, radioterapia, terapia fotodinámica, etc.). El pronóstico depende de la localización del tumor y de la posibilidad de obtener una resección quirúrgica con márgenes amplios, ya que se considera un tumor agresivo localmente pero que tarda en metastatizar. Se recomienda realizar escisiones amplias al tratar quirúrgicamente estos tumores cutáneos en perros, con un mínimo de 2 cm de márgenes laterales tanto en tumores localizados en el plano nasal como en otras localizaciones del cuerpo. En gatos es frecuente que este tumor esté localizado en la oreja, párpados o en el plano nasal, y el tratamiento quirúrgico de elección será una pinectomía (parcial o total) con un mínimo de 1 cm de margen quirúrgico, una resección local palpebral con 4-5 mm de margen quirúrgico o una resección del plano nasal con un mínimo de 5 mm de márgenes quirúrgicos16.
Interpretación histopatológica y limitaciones técnicas
Se recomienda enviar todos los tumores extirpados para un estudio histopatológico de manera rutinaria. La descripción histológica sobre la escisión tumoral se utiliza para confirmar el tipo y grado histológico de tumor, para determinar el riesgo de recidiva y el posible requerimiento posoperativo de tratamientos adyuvantes (principalmente quimioterapia o radioterapia) o de una segunda intervención quirúrgica. Factores como el tipo y tamaño de tumor, el ratio mitótico y el grado de invasión tisular ayudan a determinar el riesgo de recidiva del tumor. Asimismo, el estudio histológico nos determinará si el proceso quirúrgico ha sido exitoso (en cuanto a la obtención de márgenes quirúrgicos libres de células tumorales).
Histológicamente, la existencia de células tumorales en los márgenes quirúrgicos se define como márgenes incompletos. Sin embargo, la definición de márgenes completos sigue siendo controvertida. En los últimos años se ha considerado que, en tumores cutáneos y subcutáneos, aquellas resecciones en que las células tumorales estén a menos de 3 mm del borde quirúrgico se denominarían resecciones estrechas o cercanas, mientras que si se encontraban a más de 3-5 mm se denominarían resecciones amplias o completas17. Existen factores técnicos que influyen en la interpretación de los márgenes quirúrgicos. Varios estudios han descrito una reducción en los márgenes quirúrgicos entre la escisión del tumor y la evaluación histopatológica tanto en perros como en gatos18,19. Esta reducción de márgenes quirúrgicos se ha atribuido a la contracción tisular y a la infiltración microscópica de los márgenes quirúrgicos por células tumorales. La contracción del tejido es probablemente el problema técnico más estudiado y descrito hasta el momento. Esta contracción del tejido ocurre de manera principal inmediatamente tras la escisión, y se debe a la contracción de miofibrillas y la elasticidad tisular al separar el tejido afectado de las estructuras adyacentes. En un estudio retrospectivo intraoperatorio en mastocitomas cutáneos y subcutáneos, se observó una reducción de tejido libre de células tumorales entre un 35 y un 42 %18,20, mientras que en otro estudio evaluando mastocitomas y sarcomas de tejidos blando se observó una reducción en los márgenes quirúrgicos de hasta 8 mm y 5 mm respectivamente18. Recientemente se ha publicado la guía del consenso para la evaluación de márgenes quirúrgicos donde los márgenes histológicos libres de células tumorales (histologic tumour-free margin (HTFM)) deben describirse tanto cuantitativa como cualitativamente y se deben evitar términos como márgenes limpios, sucios, cercano o amplio18.
Las muestras examinadas en histopatología son una representación de la muestra total, y solo se examina una fracción muy pequeña de la misma21. La comunicación con el patólogo es fundamental para valorar la muestra enviada para histopatología, indicando cuales son los márgenes quirúrgicos para evaluar. Algunos cirujanos colocan suturas en el tejido retirado para mantener las capas de tejido en su posición anatómica. A su vez estas suturas ayudarán a una mejor descripción de la localización del tejido y los márgenes de escisión a evaluar. La aplicación de tinta en los bordes también ayuda a la orientación del tejido y a su vez delimita el verdadero margen de escisión. Para una buena identificación se recomienda no utilizar los colores rosa y morado ya que se pueden confundir con la tinción de hematoxilina y eosina. Otros cirujanos prefieren colocar suturas en zonas donde sospechan que hay presencia de lesión microscópica, para que el patólogo las examine con más detenimiento, o incluso enviar de manera independiente muestras de tejido de las zonas de interés.
Márgenes incompletos en mastocitomas y sarcomas de tejidos blandos
La presencia de márgenes incompletos es normal en cirugías intracapsulares y en cirugías marginales. Sin embargo, en una cirugía de intención curativa indica que no se ha conseguido el propósito de la cirugía. En cualquier caso, la presencia de márgenes incompletos en histología indica que la escisión quirúrgica no ha sido completa y por tanto existe riesgo de recidiva local del tumor. El riesgo de recidiva local de tumores resecados con márgenes incompletos varía en función del tipo tumor y su grado histológico. Este riesgo se ha estudiado principalmente en mastocitomas y en sarcomas de tejidos blandos.
En mastocitomas se ha descrito una tasa de recidiva local tras cirugía con resecciones incompletas de entre un 18 y un 38 %22,23,24. En el caso de sarcomas de tejidos blandos, varios estudios25,26 han reportado la tasa de recidiva tumoral después de realizar una resección marginal, siendo esta tasa del 7 % en sarcomas de grado bajo, del 34 % en tumores de grado intermedio, y del 75 % en sarcomas de grado alto26. Estas tasas de recidivas locales en presencia de márgenes incompletos sugieren que realizar un tratamiento adyuvante o una reintervención quirúrgica no es siempre necesario23,24.
De manera similar, se han realizado estudios investigando la presencia de células tumorales en reintervenciones realizadas a pacientes con mastocitomas y sarcomas de tejidos blandos en los que se habían detectado márgenes incompletos tras la cirugía inicial. En estos estudios, al analizar la cicatriz y la zona de la cirugía previa se encontraron células tumorales residuales en el 27 % de las cirugías en mastocitomas24, y en un 22 % de las cirugías en sarcomas de tejidos blandos27.
Se ha investigado el uso de tratamientos adyuvantes en casos de tumores resecados de manera incompleta. Un estudio en mastocitomas28 demostró que existe un beneficio en realizar un tratamiento adyuvante en casos de márgenes quirúrgicos incompletos, y que el tiempo medio de supervivencia de los pacientes fue muy superior cuando se realizaba una reintervención quirúrgica (2930 días) o se realizaba un tratamiento con radioterapia (2194 días), comparado con aquellos casos en los que no se administraba ningún tratamiento adyuvante (710 días). En este mismo estudio la tasa de recidiva local fue de un 13 % en pacientes que fueron reintervenidos, un 8 % en pacientes que recibieron radioterapia y un 38 % en pacientes que no recibieron tratamiento adyuvante28. El uso de quimioterapia de forma adyuvante tras una cirugía se ha recomendado en mastocitomas con una alta tasa de metastatización (tumores de grado 3 y tumores de grado 2 con características de malignidad altas)8.
Se ha descrito también la administración de un tratamiento de radioterapia adyuvante en casos con escisiones incompletas de sarcomas de tejidos blandos, con unas tasas de supervivencia a los 1, 3 y 5 años del tratamiento del 80-87 %, del 61-81 % y del 76 % respectivamente14,29, un tiempo medio de supervivencia de 2270 días30, una tasa de recidiva local tras el tratamiento del 17-21 %29,31,32 y con un 8-23 % de los pacientes desarrollando metástasis29,32. El uso de quimioterapia como tratamiento adyuvante en sarcomas de tejidos blandos resecados de manera incompleta no está claro14 con algunos estudios demostrando que su uso no está justificado33. Otros estudios sin embargo han sugerido que el uso de quimioterapia metronómica es beneficiosa para prevenir recidivas y aumentar los tiempos libres de enfermedad en pacientes con sarcomas de tejidos blandos resecados de forma incompleta34. La mayoría de las veces se utiliza quimioterapia como tratamiento adyuvante únicamente en sarcoma de tejidos blandos de grado alto35.
En resumen, en caso de mastocitomas el tratamiento adyuvante parece ser beneficioso cuando se han obtenido márgenes incompletos. En casos de sarcomas de tejidos blandos resecados de manera incompleta existe un debate en cuanto a la necesidad de realizar este tratamiento adyuvante, e incluso en cuanto al tipo de tratamiento recomendado (reintervención quirúrgica o radioterapia local). La decisión sobre como afrontar estos casos se debe tomar de manera individualizada para cada paciente, teniendo en cuenta factores como la naturaleza biológica del tumor (tipo y grado histológico), la localización de este y las consideraciones del propietario.
Conclusión
El tratamiento quirúrgico sigue siendo clave en el tratamiento del paciente oncológico. Es necesario conocer la naturaleza biológica del tumor para poder establecer así la extensión de nuestra cirugía, y alcanzar los objetivos que persigamos con la intervención quirúrgica. Respetar los márgenes quirúrgicos recomendados para cada tumor es esencial para maximizar las probabilidades de éxito en la cirugía de intención curativa.
Bibliografía
- Farese JP, Bacon NJ, Liptak JM, Know K; Introduction to Oncologic Surgery for the General Surgeon; in Veterinary surgery small animal; Karen M.Tobias, Spencer A. Johnston, 2018 by Elsevier, Inc; pp 325-345.
- Milovancev M, Russell DS; Surgical margins in the veterinary cancer patient; in Veterinary and Comparative Oncology; 2017 by John Wiley & Sons Ltd; pp 1136-1157.
- Kudnig ST, Seguin B; Principles of Surgical Oncology; in Veterinary Surgical Oncology; 2012 by Wiley-Blackwell; pp 6-10
- Nimwegen SA, Kirpensteijn J; Specific disorders of the skin and subcutaneous tissue; in Veterinary surgery small animal; Karen M.Tobias, Spencer A. Johnston, 2018 by Elsevier, Inc; pp 1508-1550.
- Patnaik AK,Ehler WJ,MacEwen EG:Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 dogs.Vet Pathol.21:4691984.
- Simpson AM, Ludwig LL, Newman SJ, Bergman PJ, Hottinger HA, Patnaik AK. Evaluation of surgical margins required for complete excision of cutaneous mast cell tumors in dogs.J Am Vet Med Assoc. 2004;224(2):236–240.
- Kiupel M,Webster JD, Bailey KL, et al.:Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior.Vet Pathol.2011; 48:147-155.
- Warland J, Valentina B, Owen L, Dobson J. Canine mast cell tumours: decision-making and treatment. In Practice, 2015; 37(7), 315–332.
- Pratschke KM,Atherton MJ,Sillito JA, et al.:Evaluation of a modified proportional margins approach for surgical resection of mast cell tumors in dogs: 40 cases (2008-2012).J Am Vet Med Assoc.2013; 243:1436-1441.
- Saunders H, Thomson MJ, O'Connell K, Bridges JP, Chau L.Evaluation of a modified proportional margin approach for complete surgical excision of canine cutaneous mast cell tumours and its association with clinical outcome.Vet Comp Oncol.2020; 1–12.
- Gill V, Leibman N, Monette S, Craft D, Bergman P.Prognostic Indicators and Clinical Outcome in Dogs with Subcutaneous Mast Cell Tumors Treated with Surgery Alone: 43 Cases. Journal of the American Animal Hospital Association, JAAHA, 2020; 56(4), 215-225.
- Thompson, J. J.; Pearl, D. L.; Yager, J. A.; Best, S. J.; Coomber, B. L.; Foster, R. A.Canine Subcutaneous Mast Cell Tumor: Characterization and Prognostic Indices. Veterinary Pathology, 2011; 48(1), 156–168.
- Newman SJ, Mrkonjich L, Walker KK, et al. Canine subcutaneous mast cell tumour: diagnosis and prognosis. J Comp Pathol 2007;136: 231–9.
- Bray , J. P . Soft tissue sarcoma in the dog – part 1: a current review . Journal of Small Animal Practice. 20016; 57, 510 - 519 .
- Bray, J. P. Soft tissue sarcoma in the dog - Part 2: surgical margins, controversies and a comparative review. Journal of Small Animal Practice, 2017; 58(2), 63–72.
- Murphy, S.Cutaneous Squamous Cell Carcinoma in the Cat: Current understanding and treatment approaches. Journal of Feline Medicine and Surgery, 2013; 15(5), 401–407.
- Dennis MM,McSporran KD,Bacon NJ, et al.:Prognostic factors for cutaneous and subcutaneous soft tissue sarcomas in dogs.Vet Pathol.2011; 48:73-84.
- Milovancev, M, Russell, DS.Surgical margins in the veterinary cancer patient. Vet Comp Oncol2017; 15:1136–1157.
- Terry JL, Milovancev M, Nemanic S, Löhr CV. Quantification of surgical margin length changes after excision of feline injection site sarcomas—a pilot study. Vet Surg. 2017; 46:189-196.
- Risselada M, Mathews KG and Griffith E. Surgically planned versus histologically measured lateral tumor margins for resection of cutaneous and subcutaneous mast cell tumors in dogs: 46 cases (2010 – 2013).; Journal of the American Veterinary Medical Association; 2015; pp 184 – 189.
- Kopke L, Bastos J, Filho J, et al. Safety margin—an old and relative concept. An Bras Dermatol 2005; 80:279–286.
- Michels GM, Knapp DW, DeNicola DB, Glickman N and Bonney P.; Prognosis following surgical excision of canine cutaneous mast cell tumors with histopathologically tumor-free versus nontumor-free margins: a retrospective study of 31 cases; Journal of the American Animal Hospital Association; 2002; pp 458-466.
- Seguin B, Besancon MF, McCallan JL, Dewe LI, Tenwolde MC, Wong EK, et all; Recurrence rate, clinical outcome, and cellular proliferation indices and prognostic indicators after incomplete surgical excision of cutaneous grace II mast cell tumors: 28 dogs; Journal of Veterinary Internal Medicine; 2006; pp 933-940.
- Karbe. Evaluation of scar revision after inadequate primary excision of cutaneous mast cell tumors in 85 dogs (2000–2013). Vet Surg. 2021; 50(4): 807-815.
- Stefanello D,Morello E,Roccabianca P, et al.:Marginal excision of low-grade spindle cell sarcoma of canine extremities: 35 dogs (1996-2006).Vet Surg.2008; 37:461.
- McSporran K:Histologic grade predicts recurrence for marginally excised canine subcutaneous soft tissue sarcomas.Vet Pathol.2009;466:928-933.
- Bacon NJ, Dernell WS, Ehrhart N, Powers BE, Withrow SJ.Evaluation of primary re-excision after recent inadequate resection of soft tissue sarcomas in dogs: 41 cases (1999–2004). Journal of the American Veterinary Medical Association, 2007; 230(4), 548–554.
- Kry KL,Boston SE.Additional local therapy with primary re-excision or radiation therapy improves survival and local control after incomplete or close surgical excision of mast cell tumors in dogs.Vet Surg.2014;43:182-189.
- Mcknight, J. A., Mauldin, G. N., Mcentee, M. C., et al. Radiation treatment for incompletely resected soft-tissue sarcomas in dogs. Journal of the American Veterinary Medical Association, 2000; 217, 205-210.
- Forrest, L. J., Chun, R., Adams, W. M., et al. Postoperative radiotherapy for canine soft tissue sarcoma. Journal of Veterinary Internal Medicine, 2000; 14, 578-582.
- Demetriou, J. L., Brearley, M. J., Constantino-Casas, F., et al. Intentional marginal excision of canine limb soft tissue sarcomas followed by radiotherapy. Journal of Small Animal Practice 2012; 53, 174-181.
- KungMBJ,PoirerVJ,DennisMM, et al.Hypofractionated radiation therapy for the treatment of microscopic canine soft tissue sarcoma.Vet Comp Oncol2016;14:e135–e145.
- Selting, K. A., Powers, B. E., Thompson, L. J., et al. Outcome of dogs with high-grade soft tissue sarcomas treated with and without adjuvant doxorubi cin chemotherapy: 39 cases (1996-2004). Journal of the American Veterinary Medical Association, 2005; 227, 1442-1448.
- Elmslie, R. E., Glawe, P. & Dow, S. W. Metronomic therapy with cyclophosphamide and piroxicam effectively delays tumor recurrence in dogs with incompletely resected soft tissue sarcomas. Journal of Veterinary Internal Medicine, 2008; 22, 1373-1379.
- Matz, Brad M.Current Concepts in Oncologic Surgery in Small Animals. Veterinary Clinics of North America: Small Animal Practice, 2015; 45(3), 437–449.
 by Multimédica
by Multimédica