Principales medios para el control de la hemostasia quirúrgica en pequeños animales
Resumen breve
La hemostasia quirúrgica es el conjunto íntimo de procesos que mantienen el flujo sanguíneo de manera simultánea a la respuesta trombótica que se produce ante el desarrollo de una lesión vascular asociada al procedimiento quirúrgico1, presentando relevancia durante el periodo perioperatorio ya que se trata de un mecanismo de defensa que junto con la respuesta inflamatoria protege la integridad del sistema vascular después de una lesión tisular y por tanto presenta una influencia notable…Índice de contenidos

Resumen
La hemostasia quirúrgica es el conjunto íntimo de procesos que mantienen el flujo sanguíneo de manera simultánea a la respuesta trombótica que se produce ante el desarrollo de una lesión vascular asociada al procedimiento quirúrgico1, presentando relevancia durante el periodo perioperatorio ya que se trata de un mecanismo de defensa que junto con la respuesta inflamatoria protege la integridad del sistema vascular después de una lesión tisular y por tanto presenta una influencia notable sobre el pronóstico de nuestros pacientes, generando las anomalías en este conjunto de procesos, repercusiones negativas que van desde el impacto sobre la técnica quirúrgica al reducirse la visibilidad del campo quirúrgico, al incremento del riesgo de infección, y el retraso en la cicatrización al interferir con el soporte sanguíneo tisular, así como la deficiente aposición de los tejidos, o la inhibición de sistema fagocítico mononuclear, presentando como últimas consecuencias el desarrollo de shock, hipoxia y parada cardiorrespiratoria.
Esta revisión científica trata de indagar en aquellas técnicas que permitan controlar el sangrado perioperatorio, así como establecer una óptima hemostasia quirúrgica, tal y como determinan los principios de Halstead, centrándose en los aspectos clave del uso de pinzas hemostáticas, ligadura no convencional (p. ej., hemoclips), electrobisturí, láser u otras como el uso de diversos sistemas hemostáticos (p. ej., gelatina o colágeno) o agentes sistémicos, basándose su elección en el tipo de sangrado, el procedimiento quirúrgico y la disponibilidad de los mismos.
Introducción
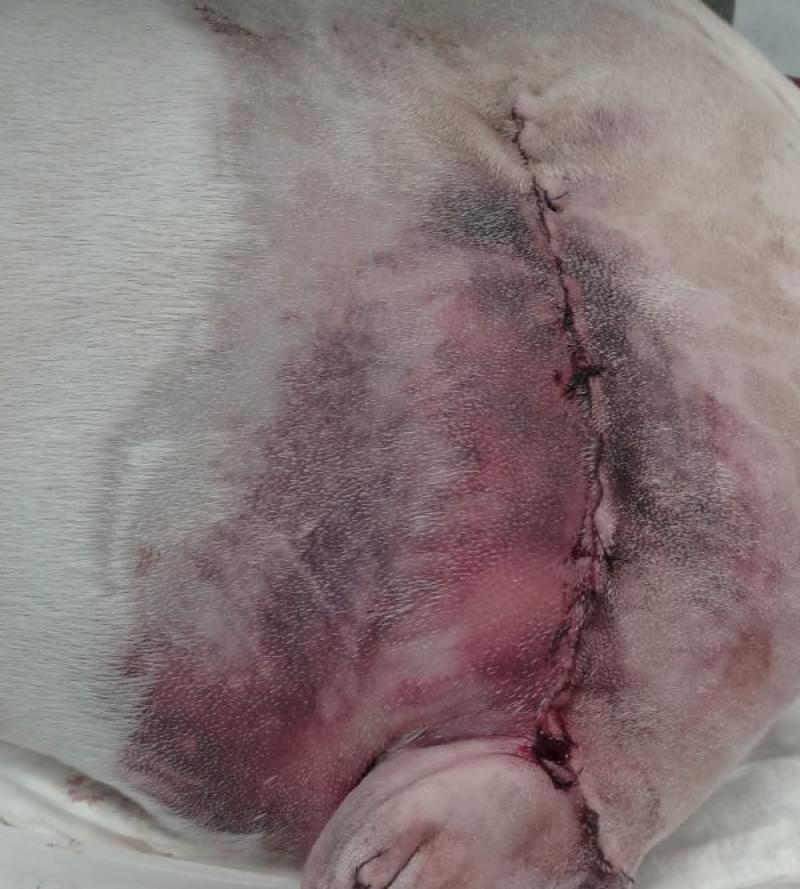
A pesar de los continuos avances en el desarrollo de técnicas quirúrgicas, la pérdida de sangre continúa siendo uno de los problemas a los que el cirujano se enfrenta con mayor frecuencia, afectando esta situación de distinto modo a cada paciente y viéndose ampliamente influenciada por la presencia de enfermedades concomitantes o de otros factores como la hipotermia perioperatoria, la hemodilución y la acidosis2, o situaciones clínico-quirúrgicas como la presencia de adhesiones durante reintervenciones, hemorragia capilar difusa, presencia de tejidos friables (p. ej., cirugía oncológica), o sangrado a nivel óseo, resultando en muchos casos insuficientes las técnicas convencionales para controlar tales pérdidas3 y generando consecuencias variables tanto a corto como a largo plazo para el animal entre las que se incluyen un amplio abanico de complicaciones, desde leves como la aparición de hematomas (Figura 1), al desarrollo de síndrome de inflamación respuesta sistémica (SIRS) y fallo multiorgánico que pueden resultar deletéreos y letales en nuestros pacientes.
Mientras que la tasa de incidencia intraoperatoria de hemorragias en pequeños animales se encuentra entre el 7 y el 79 % en cirugía abdominal4 y en el 3 % en el periodo postoperatorio5, en medicina humana se ha determinado una tasa de mortalidad de hasta el 42 % en pacientes con pérdidas de sangre considerable6, lo que junto al aumento de costes relacionados con la hospitalización y la administración de hemoproductos7,8, lo convierte en un problema de importancia extrema sobre el que establecer una serie de medidas estratégicas tanto a nivel preventivo como ante el desarrollo inesperado de una hemorragia activa.
Hemostasia. Breve recuerdo
El conocimiento de los mecanismos de hemostasia resulta fundamental para el manejo y estabilización de los pacientes que van a ser sometidos a un procedimiento quirúrgico, ya que se precisa de una interacción compleja entre la pared del vaso, la cascada de la coagulación y sistemas fibrinolíticos9,10, siendo el estímulo desencadenante de su activación la lesión del endotelio vascular11.
En aquellos casos en los que se produce lesión vascular, se generará una vasoconstricción en el vaso afectado que obliterará temporalmente el lumen, permitirá la adhesión plaquetaria y su activación que se produce ante la unión de las plaquetas al colágeno del subendotelio vascular tras la lesión en la pared a través de la glicoproteína Ib/IX de la membrana plaquetaria mediante la acción del factor von Willebrand que actúa como puente, formándose ante la agregación plaquetaria subsiguiente el tapón plaquetario temporal que presentará una baja resistencia11, y que posteriormente se transformará en el coágulo definitivo y estable, ante la producción de fibrina, estabilizando el tapón anteriormente formado dando lugar a un plug hemostático secundario, que será capaz de mantener la perfusión del vaso afectado conforme se reduce la vasoconstricción.
Dicha vasoconstricción, junto con la reducción del flujo sanguíneo se mantendrá debido a la secreción de serotonina, prostaglandinas y tromboxanos, en lo que la cascada de coagulación realiza su intervención mediante una serie de mecanismos y reacciones en las que se encuentran involucradas proteínas plasmáticas, plaquetas e iones como el calcio que producirán la conversión de fibrinógeno a fibrina11.
Los factores de coagulación se producen en el hígado, circulando en sangre de manera inactiva en condiciones fisiológicas en las que no se produce lesión endotelial, desencadenándose la activación seriada de los mismos mediante reacciones dependientes de dichos factores en caso de lesión vascular produciendo como consecuencia la transformación de fibrinógeno en fibrina mediante la acción de la trombina que mejorará la estabilidad del coágulo al generarse enlaces covalentes entre los monómeros de fibrina.
La homeostasis de este sistema se mantiene mediante un entramado fisiológico que depende fundamentalmente de interacciones multifactoriales entre el endotelio vascular, las plaquetas, el tono vascular, el flujo sanguíneo, la coagulación y la fibrinolisis.
Importancia de la hemostasia en el periodo perioperatorio
Durante el acto quirúrgico existen muchos factores que pueden incrementar la susceptibilidad del paciente al desarrollo de hemorragias12-14 (Tabla 1), por lo que se han de adoptar aquellas medidas que disminuyan su incidencia y magnitud desde la correcta aplicación de los principios de Halstead (Tabla 2), al uso de aquellas técnicas de hemostasia y medidas preventivas que permitan establecer un equilibrio dinámico entre el sangrado y la coagulación que además contribuirán de manera indirecta mejorando la visualización de la zona, acortando el tiempo quirúrgico, y disminuyendo el riesgo de infecciones quirúrgicas (fundamentalmente ante la disminución del tiempo quirúrgico, de la hipotermia asociada a la anestesia, y del sangrado intrínseco), evitando los potenciales riesgos ante la administración de hemoderivados15-18.
| Tabla 1. Principales factores implicados en el sangrado intraoperatorio. |
|
Modificado de: Mokirawa T. Tissue Sealing. American Journal of Surgery. 2001;182(2 Suppl):29S-35S.
| Tabla 2. Principios de Halstead (1911). |
|
La citada hipotensión intraoperatoria puede disminuir la precisión del cirujano a la hora de detectar el foco de sangrado fomentando además el uso incorrecto de técnicas de hemostasia, mientras que tanto la hipotermia como la acidosis pueden disminuir las reacciones enzimáticas afectando de manera notable al proceso de coagulación2, lo que podría incrementar el riesgo de hemorragia tardía, que generalmente se producen en las 24 horas posteriores a la intervención, siendo normalmente consecuencia directa de la hemostasia ineficaz (p. ej., ligaduras sueltas, daño vascular sobrevenido, necrosis de los vasos cauterizados) o debido a una formación de un coágulo aberrante incapaz de cumplir su cometido en todo este proceso.
Principales métodos, mecanismos y medios destinados al control de la hemorragia intraoperatoria
Existen múltiples opciones para el control del sangrado, entre las que encontramos las técnicas mecánicas y térmicas, así como los agentes tópicos y la terapia farmacológica (Tabla 3), no siendo objeto de la presente revisión los torniquetes, la ligadura convencional, sellantes ni adhesivos tisulares.
| Tabla 3. Principales medios de hemostasia en cirugía veterinaria. |
| Tipo | Técnica |
| Técnicas mecánicas |
|
| Técnicas térmicas |
|
| Técnicas farmacológicas |
|
| Miscelánea |
|
a) Medios mecánicos
a.1) Hemostasia por compresión y relleno de cavidades
La compresión directa en el lugar de sangrado constituye la primera opción para el control del sangrado (p. ej., mediante la presión con gasas tras la incisión cutánea o durante el cierre de una laparotomía) resultando de utilidad en vasos de pequeño calibre en pacientes sin anomalías en la coagulación, habiendo de evitar en la medida de lo posible la fricción que causa la aplicación del material textil con la finalidad de evitar la abrasión iatrogénica, el consecuente daño tisular y el desprendimiento de los coágulos, siendo la base tanto de la hemostasia por relleno de cavidades como de los vendajes por compresión.
a.2) Pinzas hemostáticas
Las pinzas hemostáticas constituyen una herramienta fundamental a la hora de realizar angiotripsia temporal, generando una lesión sobre el endotelio vascular que produce la activación de los mecanismos fisiológicos de la coagulación anteriormente descritos, resultando eficaz e incluso definitiva en vasos de muy pequeño calibre, no constituyendo un método útil en vasos de mediano o gran calibre y en la que el tiempo hasta la formación del coágulo depende no solo del diámetro de dichos vasos, si no de la presión sanguínea, o de la ausencia de anomalías en la coagulación.
A pesar de que existen múltiples variedades de fórceps, los mosquitos Halsted son los más comúnmente usados para pequeños vasos, mientras que otros como los Crile, Rochester, Carmalt y Ochsner se utilizan para el control del sangrado en vasos mayores previamente a la utilización de un método de hemostasia definitivo (Tabla 4).
| Tabla 4. Principios de utilización de pinzas hemostáticas. |
|
Estos instrumentos podrían no resultar apropiados en casos de sangrado de difícil acceso o identificación, hemorragia en sábana, la administración de anticoagulantes previamente a la cirugía, coagulopatía relacionada con el paciente, el proceso quirúrgico o anestésico8,14.
a.3) Clips vasculares
Los clips vasculares de titanio, acero inoxidable, material polimerizado absorbible o no absorbible son unidades individuales de grapas en forma de V disponibles en varios tamaños que requieren de un aplicador, ideales para la oclusión de vasos sangrantes con un radio de 1 mm, siendo capaces de ocluir vasos de hasta 5 mm de diámetro, presentando ventajas como la aplicación rápida, la colocación en zonas inaccesibles donde las estructuras anexas no permiten el uso de métodos como la sutura convencional o destinándose a su utilización como perímetro quirúrgico en un área quirúrgica de excisión tumoral20,21 para planificar tratamientos posteriores22 (p. ej., radioterapia), no estando exentas de desventajas entre las que se encuentran su mayor potencial de deslizamiento o desprendimiento de la vasculatura en comparación con la sutura convencional23, siendo generalmente necesario aplicar más de un hemoclip en aquellos casos en los que la dificultad técnica o el tamaño constituyan un handicap a nivel quirúrgico pudiendo en limitadas ocasiones y a pesar de ser un material inerte, comportarse como cuerpo extraño20,21.
Para su aplicación y fundamentalmente con el objetivo de prevenir el deslizamiento, se recomienda cumplir los principios de aplicación de hemoclips (Tabla 5), estando indicados tanto en cirugía laparoscópica y torascoscópica, como en procedimientos abiertos en tórax24,25 y abdomen (p. ej., la ligadura del conducto arterioso persistente26,27), siendo posible la utilización de clips no metálicos de naturaleza polimérica en aquellos casos en los que se requieran de una mayor resistencia ante fuerzas externas o la presión intravascular28 o bien la ausencia de interferencia en el resultado de métodos de diagnóstico complementario (p. ej., la resonancia magnética nuclear o la tomografía axial computadorizada).
| Tabla 5. Principios de aplicación de hemoclips |
|
b) Mecanismos térmicos
Producen un incremento de la temperatura ante la transducción de energía hacia los tejidos, que da lugar a la contracción de las paredes vasculares y del tejido periférico con la consecuente formación del coágulo, produciéndose inflamación y edema en torno a 34°C, la inactivación enzimática en torno a los 45°C y la desnaturalización de las proteínas, con la consecuente coagulación tisular a temperaturas mayores de 60°C, generándose una lesión sobre los eritrocitos que provocará la quimiotaxis plaquetaria ocurriendo la lisis de la membrana celular a temperaturas de en torno a 100°C, desecándose los tejidos a consecuencia de la evaporación.
b.1) Electrocoagulación
La incorporación en los últimos años del bisturí eléctrico ha constituido un verdadero avance en cirugía veterinaria, ya que permite obtener una hemostasia definitiva con un bajo impacto sobre la cicatrización, disminuyendo el tiempo quirúrgico y las pérdida de sangre, aunque presentan sus inconvenientes, siendo su uso extremamente dificultoso o ineficaz en vasos friables, superficies óseas, tejidos parenquimatosos o en aquellos órganos que contengan múltiples capilares difusos pudiendo provocar hemorragias secundarias o quemaduras térmicas en aquellos casos en los que se utilice de manera incorrecta, así como retraso en el tiempo de cicatrización, produciendo un incremento en el riesgo de infección de la herida.
En todo caso, el flujo de corriente de alta frecuencia a través de los tejidos dará lugar a un efecto térmico que permitirá cortar o coagular los tejidos y vasos, y en la que el modo de coagulación se producirá ante la administración de ondas discontinuas que generarán una elevación de la temperatura, la deshidratación y el estrechamiento de arterias menores de 1 mm y venas menores de 2 mm de diámetro y la oclusión del lumen por trombosis30,31.
La coagulación monopolar es el modo más comúnmente utilizado en cirugía veterinaria y es el resultado del flujo de corriente desde el punto de disección-coagulación (electrodo activo) a través del cuerpo del paciente a un electrodo neutro colocado en contacto con el cuerpo del paciente, generando una lesión controlada únicamente la zona de aplicación del bisturí eléctrico.
Aunque su precisión y efectividad son elevadas, la coagulación monopolar presenta desventajas como el riesgo de desarrollo de quemaduras accidentales a distancia del punto de aplicación del electrodo, así como el límite de coagulación establecido.
Mientras, en la coagulación bipolar la corriente pasa de una punta de la pinza a través del tejido hacia la punta de la pinza opuesta (Figura 3), habiendo de estar ambos electrodos en contacto con el tejido a coagular, por lo que en relación al modo monopolar el flujo de corriente es más corto y la seguridad del sistema mayor, al no precisar de un voltaje alto.
Además, esta produce hemostasia de pequeños vasos eficaz y rápida, sin paso de corriente a través del paciente y por tanto sin lesiones asociadas a la misma, siendo el sellado menos seguro, pudiéndose producir adhesión tisular a las palas, por lo que se recomienda la irrigación de estas durante su utilización.
b.2) Termofusión vascular y fusión tisular
Se trata de un dispositivo bipolar avanzado que permite el sellado de vasos mediante la compresión vascular a una fuerza constante, sobre la que se aplica un pulso de radiofrecuencia, con una potencia proporcional a la impedancia del tejido comprimido, generando una fusión de la elastina y el colágeno de manera permanente y la oclusión de vasos de hasta 7 mm en un ciclo de termofusión con una duración de entre 1 y 5 segundos, no superando la punta del dispositivo los 45 grados32, reduciendo el riesgo de lesiones tisulares colaterales en lo que respecta a otros métodos térmicos, así como el tiempo quirúrgico (Figura 4).
En la actualidad estas técnicas han evolucionado hacia la fusión tisular que confiere ventajas como la mayor velocidad del sistema, y la mayor flexibilidad, precisión y consistencia del sellado, habiéndose utilizado en cirugía veterinaria para la realización de ovariohisterectomías33, biopsia pulmonar asistida por toracoscopia34, adrenalectomías, tonsilectomías35, pericardiectomías, esplenectomía, timoma, pancreatectomía parcial36 o laparoscopia (Figura 5)
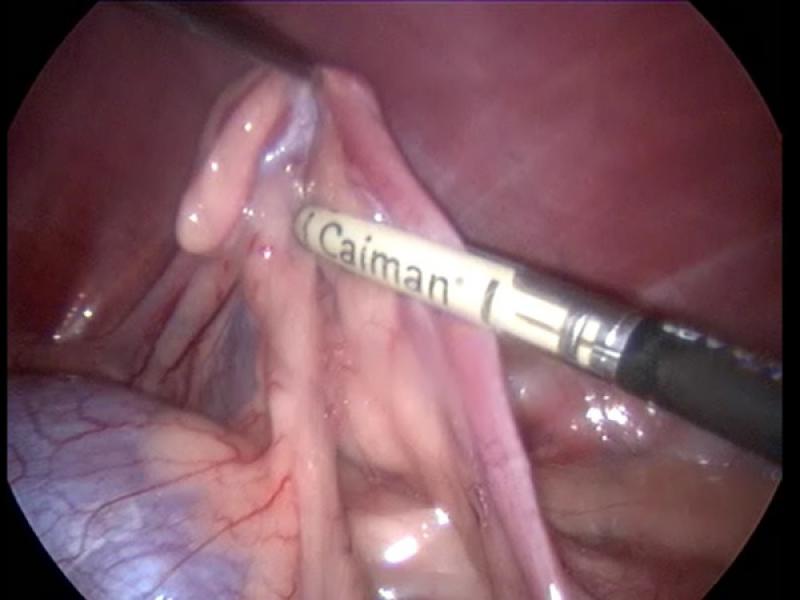
b.3) Laser quirúrgico
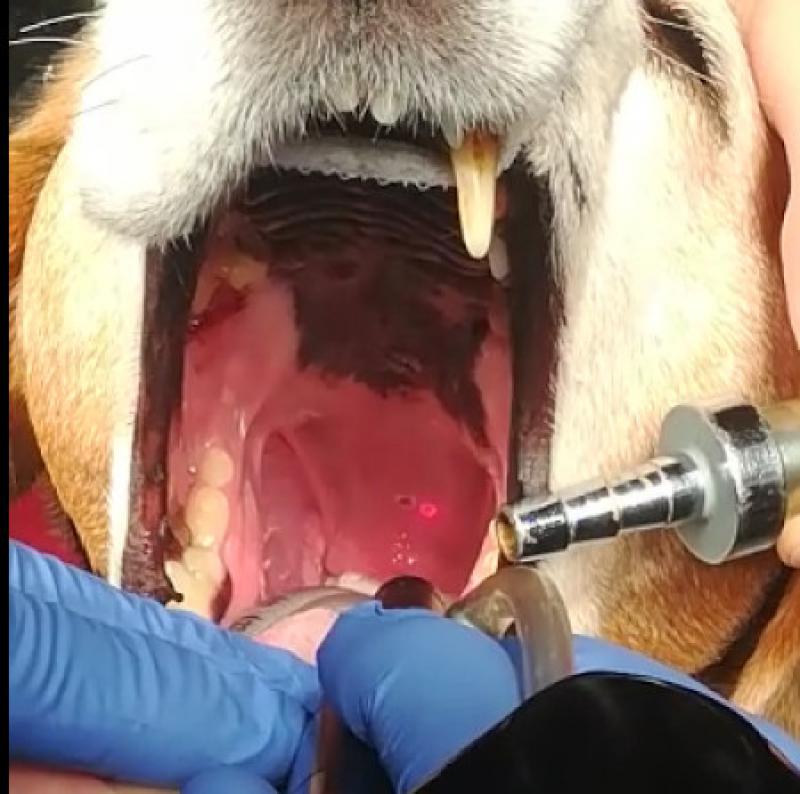
Se trata de la aplicación de un haz de fotones de manera intermitente y mediante pulsos cortos de energía, que interacciona con los tejidos generando un efecto fototérmico que permite tanto la exéresis como la coagulación tisular, siendo la penetración proporcional a la longitud de onda, e inversamente proporcional a la absorción.
La superficie del tejido seccionado se encontrará recubierta por tejido carbonizado, siendo el espesor de la capa constituida por el mismo determinado por la potencia, estimándose la profundidad de la necrosis térmica en alrededor de 0,7 mm, siendo una opción óptima en la exéresis de procesos cutáneos37 o en la cirugía de paladar blando38.
c) Hemostáticos tópicos
Se pueden aplicar de manera directa sobre el lugar de sangrado para prevenir la hemorragia capilar durante el periodo perioperatorio13, siendo su uso ideal en sangrado difuso con baja presión, evitando la presencia de efectos secundarios indeseables relacionados con la administración de medicación hemostática sistémica18,39-42.
Su utilización puede resultar notable en combinación con otros métodos en zonas de sección u órganos parenquimatosos, si bien algunos de ellos pueden incrementar el riesgo de infección bacteriana, por lo que se deben usar con cautela siendo ajustados en función de la superficie a tratar.
Los hemostáticos tópicos se clasifican en agentes activos, que actúan sobre las plaquetas y la cascada de coagulación, pasivos, que actúan como estructuras físicas que ejercen presión mecánica sobre la zona de sangrado y sirve como asiento para los factores de coagulación, o una combinación de los anteriores39-42.
En medicina humana, uno de los primeros agentes hemostáticos utilizados fue la esponja de algodón que permitía mantener la sangre y los productos de la coagulación mediante propiedades físicas como la absorción, si bien actuaban como un cuerpo extraño con una alta incidencia de hemorragia tardía, el avance de la infraestructura y materiales quirúrgicos y la apuesta de futuro por la cirugía laparoscópica ha hecho ganar relevancia a los hemostáticos tópicos con el desarrollo múltiples presentaciones, siendo las esponjas las más comúnmente utilizadas en cirugía veterinaria, encontrándose en desuso las presentaciones en polvo dada su alta carga electrostática y su fuerte adhesión a guantes e instrumental quirúrgico18.
La elección de estos depende de factores diversos como el tamaño de la herida, el acceso quirúrgico, la severidad del sangrado, siendo ideal escoger aquel que permita el rápido control del sangrado, su facilidad de aplicación, su estabilidad y su precio (Tabla 6).
| Tabla 6. Propiedades del hemostático tópico ideal. |
|
c.1) Hemostáticos tópicos pasivos
c.1.a) Celulosa oxidada regenerada
Contienen celulosa oxidada regenerada9,43 que inicia la coagulación ante la activación por contacto actuando como una barrera mecánica frente al sangrado9,14, presentando un pH moderadamente ácido que refuerza su capacidad como hemostático y le hace presentar actividad bacteriostática moderada44.
Generalmente presenta un tiempo de actuación entre 3 y 8 minutos en función del hemostático empleado y una reabsorción variable de entre 14 días y 6 semanas, siendo su biodegradabilidad dependiente de factores ambientales, así como de la cantidad utilizada y el lugar de implantación, permitiendo a diferencia de otros hemostáticos tópicos su uso en pequeñas cantidades en cirugía espinal19.
Los derivados de la celulosa oxidada regenerada se pueden cortar y moldear con la finalidad de adaptarlos a la zona a tratar ante su fácil manejo, ya que a pesar de mostrar una adhesión leve a los guantes quirúrgicos, esta no resulta significativa en el caso del material quirúrgico, situación por la que se indica su aplicación con pinzas de mano9,19,45.
Además, dado que su pH ácido inactiva la trombina, no ha de considerarse como agente hemostático de elección para la utilización junto a hemostáticos tópicos mixtos46,47, siendo su apariencia radiológica un factor a tener en cuenta ya que, en medicina humana, al igual que las gelatinas han mimetizado la apariencia de absceso en estudios de imagen realizados durante el postquirúrgico18,43.
c.1.b) Colágeno
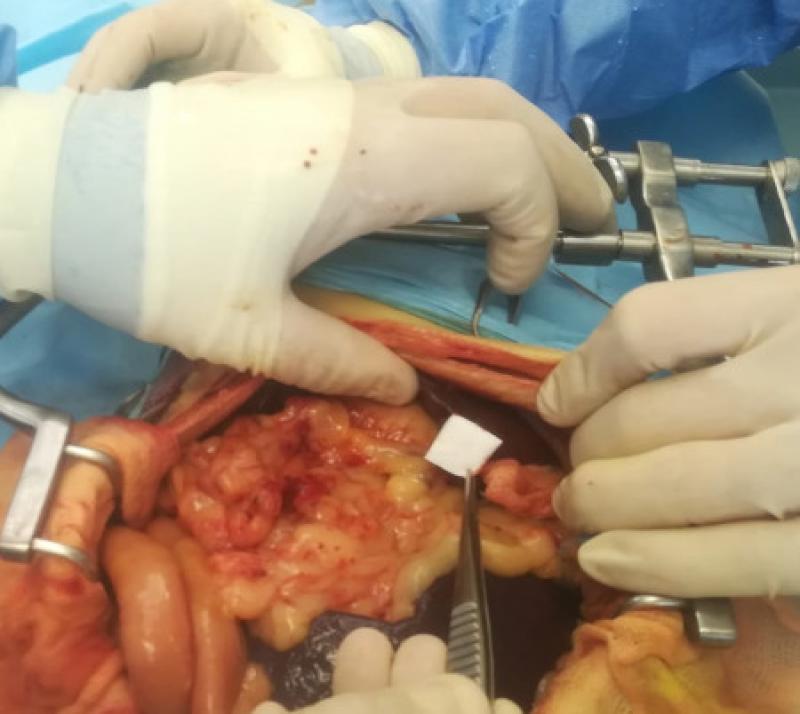
Las esponjas tópicas derivadas del colágeno bovino de tipo II, proveen de hemostasia no solo de tipo mecánica, si no a través de la activación por contacto y la actuación directa a nivel plaquetario que ocurre como resultado del contacto directo entre la sangre y el colágeno48-50, habiéndose determinado su superioridad como hemostático en lo que respecta a otros agentes pasivos en casos de trombocitopenia y función plaquetaria anormal en medicina humana.
Los derivados del colágeno bovino pueden causar reacciones inmunes o alérgicas en nuestros pacientes9,14, ya que, aunque no hay estudios al respecto en pequeños animales, en medicina humana hasta el 4% de los pacientes presentan reacciones alérgicas a sus componentes51, por lo que ha de ser un hecho a tener en cuenta a la hora de utilizarlas en la práctica diaria.
c.1.c) Gelatinas
Son estructuras porosas derivadas de la gelatina porcina, utilizadas en medicina humana desde mediados del siglo pasado que han adquirido de una importancia relativa en medicina veterinaria, al producir el taponamiento de capilares, promoviendo la agregación plaquetaria45 disminuyendo de manera notable la pérdida intraoperatoria de sangre18, habiéndose demostrado su potencial hemostático en modelos experimentales como laceración de la arteria aorta y cava, maxilectomías52, biopsia de tracto esplénico en perros53.
Estos compuestos presentan una capacidad de manejo moderada, adaptándose a zonas irregulares y adquiriendo un volumen considerable al contactar con la zona de sangrado, generando una matriz estable para la formación del coágulo14 que se absorbe en aproximadamente 5 semanas (en función de la cantidad utilizada, el lugar de implantación y otros factores inherentes a la herida), generando una reacción tisular mayor al de otros productos39,40, presentando ciertas desventajas como la adhesión errática a material impregnado en sangre, el desprendimiento de la zona de sangrado ante la falta de unión íntima con el vaso lesionado19, habiéndose determinado en el ser humano efectos adversos potenciales como el desarrollo de reacciones anafilácticas agudas o de fenómenos de hipersensibilidad tardía, pudiendo generarse granulomas o abscesos, habiéndose registrado un aumento del riesgo de sobrecrecimiento bacteriano por lo que no se recomienda su uso ante la sospecha de infección debiéndose utilizar la menor cantidad posible y en algunos casos retirarla una vez se ha conseguido la hemostasia ante la posibilidad de desarrollo de alguno o varios de los eventos anteriormente descritos.
En lo que respecta a la apariencia postoperatoria de las esponjas residuales tanto en ecografía como en resonancia magnética nuclear puede incrementar la posibilidad de interpretaciones erróneas pudiendo confundirse la persistencia de la esponja de gelatina con la recidiva de tumor o absceso postoperatorio en el ser humano18,54 por lo que es importante detallar la cantidad usada y la localización con la finalidad de evitar un diagnóstico impreciso que lleve a una reintervención innecesaria.
c.1.d) Quitosan
Se trata de un biopolímero de aminopolisacáridos biodegradable e hipoalergénico, descubierto en 1859 compuesto por unidades de N-acetil-D-glucosamina y Beta-(1-4)-D-Glucosamina que se extrae de ciertos artrópodos marinos55 con propiedades antihemorrágicas, antimicrobianas y fungicidas56, que al contacto con la sangre inicia la formación del coágulo mediante la atracción de eritrocitos, debido a la carga iónica positiva del mismo y la carga iónica negativa de los glóbulos rojos, siendo metabolizado por lisozimas en glucosamina, presentando acción incluso ante condiciones de normotermia, hipotermia y administración concomitante de anticoagulantes57 (p. ej., heparina).
c.1.e) Esferas de polisacáridos
Se trata de esferas hidrofílicas con origen vegetal y presentación clínica en polvo que concentran por deshidratación los componentes sólidos de la sangre produciendo estimulación plaquetaria39, siendo metabolizadas mediante amilasas endógenas en 24-48 horas, debiéndose utilizar con cautela en animales diabéticos o neonatos debido a la liberación de polisacáridos.
Se encuentran destinadas al cese de la hemorragia en heridas externas, no aconsejándose su utilización en cavidad abdominal, torácica u otras en las que pueda haber un compromiso de espacio ya que su volumen se incrementa en hasta un 500 % con presentación clínica en polvo y mediante dosificador.
c.1.f) Cera ósea
Es un hemostático tópico compuesto por cera de abeja y vaselina cuyo efecto está basado en su acción mecánica más que en sus propiedades biológicas, que permite la formación del coágulo mediante la ralentización y oclusión del flujo en los vasos dañados por la compresión directa que produce sobre las superficies óseas.
En ocasiones su adherencia al hueso es errática requiriendo de una cureta para su aplicación, siendo utilizada en cirugía espinal, esternotomía media58, mandibulectomía y maxilectomía, aunque ha de usarse con cautela en aquellos casos en los que se requiera de una cicatrización rápida, ya que inhibe la osteogénesis58-61, habiéndose registrado una mayor incidencia de infección ante su uso, así como aislado monocitos, células gigantes y fagocitos determinantes de una reacción a cuerpo extraño, situaciones por las que se ha de valorar el uso de copolímeros hidrosolubles como alternativa ya que presentan menor riesgo de infección, se adhieren mejor a los huesos y no presentan correlación negativa con la cicatrización ósea62-63.
c.2) Hemostáticos tópicos activos
Entre aquellos agentes activos, la trombina (tradicionalmente de origen bovino), se ha utilizado para estimular la agregación plaquetaria y transformar el fibrinógeno en fibrina en el lugar de sangrado, siendo de elevada utilidad en cirugía ortopédica, neurológica, vascular, torácica, y procedimientos en la cabeza y cuello.
Las trombinas reconstituibles han demostrado causar reacciones de hipersensibilidad en el ser humano64, si bien continúan comercializándose para su uso, se ha de tener en cuenta que sus componentes individuales pueden causar complicaciones en pequeños animales, en los que la reacción cruzada podría incluso resultar en alteraciones en la coagulación, por lo que el uso de esta en posteriores cirugías no está recomendado.
Existen además productos combinados que incorporan agentes activos y pasivos como las esponjas de gelatina con trombina, con un precio mayor, que incluso pueden venir acompañados de adaptadores para su uso en cirugía mínimamente invasiva.
d) Métodos farmacológicos
El uso de métodos farmacológicos tópicos como la epinefrina o sistémicos como los análogos de la desmopresina, derivados de la lisina permiten junto con los agentes hemostáticos tópicos citados anteriormente y los adhesivos tisulares garantizar la hemostasia quirúrgica mediante la mejora en los mecanismos naturales de la coagulación.
d.1)Uso tópico
d.1.a) Simpaticomiméticos
Tanto la adrenalina como la efedrina utilizados por vía tópica provocan una vasoconstricción local rápida, que permite la formación del plug plaquetario en arterias de pequeño calibre, presentando la desventaja de poder absorberse a nivel sistémicos.
d.2) Uso sistémico
d.2.a) Derivados de la lisina
Los análogos sintéticos de la lisina como el ácido aminocaproico y ácido tranexámico (Tabla 7) se han utilizado ampliamente en veterinaria, habiendo demostrado su efectividad a la hora de reducir las necesidades de transfusión en el paciente quirúrgico65.
| Tabla 7. Derivados de la lisina. Dosificación en pequeños animales. |
| Compuesto | Dosis |
| Ácido tranexámico | 10-15 mg/kg Oral, IV lento, IM. |
| Ácido aminocaproico | 15-40 mg/kg IV lento |
Estos bloquean el lugar de enlace de la lisina a la enzima plasmina esencial para la unión de la plasmina a la fibrina, inhibiendo por tanto la fibrinolisis, y permitiendo la acción de la fibrina durante un periodo más prolongado, fomentando la estabilidad del coágulo una vez este se ha formado66.
Cabe destacar que dosis a partir de 20 mg/kg de ácido tranexámico pueden inducir emesis, incrementándose las posibilidades conforme aumenta la misma, habiéndose documentado en otro estudio una incidencia de vómitos del 3 % a la dosis habitualmente utilizada67,68.
Mientras, otro estudio investigó la administración de ácido aminocaproico, un antifibrinolítico similar en galgos sometidos a gonadectomía determinando una disminución significativa de la incidencia de sangrado postoperatorio ante el incremento de la estabilidad del coágulo69.
d.2.b) Etamsilato
El etamsilato es un agente con acción hemostática y angioprotectora que parece incrementar la resistencia del endotelio vascular, produciendo una disminución del sangrado directamente proporcional a la severidad del mismo, probablemente ante su mecanismo de acción basado en el incremento de la adhesión y agregación plaquetaria70, aumentando los niveles de fibrinógeno y activando los factores plaquetarios III y IV, produciendo una disminución de la acción de las prostaglandinas que causan disgregación plaquetaria71.
Su efecto se inicia 30 minutos tras su administración siendo la dosis en pequeños animales de 6.25-12.5 mg/Kg IM o IV, presentando un amplio margen de seguridad de hasta 200 mg/kg, y acción sinérgica con la desmopresina, si bien su eficacia es menor al de otros fármacos sistémicos.
La capacidad hemostática está relacionada con variables relacionadas con el procedimiento quirúrgico y el paciente, y el desarrollo de fenómenos tanto intrínsecos como extrínsecos a los mismos.
d.2.c) Desmopresina
Es un análogo sintético de la vasopresina que estimula la liberación de factor de Von Willebrand y el factor VIII de las células endoteliales, que puede utilizarse para prevenir y tratar el sangrado en animales con deficiencia del factor von Willebrand, aunque no parece mejorar la hemostasia en animales sanos72.
Su acción es notable desde los 30 minutos posteriores a su administración, por lo que debe administrarse previamente al acto quirúrgico a una dosis de 1 mcg/kg SC o 0,3 mcg/kg IV lento y diluido72.
Presenta efectos adversos relacionados como la hiponatremia y la retención de agua, aunque estos son raros en el perro, considerándose el riesgo de tromboembolismo mayor en el ser humano durante el periodo perioperatorio.
Conclusión
La hemostasia está relacionada con el procedimiento quirúrgico y el pronóstico del paciente, siendo la responsabilidad del cirujano optimizar, plantear y protocolizar todas aquellas medidas que permitan no solo detener, si no prevenir el sangrado, considerándose como factor clave la rápida actuación y formación del equipo quirúrgico así como el reciclaje y obtención de aquellos conocimientos que permitan el uso amplio y correcto de los instrumentos o fármacos relacionados con la misma.
Bibliografía
- RL, Bradshaw RA, Gabriel D, Ortel TL,Lawson J, Mann KG. A review of the therapeutic uses of thrombin. Thrombosis and Haemostasis 2004;91(5):851-860
- Dagi TF. The management of postoperative bleeding. Surgical Clinics of North America 2005;85:1191–213.
- Samudrala S. Topical hemostatic agents in surgery: a surgeon’s perspective. AORN Journal 2008;88:S2–11
- Berzon JL. Complications of Elective Ovariohysterectomies in the Dog and Cat at a Teaching Institution: Clinical Review of 853 Cases. Veterinary Surgery 1979;8(3), 89–91.
- Burrow R. Complications observed during and after ovariohysterectomy of 142 bitches at a veterinary teaching hospital. Veterinary Record 2005; 157(26), 829–833
- Carson JL, Poses RM, Spence RK, Bonavita G. Severity of anaemia and operative mortality and morbidity. Lancet 1988;1:727–9.
- Shander A. Financial and clinical outcomes associated with surgical bleeding complications. Surgery 2007;142(suppl 4):S20–5.
- Heneghan C. Zittermann, A. Self-monitoring of oral anticoagulation: systematic review and meta-analysis of individual patient data. The Lancet 2012;379(9813), 322–334.
- Gabay M. Absorbable hemostatic agents. American Journal of Health-System Pharmacy 2006;63(13):1244-1253
- Adams GL, Manson RJ, Turner I, Sindram D,Lawson JH. The balance of thrombosis and hemor-rhage in surgery. Hematology & Oncolology Clinics of North America 2007;21(1):13-24.
- Hemostasis. En: Porter RS, ed. The Merck Manuals Online Medical Library.
- Morikawa T. Tissue sealing. American Journal of Surgery.2001;182(2Suppl):29S-35S.
- Block JE. Severe blood loss during spinal recon-structive procedures: the potential usefulness oftopical hemostatic agents. Medical Hypotheses.2005;65(3):617-621
- Oz MC, Rondinone JF, Shargill NS. FloSeal Ma-trix: new generation topical hemostatic sealant. Journal of Cardiac Surgery 2003;18(6):486-493.
- McDonnell MF, Glassman SD JR. Perioperative complications of anterior procedures on the spine. Journal of Bone and Joint Surgery 1996;78(6):839-847.
- Carreon LY, Puno RM, Dimar JR 2nd, Glassman SD, Johnson JR. Perioperative complications of posterior lumbar decompression and arthrodesis in older adults. Journal of Bone and Joint Surgery 2003;85-A(11): 2089-2092.
- Bochicchio G, Dunne J, Bochicchio K, Scalea T. The combination of platelet-enriched autologousplasma with bovine collagen and thrombin decreas-es the need for multiple blood transfusions in trauma patients with retroperitoneal bleeding. Trauma 2004;56(1):76-79.
- Tomizawa Y. Clinical benefits and risk analisis of topical hemostats: a review. Journal of Artificial Organs 2005;8(3):137-142.
- Sabel M, Stummer W. The use of local agents: Surgicel and Surgifoam. European Spine Journal. 2004;13(Suppl 1):S97-S101
- Tobias KM. Surgical stapling devices in veterinary medicine: a review. Veterinary Surgery 2007;36:341–9
- Monnet E, Orton EC. Surgical stapling devices in cardiovascular surgery. Veterinary Clinics of North America: Small Animal Practice 1994;24:367–74.
- McEntee MC, Steffey M, Dykes NL: Use of surgical hemoclips in radiation treatment planning. Veterinary Radiology and Ultrasound 49:395, 2008.
- Schmiedt CW. Suture material, tissue staplers, ligation devices, and closure methods. En: Tobias KM, Johnston SA, editors. Veterinary surgery: small animal, vol. 1, 1st edition. Philadelphia: WB Saunders; 2012. p. 196–200.
- LaRue SM, Withrow SJ, Wykes PM. Lung resection using surgical staples in dogs and cats. Veterinary Surgery 1987;16:238–40.
- Walshaw R. Stapling techniques in pulmonary surgery. Veterinary Clinics of North America: Small Animal Practice 1994;24:334–66.
- Borenstein N, Behr L, Chetboul V. Minimally invasive patent ductus arteriosus occlusion in 5 dogs. Veterinary Surgery 2004;33:309–13.
- Corti LB, Merkley D, Nelson OL. Retrospective evaluation of occlusion of patent ductus arteriosus with Hemoclips in 20 dogs. JAAHA 2000;36:548–55.
- Hsu TC: Comparison of holding power of metal andabsorbable hemostatic clips. American Journal of Surgery 191:68, 2006.
- Toombs JP, Clark KM. Basic operative techniques. En: Slatter D, editor. Textbook of small animal surgery, vol. 1, 3rd edition. Philadelphia: WB Saunders; 2003;199.
- Kinoshita T, Kanehira E, Omura K, Kawakami K, Watanabe Y. Experimental study on heat production by a 23.5 kHz ultrasonically activated device for endoscopic surgery. Surgery and Endoscopics. 1999;13:621-5.
- Shimi SM. Dissection techniques in laparoscopic surgery: a review. Journal of the Royal College of Surgeons of Edimburg. 1995;40:249-59. 2.
- Campbell PA, Cresswell AB, Frank TG, Cuschieri A. Realtime thermography during energized vessel sealing and dissection. Surgery and Endoscopics. 2003;17:1640-5.
- Schwarzkopf I. Vessel sealing versus suture ligation for canine ovarian pedicle haemostasis: a randomised clinical trial. Veterinary Record 2014;176(5), 125–125
- Mayhew PD Culp, Pascoe PJ.Use of the Ligasure Vessel-Sealing Device for Thoracoscopic Peripheral Lung Biopsy in Healthy Dogs. Veterinary Surgery, 2012; 41(4), 523–528.
- Belch A, Rasotto R. Comparison of the use of LigaSure versus a standard technique for tonsillectomy in dogs. Veterinary Record 180(8), 196–196.
- Wouters EGH, Buishand FO, Kik M, & Kirpensteijn, J.Use of a bipolar vessel-sealing device in resection of canine insulinoma. Journal of Small Animal Practice, 2011;52(3), 139–145.
- Paczuska J, Kiełbowicz Z, Nowak M, Antończyk A, Ciaputa R, Nicpoń J. The carbon dioxide laser: an alternative surgery technique for the treatment of common cutaneous tumors in dogs.Acta Veterinaria Scandinava. 2014;56(1):1
- Kirsch MS, Spector D, Kalafut SR, Moore GE, McDougall R. Comparison of carbon dioxide laserversusbipolar vessel device for staphylectomy for the treatment of brachycephalic obstructive airway syndrome.Canadian Veterinary Journal. 2019;60(2):160-166
- Spotnitz WD, Burks S. Hemostats, sealants, and adhesives: components of the surgical toolbox. Transfusion 2008;48: 1502–16.
- Spotnitz WD. Active and mechanical hemostatic agents. Surgery 2007;142(suppl 4):S34–8
- Seyednejad H, Imani M, Jamieson T, Seifalian AM. Topical haemostatic agents. British Journal of Surgery 2008;95:1197–225.
- Palm MD, Altman JS. Topical hemostatic agents: a review. Dermatologic Surgery 2008;34:431–45.
- Sundaram CP, Keenan AC. Evolution of hemostatic agents in surgical practice. Indian Journal of Urology. 2010;26(3):374-8.
- Dineen P. The effect of oxidized regenerated cellulose on experimental infected splenotomies. Journal of Surgical Research 1977;23:114.
- Erne JB, Mann FA: Surgical hemostasis. Compendium on Continuing Education 25:732, 2003
- Coln D, Horton J, Ogden ME. Evaluation of hemostatic agents in experimental splenic lacerations. American Journal of Surgery 145:256, 1983
- Wagner WR, Pachence JM, Ristich J. Comparative in vitro analysis of topical hemostatic agents. Journal of Surgery and Research 1996;66:100
- Abbott WM, Austen WG: The effectiveness and mechanism of collagen-induced hemostasis. Surgery 78:723, 1975
- Solheim E, Anfinsen OG, Holmsen H, et al: Effect of local hemostatics on platelet aggregation. European Surgical Research 1991;23:45.
- Wagner WR, Pachence JM, Ristich J. Comparative in vitroanalysis of topical hemostatic agents. Journal of Surgery Research 66:100, 1996.
- Lynn AK, Yannas IV, Bonfield W. Antigenicity and immunogenicity of collagen. Journal of Biomedical Materials Research part B 2004;71(2):343-354.
- Salisbury SK, Thacker HL, Pantzer EE, Wheaton LG. Partial Maxillectomy in the Dog Comparison of Suture Materials and Closure Techniques. Veterinary Surgery 1985; 14: 265-276
- Choi SH, Postbiopsy Splenic Bleeding in a Dog Model: Comparison of Cauterization, Embolization, and Plugging of the Needle Tract. American Journal of Roentgenology. 2005;185:4, 878-884
- Kothbauer KF, Jallo GI, Epstein FJ. Foreign body reaction to hemostatic materials mimicking recurrent brain tumor. Journal of Neurosurgery, 2001;95(3), 503–506.
- Burkatovskaya M, Tegos GP, Swietlik E. Use of chitosan bandage to prevent fatal infections developing from highly contaminated wounds in mice. Biomaterials 27:4157, 2006
- Szatmári, V.Chitosan hemostatic dressing for control of hemorrhage from femoral arterial puncture site in dogs. Journal of Veterinary Science 2015; 16(4), 517
- Fatma Özdemir, Betül Çam Etöz, Naciye İşbil Büyükcoşkun, Deniz Sığırlı.Hemostatic effect of a chitosan linear polymer (Celox®) in a severe femoral artery bleeding rat model under hypothermia or warfarin therapy.Ulus Travma Acil Cerrahi Derg.2011; 17(3):199-204
- Brightmore TG, Hayes P, Humble J. Hemostasis and healing following median sternotomy. Langenbecks Archives of Surgery (suppl):39, 1975. Online Source.
- Magyar CE, Aghaloo TL, Atti E. Ostene, a new alkylene oxide copolymer bone hemostatic material, does not inhibit bone healing. Neurosurgery. 2008;63(4 suppl 2):373
- Ibarrola JL, Bjorenson JE, Austin BP. Osseous reactions to three hemostatic agents. Journal of Endodontics 1985;11:75.
- Nelson DR, Buxton TB, Luu QN. The promotional effect of bone wax on experimental Staphylococcus aureus osteomyelitis. Journal of Thoracic and Cardiovasc Surgery 1990; 99:977
- Wang MY, Armstrong JK, Fisher TC. A new pluronic based, bone hemostatic agent that does not impair osteogenesis. Neurosurgery 2001;49:962
- Wellisz T, Armstrong JK, Cambridge J. The effects of a soluble polymer and bone wax on sternal healing in an animal model. Annals of Thoracic Surgery 2008; 85:1780
- Lawson JH. Clinical use and immunologic impact of thrombin in surgery. Seminars on Thrombosis and Haemostasis 2006;32(suppl1):98–110.
- Henry DA, Moxey AJ, Carless PA. Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion. Cochrane Database System Review 2001;1. Online Source
- Wellington K, Wagstaff AJ. Tranexamic acid: a review of its use in the management of menorrhagia. Drugs 2003;63:1417–1433
- Kelmer, E. Retrospective evaluation of the safety and efficacy of tranexamic acid (Hexakapron) for the treatment of bleeding disorders in dogs. Israel Journal of Veterinary Medicine 2013;68. 94-100.
- Marín LM, Lazbik MC. Epsilon Aminocaproic Acid for the Prevention of Delayed Postoperative Bleeding in Retired Racing Greyhounds Undergoing Gonadectomy. Veterinary Surgery, 2012;41(5), 594–603.
- Kakiuchi H, Fujii Y. Efficacy and safety of tranexamic acid as an emetic in dogs. American Journal of Veterinary Research, 2014; 75(12), 1099–1103.
- Elbourne D, Ayers S, Dellagrammaticas H,.Randomised controlled trial of prophylactic etamsylate: follow up at 2 years of age. Archives of Disease in Childhood - Fetal and Neonatal Edition 2001;84:F183-F187.
- Kovács L, Falkay G. Etamsylate as inhibitor of prostaglandin biosynthesis in pregnant human myometrium in vitro. Experientia 1981;37, 1182–1183.
- Callan MB. Effect of desmopressin acetate administration on primary hemostasis in Doberman Pinschers with type-1 von Willebrand disease as assessed by a point-of-care instrument. American Journal of Veterinary Research, 63(12), 1700–1706.
 by Multimédica
by Multimédica