Síndrome de dilatación-vólvulo gástrico en el perro (I): actualización clínica en el diagnóstico y la estabilización médica
Resumen breve
En esta primera parte del artículo, revisamos la anatomía implicada, la fisiopatología del DVG, los factores predisponentes y el enfoque diagnóstico, así como los pilares del manejo médico de urgencia que deben implementarse desde el primer contacto con el paciente.Índice de contenidos
Introducción
La dilatación-vólvulo gástrico (DVG) es una de las urgencias quirúrgicas más graves y frecuentes en perros de razas grandes y gigantes. Se caracteriza por una rotación del estómago, por lo general en su eje longitudinal, que impide su vaciado normal, atrapa aire y fluidos en su interior y genera una rápida distensión abdominal1. Esta distensión provoca una compresión de vasos abdominales clave, en especial la vena cava caudal, lo que desencadena una cascada de alteraciones hemodinámicas y compromete la perfusión de los órganos abdominales y torácicos1,2.
La comprensión de la vascularización gástrica y del drenaje venoso y linfático abdominal es esencial para entender el daño tisular que puede producirse en pocas horas. De hecho, la gravedad del cuadro no depende únicamente de la torsión en sí, sino de sus consecuencias sistémicas: reducción del gasto cardíaco, hipoperfusión tisular, disfunción multiorgánica y, en última instancia, shock1-4.
En estos casos, el tratamiento médico inicial representa un paso imprescindible antes de plantear la cirugía. La estabilización hemodinámica, la descompresión gástrica, la administración de oxígeno y el control del dolor son intervenciones prioritarias que deben instaurarse con rapidez1-4. La evolución del paciente y el pronóstico quirúrgico dependen en gran medida de la eficacia de esta fase médica.
En esta primera parte del artículo, revisamos la anatomía implicada, la fisiopatología del DVG, los factores predisponentes y el enfoque diagnóstico, así como los pilares del manejo médico de urgencia que deben implementarse desde el primer contacto con el paciente.
Anatomía
El estómago recibe su irrigación arterial a través del tronco celíaco, una rama de la aorta abdominal que se divide en tres arterias principales: la arteria gástrica izquierda, que irriga el fundus y el esófago distal; la arteria hepática, que emite ramas hacia el hígado y la vesícula biliar y continúa como gástrica derecha, irrigando la curvatura menor hasta anastomosarse con la arteria gástrica izquierda y arteria esplénica, que aporta ramas al páncreas y al bazo, a continuación se con convierte en la arteria gastroepiploica izquierda, encargada de irrigar la curvatura mayor y que se une con la arteria gastroepiploica derecha, que se derivada de la arteria gastroduodenal, que se origina en la arteria hepática2.
Además, las arterias gástricas cortas, derivadas de la esplénica, irrigan el fundus y se conectan con la arteria gástrica izquierda2. En casos de vólvulo o torsión gástrica, es frecuente que estos vasos se desgarren o sufran avulsión, lo que puede provocar hemorragias intraabdominales y necrosis gástrica5-7. El retorno venoso del estómago se realiza hacia la vena porta, a través de la vena esplénica por el lado izquierdo y de la vena gastroduodenal por el lado derecho2. El drenaje linfático se dirige a los ganglios linfáticos gástricos y esplénicos, y de ahí hacia los ganglios linfáticos hepáticos2,8. En cuanto a la inervación, el estómago recibe fibras parasimpáticas del nervio vago y fibras simpáticas del plexo celíaco2,9.
Fisiopatología
En los casos de torsión gástrica, el estómago suele rotar en el sentido de las agujas del reloj, tomando como referencia la perspectiva del cirujano (es decir, con el paciente en decúbito dorsal y la mirada dirigida hacia craneal)5,7. Durante este giro, el antro pilórico se desplaza desde la región ventral derecha hacia una posición dorsal en el lado izquierdo. La rotación gástrica más común oscila entre los 220° y 270°, aunque se han documentado casos con grados de torsión que van desde los 90° hasta una rotación completa de 360°6,7. De forma mucho menos frecuente, también se han descrito rotaciones en sentido antihorario10. El bazo, por su parte, suele acompañar al estómago y desplazarse hacia la zona ventral derecha del abdomen7.
Esta patología da lugar a una anomalía anatómica que origina la oclusión del píloro y cardias, y disminuye los sistemas de vaciado fisiológico del estómago, que continúa dilatándose por acumulación de gases de fermentación, líquidos gástricos y como consecuencia de la aerofagia7. El incremento de la presión intraabdominal secundario a la dilatación gástrica produce una compresión vascular significativa, elevación del diafragma y compresión de las estructuras abdominales adyacentes11. Estas alteraciones fisiopatológicas se traducen en una reducción del retorno venoso, del gasto cardíaco, de la contractilidad miocárdica y de la presión arterial media6,7,11. Como consecuencia, se compromete la perfusión de los órganos abdominales, lo que favorece el desarrollo de un proceso inflamatorio sistémico de mayor magnitud11. La hipertensión portal reduce la perfusión del sistema gastrointestinal, que conlleva isquemia, acidosis y liberación de factores depresores del miocardio por el páncreas2,6,7, así como radicales libres, y subsecuente traslocación bacteriana2. La obliteración de los vasos de la pared gástrica produce necrosis, que suele presentarse en el fundus2,6. En respuesta a la hipovolemia, las glándulas adrenales liberan catecolaminas que provocan una fuerte vasoconstricción y aceleran el ritmo cardíaco, lo que aumenta la demanda de oxígeno del corazón, que a su vez está recibiendo una perfusión deficiente por el propio estado de hipovolemia2,6. Este sistema, en conjunto, desencadena un shock distributivo, un shock cardiogénico y puede conllevar un síndrome de respuesta inflamatoria sistémica (SIRS por las siglas en inglés de systemic inflammatory response syndrome) y síndrome de disfunción multiorgánica (MODS por las siglas en inglés multiple organ dysfunction syndrome)12. Asimismo, una vez corregida la posición anómala del estómago y reinstaurar el retorno del flujo sanguíneo normal, se puede producir una lesión por reperfusión2,6,7,13-17.
A lo largo del desarrollo del síndrome de dilatación-vólvulo gástrico, pueden verse comprometidos múltiples sistemas orgánicos, incluidos el cardiovascular, respiratorio, gastrointestinal, renal y de coagulación7,12. La distensión gástrica genera una compresión torácica significativa que dificulta la respiración, de manera que agrava la hipoxemia y la hipercapnia, y favoreciendo a su vez la aerofagia2,12. Además, el sistema respiratorio puede verse aún más afectado por la aparición de neumonía por aspiración12. Las manifestaciones en el sistema cardiovascular son: arritmias, disfunción miocárdica y shock cardiogénico12. La reducción del volumen intravascular también afecta a la perfusión coronaria que, junto a la producción de factor depresor del miocardio, puede conllevar isquemia miocárdica y arritmias2,6. Se describen alteraciones electrocardiográficas en el 40-70 % de los perros con este síndrome que en general son de origen ventricular (p. ej., contracciones ventriculares prematuras, ritmos idioventriculares acelerados o taquicardia ventricular)2,5,6,13,18. Las concentraciones de troponina sérica aumentan en perros con DVG y alcanzan concentraciones máximas a las 48-72 horas posquirúrgicas que se correlacionan con las anomalías electrocardiográficas2,19,20.
Causas y factores predisponentes
Se han propuesto numerosos factores de riesgo para el DVG, como:
- Razas puras grandes o gigantes.
- Aumento de la relación entre la profundidad y ancho torácico.
- Sobrepeso.
- Antecedentes en parientes de primer grado.
- Distribución de la alimentación en menos comidas al día con mayor cantidad.
- Comportamiento rápido o agresivo durante la ingesta.
- Disminución del tamaño de partícula del alimento.
- Alteraciones primarias de la motilidad gástrica.
- Aumento del estrés o ejercicio postprandial2,5-7,21-25.
Algunos estudios han señalado una posible asociación entre la presencia de hernia de hiato26 o cuerpos extraños gástricos27 y un mayor riesgo de desarrollar torsión gástrica. Asimismo, se ha sugerido que los pacientes a los que con anterioridad se les ha realizado una esplenectomía por otras patologías podrían tener una mayor predisposición a padecer un DVG28-30. Sin embargo, existe cierta controversia: mientras algunos estudios describen que la gastropexia profiláctica es una medida preventiva en pacientes con riesgo aumentado que requieren esplenectomía30, otros estudios no han encontrado una correlación estadísticamente significativa que justifique esta recomendación28,29.
Las razas con mayor riesgo de sufrir esta patología son el Gran danés, el Setter Gordon, el Setter irlandés, el Weimaraner, el San Bernardo, el Caniche estándar, el Basset hound, el Pastor alemán, el Dóberman, y el Shar-pei2,7,31,32 No obstante, aunque con menor frecuencia, también se han documentado casos en razas pequeñas e incluso en gatos7. Diversos estudios han descrito una posible influencia genética en la predisposición a desarrollar esta patología33,34. Se ha observado que alteraciones en la composición del microbioma intestinal y la presencia de al menos un alelo de riesgo se asocian con una mayor probabilidad de sufrir DVG35. Además, hasta un 21 % de los perros diagnosticados con este síndrome presentan antecedentes de trastornos gastrointestinales previos1. La ingesta de pienso seco en altas cantidades, con distribución de la alimentación en una toma al día, parece incrementar el riesgo de sufrir esta patología23,36,37.También se ha establecido una posible relación entre una ingesta excesiva de agua y el inicio de DVG1,23.
En la actualidad no se ha determinado de forma clara, si la distensión gástrica ocurre antes del vólvulo o si este es el evento inicial, ya que existen evidencias que respaldan ambas hipótesis2,38. El hecho de que la gastropexia prevenga este síndrome al evitar el vómito improductivo y la acumulación de gas y productos de fermentación sugiere que el vólvulo podría preceder a la dilatación. Sin embargo, también se han reportado casos de dilatación gástrica sin vólvulo en perros que previamente se habían sometido a una gastropexia2,37,39.
Diagnóstico
Con frecuencia, el diagnóstico de DVG se basa en la anamnesis y exploración física, aunque se confirma mediante la identificación del posicionamiento anómalo del píloro realizando pruebas de imagen, como la radiografía5,7. Los signos clínicos más frecuentes son: abdomen distendido y timpanismo a la percusión, vómitos improductivos, ptialismo, inquietud y posturas antiálgicas como la postura de rezo2,3,6,7.En determinadas ocasiones, la esplenomegalia secundaria a la congestión del bazo puede ser palpable2,7.
Los hallazgos de la exploración física varían en función del estado de gravedad del paciente y la fase de shock en la que se encuentre2,7. Los animales con shock compensado suelen presentar depresión mental leve a moderada, taquicardia, tiempo de relleno capilar normal o prolongado, extremidades frías, calidad del pulso de regular a moderada, taquipnea y presión arterial normal40. A medida que se mantiene el compromiso de la perfusión sistémica, los mecanismos compensatorios comienzan a fallar. La aparición de mucosas pálidas, pulso periférico de mala calidad, depresión del estado mental y disminución de la presión arterial indican la progresión del animal hacia un estado de shock descompensado40, que puede desencadenar en una perfusión orgánica reducida, lo cual conduce a un fallo orgánico terminal y muerte40.
Las radiografías en decúbito lateral derecho es el método preferible para diferenciar una dilatación de una DVG7,41. En animales en los que se ha producido un vólvulo, se observa una posición anómala del píloro con atrapamiento de aire en su interior o compartimentalización gástrica (Figura 1), formando una doble burbuja, C invertida o signo de Popeye2,6,7,41.
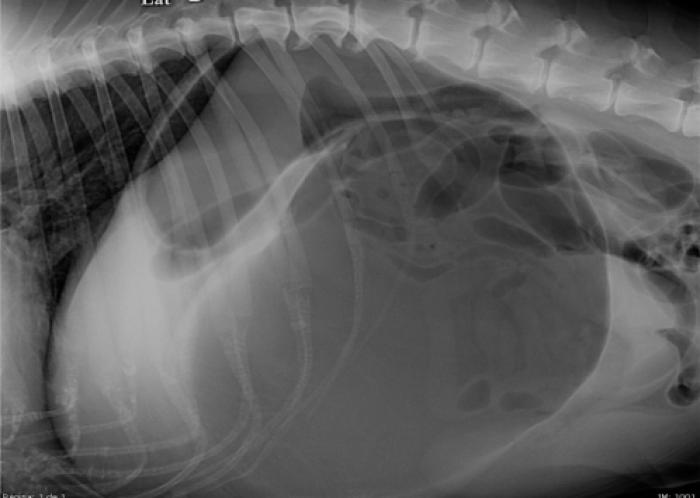
Figura 1. Radiografía de abdomen lateral derecha de dilatación-vólvulo gástrico, con imagen de compartimentalización gástrica.
En pacientes con torsión gástrica de 360°, se ha documentado una imagen radiográfica compatible con un mayor grado de distensión esofágica y ausencia de gas en el intestino delgado41.Por otro lado, los signos radiológicos de compartimentalización gástrica se observan con mayor claridad en casos de torsión de 180°, lo que sugiere una mayor sensibilidad diagnóstica en este tipo de presentación41. En los pacientes que reciben una compresión gástrica antes del estudio radiológico, puede ser más complicado observar el atrapamiento de aire de forma clara, pero el pliegue gástrico con densidad de tejido blando aún debe ser visible2.La diferenciación entre dilatación y DVG mediante técnicas de imagen es fundamental,dado que la segunda es una enfermedad potencialmente mortal que requiere intervención quirúrgica41. En animales en los que se observa una dilatación gástrica, pero sin línea de torsión, es conveniente buscar la causa de la aerofagia (dolor, disnea, u otras etiologías) y resolver la causa primaria. En estos casos, los autores recomiendan realizar un estudio radiológico de tórax para descartar neumonías u otros procesos respiratorios que puedan generar disnea. Para una adecuada valoración de abdomen y tórax, los autores recomiendan realizar proyecciones de ambas localizaciones anatómicas por separado (Figura 2A-C).
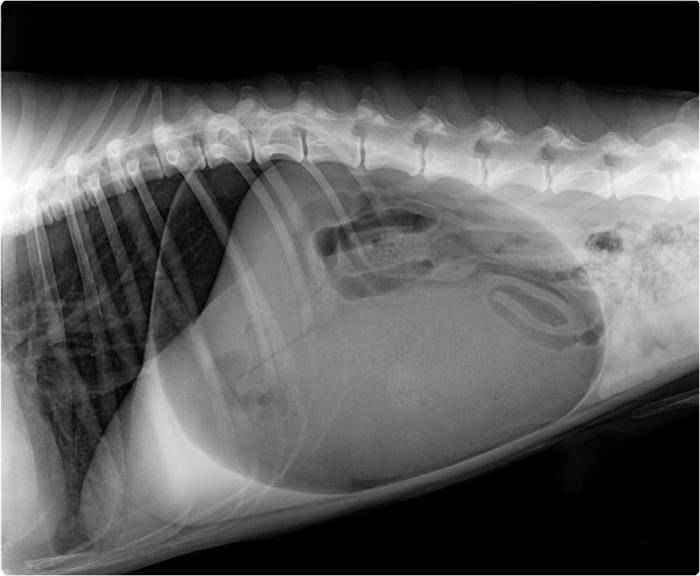
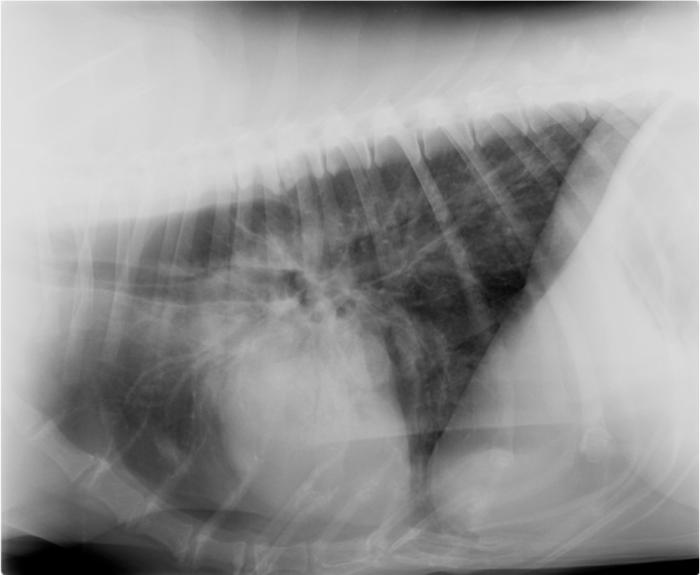
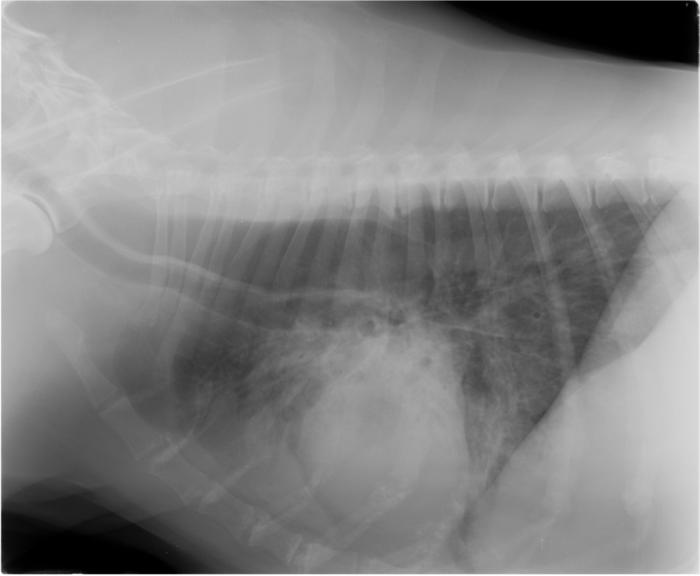
Figura 2. (A) Radiografía de abdomen en decúbito lateral derecho de distensión gástrica originada por aerofagia por una neumonía. Nótese que, aunque la imagen aparece el tórax los valores no están optimizados para el tórax. (B) Radiografía torácica lateral derecha y (C) lateral izquierda de este mismo paciente. El patrón broncoalveolar (compatible con neumonía) es especialmente evidente en lateral izquierda.
La detección de neumoperitoneo en radiografías simples puede indicar la presencia de una perforación gástrica2,6,7, mientras que la visualización de aire en la pared del estómago (neumatosis gástrica) suele ser signo de necrosis6,7. Ambos hallazgos representan una urgencia quirúrgica2,6,7. No obstante, deben interpretarse con precaución en pacientes que hayan sido previamente trocarizados, ya que el aire libre podría deberse a ese procedimiento2. Por otro lado, la ecografía abdominal puede ser útil para confirmar la sospecha de hemoabdomen o perforación gástrica5.
Es imprescindible realizar una analítica sanguínea completa que incluya un hemograma, bioquímica, iones séricos y gasometría arterial o venosa. Estas son herramientas diagnósticas esenciales que permiten una evaluación rápida y precisa del estado general del paciente y orientan sobre la severidad del cuadro clínico, contribuyendo a la toma de decisiones clínicas urgentes. Los hallazgos laboratoriales se relacionan principalmente con la hipotensión y sus efectos secundarios2. El hemograma puede mostrar hemoconcentración y leucograma de estrés6, además de trombocitopenia por consumo2 o por alteraciones de la coagulación (un posible CID)7. En ocasiones se puede observar elevación de la alanina aminotransferasa (ALT) y de la bilirrubina total, asociado al daño hepatocelular y a la hipoxia y estasis biliar2,6. La hipotensión puede generar un aumento de creatinina y nitrógeno ureico2,6. A su vez, la insuficiencia vascular puede llevar a un incremento en la producción de ácido láctico, lo cual contribuye al desarrollo de acidosis metabólica7. No obstante, en algunos casos, esta alteración puede verse parcialmente compensada por una alcalosis metabólica secundaria al secuestro de iones en la luz gástrica, lo que permite una normalización temporal del pH sistémico7. Sin embargo, la compresión diafragmática inducida por la distensión gástrica puede ocasionar hipoventilación de forma que exacerbe la acidosis7. En general, las alteraciones electrolíticas asociadas suelen resolverse tras la corrección de la posición gástrica y la administración adecuada de fluidoterapia2.
Algunos hallazgos laboratoriales permiten también establecer factores pronósticos del paciente a la hora de evaluar y emitir un posible pronóstico general del paciente de cara al procedimiento quirúrgico y posoperatorio. Diversos estudios han documentado la presencia de acidosis metabólica e hipocalemia como hallazgos frecuentes en perros con DVG42,43. Un estudio realizado en 1982 no encontró una correlación significativa entre la severidad de las alteraciones ácido-base y electrolíticas con la duración del cuadro clínico, la frecuencia cardíaca o la frecuencia respiratoria, por lo que se indicó que el manejo terapéutico de estos pacientes debe basarse en mediciones precisas del pH sanguíneo, del bicarbonato sérico y de las concentraciones de electrolitos42. Sin embargo, estudios más recientes han asociado niveles elevados de lactato plasmático, anión gap y fósforo inorgánico, junto con valores reducidos de pH, bicarbonato y exceso de base, con la presencia de necrosis gástrica y un pronóstico desfavorable43,44. En este contexto, los parámetros de pH y bicarbonato se relacionaron estrechamente con la presencia de necrosis gástrica, mientras que el pH, el bicarbonato y el fósforo inorgánico mostraron una asociación significativa con el desenlace clínico43.
La mayoría de los pacientes con DVG presentan hiperlactatemia asociada al estado de hipoperfusión e isquemia6,44. Se ha determinado la utilidad del lactato plasmático como marcador clínico para evaluar el estado de perfusión, monitorizar la evolución durante la estabilización y predecir la probabilidad de supervivencia en pacientes con DVG, determinando que un valor elevado puede ser indicativo de necrosis gástrica y un peor pronóstico en perros con DVG2,6,43-47. Se recomienda la monitorización estrecha de pacientes con concentración de lactato plasmático superior a 6 mmol/l, ya que se ha asociado a una mayor probabilidad de cursar con necrosis gástrica6,45-47. Sin embargo, el valor pronóstico no depende de una sola medición, sino de su evolución a lo largo del periodo de estabilización y en respuesta a la fluidoterapia44,46: una disminución del 40 % en los niveles de lactato tras la administración de fluidos puede ser indicativa de una mejoría clínica y un pronóstico más favorable; por el contrario, la presencia de hiperlactatemia persistente se ha asociado con una mayor probabilidad de mortalidad44.
Se ha descrito que la utilización de otros posibles marcadores de pronóstico, como la mioglobina sérica6,48, la proteína C reactiva6,49-51 y las troponinas cardíacas séricas I y T20. Las troponinas cardíacas séricas I y T son marcadores del daño miocárdico y su elevación en suero se ha correlacionado con el riesgo de presentar anormalidades en el ECG y con un peor desenlace clínico20. Sin embargo, aunque la mioglobina sérica y la proteína C reactiva suelen encontrarse elevadas en pacientes con DVG, no han demostrado ser marcadores lo suficientemente específicos ni sensibles para predecir de manera confiable la extensión de daño o la mortalidad en estos pacientes si se interpretan como únicos parámetros indicadores de pronóstico48-51.
Estabilización médica
El síndrome de DVG de manera inicial es una urgencia médica y no quirúrgica6. El tratamiento comienza en la estabilización hemodinámica del paciente y la descompresión, antes del planteamiento cirugía3,6. Los animales en estado de descompensación hemodinámica requieren una estabilización previa antes de poder realizar estudios de imagen. Por ello, la sospecha clínica y el inicio del tratamiento suelen basarse principalmente en la anamnesis y los signos clínicos observados5. Si los intentos de descompresión resultan ineficaces, se debe proceder a una cirugía de urgencia en un plazo máximo de 2 a 3 horas desde el inicio del cuadro, para evitar el deterioro de la viabilidad de la pared gástrica6. En algunos casos, la descompresión durante el manejo médico inicial puede permitir que el estómago recupere su posición anatómica normal6,7. No obstante, estos pacientes siguen teniendo un alto riesgo de recidiva, por lo que se recomienda realizar una gastropexia diferida, incluso cuando el tratamiento conservador haya sido exitoso7.
El tratamiento médico está enfocado a normalizar los parámetros hemodinámicos y mantener la normotensión (mínimo 60-65 mmHg de presión arterial media), mediante expansión y mantenimiento del volumen intravascular para proveer una adecuada hidratación a nivel celular2,52. Comienza por la colocación de uno o dos catéteres intravenosos (dependiendo del tamaño del paciente) del mayor calibre posible, preferiblemente en venas de localización craneal al vólvulo (como por ejemplo la vena cefálica)2,5,6. Se administrará fluidoterapia de shock guiada por objetivos. Idealmente, comienza con un bolo de cristaloide isotónico (como por ejemplo Ringer lactato) en bolos de 10-20 ml/kg administrado en 15-30 minutos (dosis máxima total de 60-90 ml/kg)2,6,7,52. Tras cada bolo es necesario reevaluar los parámetros de perfusión sanguínea para valorar la necesidad de continuar con la administración de bolos52. En ocasiones, puede requerirse la administración de solución hipertónica salina 7 % o 7.5 % a dosis de 3-5 ml/kg en 10-20 minutos6,52. En pacientes con hipotensión con respuesta parcial a la fluidoterapia de shock, se considera el uso de vasopresores como la norepinefrina (0.1-2 µg/kg/min) en infusión continua intravenosa2,6, comenzando por la dosis más baja y monitorizando de forma continua al paciente. Otra posibilidad, consiste en la administración de dopamina (agonista α y β), que es el precursor endógeno de la norepinefrina, a dosis de 5-15 µg/kg/min, en infusión continua intravenosa. En caso de que la contractibilidad cardiaca se encuentre comprometida, puede añadirse un inotropo positivo como la dobutamina (2-10 µg/kg/min) en infusión continua intravenosa6. A su vez, es importante resaltar que desde la recepción inicial del paciente, se debe administrar oxigenoterapia6,7. El uso de antibióticos de amplio espectro, como la cefazolina 22 mg/kg vía intravenosa7 o amoxicilina-ácido clavulánico 22 mg/kg vía intravenosa6, está indicado por la posible traslocación bacteriana, que puede estar relacionada con el estasis venoso en el tracto gastrointestinal y con el deterioro de la integridad de la pared gástrica1,2,7.
El paciente debe permanecer con monitorización electrocardiográfica continuada dado el riesgo de desarrollar arritmiascardíacas1,2 (Figura 3A-C), tanto supraventriculares como ventriculares, siendo la taquicardia ventricular la presentación más común6.
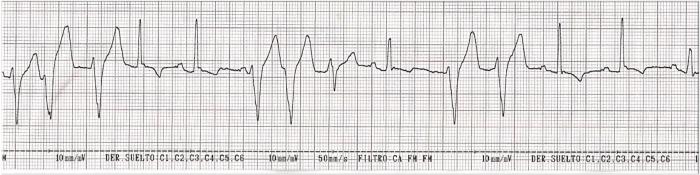
Figura 3. Electrocardiograma (ECG) con presentación de (A) complejos ventriculares prematuros, (B) taquicardia ventricular y (C) ritmo idioventricular acelerado (marcado en rojo).
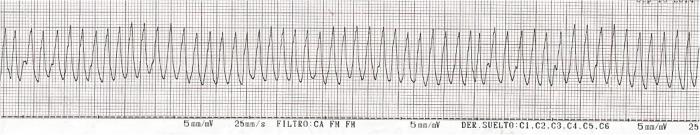
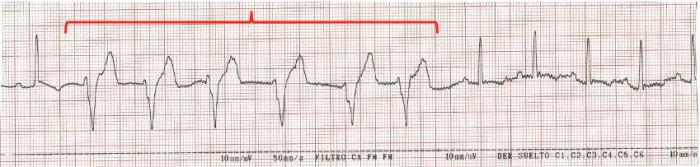
Su tratamiento incluye el mantenimiento de un correcto estado de hidratación, el control analgésico y la corrección de desequilibrios electrolíticos, principalmente, la hipopotasemia (Tabla 1)1,2,6,7.
| Concentración plasmática estimada de potasio | Concentración plasmática de potasio (mEq/l) | Concentración recomendada de potasio en la solución de fluidoterapia (mEq/l) |
|---|---|---|
| Aumentada | > 5.0 | 0 |
| Normal | 3.5-5.5 | 20 |
| Disminuida | ||
| Leve | 3-3.5 | 25 |
| Moderada | 2.5-3 | 40 |
| Severa | 2-2.5 | 60 |
| Muy severa | < 2 | 80 |
| KCl 2M = 2 mEq/ml No exceder una velocidad máxima de 0.5 mEq/kg/h |
Tabla 1. Directriz para la suplementación de cloruro de potasio (KCl) en perros y gatos según la concentración plasmática de potasio.
Si el tratamiento de la hipopotasemia resulta refractario, se debe considerar la presencia de hipomagnesemiaconcomitante, por lo que deberá de tratarse6. El tratamiento de arritmias está indicado cuando se mantengan a pesar de la instauración de tratamiento médico y si la arritmia supone un compromiso hemodinámico, o si presenta una frecuencia ventricular mantenida por encima de 160 latidos por minuto2,6,7. Estas arritmias pueden tratarse con lidocaína, comenzando con un bolo intravenoso de 1 a 2 mg/kg para valorar la respuesta clínica6,7. Si se observa una respuesta positiva, se recomienda continuar con una infusión continua intravenosa a una dosis de 50 a 75 µg/kg/min7. Este tratamiento debe iniciarse siempre con dosis bajas y ajustarse de forma progresiva según la evolución del paciente7. Es importante no exceder una dosis total de 6 mg/kg por vía intravenosa, debido al riesgo de toxicidad por lidocaína7. Otros fármacos antiarrítmicos que se pueden emplear son la procainamida (bolo inicial a 10-15 mg/kg lento, seguido de infusión continua a 25-50 µg/kg/min6) y sotalol vía oral como último recurso7.
Una vez iniciada la resucitación con fluidoterapia, se realiza la descompresión gástrica mediante la trocarización percutánea y la intubación orogástrica, de forma cuidadosa para evitar la perforación del esófago2,5,7. La trocarización percutánea permite aliviar rápidamente la descompresión y se realiza empleando un catéter de calibre 16 G o 18 G o trócar pequeño, previo rasurado y preparación aséptica de la zona2,5,7. Para minimizar los riesgos, es preciso percutir en abdomen craneal, caudal a las costillas, para encontrar la zona con mayor timpanismo, con preferencial del costado derecho con el fin de reducir las posibilidades de dañar el bazo. Un estudio realizado en 2013 evaluó la intubación orogástrica y la trocarización como métodos de descompresión gástrica para el manejo inicial de DVG y determinar que ambas son técnicas aceptables asociadas a bajas tasas de complicaciones y altas tasas de éxito53. Generalmente, los autores tienden a realizar primero una trocarización percutánea y posteriormente proceden a la intubación orogástrica, con el fin de reducir la presión en el estómago y facilitar el paso de la sonda. Idealmente, se recomienda realizar las pruebas de imagen y la descompresión después de haber iniciado la resucitación con fluidos, con el objetivo de minimizar el riesgo de colapso cardiovascular asociado al estrés físico o manipulación excesiva del paciente durante el procedimiento2,5.
Para la realización del sondaje orogástrico, es necesaria la sedación del paciente. Los protocolos habituales recomiendan el uso de opioides agonistas puros del receptor m (como por ejemplo metadona 0.2 mg/kg intravenosa o fentanilo 0.35 µg/kg intravenoso) combinados con midazolam (0.1-0.5 mg/kg intravenoso)5. Se debe tener precaución y proteger las vías respiratorias durante el sondaje orogástrico, por lo que está indicado realizar previamente una intubación endotraqueal2 (Figura 4).
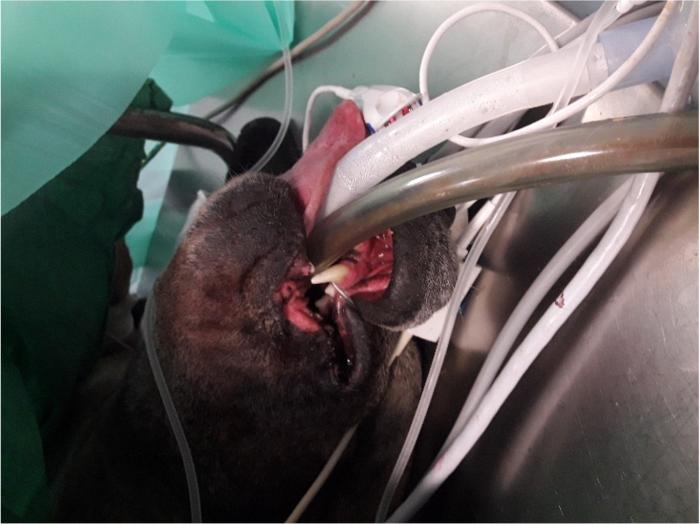
Figura 4. Paciente con intubación endotraqueal y orogástrica.
La sonda orogástrica debe ser flexible, de superficie lisa y de gran diámetro (mínimo 1.5 cm), y se debe marcar la longitud objetivo previo a su introducción (desde las fosas nasales hasta la apófisis xifoides o borde caudal de la última costilla)2,7. El paso de la sonda al estómago puede ser complicado por la compresión del esófago distal2, en estos casos, la descompresión mediante trocarización percutánea es necesaria para facilitar el paso de la sonda2,5,7. Una vez eliminado el aire, se deben realizar lavados a través de la sonda orogástrica con agua templada (5-10 ml/kg)6,7; si el líquido procedente del estómago contiene sangre, puede indicar la presencia de necrosis gástrica7. Si no es posible recuperar el líquido introducido, se deben repetir las pruebas de imagen por sospecha de perforación gástrica6. Si el paciente se encuentra estable, se recomienda la realización de radiografías de revisión posterior a la descompresión7. Hay autores que recomiendan el mantenimiento de una sonda nasogástrica del mayor calibre posible tras la descompresión para evitar posibles redilataciones hasta la entrada en quirófano6.
En caso de no poder introducir la sonda orogástrica y no disponer de medios para una cirugía inmediata, se ha descrito la colocación de un catéter de gastrostomía percutánea temporal guiada por ultrasonido para proporcionar descompresión gástrica sostenida en perros con GDV: se describen resultados favorables al ser una técnica rápida y sin complicaciones mayores que proporciona una descompresión gástrica eficaz y sostenida54.
El tiempo dedicado al soporte intensivo con fluidoterapia y descompresión gástrica durante el manejo médico inicial es esencial para lograr una reducción en la tasa de mortalidad. Estudios recientes han demostrado que una mayor duración del intervalo entre la presentación clínica y la intervención quirúrgica puede ser beneficioso, siempre que se acompañe de una adecuada estabilización médica de urgencia, basada en una individualización de cada caso2,55-56 (Tabla 2).
| Estabilización hemodinámica | |
| Prioridad |
|
| Acceso venoso | 1-2 catéteres del mayor calibre posible en vena cefálica u otra vena craneal al vólvulo |
| Fluidoterapia de shock | Guiada por objetivos:
|
| Uso de vasopresores | En hipotensión con respuesta parcial a fluidoterapia de shock:
|
| Inotrópicos | Si hay compromiso de la contractibilidad cardíaca:
|
| Oxigenoterapia | Siempre desde la recepción del paciente |
| Antibioterapia | Valorar necesidad en cada caso:
|
| Monitorización del paciente | |
| Presión arterial | Mantener PAM > 60-65 mmHg |
| Electrolitos |
|
| Lactato |
|
| Electrocardiograma | Monitorización continua, detección de arritmias cardíacas |
| Arritmias | |
| Más comunes |
|
| Causas relacionadas | Hipovolemia, hipoxia, desequilibrios electrolíticos (hipopotasemia, hipomagnesemia) |
| ¿Debo tratarla? |
|
| Tratamiento de la taquicardia ventricular |
|
| Descompresión gástrica | |
| Trocarización percutánea |
|
| Sondaje orogástrico |
|
| Sonda nasogástrica | Puede colocarse para evitar recidivas |
| Gastrostomía percutánea ecoguiada |
|
| ¿Y la cirugía? | |
| Descompresión gástrica ineficaz | Cirugía urgente en 2-3 horas |
| Descompresión eficaz y rectificación del vólvulo | Se recomienda gastropexia diferida por alto riesgo de recidiva |
| La estabilización médica intensiva e individualizada es clave para reducir la tasa de mortalidad |
Tabla 2. Estabilización médica inicial.
Puntos clave
- La DVG es una urgencia potencialmente mortal, que requiere estabilización intensiva y, posteriormente, resolución quirúrgica que incluya la realización de una gastropexia.
- La distensión gástrica produce compresión vascular y de los órganos adyacentes, Desencadena un shock distributivo y cardiogénico, y puede conllevar el desarrollo de SIRS y MODS.
- El diagnóstico presuntivo se basa en signos clínicos típicos y se confirma mediante radiografía en decúbito lateral derecho, identificando imagen de compartimentalización gástrica.
- La estabilización médica inicial incluye fluidoterapia de choque guiada por objetivos, descompresión gástrica mediante trocarización e intubación orogástrica, y monitorización electrocardiográfica continua.
- La hiperlactatemia superior a 6 mmol/l, en especial en ausencia de respuesta a fluidoterapia, es un factor pronóstico negativo. Se ha asociado a necrosis gástrica y un peor desenlace clínico.
Bibliografía
1. Olimpo M, Cillari S, Ferraris EI, Giacobino D, Savarino P, Piras LA, Martinelli G, Morello EM. Gastric Dilatation-Volvulus in Dogs: Analysis of 130 Cases in a Single Institution.Animals. 2025; 15(4):579-595. doi: 10.3390/ani15040579
2. Cornell K. Estómago. En: Tobias KM, Johnston SA, editores. Cirugía veterinaria de pequeños animales, Segunda Edición. Zaragoza (ES): Grupo Asís; 2023. p. 1700-1730.
3. Broome CJ, Walsh VP. Gastric dilatation-volvulus in dogs. N Z Vet J. 2003; 51(6):275-283. doi: 10.1080/00480169.2003.36381.
4. Rosselli D. Updated Information on Gastric Dilatation and Volvulus and Gastropexy in Dogs. Vet Clin North Am Small Anim Pract. 2022; 52(2):317-337. doi: 10.1016/j.cvsm.2021.11.004.
5. Tolbert KT. Gastric Diseases. In: Côté E, Ettinger SJ, Feldman EC, editors. Ettinger’s Textbook of Veterinary Internal Medicine, Ninth Edition. Philadelphia: Elsevier; 2024. p. 1667-1682.
6. Carrillo JD, Escobar MT, Martínez M, Gil-Chinchilla JI, García-Fernández P, Jiménez-Peláez M. Síndrome de dilatación-vólvulo gástrico (DVG). Clin Vet Peq Anim. 2016; 36(3): 163-177.
7. HedLund CS, Fossum TW. Cirugía del estómago. En: Fossum TW, editor. Cirugía en Pequeños Animales, Tercera Edición. Barcelona (ES): Elsevier; 2009. p. 409-433.
8. Bezuidenhout A. The lymphatic system. En: Evans H, editor. Miller’s anatomy of the dog, Third Edition. Philadelphia: Saunders; 1993. pp 745-746. (Sale en 2. Tobias)
9. Evans HE, de Lahunta A. The digestive apparatus and abdomen. En: Evans H, de Lahunta A, editors. Miller’s anatomy of the dog, Fourth Edition. St Louis: Saunders; 2013. pp 281-337. (Sale en 2. Tobias)
10. Zweig JN, DeGroot WD. Counterclockwise gastric dilatation and volvulus in a dog. Can Vet J. 2022; 63(7):711-714.
11. Kirkpatrick AW, Roberts DJ, De Waele J, Jaeschke R, Malbrain ML, De Keulenaer B, Duchesne J, Bjorck M, Leppaniemi A, Ejike JC, Sugrue M, Cheatham M, Ivatury R, Ball CG, Reintam Blaser A, Regli A, Balogh ZJ, D'Amours S, Debergh D, Kaplan M, Kimball E, Olvera C; Pediatric Guidelines Sub-Committee for the World Society of the Abdominal Compartment Syndrome. Intra-abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013; 39(7):1190-1206. doi: 10.1007/s00134-013-2906-z.
12. Sharp CR, Rozanski EA. Cardiovascular and systemic effects of gastric dilatation and volvulus in dogs. Top Companion Anim Med. 2014; 29(3):67-70. doi: 10.1053/j.tcam.2014.09.007.
13. Brourman JD, Schertel ER, Allen DA, Birchard SJ, DeHoff WD. Factors associated with perioperative mortality in dogs with surgically managed gastric dilatation-volvulus: 137 cases (1988-1993). J Am Vet Med Assoc. 1996; 208(11):1855-1858.
14. Badylak SF, Lantz GC, Jeffries M. Prevention of reperfusion injury in surgically induced gastric dilatation-volvulus in dogs. Am J Vet Res. 1990; 51(2):294-299.
15. Lantz GC, Badylak SF, Hiles MC, Arkin TE. Treatment of reperfusion injury in dogs with experimentally induced gastric dilatation-volvulus. Am J Vet Res. 1992; 53(9):1594-1598.
16. Bulkley GB. Free radical-mediated reperfusion injury: a selective review. Br J Cancer Suppl. 1987; 8:66-73.
17. Hausenloy DJ, Yellon DM. Myocardial ischemia-reperfusion injury: a neglected therapeutic target. J Clin Invest. 2013; 123(1):92-100. doi: 10.1172/JCI62874.
18. Muir WW. Gastric dilatation-volvulus in the dog, with emphasis on cardiac arrhythmias. J Am Vet Med Assoc. 1982; 180(7):739-742.
19. Aona BD, Rush JE, Rozanski EA, Cunningham SM, Sharp CR, Freeman LM. Evaluation of echocardiography and cardiac biomarker concentrations in dogs with gastric dilatation volvulus. J Vet Emerg Crit Care (San Antonio). 2017; 27(6):631-637. doi: 10.1111/vec.12667.
20. Schober KE, Cornand C, Kirbach B, Aupperle H, Oechtering G. Serum cardiac troponin I and cardiac troponin T concentrations in dogs with gastric dilatation-volvulus. J Am Vet Med Assoc. 2002; 221(3):381-388. doi: 10.2460/javma.2002.221.381.
21. Glickman LT, Glickman NW, Schellenberg DB, Raghavan M, Lee TL. Incidence of and breed-related risk factors for gastric dilatation-volvulus in dogs. J Am Vet Med Assoc.2000; 216(1):40-45. doi: 10.2460/javma.2000.216.40.
22. Glickman LT, Glickman NW, Schellenberg DB, Simpson K, Lantz GC. Multiple risk factors for the gastric dilatation-volvulus syndrome in dogs: a practitioner/owner case-control study. J Am Anim Hosp Assoc. 1997; 33(3):197-204. doi: 10.5326/15473317-33-3-197.
23. Glickman LT, Glickman NW, Schellenberg DB, Raghavan M, Lee T. Non-dietary risk factors for gastric dilatation-volvulus in large and giant breed dogs. J Am Vet Med Assoc.2000; 217(10):1492-1499. doi: 10.2460/javma.2000.217.1492.
24. Schaible RH, Ziech J, Glickman NW, Schellenberg D, Yi Q, Glickman LT. Predisposition to gastric dilatation-volvulus in relation to genetics of thoracic conformation in Irish setters. J Am Anim Hosp Assoc. 1997; 33(5):379-383. doi: 10.5326/15473317-33-5-379.
25. Schellenberg D, Yi Q, Glickman NW, Glickman LT. Influence of thoracic conformation and genetics on the risk of gastric dilatation-volvulus in Irish setters. J Am Anim Hosp Assoc. 1998; 34(1):64-73. doi: 10.5326/15473317-34-1-64.
26. Aslanian ME, Sharp CR, Garneau MS. Gastric dilatation and volvulus in a brachycephalic dog with hiatal hernia. J Small Anim Pract. 2014; 55(10):535-537. doi: 10.1111/jsap.12235.
27. de Battisti A, Toscano MJ, Formaggini L. Gastric foreign body as a risk factor for gastric dilatation and volvulus in dogs. J Am Vet Med Assoc. 2012; 241(9):1190-1193. doi: 10.2460/javma.241.9.1190.
28. Goldhammer MA, Haining H, Milne EM, Shaw DJ, Yool DA. Assessment of the incidence of GDV following splenectomy in dogs. J Small Anim Pract. 2010; 51(1):23-28. doi: 10.1111/j.1748-5827.2009.00844.x.
29. Grange AM, Clough W, Casale SA. Evaluation of splenectomy as a risk factor for gastric dilatation-volvulus. J Am Vet Med Assoc. 2012; 241(4):461-466. doi: 10.2460/javma.241.4.461.
30. Sartor AJ, Bentley AM, Brown DC. Association between previous splenectomy and gastric dilatation-volvulus in dogs: 453 cases (2004-2009). J Am Vet Med Assoc. 2013; 242(10):1381-1384. doi: 10.2460/javma.242.10.1381.
31. Brockman DJ, Washabau RJ, Drobatz KJ. Canine gastric dilatation/volvulus syndrome in a veterinary critical care unit: 295 cases (1986-1992). J Am Vet Med Assoc. 1995; 207(4):460-464.
32. Glickman LT, Glickman NW, Pérez CM, Schellenberg DB, Lantz GC. Analysis of risk factors for gastric dilatation and dilatation-volvulus in dogs. J Am Vet Med Assoc. 1994; 204(9):1465-1471.
33. Harkey MA, Villagran AM, Venkataraman GM, Leisenring WM, Hullar MAJ, Torok-Storb BJ. Associations between gastric dilatation-volvulus in Great Danes and specific alleles of the canine immune-system genes DLA88, DRB1, and TLR5. Am J Vet Res. 2017; 78(8):934-945. doi: 10.2460/ajvr.78.8.934.
34. Piras IS, Perdigones N, Zismann V, Briones N, Facista S, Rivera JL, Rozanski E, London CA, Hendricks WPD. Identification of Genetic Susceptibility Factors Associated with Canine Gastric Dilatation-Volvulus. Genes (Basel). 2020; 11(11):1313-1332. doi: 10.3390/genes11111313.
35. Hullar MAJ, Lampe JW, Torok-Storb BJ, Harkey MA. The canine gut microbiome is associated with higher risk of gastric dilatation-volvulus and high risk genetic variants of the immune system. PLoS One. 2018; 13(6):e0197686. doi: 10.1371/journal.pone.0197686.
36. Raghavan M, Glickman N, McCabe G, Lantz G, Glickman LT. Diet-related risk factors for gastric dilatation-volvulus in dogs of high-risk breeds. J Am Anim Hosp Assoc. 2004; 40(3):192-203. doi: 10.5326/0400192.
37. Jennings PB Jr, Butzin CA. Epidemiology of gastric dilatation-volvulus in the military working dog program. Mil Med. 1992; 157(7):369-371.
38. Brockman DJ, Holt DE, Washabau RJ. Pathogenesis of acute gastric dilatation-volvulus: is there a unifying hypothesis? Compend Contin Educ Pract Vet. 2000; 22(12):1108-1114.
39. Jennings PB Jr, Mathey WS, Ehler WJ. Intermittent gastric dilatation after gastropexy in a dog. J Am Vet Med Assoc. 1992; 200(11):1707-1708..
40. De Laforcade A, Silverstein DC. Classification and Initial Management of Shock States. In: Silverstein DC, Hopper K, editors. Small Animal Critical Care Medicine, Third Edition. St. Louis: Elsevier; 2023. p. 37-41.
41. Mur PE, Appleby R, Phillips KL, Singh A, Monteith G, Gilmour LJ, Keenihan E, Daniaux L, Linden AZ. Radiographic findings in dogs with 360 degrees gastric dilatation and volvulus. Vet Radiol Ultrasound. 2025; 66(1):e13445. doi: 10.1111/vru.13445.
42. Muir WW. Acid-base and electrolyte disturbances in dogs with gastric dilatation-volvulus. J Am Vet Med Assoc. 1982; 181(3):229-231.
43. Rauserova-Lexmaulova L, Vanova-Uhrikova I, Rehakova K. Acid-Base, Electrolyte and Lactate Abnormalities as Well as Gastric Necrosis and Survival in Dogs With Gastric Dilation-Volvulus Syndrome. A Retrospective Study in 75 Dogs. Top Companion Anim Med. 2020; 39:100403. doi: 10.1016/j.tcam.2020.100403.
44. Mooney E, Raw C, Hughes D. Plasma lactate concentration as a prognostic biomarker in dogs with gastric dilation and volvulus. Top Companion Anim Med. 2014; 29(3):71-76. doi: 10.1053/j.tcam.2014.09.005.
45. de Papp E, Drobatz KJ, Hughes D. Plasma lactate concentration as a predictor of gastric necrosis and survival among dogs with gastric dilatation-volvulus: 102 cases (1995-1998). J Am Vet Med Assoc. 1999; 215(1):49-52.
46. Zacher LA, Berg J, Shaw SP, Kudej RK. Association between outcome and changes in plasma lactate concentration during presurgical treatment in dogs with gastric dilatation-volvulus: 64 cases (2002-2008). J Am Vet Med Assoc. 2010; 236(8):892-897. doi: 10.2460/javma.236.8.892.
47. Beer KA, Syring RS, Drobatz KJ. Evaluation of plasma lactate concentration and base excess at the time of hospital admission as predictors of gastric necrosis and outcome and correlation between those variables in dogs with gastric dilatation-volvulus: 78 cases (2004-2009). J Am Vet Med Assoc. 2013; 242(1):54-58. doi: 10.2460/javma.242.1.54.
48. Adamik KN, Burgener IA, Kovacevic A, Schulze SP, Kohn B. Myoglobin as a prognostic indicator for outcome in dogs with gastric dilatation-volvulus. J Vet Emerg Crit Care (San Antonio). 2009; 19(3):247-253. doi: 10.1111/j.1476-4431.2009.00421.x.
49. Plickert HD, Einspanier R, Arndt G, Brunnberg L, Kohn B. Evaluation of a point-of-care test for canine C-reactive protein. Vet Clin Pathol. 2011; 40(3):384-388. doi: 10.1111/j.1939-165X.2011.00339.x.
50. Israeli I, Steiner J, Segev G, Kass PH, Suchodolski JS, Sattasathuchana P, Bruchim Y, Yudelevitch S, Aroch I. Serum pepsinogen-A, canine pancreatic lipase immunoreactivity, and C-reactive protein as prognostic markers in dogs with gastric dilatation-volvulus. J Vet Intern Med. 2012; 26(4):920-928. doi: 10.1111/j.1939-1676.2012.00940.x.
51. Nečasová A, Urbanová L, Staňková L, Pompová A, Filipejová Z, Somerlíková K, Řeháková K, Nečas A. Protein C activity in dogs with gastric dilatation and volvulus. Acta Vet. Brno. 2022; 91(1):35-42. doi: 10.2754/avb202291010035
52. Balakrishnan A, Silverstein DC. Shock Fluids and Fluid Challenge. In: Silverstein DC, Hopper K, editors. Small Animal Critical Care Medicine, Third Edition. St. Louis: Elsevier; 2023. p. 402-408.
53. Goodrich ZJ, Powell LL, Hulting KJ. Assessment of two methods of gastric decompression for the initial management of gastric dilatation-volvulus. J Small Anim Pract. 2013; 54(2):75-79. doi: 10.1111/jsap.12019.
54. Fox-Alvarez WA, Case JB, Lewis DD, Joyce AC, Cooke KL, Toskich B. Evaluation of a novel technique involving ultrasound-guided, temporary, percutaneous gastropexy and gastrostomy catheter placement for providing sustained gastric decompression in dogs with gastric dilatation-volvulus. J Am Vet Med Assoc. 2019; 255(9):1027-1034. doi: 10.2460/javma.255.9.1027.
55. White RS, Sartor AJ, Bergman PJ. Evaluation of a staged technique of immediate decompressive and delayed surgical treatment for gastric dilatation-volvulus in dogs. J Am Vet Med Assoc. 2021; 258(1):72-79. doi: 10.2460/javma.258.1.72.
56. Matthiesen DT. The gastric dilatation-volvulus complex: medical and surgical considerations. J Am Anim Hosp Assoc. 1983; 19(6):925-932.
 by Multimédica
by Multimédica
