Genodermatosis en dermatología veterinaria
Resumen breve
Parafraseando una frase de Eberhard Trumler “ Estar constantemente enfermo no es un estado físico normal para un perro, sino un signo inequívoco de una debilidad constitucional”. En las genodermatosis veterinarias, muchas veces nos encontramos pacientes en la consulta que cuando identificamos estas genodermatosis vemos que estamos ante un paciente delicado, pobre de pelo, con malformaciones dérmicas, alteraciones dermatológicas que nos indican justamente eso, una debilidad en la constitución…Índice de contenidos
Introducción
Parafraseando una frase de Eberhard Trumler “ Estar constantemente enfermo no es un estado físico normal para un perro, sino un signo inequívoco de una debilidad constitucional”. En las genodermatosis veterinarias, muchas veces nos encontramos pacientes en la consulta que cuando identificamos estas genodermatosis vemos que estamos ante un paciente delicado, pobre de pelo, con malformaciones dérmicas, alteraciones dermatológicas que nos indican justamente eso, una debilidad en la constitución de la piel. Ningún mamífero presenta la diversidad fenotípica del perro, existen más de 450 razas de perros conocidas distribuidas por todo el mundo, siendo genéticamente próximas, con algunos cambios que generan la diversidad del fenotipo y aunque algunas tienen un origen antiguo, las razas actuales son de reciente creación, a partir de un grupo pequeño de individuos. Cada vez se conoce más la base genética de las características fenotípicas de las diferentes razas caninas. Por ejemplo, el tipo de pelo está codificado por un sistema de solo tres genes. La combinación de alelos de estos tres genes (corto-largo), (duro/con bigotes-no duro) y liso-rizado, crea todos los tipos de pelos de las más de 400 razas que se conocen de perros. La base molecular y las proteínas codificadas por estos tres genes, se han descifrado de forma completa muy recientemente. Existen entre 50 a 60 genodermatosis conocidas, en este artículo no vamos a identificar y hablar de todas, pero existen otras muchas más que son claramente patologías con una sospecha genética clara (hipotiroidismo/perro de agua español, por ejemplo) La técnica más frecuente para identificar la causa genética de una genodermatosis es el Genome Wide Analysis (GWA), que permite asociar un determinado fenotipo a una zona concreta del ADN. En dermatología veterinaria es muy frecuente estudiar cada una de las enfermedades dermatológicas según su diferente localización: epidermis, dermis y folículo piloso.
Genodermatosis epidérmicas
En la cornificación del estrato córneo, que es el proceso de formación de dicho estrato, engloba la fase de queratinización con la formación de la queratina de las células epiteliales, muchas proteínas forman parte de este proceso, entre ellas la filagrina, la loricrina y las transglutaminasas. La filagrina es la proteína que une los filamentos de queratina y la loricrina es la que permite que fuera de estos queratinocitos se forme una especie de cemento para que se unan entre ellos.
Ictiosis no epidermiolítica del Golden Retriever
Se caracterizó en el año 2010, como un defecto en la proteína transglutaminasa transmitido de manera autosómica recesiva por el gen PNPLA1. El término ictiosis procede de ichthys (peces) enfermedad caracterizada por la presencia de parches escamosos cutáneos; son un grupo de trastornos hereditarios de la queratinización también conocidos en la especie humana, siendo no epidermiolítica el defecto puede estar en cualquier parte de la capa coó
Ictiosis epidermolítica del Norfolk Terrier
Es una ictiosis descamativa e hiperqueratótica. Se debe a una falta de la queratina 10(KRT 10), debido a un cambio en un nucleótido de la misma y fue caracterizada como tal en el año 2005.
La ictiosis epidermolítica del Norfolk terrier, invariablemente asociada con un defecto en la síntesis de queratina, con transmisión autosómica recesiva y debida a una alteración en el gen que codifica para la queratina 10 (KRT10), una proteína que junto con la KRT1 se encuentra en las capas superiores de la epidermis donde contribuye al mantenimiento de la estabilidad celular.
Los perros afectados, desde su nacimiento, tienen un color de piel más oscuro de lo normal y están sujetos a fácil erosión cutánea tras un ligero traumatismo. Con el avance de la edad, la hiperpigmentación progresa y aparecen numerosas escamas de color marrón íntimamente adheridas a la superficie de la piel y distribuidas principalmente en la región ventral del cuerpo.
Ictiosis lamelar no epidermolítica Jack Russell Terrier
El defecto puede estar en cualquier parte de la capa córnea y no sólo en las queratinas, asociada a una mutación en el gen que codifica para la transglutaminasa 1 (TGM1), un enzima esencial para la formación y la estabilidad de la envoltura del estrato córneo, una estructura cuya constitución es la etapa final de la diferenciación de los queratinocitos. En esta raza, escamas grisáceas se distribuyen en amplias regiones del cuerpo sin pelo, incluyendo el puente nasal, y la piel parece estar como arrugada con los pelos atrapados entre el material queratínico.
Paraqueratosis nasal del Labrador Retriever
Mutación conocida del cromosoma 11, aunque no ha sido aún publicada en ninguna revista científica.
Epidermólisis bullosa congénita
Durante los últimos 30 años en la medicina veterinaria se han descrito numerosas patologías de la unión dermo-epidérmica, pero sólo en la última década, gracias a los avances en inmunología y biología molecular, ha sido posible identificar los mecanismos implicados en la patogénesis de las enfermedades hereditarias caracterizadas por el desprendimiento de la epidermis de la dermis que resulta en la formación de vesículas-bullas (Figura 1).
Entre estas enfermedades, está la epidermólisis bullosa congénita (EBC). En conformidad con lo que se ha descrito en medicina humana, en los animales la misma enfermedad también se clasifica en tres subtipos, de acuerdo con el componente estructural directamente involucrado:
- La epidermólisis bullosa simple (EBS): la mutación se produce en la capa basal. Las ampollas se localizan en la epidermis y cicatrizan sin que haya pérdida de tejido. Es la menos grave, ya que los afectados pueden mejorar con el tiempo.
- La epidermólisis bullosa juntural (EBJ o epidermólisis bullosa de la unión): el defecto está en las proteínas de la lámina lúcida. Existen distintos grados, desde una variedad letal en la etapa neonatal hasta otra que mejora con el tiempo.
- La epidermólisis bullosa distrófica (EBD): el defecto se da por debajo de la lámina densa y es causa de lesiones graves.
Bases genéticas
En el caso de EBS, la mayoría de los casos documentados en la literatura se refieren a la especie bovina, con la participación de la queratina 5 (KTR5) y a la especie equina, para la cual se describe una mutación en la plectina, una proteína de anclaje de los componentes del citoesqueleto. En el perro y en una sola publicación, se hace referencia a los Collies pero sin identificar la posible mutación.
Las lesiones clínicas más importantes están representadas principalmente por placas eritematosas, erosiones, úlceras, y en raras ocasiones vesículas (dado el carácter transitorio de la misma lesión), sobre todo en las extremidades y en la cara (alrededor de los ojos, región perilabial) y oídos, así como en la mucosa oral.
Dentro de EBS, se han descrito también variantes suprabasales como la epidermólisis bullosa acantolítica en la especie bovina y recientemente, en los perros, el síndrome de displasia-fragilidad ectodérmica debido a mutaciones en el gen que codifica la placofilina-1 (PKP1), una proteína estructural de las uniones desmosomiales. En este último caso, los pacientes sufren de laceraciones cutáneas incluso tras un trauma moderado y con la edad, de una marcada fragilidad de la piel y áreas multifocales de alopecia parcial.
En la EBJ, se han descrito erosiones y úlceras en las extremidades, región auricular y bucal y lesiones en las uñas, en una ternera de raza Charolais, en caballos y en ovejas. En perros en razas como el Beauceron, Caniche miniatura, perro de muestra alemán de pelo corto, se han documentado lesiones en las almohadillas y uñas, así como en el paladar y lengua. La misma enfermedad también se ha documentado en dos gatos de raza europea. En todos estos casos, el defecto genético se ha identificado a cargo de la laminina-5 (LM3A32 o LM332), la principal glicoproteína adhesiva de la lámina basal.
La EBD, se ha descrito en varias razas de perros y gatos. La mutación más importante es la del colágeno VII, que forma fibrillas de anclaje en la unión dermo-epidérmica. Inicialmente, los pacientes se presentan con hemorragias puntiformes en la lengua y el paladar, pero rápidamente aparecen ampollas y úlceras que se extienden más allá de la cavidad oral, en otras membranas mucosas, tales como la del esófago.
Genodermatosis dérmicas
En la cornificación del estrato córneo, que es el proceso de formación de dicho estrato, engloba la fase de queratinización con la formación de la queratina de las células epiteliales, muchas proteínas forman parte de este proceso, entre ellas la filagrina, la loricrina y las transglutaminasas. La filagrina es la proteína que une los filamentos de queratina y la loricrina es la que permite que fuera de estos queratinocitos se forme una especie de cemento para que se unan entre ellos.
Ictiosis no epidermiolítica del Golden Retriever
Se caracterizó en el año 2010, como un defecto en la proteína transglutaminasa transmitido de manera autosómica recesiva por el gen PNPLA1. El término ictiosis procede de ichthys (peces) enfermedad caracterizada por la presencia de parches escamosos cutáneos; son un grupo de trastornos hereditarios de la queratinización también conocidos en la especie humana, siendo no epidermiolítica el defecto puede estar en cualquier parte de la capa coó
Ictiosis epidermolítica del Norfolk Terrier
Es una ictiosis descamativa e hiperqueratótica. Se debe a una falta de la queratina 10(KRT 10), debido a un cambio en un nucleótido de la misma y fue caracterizada como tal en el año 2005.
La ictiosis epidermolítica del Norfolk terrier, invariablemente asociada con un defecto en la síntesis de queratina, con transmisión autosómica recesiva y debida a una alteración en el gen que codifica para la queratina 10 (KRT10), una proteína que junto con la KRT1 se encuentra en las capas superiores de la epidermis donde contribuye al mantenimiento de la estabilidad celular.
Los perros afectados, desde su nacimiento, tienen un color de piel más oscuro de lo normal y están sujetos a fácil erosión cutánea tras un ligero traumatismo. Con el avance de la edad, la hiperpigmentación progresa y aparecen numerosas escamas de color marrón íntimamente adheridas a la superficie de la piel y distribuidas principalmente en la región ventral del cuerpo.
Ictiosis lamelar no epidermolítica Jack Russell Terrier
El defecto puede estar en cualquier parte de la capa córnea y no sólo en las queratinas, asociada a una mutación en el gen que codifica para la transglutaminasa 1 (TGM1), un enzima esencial para la formación y la estabilidad de la envoltura del estrato córneo, una estructura cuya constitución es la etapa final de la diferenciación de los queratinocitos. En esta raza, escamas grisáceas se distribuyen en amplias regiones del cuerpo sin pelo, incluyendo el puente nasal, y la piel parece estar como arrugada con los pelos atrapados entre el material queratínico.
Paraqueratosis nasal del Labrador Retriever
Mutación conocida del cromosoma 11, aunque no ha sido aún publicada en ninguna revista científica.
Epidermólisis bullosa congénita
Durante los últimos 30 años en la medicina veterinaria se han descrito numerosas patologías de la unión dermo-epidérmica, pero sólo en la última década, gracias a los avances en inmunología y biología molecular, ha sido posible identificar los mecanismos implicados en la patogénesis de las enfermedades hereditarias caracterizadas por el desprendimiento de la epidermis de la dermis que resulta en la formación de vesículas-bullas (Figura 1).
Entre estas enfermedades, está la epidermólisis bullosa congénita (EBC). En conformidad con lo que se ha descrito en medicina humana, en los animales la misma enfermedad también se clasifica en tres subtipos, de acuerdo con el componente estructural directamente involucrado:
- La epidermólisis bullosa simple (EBS): la mutación se produce en la capa basal. Las ampollas se localizan en la epidermis y cicatrizan sin que haya pérdida de tejido. Es la menos grave, ya que los afectados pueden mejorar con el tiempo.
- La epidermólisis bullosa juntural (EBJ o epidermólisis bullosa de la unión): el defecto está en las proteínas de la lámina lúcida. Existen distintos grados, desde una variedad letal en la etapa neonatal hasta otra que mejora con el tiempo.
- La epidermólisis bullosa distrófica (EBD): el defecto se da por debajo de la lámina densa y es causa de lesiones graves.
Bases genéticas
En el caso de EBS, la mayoría de los casos documentados en la literatura se refieren a la especie bovina, con la participación de la queratina 5 (KTR5) y a la especie equina, para la cual se describe una mutación en la plectina, una proteína de anclaje de los componentes del citoesqueleto. En el perro y en una sola publicación, se hace referencia a los Collies pero sin identificar la posible mutación.
Las lesiones clínicas más importantes están representadas principalmente por placas eritematosas, erosiones, úlceras, y en raras ocasiones vesículas (dado el carácter transitorio de la misma lesión), sobre todo en las extremidades y en la cara (alrededor de los ojos, región perilabial) y oídos, así como en la mucosa oral.
Dentro de EBS, se han descrito también variantes suprabasales como la epidermólisis bullosa acantolítica en la especie bovina y recientemente, en los perros, el síndrome de displasia-fragilidad ectodérmica debido a mutaciones en el gen que codifica la placofilina-1 (PKP1), una proteína estructural de las uniones desmosomiales. En este último caso, los pacientes sufren de laceraciones cutáneas incluso tras un trauma moderado y con la edad, de una marcada fragilidad de la piel y áreas multifocales de alopecia parcial.
En la EBJ, se han descrito erosiones y úlceras en las extremidades, región auricular y bucal y lesiones en las uñas, en una ternera de raza Charolais, en caballos y en ovejas. En perros en razas como el Beauceron, Caniche miniatura, perro de muestra alemán de pelo corto, se han documentado lesiones en las almohadillas y uñas, así como en el paladar y lengua. La misma enfermedad también se ha documentado en dos gatos de raza europea. En todos estos casos, el defecto genético se ha identificado a cargo de la laminina-5 (LM3A32 o LM332), la principal glicoproteína adhesiva de la lámina basal.
La EBD, se ha descrito en varias razas de perros y gatos. La mutación más importante es la del colágeno VII, que forma fibrillas de anclaje en la unión dermo-epidérmica. Inicialmente, los pacientes se presentan con hemorragias puntiformes en la lengua y el paladar, pero rápidamente aparecen ampollas y úlceras que se extienden más allá de la cavidad oral, en otras membranas mucosas, tales como la del esófago.
Genodermatosis foliculares
De estas alteraciones derivarán las razas alopécicas (crestados chinos, por ejemplo), de las que se conoce que existe una alteración en el gen FOX13, que se transmite de manera autosómica recesiva, dando los ejemplares alopécicos los heterocigotos en esta duplicación genética.
Se trata de un grupo complejo de trastornos congénitos que se caracterizan por un desarrollo anormal de los tejidos y órganos de origen ectodérmico, como las glándulas lagrimales, la piel, el pelo y los dientes.
Durante años y en medicina humana, se han descrito hasta 190 variantes de la misma condición, pobremente diferenciables desde el punto de vista clínico y por lo tanto clasificables sólo de acuerdo con el defecto funcional subyacente. Entre todas estas formas, la más común es la displasia ectodérmica hipohidrótica o anhidrótica o síndrome de Christ-Siemens Touraine que puede ser heredada como defecto autosómico recesivo, dominante, o estar relacionada con el cromosoma X (XLED). Este último modo de transmisión es el más frecuente y se debe a mutaciones en el gen que codifica para la ectodisplasina-A (EDA), una proteína de transmembrana que tiene un papel clave en la morfogénesis de los derivados ectodérmicos.
Dado que este gen se localiza en el cromosoma X, los sujetos masculinos (XY cariotipo) siempre serán homocigotos para el mismo gen y por lo tanto en ellos la enfermedad se manifestará.
En medicina veterinaria, las razas de perros cuyo fenotipo se clasifica como de displasia ectodérmica, están representados por el perro sin pelo mejicano y el perro crestado chino, ambos caracterizados por extensas zonas del cuerpo normalmente glabras (excepto la cabeza y las extremidades) y anomalías dentales. El carácter del manto desnudo, letal en el estado homocigótico, se transmite según un patrón de herencia semidominante autosómica y está ligado al cromosoma 17, y en particular a FOX13, un factor de transcripción implicado en el desarrollo ectodérmico.
Los animales en los que se han identificado mutaciones en el gen que codifica para la EDA y que por lo tanto se han descrito como afectados por la displasia ectodérmica relacionada con el cromosoma X, han sido perros, bovinos, caracterizados por áreas con pelo rudimentario o por alopecia cuya distribución es principalmente en las regiones fronto-temporal, torácica o sacral; por anormalidades dentales caracterizadas por la persistencia de los dientes deciduos o falta de erupción dental e, histológicamente, por la ausencia de las unidades foliculares y glandulares.
Displasia foliculares-alopecia por dilución del color
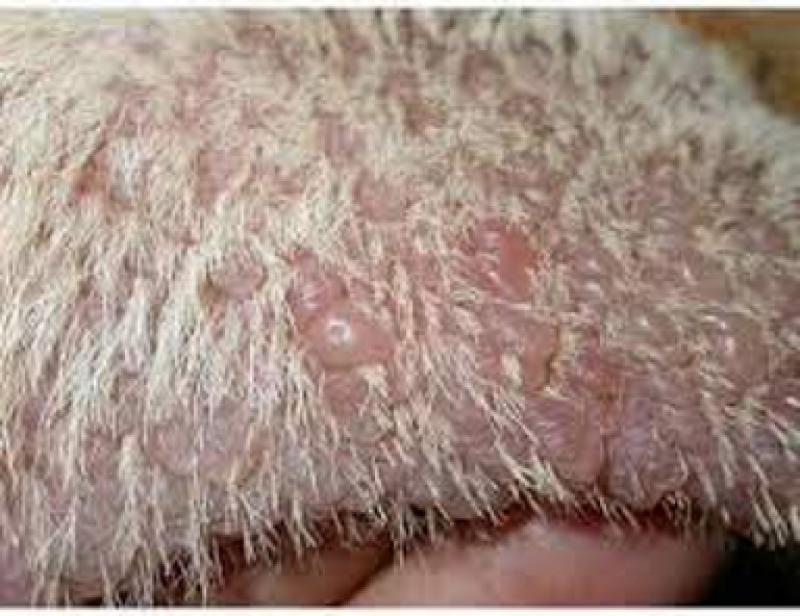
El perro en este caso de genodermatosis nace con pelo, pero se necesita un tiempo para que se acumule la melanina dentro del folículo antes de verse la caída del pelo. Existe una mutación en la proteína melanofilina, que causa la dilución del color-displasia foliculares (Figura 2.).
Las patologías displasias de los folículos pilosos se caracterizan por un crecimiento anormal del folículo piloso y del propio pelo en sí. Se pueden considerar adquiridas y de base hereditaria.
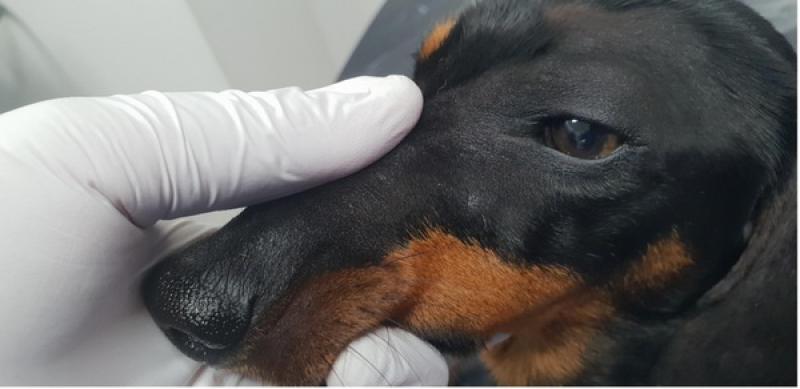
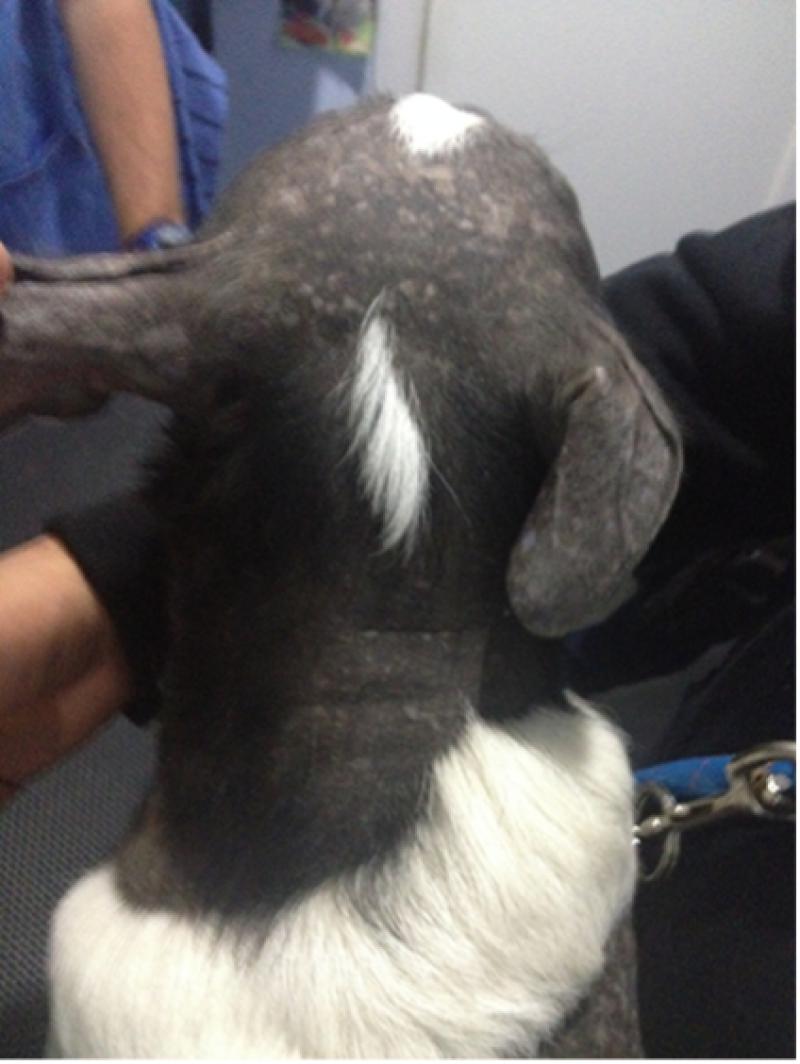
Las displasias foliculares se encuadran dentro de un grupo de genodermatosis poco frecuentes y de mecanismos complicados y poco conocidos. Presentándose clínicamente como alopecias solo en las zonas de pelo negro y descamación, así como hipotricosis marcada, de un comienzo progresivo y de edad de aparición temprana (Figuras3 y 4).
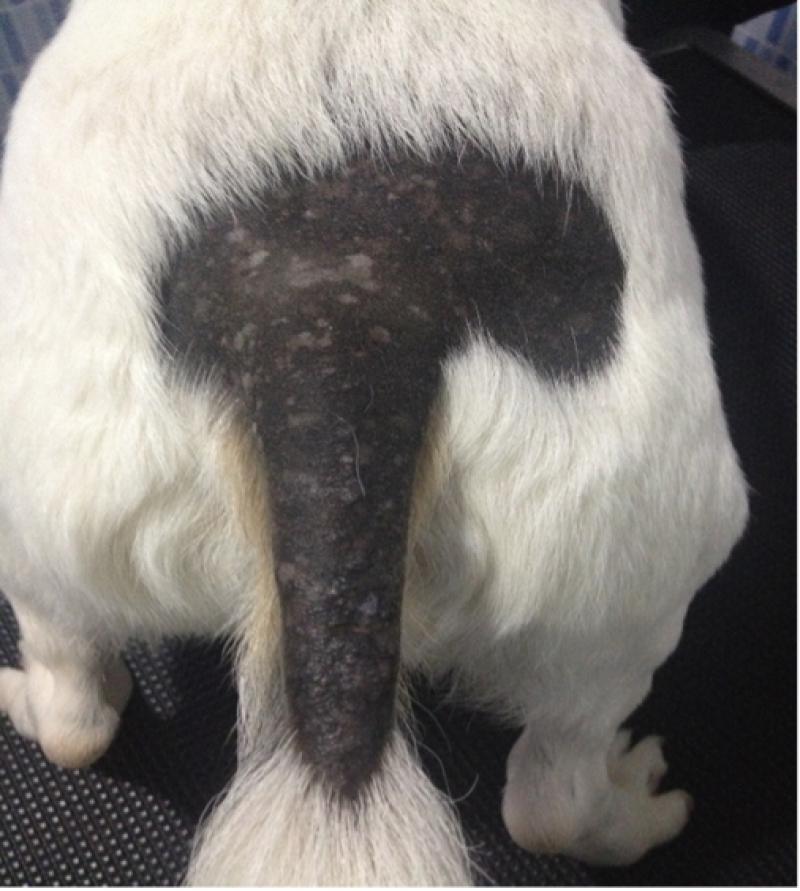
Desde un punto de vista genético están asociadas al gen MHPL, observándose una mutación en estos genes que da como consecuencia defectos en el transporte intracelular de melanina (Figura 5).
>El gen MLPH en el perro es sensiblemente más corto que el humano, 48 kb frente a los 67 kb en el humano, y además posee un alto contenido en guanina y citosina (GC), en concreto un 59.5 % que está muy por encima de la media en humana que se cuantifica en el 41 %.
La sintomatología clínica de esta genodermatosis, se caracteriza por zonas alopécicas en la capa de pelo negro, con hipotricosis y descamación, y con presencia de prurito moderado (3-4 en la escala comportamental de Hill, Lau y Ribnicek, año 2007).
Conclusiones
Las genodermatosis en veterinaria serán en los próximos años un problema mucho más frecuente en la clínica dermatológica diaria, de lo que son en la actualidad, este artículo es solo un resumen de las más importantes y habituales, a la vez existen muchas más y otras como se ha comentado anteriormente, que sin ser genodermatosis, pueden tener una clara influencia genética. En opinión del autor es uno de los campos en dermatología veterinaria más apasionantes de investigación y de evolución.
Por último, le quería dedicar este articulo a mi querido profesor Don Gabriel Lancho de León, que aunque ya no esta con nosotros le hubiera hecho mucha ilusión leer este artículo.
Bibliografia
- Akey JM, Ruhe AL, Akey DT, et al. Tracking footprints of artificial selection in the dog genome. PNAS 107:1160-1165, 2010.
- Cadiergues MC, Patel A, Shearer DH, et al. Cornification defect in the Golden retrivier: clinical, histopathological, ultrastructural and genetic characterization. Vet Derm 19:120-129, 2008.
- Casal ML, Jezyk PF, Greek JM, et al. X-linked ectodermal dysplasia in the dog. J Hered 88:513-517, 1997.
- Casal ML, Mauldin EA, Ryan S, et al. Frequent respiratory tract infections in the canine model of X-linked ectodermal dysplasia are not caused by an immune deficiency. Vet Immunol Immunopathol 107:95–104, 2005.
- Casal ML, Scheidt JL, Rhodes Jl, et al. Mutation identification in a canine model of X-linked ectodermal dysplasia. Mamm Genom 16: 524-531, 2005.
- Clarke A, Phillips DI, Brown R, Harper PS. Clinical aspects of X-linked hypohidrotic ectodermal dysplasia. Arch Dis Child 62:989–996, 1987.
- Credille KM, Barnhart KF, Minor JS, et al. Mild recessive epidermolytic hyperkeratosis associated with a novel keratin 10 donor splice-site mutation in a family of Norfolk terrier dogs. Br J Dermatol 153:51-58, 2005.
- Credille KM, Minor JS, Barnhart KF, et al. Transglutaminase 1-deficient recessive lamellar ichthyosis associated with a LINE-1 insertion in Jack Russell terrier dogs. Br J Dermatol 161:265-272, 2009.
- DiGiovanna JJ, Robinson-Boston L. Ichthyosis: etiology, diagnosis and management. American Journal of Clinical Dermatology 4:81-95, 2003.
- Docampo MJ, Zanna G, Fondevila D, et al. Increased HAS2-driven hyaluronic acid synthesis in shar-pei dogs with hereditary cutaneous hyaluronosis (mucinosis). Vet Derm 22:535-545, 2011.
- Drögemüller C, Karlsson EK, Hytonen M, et al. A Mutation in Hairless Dogs Implicates FOXI3 in Ectodermal Development. Science 321: 1462, 2008.
- Ford CA, Stanfield AM, Spelman RJ, et al. A mutation in bovine keratin 5 causing epidermolysis bullosa simplex, transmitted by a mosaic sire. J Invest Dermatol 124:1170–1176, 2005.
- French KR, Pollitt CC. Equine laminitis: clevage of laminin 5 associated with basement membrane dysadhesion. Equine Vet J 36:242-277, 2004.
- Grall A, Guaguère E, Planchais S, et al. PNPLA1 mutations cause autosomal recessive congenital ichthyosis in golden retriever dogs and humans. Nat Genet 44:140-148, 2012.
- Guaguere E, Bensignor E, Muller A, et al. Epidemiological, clinical, histopathological and ultrastructural aspects of ichthyosis in golden retrievers: a report of 50 cases. Vet Dermatol 18: 382–383, 2007.
- Guaguere E, Berg K, Degorce-Rubioales F, et al. FC-26 junctional epidermolysis bullosa in a Charolais calf with deficient expression of integrinα6β4. Vet Derm 15:28, 2004.
- Mauldin EA, Credille KM, Dunstan RW, et al. The clinical and morphologic features of nonepidermolytic ichthyosis in the golden retriever. Vet Pathol 45:174-180, 2008.
- Mauldin EA., Credille KM., Dunstan RW, et al. Clinical, histopathological and ultrastructural analysis of golden retriever ichthyosis. Vet Dermatol 18 187, 2007.
- Moura E, Cirio SM. Clinical and genetic aspects of X-linked ectodermal dysplasia in the dog a review including three new spontaneous cases. Vet Derm 15:269–277, 2004.
- Olivry T, Linder KE, Wang P, et al. Deficient plakophilin-1 expression due to a mutation in PKP1 causes ectodermal dysplasia skin fragility syndrome in Chesapeake bay retrievier dogs. Plos One, 7:e332072, 2012.
- Riet-Cornea F, Barros SS, dame MC, et al. Hereditary suprabasilar acantholytic mechanobullous dermatosis in buffaloes (bubalus bubalis). Veterinary Pathology 31:450-454, 1994.
- Scott DW, Schultz. Epidermolysis bullosa simplex in the Collie dog. JAVMA 171:721–727, 1977.
- Zanna G, Docampo MJ, Fondevila D, et al. Hereditary cutaneous mucinosis in shar pei dogs is associated with increased hyaluronan synthase-2 mRNA transcription by cultured dermal fibroblasts. Vet Derm 20: 377-382, 2009.
- Zanna G, Fondevila D, Bardagí M, et al. Cutaneous mucinosis in shar pei dogs is due to hyaluronic acid deposition and is associated with high levels of hyaluronic acid in serum. Vet Derm 19: 314-318, 2008.
 by Multimédica
by Multimédica