Dermatitis miliar, como patrón lesional de un gato con FASS
Resumen breve
El síndrome de piel atópica felina (FASS) es un síndrome inflamatorio y pruriginoso de la piel de los gatos manifestado por un espectro de patrones de reacción, que puede estar asociado con anticuerpos IgE contra alérgenos ambientales.Índice de contenidos

Resumen
El síndrome de piel atópica felina (FASS) es un síndrome inflamatorio y pruriginoso de la piel de los gatos manifestado por un espectro de patrones de reacción, que puede estar asociado con anticuerpos IgE contra alérgenos ambientales. Este síndrome es, por lo tanto, el equivalente de lo que se ha descrito previamente como atopia felina o dermatitis de hipersensibilidad felina no inducida por alimentos1,16.
El diagnóstico del FASS en gatos es similar a en perros y se basa en los signos clínicos compatibles y el descarte de otras enfermedades con características clínicas similares. Sin embargo, las lesiones cutáneas de FASS son mucho más variables en apariencia y menos predecibles en distribución, que la de los humanos o los perros y poco se conoce sobre su heredabilidad14.
La dermatitis alérgica por picadura de pulgas (y otros insectos) y las reacciones cutáneas adversas a los alimentos, pueden presentar signos que se superponen a la FASS, no quedando incluidos dentro de la designación de atopia.
Es frecuente en la clínica diaria y requiere abordaje con un protocolo adecuado, que junto con los criterios clínicos nos permita llegar al diagnóstico de dermatitis por hipersensiblidad no relacionado con alimento ni con pulgas (NFNFHD).
Los patrones de reacción involucrados en FASS y sus diferenciales incluyen dermatitis miliar, alopecia/hipotricosis autoinfligida, prurito de cabeza y cuello y complejo granuloma eosinofílico. Alguno de estos patrones, son únicos en los gatos14.
En nuestro paciente destaca como patrón lesional, la dermatitis miliar, que puede ser localizada o generalizada, y puede ser el único signo o bien acompañarse de otras lesiones cutáneas, primarias o secundarias.
Los grupos de pápulas, de pequeño tamaño (1-2 mm), se observan con frecuencia en cabeza y cuello, extremidades, tronco o en la región dorsolumbar. El prurito generalmente está presente, aunque los pacientes con no-prurito pueden parecer clínicamente normales desde la distancia, y las lesiones se vuelven obvias solo al manipular al gato e inspeccionar de cerca la piel1.
Para el control de los signos clínicos debemos recurrir a tratamiento farmacológico con inmunomoduladores, dietas hipoalergénicas e inmunoterapia alergenoespecífica2,3.
Descripción del caso
Se presenta en consulta un gato macho esterilizado Común europeo de pelo corto, de 6 años, por prurito, hipotricosis y lesiones dermatológicas secundarias al rascado y lamido excesivo. Convive con otra gata, sin lesiones. Ambos reciben una dieta de supermercado, están correctamente vacunados y desparasitados interna y externamente.
El examen físico general del paciente es normal, presentando todas las constantes dentro de los valores fisiológicos. En el examen dermatológico, presenta eczema miliar, palpándose pequeñas lesiones papulocostrosas distribuidas desde la zona dorsal interescapular, toda la región dorsolumbar, hasta la base de la cola (Figura 1).
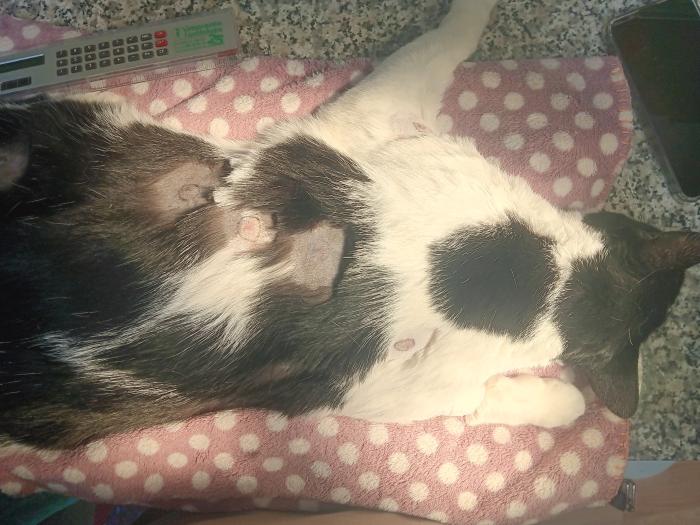
Figura 1. Aspecto macroscópico de las lesiones , marcaje y medición para toma de muestras para el estudio histopatológico de las lesiones
Entre los diagnósticos diferenciales se consideran las dermatosis pruriginosas como causa de la dermatitis miliar: DAPP, non-food non-flea hypersensitivity dermatitis (NFNFHD) y alergia alimentaria, ectoparásitos como Trombiculae spp. (ácaro de la cosecha), Cheyletiella spp., Otodectes cynotis, Sarcoptes scabiei, Felicola subrostratus, Notoedres cati y Demodex spp. e infecciosas (dermatofitosis, piodermas superficiales) o reacciones medicamentosas.
El examen microscópico del pelo adyacente a la zona de las lesiones papulocostrosas, presenta puntas rotas, debido al exceso de lamido por prurito que presenta el paciente.
La citología en superficie de las lesiones evidencia una alta concentración de células linfoides marcadamente homogéneas, de tamaño intermedio, sin displasias aparentes morfológicas y bien conservadas. Encontramos además un número reducido de eosinófilos y células fusiformes reactivas compatibles con fibroblastos. Sin presencia de agentes infecciosos (Figura 2).
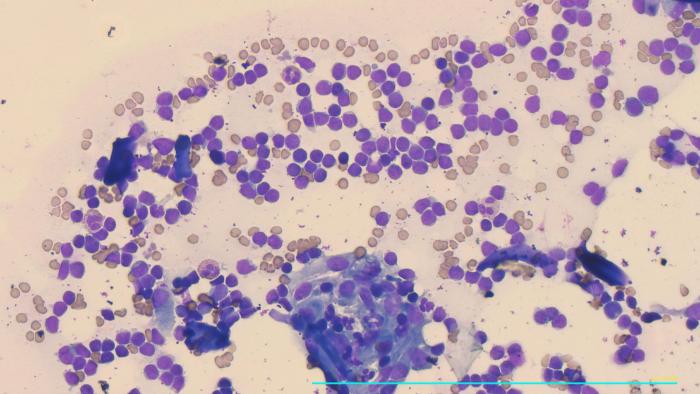
Figura 2. Abundantes células linfoides, la mayoría son células intermedias se morfología redonda, algunos eosinófilos no degenerados y fibroblastos con incremento de la basofilia citoplasmática sin displasias morfológicas celulares o nucleares. Sin agentes infecciosos.
El raspado cutáneo, examen con la lámpara de Wood, cultivo de dermatofitos y la prueba del celo son negativos. El examen coprológico por flotación resulta negativo y también se descartan causas parasitarias.
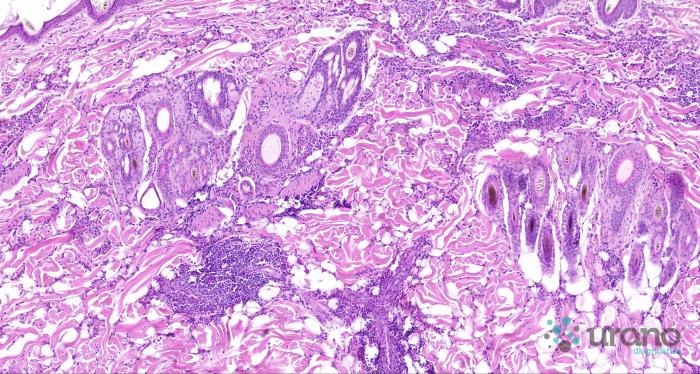
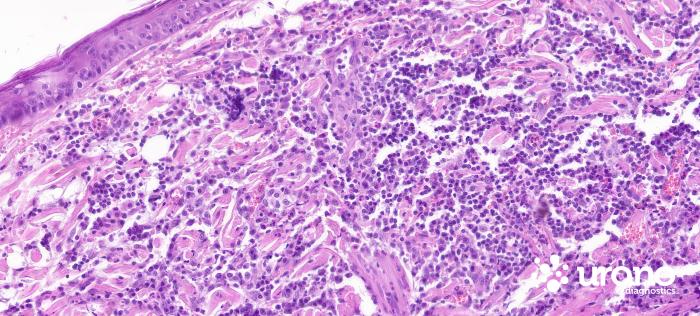
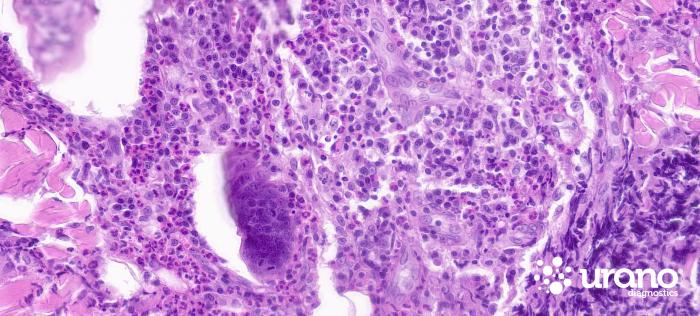
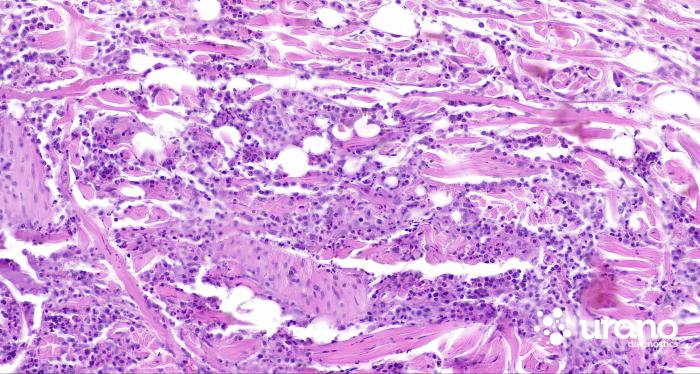
La biopsia de los nódulos, tras su exéresis quirúrgica confirma una dermatosis eosinofílica de multifocal a difusa moderada a intensa crónica y descarta el linfoma cutáneo (Figura 3A-E).
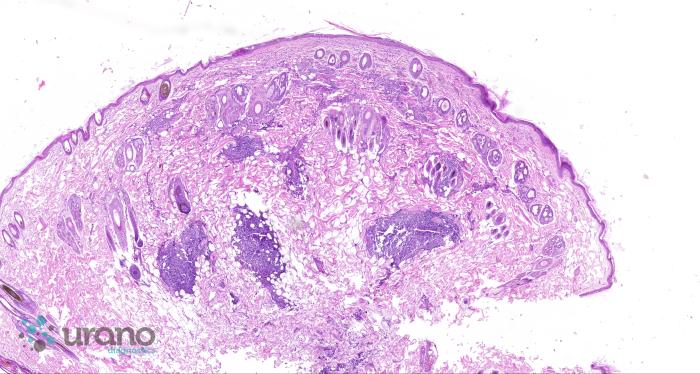
Figura 3. Hematoxilina/eosina (A) 4x, (B) 10x. Nódulos multifocales localizados con predominio perifolicular/perianexal, hematoxilina/eosina (C) 40x, (D, E) 60x. Infiltrados inflamatorios predominantemente eosinofílicos, y menor componente neutrofílico, macrofágico y linfoplasmocitario.
El tratamiento consiste en la aplicación de furalaner en spot-on (Bravecto®, MSD salud animal) para el control parasitario y prednisolona vía oral a dosis de 1 mg/kg cada 24 horas (Prednicortone®,Dechra) durante 7 días, disminuyendo la dosis a 0.5 mg/kg cada 24 horas durante 10 días, ácidos grasos y limpieza tópica (Douxo pyo pads®, Ceva).
La respuesta clínica inicialmente es buena, pero al interrumpir el tratamiento oral, las lesiones reaparecen. Se retoma el tratamiento oral y a la vez se instaura una dieta hipoalergénica (z/d Hill´s) para descartar por protocolo diagnóstico, las reacciones de hipersensibilidad al alimento. Se administra la dieta conservada congelada (reduce el depósito de ácaros sobre la misma), en porciones durante 10 semanas, sin observar respuesta clínica.
Tras descartar las reacciones cutáneas (dermatitis eosinofílica) a parásitos y alimentos, nos queda el diagnóstico clínico de FASS.
Para controlar la sintomatología, usamos la inmunoterapia, tras realizar un test serológico de alérgenos ambientales, con resultados positivos (más de 19 unidades de ELISA) a ácaros Dermatophagoides farinae, Tyrophagus putrescentiae, Dermatophagoides pteronyssinus y (más de 15 unidades) a pólenes, a Parietaria judaica y Ambrosia elatior. Se elabora inmunoterapia con los ácaros y los pólenes descritos y se inicia inmunoterapia con vacuna subcutánea.
Pronto hay una mejora en la sintomatología clínica valorada por la propietaria de 7/10 al iniciar el tratamiento (valorado con el sistema SCORFAD, por las siglas en inglés de scoring feline allergic dermatitis, unaescala de valoración de la severidad de las lesiones) y de 2/10 a los 3 meses, despareciendo el eczema miliar prácticamente en toda su extensión. No ha necesitado terapia farmacológica coadyuvante desde el inicio de la inmunoterapia.
Discusión
El término dermatitis por hipersensibilidad felina ha sido reemplazado por el síndrome de piel atópica felina (FASS), que se refiere explícitamente a enfermedades alérgicas de la piel inducidas por alérgenos ambientales (por ejemplo, ácaros del polvo, pólenes)15,17. La FASS es la enfermedad pruriginosa inflamatoria de la piel de los gatos más prevalente (20 %)16.
Los gatos con diagnóstico de FASS suelen presentar uno o más de los siguientes patrones lesionales: dermatitis miliar, alopecia simétrica autoinducida, prurito facial de cabeza y cuello con excoriaciones y erosiones y complejo de granuloma eosinofílico. Las manifestaciones de prurito en gatos son rascarse, frotarse, masticar, lamer y/o excesivo aseo (Tabla 1).
| Presencia de: |
|---|
|
| Ausencia de: |
|
Tabla 1. Criterios de diagnóstico para felinos síndrome atópico (alimentación y/o inducido por el medio ambiente) (adaptada de Vargo, Cheryl and Frane Banovic. Insights in dermatology feline atopic skin syndrome. 2022).
Por tanto la dermatitis miliar no es un diagnóstico, sino un patrón de reacción con muchas etiologías posibles diferentes; la lista de diagnósticos diferenciales es extensa e incluye la hipersensibilidad a la picadura de la pulga, reacción adversa al alimento cutánea, la dermatitis atópica, ectoparásitos, infecciones (por bacterias, virus, levaduras o dermatofitos), reacciones cutáneas adversas medicamentosas, pénfigo foliáceo, desequilibrios nutricionales, síndrome hipereosinofílico felino y urticaria pigmentosa, o las neoplasia cutáneas (linfoma cutáneo, carcinoma de células escamosas, mastocitoma)4,5.
Al no existir lesiones patognomónicas de la enfermedad de hipersensibilidad en gato, es necesario descartar enfermedades similares.
Una vez descartadas las enfermedades infecciosas y parasitarias, es importante instaurar una dieta de eliminación durante 6-8 semanas con una dieta de proteínas y carbohidratos novel para el gato y tras el período enfrentarlo a la dieta original, para confirmar la recurrencia de los signos clínicos.
En la citología del paciente la presencia de una población linfoide homogénea a nivel cutáneo junto con una presentación nodular múltiple hace que el linfoma cutáneo sea un origen plausible, siendo necesaria la confirmación histopatológica del proceso, ya que fenómenos inmunomediados pueden provocar una reacción cutánea similar8.
Sin embargo, el estudio histopatológico de las lesiones, evidencia hiperplasia epidérmica moderadamente intensa, asociada a discreta hiperqueratosis focalmente paraqueratótica, con áreas erosivas. A nivel dérmico, se observan infiltrados inflamatorios predominantemente eosinofílicos y menor componente neutrofílico, macrofágico y linfoplasmocitarios, que descarta el proceso neoplásico y confirma la dermatosis eosinofílica multifocal a difusa moderada-intensa a crónica.
Para su tratamiento es necesario el uso de fármacos inmunomoduladores glucocorticoides o imunosupresores como la ciclosporina, cuya respuesta clínica suele ser eficaz y se busca la dosis mínima efectiva para evitar efectos secundarios a medio-largo plazo10,12.
En nuestro paciente fue necesario recurrir a la inmunoterapia específica con alérgenos felinos (ASIT), que se considera un tratamiento seguro y eficaz para la atopia felina. ASIT, se define como la práctica de administrar cantidades gradualmente crecientes de un extracto alérgeno a un sujeto alérgico. La finalidad es reducir o eliminar los síntomas asociados a exposiciones posteriores al alérgeno causante. Algunos autores, recomiendan la inmunoterapia alergenoespecífica con una respuesta clínica de entre 60-78 % en pacientes con atopia felina.
De igual importancia es tener un sistema scoring feline allergic dermatitis (SCORFAD), sabiendo que una reducción igual o superior al 50 % en la puntuación es considerado como buena respuesta al tratamiento y owner pruritus score (OPS), como escala para la valoración de los criterios clínicos usados para el diagnóstico y seguimiento de la respuesta a los tratamientos aplicados6.
La inmunoterapia ha demostrado ser un tratamiento seguro y eficaz en este caso, observando una mejoría excelente en los signos clínicos y disminución de los niveles de IgE específicos en sangre. Es el único tratamiento para FASS que tiene el potencial de inducir tolerancia y permitir la reducción o eliminación completa de otros tratamientos a largo plazo.
Además, la incidencia informada de efectos secundarios en pacientes felinos atópicos sometidos a ASIT es muy baja y principalmente anecdótica13.
Bibliografía
1. Bajwa J. Feline atopic syndrome - An update. Can Vet J. 2021 Nov;62(11):1237-1240.
2. Favrot C. Feline Non-Flea Induced Hypersensitivity Dermatitis: Clinical features, diagnosis and treatment. Journal of Feline Medicine and Surgery. 2013;15(9):778-784.
3.Favrot C, Steffan J, Seewald W, Hobi S, Linek M, Marignac G, Olivry T, Beco L, Nett C, Fontaine J, Roosje P, Bergvall K, Belova S, Koebrich S, Pin D, Kovalik M, Meury S, Wilhelm S. Establishment of diagnostic criteria for feline nonflea-induced hypersensitivity dermatitis. Vet Dermatol. 2012 Feb;23(1):45-50, e11.
4. Beale KM. Miliary Dermatitis, 22nd Annual Congress of the ESVD-ECVD on Veterinary Dermatology. Mainz, Germany 2007: 171-176.
5. Grant DI. Miliary dermatitis in the cat. Journal of Small Animal Practice 1991; 32: 387-393.
6. Steffan J., Olivry T., Forster SL, Seewald W. Responsiveness and validity of the SCORFAD, an extent and severity scale for feline hypersensitivity dermatitis. Vet Dermatol. 2012 Oct; 23(5):410-e7
7. Jackson A, Foster A. Management of feline military dermatitis: a clinical update. In Practice 2006; 28: 147-151.
8.Economu, L., Stell, A., O'Neill, D.G., Schofield, I., Stevens, K. and Brodbelt, D. (2021), Incidence and risk factors for feline lymphoma in UK primary-care practice. J Small Anim Pract, 62: 97-106.
10. Noli C, Scarampella F. Prospective open pilot study on the use of cyclosporin for feline allergic skin disease. Journal of Small Animal Practice 2006; 47: 434-438.
11. Scott DW, Miller WH, Griffin CE. Skin Immune System and Allergic Skin Diseases. En: Muller and Kirk´s Small Animal Dermatology, 6th edition. Philadelphia, PA: W.B. Saunders Company, 2001:632-633.
12. Roberts ES, Tapp T, Trimmer A, Roycroft L, King S. Clinical efficacy and safety following dose tapering of ciclosporin in cats with hypersensitivity dermatitis. Journal of Feline Medicine and Surgery. 2016;18(11):898-905.
13. Trimmer AM, Griffin CE, Rosenkrantz WS. Feline immunotherapy. Clin Tech Small Anim Pract. 2006 Aug;21(3):157-61.
14.Santoro D, Pucheu-Haston CM, Prost C, Mueller RS, Jackson H. Clinical signs and diagnosis of feline atopic syndrome: detailed guidelines for a correct diagnosis. Vet Dermatol. 2021 Feb;32(1):26-e6
15.Halliwell R, Pucheu-Haston CM, Olivry T, Prost C, Jackson H, Banovic F, Nuttall T, Santoro D, Bizikova P, Mueller RS. Feline allergic diseases: introduction and proposed nomenclature. Vet Dermatol. 2021 Feb;32(1):8-e2.
16.Hobi S, Linek M, Marignac G, et al. Clinical characteristics and causes of pruritus in cats: a multicentre study on feline hypersensitivityassociated dermatoses. Vet Dermatol. 2011;22(5):406-413
17.Vargo, Cheryl and Frane Banovic. “INSIGHTS IN DERMATOLOGY Feline Atopic Skin Syndrome.” (2022).
18.Diesel A. Cutaneous Hypersensitivity Dermatoses in the Feline Patient: A Review of Allergic Skin Disease in Cats. Vet Sci. 2017 May 9;4(2):25
 by Multimédica
by Multimédica
