Infección por Mycobacterium avium en perros: revisión del tema y presentación de un caso clínico.
Resumen breve
Los perros son naturalmente resistentes a las infecciones por el complejo Mycobacterium avium-intracellulare (MAC); sin embargo, existe una predisposición en ciertas razas, así como en algunos individuos en particular. La presentación clínica mas frecuente se caracteriza por cuadros gastrointestinales con compromiso de linfonódulos superficiales y profundos. El diagnóstico confirmatorio constituye un desafío para el veterinario clínico e involucra tinciones específicas (Ziehl Neelsen), cultivos…Índice de contenidos
Resumen
Los perros son naturalmente resistentes a las infecciones por el complejo Mycobacterium avium-intracellulare (MAC); sin embargo, existe una predisposición en ciertas razas, así como en algunos individuos en particular. La presentación clínica mas frecuente se caracteriza por cuadros gastrointestinales con compromiso de linfonódulos superficiales y profundos. El diagnóstico confirmatorio constituye un desafío para el veterinario clínico e involucra tinciones específicas (Ziehl Neelsen), cultivos diferenciales y métodos moleculares. Existen diferentes protocolos antibióticos para el tratamiento siendo el pronóstico, en muchos casos, reservado. El objetivo de este trabajo fue realizar una revisión sobre la infección por MAC en caninos así como la presentación de un caso clínico de un canino joven de raza Schnnauzer Miniatura oriundo de Buenos Aires, Argentina.
Introducción
El complejo Mycobacterium avium-intracellulare (MAC) es un grupo de micobacterias estrechamente relacionadas, con distintos grados de patogenicidad, diferencias en su distribución ambiental y en su hospedador primario. MAC está formado por dos integrantes: M. avium y M. intracelullare. A su vez, la especie M. avium se encuentra dividida en cuatro subespecies conocidas: M. avium avium, M. avium paratuberculosis, M. avium hominissuis y M. avium silvaticum1.
Producen infecciones en diferentes hospedadores, incluidos el hombre, rumiantes domésticos y silvestres, porcinos, equinos y aves domésticas, entre otros. Con menos frecuencia, produce enfermedad en caninos y felinos2,3. En caninos han sido reportadas infecciones por las siguientes subespecies: M. avium avium4, M. avium hominissuis 5,3 y M. avium paratuberculosis6.
Los perros son naturalmente resistentes a las infecciones por M. avium; sin embargo, existe cierta predisposición racial e individual. Estas infecciones se pueden dar en cualquier tipo de canino, aunque es más frecuente en Schnnauzer Miniatura, Basset Hound, Pug y Yorkshire terrier7,8,5,9,10,3. Probablemente existan linajes donde existe un compromiso primario de la respuesta inmune celular. Esto favorecería la colonización y diseminación de M. avium11,12.
El mecanismo de transmisión en los perros es a través del medio ambiente11; ya que estos microorganismos se encuentran principalmente en el suelo, el agua y las heces de aves.
Ingresan al organismo por diferentes vías: por inhalación, por vía oral o por inoculación percutánea13. La infección puede ser localizada o diseminada, dependiendo del inóculo, de la inmunidad y de la susceptibilidad del individuo afectado. Una vez en el interior del organismo, los bacilos son fagocitados por macrófagos. Dentro de estas células, sobreviven y se multiplican. La diseminación de los macrófagos infectados permite la formación de granulomas en diferentes tejidos y órganos, así como una inflamación crónica persistente14. Los granulomas se forman, con mayor frecuencia, en hígado, intestino, bazo y médula ósea6. A diferencia de lo que ocurre en otras especies, los granulomas producidos en caninos por M. avium presentan un centro de necrosis licuefactiva y formación de células gigantes15.
Signos clínicos
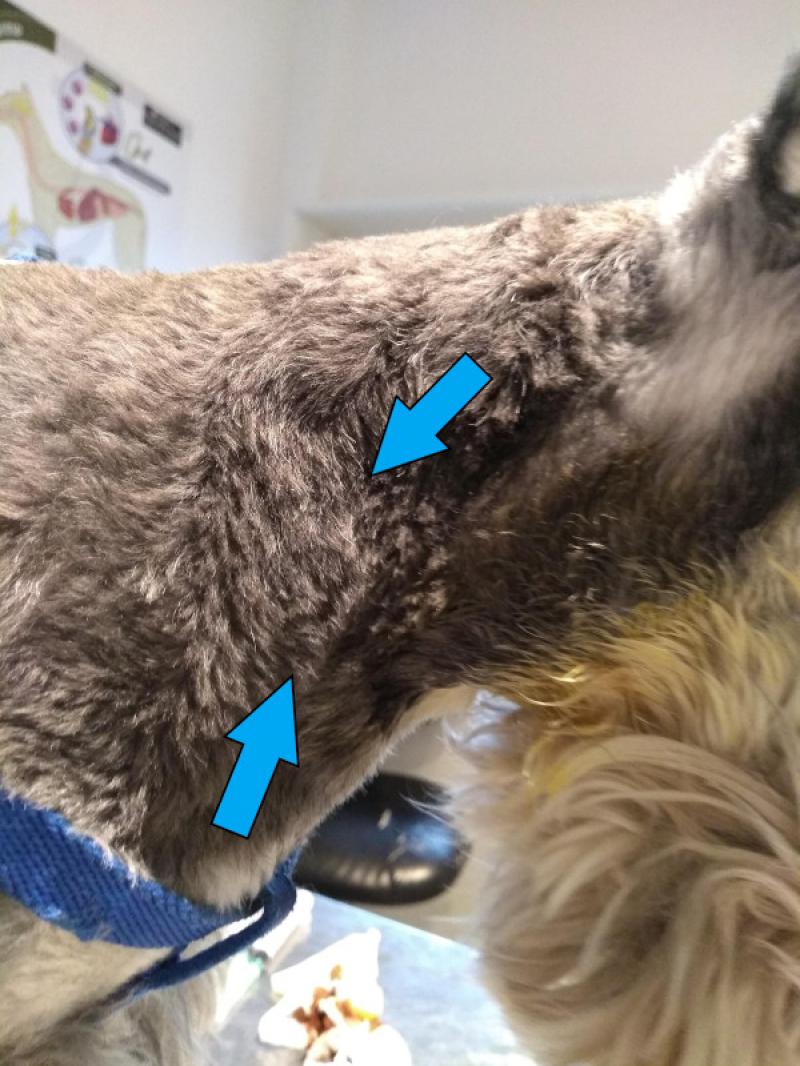
La sintomatología es variable, y está asociada a la vía de ingreso del agente. Dentro de la sintomatología inespecífica, se evidencia decaimiento, febrícula y pérdida de peso. Más característico es el compromiso de diferentes linfonódulos superficiales y profundos3,10. A la inspección por palpación pueden percibirse afectados dos o más linfonódulos superficiales, donde se identifica aumento de tamaño y alteración en la consistencia (Figura 1).
Los cuadros gastrointestinales están mayormente asociados a la infección por vía oral, siendo estos los más reportados en la literatura internacional3,7,8,14,16,17,18, así también, como en la experiencia de los autores. Los signos gastrointestinales incluyen anorexia o hiporexia, náuseas, vómitos y/o diarreas continuas o intermitentes. Las deposiciones pueden estar acompañadas por presencia de sangre fresca, moco o melena dependiendo del compromiso en mucosa intestinal. Puede existir disfagia si hay afección extensa de los linfonódulos submaxilares y cervicales. A la palpación abdominal, se podrá comprobar la linfoadenomegalia mesentérica, así como también el engrosamiento de la mucosa intestinal. Con frecuencia, se puede observar en estos pacientes pérdida crónica de peso con apetito conservado.
A diferencia de lo que ocurre con Mycobacterium tuberculosis en caninos, no son frecuentes los síntomas respiratorios, aunque en necropsia se pueden hallar granulomas en el parénquima pulmonar10.
Con menor frecuencia, se han reportado lesiones a nivel de la médula espinal con signos neurológicos asociados, uveítis, lesiones nodulares en piel y osteomielitis, esta última se evidencia por claudicaciones de aparición repentina8,10,19.
Diagnóstico
Laboratorio de rutina
Los hallazgos que se pueden detectar en un análisis de sangre incluyen anemia arregenerativa, de leve a moderada, leucocitosis (con neutrofilia y linfopenia), hiperproteinemia, hipoalbuminemia, así como un incremento en las enzimas hepáticas10,13,14,16.
Ultrasonografía
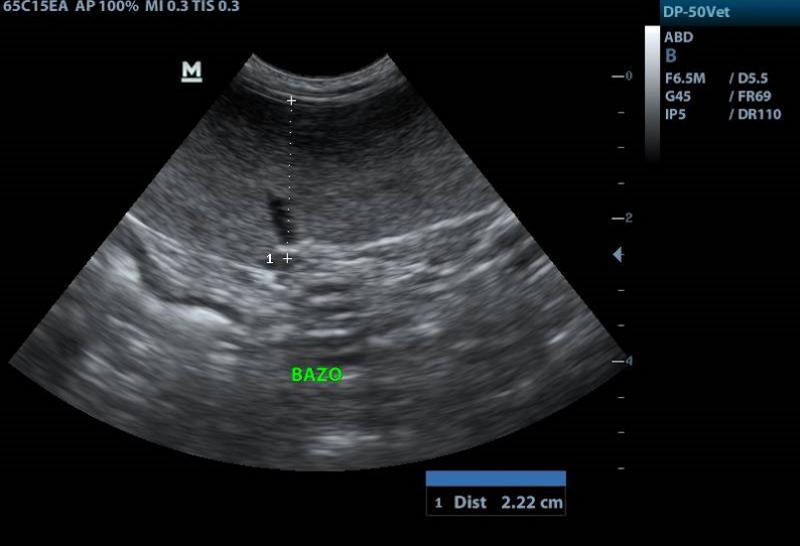
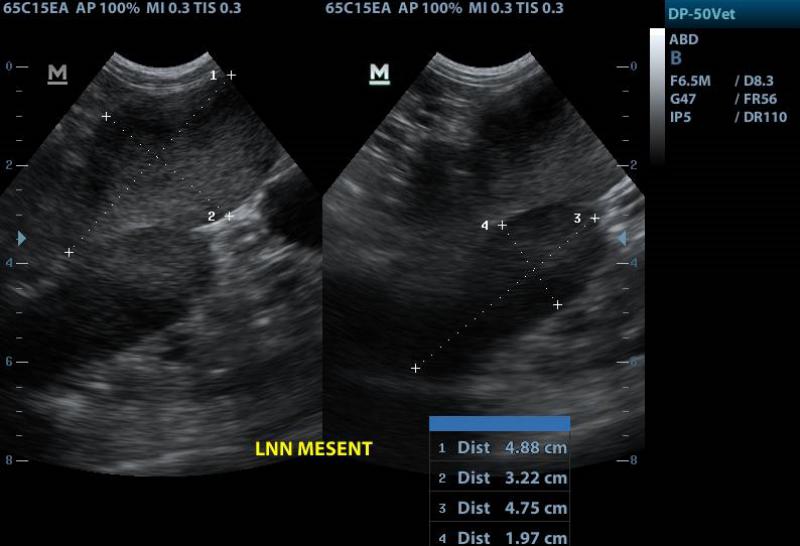
La ecografía puede revelar esplenomegalia, hepatomegalia así como compromiso marcado de los linfonódulos mesentéricos. A su vez, pueden observarse nódulos hipoecoicos en forma aislada en hígado y/o bazo. Otro hallazgo posible, es el engrosamiento de la pared intestinal10,16,17.
Toma de muestra
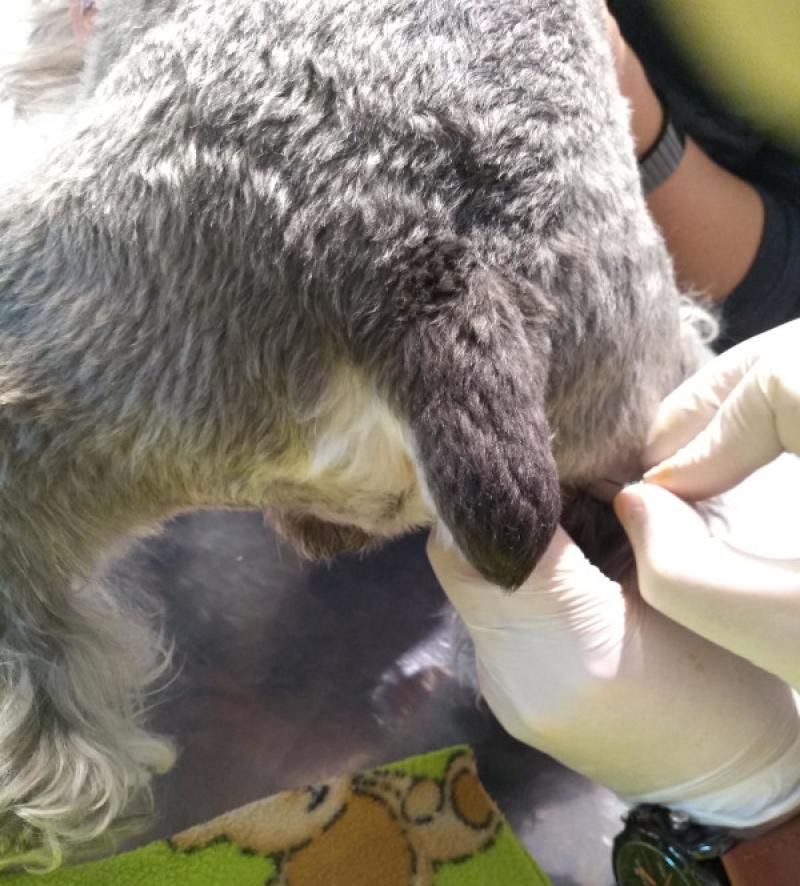
Frente a la presencia de linfoadenomegalia superficial generalizada en un paciente sospechoso de infección por MAC, se debe realizar la punción – aspiración con aguja fina de dos o más linfonódulos afectados (Figura 2). No se recomienda hacer la punción en linfonódulos submaxilares ya que pueden estar reactivos por procesos inflamatorios/infecciosos de cavidad oral.
Una vez obtenido el material de punción, se realiza el extendido en portaobjetos. En el caso de realizarse una tinción de rutina, como es la de Giemsa, es esperable encontrar bacilos con tinción negativa, así como una importante población de macrófagos y células gigantes.
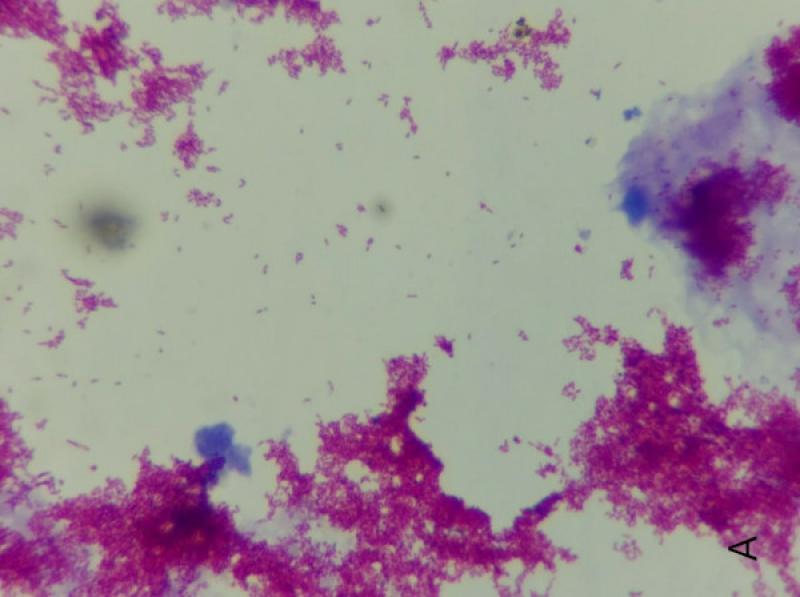
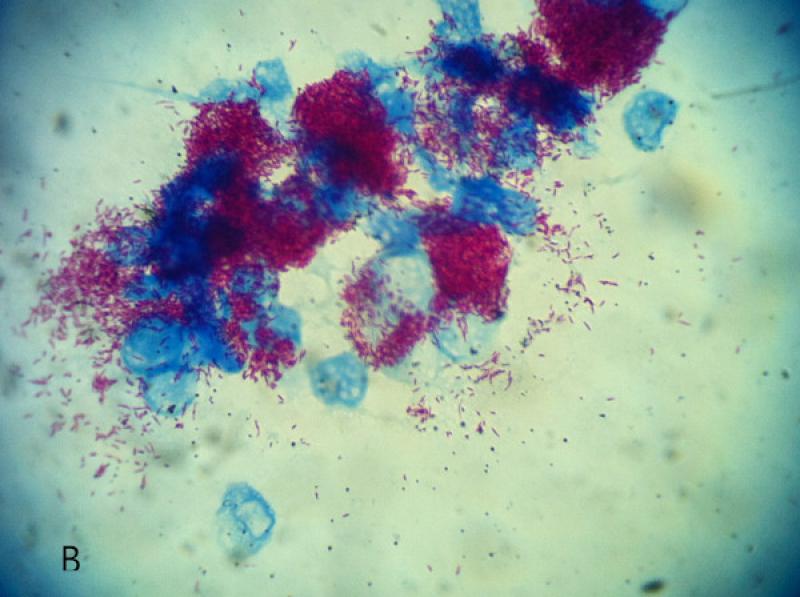
Se debe realizar, una tinción diferencial, la tinción de Ziehl Neelsen (Z-N), para evidenciar los bacilos acido alcohol resistentes (BAAR)3. (Fig. 3) También se puede realizar punción de medula ósea para evidenciar macrófagos activados con bacilos positivos a la tinción de Z-N14.
Diagnóstico microbiológico
La muestra debe ser procesada con los recaudos de bioseguridad necesarios para la manipulación de este tipo de microorganismos
Cultivo bacteriológico
Para eliminar la flora saprofita de la muestra y obtener un cultivo en pureza, ésta debe ser decontaminada previamente por algún método, como por ejemplo el método de Petroff 20. Este método utiliza NaOH al 4 % que elimina la flora saprofita mientras que las micobacterias resisten a su contacto. Luego el sedimento es sembrado en medios de cultivo específicos y diferenciales. Los más utilizados son los medios sintéticos y los elaborados a base de yema de huevo.
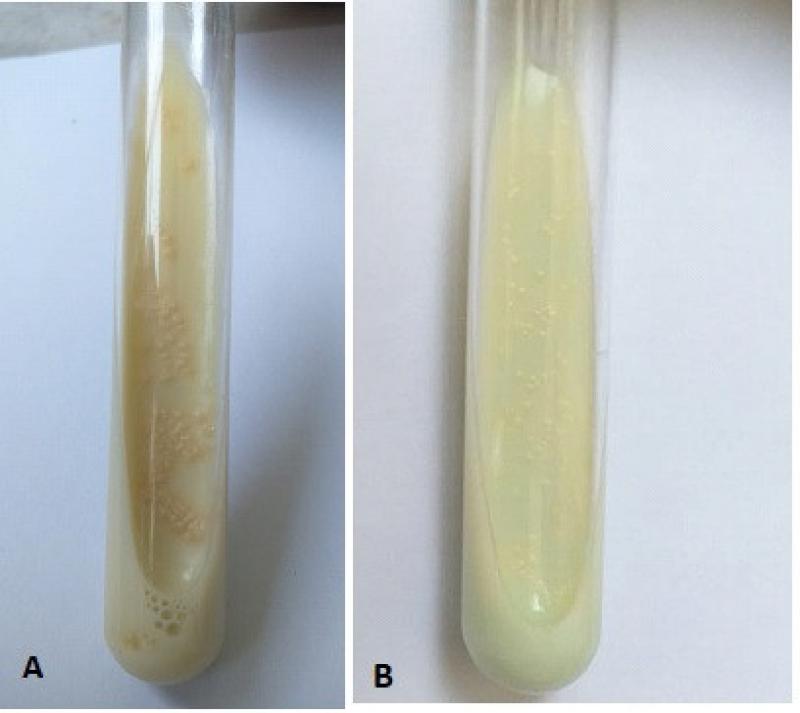
Dentro de los últimos, se encuentra el medio de Löwestein Jensen (LJ), con glicerol como fuente de carbono, para el desarrollo de Mycobacterium tuberculosis, MAC y otras micobacterias ambientales, y el medio Stonebrink (ST) con piruvato como fuente de carbono, para el desarrollo de Mycobacterium bovis, siendo ésta la micobacteria patógena principal en el ámbito veterinario (Figura 4)
La siembra en paralelo en los dos medios se realiza para poder diferenciar las principales micobacterias que pueden afectar a los caninos, siendo esto importante debido a los diferentes riesgos zoonóticos y tratamientos antibióticos específicos necesarios4.
Diagnóstico molecular
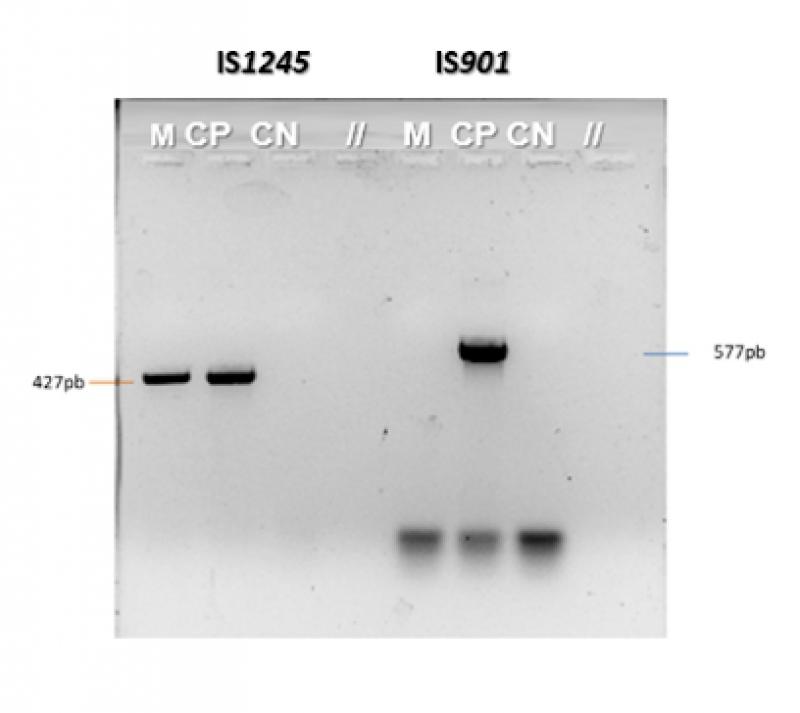
Una vez obtenido el cultivo en pureza se prosigue con la identificación de especie y subespecie a través de técnicas moleculares como la técnica de PCR. Las secuencias más utilizadas para diferenciar las principales micobacterias son: IS6110 para complejo Mycobacterium tuberculosis e IS1245 para MAC21,22.
Para identificar y diferenciar intraespecie las micobacterias del complejo Mycobacterium tuberculosis se utiliza comúnmente la técnica de Spoligotyping23. Para identificar las especies dentro del MAC, se amplifican otras secuencias IS901 e IS900 para diferenciar Mycobacterium avium avium de Mycobacterium avium hominissuius la primera y la segunda para identificar Mycobacterium avium paratuberculosis24,25 (Figura 5).
Luego se puede continuar con la genotipificación y diferenciación por técnicas de Variable Number of Tandem Repeats VNTR26.
Diagnóstico post mortem
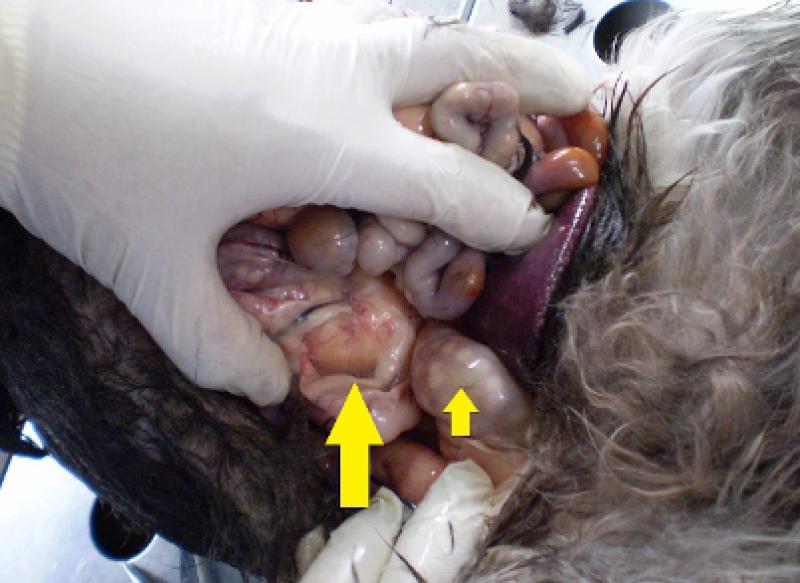
En la necropsia de caninos infectados, se destaca el compromiso preponderante del tracto intestinal12,14. A nivel abdominal, los hallazgos más relevantes son la presencia de adenomegalias mesentéricas con tamaños que van de 3-12 cm de diámetro (Figura 6).
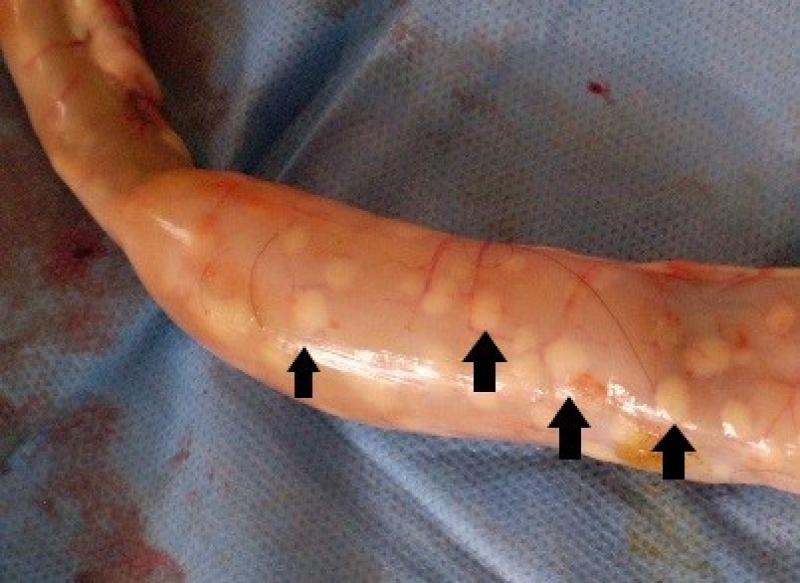
En el intestino, en prácticamente todo su recorrido, se muestra hiperplasia de los nódulos linfoides (Placas de Peyer), que son fácilmente identificables al exponer la luz de estos18 (Figura 7). En la observación microscópica, se evidencian un reemplazo del tejido linfoide por población mayormente histiocitaria con alta carga de BAAR4,14 (Figura 8).
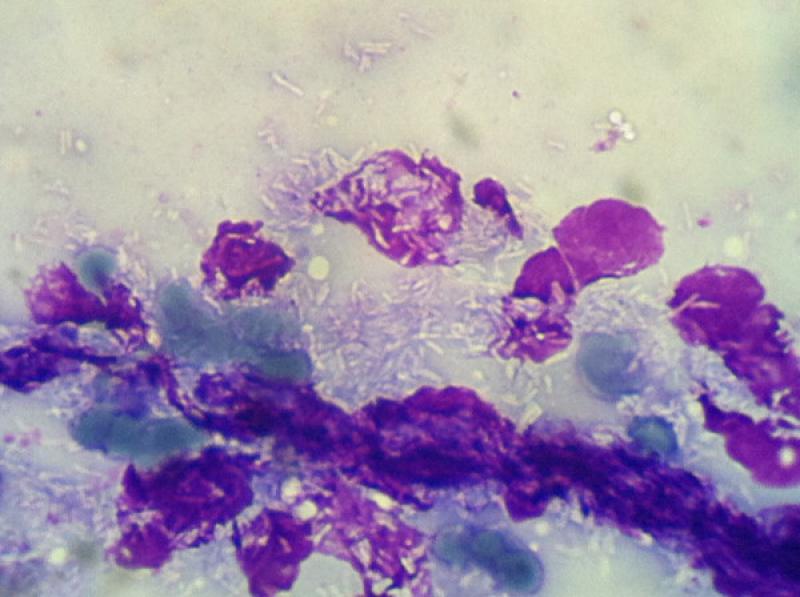
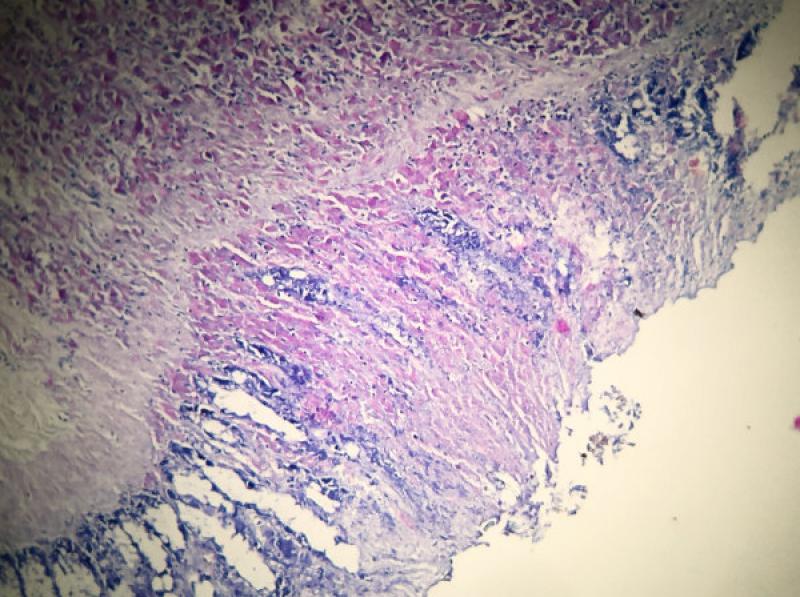
Los nódulos que infiltran el corion laminar de la mucosa invaden las vellosidades y en gran cantidad exulceran hacia la luz descargando bacilos con posterior eliminación con las heces17 (Figura 9). La estructura microscópica de los mismos muestra características similares en algunos casos a las observadas en la enfermedad de Crohn, que se sabe se relaciona también con micobacterias de este complejo27.
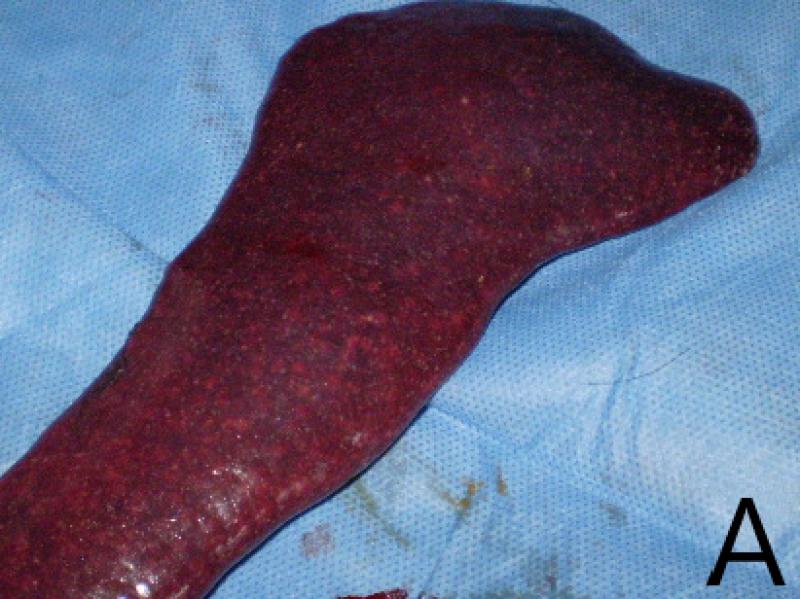
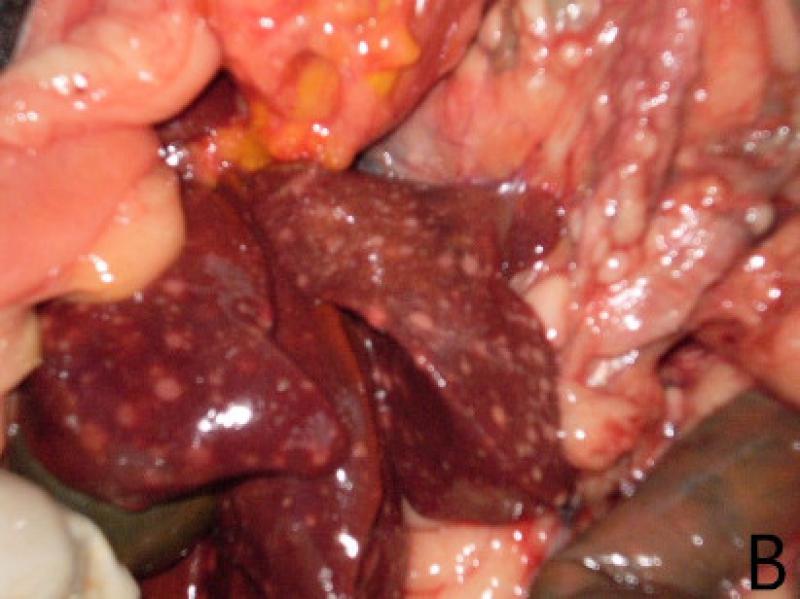
En algunos animales se ha observado diseminación significativa en bazo, en otros, adenomegalia mediastinal8,18. El hígado también puede verse invadido por los granulomas (Figura 10).
Tratamiento
El tratamiento de las infecciones por MAC en caninos constituye un verdadero desafío. Como droga primaria, el uso de macrólidos, como claritromicina o azitromicina, es primordial8,10. Estas drogas son de amplia utilización en medicina humana frente a pacientes con infecciones por micobacterias no tuberculosas4. Los macrólidos utilizados como monodroga no son eficaces y generan rápidamente resistencia; por lo tanto, deben combinarse con otras drogas7,8.
La terapia inicial debe incluir, al menos, dos antibióticos y en algunos casos, hasta tres. Existen protocolos que incluyen azitromicina o claritromicina, etambutol y rifampicina28 o fluoroquinolonas en reemplazo de la rifampicina8. En casos severos, se ha utilizado como tercer antibiótico a la amikacina o estreptomicina del grupo de los aminoglucósidos29.
Pronóstico
Según la bibliografía, no existe un tratamiento completamente efectivo para infecciones generalizadas producidas por bacterias del MAC. Algunos pacientes mueren durante el tratamiento12,18 o los propietarios decidieron la eutanasia8,16,17,18,3. Sin embargo, el diagnóstico temprano, los controles veterinarios periódicos, así como el uso de combinaciones de diferentes antibióticos pueden prolongar la vida, por años, de estos pacientes (Fernandez & Iachini, datos no publicados).
Potencial zoonótico
Las personas están continuamente expuestas a micobacterias del MAC presentes en el medio ambiente, animales domésticos y silvestres, pero solo un pequeño porcentaje, de la interacción hombre/micobacteria, evoluciona a una infección clínica4.
Los pacientes con algún tipo de inmunocompromiso son las personas de mayor riesgo a desarrollar enfermedad por este tipo de micobacterias30.Aunque no existen reportes registrados de infección por contacto con perros o gatos, hay un potencial riesgo zoonótico, principalmente cuando se encuentra involucrada la subespecie de M. avium31.
Por otro lado, la eliminación de agentes del MAC por heces, constituiría una fuente adicional de contagio para aquellos pacientes susceptibles17.
Caso clínico

Se presenta al servicio de enfermedades infecciosas y parasitarias de la Clínica Veterinaria Panda, un paciente canino, de 3 años, macho castrado, raza Schnauzer Miniatura derivado del centro veterinario San Martín. El paciente fue remitido por un diagnóstico de infección por Mycobacterium avium (Figura 11).
Dentro de sus antecedentes contaba con un cuadro de decaimiento y de malestar gastrointestinal que fue mejorando con el tratamiento sintomático. Sin embargo, con la evolución de los días, manifestó adenomegalia evidente en linfonódulos poplíteos, submaxilares, pre escapulares y axilares. Dentro de los métodos complementarios, en la ecografía abdominal se evidenció linfoadenopatías mesentéricas así como esplenitis.
La placa de tórax sin alteraciones. Se realizó una PAAF del linfonódulo poplíteo izquierdo revelando linfoadenitis granulomatosa con BAAR.
El diagnóstico definitivo se realizó en el servicio de la cátedra de Enfermedades Infecciosas – Facultad de Ciencias Veterinarias, Universidad de Buenos Aires. Se sembró la muestra recuperada de la PAAF en los dos medios diferenciales (ST-LJ). Se observó desarrollo en el medio de LJ al día 17 de siembra, se realizó la tinción de Z-N donde se observaron BAAR. Se suspendieron tres colonias en agua destilada estéril y se obtuvo ADN por lisis térmica. Se realizó la identificación de especie de micobacteria presente por medio de la técnica de PCR. Los resultados fueron positivos a la secuencia de inserción 1245 y negativos a IS901 y a IS900, indicando que se trataba de Mycobacterium avium hominnissuis. Simultáneamente se realizó notificación del caso al centro de zoonosis local y la propietaria fue derivada al Hospital de Enfermedades Infecciosas “Francisco J. Muñiz” para su control.
Una vez derivado al servicio, en la exploración clínica, se detectó la presencia de una linfoadenomegalia generalizada de los linfonódulos superficiales (principalmente de los poplíteos y pre-escapulares), con consistencia firme. La mucosa gingival se encontraba levemente pálida. No manifestó dolor a la palpación abdominal ni se evidenció, por maniobras semiológicas, la presencia de linfoadenomegalia mesentérica.
Dentro de la analítica sanguínea, se observó un hematocrito de 32% así como un aumento de la ALT, con un valor de 253 UI/l. El resto de los parámetros se encontraban dentro de los valores normales. La serología para Ehrlichia canis fue negativa.
Se instauró un protocolo antibiótico que incluyó: claritromicina (10 mg/kg/12h) + ciprofloxacina (10 mg/kg/24h) + etambutol (10 mg/kg/24h). El mismo ya había sido utilizado previamente en el tratamiento de otros caninos con el mismo cuadro clínico por M.avium (Fernandez & Iachini, datos no publicados).
Al mes de comenzar el tratamiento, el paciente no manifestó recidivas clínicas y había mejorado notablemente. Todos los parámetros hematológicos y bioquímicos se encontraron dentro de valores normales. En la exploración, continuaba la linfoadenomegalia generalizada de linfonódulos superficiales y la ecografía reveló linfoadenitis mesentérica así como esplenitis (Figura 12).
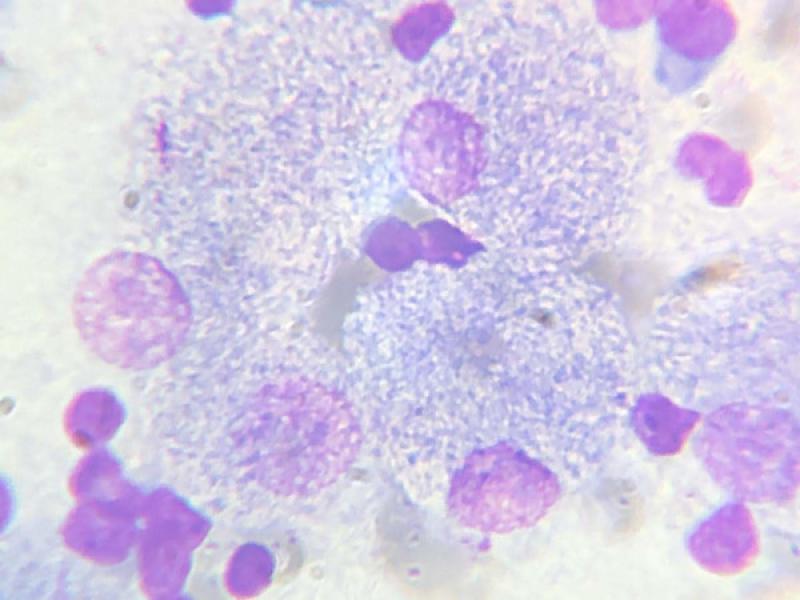
A su vez, se repitió la citología de linfonódulos poplíteos por PAAF donde se constató, mediante tinción de Giemsa, una población linfoide heterogénea con predominio de linfocitos pequeños. Presencia de abundantes macrófagos y células gigantes multinucleadas con gran cantidad de bacilos intracitoplasmáticos con tinción negativa compatibles con micobacterias (Figura 13).
El paciente fue controlado a los 6 meses de iniciado el tratamiento en el servicio veterinario, donde la propietaria relató la ausencia de signos gastrointestinales y un aumento de peso del animal. A la exploración clínica, no se detectó linfoadenomegalia ni alteraciones de los linfonódulos superficiales. Tanto el análisis de sangre como la ecografía abdominal de control se encontraban dentro de parámetros normales. El paciente continúa con buena evolución desde hace más de 10 meses sin haber suspendido el tratamiento antibiótico. Cuando se cumpla un año de tratamiento, se hará una reevaluación para determinar si se suspende el mismo o se continua por un periodo más prolongado.
Conclusión
Los perros comúnmente son resistentes a las infecciones por micobacterias del MAC; sin embargo, como ya fue descripto, existen razas (e inclusive linajes) más susceptibles a estas infecciones3,5,8,9,10,14,18. Asimismo, en caninos mestizos como en otras razas caninas, pueden actuar como patógenos oportunistas en situaciones de inmunosupresión primaria o adquirida. En aquellos pacientes con cuadros gastrointestinales asociado a linfoadenomegalia generalizada se debería incluir dentro de los diagnósticos diferenciales. Será fundamental el uso de herramientas moleculares para diferenciar especies de micobacterias así como las diferentes sub-especies del MAC, en particular.
El riesgo zoonótico por contacto con perros con infección activa se considera extremadamente bajo en propietarios inmunocompetentes, por lo tanto, es ético la aplicación de un tratamiento con diferentes drogas consensuando siempre con el propietario del animal. Durante el seguimiento del paciente se deberá realizar citología y PCR control de linfonódulos, sangre y otros tejidos para constatar la evolución del animal. Hasta la fecha, no existen pautas en la duración del tratamiento, por lo que se aconseja que sea prolongado y sostenido en el tiempo. El mismo deberá incluir claritromicina, así como la asociación de dos antibióticos más.
A fin de comenzar un tratamiento temprano se debería considerar la posibilidad de establecer una rutina de estudio clínico preventivo en razas predispuestas, sobre todo un estudio minucioso de los linfonódulos superficiales y especialmente del abdomen que incluya ecografía temprana a partir de los 6 meses de edad, periódicamente hasta la edad de 3 años, ya que esta edad parece ser el límite en la cual se puede desarrollar la presentación clínica8,12.
Aun, queda como desafío, la rápida sospecha de esta patología por parte de la comunidad veterinaria, principalmente en razas susceptibles, la accesibilidad a los diferentes métodos diagnósticos, el monitoreo de la evolución a lo largo del tiempo de los pacientes con tratamientos prolongados, así como la valoración del verdadero riesgo zoonótico para los propietarios.
Bibliografía
- Rindi, L. & Garzelli, C. (2014). Genetic diversity and phylogeny of Mycobacterium avium. Infect Genet Evol 21, 375–383.
- Beck A, Špičić S, Butorović-Dujmović M, Račić I, Huber D, Gudan Kurilj A, Beck R, Cvetnić Ž. Mucocutaneous Inflammatory Pseudotumours in Simultaneous Mycobacterium avium subsp. avium and Mycobacterium avium subsp. hominissuis Infection in a Cat. J Comp Pathol. 2015 Nov;153(4):227-30
- Barandiaran S, Martínez Vivot M, Falzoni E, Marfil MJ, Pérez Tort G, Rovatti P, Fernández M, Iachini R, Satek F, Duchene A, Zumárraga MJ. Mycobacterioses in dogs and cats from Buenos Aires, Argentina. J Vet Diagn Invest. 2017 Sep;29(5):729-732
- Armas F, Furlanello T, Camperio C, Trotta M, Novari G, Marianelli C. Molecular characterization and drug susceptibility profile of a Mycobacterium avium subspecies avium isolate from a dog with disseminated infection. J Med Microbiol. 2016 Apr;65(4):278-285
- Haist, V., Seehusen, F., Moser, I., Hotzel, H., Deschl, U., Baumga¨rtner, W. & Wohlsein, P. (2008). Mycobacterium avium subsp. hominissuis infection in 2 pet dogs, Germany. Emerg Infect Dis 14, 988–990
- Miller MA, Davey SC, Van Helden LS, Kettner F, May SM, Last R, Grewar JD, Botha L, Van Helden PD. Paratuberculosis in a domestic dog in South Africa. J S Afr Vet Assoc. 2017 Mar 30;88(0):e1-e5
- Miller, M. A., Greene, C. E. & Brix, A. E. (1995). Disseminated Mycobacterium avium-intracellulare complex infection in a miniature schnauzer. J Am Anim Hosp Assoc 31, 213–216.
- Horn, B., Forshaw, D., Cousins, D. & Irwin, P. J. (2000). Disseminated Mycobacterium avium infection in a dog with chronic diarrhoea. Aust Vet J 78, 320–325.
- Campora, L., Corazza, M., Zullino, C., Ebani, V. V. & Abramo, F. (2011). Mycobacterium avium subspecies hominissuis disseminated infection in a Basset Hound dog. J Vet Diagn Invest 23, 1083–1087.
- Skyes J. (2013). Canine and Feline Infectious Diseases. Ed Elsevier. 1st edition.
- Biet, F., Boschiroli, M. L., Thorel, M. F. & Guilloteau, L. A. (2005). Zoonotic aspects of Mycobacterium bovis and Mycobacterium aviumintracellulare complex (MAC). Vet Res 36, 411–436.
- Lam A, Foster D, Martin P, Spielman D, Chee H, Strong M, Fyfe J, Malik R. Treatment of Mycobacterium avium infection in a dog. 2012. Australian Veterinary Practitioner. 42 (2)
- Greene C. Infectious Diseases of the Dog and Cat. 4th edition. Ed Elsevier. 2011
- Bauer N, Burkhardt S, Kirsch A, Weiss R, Moritz A, Baumgaertner W. Lymphadenopathy and diarrhea in a Miniature Schnauzer. Vet Clin Pathol. 2002;31(2):61-4
- Shackelford, C. C. & Reed, W. M. (1989). Disseminated Mycobacterium avium infection in a dog. J Vet Diagn Invest 1, 273–275.
- Gow AG, Gow DJ. Disseminated Mycobacterium avium complex infection in a dog. Vet Rec. 2008 May 3;162(18):594-5
- Kontos, V., Papadogiannakis, E. I., Mantziaras, G., Styliara, M. & Kanavaki, S. (2014). A case of disseminated Mycobacterium avium infection in a dog in Greece. Case Rep Vet Med 2014, 597847.
- Feijoó, S ¹; Lamarca, G ¹; Fernandez, M ²; Duchene, A ¹; Gómez, N ¹, Iachini, R. Comunicación de dos casos de infección diseminada por Mycobacterium avium en el Schnauzer miniatura. 2015. Revista Veterinaria Argentina. Vol XXXIII. N° 325.
- Sharp E, Taylor S, O'Halloran C. Unusual presentation of canine Mycobacterium avium infection. Vet Rec. 2019 Jun 29;184(26):800.
- Manual de Micobacterias, Asociación Argentina de Veterinarios de Laboratorio de Diagnóstico, 2005- Jorge, C., Alito, A., Bernardelli, A., Canal, A., Cataldi, A., Cicuta, M., ... & Oriani, S. (2005). Manual de diagnóstico de micobacterias de importancia en medicina veterinaria. Acosta Hnos, Santa Fe.
- Hermans PW, et al. Insertion element IS986 from Mycobacterium tuberculosis: a useful tool for diagnosis and epidemiology of tuberculosis. J Clin Microbiol 1990;28:2051–2058
- Guerrero C, et al. A novel insertion element from Mycobacterium avium, IS1245, is a specific target for analysis of strain relatedness. J Clin Microbiol 1995;33:304–307.
- Kantor I, Bernardelli A. Identificación preliminar de micobacterias aisladas en muestras de origen humano o animal [Preliminary identification of mycobacteria isolated in human or animal samples]. Rev Med Vet (Bs As) 1987;68:86–90. Spanish
- Kunze ZM, et al. IS901, a new member of a widespread class of atypical insertion sequences, is associated with pathogenicity in Mycobacterium avium. Mol Microbiol 1991;5:2265–2272
- Collins MT, Lisby G, Moser C, Chicks D, Christensen S, Reichelderfer M, Høiby N, Harms BA, Thomsen OO, Skibsted U, Binder V. Results of multiple diagnostic tests for Mycobacterium avium subsp. paratuberculosis in patients with inflammatory bowel disease and in controls. J Clin Microbiol. 2000. Dec;38(12):4373-81.
- Tirkkonen T, et al. Comparison of variable-number tandemrepeat markers typing and IS1245 restriction fragment length polymorphism fingerprinting of Mycobacterium avium subsp. hominissuis from human and porcine origins. Acta Vet Scand 2010;52:21.
- Zhang, Peilin & Minardi, Lawrence & Kuenstner, John & Kruzelock, Rusty. (2015). Mycobacterium avium subspecies hominissuis in Crohn's disease: A case report. Gastroenterology report.
- Griffith, D. E., Aksamit, T., Brown-Elliott, B. A., Catanzaro, A., Daley, C., Gordin, F., Holland, S. M., Horsburgh, R., Huitt, G. & other authors (2007). An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med 175, 367–416.
- Kasperbauer S & Daley C. Diagnosis and treatment of infections due to M.avium complex. Semin Respirit Crit Care Med. 29, 569-576.
- Daley CL. Mycobacterium avium Complex Disease. Microbiol Spectr. 2017.Apr;5(2). doi: 10.1128/microbiolspec.TNMI7-0045-2017. Review..
- Araste´ h, K. N., Cordes, C., Ewers, M., Simon, V., Dietz, E., Futh, U. M., Brockmeyer, N. H. & L’age, M. P. (2000). HIV-related nontuberculous mycobacterial infection: incidence, survival analysis and associated risk factors. Eur J Med Res 5, 424–430.
 by Multimédica
by Multimédica