Abscesos submandibulares en conejos: revisión
Resumen breve
En la actualidad, la enfermedad bucodental (EBD) en conejos con complicaciones como la osteomielitis/abscesos son presentaciones muy habituales en la clínica diaria. El tratamiento debe realizarse desde un abordaje multidisciplinar, que incluirá medicina interna, nutrición, imagen, microbiología, cirugía y rehabilitación para intentar obtener los mejores resultados en esta patología tan compleja. Las nuevas técnicas de imagen (TAC) permiten realizar diagnósticos (y pronósticos) mucho más…Índice de contenidos
Resumen
En la actualidad, la enfermedad bucodental (EBD) en conejos con complicaciones como la osteomielitis/abscesos son presentaciones muy habituales en la clínica diaria. El tratamiento debe realizarse desde un abordaje multidisciplinar, que incluirá medicina interna, nutrición, imagen, microbiología, cirugía y rehabilitación para intentar obtener los mejores resultados en esta patología tan compleja. Las nuevas técnicas de imagen (TAC) permiten realizar diagnósticos (y pronósticos) mucho más precisos, así como preparar de una manera más individualizada y precisa los procedimientos quirúrgicos necesarios. La realización de cultivos y antibiogramas resultan imprescindibles debido al elevado porcentaje de resistencias antibióticas existentes, así como a la elevada presencia de bacterias anaerobias en esta patología. Los avances en biomateriales para la liberación local de fármacos, así como en protocolos de rehabilitación mediante el empleo de laserterapia pueden ayudar de manera significativa al control de la infección y a la regeneración tanto del tejido como a la osificación del hueso afectado, mejorando los tiempos de recuperación y porcentaje de éxito en el tratamiento de esta patología.
Introducción
La enfermedad bucodental (EBD) es una de las presentaciones más habituales de patologías en los conejos en la clínica diaria1.
Según su etiología, se dividen en:
- Congénitas (maloclusión congénita), que afecta más frecuentemente a incisivos.
- Enfermedad dental adquirida, cuya etiología es variable y puede incluir traumatismos, desgaste inadecuado debido a una dieta inapropiada, enfermedad metabólica del hueso subyacente e incluso tumores.
Dentro de las posibles evoluciones de la EBD, la complicación más habitual y problemática son las infecciones periapicales, osteomielitis y abscesos faciales (submandibulares, maxilares, retrobulbares). Estos abscesos se presentan como masas de gran tamaño, generalmente en el aspecto ventrolateral de la mandíbula, lateral de la maxila o como un exoftalmo unilateral1.
A la hora de manejar esta patología, es importante remarcar que el absceso en sí no es la patología primaria1,2, por lo que siempre será necesario realizar pruebas complementarias (entre las que se incluirán estudios de imagen estándares o avanzadas) para poder realizar un diagnóstico y pronóstico lo más adecuados posibles y así recomendar el tratamiento (generalmente siempre fármaco-quirúrgico-analgésico) más correcto para cada paciente3,4.
Debido a lo explicado en el párrafo anterior, el tratamiento médico, en exclusiva o acompañado de un plan quirúrgico no agresivo, suele fracasar en un porcentaje muy elevado de las ocasiones. Igualmente, es cierto que por buen plan quirúrgico que se realice, sin una correcta aproximación farmacológica posterior también se fracase muy probablemente con el paciente. La naturaleza dinámica de la flora polimicrobiana de la cavidad bucal, la fisio-anatomía especial de la dentición de estos pacientes, la capacidad del antibiótico seleccionada para atravesar el hueso, las resistencias antibióticas y sus posibles efectos adversos (principalmente sobre tracto digestivo) que pueden requerir la interrupción del tratamiento a largo plazo, pueden explicar casi siempre los resultados inadecuados y la alta tasa de recurrencia.
Por todo lo comentado, será importante realizar un correcto abordaje diagnóstico, tratamiento quirúrgico y tratamiento médico posterior.
Protocolo diagnóstico
Fisiopatología y consideraciones clínicas
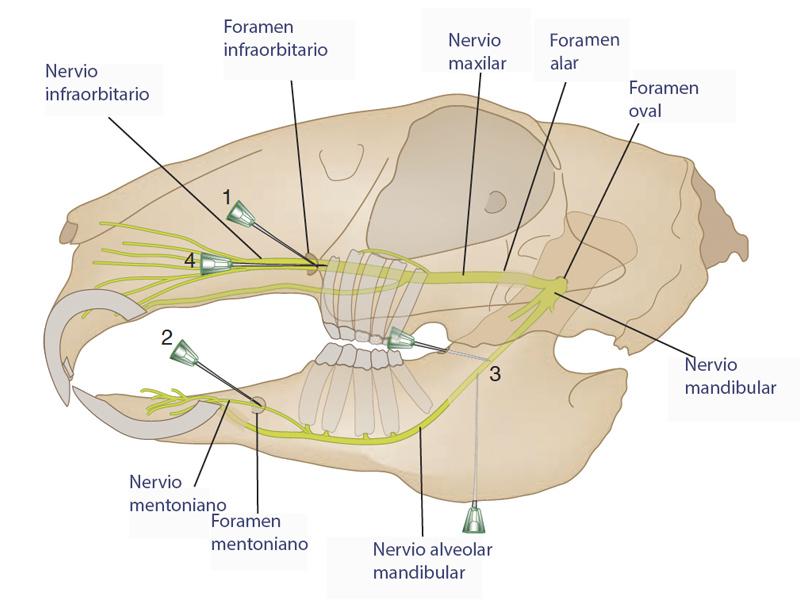
Debido a la anatomía tan específica de la dentadura en esta especie, así como la estrecha relación existente entre la corona de reserva del diente (porción de la corona malar que se encuentra en el interior del alveolo) con el hueso alveolar que lo rodea, las infecciones periapicales fácilmente afectan a dicho hueso, produciendo una osteomielitis primero y un absceso como evolución posterior5.
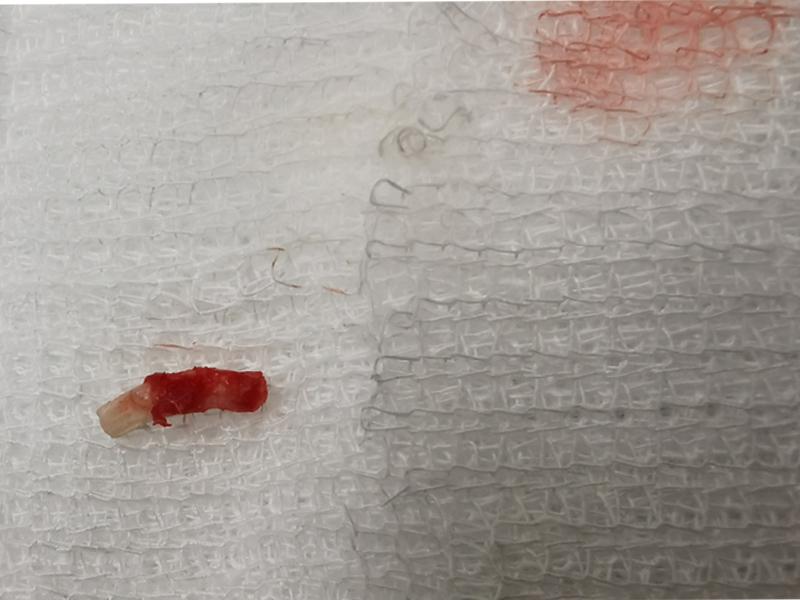
Los abscesos aparecerán a la exploración como entidades únicas o multilobuladas, de contenido pastoso, rodeados de una potente cápsula (Figuras 1y 2).
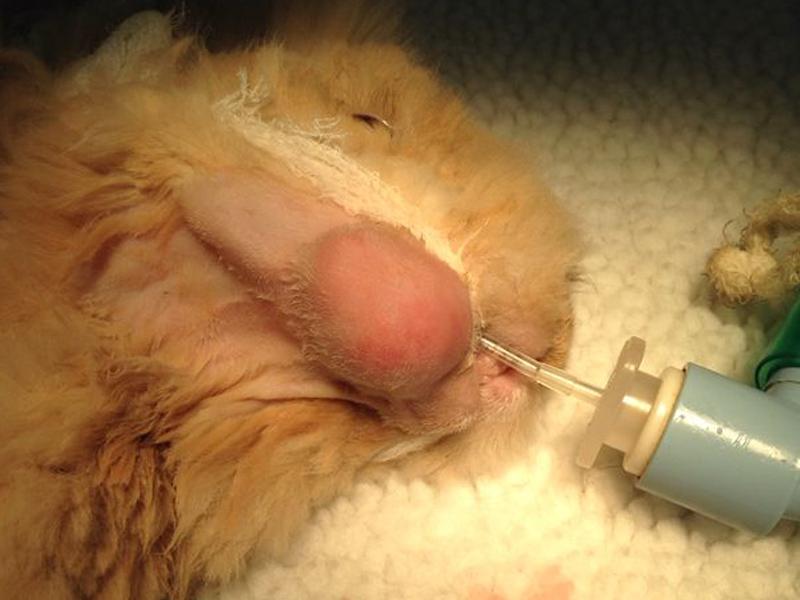

Parte de la fisiopatología e implicaciones clínicas de las infecciones/abscesos periapicales en lagomorfos todavía no se conoce al 100 %, lo que hace que en muchas ocasiones el diagnóstico clínico se produzca cuando ésta se encuentra en estadios muy avanzados1. El hecho de que los conejos sean presas en la naturaleza les obliga a “esconder” síntomas de enfermedad. Este hecho puede ser una de las causas por los que el componente de dolor evidente que produce una osteomielitis/absceso (al menos cuando se compara con otros mamíferos) no se demuestra en muchos pacientes ni siquiera en estadios muy avanzados de la enfermedad5.
Conociendo esta característica especial de estos pacientes, el término de medicina bucodental preventiva cobrará un papel fundamental en el manejo de la EBD. Chequeos periódicos 2-3 veces al año en función de la situación de cada animal (presencia de EBD, edad, dieta, etc.), con una exploración completa bucodental podrían ayudar a adelantarse a la aparición de la EBD en estadios avanzados, pudiendo introducir ciertas terapias “protectoras” (dieta, analgesia, limados periódicos correctores, etc.). Así:
- La exploración general del animal puede ayudar a detectar síntomas sutiles que pueden tener (o no) alguna relación con patologías bucodentales. Una disminución en la cantidad de ingesta o cambios en costumbres de alimentación, hiporexia, cambios en las heces o pérdida de peso, excesivo acicalamiento, ptialismo, epífora/dacriocistitis, disnea (rinitis), problemas gastrointestinales crónicos/recurrentes, mal pelaje, pueden ser reflejos de una patología bucodental más o menos incipiente.
- La exploración de las piezas dentales puede detectar la existencia de defectos en las coronas malares sobre las que actuar mediante terapia dietética, analgésica, quirúrgica mediante limados correctores o apicetomías preventivas.
- La palpación de ramas mandibulares puede localizar focos de deformidad en dichas áreas anatómicas, que hagan sospechar de sobrecrecimientos de ápices dentarios con afectación leve/moderada del hueso alveolar, o su destrucción y presencia de un absceso submandibular ya formado.
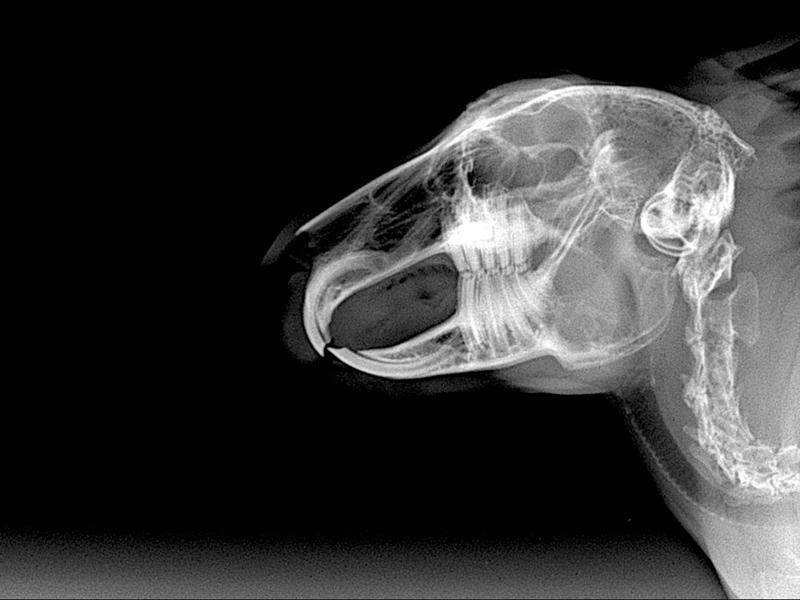
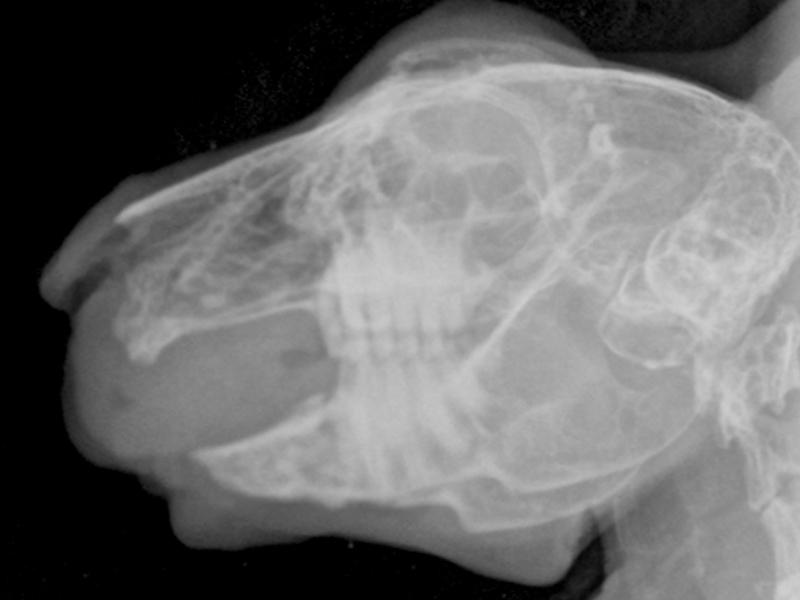
- El estudio radiográfico lateral de cráneo ayudará a detectar alteraciones en plano oclusal dentario que pueda exigir una exploración bucodental más profunda bajo sedación (Figura 3).
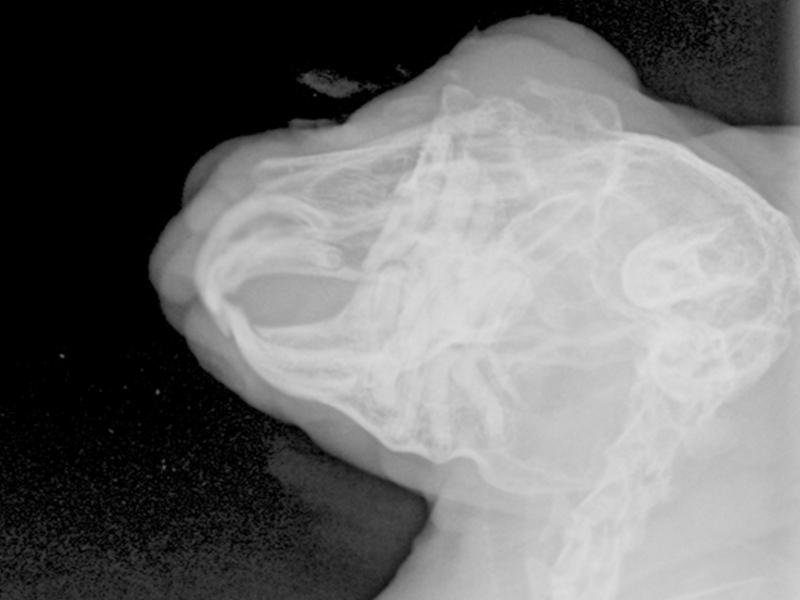
- Radiografías oblicuas de cráneo pueden ayudar a detectar sobrecrecimientos de ápices malares que requieran tratamiento dietético o quirúrgico (limados periódicos para aliviar presión sobre coronas o apicetomías preventivas) (Figura 4).
Diagnóstico de absceso bucodental
La enfermedad bucodental en lagomorfos se trata de un síndrome con un amplio abanico de síntomas asociados, ya sean relacionados directamente con el problema dental existente (disminución en ingesta, cambios en heces, etc.), o con complicaciones sistémicas secundarias (bajada de peso, mala calidad del pelaje, etc.).
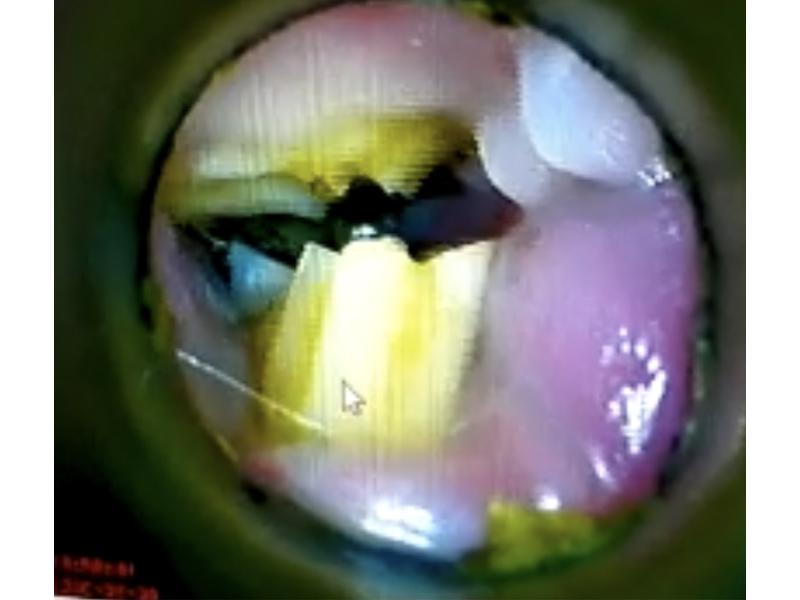
Antes de realizar la exploración clínica, una historia clínica en profundidad enfocada en este caso a hábitos dietéticos (principalmente a la ingesta de heno), pueden ayudar a sospechar de la existencia de una posible patología dental. La exploración intraoral sin sedación dará información básica sobre plano oclusal de primeras piezas malares (Figura 5) y posible visualización de supuración interdental, pero para la correcta exploración de todas las piezas malares se requerirá la sedación del paciente (Figura 6). La palpación sistemática de ambas ramas mandibulares detectará sobrecrecimientos dentales, deformidades periapicales y abscesos con osteólisis asociada. La exploración del ojo y estructuras perioculares pondrán de manifiesto posibles alteraciones anatómicas (dacriocistitis, exoftlamo, etc.) que puedan estar relacionadas con una enfermedad bucodental de piezas maxilares. Las patologías asociadas a la maxila no serán abordadas en este artículo.
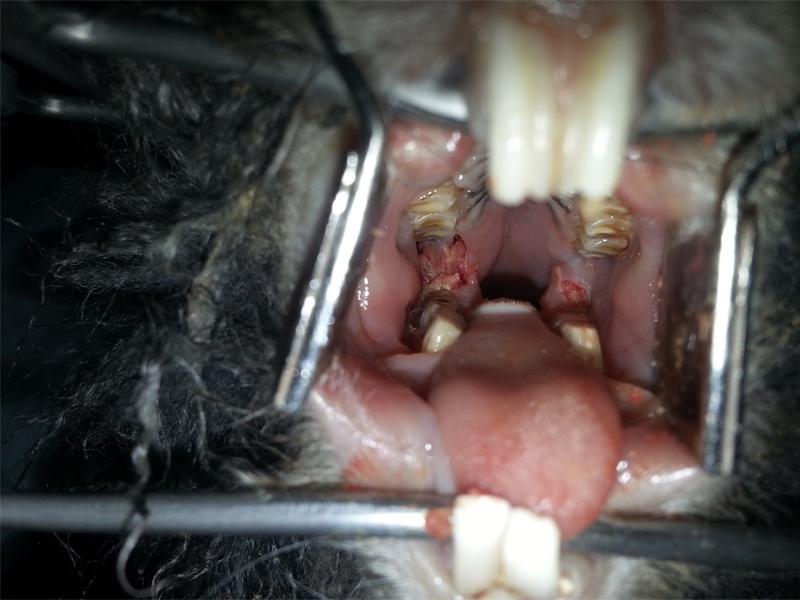
Para el diagnóstico definitivo de abscesos de origen dentario, la realización de estudios de imagen será imprescindible. En la clínica de lagomorfos se emplean de manera rutinaria radiografías y TACs. Mientras que la radiografía crea imágenes superpuestas en un solo plano, el TAC genera imágenes del paciente que se renderizarán por un software para conseguir un estudio en 3 dimensiones (Figura 7). Ambas técnicas deberán emplearse de manera conjunta para un buen diagnóstico y seguimiento del paciente.
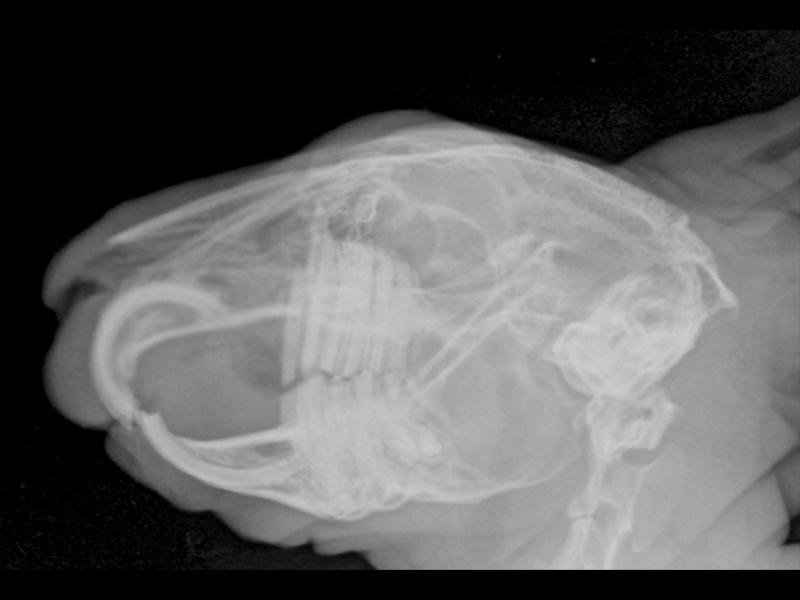
Estudio radiográfico
Aporta información básica que complementa la exploración clínica previa y representa una de las herramientas diagnósticas más empleada en la medicina bucodental veterinaria. Un estudio radiográfico completo dentario en lagomorfos debe incluir al menos una proyección laterolateral (LL) de cráneo, oblicuas derecha (OD) e izquierda (OI), dorsoventral (DV) y rostro-caudal. Otras proyecciones (VD, diferentes ángulos oblicuos, empleo de contraste, etc.) pueden ser necesarios para cada caso concreto (Figura 8, ver Figura 4).
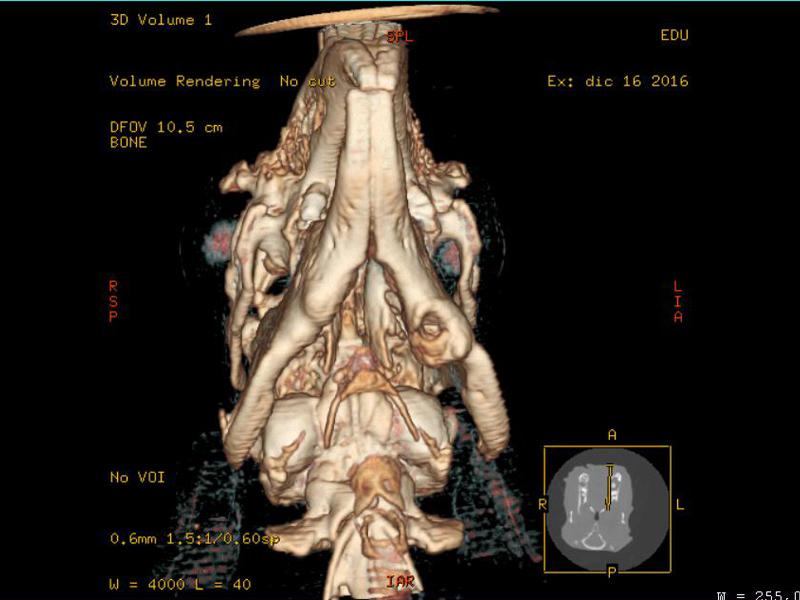
Tomografía axial computerizada (TAC)
Los estudios de TAC del cráneo de lagomorfos son considerados como una herramienta de imagen crucial para el correcto diagnóstico de la EBD y sus complicaciones (osteomielitis de mandíbula/maxila, abscesos, empiemas, otitis medias o alteraciones en cavidad nasal/paranasal).
Actualmente se considera que un TAC aporta una información más precisa que un estudio radiográfico para el abordaje de la EBD. Un estudio retrospectivo realizado en 30 conejos con EBD comparó TAC y estudios radiográficos a dos niveles: consistencia y precisión diagnóstica. La precisión resultó superior con el TAC en un 80 % de los pacientes, y en un 56,6 % ayudó a planificar la cirugía dental y extraoral de una manera más precisa (en comparación con un 16,6 % en el caso de la radiografía)6.
Una vez repasada la fisiopatología y métodos de imagen que ayudarán a diagnosticar una EBD con osteomielitis/absceso, se proceden a comentar los puntos básicos para el correcto tratamiento de dicha patología.
Tratamiento médico
Con la excepción de algunos casos puntuales, no existe publicada ninguna serie de casos que demuestren que la terapia médica en exclusiva sea efectiva. La fisiopatología de la EBD en lagomorfos, con la presencia de abscesos con cápsula bacteriana, pus (generalmente con un área central formada por detritus celulares), osteomielitis y tejido afectado (partes blandas y hueso) que actúan como material de secuestro, explican la necesidad de actuar sobre todos ellos de manera agresiva y con tratamientos de larga duración para obtener los mejores resultados.
La terapia médica debe centrarse en:
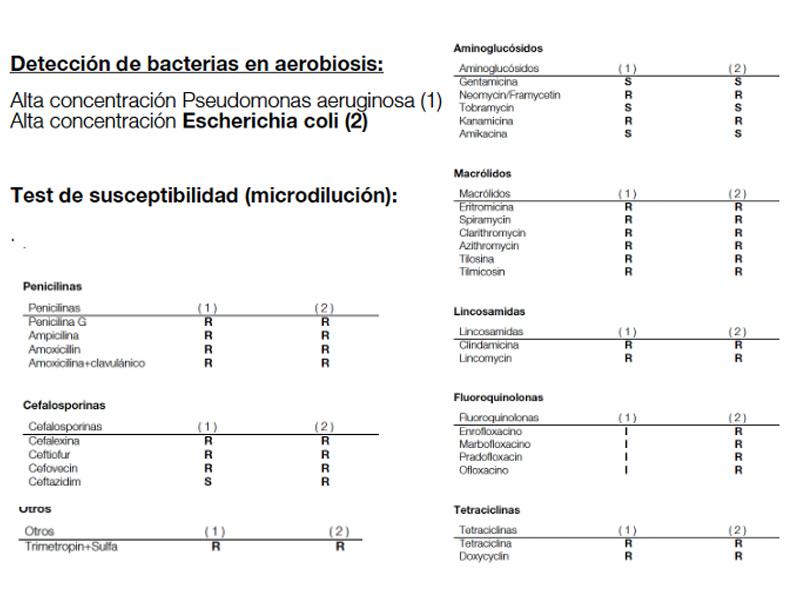
- Tratamiento antibiótico: debido a la infección asociada a esta patología, es imprescindible como parte de una terapia multimodal tras el procedimiento quirúrgico necesario. Existen diferentes estudios de bacterias presentes en estos abscesos7,8,9 con diferentes patógenos implicados. La recomendación de los autores como parte básica de cualquier tratamiento antibiótico es la realización de un cultivo de la cápsula bacteriana obtenido durante el acto quirúrgico, incluyendo siempre un cultivo de bacterias anaerobias. En un estudio realizado en en el centro veterinario de los autores sobre cultivos tras cirugía orofacial en 50 pacientes durante el periodo de marzo 2022 a marzo 2023, en un 29,6 % de ellos se aislaron bacterias anaerobias. De ellas, un 30 % fueron resistentes al pradofloxacino y un 50 % al metronidazol y penicilina G. Con respecto a los microorganismos aerobios aislados, principalmente se identificaron bacterias correspondieron al género Pseudomonas en un 29 % de los cultivos y enterobacterias (E. coli, Klebsiella y Enterobacter) en un 27 % de las ocasiones. Los antibiogramas demostraron multirresistencias en un 91 % de los antibiogramas realizados, con los mejores resultados de sensibilidad global encontrados en el grupo farmacológico de los aminoglicósidos y de las quinolonas (Figura 9).
- Para la ayuda en el tratamiento local de las infecciones, además de las curas locales, el empleo de hidrogeles bioactivos está siendo investigado para mejorar los resultados en infecciones y regeneración local de hueso, en sustitución de biomateriales más antiguos (como el cemento óseo impregnado de antibióticos o PMMAs) con problemas de bajo tiempo de actuación, incompatibilidad con muchos antibióticos o cinéticas de liberación in vivo/in vitro del antibiótico.
- Tratamiento analgésico: imprescindible debido a la destrucción ósea realizada tanto por la infección como por la propia cirugía. En experiencia de los autores se realiza una analgesia multimodal a largo plazo, disminuyendo progresivamente fármacos en función de evolución del paciente. Los analgésicos más empleados en la actualidad se basan en:
- AINEs: meloxicam: 0,5-1,0 mg/kg SID-BID.
- Opiáceos: buprenorfina 0,05 mg/kg TID-QID, fentanilo 4-8 ug/kg/h en CRI o mediante parches dérmicos de liberación prolongada.
- Analgésicos puros: metamizol 65-85 mg/kg TID-QID.
- Anestésicos locales: bloqueo nervios faciales con bupivacaína, CRI lidocaína 3-6 mg/kg/h.
- Fármacos sobre receptores GABA: gabapentina: 10-30 mg/kg BID-TID.
- Laserterapia: los beneficios del efecto de la terapia laser para promover la cicatrización de heridas en animales y medicina humana está ampliamente demostrada. En la actualidad ya existen estudios que demuestran una disminución de carga bacteriana en heridas contaminadas mejorando tiempos de cicatrización10-16. El efecto analgésico de la terapia láser también se encuentra ampliamente estudiada15-22, en múltiples patologías osteoartrósicas, pudiendo emplearse en estos pacientes. Su empleo nos está ayudando a reducir dosis y tiempos de otras terapias analgésicas comúnmente empleadas (Figura 10).
- Terapia de soporte: fluidoterapia y nutrición asistida hasta asegurar una correcta ingesta voluntaria y defecación por parte del paciente.
Tratamiento quirúrgico
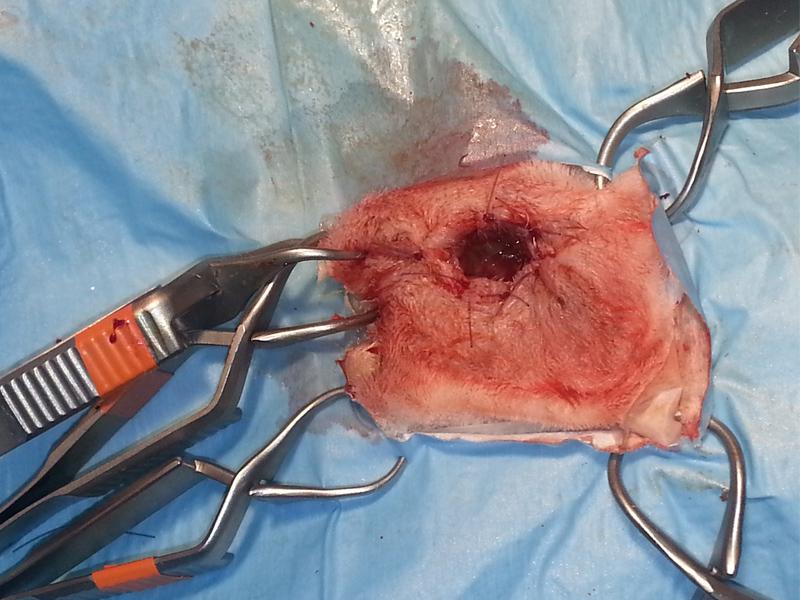
El tratamiento quirúrgico de los abscesos faciales se ha discutido ampliamente en la literatura. El éxito se basa en la extirpación de la totalidad de la cápsula bacteriana, extracción de las piezas afectadas y desbridamiento del hueso perilesional afectado. Cualquier deficiencia en estos tres puntos disminuirá significativamente las posibilidades de éxito de la técnica quirúrgica. En experiencia de clínica de los autores y en base a la bibliografía consultada23-31 los mejores resultados se hallan mediante la marsupialización de la herida quirúrgica producida y cierre por segunda intención apoyada en el tratamiento antibiótico sistémico y local según antibiograma, laserterapia y curas periódicas bajo sedación hasta el cierre completo, manteniendo la antibioterapia durante al menos 6-12 semanas.
Las curas preferidas por el autor hasta la llegada del antibiograma son antisépticos diarios y el empleo de pomadas enzimáticas/antibióticas. La retirada de los puntos de la marsupialización se realizará a los 5-7 días postquirúrgicos (o con la llegada del antibiograma), acompañados de una cura en profundidad bajo sedación del área quirúrgica.
Técnica quirúrgica para el abordaje del absceso submandibular
- Inducción de la anestesia general, intubación y posición en decúbito lateral, dependiendo de la ubicación del absceso.
- Anestesia local mediante bloqueo nerviosos de los nervios mentales y alveolares inferiores (Figura 11).
- Preparación campo quirúrgico mediante rasurado y lavado quirúrgico. Colocación de campos estériles.
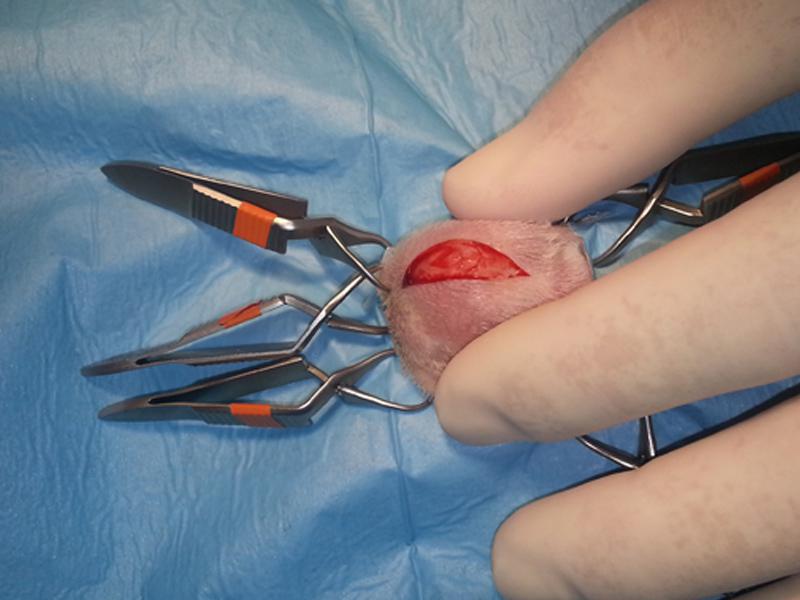
- Abordaje quirúrgico sobre el absceso: incisión en la piel, preservando la cápsula.
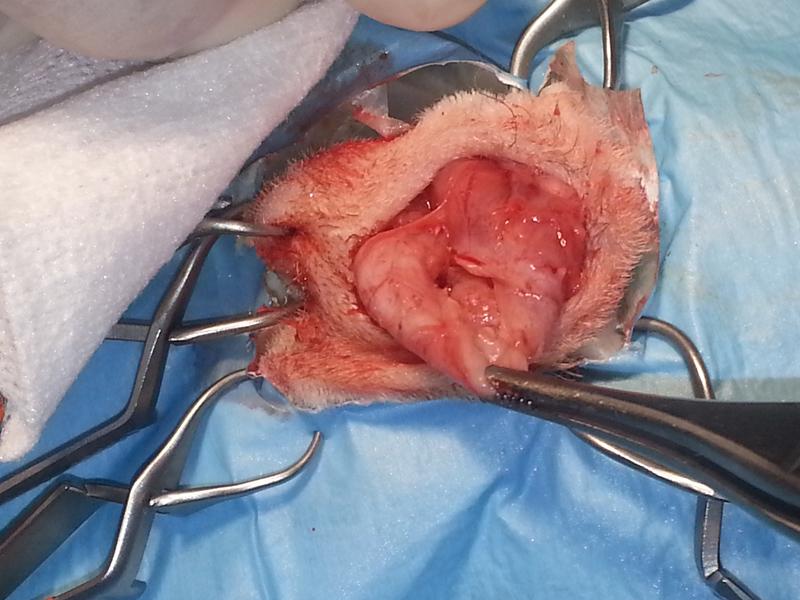
- Disección de tejido subcutáneo y muscular hasta exponer la cápsula del absceso. La unión entre la cápsula y el hueso cortical subyacente se disecciona con una hoja de bisturí o tijeras. Se extirpa la pared del absceso, incluido el hueso afectado. Una pequeña porción de la cápsula se envía siempre para su cultivo y pruebas de sensibilidad antibiótica.
- Se elimina el exudado purulento usando aplicadores con punta de algodón/cucharas de curetaje y la cavidad ósea se lava completamente con solución salina o clorhexidina al 0,1 %.
- El hueso cortical infectado o necrótico se elimina usando una cureta de hueso/micromotor de trauma.
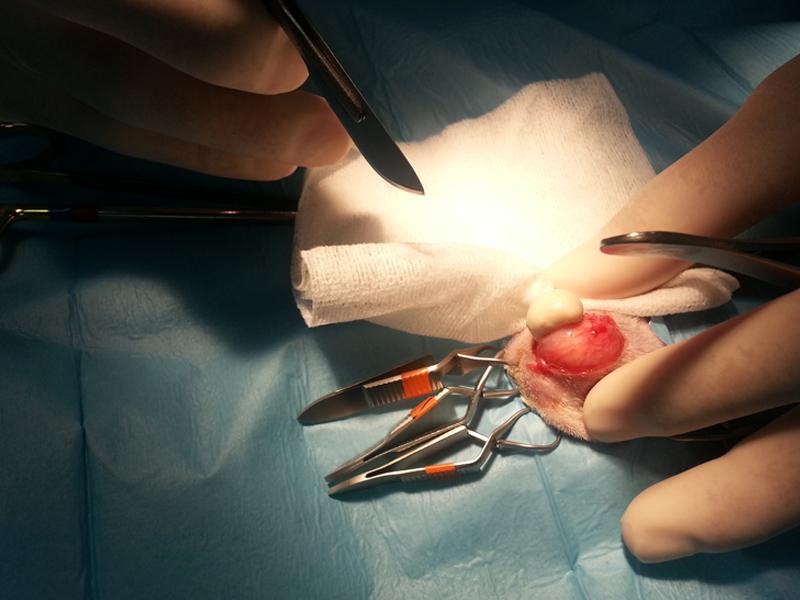
- Extracción por abordaje extraoral (o con ayuda de abordaje intraoral) de las piezas afectadas mediante el empleo de elevadores dentales. En algunos casos, el fragmento de diente se encontrará anquilosado a una pequeña porción de hueso alveolar necrótico. La cavidad ósea se lava nuevamente como se describió anteriormente.
- Marsupialización de los tejidos blandos alrededor del sitio quirúrgico usando sutura de pequeño calibre (3/0 o menor) (Figuras 12 a 16).

Bibliografía
- Meredith A., Lord B., BSVA Manual of Rabbit Medicine. 2016; 313, Ed. BSAVA
- Capello V., Surgical Treatment of Facial Abscesses and Facial Surgery in Pet Rabbits, Vet Clin Exot Anim 19 (2016) 799–823
- Baur DA, Altay MA, Flores-Hidalgo A, Ort Y, Quereshy FA. Chronic osteomyelitis of the mandible: diagnosis and management–an institution's experience over 7 years. J Oral Maxillofac Surg. 2015;73: 655-665.
- Marschall JS, Flint RL, Kushner GM, Alpert B. Management of mandibular osteomyelitis with segmental resection, nerve preservation, and immediate reconstruction. J Oral Maxillofac Surg. 2019;77:1490- 1504.
- Capello V. Clinical technique: treatment of periapical infections in pet rabbits and rodents. J Exot Pet Med 2008;17:124–31.
- Capello V, Cauduro A. Comparison of diagnostic consistency and diagnostic accuracy between survey radiography and computed tomography of the skull in 30 rabbits with dental disease. J Exotic Pet Med 2016;25(2):115–27.
- Tyrrel KL, Citron DM, Jenkins JR, et al. Periodontal bacteria in rabbit mandibular and maxillary abscesses. J Clin Microbiol 2002;40:1044–7.
- Ward GS, Crumrine MH, Mattloch JR. Inflammatory exostosis and abscessation associated with Fusobacterium nucleatum in a rabbit. Lab Anim Sci 1981;31: 280–1.
- Gardhouse S, Sanchez-Migallon Guzman D et al. Microbiology and antimicrobial susceptibilities of odontogenic abscesses in domestic rabbits. Proceedings of the ExoticsCon. San Antonio (TX): 2015. p. 357
- Rico-Holgado, Ortiz-Díez G, C Martín Espada M, et al. Effect of Low-Level Laser Therapy on Bacterial Counts of Contaminated Traumatic Wounds in Dogs, J Lasers Med Sci. 2021; 12: e78.
- L. Nussbaum, Las Heras F., P.H. Pritzker K., Effects of low intensity laser irradiation during healing of infected skin wounds in the rat. Photonics Lasers Med. Feb 2014; 3(1): 23–36.
- Percival SL, Francolini I, Donelli G. Low-level laser therapy as an antimicrobial and antibiofilm technology and its relevance to wound healing. Future Microbiol. 2015;10(2):255-72. doi: 10.2217/fmb.14.109. PMID: 25689537.
- Kazem Shakouri S, Soleimanpour J, Salekzamani Y, Oskuie MR. Effect of low-level laser therapy on the fracture healing process. Lasers Med Sci. 2010 Jan;25(1):73-7. doi: 10.1007/s10103-009-0670-7. Epub 2009 Apr 28. PMID: 19399356.
- dos Santos Santinoni C., Francine Fernandes Oliveira H.,Eduardo de Souza Batista V., Aparecido Araujo Lemos C., Ramos Verri F. Influence of low-level laser therapy on the healing of human bone maxillofacial defects: A systematic review. Journal of Photochemistry and Photobiology B: Biology, Volume 169 (83-89), 2017
- Bai, J., Li, L., Kou, N. et al. Low level laser therapy promotes bone regeneration by coupling angiogenesis and osteogenesis. Stem Cell Res Ther 12, 432 (2021)
- Aoki A, Mizutani K, Schwarz F, Sculean A, Yukna RA, Takasaki AA, Romanos GE, Taniguchi Y, Sasaki KM, Zeredo JL, Koshy G, Coluzzi DJ, White JM, Abiko Y, Ishikawa I, Izumi Y. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 2015 Jun;68(1):217-69. doi: 10.1111/prd.12080. PMID: 25867988.
- Metin R, Tatli U, Evlice B. Effects of low-level laser therapy on soft and hard tissue healing after endodontic surgery. Lasers Med Sci. 2018 Nov;33(8):1699-1706. doi: 10.1007/s10103-018-2523-8.
- Han DS, Lee CH, Shieh YD, Chen CC. Involvement of Substance P in the Analgesic Effect of Low-Level Laser Therapy in a Mouse Model of Chronic Widespread Muscle Pain. Pain Med. 2019 Oct 1;20(10):1963-1970.
- Falaki F, Nejat AH, Dalirsani Z. The Effect of Low-level Laser Therapy on Trigeminal Neuralgia: A Review of Literature. J Dent Res Dent Clin Dent Prospects. 2014 Winter;8(1):1-5. doi: 10.5681/joddd.2014.001. Epub 2014 Mar 5.
- Ferreira DM, Zângaro RA, Villaverde AB, Cury Y, Frigo L, Picolo G, Longo I, Barbosa DG. Analgesic effect of He-Ne (632.8 nm) low-level laser therapy on acute inflammatory pain. Photomed Laser Surg. 2005 Apr;23(2):177-81. doi: 10.1089/pho.2005.23.177. Erratum in: Photomed Laser Surg. 2007 Feb;25(1):63.
- Artés-Ribas M, Arnabat-Dominguez J, Puigdollers A. Analgesic effect of a low-level laser therapy (830 nm) in early orthodontic treatment. Lasers Med Sci. 2013 Jan;28(1):335-41.
- Sammons T, Shanks S. Efficacy of red low-level laser for postoperative pain management: A review of literature. J Perioper Pract. 2022 Nov 17.
- Capello V, Gracis M, Lennox AM. Rabbit and rodent dentistry handbook. Lake Worth (FL): Zoological Education Network; 2005.
- Capello V. Clinical technique: treatment of periapical infections in pet rabbits and rodents. J Exot Pet Med 2008;17:124–31.. Harcourt-Brown F, Chitty J. Facial abscesses. In: Harcourt-Brown F, Chitty J, editors. Manual of rabbit surgery, dentistry and imaging. 1st edition. Quedgeley (Gloucester): British Small Animal Veterinary Association; 2013 p. 395–422, 29.
- Capello V. Extraction of cheek teeth and surgical treatment of periodontal abscessations in pet rabbits with acquired dental disease. Exotic DVM 2004;6:31–8.
- Taylor WM, Beaufre`re H, Mans C, et al. Long-term outcome of treatment of dental abscesses with a wound packing technique in pet rabbits: 13 cases (1998-2007). J Am Vet Med Assoc 2010;237:1444–9.
- Bennet RA. Management of abscesses of the head in rabbits. Proceedings. North Am Vet Conf. Orlando, FL, 1999. p. 822–23.
- Divers SJ. Mandibular abscess treatment using antibiotic-impregnated beads. Exotic DVM 2000;2:15–8.
- Remeeus PG, Verbeek M. The use of calcium hydroxide in the treatment of abscesses in the cheek of the rabbit resulting from a dental periapical disorder. J Vet Dent 1995;12:19–22.
- Harcourt-Brown FM. Honey to treat rabbit abscesses. Exotic DVM 2002;3:13–4.
- Mathews KA, Binnington AG. Wound management using honey. Comp Cont Ed 2002;24:53–60.
- Thabit AK, Fatani DF, Bamakhrama MS, Barnawi OA, Basudan LO, Alhejaili SF. Antibiotic penetration into bone and joints: an updated review. Int J Infect Dis. 2019;81:128-136.
- Zein Eddine SB, Cooper-Johnson K, Ericksen F, et al. Antibiotic duration and outcome complications for surgical site infection prevention in traumatic mandible fracture. J Surg Res. 2019;247:524–529.
- Cortes-Penfield NW, Kulkarni PA. The history of antibiotic treatment of osteomyelitis. Open Forum Infect Dis. 2019;6:ofz181.
- Kudva A, Kamath AT, Dhara V, Ravindranath V. Chronic recurrent osteomyelitis: a surgeon's enigma. J Oral Pathol Med. 2019;48: 180-184.
- van Vugt TAG, Arts JJ, Geurts JAP. Antibiotic-loaded Polymethylmethacrylate beads and spacers in treatment of orthopedic infections and the role of biofilm formation. Front Microbiol. 2019;10: 1626.
- Anagnostakos K, Wilmes P, Schmitt E, Kelm J. Elution of gentamicin and vancomycin from polymethylmethacrylate beads and hip spacers in vivo. Acta Orthop. 2009;80:193-197.
- Moojen DJF, Hentenaar B, Vogely HC, Verbout AJ, Castelein RM, Dhert WJ. In vitro release of antibiotics from commercial PMMA beads and articulating hip spacers. J Arthroplasty. 2008;23:1152- 1156.
- van Vugt TAG, Walraven JMB, Geurts JAP, Arts JJC. Antibioticloaded collagen sponges in clinical treatment of chronic osteomyelitis:a systematic review. J Bone Joint Surg Am. 2018;100:2153-2161.
- De Mori A, Hafidh M, Mele N, et al. Sustained release from injectable composite gels loaded with silver nanowires designed to combat bacterial resistance in bone regeneration applications. Pharmaceutics. 2019;11(3):116
- Maher Eltawila A., Nageeb Hassan M., Mohamed Safaan S., Abd El-Fattah A., Zakaria O., K. El-Khordagui L., Kandi S., Local treatment of experimental mandibular osteomyelitis with an injectable biomimetic gentamicin hydrogel using a new rabbit model, J Biomed Mater Res. 2021;1–12.
- Nesrin Coşkunmeriç, Neslihan Üstündağ Okur, Mehmet Evren Okur, Şule Ayla, Ayşegül Yoltaş & Sinem Yaprak Karavana, Promising nanogels loaded with usnic acid for oral ulcer treatment: development, characterization, and in vivo evaluation in rabbits, Pharmaceutical Development and Technology, 26:4, 431-443, 2021
- Mudalal M., Sun X., Li X., Zhou Y., The evaluation of leukocyte-platelet rich fibrin as an anti-inflammatory autologous biological additive, Saudi Med J 2019; Vol. 40 (7)
- Popesko P, Rajtová V, Horák J. A Colour Atlas of Anatomy of Small Laboratory Animals Volume 1: Rabbit, Guinea Pig, W.B. Saunders Company. 2003
Seguimiento
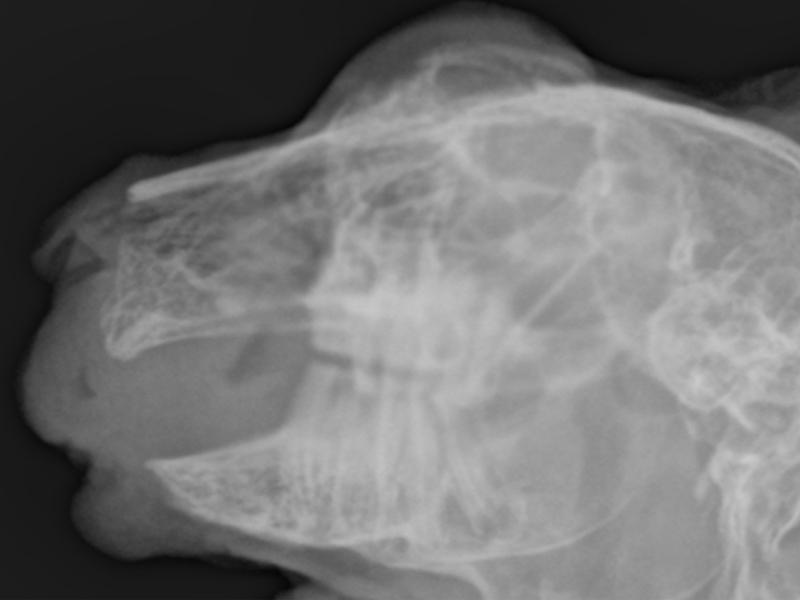
Los abscesos periapicales en conejos están asociados con un alto porcentaje de recidivas. El seguimiento a corto plazo incluirá como mínimo revisiones periódicas (cada 2 a 7 días) hasta el cierre completo de la piel, sesiones láser al menos durante 3 meses y evaluación radiográfica a los 1,5-3 meses hasta detectar la aparición de remodelación ósea en el lugar (Figuras 17 y 18) de la osteomielitis. Posteriormente, se recomiendan revisiones periódicas 2-4 veces al año en función de cada caso para examinar el área quirúrgica, así como el resto de piezas dentarias.
 by Multimédica
by Multimédica