Prevalencia y factores de riesgo asociados a la hipertensión sistémica en perros con síndrome de Cushing espontáneo
Resumen breve
La hipertensión sistémica (HS) es habitual en perros con síndrome de Cushing (SC), aunque no muchos estudios han evaluado su prevalencia y factores de riesgo asociados. El objetivo de este estudio fue determinar la prevalencia y gravedad de la HS en perros con SC y su relación con los hallazgos clínicos y laboratoriales para identificar potenciales factores de riesgo. Se incluyeron de forma retrospectiva 66 perros con SC espontáneo. En todos se midió la presión arterial sistólica (PAS) mediante…Índice de contenidos
Resumen
La hipertensión sistémica (HS) es habitual en perros con síndrome de Cushing (SC), aunque no muchos estudios han evaluado su prevalencia y factores de riesgo asociados. El objetivo de este estudio fue determinar la prevalencia y gravedad de la HS en perros con SC y su relación con los hallazgos clínicos y laboratoriales para identificar potenciales factores de riesgo. Se incluyeron de forma retrospectiva 66 perros con SC espontáneo. En todos se midió la presión arterial sistólica (PAS) mediante el método Doppler y se recopilaron los signos clínicos, el examen físico y los datos laboratoriales.
La prevalencia de HS (≥150 mmHg) fue de un 82 % y la de HS grave (≥180 mmHg) un 46 %. Todos los perros con trombocitosis tenían HS (p = 0,002), siendo un recuento plaquetar ≥438 x103/µL 100 % específico y 61,1 % sensible para predecir HS (AUC = 0,802; p = 0,001). La mediana de los niveles de potasio fue más baja en perros hipertensos (4,1 mEq/L) que en normotensos (4,5 mEq/L; p = 0,007). Los perros cuyo cociente proteína creatinina en orina (UPC) fue ≥0,5 presentaron una PAS mediana superior (210 mmHg) que aquellos sin proteinuria (160 mmHg; p = 0,034).
En conclusión, la HS es una complicación frecuente del SC y habitualmente es grave. La PAS debe evaluarse siempre en estos perros al diagnóstico, especialmente si existe trombocitosis, proteinuria o niveles bajos de potasio.
Introducción
El síndrome de Cushing (SC) es una de las endocrinopatías más frecuentes en perros de edad media-avanzada caracterizada por una producción excesiva y crónica de cortisol por parte de la corteza adrenal. Este exceso de cortisol puede deberse a un tumor hipofisario productor de ACTH (del inglés: pituitary dependent hypercortisolism PDH), ser secundario a una neoplasia adrenal productora de cortisol (del inglés: adrenal dependent hypercortisolism ADH) o, menos frecuentemente, ser secundario a la secreción ectópica de ACTH1 o por un hipercortisolismo dependiente del alimento2.
El hipercortisolismo crónico puede producir diversas complicaciones, como diabetes mellitus (DM), hipertensión sistémica (SH), proteinuria, glomerulosclerosis, pancreatitis, mucocele biliar, una mayor susceptibilidad a las infecciones, o tromboembolismo pulmonar entre otros, tanto en perros como en personas3-21.
La HS asociada al hipercortisolismo es frecuente en personas con SC, afectando a un 70-85 % de los pacientes4-8. Los mecanismos fisiopatológicos de la HS en el SC aún no están completamente descritos, pero en personas se ha propuesto un modelo multifactorial que involucra diversas vías: el sistema renina-angiotensina, una mayor actividad mineralocorticoide, el sistema nervioso simpático, el sistema vasoregulador, factores metabólicos, la remodelación vascular y la apnea del sueño4-6. En medicina humana se han descrito algunos factores de riesgo para la HS asociada al hipercortisolismo.
En niños existe una correlación positiva entre la HS y las concentraciones circulantes de cortisol. Además, la HS es más frecuente en niños con SC independiente de la ACTH22. Esta tendencia también se ha observado en adultos con SC independiente de la ACTH, pero la prevalencia de HS es similar entre aquellos con SC independiente o dependiente de la ACTH. Por otro lado, en adultos con SC la edad, el índice de masa corporal y la duración del hipercortisolismo se asocian al desarrollo de HS, sin embargo, la HS no se correlaciona con las concentraciones circulantes de cortisol7.
Las personas con hipercortisolismo e hipertensión tienen concentraciones más bajas de potasio que aquellas normotensas, especialmente en casos de SC ectópico, en los que la hipokalemia es frecuente y se asocia estrechamente a la hipertensión7, 23-25.
En perros con SC la prevalencia de HS oscila entre el 31 % y el 86 %11-14, 26-29. Se han descrito mecanismos fisiopatológicos en el perro, como el incremento de la actividad mineralocorticoide30, 31, una reducción en los niveles de óxido nítrico13 o una mayor resistencia vascular renal26, 32. Pocos estudios han valorado los factores de riesgo asociados a la HS en perros con SC; no se ha observado diferencia en la prevalencia o gravedad de la HS entre perros con PDH o ADH ni correlación entre la presión arterial sistólica (PAS) y la edad, sexo, estado reproductivo o los resultados de la estimulación con ACTH11.
Otros estudios sí que han encontrado, aunque de forma inconsistente, una relación entre el cociente proteína creatinina en orina (UPC) o las concentraciones basales de cortisol y la PAS. Algunos autores han observado una correlación entre la PAS y el UPC pero no con el cortisol basal, mientras que otros han encontrado una correlación entre la PAS y las concentraciones basales de cortisol pero no con el UPC11-14.
Por todo ello, los objetivos de este estudio fueron determinar la prevalencia y la gravedad de perros con SC espontáneo e identificar potenciales factores de riesgo asociados a la HS en estos perros.
Materiales y métodos
Se revisaron de forma retrospectiva los historiales clínicos de perros con SC espontáneo que acudieron al Hospital Clínico Veterinario Complutense entre enero de 2013 y diciembre de 2016. Todos los propietarios firmaron el consentimiento para utilizar los datos de su animal con fines relacionados con la investigación.
Se sospechó de SC cuando se observaron signos clínicos (p. ej., polidipsia, poliuria, polifagia o jadeo en reposo) y alteraciones en el examen físico (p. ej., pérdida de pelo, piel fina o distensión abdominal) compatibles con la enfermedad. El diagnóstico de SC se confirmó cuando dos de las siguientes pruebas resultaron positivas: cociente cortisol creatinina en orina (UCCR), estimulación con ACTH o supresión con dexametasona a dosis bajas (SDDB). En todos los casos se realizó también una ecografía abdominal. Los resultados de la SDDB, supresión con dexametasona a dosis altas, concentraciones endógenas de ACTH o bien los resultados de la ecografía abdominal, fueron utilizados como pruebas diferenciadoras entre PDH y ADH3, 33-35.
Los criterios de exclusión fueron: perros que ya estaban recibiendo tratamiento para el SC, perros con enfermedad renal crónica (ERC) IRIS 3 o 4, y/o perros con enfermedad cardiaca estadio C o D según el consenso del ACVIM36, 37. La ERC se clasificó según las concentraciones séricas de creatinina, y SDMA cuando estuvo disponible, y se sub-clasificaron según la proteinuria37. En aquellos perros que presentaron un soplo cardiaco, signos clínicos compatibles con enfermedad cardiaca, o ambos, se realizaron radiografías torácicas y una ecocardiografía36.
Se recopilaron los datos de la reseña, signos clínicos descritos por el propietario al diagnóstico y duración de los mismos, hallazgos del examen físico, enfermedades concurrentes, y tipo de SC (PDH o ADH). Se valoró también el índice de condición corporal (ICC) y los perros fueron clasificados como con sobrepeso (ICC ≥7/9), en peso ideal (ICC 4-6/9) o bajos de peso (ICC ≤3/9). La PAS se midió en todos los perros mediante el método Doppler (Vettex® Uni 900, Huntleigh Diagnostics Ltd., Cardiff, UK) utilizando una sonda plana de 8 Mhz colocada entre las almohadillas carpal y metacarpal de la extremidad anterior izquierda. La PAS se midió en decúbito esternal o lateral utilizando la mínima sujeción posible.
El ancho del manguito utilizado fue de un 30-40 % de la circunferencia de la extremidad en el lugar de colocación del mismo28, 29. El valor de PAS final fue la media de al menos 5 medidas consecutivas y similares tras, al menos, 5 minutos de aclimatación y antes de realizar ningún otro procedimiento. En caso de observarse, se realizaron las medidas necesarias hasta obtener al menos 5 medidas similares. Los perros fueron clasificados como hipertensos cuando la PAS fue ≥150 mmHg y sub-clasificados en función del riesgo de daño en órganos diana en hipertensión leve (150-159 mmHg), moderada (160-179 mmHg) o grave (≥180 mmHg)28, 29.
En cuanto a los datos laboratoriales (hemograma, perfil bioquímico completo, electrolitos, urianálisis y cultivo de orina, estimulación con ACTH, SDDB y UCCR) solo fueron revisados e incluidos aquellos realizados por el laboratorio del centro de los autores, para evitar diferencias entre las distintas técnicas y rangos de referencia. El perfil bioquímico incluyó la determinación de glucosa, proteínas totales, urea, creatinina, alanina-aminotransferasa (ALT), fosfatasa alcalina (ALKP), colesterol, sodio, potasio, cloro y calcio total. Las concentraciones tanto séricas como urinarias de cortisol fueron determinadas mediante un sistema de inmunoensayo (Immulite® 2000, Siemens Healthcare S.L.U, Madrid, Spain).
El urianálisis consistió en la determinación de la densidad urinaria (DU) mediante refractometría, la realización de una tira de orina y la valoración del sedimento. La DU fue considerada baja con valores <1.030. El sedimento urinario se consideró inactivo cuando no se observaron bacterias y, en caso de haber glóbulos rojos o blancos, había menos de 10 glóbulos rojos o 5 blancos por campo. Para el cultivo de orina la muestra fue obtenida por cistocentesis, e inoculada en placas de agar sangre para su incubación a 37ºC durante 72 horas antes de ser consideradas negativas.
En cultivos en los que hubo crecimiento bacteriano, los microorganismos fueron aislados e identificados siguiendo procedimientos estándar. Los datos de UPC utilizados en este estudio incluyen exclusivamente a aquellos con un cultivo urinario negativo y un sedimento urinario inactivo. Se consideró proteinuria como un UPC > 0,537.
El análisis estadístico se llevó a cabo utilizando un software informático (IBM SPSS Statistics for Windows, v.25.0, IBM corp., Armonk, New York, USA). Se utilizó la prueba de Shapiro-Willks para valorar la distribución de los datos; como algunas variables no siguieron una distribución normal al dividirlas en grupos se optó por utilizar pruebas no paramétricas. Las comparaciones entre las categorías de variables categóricas dicotómicas se realizaron mediante la prueba exacta de Fisher y, para variables con más de dos categorías, mediante la prueba de chi-cuadrado (resultados expresados como porcentajes).
Para la comparación de variables cuantitativas entre dos grupos se utilizó la prueba de suma de rangos de Mann-Whitney y, para aquellas con tres grupos la prueba de Kruskal-Wallis (resultados expresados como mediana, rango, rango interquartílico [IQR]). La correlación entre variables continuas se evaluó con el coeficiente de correlación de Spearman. En cuanto al riesgo se valoró para las variables categóricas calculando las odds ratio (OR) y el intervalo de confianza del 95 % (IC 95 %).
Para las variables continuas se calcularon las curvas ROC (receiver operating characteristic) para evaluar la sensibilidad y especificidad de las diferentes variables a la hora de predecir la HS; para hallar el punto de corte óptimo se utilizó el índice de Youden. También se llevó a cabo un análisis multivariante utilizando la regresión logística; las variables fueron incluidas en el modelo utilizando el método Wald de selección por pasos hacia adelante. Las variables con más de 30 datos perdidos no fueron incluidas en el análisis multivariante. En todos los casos un valor de p < 0,05 fue considerado como estadísticamente significativo.
Resultados
Se revisaron 90 historiales clínicos, de los cuales 24 no cumplieron los criterios de inclusión. Los motivos de exclusión fueron: ERC estadio IRIS 3 (n=2), enfermedad mitral en estadio C (n=1) y tratamientos previos con trilostano (n=21). Por tanto, 66 perros fueron finalmente incluidos.
Reseña, tipo de SC y enfermedades concurrentes
Veintiséis perros (39 %) eran machos (14 castrados; 54 %) y 40 (61 %) hembras (29 castradas; 73 %). Veintiséis perros eran mestizos y 40 de raza pura de las siguientes razas: Yorkshire Terrier (n=7), Schnauzer miniatura (n=4), West Highland White Terrier (n=4), Cocker Spaniel inglés (n=3), Caniche miniatura (n=3), Bóxer (n=2), Scottish Terrier (n=2), Pomerania (n=2), Pitbull (n=2), Maltés (n=2), Shih Tzu (n=2), y un perro de cada una de las siguientes Bichón Frise, Border Collie, Bulldog francés, Bulldog inglés, Pastor Alemán, Cocker Spaniel americano y Teckel.
La edad al diagnóstico fue de entre 6 y 18 años (mediana de 11 años). Cincuenta y siete perros tenían PDH (86 %) y 9 ADH (14 %); ningún perro fue diagnosticado de hipercortisolismo adrenal e hipofisario concurrentes. Ocho perros (12 %) tenían ERC estadio IRIS 2 y 7 perros (11 %) eran diabéticos. Cuatro perros (6 %) habían sido previamente diagnosticados erróneamente de hipotiroidismo y habían recibido tratamiento con levotiroxina durante varios meses en su centro remisor antes del diagnóstico de SC; en todos estos casos la levotiroxina se suspendió al menos 15 días antes de la medición de la PAS.
Además, 4 perros (6 %) tenían pancreatitis crónica, cuyo diagnóstico se basó en los signos clínicos (es decir, hiporexia, vómitos y/o diarrea), elevación de la lipasa pancreática específica canina y los resultados ecográficos. La duración mediana de los signos clínicos antes del diagnóstico fue de 8 meses (rango 1-36 meses).
Signos clínicos y hallazgos del examen físico
En 60/66 perros (91 %) el propietario refrió polidipsia/poliuria, y en 52/66 (79 %) polifagia. En 51/66 perros (77 %) se observó pérdida de pelo, en 49/66 (74 %) alguna alteración dermatológica (como piel fina, hiperpigmentación o comedones) y 7/66 (11 %) tenían lesiones cutáneas compatibles con calcinosis cutis. En 35/66 perros (53 %) se observó distensión abdominal y 41/66 (62 %) presentaban un jadeo excesivo según sus propietarios. Doce de los 66 perros (18 %) tenían clínica neurológica (convulsiones, “circling”, “pressing” y/o neuropatías periféricas). En cuanto al ICC un 40 % (25/66) tenían sobrepeso y un 6 % (4/66) un peso bajo.
Hemograma, bioquímica, concentraciones de cortisol, urianálisis y cultivo de orina
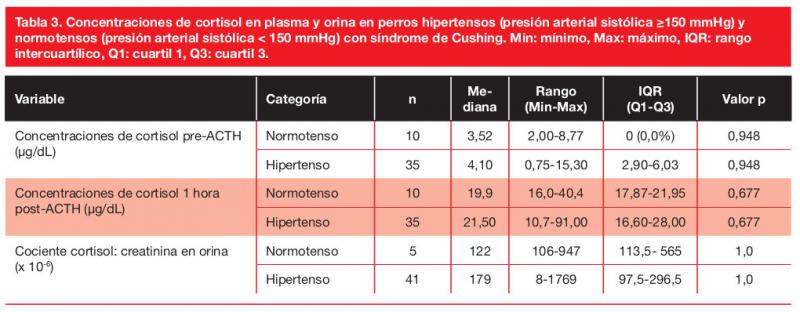
Los resultados de los hemogramas se muestran en la tabla 1, y los de la bioquímica, las concentraciones de cortisol, la DU y el UPC en la tabla 2.
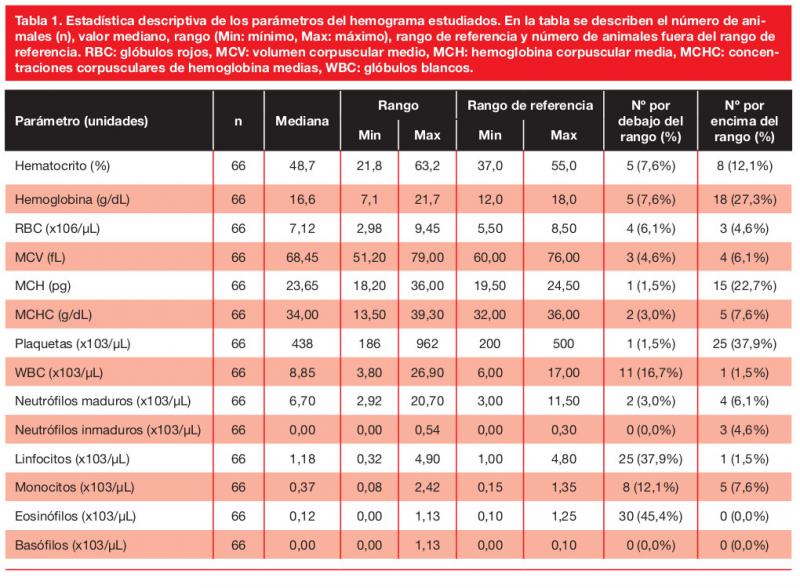
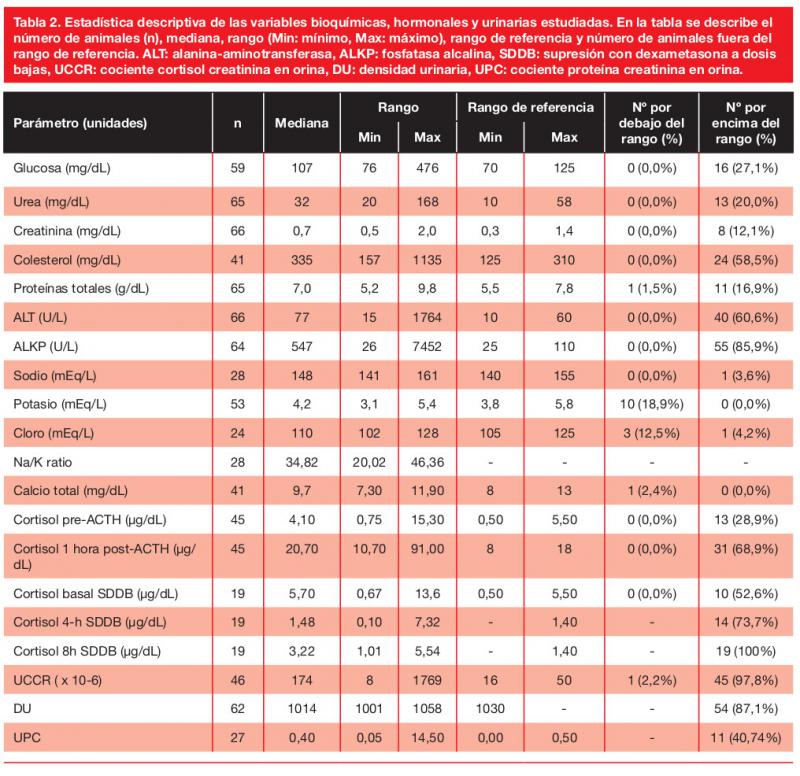
Las alteraciones más frecuentes en el hemograma fueron trombocitosis (25/66, 38 %), linfopenia (25/66, 38 %) y eosinopenia (30/66, 45 %) y, en la bioquímica, elevación de la ALT (40/66, 61 %) y de la ALKP (55/64, 86 %), hipercolesterolemia (24/41, 58 %) e hiperglucemia (16/59, 27 %).
El urianálisis (n=62) mostró una DU baja en 54 perros (87 %) y 15/62 perros (24 %) tenían un sedimento urinario activo. Siete perros (11 %) tenían bacteriuria, 6/62 (10 %) hematuria y 3/62 (5 %) piuria. En 9/62 perros (14 %) se observaron cristales en orina, siendo de oxalato cálcico en solo dos (2/62; 3 %). De los 50 cultivos de orina realizados hubo crecimiento bacteriano en 9 de ellos (18 %) consistente con infección de tracto urinario. Cuando la proteinuria se evaluó mediante la tira de orina se observó en más de la mitad de los animales (34/62; 55 %); al evaluarlo mediante el UPC, se observó un UPC ≥ 0,5 en 11/27 perros (41 %).
De los 19 perros en los que se realizó una SDDB 10/19 (53 %) mostraron una ausencia de supresión (cortisol a las 4 h y 8 h > 1 µg/dL y ambos >50 % del cortisol basal), 4/19 (21 %) supresión parcial (cortisol a las 4 h y 8 h > 1 µg/dL, pero al menos uno de ellos <50% del cortisol basal) y 5/19 (26 %) mostraron un patrón de escape (cortisol a las 4 h < 1 µg/dL y cortisol a las 8 h > 1 µg/dL).
Presión arterial sistólica
La PAS osciló entre 120 mmHg y 280 mmHg, con un valor mediano de 170 mmHg (IQR 150-200 mmHg). Se observó HS en 54/66 perros (82 %); 6 tenían hipertensión leve (9 %), 18/66 moderada (27 %) y 30/66 grave (46 %).
Comparaciones entre la PAS y el resto de variables
Reseña, tipo de SC, enfermedades concurrentes, signos clínicos y hallazgos del examen físico
La prevalencia de HS fue similar entre los perros con ADH (8/9; 89 %) y PDH (46/57; 81 %) (p=1,0). La PAS mediana de los perros con ADH (200 mmHg, rango 140-240 mmHg, IQR 170-220 mmHg) fue superior a la de los perros con PDH (170 mmHg; rango 120-280 mmHg, IQR 150-200 mmHg) pero no de forma estadísticamente significativa (p=0,078).
La prevalencia de HS entre los perros con enfermedades concurrentes fue significativamente menor en los perros diabéticos (3/7; 43 %) que en los no diabéticos (51/59; 86 %) teniendo los primeros una menor OR de padecer HS (OR=0,118; IC 95 % 0,022-0,626; p=0,017). La PAS mediana también fue significativamente menor (p=0,028) en los perros con DM (140 mmHg, rango 120-200 mmHg, IQR 125-170 mmHg) que en los no diabéticos (170 mmHg, rango 120-280 mmHg, IQR 160-200 mmHg); sin embargo, no se observó correlación con la gravedad de la hipertensión.
Los perros previamente diagnosticados erróneamente de hipotiroidismo y tratados con levotiroxina no mostraron una mayor prevalencia de HS (3/4, 75%) en comparación con el resto de la población (51/62, 82 %; p=0,56). Tampoco los perros con ERC IRIS 2 tuvieron mayor prevalencia de HS (7/8, 88 %) que aquellos sin ERC (47/58, 81 %; p=1,0).
No se observó correlación entre la prevalencia de HS ni diferencias en la PAS mediana en cuanto a edad, sexo o estado reproductivo. Tampoco se observaron diferencias en cuanto a los signos clínicos o hallazgos del examen físico.
Hemograma y bioquímica
Los perros hipertensos tuvieron un recuento plaquetario mediano significativamente mayor (487,50 x103/µL, rango 186,00-962,00 x103/µL, IQR 368,00-570,00 x103/µL) que los normotensos (293,00 x103/µL, rango 242,00-436,00 x103/µL, IQR 272,50-382,00 x103/µL) (p=0,001). El área bajo la curva ROC (AUCR) fue de 0,802 (IC 95 %= 0,698-0,907; p=0,001) siendo un recuento plaquetar ≥438 x103/µL 100 % específico y 61,1 % sensible para predecir HS (Figura 1).
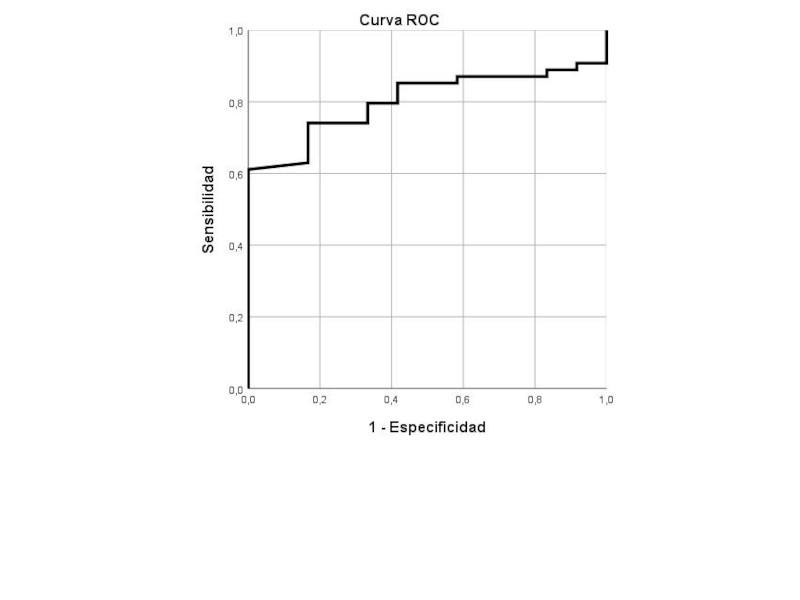
La prevalencia de HS también fue significativamente mayor en aquellos perros con trombocitosis (≥500 x103/µL) (100 %, 25/25) en comparación con aquellos con un recuento plaquetario normal (54 %; 29/41; p=0,002). No se observó ninguna relación con el resto de parámetros del hemograma.
En cuanto a los parámetros bioquímicos evaluados, solamente el potasio (n=53) y la ratio Na/K (n=28) estuvieron correlacionados significativamente con la PAS. Las concentraciones séricas de potasio mostraron una correlación negativa con la PAS (r=-0,315, p=0,022); las concentraciones medianas de potasio fueron significativamente menores en perros hipertensos (4,1 mEq/L, rango 3,1-5,4 mEq/L, IQR 3,9-4,3 mEq/L) que en normotensos (4,5 mEq/L, rango 4,0-5,0 mEq/L, IQR 4,3-4,7 mEq/L) (p=0,007) y fueron significativamente más bajas en aquellos con hipertensión grave (4,1 mEq/L, rango 3,1-5,1 mEq/L, IQR 3,9-4,2 mEq/L) que en el resto de la población (4,3 mEq/L, rango 3,3-5,4 mEq/L, IQR 3,9-4,6 mEq/L) (p=0,027).
El AURC para las concentraciones séricas de potasio fue de 0,789 (IC 95 % 0,655-0,953; p=0,007) y concentraciones ≤4,35 mEq/L fueron 88,9 % específicas y 65,9 % sensibles para detectar HS (Figura 2). Todos los perros con hipokalemia ([K] <3,8 mEq/L) (10/53 perros, 19 %) estaban hipertensos; sin embargo, no hubo una diferencia estadísticamente significativa al comparar la prevalencia de HS de aquellos sin hipokalemia (34/43, 79 %; p=0,180).
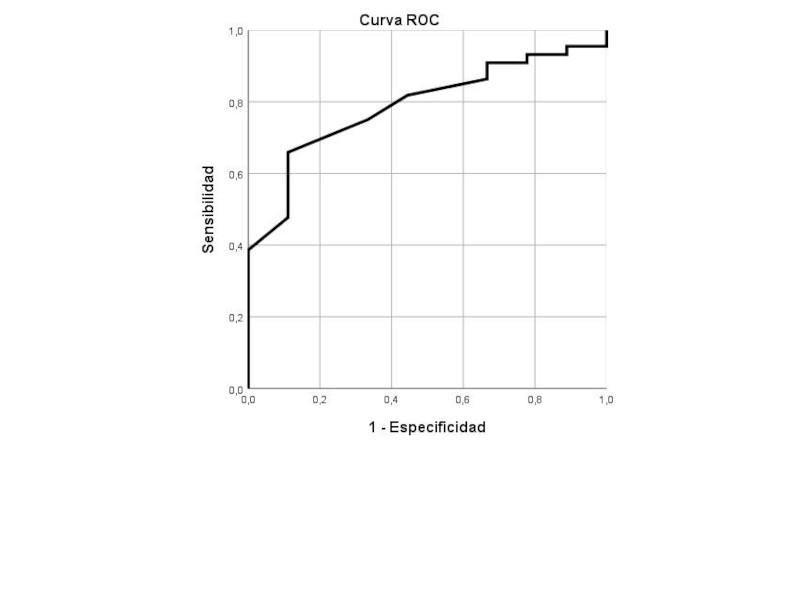
La ratio Na/K se correlacionó positivamente con la PAS (r=0,497, p=0,007), fue significativamente mayor en los perros hipertensos (35,85; rango 29,02-46,36; IQR 32,44-38,97) que en los perros normotensos (32,44; rango 31,15-33,72; IQR 32,20-33,33; p=0,048) y, además, fue significativamente mayor en perros con hipertensión grave (36,15; rango 29,02-42,06; IQR 34,93-38,59) en comparación con el resto de los perros (32,44; rango 30,00-46,36; IQR 32,17-34,65; p=0,022). El AURC fue similar a la obtenida para las concentraciones séricas de potasio (0,787; IC 95 % 0,625-0,949; p=0,048) y valores de Na/K ≥33,8 mostraron una especificidad del 100 % y una sensibilidad del 73,9 % para predecir HS.
Urianálisis, UPC y cultivo de orina
La DU mediana (n=62) fue significativamente menor en los perros hipertensos (1.012, rango 1.001-1.058, IQR 1.007-1.017) que en los normotensos (1.025, rango 1.009-1.043, IQR 1.015-1.035) (p=0,006). Los perros con una DU disminuida (≤ 1.029) tuvieron una prevalencia de HS significativamente mayor (48/54; 89 %) que aquellos con una DU ≥1030 (4/8, 50 %; p=0,019).
De los 8 perros con una DU ≥1030, 3/8 (38 %) eran diabéticos (p=0,024). Como la DM se vio asociada con una menor PAS se optó por eliminar a los perros diabéticos y repetir el análisis de los datos de la DU. En perros no diabéticos no se observaron diferencias en la DU mediana entre aquellos hipertensos (1.018, rango 1.009-1.043, IQR 1.013-1.029) y aquellos normotensos (1.018, rango 1.009-1.043, IQR 1.013-1.029; p=0,12), ni en la prevalencia de HS entre aquellos con una DU <1.030 (46/51, 90 %) o ≥1.030 (4/5, 80 %; p=0,445). Todos los perros con ERC tenían una DU <1.030 (8/8, 100 %), pero en comparación con el resto de la población la diferencia no fue significativa (46/54, 85 %; p=0,581). Los valores medianos de DU tampoco fueron significativamente diferentes entre aquellos perros con o sin ERC.
Al valorar la proteinuria mediante la tira de orina (n=62), los perros proteinúricos tuvieron unos valores medianos de PAS significativamente mayores (182 mmHg, rango 130-280 mmHg, IQR 160-210 mmHg) y una mayor prevalencia de HS (32/34, 94 %) que aquellos sin proteinuria (160 mmHg, rango 120-240 mmHg, IQR 143-180 mmHg [p=0,005], y 20/28, 71 % [p=0,033] respectivamente). La prevalencia de HS grave también fue significativamente mayor en perros proteinúricos según la tira de orina (20/34, 59 %) que en aquellos con un resultado negativo (8/28, 29 %; p=0,022).
Los perros con un UPC ≥ 0,5 tuvieron una PAS mediana significativamente mayor (210 mmHg, rango 120-280 mmHg, IQR 165-235 mmHg) que la de los perros no proteinúricos (160 mmHg, rango 120-230 mmHg, IQR 148-192 mmHg) (p=0,034) aunque la prevalencia de HS fue similar para ambos grupos y la presencia de proteinuria no incrementó las OR respecto a la HS. El AURC para el UPC fue baja (0,644, IC 95 % 0,469-0,858) por lo que no se muestran los puntos de corte.
No se observaron diferencias en la DU o en la presencia de proteinuria (mediante la tira de orina o mediante UPC) entre aquellos perros con o sin ERC. Los datos del sedimento urinario y del cultivo de orina no estuvieron relacionados con la PAS, aunque todos los perros con hematuria tenían HS.
Concentraciones plasmáticas y urinarias de cortisol
Las concentraciones plasmáticas y urinarias de cortisol no mostraron correlación con la PAS ni fueron significativamente diferentes entre los perros hipertensos y normotensos (Tabla 3). Solo 1 de los 19 perros (5 %) en los que se realizó la SDDB estaba normotenso, por tanto, las concentraciones medianas de cortisol de esta prueba de los perros hipertensos y normotensos no pudieron ser comparadas, ni se muestra la prevalencia de SH entre los diferentes patrones de la SDDB. Las PAS mediana fue menor en aquellos perros con un patrón en la SDDB de supresión parcial (157 mm Hg, rango 146-180 mmHg, IQR 150-170 mmHg) que en aquellos con ausencia de supresión (192 mmHg, rango 160-220 mmHg, IQR 165-210 mmHg) o con un patrón de escape (185 mmHg, rango 170-280 mmHg, IQR 170-200 mmHg), aunque la diferencia no fue estadísticamente significativa (p=0,068).
Además, la ratio Na/K se correlacionó positivamente con las concentraciones de cortisol post-ACTH (r=0,458; p=0,049) y con el UCCR (r=0,489; p=0,033).
Análisis de riesgo multivarianteç
En el análisis multivariante el modelo final incluyó tres variables: recuento plaquetario (OR 1,011; IC 95 % 1,002-1,020; p=0,018), concentraciones séricas de potasio (OR 0,066; IC 95 % 0,007-0,627; p=0,018) y presencia de DM (OR 0,060; IC 95 % 0,005-0,765; p=0,030).
Discusión
Un 82 % de los perros con SC espontáneo presentaron HS y, cerca de la mitad, tenían hipertensión grave (PAS ≥ 180 mmHg) con un elevado riesgo de daño en órganos diana. La HS se vio asociada a la presencia de trombocitosis, concentraciones séricas de potasio más bajas y proteinuria. La DM parece ser un factor protector para la HS en perros con SC.
La HS tiene una alta prevalencia tanto en personas como en perros con hipercortisolismo3-7, 11-14, 26-29. Sin embargo, pocos estudios abordan la prevalencia y factores de riesgo asociados a la HS en perros con SC espontáneo. En este estudio, la prevalencia de HS fue alta (82 %), similar a los datos de personas con SC (70-85 %)4-7. La prevalencia de HS en el presente estudio fue similar a la descrita en perros con SC en un estudio previo11, pero ligeramente superior a la descrita por otros12-14,16,26,32.
El hecho de que la prevalencia de HS en el presente estudio sea cercana al límite superior del rango descrito podría estar relacionada con el valor de corte para definir HS. En este estudio se consideró HS una PAS ≥ 150 mmHg (de acuerdo con el consenso del ACVIM de 200728), mientras que en la mayoría de los estudios previos se define como PAS ≥ 160 mm Hg13,14,26. Además, esta mayor prevalencia podría estar influida por el hecho de que un 30 % de los perros eran referidos. Las comparaciones entre diferentes estudios son difíciles debido a los diferentes criterios de inclusión, la variabilidad a la hora de definir HS, y las diversas técnicas de medición de la PAS.
En este estudio se incluyen todos los perros con SC (ADH y PDH). No obstante, ni la prevalencia ni la gravedad de la HS entre los perros con PDH o ADH fue significativamente diferente. La clasificación de los perros respecto a la PAS se basó en el riesgo de daño en órganos diana siguiendo el consenso del ACVIM para la HS en perros28, siendo la prevalencia de hipertensión grave (≥180 mmHg) en este estudio superior a la descrita con anterioridad11. Esto podría estar parcialmente explicado por el punto de corte utilizado en estudios previos para definir hipertensión grave (≥190 mmHg).
Considerando la elevada prevalencia de HS en ambos estudios, y especialmente la de HS grave (con independencia del punto de corte utilizado, el riesgo de daño en órganos diana para un perro con una PAS ≥ 180 mmHg es elevado), la PAS debería evaluarse en todos los perros cuando se sospeche de SC.
Las características de la población (edad, sexo, estado reproductivo y raza) de este estudio, así como la proporción entre perros con PDH o ADH, fueron coherentes con lo descrito en la literatura3,38-40.
La edad, el ICC, el sexo y el estado reproductivo no se vieron asociados a la PAS como ya había sido descrito anteriormente11. La edad se ha visto asociada a la HS en adultos con SC7, aunque la PAS tiende a aumentar con la edad en la población en general41, por lo que no está claro hasta qué punto la edad es un factor independiente que favorezca el desarrollo de HS en personas con hipercortisolismo. En el caso de los perros el efecto de la edad en la presión sanguínea no está claro. Se ha descrito un pequeño incremento en la PAS de 1-3 mmHg al año en algunos estudios, pero esto no ha sido observado por otros autores29,42-44. Además, en contraposición con nuestros hallazgos, en personas con hipercortisolismo se ha observado una relación entre el índice de masa corporal y la hipertensión.
En personas con SC la prevalencia de obesidad (57-100 %) es superior a la observada en los perros de este estudio (40 %), y habitualmente está asociada con la presencia de síndrome metabólico, obesidad central y apnea del sueño, que pueden contribuir al desarrollo de hipertensión4-7,45. En los perros no se ha demostrado la existencia del síndrome metabólico46 y en perros obesos la HS es poco frecuente y la obesidad no ha sido descrita como un factor de riesgo para la HS29,42,43,47.
En adultos con SC la duración del hipercortisolismo se ha asociado a la HS7, aunque en niños en los que la duración de la sintomatología previa al diagnóstico es de 6 meses, la prevalencia de HS también es elevada22,48. En el presente estudio, la HS en perros no se vio asociada a la duración de los signos clínicos lo que podría sugerir que existen similitudes con los pacientes pediátricos con SC en cuanto al desarrollo de la HS.
El origen del hipercortisolismo (PDH o ADH) no tuvo relación con la PAS o con la prevalencia de HS como ya había sido descrito11. Esto refleja que la HS derivada del SC está asociada a los efectos del hipercortisolismo crónico más que como consecuencia de una masa adrenal o de hipertensión secundaria a la presencia de una neoplasia. Sin embargo, se observó una cierta tendencia a tener una PAS superior en los perros con ADH, similar a lo descrito en personas con SC8. Es necesario realizar más estudios incluyendo un mayor número de animales con ADH, ya que el pequeño número de animales con una masa adrenal en el presente estudio podría haber conllevado errores de tipo II.
De forma similar a lo observado en personas y perros con SC5,7,11 no se observó una correlación entre las concentraciones plasmáticas o urinarias de cortisol y la PAS. Esta falta de correlación con el grado de hipercortisolismo sugiere que la hipertensión en perros con SC probablemente tenga una etiología multifactorial, de forma análoga a lo propuesto en medicina humana, no siendo únicamente dependiente de las concentraciones de cortisol4-7.
Las enfermedades concurrentes que afectan a la PAS no fueron un factor de riesgo para la HS. En el presente estudio un 11 % de los perros tenían DM al momento del diagnóstico, lo que está en concordancia con los datos previos49, pero es inferior a aquellos procedentes de medicina humana (32-45 %)7,8,10, lo que sugiere que la DM asociada al hipercortisolismo es menos habitual en perros que en personas. Se desconoce por qué algunos perros con SC desarrollan DM mientras que otros no. Se ha hipotetizado que el hipercortisolismo en perros puede actuar como un factor desencadenante en aquellos con lesión pancreática pre-existente50. En medicina humana el hipercortisolismo se asocia a obesidad central y al síndrome metabólico que producen una resistencia periférica a la acción de la insulina y finalmente pueden derivar en DM tipo II10. Sin embargo, el síndrome metabólico no ha sido demostrado en el perro46 y aunque la obesidad induce resistencia a la acción de la insulina en esta especie, no hay evidencia de que los perros obesos desarrollen DM tipo II46,50,51.
Esto podría explicar la baja prevalencia de DM en perros con SC en comparación con las personas con esta enfermedad. En este estudio, la prevalencia de HS en perros con DM y SC fue de un 43 %. Estos resultados son ligeramente inferiores a los descritos por otros autores en perros con DM (55-67 %)52,53, pero similares a los referidos por otros en perros con DM (46 %)54 o con ambas patologías (50 %)26. Es interesante que en este estudio los perros con DM y SC concurrente tuvieran una menor prevalencia de HS y menor PAS que aquellos que solamente padecían SC. En personas con SC el síndrome metabólico, la obesidad visceral y la resistencia a la insulina contribuyen al desarrollo de HS ya que promueven la aparición de apnea del sueño, aterosclerosis y la remodelación vascular4-6. No obstante, un estudio que evaluó el riesgo cardiovascular en pacientes con SC no identificó diferencias estadísticamente significativas entre el valor de la PAS de los pacientes con DM o alteraciones en el metabolismo de la glucosa y aquellos con un metabolismo de la glucosa normal7.
En cualquier caso, esto no explica el menor riesgo de HS de los perros diabéticos observado en el presente estudio. Los resultados sugieren que en perros con SC la DM no fue un factor de riesgo para el desarrollo de HS. Sin embargo, como únicamente fueron incluidos 7 perros con DM los resultados han de ser interpretados con cautela. Es necesario realizar estudios con un mayor número de animales que presenten ambas patologías para poder elucidar este hallazgo.
La trombocitosis fue frecuente en esta población de perros, como ya ha sido descrito tanto en perros como en personas con hipercortisolismo3,9,33,55,56. Aunque los mecanismos que promueven la trombocitosis en perros con SC no se conocen completamente se cree que es el resultado de una estimulación directa de la médula ósea3,55,57. En este estudio todos los perros con un recuento plaquetario superior a 438x 103/µL, y en consecuencia todos los perros con trombocitosis, tuvieron HS. Hasta donde se sabe este hallazgo no había sido descrito previamente. En personas con hipertensión inducida por cortisol se ha observado un incremento en las concentraciones de eritropoyetina58.
En personas y en perros la eritropoyetina tiene un efecto directo sobre los megacariocitos59,60, así como efectos vasoconstrictores directos, y ha sido propuesta como uno de los mecanismos posibles que influyen en la HS en personas con SC58. Además, en personas con SC se ha observado un mayor estrés oxidativo que deriva en la activación de las plaquetas a través del tromboxano-A2 (TXA2)61,62. El TXA2 es un potente vasoconstrictor que también contribuye a la liberación, activación y agregación plaquetar5,6,9,63. Tanto la eritropoyetina como el TXA2 podrían jugar un papel en la hipertensión inducida por glucocorticoides en el perro, pero son necesarios más estudios.
Las alteraciones bioquímicas fueron similares a las descritas previamente3,33,40. Las concentraciones de potasio, así como la ratio Na/K se vieron asociadas significativamente con la PAS. Se observó una diferencia entre las concentraciones de potasio de los perros con o sin HS, así como de los perros con hipertensión grave; además, todos los perros con hipokalemia ([K] < 3,8 mEq/L) estaban hipertensos. Estos hallazgos podrían sugerir que los receptores de mineralocorticoides (RM) podrían estar involucrados en el desarrollo de la HS en perros con SC. Los RM tienen la misma afinidad por la aldosterona que por el cortisol, pero no por la cortisona64-66. La enzima 11β-hidroxiesteroide deshidrogenasa (11β-HSD) convierte el cortisol en cortisona y está abundantemente expresada en los tejidos diana de los mineralocorticoides (es decir, corteza renal, endotelio vascular y células de la musculatura lisa) blindando la especificidad del RM a la aldosterona64,67-69.
El hipercortisolismo satura la 11β-HSD permitiendo que el cortisol se una al RM, provocando un exceso aparente de mineralocorticoides. En personas con hipercortisolismo esto se ha asociado a una mayor retención de sodio y excreción de potasio, lo cual puede contribuir al desarrollo de HS5-7,23,25,45,66-68,70-72.
Estudios previos en perros con PDH han encontrado que éstos tienen concentraciones de aldosterona menores que los controles sanos30,31. Se ha propuesto que este hallazgo es debido al exceso aparente de mineralocorticoides por la saturación de los RM inducida por glucocorticoides30, o bien debido a la transformación de las células de la zona glomerulosa en células similares a las de la zona fascicular31. Es posible que, como en personas con SC, las concentraciones reducidas de aldosterona sean el resultado, al menos parcialmente, de la saturación de los RM, derivando en unas menores concentraciones séricas de potasio, mayor reabsorción tubular de sodio e HS.
La saturación de los RM podría explicar la relación observada en este estudio entre la HS y las concentraciones séricas de potasio. Sin embargo, son necesarios más estudios que valoren la aldosterona, la actividad de la 11β-HSD, los electrolitos en orina y la relación de todos ellos con la HS.
En el presente estudio se observó una correlación entre la DU y la HS, aunque incluyendo los perros sin DM no se observó. Esto podría sugerir que la alta proporción de perros diabéticos en el grupo de perros con una DU ≥ 1.030 estaba reduciendo la prevalencia de HS, más que la existencia de una relación directa entre la DU y la HS.
La presencia de proteinuria (definida como un UPC ≥ 0.5) fue habitual, estando presente en un 41 % de los perros, similar a lo descrito previamente11,13,17. La prevalencia de HS fue parecida entre los perros proteinúricos y no proteinúricos, aunque los valores medianos de PAS fueron superiores en los perros con proteinuria, en concordancia con lo descrito por otros autores11. La relación entre la PAS y la proteinuria en perros con SC no siempre se ha observado en estudios previos11-14,32. La hipertensión inducida por los glucocorticoides puede derivar en un incremento en el flujo sanguíneo renal, aumentando la presión intraglomerular y potencialmente contribuyendo a la proteinuria13,73-75. Sin embargo, otros autores no han encontrado una relación entre la HS y la proteinuria en perros con SC, sugiriendo que el desarrollo de proteinuria en estos perros es multifactorial y otros mecanismos como la dislipidemia, alteraciones del endotelio vascular, la glomeruloesclerosis y el estado hipercoagulable de estos perros podrían también jugar un papel11,12,14,32.
El diseño de este estudio presenta limitaciones, principalmente derivadas de su naturaleza retrospectiva. Aunque la medición de la PAS es un procedimiento estandarizado en nuestro centro, la falta de un diseño prospectivo hace que los resultados puedan estar sujetos a variaciones individuales y no se registraron los potenciales eventos estresantes. Además, no todas las variables fueron medidas en todos los pacientes y es posible que otros factores de riesgo no estudiados puedan estar presentes. Desafortunadamente, debido a la naturaleza retrospectiva del estudio, no se determinaron las concentraciones de aldosterona, haciendo difícil obtener conclusiones sobre la relación entre las concentraciones de potasio y la HS, así como del potencial papel del RM en el desarrollo de la HS en perros con SC.
Otra limitación potencial es que actualmente no existe ningún dispositivo para la determinación de la presión sanguínea que haya sido completamente validado en perros despiertos29. El método Doppler es la técnica utilizada en nuestro centro y el protocolo cumple las recomendaciones de las guías ACVIM28,29. Los estudios realizados en perros despiertos comparando el método Doppler o la oscilometría con la determinación de la presión arterial invasiva han demostrado que ninguno de ellos satisface completamente todos los criterios del ACVIM para su validación29,76-78. La oscilometría de alta definición permite valorar las ondas de pulso para detectar posibles artefactos, lo que podría conllevar la obtención de resultados más fiables en comparación con otros dispositivos79. Sin embargo, en un estudio que comparó la oscilometría de alta definición y el método Doppler en perros despiertos, los resultados mostraron que los valores de PAS obtenidos con ambos dispositivos fueron similares80.
En conclusión, la HS, habitualmente grave, es frecuente en perros con SC y la presión arterial debe determinarse de forma rutinaria en perros con sospecha de SC. En aquellos casos en que la presión arterial no pueda medirse de forma rutinaria la presencia de trombocitosis, concentraciones bajas de potasio y la presencia de proteinuria debe aumentar las sospechas de una posible HS y del potencial daño en los órganos diana y podría incitar al clínico a realizar este procedimiento. La asociación entre la HS y las concentraciones séricas de potasio podría sugerir que el RM juega un papel en el desarrollo de hipertensión en estos perros; sin embargo, es necesario realizar más estudios para investigar la relación entre la HS, la aldosterona, y la actividad de la11β-HSD en perros con SC. Para terminar, los perros con DM y SC de forma concurrente parecieron tener un menor riesgo de hipertensión; este hallazgo debe ser investigado en mayor profundidad.
Bibliografía
- Galac S, Kooistra HS, Voorhout G, van den Ingh TS, Mol JA, van den Berg G, Meij BP. Hyperadrenocorticism in a dog due to ectopic secretion of adrenocorticotropic hormone. Domestic animal endocrinology. 2005;28(3):338-48.
- Galac S, Kars VJ, Voorhout G, Mol JA, Kooistra HS. ACTH-independent hyperadrenocorticism due to food-dependent hypercortisolemia in a dog: a case report. Veterinary journal (London, England : 1997). 2008;177(1):141-3.
- Pérez Alenza MD, Melián C. . Hyperadrenocorticism in Dogs. In: Ettinger SJ, Feldman E.C., Côté E. , editor. Textbook of Veterinary Internal Medicine. 2. 8th ed. St. Louis, Missouri: Elsevier; 2017. p. 4345- 89.
- Pivonello R, Isidori AM, De Martino MC, Newell-Price J, Biller BM, Colao A. Complications of Cushing's syndrome: state of the art. The lancet Diabetes & endocrinology. 2016;4(7):611-29.
- Isidori AM, Graziadio C, Paragliola RM, Cozzolino A, Ambrogio AG, Colao A, Corsello SM, Pivonello R. The hypertension of Cushing's syndrome: controversies in the pathophysiology and focus on cardiovascular complications. Journal of hypertension. 2015;33(1):44-60.
- Magiakou MA, Smyrnaki P, Chrousos GP. Hypertension in Cushing's syndrome. Best practice & research Clinical endocrinology & metabolism. 2006;20(3):467-82.
- Mancini T, Kola B, Mantero F, Boscaro M, Arnaldi G. High cardiovascular risk in patients with Cushing's syndrome according to 1999 WHO/ISH guidelines. Clinical endocrinology. 2004;61(6):768-77.
- Valassi E, Santos A, Yaneva M, Toth M, Strasburger CJ, Chanson P, Wass JA, Chabre O, Pfeifer M, Feelders RA, Tsagarakis S, Trainer PJ, Franz H, Zopf K, Zacharieva S, Lamberts SW, Tabarin A, Webb SM. The European Registry on Cushing's syndrome: 2-year experience. Baseline demographic and clinical characteristics. European journal of endocrinology. 2011;165(3):383-92.
- Isidori AM, Minnetti M, Sbardella E, Graziadio C, Grossman AB. Mechanisms in endocrinology: The spectrum of haemostatic abnormalities in glucocorticoid excess and defect. European journal of endocrinology. 2015;173(3):R101-13.
- Barbot M, Ceccato F, Scaroni C. Diabetes Mellitus Secondary to Cushing's Disease. Frontiers in endocrinology. 2018;9:284.
- Ortega TM, Feldman EC, Nelson RW, Willits N, Cowgill LD. Systemic arterial blood pressure and urine protein/creatinine ratio in dogs with hyperadrenocorticism. Journal of the American Veterinary Medical Association. 1996;209(10):1724-9.
- Lien YH, Hsiang TY, Huang HP. Associations among systemic blood pressure, microalbuminuria and albuminuria in dogs affected with pituitary- and adrenal-dependent hyperadrenocorticism. Acta veterinaria Scandinavica. 2010;52:61.
- Vidal PN, Miceli DD, Arias ES, D’Anna E, García JD, Castillo VA. Decrease of nitric oxide and increase in diastolic blood pressure are two events that affect renal function in dogs with pituitary dependent hyperadrenocorticism. Open veterinary journal. 2018;8(1):86-95.
- Mazzi A, Fracassi F, Dondi F, Gentilini F, Famigli Bergamini P. Ratio of urinary protein to creatinine and albumin to creatinine in dogs with diabetes mellitus and hyperadrenocorticism. Veterinary research communications. 2008;32 Suppl 1:S299-301.
- Mawby DI, Whittemore JC, Fecteau KA. Canine pancreatic-specific lipase concentrations in clinically healthy dogs and dogs with naturally occurring hyperadrenocorticism. Journal of veterinary internal medicine. 2014;28(4):1244-50.
- Smets PM, Lefebvre HP, Meij BP, Croubels S, Meyer E, Van de Maele I, Daminet S. Long-term follow-up of renal function in dogs after treatment for ACTH-dependent hyperadrenocorticism. Journal of veterinary internal medicine. 2012;26(3):565-74.
- Hurley KJ, Vaden SL. Evaluation of urine protein content in dogs with pituitary-dependent hyperadrenocorticism. Journal of the American Veterinary Medical Association. 1998;212(3):369-73.
- Lee D, Lee Y, Choi W, Chang J, Kang JH, Na KJ, Chang DW. Quantitative CT assessment of bone mineral density in dogs with hyperadrenocorticism. Journal of veterinary science. 2015;16(4):531-42.
- Aicher KM, Cullen JM, Seiler GS, Lunn KF, Mathews KG, Gookin JL. Investigation of adrenal and thyroid gland dysfunction in dogs with ultrasonographic diagnosis of gallbladder mucocele formation. PloS one. 2019;14(2):e0212638.
- Hoffman JM, Lourenco BN, Promislow DEL, Creevy KE. Canine hyperadrenocorticism associations with signalment, selected comorbidities and mortality within North American veterinary teaching hospitals. The Journal of small animal practice. 2018;59(11):681-90.
- Jaffey JA, Pavlick M, Webster CR, Moore GE, McDaniel KA, Blois SL, Brand EM, Reich CF, Motschenbacher L, Hostnik ET, Su D, Lidbury JA, Raab O, Carr SV, Mabry KE, Fox-Alvarez W, Townsend S, Palermo S, Nakazono Y, Ohno K, VanEerde E, Fieten H, Hulsman AH, Cooley-Lock K, Dunning M, Kisielewicz C, Zoia A, Caldin M, Conti-Patara A, Ross L, Mansfield C, Lynn O, Claus MA, Watson PJ, Swallow A, Yool DA, Gommeren K, Knops M, Ceplecha V, de Rooster H, Lobetti R, Dossin O, Jolivet F, Papazoglou LG, Pappalardo MCF, Manczur F, Dudas-Gyorki Z, O'Neill EJ, Martinez C, Gal A, Owen RL, Gunn E, Brown K, Harder LK, Griebsch C, Anfinsen KP, Gron TK, Marchetti V, Heilmann RM, Pazzi P, DeClue AE. Effect of clinical signs, endocrinopathies, timing of surgery, hyperlipidemia, and hyperbilirubinemia on outcome in dogs with gallbladder mucocele. Veterinary journal (London, England : 1997). 2019;251:105350.
- Lodish MB, Sinaii N, Patronas N, Batista DL, Keil M, Samuel J, Moran J, Verma S, Popovic J, Stratakis CA. Blood pressure in pediatric patients with Cushing syndrome. The Journal of clinical endocrinology and metabolism. 2009;94(6):2002-8.
- Salih M, Bovee DM, van der Lubbe N, Danser AHJ, Zietse R, Feelders RA, Hoorn EJ. Increased Urinary Extracellular Vesicle Sodium Transporters in Cushing Syndrome With Hypertension. The Journal of clinical endocrinology and metabolism. 2018;103(7):2583-91.
- Goyal A, Gupta U, Kandasamy D, Khadgawat R. Severe Hypercortisolism with Hypokalemic Alkalosis Mimicking Ectopic Cushing Syndrome in a Patient with Cushing Disease Due to Pituitary Microadenoma. Indian J Endocrinol Metab. 2018;22(6):860-3.
- Torpy DJ, Mullen N, Ilias I, Nieman LK. Association of hypertension and hypokalemia with Cushing's syndrome caused by ectopic ACTH secretion: a series of 58 cases. Annals of the New York Academy of Sciences. 2002;970:134-44.
- Novellas R, de Gopegui RR, Espada Y. Determination of renal vascular resistance in dogs with diabetes mellitus and hyperadrenocorticism. The Veterinary record. 2008;163(20):592-6.
- Reusch CE, Schellenberg S, Wenger M. Endocrine hypertension in small animals. The Veterinary clinics of North America Small animal practice. 2010;40(2):335-52.
- Brown S, Atkins C, Bagley R, Carr A, Cowgill L, Davidson M, Egner B, Elliott J, Henik R, Labato M, Littman M, Polzin D, Ross L, Snyder P, Stepien R. Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. Journal of veterinary internal medicine. 2007;21(3):542-58.
- Acierno MJ, Brown S, Coleman AE, Jepson RE, Papich M, Stepien RL, Syme HM. ACVIM consensus statement: Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. Journal of veterinary internal medicine. 2018.
- Goy-Thollot I, Pechereau D, Keroack S, Dezempte JC, Bonnet JM. Investigation of the role of aldosterone in hypertension associated with spontaneous pituitary-dependent hyperadrenocorticism in dogs. The Journal of small animal practice. 2002;43(11):489-92.
- Javadi S, Kooistra HS, Mol JA, Boer P, Boer WH, Rijnberk A. Plasma aldosterone concentrations and plasma renin activity in healthy dogs and dogs with hyperadrenocorticism. The Veterinary record. 2003;153(17):521-5.
- Chen HY, Lien YH, Huang HP. Association of Renal Resistive Index, Renal Pulsatility Index, Systemic Hypertension, and Albuminuria with Survival in Dogs with Pituitary-Dependent Hyperadrenocorticism. International journal of endocrinology. 2016;2016:3814034.
- Behrend EN, Kooistra HS, Nelson R, Reusch CE, Scott-Moncrieff JC. Diagnosis of spontaneous canine hyperadrenocorticism: 2012 ACVIM consensus statement (small animal). Journal of veterinary internal medicine. 2013;27(6):1292-304.
- Benchekroun G, de Fornel-Thibaud P, Rodriguez Pineiro MI, Rault D, Besso J, Cohen A, Hernandez J, Stambouli F, Gomes E, Garnier F, Begon D, Maurey-Guenec C, Rosenberg D. Ultrasonography criteria for differentiating ACTH dependency from ACTH independency in 47 dogs with hyperadrenocorticism and equivocal adrenal asymmetry. Journal of veterinary internal medicine. 2010;24(5):1077-85.
- Smiley LE, Peterson ME. Evaluation of a urine cortisol:creatinine ratio as a screening test for hyperadrenocorticism in dogs. Journal of veterinary internal medicine. 1993;7(3):163-8.
- Atkins C, Bonagura J, Ettinger S, Fox P, Gordon S, Haggstrom J, Hamlin R, Keene B, Luis-Fuentes V, Stepien R. Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. Journal of veterinary internal medicine. 2009;23(6):1142-50.
- IRIS. IRIS Staging of CKD (modified 2017) http://wwwiris-kidneycom/guidelines/staginghtml. 2017.
- Carotenuto G, Malerba E, Dolfini C, Brugnoli F, Giannuzzi P, Semprini G, Tosolini P, Fracassi F. Cushing's syndrome-an epidemiological study based on a canine population of 21,281 dogs. Open veterinary journal. 2019;9(1):27-32.
- O'Neill DG, Scudder C, Faire JM, Church DB, McGreevy PD, Thomson PC, Brodbelt DC. Epidemiology of hyperadrenocorticism among 210,824 dogs attending primary-care veterinary practices in the UK from 2009 to 2014. The Journal of small animal practice. 2016;57(7):365-73.
- Bennaim M, Centola S, Ramsey I, Seth M. Clinical and Clinicopathological Features in Dogs with Uncomplicated Spontaneous Hyperadrenocorticism Diagnosed in Primary Care Practice (2013-2014). Journal of the American Animal Hospital Association. 2019;55(4):178-86.
- Kearney PM, Whelton M, Reynolds K, Muntner P, Whelton PK, He J. Global burden of hypertension: analysis of worldwide data. Lancet (London, England). 2005;365(9455):217-23.
- Bodey AR, Michell AR. Epidemiological study of blood pressure in domestic dogs. The Journal of small animal practice. 1996;37(3):116-25.
- Remillard RL, Ross JN, Eddy JB. Variance of indirect blood pressure measurements and prevalence of hypertension in clinically normal dogs. American journal of veterinary research. 1991;52(4):561-5.
- Meurs KM, Miller MW, Slater MR, Glaze K. Arterial blood pressure measurement in a population of healthy geriatric dogs. Journal of the American Animal Hospital Association. 2000;36(6):497-500.
- Pivonello R, Faggiano A, Lombardi G, Colao A. The metabolic syndrome and cardiovascular risk in Cushing's syndrome. Endocrinology and metabolism clinics of North America. 2005;34(2):327-39, viii.
- Verkest KR. Is the metabolic syndrome a useful clinical concept in dogs? A review of the evidence. Veterinary journal (London, England : 1997). 2014;199(1):24-30.
- Perez-Sanchez AP, Del-Angel-Caraza J, Quijano-Hernandez IA, Barbosa-Mireles MA. Obesity-hypertension and its relation to other diseases in dogs. Veterinary research communications. 2015;39(1):45-51.
- Magiakou MA, Mastorakos G, Zachman K, Chrousos GP. Blood pressure in children and adolescents with Cushing's syndrome before and after surgical care. The Journal of clinical endocrinology and metabolism. 1997;82(6):1734-8.
- Miceli DD, Pignataro OP, Castillo VA. Concurrent hyperadrenocorticism and diabetes mellitus in dogs. Research in veterinary science. 2017;115:425-31.
- Gilor C, Niessen SJ, Furrow E, DiBartola SP. What's in a Name? Classification of Diabetes Mellitus in Veterinary Medicine and Why It Matters. Journal of veterinary internal medicine. 2016;30(4):927-40.
- Verkest KR, Rand JS, Fleeman LM, Morton JM. Spontaneously obese dogs exhibit greater postprandial glucose, triglyceride, and insulin concentrations than lean dogs. Domestic animal endocrinology. 2012;42(2):103-12.
- Herring I, Panciera D, Werre S. Longitudinal Prevalence of Hypertension, Proteinuria, and Retinopathy in Dogs with Spontaneous Diabetes Mellitus. Journal of veterinary internal medicine. 2014;28(2):488-95.
- Marynissen SJ, Smets PM, Ghys LF, Paepe D, Delanghe J, Galac S, Meyer E, Lefebvre HP, Daminet S. Long-term follow-up of renal function assessing serum cystatin C in dogs with diabetes mellitus or hyperadrenocorticism. Veterinary clinical pathology. 2016;45(2):320-9.
- Struble AL, Feldman EC, Nelson RW, Kass PH. Systemic hypertension and proteinuria in dogs with diabetes mellitus. Journal of the American Veterinary Medical Association. 1998;213(6):822-5.
- Park FM, Blois SL, Abrams-Ogg AC, Wood RD, Allen DG, Nykamp SG, Downie A. Hypercoagulability and ACTH-dependent hyperadrenocorticism in dogs. Journal of veterinary internal medicine. 2013;27(5):1136-42.
- Sato T, Hiramatsu R, Iwaoka T, Fujii Y, Shimada T, Umeda T. Changes of platelets, serum lactic dehydrogenase, gamma-glutamyltranspeptidase, choline esterase and creatine phosphokinase levels in patients with Cushing's syndrome. The Tohoku journal of experimental medicine. 1984;142(2):195-200.
- Woolcock AD, Keenan A, Cheung C, Christian JA, Moore GE. Thrombocytosis in 715 Dogs (2011-2015). Journal of veterinary internal medicine. 2017;31(6):1691-9.
- Kelly JJ, Martin A, Whitworth JA. Role of erythropoietin in cortisol-induced hypertension. Journal of human hypertension. 2000;14(3):195-8.
- Stohlawetz PJ, Dzirlo L, Hergovich N, Lackner E, Mensik C, Eichler HG, Kabrna E, Geissler K, Jilma B. Effects of erythropoietin on platelet reactivity and thrombopoiesis in humans. Blood. 2000;95(9):2983-9.
- Wolf RF, Peng J, Friese P, Gilmore LS, Burstein SA, Dale GL. Erythropoietin administration increases production and reactivity of platelets in dogs. Thrombosis and haemostasis. 1997;78(6):1505-9.
- Karamouzis I, Berardelli R, D'Angelo V, Fussotto B, Zichi C, Giordano R, Settanni F, Maccario M, Ghigo E, Arvat E. Enhanced oxidative stress and platelet activation in patients with Cushing's syndrome. Clinical endocrinology. 2015;82(4):517-24.
- Prazny M, Jezkova J, Horova E, Lazarova V, Hana V, Kvasnicka J, Pecen L, Marek J, Skrha J, Krsek M. Impaired microvascular reactivity and endothelial function in patients with Cushing's syndrome: influence of arterial hypertension. Physiological research. 2008;57(1):13-22.
- Nakahata N. Thromboxane A2: physiology/pathophysiology, cellular signal transduction and pharmacology. Pharmacology & therapeutics. 2008;118(1):18-35.
- Fuller PJ, Young MJ. Mechanisms of mineralocorticoid action. Hypertension (Dallas, Tex : 1979). 2005;46(6):1227-35.
- Funder JW, Pearce PT, Smith R, Smith AI. Mineralocorticoid action: target tissue specificity is enzyme, not receptor, mediated. Science (New York, NY). 1988;242(4878):583-5.
- Quinkler M, Stewart PM. Hypertension and the cortisol-cortisone shuttle. The Journal of clinical endocrinology and metabolism. 2003;88(6):2384-92.
- Stewart PM. Tissue-specific Cushing's syndrome, 11beta-hydroxysteroid dehydrogenases and the redefinition of corticosteroid hormone action. European journal of endocrinology. 2003;149(3):163-8.
- Stewart PM, Walker BR, Holder G, O'Halloran D, Shackleton CH. 11 beta-Hydroxysteroid dehydrogenase activity in Cushing's syndrome: explaining the mineralocorticoid excess state of the ectopic adrenocorticotropin syndrome. The Journal of clinical endocrinology and metabolism. 1995;80(12):3617-20.
- Edwards CR, Stewart PM, Burt D, Brett L, McIntyre MA, Sutanto WS, de Kloet ER, Monder C. Localisation of 11 beta-hydroxysteroid dehydrogenase--tissue specific protector of the mineralocorticoid receptor. Lancet (London, England). 1988;2(8618):986-9.
- Lian P, Li H, Zhang Y, Ji Z. [Effects of activity of 11beta-hydroxysteroid dehydrogenase type 2 on serum potassium levels in Cushing's syndrome patients]. Zhonghua yi xue za zhi. 2015;95(12):929-32.
- Bailey MA. 11beta-Hydroxysteroid Dehydrogenases and Hypertension in the Metabolic Syndrome. Current hypertension reports. 2017;19(12):100.
- Palermo M, Shackleton CH, Mantero F, Stewart PM. Urinary free cortisone and the assessment of 11 beta-hydroxysteroid dehydrogenase activity in man. Clinical endocrinology. 1996;45(5):605-11.
- Lees GE, Brown SA, Elliott J, Grauer GE, Vaden SL. Assessment and management of proteinuria in dogs and cats: 2004 ACVIM Forum Consensus Statement (small animal). Journal of veterinary internal medicine. 2005;19(3):377-85.
- Smets P, Meyer E, Maddens B, Daminet S. Cushing's syndrome, glucocorticoids and the kidney. General and comparative endocrinology. 2010;169(1):1-10.
- Schellenberg S, Mettler M, Gentilini F, Portmann R, Glaus TM, Reusch CE. The effects of hydrocortisone on systemic arterial blood pressure and urinary protein excretion in dogs. Journal of veterinary internal medicine. 2008;22(2):273-81.
- Vachon C, Belanger MC, Burns PM. Evaluation of oscillometric and Doppler ultrasonic devices for blood pressure measurements in anesthetized and conscious dogs. Research in veterinary science. 2014;97(1):111-7.
- Bosiack AP, Mann FA, Dodam JR, Wagner-Mann CC, Branson KR. Comparison of ultrasonic Doppler flow monitor, oscillometric, and direct arterial blood pressure measurements in ill dogs. Journal of veterinary emergency and critical care (San Antonio, Tex : 2001). 2010;20(2):207-15.
- Haberman CE, Kang CW, Morgan JD, Brown SA. Evaluation of oscillometric and Doppler ultrasonic methods of indirect blood pressure estimation in conscious dogs. Canadian journal of veterinary research = Revue canadienne de recherche veterinaire. 2006;70(3):211-7.
- Rysnik MK, Cripps P, Iff I. A clinical comparison between a non-invasive blood pressure monitor using high definition oscillometry (Memodiagnostic MD 15/90 Pro) and invasive arterial blood pressure measurement in anaesthetized dogs. Veterinary anaesthesia and analgesia. 2013;40(5):503-11.
- Chetboul V, Tissier R, Gouni V, de Almeida V, Lefebvre HP, Concordet D, Jamet N, Sampedrano CC, Serres F, Pouchelon JL. Comparison of Doppler ultrasonography and high-definition oscillometry for blood pressure measurements in healthy awake dogs. American journal of veterinary research. 2010;71(7):766-72.
 by Multimédica
by Multimédica