¿Qué aspectos se tienen en cuenta en las pautas de desparasitación en pequeños animales?
Resumen breve
La distribución cosmopolita de los parásitos y las posibles consecuencias clínicas en animales de compañía, son algunos de los aspectos más relevantes a la hora de establecer protocolos antiparasitarios. Sin embargo, ni la pauta de desparasitación, ni el objetivo que se persigue son siempre los mismos.Índice de contenidos
Resumen
La distribución cosmopolita de los parásitos y las posibles consecuencias clínicas en animales de compañía, son algunos de los aspectos más relevantes a la hora de establecer protocolos antiparasitarios. Sin embargo, ni la pauta de desparasitación, ni el objetivo que se persigue son siempre los mismos.

Conocer qué endoparásitos digestivos afectan o pueden afectar a las mascotas, debería ser la base de cualquier protocolo antiparasitario. Por lo que, los análisis coprológicos deberían utilizarse no solo cuando existe parasitosis sino también para conocer si existe parasitación.
El objetivo fue estudiar si las pautas de desparasitación son uniformes y eficaces, y si realmente se conoce qué finalidad se persigue con ellas.
Para ello, se realizó una encuesta epidemiológica a 39 propietarios de perros y gatos, destacando los aspectos relacionados con el hospedador y medio.
Además, se tomaron muestras fecales llevando a cabo distintas técnicas coprológicas para la detección de endoparásitos digestivos.
El 41 % de los carnívoros mostró infecciones patentes, siendo Giardia duodenalis 33,3 % (Figura 1), el endoparásito digestivo más detectado. El 71 % de los propietarios desparasitaba regularmente, destacando que los análisis coprológicos solo se utilizaron en casos de animales con clínica; 35,9 %.
Los tratamientos antiparasitarios en carnívoros persiguen evitar las parasitosis y también las zoonosis, por lo que, deberían realizarse análisis coprológicos para detectar la presencia de formas parásitas en heces y decidir, dependiendo de otros factores del hospedador como hábitat, alimentación o viajes, qué pauta es la más adecuada en cada caso.
Introducción
Importancia de los animales de compañía y sus parásitos
La presencia de animales de compañía en los hogares, es cada vez mayor. De hecho, se considera que al menos el 39,7 % de los hogares españoles cuentan con alguna mascota entre las que destacan perros y gatos1.
Los beneficios que pueden aportar, no están solo relacionados con hábitos más saludables por parte de los propietarios, sino también, se han demostrado efectos positivos en pacientes con cáncer, perros que han demostrado poder detectar los niveles de glucemia en pacientes diabéticos o en pacientes con epilepsia. Más allá, de que, tener animales de compañía reduce la soledad, ayuda en casos de estrés postraumático o casos de enfermedades mentales2.
Sin embargo, se ven afectados por distintos parásitos, tanto internos como externos. Los más frecuentes son los endoparásitos digestivos, entre los que se engloban distintos agentes parasitarios que se pueden detectar con técnicas coprológicas en periodo de patencia. Estos parásitos, a veces son específicos, pero en otros casos podrán afectar a perros y gatos, e incluso, aquellos que tienen potencial zoonósico, podrán afectar a los humanos3.
Dentro de los parásitos con potencial zoonósico hay protistas como Giardia duodenalis, cestodos como Dipylidium caninum o Taeniidae, o nematodos como Thichuris vulpis, Ancylostoma caninum o Toxocara canis en perros4,5. Mientras que en gatos se pueden detectar también G. duodenalis y D. caninum como en perros, y, además, Toxoplasma gondii, Toxocara cati o A. tubaeforme entre otros3.
Todos ellos, pueden producir clínica en los animales infectados. En ocasiones los signos clínicos, son poco evidentes como decaimiento o ligera anemia, aunque otras veces, pueden producir gastroenteritis más agudas o problemas respiratorios en el caso de Toxocara.
Factores epidemiológicos que influencian la frecuencia de aparición de endoparásitos digestivos
Debido, entre otras causas, al elevado número de hospedadores disponibles, los endoparásitos digestivos suelen tener una distribución cosmopolita. En Europa, esta incidencia se estima en perros entre el 30-35 % y en gatos entre el 20-40 %6,7,8.
Las diferencias entre la frecuencia de aparición de parásitos entre las macotas, se deben, fundamentalmente a distintos factores epidemiológicos asociados, como el hospedador y el medio ambiente. Por otra parte, deben tenerse en cuenta las distintas pautas de desparasitación que siguen o no sus propietarios. Sin olvidar que las técnicas laboratoriales que permiten su detección pueden tener distinta sensibilidad.
Si se tiene en cuenta la especie animal, en gatos algunos de los parásitos más frecuentes son: Giardia duodenalis, D. caninum, Cystoisospora, Toxascaris leonina, Aelurostrongylus abstrusus o Cryptosporidium9.
En perros, nematodos de la familia Ancylostomatidae (29,7-43,1 %), T. vulpis (31,3-40,2 %), T. canis (6,1-18,6 %), Toxascaris leonina (2,3-13,7 %), Cystoisospora (3,8-7 %), Taeniidae (0,8-5,9 %) y Giardia duodenalis (2,3-3,9 %)10.
Además, se deben analizar otros factores del hospedador, y uno de los más relevantes es la edad. El motivo fundamental, es que, en algunos casos, los hospedadores desarrollan distintos mecanismos que dificultan a los parásitos completar sus ciclos biológicos, y, por lo tanto, disminuyen las consecuencias de las acciones patógenas.
Por ejemplo, en infecciones por Toxocara canis si los cachorros tienen menos de seis meses es más probable que sufran migración hepato-pulmonar y después infecciones patentes. En animales de más de 6 meses, se produce una migración somática, que, si bien permite a las larvas sobrevivir largos periodos de tiempo, no permite que el parásito complete su fase endógena, y, por lo tanto, no hay infecciones patentes11.
Pero no solo está demostrado que la mayoría de las infecciones parasitarias se detectan en animales jóvenes, con el aumento de la edad, se vuelve a detectar un mayor porcentaje de perros parasitados, que podría deberse a falta de inmunidad a largo plazo o disminución de respuesta inmunitaria en animales de edades avanzadas.
La edad, también es importante en casos de coccidios. El escaso número de animales adultos en los que se detecta Cystoisospora, podría indicar una inmunidad casi de por vida frente a este género parasitario12. Otro factor epidemiológico muy importante es el hábitat, que va a favorecer o dificultar su infección. Como demuestra un estudio realizado en España en perros de granja y perros callejeros, en el que, a pesar de que en ambos casos hay elevado contacto de los hospedadores con los parásitos, los perros vagabundos mostraron prevalencias del 72,5 %, y los de granja del 58,8 %10.
Cabe destacar, qué tipo de ciclo biológico tienen los parásitos. Los cestodos, tienen ciclos biológicos indirectos, por lo que, en todos los casos necesitan de hospedadores intermediarios. En el caso de D. caninum suelen ser pulgas, aunque también podrían ser piojos. En la familia Taeniidae, son rumiantes, lagomorfos, roedores y otros mamíferos los que actúan como hospedadores intermediarios. Por lo que, perros y/o gatos que estén más en contacto con estos hospedadores intermediarios serán los más afectados.
Por otra parte, las condiciones medioambientales, fundamentalmente factores abióticos como la temperatura y la humedad, van a ser responsables de que las formas parásitas en heces, que no son infectantes, puedan o no alcanzar este estadío evolutivo. En el caso de Toxocara canis, se sabe que, siempre mantenidos en agua, se produciría desarrollo de la larva en el interior, hasta los 37°C, pero cuando más cerca esté la temperatura de este valor, antes se producirá este desarrollo. Aunque también se detectó que pueden sobrevivir a temperaturas de congelación, que aseguran que pueden tolerar un rango térmico muy amplio y sobrevivir, y que, sin duda, es uno de los factores que facilita su presencia en animales de compañía13.
Algo similar sucede con los ancilostómidos, en los que la eclosión del huevo y desarrollo hasta forma infectante (larva 3) es más rápido durante los meses más cálidos y húmedos14. Otros factores como la longevidad de los parásitos en el hospedador, o su prolificidad, pueden favorecer la contaminación medioambiental y, por lo tanto, hacer más sencilla la infección de los carnívoros domésticos.
Un adulto de Toxocara canis puede eliminar al día 200.000 huevos, por lo que, si un perro de menos de 6 meses tuviese una intensidad de parasitación por este nematodo muy elevada, contaminaría con millones de huevos el medio ambiente en un día.
La supervivencia de los huevos de ascáridos, es muy elevada, debido a que poseen varias cubiertas que los protegen. De hecho, no solo resisten más que otras formas parásitas, sino que son capaces de resistir al uso de diferentes desinfectantes y altas temperaturas durante más de 12 meses13.
Destacando también, que algunos parásitos pueden utilizar más de una vía de infección para penetrar en el hospedador, como Toxocara canis, que puede infectar vía oral, transplacentaria, lactogénica, o utilizando hospedadores paraténicos en los que migran a distintos órganos y tejidos y permanecen viables durante largos periodos de tiempo15. Por lo que, se facilita el contacto parásito hospedador.
La posible falta de especificidad parasitaria favorecería que perros y gatos compartiesen parásitos, sin embargo, en el caso de los endoparásitos digestivos más frecuentes, la mayoría de ellos son especie específicos, exceptuando por ejemplo a D. caninum, que puede afectar a ambos carnívoros, aunque es más frecuente en gatos, donde se considera que el acicalamiento, favorece la ingestión de pulgas con cisticercoides.
Pautas de desparasitación internas y/o externas que influencian la presencia de endoparásitos digestivos
Para establecer protocolos adecuados de desparasitación la European Scientific Counsel Companion Animal Parasites (ESCCAP), ha generado unas guías con unas pautas en las que recomiendan tener en cuenta, algunos de los factores ya mencionados anteriormente en este artículo, como son la edad del animal, hábitat o alimentación por posible ingestión de hospedadores intermediarios y/o paraténicos16.
Sin embargo, las razones por las que los propietarios deciden o no desparasitar a sus animales, no son siempre las mismas, ya que, en unos casos, los propietarios desparasitan de forma preventiva, en otros cuando se detectan signos clínicos, otros para mantener la salud del animal y evitar zoonosis y en otros casos, simplemente porque el propietario considera que se debe desparasitar11.
Uno de los protocolos de desparasitación preventiva frente a endoparásitos y ectoparásitos más frecuentemente utilizado es cada tres meses y su finalidad, la prevención, aunque las consecuencias clínicas de parásitos como D. caninum o los ancilostómidos no se conocen en muchas de las encuestas que se realizan para conocer estos datos3.
Sin embargo, en algunos casos, la desparasitación se hace 4 veces al año, para disminuir el riesgo de zoonosis, como en el caso de T. canis. Aunque algunas investigaciones realizadas en ascáridos, aconsejan que estas pautas de desparasitación en animales mayores de 6 meses son, excesivas, por lo que debería recomendarse tratamientos selectivos, en los que se evidencia la presencia de parásitos con análisis laboratorial en vez de tratamientos a ciegas o intervalos definidos, en los que no se tiene en cuenta, si el animal sufre una infección patente, y más aún, si el animal está o no parasitado11.
El riesgo de infección, no es el mismo en todos los animales. Distintos factores epidemiológicos son los responsables de estas diferencias. ESCAPP establece 4 categorías. La categoría A en la que se recomienda desparasitación y examen fecal de una a dos veces al año. La categoría B con 4 tratamientos y exámenes fecales por año. Categoría C con 12 tratamientos por año frente cestodos y 4 frente nematodos con análisis fecales y la categoría D en la que se engloban animales que salen al exterior con o sin supervisión y que pueden ingerir carroña o heces de otros animales, en los que se recomienda desparasitar 12 veces al año.
En España el 96,12 % de los perros pertenecen al grupo D, mientras que la mayoría de los gatos, forman parte de la categoría A; 62 %1. En Alemania la situación difiere en perros, encontrándose un 62,4 % de ellos formando parte de la categoría D. Sin embargo, en gatos, la situación es similar y el 52,8 % está en la categoría A17. Y en un estudio realizado en Reino Unido, el porcentaje de perros en el grupo D es similar al español; 97 %. Pero los gatos que formaron parte del grupo D fueron el 68 %18.
Uno de los problemas fundamentales es que, las pautas de desparasitación que se siguen, no son las adecuadas en cada grupo de riesgo, siendo habitual, que se realicen menos desparasitaciones de las recomendadas. Sirva como ejemplo que en perros españoles que pertenecían a la categoría D, la pauta más habitual haciendo la media era 2,7 ± 2,21.
Observando los resultados obtenidos en distintos estudios, es evidente, que, la pauta de desparasitación, debe tener en cuenta, cuál es el riesgo de infección de los animales para tomar decisiones adecuadas por parte del veterinario. Y que el uso de protocolos a intervalos definidos, sin detectar qué endoparásitos están presentes, complica establecer protocolos de desparasitación correctos y, por lo tanto, dificulta disminuir las infecciones humanas, en el caso de agentes zoonósicos.
Igualmente, las pautas de desparasitación, deben tener en cuenta el o los principios activos utilizados, ya que, en muchos casos, los antiparasitarios internos habituales solo son nematocidas, y si no incluyen otro principio activo, como es el praziquantel, no serían efectivos frente cestodos. Además de que, el número de días que se tiene que administrar el tratamiento varía dependiendo del parásito, sus características biológicas y de la presencia o no de signos clínicos en el animal de compañía.
Si se tiene un cachorro con Toxocara canis tradicionalmente, se ha comenzado con la desparasitación a las 2 semanas de vida, sin embargo, la prevención de problemas clínicos por este ascárido debería centrarse en la prevención de la vía de transmisión vertical19.
Igualmente, como tratamiento antiparasitario eficaz frente a Toxocara canis, está demostrada la eficacia de benzimidazoles y pirantel frente ascáridos, así como combinaciones de febantel, pirantel y praziquantel. Sim embargo, el mecanismo de acción es distinto, por lo que, se debe tener en cuenta la intensidad de parasitación, a la hora de pautar un protocolo correcto antiparasitario20.
Sin olvidar, que la pauta de desparasitación externa, previene de la presencia de ectoparásitos y/o también endoparásitos. Por ejemplo, todos aquellos antiparasitarios externos, que sean efectivos frente a pulgas, disminuirán la presencia de D. caninum en ese medio ambiente. El uso de fluralaner tanto administración tópica como oral es eficaz en la prevención de la transmisión de D. caninum durante 12 semanas21. Aunque en la actualidad está demostrada la eficacia de distintas terapias para el control de pulgas como el uso de espinosad, fipronil con metopreno, piriproxifeno, lufenurón, imidacloprid con metopreno, afoxalaner, sarolaner o lotilaner22.
Técnicas de diagnóstico de endoparásitos digestivos y uso de la coprología
Para el diagnóstico de endoparásitos digestivos, existen distintas técnicas laboratoriales que pueden utilizarse; desde técnicas inmunológicas como el ELISA para detección de coproantígenos de Ancylostoma caninum y Toxocara canis en perros y Toxocara cati en gatos23 o técnicas moleculares, PCR para la detección entre otros de T. canis24.
Sin embargo, las técnicas coprológicas siguen siendo las de elección para el diagnóstico de endoparásitos digestivos, no solo porque su coste es mejor, sino por su rapidez y eficacia en la detección de infecciones patentes de estos parásitos.
Aunque, debe tenerse en cuenta, que si bien, el Telemann modificado10 es la técnica coprológica rutinaria para diagnóstico de estos agentes parasitarios, en el caso de sospechar de G. duodenalis se usará el MIF25 (mertiolato yodo formalina) y si la forma en heces del parásito es una larva, como en el caso de Angiostrongylus vasorum y Aelorostrongylus abstrusus, se utilizará el Baermann modificado o migración larvaria26.
La excreción fecal intermitente de algunos parásitos, como G, duodenalis, será responsable de que, se deban realizar coprológicos de muestras recogidas en días consecutivos, entre 3 y 5 días, y se denominará a este análisis coprológico seriado. Mientras que, en otros casos, con la recogida de una única muestra fecal y posterior análisis sería suficiente, recibiendo el nombre de análisis coprológico simple.
Por último, hay que destacar que no siempre que se detectan endoparásitos digestivos utilizando alguna de las técnicas coprológicas mencionadas, se ha producido la infección. De hecho, está demostrado que la coprofagia, puede permitir resultados coprológicos positivos. Cuando se detectan huevos no embrionados en heces, estos no implican infecciones patentes, simplemente implican que el animal ha ingerido heces parasitadas19.
Material y Metodos
El presente estudio se hizo entre octubre 2020 y abril 2021. Se creó una encuesta epidemiológica, centrada en factores relacionados con el hospedador, hábitat y protocolo de desparasitación seguido. Se recogieron muestras fecales, se recomendó en todos los casos recogida de 3 a 5 días consecutivos, pero se ofrecía la toma de una única muestra.
La encuesta epidemiológica se completó con un cuestionario online que se facilitó a los propietarios, preguntando sexo, edad, especie y raza de los animales. Además de preguntar por hábitat, tipo de alimentación, convivencia con más animales y lugar de residencia. Directamente enfocado a prevención y control de parásitos por pauta de desparasitación, así como principios activos utilizados. El estudio contó con13 gatos y 26 perros. Raza, sexo y edad de los animales se muestran en las Tablas 1 y Tabla 2.
| Tabla 1. Razas, rango de edad y sexo de los gatos del estudio. |
| Raza | Rango edad meses | Sexo Macho Hembra |
| Común Europeo | (5-144) | 6 4 |
| Charteux | 3 | 1 0 |
| Toyger | 24 | 0 1 |
| Siames | 96 | 0 1 |
| Tabla 2. Razas, rango de edad y sexo del estudio Sd = sin dato . |
| Raza | Total perros/raza | Rango edad meses | Sexo Macho Hembra |
| American Pitbull Terrier | 1 | Sd* | 0 1 |
| Braco de Weimar | 1 | 48 | 0 1 |
| Caniche toy | 1 | 156 | 0 1 |
| Galgo | 1 | 36 | 1 0 |
| Golden Retriever | 1 | 132 | 1 0 |
| Mastín | 1 | 72 | 0 1 |
| Mestizo | 9 | 48-120 | 5 4 |
| Parson Russel | 1 | 36 | 1 0 |
| Pastor Belga Malinois | 1 | 5 | 1 0 |
| Perro Lobo Checoslovaco | 2 | 36-48 | 1 1 |
| Podenco | 1 | 8 | 1 0 |
| Pomsky | 1 | 24 | 0 1 |
| Schnauzer mini | 1 | 144 | 1 0 |
| Spitz Aleman | 1 | 36 | 0 1 |
| Teckel de pelo duro | 2 | 168-192 | 1 1 |
| Yorkshire | 1 | 132 | 1 0 |
Técnicas coprológicas utilizadas
En todas las muestras hizo técnica coprológica rutinaria de Telemann modificado. Una migración larvaria y la técnica de elección para detección de Giardia duodenalis mertiolato iodo formalina (MIF).
Resultados
En el apartado del hábitat, los propietarios informaron que los animales permanecen muchas horas en el interior, destacando que, ante poder contestar interior o interior y exterior, en perros el 61,5 % (16/26) respondieron interior. En gatos el 69,2 % (9/139) también permanecían siempre en el interior (Tabla 3).
| Tabla 3. Hábitat interior/exterior o solo interior en perros y gatos. |
| Hábitat | Gato | Perro | Total |
| Interior/Exterior | 4 | 10 | 14 |
| Interior | 9 | 16 | 25 |
| Total | 13 | 26 | 39 |
Solo en el caso de un perro, el propietario reconoce hábitos de caza y en todos los casos la alimentación se basa en administración de piensos comerciales secos o mezcla de pienso húmedo y seco. Solo en 3 perros y en 2 gatos se administra ocasionalmente carne cruda. Se recogieron datos relacionados con la presencia de otros animales. De los 13 gatos, 11 convivían con otros animales y de los perros todos menos cuatro, convivían al menos con otra especie animal (Tabla 4).
| Tabla 4. Otros animales que convivían con perros y gatos del estudio . |
| Especie | Perro y gato | Perro | Gato y roedor | Gato | Conejo | Conejo y roedor | No otros animales |
| Gato | 7 | 2 | 1 | 1 | 0 | 0 | 2 |
| Perro | 6 | 10 | 1 | 3 | 1 | 1 | 4 |
Ninguno de los propietarios había detectado presencia de ectoparásitos. Al preguntar por desparasitación se realizaron preguntas para endoparásitos y ectoparásitos. Así como por la pauta de desparasitación y el motivo.
Todos los propietarios desparasitaban, sin embargo, el motivo de desparasitación no. El 51,3 % (20/39) de los propietarios realizaba una pauta de desparasitación preventiva y clínica, el 20,5 % (8/39) solo preventiva y el 28,2 % (11/39) solo desparasitaba en caso de existir signos clínicos. Tanto en perros (38,5 %; 10/26), como en gatos (76,9 %; 10/13), el mayor número de propietarios desparasitan como prevención y si hay clínica (Tabla 5).
| Tabla 5. Motivo de desparasitación en perros y gatos. |
| Motivo desparasitación | Perro | Gato | Total |
| Preventiva y clínica | 10 | 10 | 20 |
| Solo preventiva | 8 | 0 | 8 |
| Solo clínica | 8 | 3 | 1 |
| Total | 26 | 13 | 39 |
Tanto perros como gatos recibían pautas de desparasitación interna, exceptuando 11 animales que no eran desparasitados internamente si no se detectaba clínica. La pauta más extendida es la trimestral tanto en perros (50 %; 13/26), como en gatos (53,8 %; 7/13) (Tabla 6).
| Tabla 6. Pauta de desparasitación frente endoparásitos en perros y gatos . |
| Pauta desparasitación | No | Mensual | Trimestral | 1/2 año | Total |
| Gato | 3 | 0 | 7 | 3 | 13 |
| Perro | 8 | 1 | 13 | 4 | 26 |
| Total | 11 | 1 | 20 | 7 | 39 |
Además de utilizar diferentes protocolos antiparasitarios, los propietarios, no utilizaban los mismos principios activos frente a endo y ectoparásitos. El 34,6 % (9/26) de los propietarios de perros aplica una desparasitación frente endoparásitos, pero no conoce ni el producto comercial ni los principio/s activo/s mientras que esta situación se repite en el 23 % (3/13) de los propietarios de gatos (Tabla 7).
| Tabla 7. Principios activos antiparasitarios frente endoparásitos utilizados en perro y gato . |
| Principio/s activo/s utilizados como endectocidas | Gato | Perro | Total |
| Febantel pirantel emboato praziquantel | 2 | 0 | 2 |
| Febantel+pirantel+praziquantel | 0 | 1 | 1 |
| Fipronilo+S-methoprene+eprinomectina+praziquantel | 2 | 0 | 2 |
| Milbemicina oxima+praziquantel | 4 | 6 | 10 |
| No sabe | 3 | 9 | 12 |
| Pirantel+praziquantel | 1 | 6 | 7 |
| Praziquantel | 1 | 2 | 3 |
| Producto con ingredientes naturales | 0 | 2 | 2 |
| Total | 13 | 26 | 39 |
En cuanto a las desparasitaciones externas en dos casos no se respondió el apartado y un propietario no sabía ni principio activo ni marca comercial del antiparasitario. En perros, un propietario no aportó ningún dato y otro solo sabía que utilizaba collar. Los propietarios de un gato y 3 perros no utilizaban ninguna protección frente a ectoparásitos (Tabla 8).
| Tabla 8. Principios activos antiparasitarios frente ectoparásitos utilizados en perro y gato . |
| Prinipio/s activo/s utilizados como endectocidas | Gato | Perro | Total |
| ”Collar” | 1 | 1 | 2 |
| Deltametrina | 0 | 5 | 5 |
| Fipronil | 2 | 3 | 5 |
| Fipronil+S-methoprene+eprinomectina+praziquantel | 2 | 0 | 2 |
| Flumetrina+imidacloprid | 0 | 7 | 7 |
| Fluralaner | 2 | 0 | 2 |
| Imidacloprid+permetrina | 1 | 0 | 1 |
| No | 1 | 3 | 4 |
| ”Pipeta” | 0 | 5 | 5 |
| SD = sin dato | 2 | 1 | 3 |
| Fipronil+permetrina | 2 | 1 | 3 |
| Total general | 13 | 26 | 39 |
Al realizar las técnicas coprológicas descritas, se detectaron los siguientes parásitos, Giardia duodenalis en el 33,3 % (n=13) de los animales del estudio, en gatos fueron positivos el 12,8 % (n=5) y en perros el 20,51 % (n=8). Familia Ancylostomatidae en el 2,56 % de los perros (n=1) perro. Cystoisospora felis 2,56 % de los gatos (n=1) y Eimeria media 2,56 % de los perros (n=1).
Si se tiene en cuenta el número de muestras fecales que recoge el propietario para realizar el estudio, en gatos exceptuando en dos animales, el resto enviaron una única muestra, mientras en perro de los 26 animales, solo en 3 de ellos se adjuntaron muestras de días consecutivos (Tabla 9).
| Tabla 9. Número de coprológicos seriados o simples por especie animal. |
| Especie | Coprológico simple | Coprológico seriado | Total |
| Gato | 11 | 2 | 13 |
| Perro | 23 | 3 | 26 |
| Total | 34 | 5 | 39 |
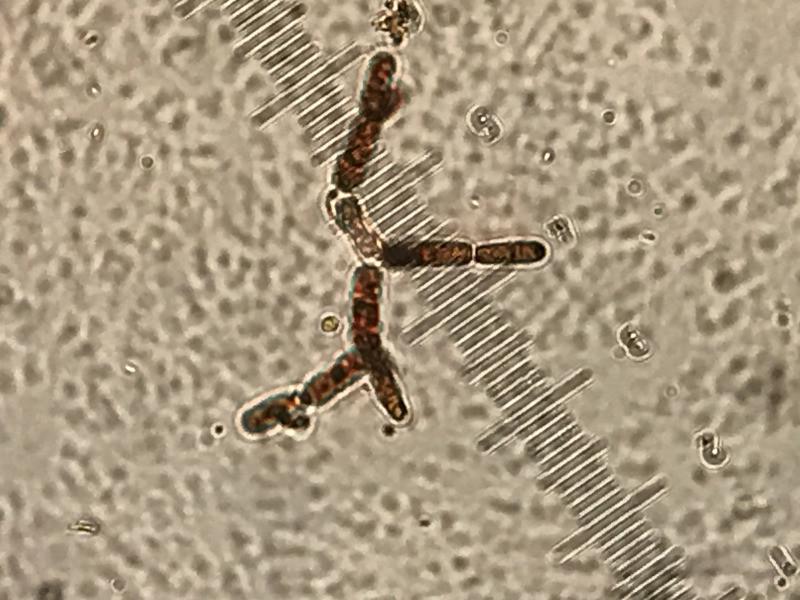
Se realizaron en todos los casos el Telemann modificado, el MIF y la migración larvaria. Todas las lecturas de sedimento fueron negativas, al igual que las migraciones larvarias. En el caso de la flotación simple se detectó un perro de 5 meses con E. media, parásito de conejos y un perro de 4 años con Ancilostómidos (Figura 2). Mientras que, solo un gato fue positivo con esta técnica, tenía 5 meses y estaba parasitado por Cystoisospora felis (Tabla 10).
| Tabla 10. Parásitos detectados por especie animal. |
| Parásitos detectados/especie animal | Cystoisospora felis | Ancilostómido | Eimeria media |
| Perro | 0 | 1 | 1 |
| Gato | 1 | 0 | 0 |
Los resultados obtenidos utilizando el MIF, 5 gatos fueron positivos a presencia de G. duodenalis y 8 perros. En 4 perros se detectó Cyniclomyces guttulatus asociado a la presencia de G. duodenalis y en un perro se detectó solo C. guttulatus (Figura 3; Tabla 11).
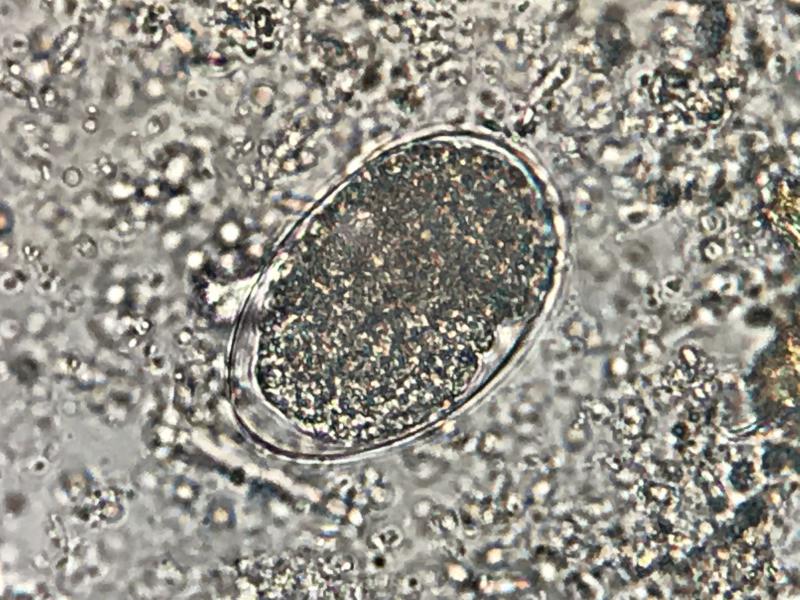
| Tabla 11. Tipo de coprológico y detección de G. duodenalis por especie animal. |
| Tipo coprológico | Perro | Gato |
| Normal | Perro | Gato |
| Seriado | 2 | 1 |
Por lo que, utilizando coprológico de una muestra y la técnica de MIF el 8,7 % de los perros fueron positivos a G. duodenalis, mientras que, el 66,6 % de los perros en los que se hizo coprológico seriado fueron positivos, si bien solo uno mostraba falta de consistencia en las heces. De los gatos positivos a G. duodenalis, el único caso en el que se hizo coprológico seriado presentaba clínica y en el resto de los casos que se hizo coprológico de una muestra, la mitad tenían clínica digestiva.
De forma global en este estudio 16 animales fuero positivos a endoparásitos digestivos. De los animales positivos a la presencia de parásitos están incluidos 10 perros y 6 gatos (Tabla 12). La detección de parásitos temiendo en cuenta el hábitat se muestra en la Tabla 13.
| Tabla 12. Número de perros y gatos con presencia o ausencia de parásitos en las heces. |
| Detección endoparásitos | Perro | Gato | Total | %Total |
| SI | 10 | 6 | 16 | 41% |
| NO | 16 | 7 | 23 | 59% |
| Total | 26 | 13 | 39 | 100% |
| Tabla 13. Parásitos identificados en perros y gatos que viven en interior solo o interior y exterior. |
| Parásitos encontrados | Perro Interior / Interior y exterior | Gato Interior / Interior y exterior | Total |
| Giardia duodenalis | 3 5 | 2 3 | 13 |
| Familia Ancylostomatidae | 1 0 | 0 0 | 1 |
| Cystoisospora felis | 0 0 | 1 0 | 1 |
| Eimeria media | 0 1 | 0 0 | 1 |
| Total | 4 6 | 3 3 | 16 |
Discusión
La presencia de animales de compañía y otros animales considerados exóticos, es una realidad cada vez mayor en los hogares europeos1. Hecho que se confirma en el presente estudio en el que el 84,6 % de los hogares con perro y el 84,6 % de los que tenían gato, contaban al menos con otra mascota.
Mantener la salud de los animales de compañía es esencial para los humanos, ya que los animales pueden infectarse con distintos agentes infectocontagiosos, como son los parásitos y en los casos de que tengan potencial zoonósico, afectar también a sus propietarios3.
Sin embargo, no solo porque los humanos que conviven con sus mascotas puedan parasitarse, sino debido también al poder patógeno de los parásitos, es esencial la detección de endoparásitos digestivos, para poder establecer protocolos de desparasitación adecuados a cada caso.
De hecho, los endoparásitos digestivos en carnívoros presentan distribución cosmopolita6, pero su incidencia depende de distintos factores epidemiológicos relacionados con el hospedador, el medio ambiente y los propios parásitos detectados. Además, se debe tener en cuenta, si el animal presenta o no signos clínicos y qué técnicas se utilizan para su diagnóstico27.
En el presente estudio, utilizando técnicas coprológicas, el 41 % de los animales de compañía fueron positivos a presencia de endoparásitos digestivos en periodo patente; el 38,5 % de los perros y el 46,1 % de los gatos.
El endoparásito más detectado fue Giardia duodenalis en el 33,3 %. Este porcentaje es similar a otros estudios realizados en España con datos del 36,5 %27, 35,4 %28 o 29 %29. Cystoisospora felis se detectó en el 2,56 % de los gatos, siendo esta incidencia más baja que la detectada en otros estudios27. Esta baja detección de Cystoisospora puede ser asociada a la edad de los gatos, ya que solo dos animales eran menores de un año y la presencia de este protista está en animales jóvenes12.
Un perro fue positivo a la presencia de familia Ancylostomatidae 2,56 %, siendo esta incidencia menor a la que se analiza en otros estudios con valores de 27 %29 o hasta del 35,6 %10. Esta baja incidencia podría deberse a que el 55,5 % de los propietarios utilizaban pautas de desparasitación frente a nematodos bien de forma preventiva o clínica.
La detección de Eimeria media en un perro, supone la detección de un parásito espurio o en tránsito. Indica coprofagia por parte del animal por lo que, se destaca la importancia de la identificación adecuada de las formas parásitas encontradas en las heces, ya que, no siempre que se detectan parásitos, es necesario ejercer un tratamiento antiparasitario. Como sucede si se encuentran huevos no embrionados, que en ningún caso implicaban infecciones patentes sino, hábitos coprófagos del hospedador19.
El medio ambiente, es fundamental para poder facilitar o dificultar la infección. Aunque existen varias vías de infección, la más frecuente es la oral, por lo que, el contacto con el exterior facilitará el posible contacto de formas infectantes con los animales10. En este estudio, se detectaron más perros con endoparásitos digestivos que permanecían más tiempo en el exterior, mientras en gatos la cantidad de animales positivos, fue la misma independientemente del hábitat, en interior o en interior y exterior.
No se han detectado endoparásitos digestivos muy frecuentes como Trichuris vulpis, Toxocara, Toxascaris leonina o cestodos con D. caninum o Taeniidae9,10. Como posibles causas, entre otras, el escaso número de animales. La edad, podría explicar la ausencia de Toxocara o Toxascaris leonina, ya que son parásitos que afectan más a animales jóvenes11.
Para que los cestodos completen su ciclo biológico, necesitan que exista contacto entre hospedador intermediario y definitivo, por lo que, en aquellos animales que permanecen más tiempo en el interior, se reduce la posibilidad de infección. De hecho, cabe recordar que ESCAPP establece 4 categorías para agrupar a los animales, dependiendo del riesgo de infección y que en España el 96,21 % de los perros se engloban en el grupo de mayor riesgo, lo que supone que la mayoría de estos animales permanecen en el exterior sin supervisión o con ella, pero que tienen contacto directo con otros perros y gatos y que pueden ingerir carroña o heces30. Por lo que, cabría esperar un mayor número de perros parasitados, del número detectado en el estudio, si bien se debe tener en cuenta, además, la pauta de desparasitación seguida por los propietarios.
La presencia de más animales en un hogar, puede facilitar la infección de las especies. Podría ser el caso de G. duodenalis, que afecta a perros y gatos, sin embargo, aunque la especie parásita es la misma, no lo son los genotipos. En perros es más frecuente encontrar el genotipo A y D, mientras que en los gatos es más frecuente detectar los genotipos A y F por lo que si existe especificidad31.
Sin olvidar, que siempre existe la posibilidad de detectar parásitos en tránsito debido a hábitos coprófagos del animal de compañía, como sucedió en este caso en un perro que convivía con un conejo, en el que se detectaron ooquistes sin esporular de Eimeria media.
Analizando los resultados obtenidos en el estudio teniendo en cuenta las pautas de desparasitación seguidas por los propietarios, el 50 % de los perros recibían una pauta de desparasitación trimestral, el 11,5 % anual, 3,8 % semestral, el 3,8 % mensual, existiendo un 30,9 % de los propietarios que no contestaron a esta pregunta.
En el caso de las pautas de desparasitación seguidas en gatos el 53,9 % desparasitaban trimestral, 23,1 % semestralmente y el 23 % no contestaron.
La pauta de desparasitación más utilizada en las dos especies animales del estudio fue la trimestral, siguiendo una de las recomendaciones de las guías ESCAPP de desparasitar 4 veces al año, aunque para decidir este protocolo, no se tuvieron en cuenta las recomendaciones de establecer el riesgo de infección30.
Sin embargo, el dato más importante sería tener en cuenta el porcentaje de propietarios que no contestaron a la pregunta, ya que implica o bien falta de conocimiento o que no tienen establecido ningún protocolo antiparasitario en sus animales, por lo que debería estudiarse cuáles son los motivos por los que los propietarios desconocen la importancia de la desparasitación, ya que, en animales de compañía, a diferencia de otras especies animales, su contacto estrecho con los humanos y la posibilidad de que estén infectados con agentes zoonósicos, hacen imprescindible la desparasitación preventiva.
De hecho, en esta investigación, se preguntó a los propietarios por los motivos de la desparasitación, detectando que el 36,5 % de los propietarios de perros y el 76,9 % de los de gatos realizaban desparasitación o bien preventiva o clínica y solo el 22,2 % de los propietarios de perros y ningún propietario de gatos tenía en cuenta en su decisión la desparasitación preventiva.
Una vez establecido que no todos los propietarios desparasitan buscando los mismos objetivos y que, de hecho, no se sigue una pauta de desparasitación uniforme, o se tiene en cuenta el riesgo de infección, se debe analizar qué principios activos son los más utilizados para desparasitar.
Si se tiene en cuenta los principios activos endectocidas, no se sigue una pauta uniforme, aunque, sin saberlo, la mayoría utilizan combinaciones de los mismos principios activos, solo cambia la marca comercial. Entre los propietarios de perros el 25 % no sabe qué antiparasitario utiliza y entre los que lo saben, la milbemicina oxima con praziquantel 23 % o pirantel con praziquantel 23 % son las combinaciones más utilizadas. Por lo que, estarían desparasitando frente nematodos y cestodos, aunque la pauta trimestral, sería en casos de riesgo alto de infección insuficiente30.
Al analizar la situación en gatos, el 23 % tampoco conoce qué antiparasitario utiliza y la milbemicina oxima con praziquantel, es, de nuevo, la combinación más utilizada por los propietarios de esta especie animal (30,8 %).
En cuanto a la pauta de desparasitación frente ectoparásitos, la situación es aún más confusa, ya que en algunos casos los propietarios confundían principios activos endectocidas con antiparasitarios externos, de los propietarios de perros el 3,8 % (n=1) no respondió a la pregunta y entre los propietarios de gato no lo hicieron el 15,4 % (n=2), lo que muestra, confusión y falta de información entre los propietarios.
En un pequeño porcentaje del total de propietarios de animales 5,1 % solo respondieron que utilizaban collar antiparasitario, el 13,8 % que utilizaban pipetas y el 10,3 % de los propietarios no utilizaban ningún tipo de protección en sus mascotas frente ectoparásitos.
Distintas formulaciones de fipronil con otros principios activos o solo fipronil, fueron las más utilizadas en gatos 46,2 % (n=6), mientras que en perros la combinación de flumetrina con imidacloprid 27 % (n=7), seguida de deltametrina 19,2 % (n=5) fue lo más utilizado en esta protección externa.
Por lo que, si se analiza qué actividad tienen los antiparasitarios externos utilizados por la mayoría de los propietarios de animales de compañía, garrapatas y pulgas serían los ectoparásitos que más preocupan.
Sin olvidar que, otros artrópodos como los flebotominos podrían transmitir protistas muy frecuentes en algunas áreas geográficas y que el fipronil no tiene ninguna eficacia frente a ellos, mientras que la deltametrina sí impediría la alimentación de los flebotominos32.
Como se ha desarrollado a lo largo del artículo, factores relacionados con la especie animal, su edad, el hábitat, la convivencia con otros animales o las pautas de desparasitación, van a ser responsables de un mayor o menor contacto con endoparásitos digestivos.
Sin embargo, no debe olvidarse, que, independientemente del riesgo de infección de los animales de compañía, deben utilizarse técnicas coprológicas para conocer si las estrategias de control antiparasitario están siendo efectivas o no.
Aunque existen más técnicas que las coprológicas para la detección de estos parásitos, siguen siendo las más utilizadas actualmente. Pero no debe tenerse en cuenta, cuántas muestras sería recomendable recoger y qué técnicas coprológicas utilizar.
De forma habitual, los propietarios recogen una única muestra, en lugar de realizar coprológicos seriados cuya mayor sensibilidad está demostrada. De hecho, en este estudio el 33,3 % de los propietarios solo recogieron varias muestras. El 11,5 % de los propietarios de perros y el 15,4 % de los propietarios de gatos, recogieron entre 3 y 5 muestras para su análisis, por lo que la detección de algunos endoparásitos con excreciones intermitentes como Giardia duodenalis, pueden no ser detectados33.
Para la detección de endoparásitos digestivos por coprología, no siempre es la técnica coprológica rutinaria o Telemann modificado10, la de elección. En el caso de buscar larvas, se utilizaría la migración larvaria26, y para la detección de Giardia duodenalis el MIF25. Por lo que, para la detección de endoparásitos digestivos, deberían tenerse en cuenta otros factores epidemiológicos, así como la posible presencia de signos clínicos que ayudará en la toma de decisiones correcta eligiendo las técnicas coprológicas necesarias en cada caso. Sin olvidar que, la presencia de Giardia duodenalis, es muy frecuente en animales de compañía y que, tal vez, los análisis coprológicos realizados para establecer el riesgo de infección deberían incluirla.
Sin descartar, que, aunque en la detección de nematodos broncopulmonares hay técnicas más sensibles que la migración larvaria, sería aconsejable hacer esta técnica, para poder establecer un control selectivo mucho más adecuado, y ampliar el conocimiento epidemiológico de los endoparásitos digestivos que afectan a animales de compañía.
Bibliografía
- Miró G, Gálvez R, Montoya A, Delgado B, Drake J. Survey of Spanish pet owners about endoparasite infection risk and deworming frequencies. Parasites & Vectors. 2020;13(1).
- Hussein SM, Solima WS, Khalifa AA. Benefits of pets’ ownership, a review based on health perspectives. J Intern Med Emerg Res. 2021;2(1):1-9.
- Pereira A, Martins Â, Brancal, Vilhena H, Silva P, Pimenta P. Diz-Lopes D, Neves N, Coimbra M, Alves AC, Cardoso L, Maia C. Parasitic zoonoses associated with dogs and cats: a survey of Portuguese pet owners’ awareness and deworming practices. Parasites Vectors 2016:9, 245.
- La Torre F, Di Cesare A, Simonato G, Cassini R, Traversa D, Frangipane di Regalbono A. Prevalence of zoonotic helminths in Italian house dogs.J Infect Dev Ctries 2018:12:666-672.
- Rabbani IA, Mareta FJ, Kusnoto, et al. Zoonotic and other gastrointestinal parasites in cats in Lumajang, East Java, Indonesia. Infect Dis Rep. 2020;12(Suppl 1):8747.
- Scaramozzino P, Carvelli A, Iacoponi F, De Liberato C. Endoparasites in household and shelter dogs from Central Italy. International Journal of Veterinary Science and Medicine. 2018;6(1):45-47.
- Barutzki D, Schaper R. Results of Parasitological Examinations of Faecal Samples from Cats and Dogs in Germany between 2003 and 2010. Parasitology Research. 2011;109(S1):45-60.
- Beugnet F, Bourdeau P, Chalvet-Monfray K, Cozma V, Farkas R, Guillot J et al. Parasites of domestic owned cats in Europe: co-infestations and risk factors. Parasites & Vectors. 2014;7(1):291.
- Montoya A, García M, Gálvez R, Checa R, Marino V, Sarquis J, Barrera JP, Rupérez C, Caballero L, Chicharro C. Cruz I, Miró G. Implications of zoonotic and vector-borne parasites to free-roaming cats in central Spain. Vet Parasitol, 2018;251 :125-130.
- Regidor-Cerrillo, Arranz-Solís D, Moreno-Gonzalo J, Pedraza-Díaz S, Gómez Bautista M, Ortega-Mora LM, Collantes-Fernández E. Prevalence of intestinal parasite infections in stray and farm dogs from Spain. Rev Bras Parasitol.2020 29(3).
- Nijsse R, Mughini-Gras L, Wagenaar JA, Ploeger HW. Recurrent patent infections with Toxocara canis in household dogs older than six months: a prospective study. Parasites Vectors. 2016: 9, 531.
- Gates MC, Nolan TJ. Endoparasite prevalence and recurrence across different age groups of dogs and cats. Vet Parasitol. 2009:166(1-2):153-158.
- Azam D, Ukpai OM, Said A, Abb-Allah GA, Rene Morgan E. Temperature and the development and surival of infective Toxocara canis larvae. Parasitol Res :2011.
- Raza A, Rand J, Ghaffar Qamar A, Jabbar A, Kopp S. Gastrointestinal parasites in shelter dogs : occurrence, pathology, treatment and risk to shelter workers.Animals.2021:(8):108.
- Schnieder T, Laabs EM and Welz C. Larval development of Toxocara canis in dogs. Vet Parasitol.2011 175(3-4), 193–206.
- Worm control in dogs and cats. ESCAPP guideline 01 In: Esccap España.2020. https://www.esccap.es/wp-content/uploads/2020/10/guia1_2020.pdf.
- Strube C, Neubert A, Sringer A, von Samson-Himmelstjerna. Survey of German pet owners quantifying endoparasitic infection risk and implications for deworming recommendations. Parasites Vectors.2019 :12;203.
- Pennelegion C, Drake J, Wiseman S, Wright I. Survey of UK pet owners quantifying internal parasite infection risk and deworming recommendation implications. Parasites Vectors.2020.13 ;218.
- Nijsse R, Ploeger HW, Wagenaar JA. Toxocara canis in house dogs: prevalence, risk factors and owners´ attitude towards deworming. Parasitol Res, 2015:114:561-569.
- Miró G, Mateo M, Montoya A, Vela E, Calonge R. Survey of intestinal parasites in stray dogs in the Madrid area and comparison of the efficacy of three anthelmintics in naturally infected dogs. Parasitol Res 2007.100, 317–320.
- Gopinath D, Meyer L, Smith J, Armstrong R. Topical or oral fluralaner efficacy against flea (Ctenocephalides felis) transmission of Dipylidium caninum infection to dogs. Parasit Vectors. 2018 :11(1):557.
- Rust MK. Recent Advancements in the Control of Cat Fleas. Insects. 2020;11(10):668.
- Elsemore DA, Geng J, Cote J, Hanna R, Lucio-Forster A, Bowman DD. Enzyme-linked immunosorbent assays for coproantigen detection of Ancylostoma caninum and Toxocara canis in dogs and Toxocara cati in cats. J Vet Diagn Invest. 2017 :29(5):645-653.
- Öge H, Öge S, Özbakiş-Beceriklisoy G. Detection and Identification of Toxocara Canis in Infected Dogs Using PCR. Helminthologia. 2019:1;56(2):118-123.
- Allen AV, Ridley DS. Further observations on the formol-ether concentration technique for faecal parasites. J Clin Pathol.1970: 23, 545–546.
- Baermann G. A simple method for the detection of Ankylostomum (nematode) larvae in soil tests. In: Baermann G, editor. Mededelingen uit het Geneeskundig Laboratorium te Weltevreden. Batavia: Javasche Boekhandel & Drukkerij; 1917. p. 41–7.
- Ursache A, Györke, A, Mircean V, Dumitrache M, Codea A, Cozma V. Toxocara cati and Other Parasitic Enteropathogens: More Commonly Found in Owned Cats with Gastrointestinal Signs Than in Clinically Healthy Ones. Pathogens.2021: 10(2):198.
- Adell-Aledón M, Köster P, de Lucio A, Puente P, Hernández-de-Mingo M, Sánchez-Thevenet P, Dea-Ayuela, M, Carmena D. Occurrence and molecular epidemiology of Giardia duodenalis infection in dog populations in eastern Spain. BMC Vet Res. 2018.14(1).
- Sanchez-Thevenet P, Carmena D, Adell-Aledón M, Dacal E, Arias E, Saugar J, Rodríguez E, Dea-Ayuela, M. High Prevalence and Diversity of Zoonotic and Other Intestinal Parasites in Dogs from Eastern Spain. Vector Borne and Zoonotic Dis.2019. 19(12), pp.915-922
- Strube C, Neubert A, Springer A, von Samson-Himmelstjerna G. Survey of German pet owners quantifying endoparasitic infection risk and implications for deworming recommendations. Parasites Vectors. 2019;12:203.
- Piekara-Stępińska A, Piekarska J, Gorczykowski M, Bania J. Genotypes of Giardia duodenalis in Household Dogs and Cats from Poland. Acta Parasitol. 2021 Jun;66(2):428-435.
- Paulin S, Frénais R, Thomas E, Baldwin PM. Laboratory assessment of the anti-feeding effect for up to 12 months of a slow release deltamethrin collar (Scalibor®) against the sand fly Phlebotomus perniciosus in dogs. Parasites Vectors.2018.11, 529.
- Fernandez de Mendoca Uchoa F, Pittela Sudré A, Destri Emmerick Campos S, Pereira Almosny NR. Assement of the diagnostic performance of four methods for the detection of Giardia duodenalis in fecal samples from human, canine and feline carries. Vet Parasitol. 2018,145 :73-78.
 by Multimédica
by Multimédica