Sarcomas asociados al punto de inyección: presentación de un caso clínico, utilidad de la histopatología y conocimiento actual
Resumen breve
Los sarcomas asociados al punto de inyección (SAPIs) son neoplasias malignas subcutáneas de los gatos. En este caso se presenta el caso de una gata de 3 años de edad con una gran masa ulcerada en la región interescapular que se abordó mediante resección quirúrgica de márgenes amplios.Índice de contenidos

Resumen
Los sarcomas asociados al punto de inyección (SAPIs) son neoplasias malignas subcutáneas de los gatos. Aunque se desconoce la patogénesis exacta, se sabe que se originan tras inyecciones de vacunas u otros fármacos. En este caso se presenta el caso de una gata de 3 años de edad con una gran masa ulcerada en la región interescapular que se abordó mediante resección quirúrgica de márgenes amplios. El análisis histopatológico confirmó que se trataba de un sarcoma con cierta diferenciación a fibrosarcoma con márgenes limpios. Teniendo en cuenta este hallazgo junco con la historia y la presentación clínica, se diagnosticó como un SAPI. No existen estudios que permitan una gradación histológica, pero si se relaciona un peor pronóstico con un alto contaje mitótico (superior a 20 figuras 2.37 mm2) y un tamaño grande de la masa (más de 3.75 cm de diámetro), dos condiciones que se cumplían en este caso. Sin embargo, en una segunda resección no se observaron células neoplásicas. El tratamiento de elección es la resección quirúrgica completa con márgenes amplios (> 3 cm) para el estudio histopatológico junto con radioterapia cuando sea posible. También se están desarrollando nuevas terapias, siendo las inmunoterapias las que están demostrando resultados más prometedores. Las recomendaciones para la prevención de los SAPIs enfatizan realizar las inyecciones en localizaciones alternativas, como las extremidades, y disminuir el número de vacunas a las necesarias.
Introducción
La vacunación es una de las medidas más efectivas para la prevención de enfermedades infecciosas. En gatos es frecuente la vacunación frente a enfermedades comunes como la panleucopenia, la rinotraqueitis, o la leucemia felina1. Sin embargo, como ocurre con cualquier tratamiento, pueden darse efectos adversos originados por la vacunación2. La reacción adversa más grave tras la vacunación en gatos es la aparición de sarcomas invasivos, denominados comúnmente como sarcomas asociados al punto de inyección (SAPIs). Esta reacción no se limita a las vacunas, sino que cualquier tipo de fármaco tanto subcutáneo como intramuscular puede originarlos3. La correlación entre estos sarcomas y las inyecciones se describió ya a principios de los años 904. Aunque aún se desconoce la patogénesis con detalle, se considera que las reacciones inflamatorias crónicas son el desencadenante.
La aparición de SAPIs puede originarse entre los 4 meses y hasta 3 años después de la inyección. La edad media de presentación son los 10 años, con una mayor incidencia entre los 6 y 11 años de edad y no existe una predilección por sexo o raza5. La incidencia es difícil de determinar, pero se estima que aparecen en entre uno y cuatro gatos por cada 10000 gatos vacunados2,6. Aunque la mayoría son fibrosarcomas, existen diversos tipos de sarcomas que se pueden originar tras la inyección, todos ellos con características invasivas7. El comportamiento de estos sarcomas es distinto al de los originados de manera espontánea, ya que aparecen en animales más jóvenes, presentan más inflamación8 y un comportamiento más agresivo con más probabilidad de recidiva9.
La localización más típica es en el espacio interescapular o la extremidad anterior, en función del lugar de inyección, aunque también se encuentran en cuello dorsal, tórax dorsolateral y zona lumbar dorsal. Las masas tumorales tienen un tamaño variable y pueden llegar a medir varios centímetros de diámetro en función del tiempo pasado hasta la visita al veterinario10. Se presentan como masas firmes, mal delimitadas y con frecuencia multilobuladas en el tejido subcutáneo o músculo esquelético. Con frecuencia presentan una cavidad central llena de líquido claro mucinoso o acuoso y la alopecia y ulceración son comunes11. Los SAPIs presentan una alta tasa de recidiva, requiriendo hasta 3 resecciones quirúrgicas en 1 o 2 años y la mayoría de los gatos pueden acabar siendo eutanasiados. Las metástasis, aunque poco frecuentes, son más probables con tiempos de supervivencia más elevados y se dan en nódulos linfáticos regionales, mediastino y pulmones10,12.
Caso clínico
En octubre de 2024 se presenta en consulta al Hospital Clínico Veterinario CEU (Alfara del Patriarca, Valencia) una gata de raza Común europeo de 3 años de edad, esterilizada y sin acceso al exterior ni contacto con otros animales. No presenta historia de enfermedades previas fue vacunada de rabia en 2022 y marzo de 2024. El motivo de consulta es la aparición de una masa en la zona interescapular, de crecimiento rápido en los últimos dos meses, alcanzando aproximadamente los 7 cm de diámetro. La masa está ulcerada y presenta prurito (Figura 1).
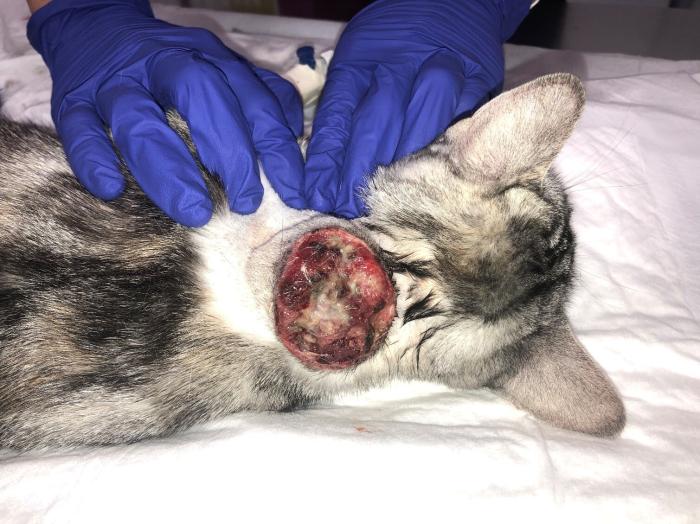
Figura 1. Aspecto de la masa en su primera presentación en el Hospital Clínico Veterinario CEU-UCH. Se observó una masa en la zona interescapular de 7 cm de diámetro, marcadamente ulcerada (imagen cedida por Isabel Juste Vidal, veterinaria del servicio de Medicina Interna del Hospital Clínico Veterinario CEU).
La analítica sanguínea revela un perfil bioquímico normal y un hemograma con leve neutrofília. Tras sedación con dexametasona (12 μg/kg) y metadona (0.3 mg/kg) se realiza una punción de aguja fina en la que se observan hallazgos compatibles con un sarcoma por punto de inyección. En la tomografía computarizada (TC) se caracteriza como una masa cavitaria, ulcerada de 5 cm de ancho, 4.5 de largo y 3.8 de alto lateralizada a la izquierda en la zona dorsal cervical con marcado realce periférico e infiltración de los músculos ventrales (Figura 2A-B).
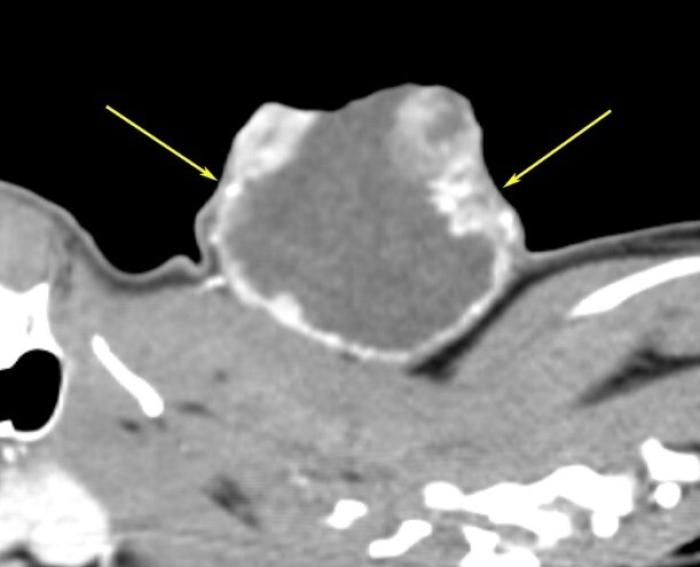
Figura 2. Imágenes de tomografía computarizada de la masa cervical: corte (A) transversal y (B) longitudinal. La masa se localiza en la parte dorsal del cuello, tiene marcado realce periférico (flechas amarillas) y se compone mayoritariamente de una parte cavitaria y una pequeña parte de tejido. En su aspecto ventral, a la altura de C3-C4 (parte media de la masa), por el lado derecho, se desdibuja la pared y los bordes de la masa se observan difusos afectando a los músculos ventrales (flecha azul) (imágenes cedidas por el servicio de diagnóstico por imagen del Hospital Clínico Veterinario CEU).
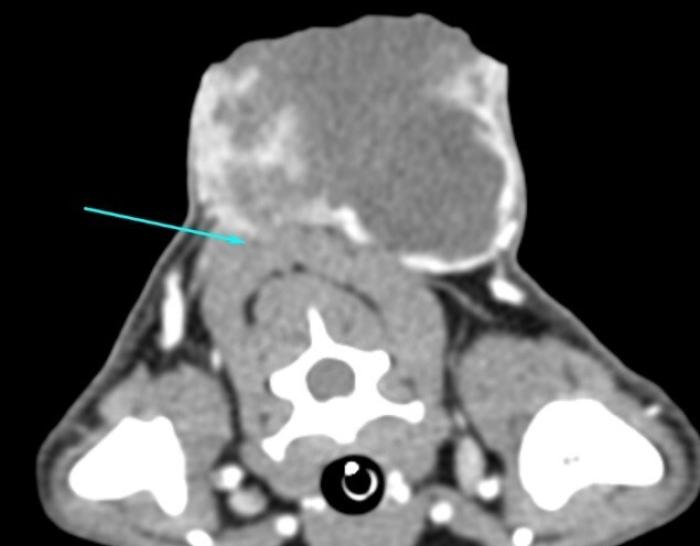
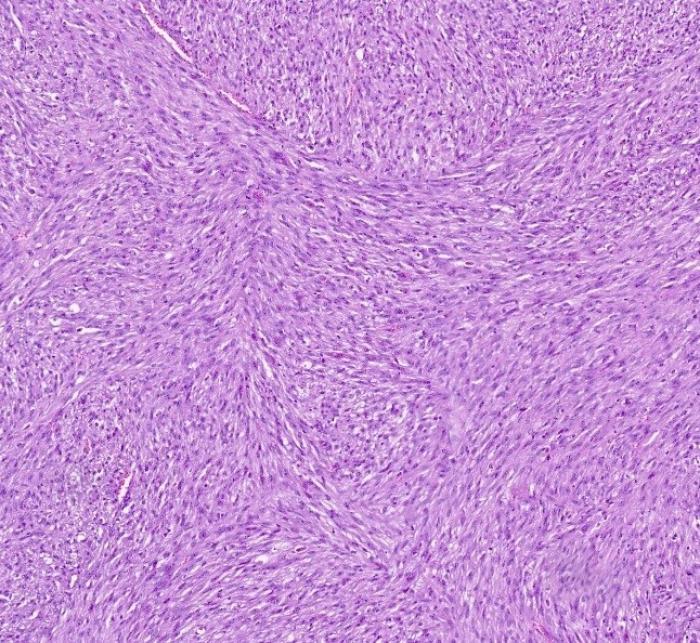
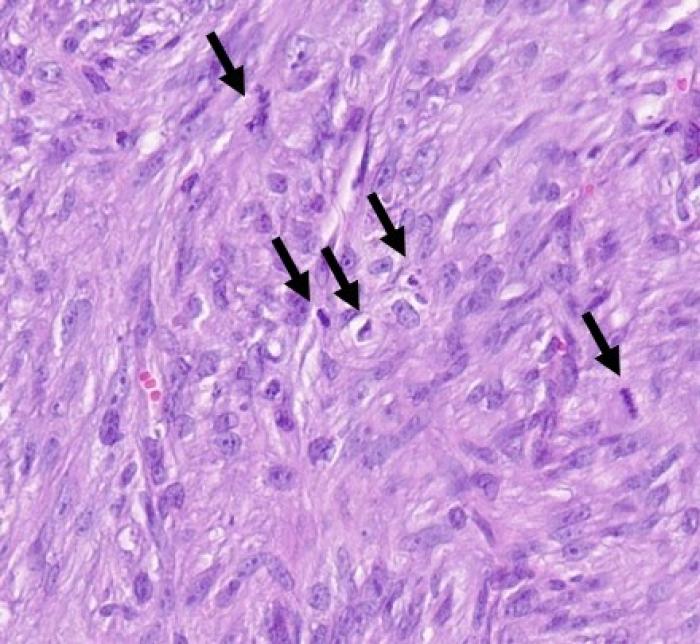
También se observa un aumento de tamaño del nódulo linfático cervical superficial dorsal derecho. Se informa al tutor que consiente la realización de una escisión de la masa con amplios márgenes de resección, pero en el momento de la cirugía el animal se presenta apático y con un hematocrito del 20.1 %. La masa ha crecido de tamaño, aumentando la superficie de ulceración que presenta mucha inflamación y secreción purulenta. Se opta por realizar un desbridamiento quirúrgico del tejido necrótico y hospitalizar al animal hasta controlar la infección secundaria. A los cuatro días se decide intervenir con una transfusión sanguínea perioperatoria. Se realiza una escisión de la masa tumoral, dejando 2 cm de márgenes alrededor del tumor. Se disecciona el tejido subcutáneo, fascia y musculatura dorsal del cuello (músculo cleidocefálico) y se secciona el plano muscular, dejando margen macroscópico evidente libre de tumor. Se remite la masa fijada con formol al 10 % para su estudio histopatológico. En el examen macroscópico se identifica una biopsia de piel de 7 cm de diámetro con una masa ulcerada central 4 x 4 cm. Se procede al tallado y procesado de la muestra. En el examen histológico se observa una masa neoplásica no encapsulada pero bien delimitada moderadamente celular que expande la dermis (Figura 3A). La neoplasia está formada por células fusiformes que crecen formando haces (Figura 3B). Las células tienen bordes mal diferenciados, moderada cantidad de citoplasma eosinófilo pálido, con un núcleo alargado y cromatina dispersa. La anisocitosis y anisocariosis son leves y se observan 31 mitosis en 10 campos a 400x (2.37 mm2) (Figura 3C). En los bordes de la masa y en las zonas de tejido cutáneo adyacentes a ella, se observan extensas zonas de ulceración, con pérdida de epitelio, material necrótico e inflamación neutrofílica y linfocítica. De manera multifocal se observan áreas de extensa necrosis lítica y pequeños focos donde las células neoplásicas crecen sobre estroma mixoide laxo.
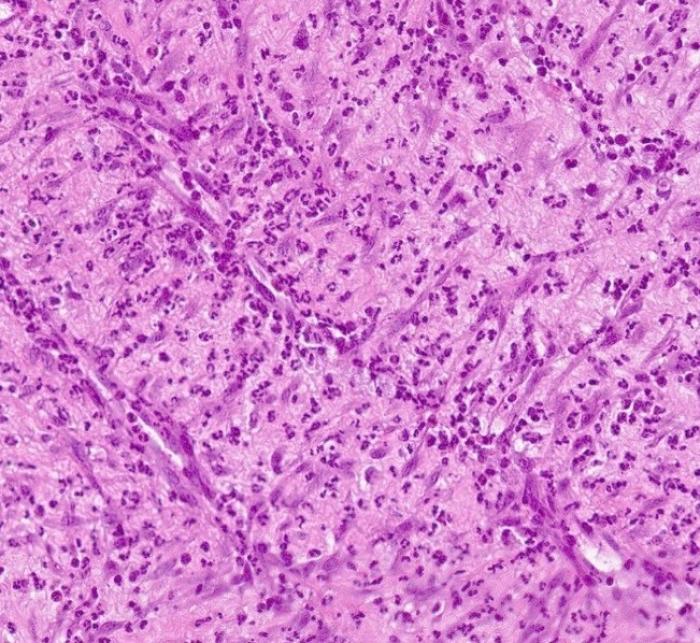
Teniendo en cuenta estos hallazgos histológicos se confirmó que se trataba de un sarcoma con moderada diferenciación a fibrosarcoma. En conjunción con la historia y los estudios clínicos se determinó que se trataba de un sarcoma asociado al punto de inyección. Tras pasar dos días en hospitalización para estabilizar al gato, se le da el alta por buena evolución de la herida quirúrgica y mantener las constantes dentro de rangos normales. A las dos semanas la herida parece haber cicatrizado por completo, pero una semana después se observa dehiscencia de las suturas con algún tramo de tejido necrótico, por lo que se toman nuevas muestras para su estudio histopatológico. En la nueva biopsia tan solo se observa inflamación grave con abundantes neutrófilos y ocasionalmente linfocitos, con proliferación de fibroblastos y vasos sanguíneos formando tejido de granulación maduro (Figura 3D). Sin embargo, no se observan células neoplásicas. Se continúan las curas normales y cuatro semanas después recibe el alta por cicatrización completa.
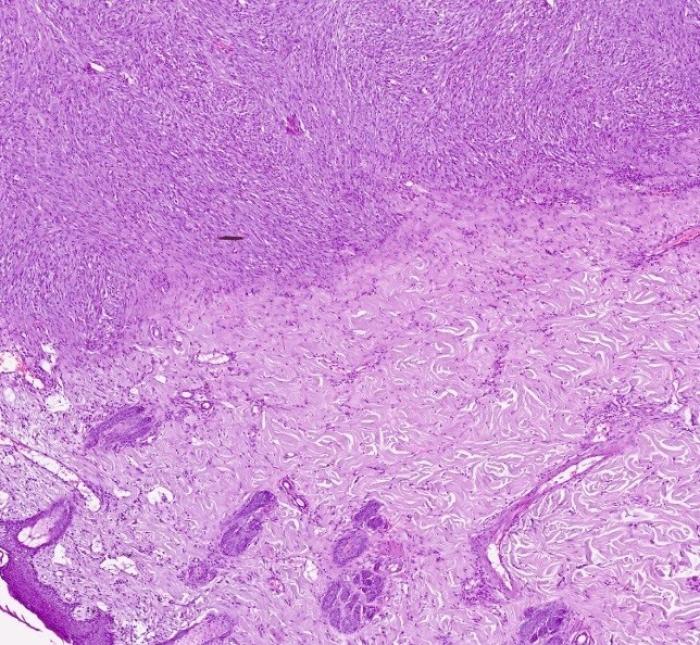
Figura 3. Imágenes histológicas del sarcoma asociado al punto de inyección. (A) Neoplasia expandiendo la dermis profunda y media. H-E. (B) La neoplasia está compuesta células fusiformes formando haces irregulares y parcialmente entrelazados. (C) Las células presentan leve anisocitosis y anisocariosis, pero abundantes figuras mitóticas (flechas). H-E. (D) En la segunda biopsia se observan numerosos neutrófilos, fibroblastos activados y vasos sanguíneos de nueva formación (tejido de granulación maduro) sin células neoplásicas. H-E.
Discusión
Desde su primera descripción en el año 19914, los SAPIs han causado preocupación entre los veterinarios al tratarse de neoplasias especialmente agresivas. De hecho, se han convertido en los sarcomas diagnosticados con más frecuencia en gatos10 e incluso se ha sugerido que la mayoría de tipos de sarcomas subcutáneos, como el condrosarcoma, son en realidad SAPIs13.
La identificación histológica es clave en el proceso diagnóstico de los SAPIs. Sin embargo, la identificación final como SAPI se debe realizar en conjunción con la historia clínica y la localización de la masa. La principal presentación de estos sarcomas es en la forma de fibrosarcoma, pero también se pueden presentar como mixosarcomas, osteosarcomas, histiocitomas fibrosos malignos, condrosarcomas y rabdomiosarcomas o incluso diversos tipos pueden coexistir en la misma masa11. La distinción entre un fibrosarcoma y solo inflamación puede ser complicada, ya que los fibroblastos activados en el tejido de granulación pueden compartir características morfológicas con las células neoplásicas. Independientemente de su tipo celular, los SAPIs se presentan en forma de una masa circular con una cápsula fibrosa parcial, pero con infiltración de células neoplásicas a lo largo de las fascias circundantes hacia la dermis y el músculo esquelético subyacente. Puede estar bien diferenciada, estando compuesta de células fusiformes formando haces irregulares y parcialmente entrelazados. Estas células tienen grandes núcleos vesiculares de ovoides a fusiformes con uno o más nucleolos. A veces las células neoplásicas pueden presentar una morfología más redondeada de características histiocíticas y con un núcleo de redondo a oval central. Si la neoplasia está indiferenciada, puede mostrar células de tamaño y forma variable con núcleos pleomórficos y con células multinucleadas de hasta 20 núcleos10,11. La cantidad de figuras mitóticas es variable y presentan mitosis aberrantes con frecuencia. Las células gigantes multinucleadas de origen tumoral o histiocítico son relativamente frecuentes y pueden presentarse con núcleos redondos sin mitosis o con una marcada anisocariosis y figuras mitóticas aberrantes. La matriz extracelular es variable y dependiente del origen celular del sarcoma. Los de origen fibroblástico pueden tener abundante colágeno, mientras que los de origen muscular tienen escasa cantidad de colágeno. Si se trata de un osteosarcoma, se puede observar deposición de matriz osteoide y si hay diferenciación condroide, las células neoplásicas se encuentran en lagunas rodeadas de estroma mixoide parcialmente hialino11. Los SAPIs se diferencian de otros sarcomas por la presencia de células menos diferenciadas, mayor número de figuras mitóticas aberrantes y mayor número de células gigantes tumorales14.
En ocasiones en los márgenes de los SAPIs se pueden observar macrófagos que contienen un material azul-gris no birrefringente en el citoplasma (probablemente adyuvante vacunal). La observación de este material puede ayudar a orientar el diagnóstico, pero solo se encuentra en una pequeña proporción de los casos10 Es frecuente observar áreas de necrosis con neutrófilos, que pueden llevar a cavitación tanto central como multifocal. También es frecuente observar un infiltrado inflamatorio linfocítico reactivo tanto en los márgenes como en la masa neoplásica, que puede llegar a ser grave. La intensidad de este infiltrado no se ha visto correlacionada con el grado de diferenciación celular11,14. En este caso clínico no se observó el material extraño pero sí la necrosis y la inflamación.
Los SAPIs pueden tener origen fibroblástico, miofibroblástico, mioblástico, condroblástico, osteoblástico y/o histiocítico. En muchos casos la desdiferenciación de las células neoplásicas impide determinar el tipo de células de origen y se requiere de técnicas inmunohistoquímicas o tinciones especiales. Por ejemplo, la tinción con hematoxilina ácida fosfotúngstica (PTAH) resalta las estriaciones del músculo esquelético. Sin embargo, el método que permite una mejor diferenciación es la inmunohistoquímica. Todos los SAPIs son positivos a vimentina debido a su origen mesenquimal. Para confirmar el inmunofenotipo de sarcoma, se pueden realizar inmunohistoquímicas para actina de músculo liso (positiva para miofibroblastos), desmina (positiva en miofibroblastos y rabdomioblastos), S100 (positivo en condrocitos), osteocalcina y osteonectina (positivas en osteoblastos), CD45 y CD18 (positivos en histiocitos). En cuanto a las células gigantes multinucleadas, el inmunofenotipo es variable, pero siempre idéntico a la población neoplásica, mientras que las células gigantes multinucleadas reactivas tan solo expresan los antígenos CD45 y CD18 como dicta su origen histiocítico11.
La gradación histológica permite hacer predicciones sobre el pronóstico y evolución de las neoplasias en animales. Desafortunadamente, no existen criterios claros de gradar este tipo de tumores, por lo que el consejo general es que no se categoricen hasta que nuevos estudios proporcionen más información con estudios de carácter prospectivo15. Se ha propuesto una clasificación de sarcomas de tejidos blandos para gatos16. Sin embargo, este estudio no diferencia si los sarcomas son de aparición espontanea o debidos a una inyección, por lo que no se puede aplicar ya que el comportamiento biológico de ambos puede ser muy distinto. Por último, un estudio ha evaluado diferentes criterios utilizados con anterioridad para gradar SAPIs. Sus resultados descartan el valor pronóstico de diversos parámetros, como expresión de enzimas remodeladoras de la matriz extracelular, tamaño de los márgenes quirúrgicos, índice de proliferación usando Ki-67, porcentaje de necrosis y diferenciación celular. Sin embargo, si se encontraron parámetros que pueden valorar la probabilidad de recurrencia y tiempo de supervivencia: el tamaño de la masa (más de 3.75 cm de diámetro mayor de la masa fijada en formaldehído) y el contaje mitótico (superior a 20 figuras en 10 campos a 400x, 2.37 mm2)17. Utilizando estos criterios, el sarcoma de este caso tendría un peor pronóstico. Sin embargo, el paciente no ha presentado recurrencia de la neoplasia hasta la fecha, tres meses después de la primera intervención.
Los SAPIs emplean gelatinasas para remodelar la matriz extracelular y facilitar la invasión de las células neoplásicas a través de las fibras de colágeno, incluyendo las metaloproteinasas de matriz 2 (MMP-2) y 9 (MMP-9). Junto a la expresión alterada de estos enzimas, los SAPIs suelen presentar mutaciones también en los inhibidores tisulares de las metaloproteinasas de matriz (TIMP), especialmente en TIMP-2, que inhibe MMP-2 y MMP-9. La importancia fisiológica y patológica de la expresión alterada de este conjunto de enzimas se ha estudiado con anterioridad en este y otros tumores18-20 No obstante los estudios más recientes no han conseguido establecer una relación directa entre la expresión de estas enzimas y el pronóstico de los SAPIs17. Tampoco parecen ser buenos objetivos para el desarrollo de tratamientos, por lo menos hasta que se entienda mejor su función durante el desarrollo de las neoplasias17,21.
Patogénesis
A pesar de estudios exhaustivos para conocer la patogénesis de los SAPIs, no se ha conseguido explicar la relación causal directa con la inyección. La hipótesis más aceptada es que la inflamación crónica local provoca una serie de transformaciones malignas en las células mesenquimales, pero se desconoce el mecanismo exacto22. Esta hipótesis se ve reforzada por la presencia de áreas centrales de necrosis con células inflamatorias y el hallazgo ocasional de macrófagos y células gigantes multinucleadas con material fagocitado consistente con adyuvantes vacunales3,4,14. Se ha calculado que uno de cada 35 o 40 reacciones inflamatorias se desarrolla en SAPI y se sabe qué factores como la carga de antígeno pueden influir en su desarrollo2,5,23. Se ha demostrado que existe un riesgo más elevado de desarrollarlos si la inflamación local perdura a los 4 meses6.
Se sabe que la sobreexpresión de factores de crecimiento y citoquinas juegan un papel importante2. Un estudio ha demostrado la expresión de ciclooxigenasa 2 (COX-2) en SAPIs y que además su expresión está correlacionada con el nivel de inflamación24. Esto es interesante ya que COX-2 se ha relacionado con anterioridad con proliferación e invasión tumoral, inhibición de apoptosis y angiogenesis25. También se ha observado alta expresión del factor nuclear kappa B (NF-kB) en SAPIs y su inhibición ha detenido el crecimiento de células de SAPIs26. Otras citoquinas pueden participar en la diferenciación de los tipos de SAPIs. Por ejemplo, el factor de crecimiento transformante beta (TGF-β) y el factor estimulante de colonias de granulocitos y monocitos dirigen la diferenciación miofibroblástica14.
El hecho de que tan solo algunos gatos desarrollen SAPIs sugiere una predisposición genética. Se ha identificado que algunos gatos afectados presentan mutaciones en el gen supresor de tumores p5327. La relación entre mutaciones en el gen p53 y la predisposición a desarrollar SAPIs aún no está clara, pero algunos estudios han demostrado una fuerte asociación entre los dos28.
Al principio, solo se identificaron las vacunas de rabia y leucemia felina como factores de riesgo para el desarrollo de SAPIs, pero con el tiempo se han incluido otras vacunas, fármacos de larga duración (especialmente corticoesteroides), antibióticos, cisplatino, meloxicam o incluso material farmacológicamente inactivo como suturas, esponjas quirúrgicas o chips, independientemente del fabricante2,5,11,23. Esto sugiere que cualquier estímulo inflamatoria podría, teóricamente, desencadenar un SAPI por la proliferación descontrolada de fibroblastos y miofibroblastos.
Debido a ser originados en respuestas inflamatorias se ha sugerido que las vacunas que contienen adyuvantes son especialmente proclives para el desarrollo de estos sarcomas. Los adyuvantes son necesarios para fomentar la reacción inflamatoria en el lugar de la inyección con el uso de vacunas inactivadas. Trazas de adyuvantes se pueden observar histológica o ultraestructuralmente en algunos SAPIs2,11. Sin embargo, también se pueden dar en vacunas vivas o recombinantes que no contiene dichos adyuvantes5,23. Por lo tanto, aunque la asociación entre los adyuvantes y una inflamación tisular más pronunciada está bien establecida, la asociación entre esta inflamación y la formación de tumores es más difícil de demostrar y no se ha establecido una relación directa clara entre este incremento de inflamación y el desarrollo de SAPIs22,23.
Tampoco se ha observado la participación directa de virus felinos en el desarrollo de los SAPIs, incluyendo virus de inmunodeficiencia felina, virus de leucemia felina, papilomavirus, poliomavirus o herpesvirus29.
Tratamiento
El plan de tratamiento debería incluir estadiaje y planificación cuidadosa de la intervención quirúrgica, ya que una escisión total es crucial. El principal tratamiento, aunque complicado, es la resección quirúrgica escisional con márgenes muy amplios (al menos 3 cm, preferiblemente 5 cm), lo cual puede requerir escapulectomía parcial o escisión de la musculatura epiaxial y procesos vertebrales dorsales. Estas resecciones agresivas están relacionadas con periodos libre de tumor más extendidos y tiempos de supervivencia mayores10,30,31. Tras la escisión, es necesario la evaluación histopatológica para confirmar la escisión completa del tumor. También es importante informar correctamente al tutor de las posibles complicaciones posquirúrgicas, especialmente las dehiscencias, que requieren de una segunda reintervención quirúrgica.
Incluso una resección quirúrgica bien realizada puede ser insuficiente, con recurrencias de hasta el 70 %. En función del estado clínico del paciente y tras realizar pruebas complementarias de imagen y análisis de sangre y orina, se pueden implementar otros tratamientos31. Se ha demostrado en diversos estudios que la radioterapia preoperatoria puede disminuir el sembrado metastático durante la cirugía y su aplicación después de la resección aumenta el intervalo libre de enfermedad así como la supervivencia3,31. Además, el tamaño de la masa y el tiempo entre la cirugía y el comienzo de la radioterapia son críticos para su eficacia32. Sin embargo, los efectos negativos tanto a corto plazo como a largo plazo de la radioterapia deben considerarse antes de administrar este tratamiento, incluyendo cambios dermatológicos y problemas gastrotintestinales31. La administración de doxorrubicina en intervalos de 3 semanas ha resultado en periodos de remisión más largos en gatos tratados con cirugía y radioterapia33. También se han observado resultados favorables a su administración tras cirugía sin radioterapia. Sin embargo, debido a su baja biodistribución y su alta toxicidad, debe administrarse con cautela y evitar tratar pacientes con fallo renal crónico, anemia hemolítica, anemia inmunomediada u otras alteraciones de la médula ósea31. La eficacia de otros agentes quimioterapéuticos en el tratamiento de los SAPIs sigue siendo dudosa y se necesitan más estudios para confirmar su utilidad31.
Además de los tratamientos más tradicionales, diversos estudios se han centrado en descubrir nuevas maneras de tratar y evitar la recidiva de SAPIs. Estudios preliminares demuestran estabilización del tumor durante 2 meses en gatos tratados con ciertos inhibidores de la tirosina quinasa12,34, pero otros fármacos con esta función no han demostrado resultados que demuestren eficacia31. Se ha demostrado la eficacia del uso de nanopartículas de oro conjugadas con doxorrubicina como tratamiento único de los SAPIs en modelos experimentales35. También se han desarrollado nuevos tratamientos que aún están en fase experimental, como técnicas de terapia génica inmunoestimuladora para la transferencia de factores estimulantes de granulocitos, IL-2 o IFN-γ3,36,37. Diversos estudios centrados en la transferencias de genes de citoquinas han demostrado reducción en las tasas de recurrencia. Entre ellos destaca el uso de virus recombinante de viruela aviar (pox) que expresa IL-2 junto a la cirugía y radioterapia, ha resultado en uno de los intervalos libres de enfermedad más largos hasta la fecha38.
Prevención
Aunque la vacunación continuará siendo indispensable para mejorar la salud general de los gatos, ser conscientes del riesgo de desarrollo de SAPIs es fundamental para evitar casos de gravedad. Debido a su frecuencia y origen iatrogénico, se han realizado esfuerzos para intentar evaluar pautas y recomendaciones para prevenirlos. Algunas recomendaciones frecuentes son la distribución de inyecciones en diversas partes del cuerpo, utilizar vacunas menos inflamatorias, limitar la vacunación a animales en riesgo o incluso no vacunar39. Evitar la región interescapular como zona para la inyección de vacunas es una opinión compartida por diferentes asociaciones veterinarias1,3,40. En concreto, se recomienda utilizar zonas distales para la inyección, por debajo de la rodilla y el codo o incluso la cola, lo que facilita el tratamiento de posibles SAPIs futuros mediante la amputación2,3. La monitorización posinyección es también clave. El ligar de inyección debe ser anotado y los veterinarios deben advertir a los tutores para que presten atención a posibles masas o hinchazones en la zona inyectada para una detección temprana de SAPIs. Cualquier masa subcutánea en gato debe ser correctamente diagnosticada e intervenida. Para facilitar el trabajo de monitoreo, se puede recomendar a los tutores seguir la regla del 3-2-1: cualquier masa debe biopsiarse para examen histopatológico si sigue presente tres meses tras la inyección, si crece hasta más de dos centímetros o si está aumentando de tamaño un mes después de la inyección2,3,40.
En cuanto a la prevención de inflamación desmesurada en los sitios de inyección, se pueden seguir diversas recomendaciones. Se deben evitar las inyecciones intramusculares en gatos, debido a que los SAPIs intramusculares son más difíciles de detectar. También se debe utilizar medicación oral o intravenosa siempre que sea posible. Especialmente se debe evitar el uso de substancias irritantes de larga duración, como los glucocorticoides. Algunas medidas que se ha demostrado que no presentan un aumento del riesgo son el tamaño de la aguja y la jeringa, la velocidad de inyección y si se aplica presión en la zona tras la inyección. Sin embargo, si se ha visto que las vacunas frías presentan un riesgo mayor, por lo que se recomienda utilizarlas después de que se encuentren a temperatura ambiente2,5.
Una de las recomendaciones más frecuentes consiste en evitar el uso de vacunas con adyuvantes y es compartida por muchos profesionales y se incluyen en las guías de organismos internacionales1,3. Sin embargo, se ha puesto en duda que la evidencia científica apoye estas decisiones39. Lo que si nos certifican los estudios hasta la fecha es que las vacunas inyectables pueden causar SAPIs, que las vacunas con adyuvantes causan más inflamación que las que no los contienen y que la inflamación puede contribuir al desarrollo de SAPIs2,5,22,23. No obstante, no se ha conseguido establecer una relación directa entre las vacunas con adyuvantes y el desarrollo de SAPIs5,23,39.
Bibliografía
1. Day, M. J., Horzinek, M. C., Schultz, R. D. & Squires, R. A. WSAVA Guidelines for the vaccination of dogs and cats. J Small Anim Pract 57, E1–E45 (2016).
2. Hartmann, K. et al. Feline Injection-Site Sarcoma and Other Adverse Reactions to Vaccination in Cats. Viruses 15, 1708 (2023).
3. Hartmann, K. et al. Feline injection-site sarcoma: ABCD guidelines on prevention and management. J Feline Med Surg 17, 606–613 (2015).
4. Hendrick, M. J. & Goldschmidt, M. H. Do injection site reactions induce fibrosarcomas in cats? J Am Vet Med Assoc 199, 968 (1991).
5. Kass, P. H. et al. Multicenter case-control study of risk factors associated with development of vaccine-associated sarcomas in cats. J Am Vet Med Assoc 223, 1283–1292 (2003).
6. Gobar, G. M. & Kass, P. H. World Wide Web-based survey of vaccination practices, postvaccinal reactions, and vaccine site-associated sarcomas in cats. J Am Vet Med Assoc 220, 1477–1482 (2002).
7. Hartmann, K. et al. Feline injection-site sarcoma. J Feline Med Surg 17, 606–613 (2015).
8. Doddy, F. D., Glickman, L. T., Glickman, N. W. & Janovitz, E. B. Feline fibrosarcomas at vaccination sites and non-vaccination sites. J Comp Pathol 114, 165–174 (1996).
9. Hendrick, M. J. et al. Comparison of fibrosarcomas that developed at vaccination sites and at nonvaccination sites in cats: 239 cases (1991-1992). J Am Vet Med Assoc 205, 1425–1429 (1994).
10. Hendrick, M. J. Mesenchymal Tumors of the Skin and Soft Tissues. in Tumors in Domestic Animals 142–175 (John Wiley & Sons, Inc., 2016). doi:10.1002/9781119181200.ch5.
11. Other Mesenchymal Tumors. in Skin Diseases of the Dog and Cat 797–812 (2005). doi:10.1002/9780470752487.ch33.
12. Martano, M., Morello, E. & Buracco, P. Feline injection-site sarcoma: Past, present and future perspectives. The Veterinary Journal 188, 136–141 (2011).
13. Durham, A. C., Popovitch, C. A. & Goldschmidt, M. H. Feline chondrosarcoma: a retrospective study of 67 cats (1987-2005). J Am Anim Hosp Assoc 44, 124–130 (2008).
14. Couto, S. S., Griffey, S. M., Duarte, P. C. & Madewell, B. R. Feline vaccine-associated fibrosarcoma: morphologic distinctions. Vet Pathol 39, 33–41 (2002).
15. Avallone, G. et al. Review of Histological Grading Systems in Veterinary Medicine. Vet Pathol 58, 809–828 (2021).
16. Dobromylskyj, M. J., Richards, V. & Smith, K. C. Prognostic factors and proposed grading system for cutaneous and subcutaneous soft tissue sarcomas in cats, based on a retrospective study. J Feline Med Surg 23, 168–174 (2021).
17. Porcellato, I. et al. Feline Injection-Site Sarcoma: Matrix Remodeling and Prognosis. Vet Pathol 54, 204–211 (2017).
18. Tamamoto, T. et al. Plasma matrix metalloproteinase-9 activity in cats with lymphoma. Vet Comp Oncol 15, 1–5 (2017).
19. Sorensen, K. C., Kitchell, B. E., Schaeffer, D. J. & Mardis, P. E. Expression of matrix metalloproteinases in feline vaccine site-associated sarcomas. Am J Vet Res 65, 373–379 (2004).
20. Stetler-Stevenson, W. G. & Gavil, N. V. Normalization of the tumor microenvironment: evidence for tissue inhibitor of metalloproteinase-2 as a cancer therapeutic. Connect Tissue Res 55, 13–19 (2014).
21. Egeblad, M. & Werb, Z. New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer 2, 161–174 (2002).
22. Day, M. J. et al. A kinetic study of histopathological changes in the subcutis of cats injected with non-adjuvanted and adjuvanted multi-component vaccines. Vaccine 25, 4073–4084 (2007).
23. Srivastav, A., Kass, P. H., McGill, L. D., Farver, T. B. & Kent, M. S. Comparative vaccine-specific and other injectable-specific risks of injection-site sarcomas in cats. J Am Vet Med Assoc 241, 595–602 (2012).
24. Santelices Iglesias, O. A. et al. Association between Degree of Anaplasia and Degree of Inflammation with the Expression of COX-2 in Feline Injection Site Sarcomas. J Comp Pathol 165, 45–51 (2018).
25. Williams, C. S., Shattuck-Brandt, R. L. & DuBois, R. N. The role of COX-2 in intestinal cancer. Expert Opin Investig Drugs 8, 1–12 (1999).
26. Hsueh, C.-S. et al. Role of nuclear factor-kappa B in feline injection site sarcoma. BMC Vet Res 15, 365 (2019).
27. Nambiar, P. R. et al. Immunohistochemical detection of tumor suppressor gene p53 protein in feline injection site-associated sarcomas. Vet Pathol 38, 236–238 (2001).
28. Banerji, N., Kapur, V. & Kanjilal, S. Association of germ-line polymorphisms in the feline p53 gene with genetic predisposition to vaccine-associated feline sarcoma. J Hered 98, 421–427 (2007).
29. Kidney, B. A., Haines, D. M., Ellis, J. A., Burnham, M. & Jackson, M. L. Evaluation of formalin-fixed paraffin-embedded tissues from vaccine site-associated sarcomas of cats for polyomavirus DNA and antigen. Am J Vet Res 62, 828–832 (2001).
30. Hershey, A. E., Sorenmo, K. U., Hendrick, M. J., Shofer, F. S. & Vail, D. M. Prognosis for presumed feline vaccine-associated sarcoma after excision: 61 cases (1986-1996). J Am Vet Med Assoc 216, 58–61 (2000).
31. Zabielska-Koczywąs, K., Wojtalewicz, A. & Lechowski, R. Current knowledge on feline injection-site sarcoma treatment. Acta Vet Scand 59, 47 (2017).
32. Cohen, M. et al. Use of surgery and electron beam irradiation, with or without chemotherapy, for treatment of vaccine-associated sarcomas in cats: 78 cases (1996-2000). J Am Vet Med Assoc 219, 1582–1589 (2001).
33. Hahn, K. A., Endicott, M. M., King, G. K. & Harris-King, F. D. Evaluation of radiotherapy alone or in combination with doxorubicin chemotherapy for the treatment of cats with incompletely excised soft tissue sarcomas: 71 cases (1989-1999). J Am Vet Med Assoc 231, 742–745 (2007).
34. Lachowicz, J. L., Post, G. S. & Brodsky, E. A phase I clinical trial evaluating imatinib mesylate (Gleevec) in tumor-bearing cats. J Vet Intern Med 19, 860–864 (2005).
35. Zabielska-Koczywąs, K. et al. Doxorubicin Conjugated to Glutathione Stabilized Gold Nanoparticles (Au-GSH-Dox) as an Effective Therapeutic Agent for Feline Injection-Site Sarcomas—Chick Embryo Chorioallantoic Membrane Study. Molecules 22, 253 (2017).
36. Hüttinger, C. et al. Neoadjuvant gene delivery of feline granulocyte-macrophage colony-stimulating factor using magnetofection for the treatment of feline fibrosarcomas: a phase I trial. The Journal of Gene Medicine 10, 655–667 (2008).
37. Jahnke, A. et al. Intra-tumoral gene delivery of feIL-2, feIFN-gamma and feGM-CSF using magnetofection as a neoadjuvant treatment option for feline fibrosarcomas: a phase-I study. J Vet Med A Physiol Pathol Clin Med 54, 599–606 (2007).
38. Jas, D. et al. Adjuvant immunotherapy of feline injection-site sarcomas with the recombinant canarypox virus expressing feline interleukine-2 evaluated in a controlled monocentric clinical trial when used in association with surgery and brachytherapy. Trials in Vaccinology 4, 1–8 (2015).
39. Kass, P. H. Prevention of Feline Injection-Site Sarcomas: Is There a Scientific Foundation for Vaccine Recommendations at This Time? Vet Clin North Am Small Anim Pract 48, 301–306 (2018).
40. Stone, A. E. et al. 2020 AAHA/AAFP Feline Vaccination Guidelines. J Feline Med Surg 22, 813–830 (2020).
 by Multimédica
by Multimédica
