Tratamiento del sarcoma posinoculación felino con cirugía combinada con radioterapia o electroquimioterapia
Resumen breve
El sarcoma asociado al sitio de inyección es una neoplasia común en felinos. El tratamiento de elección es la cirugía con márgenes de resección amplios. En el presente estudio retrospectivo se incluyeron 44 pacientes felinos con sarcomas posinoculación con el objetivo de determinar la utilidad de la electroquimioterapia y la radioterapia de ortovoltaje como tratamientos adyuvantes a la cirugía. Se comparó el tiempo libre de progresión y sobrevida.Índice de contenidos

Resumen
Introducción
El sarcoma asociado al sitio de inyección es una neoplasia común en felinos. El tratamiento de elección es la cirugía con márgenes de resección amplios que en muchos casos incluye el espesor completo o directamente la amputación cuando el sarcoma es apendicular.
Objetivos
Determinar la utilidad de la electroquimioterapia y la radioterapia de ortovoltaje como tratamientos adyuvantes a la cirugía en el sarcoma posinoculación felino con margen de resección insuficiente.
Pacientes y métodos
En el presente estudio retrospectivo se incluyeron 44 pacientes felinos con sarcomas posinoculación separados en 3 grupos. El grupo 1: pacientes tratados con cirugía solamente. El grupo 2: además de cirugía recibieron electroquimioterapia intraoperatoria. El grupo 3: además de cirugía recibieron radioterapia de ortovoltaje adyuvante. Se compara el tiempo libre de progresión y sobrevida.
Resultados
El tiempo mediano libre de progresión del grupo 1 fue de 4 meses (2-17 meses), del grupo 2, 14 meses (3-33 meses) y del grupo 3 de 10.5 meses (2-36 meses). Siendo significativas las diferencias entre los grupos 1, 2 y 3, pero no entre 2 y 3. La sobrevida global mediana fue de 6 meses (2-19 meses) para el grupo 1, de 14 meses (6-33 meses) para el grupo 2, y de 13 meses (2-36 meses) para el grupo 3. Del mismo modo, los grupos 1, 2 y 3 presentan diferencias significativas, pero no el 2 con el 3.
Conclusiones
Los pacientes tratados con cirugía con margen insuficiente se benefician de la electroquimioterapia o radioterapia adyuvante indistintamente.
Palabras clave: electroporación, vacuna, sarcoma posvacunal, gato
Introducción
El sarcoma asociado al sitio de inyección (SAPI) es una neoplasia mesenquimal que puede aparecer en gatos después de inyecciones de diferentes agentes, incluidas vacunas y antibióticos, así como en reacción a materiales diversos como suturas, o cuerpos extraños. Estos pueden generar una respuesta inflamatoria excesiva e inespecífica a dichas sustancias o agentes1,2 que progresan al desarrollo del sarcoma3,5.
El SAPI es una de las neoplasias de tejidos blandos más comunes en felinos. La incidencia es variable en distintos países reportándose desde 1-4/10.0006 hasta 13-16/10.0007. La vacunación de leucemia felina y rabia parecen ser las más frecuentemente implicadas8. El número de vacunas administradas a gatos es otro factor que está relacionado con el riesgo de desarrollar un sarcoma, por lo que un gato que recibe una vacuna tiene un riesgo en un 50 % mayor que la población no vacunada, el que recibe dos tiene un riesgo de 127 % y el que recibe tres 175 %9. En algunos países como Argentina no hay reportes epidemiológicos publicados, pero en nuestra clínica en la ciudad de Buenos Aires, Argentina, resulta ser la cuarta neoplasia más frecuente en gatos luego del linfoma, el carcinoma de células escamosas y el carcinoma mamario.
La presentación clínica más común se caracteriza por la aparición de una masa en la zona de inyección de aspecto duro que inicialmente es móvil pero rápidamente progresa invadiendo y adhiriéndose a los tejidos subyacentes10. En un 10-20 % de los casos pueden observarse metástasis pulmonares11,12. Una característica adicional es que esta enfermedad puede desarrollar metástasis salteadas, y estos hallazgos se correlacionan con un alto porcentaje de recurrencia13. La recurrencia luego de una cirugía marginal puede ser muy rápida con una mediana de 79 días, sin embargo, las cirugías más agresivas incrementan el tiempo libre de recurrencia a 325 días14. Este aspecto es lo que justifica la realización de una cirugía con márgenes de resección amplios de 3-5 cm en margen lateral15 y un plano profundo sano completo, que en muchos casos incluye el espesor completo de la pared abdominal o costal o directamente la amputación cuando el sarcoma es apendicular16.
Los tratamientos oncológicos siempre incluyen a la cirugía como tratamiento de elección asociado a una menor tasa de recurrencia17,18. Los tratamientos adyuvantes con quimioterapia no han mejorado los tiempos de supervivencia cuando se asocian a cirugía salvo en los de alto grado en los que se puede suponer que el desarrollo de metástasis es mayor11,15. En lo que respecta a radioterapia los pacientes tratados mejoran el tiempo libre de enfermedad, obteniendo tiempos libre de enfermedad de entre 405-1110 días con megavoltaje. En márgenes sucios el tiempo libre es de entre 112 y 600 días19,20.
Se describe con frecuencia el uso de radioterapia y/o quimioterapia en modalidad adyuvante o neoadyuvante como una estrategia para mejorar el resultado de la cirugía20-22. El Rol de la ECT en SAPI no está muy descripto en la literatura veterinaria. Uno de los primeros trabajos de ECT en veterinaria fue publicado por L. Mir en 1997 en el que se trataron gatos con SAPI en recurrencia luego de un tratamiento convencional de cirugía con radioterapia. En estos pacientes, el uso de ECT como rescate incrementó la sobrevida de 0.8 meses en los pacientes no tratados a 6.7 meses en los tratados23. Los resultados con el uso de ECT intraoperatoria o posoperatoria se reportan con un tiempo libre de recurrencia de 4 meses en los pacientes con cirugía sola versus 12 y 19 meses en los pacientes con ECT intraquirúrgica y posquirúrgica respectivamente14. Los resultados de la combinación de bleomicina intravenosa con cisplatino intratumoral han mostrado mejoras en la sobrevida de los pacientes respecto de los tratados de forma posquirúrgica sin toxicidad reportada14.
En las últimas guías de vacunación publicadas por Vaccination Guidelines Group (VGG) y World Small Animal Veterinary Association (WSAVA) en 2024 se considera evitar la vacunación en las zonas de difícil resección con margen limpio como la región interescapular, o preescapular y promueven la vacunación distal de la cola y miembros posteriores para luego ante la eventual aparición de un sarcoma proseguir con la amputación24. Por otro lado, en un estudio realizado mediante encuestas, las recomendaciones que implican la amputación no son comúnmente aceptadas por los propietarios de gatos25 con lo cual es probable este sea uno de los motivos por los que la vacunación se sigue realizando con frecuencia en el flanco. En este sentido, el objetivo de este trabajo de sarcoma posinyección felino fue evaluar si la cirugía asociada a la ECT intraquirúrgica o radioterapia posquirúrgica permitía mejorar el tiempo libre de recurrencias en gatos con resección quirúrgica de margen sucio o estrecha respecto de la cirugía sola.
Pacientes y métodos
En el presente estudio retrospectivo se analizó la sobrevida y el tiempo libre de enfermedad de 44 pacientes felinos tratados con cirugía sola, grupo 1, cirugía con ECT, grupo 2, y cirugía con radioterapia de ortovoltaje, grupo 3. Todos los pacientes contaban con diagnóstico histopatológico confirmado de sarcoma. Respecto de la graduación histológica, se clasificaron en grado 1, 2 y 3, y los estudios de márgenes se categorizaron en libre, estrecho y comprometido (Tabla 1).
| Característica | Grupo 1 | Grupo 2 | Grupo 3 |
|---|---|---|---|
| Tratamiento | Cirugía | Cirugía + ECT | Cirugía + OvRTP |
| Número de casos | 9 | 11 | 24 |
| Edad | 12.5 (8-17) | 12.7 (9-20) | 9.6 (3-16) |
| Relación M:H | 5:4 | 8:3 | 9:13 |
| Casos con recidivas previas | 0 | 64 % | 17 % (4) |
| Ubicaciób columna/parrilla costal | 1/8 | 5/6 | 4/20 |
Tabla 1. Descripción de los grupos de tratamiento.
En el presente análisis se excluyeron:
- Pacientes que tenían sarcoma de ubicación apendicular.
- Sarcomas no asociados al punto de inyección.
- Pacientes con márgenes de resección libres de enfermedad confirmado histopatológicamente.
- Pacientes no candidatos a cirugía por encontrarse con enfermedad inoperable o en estadio metastásico.
La cirugía consistió en la resección de la neoplasia con el mayor margen posible, en muchos casos inferior al ideal (3-5 cm y un plano profundo sano completo). Los pacientes del grupo 1, solo recibieron este tratamiento.
En el grupo 2, además de la cirugía, los pacientes recibieron el tratamiento de ECT. Se realizó en todos los casos de forma intraquirúrgica. Una vez que el tumor fue removido con el mayor margen de seguridad posible se administró Bleomicina (Bleocris, Laboratorio LKM, Buenos Aires, Argentina) de forma intravenosa, en bolo, a una dosis de 15000 UI/m2 de superficie corporal. Luego de 5-6 minutos se realizó el tratamiento en el lecho quirúrgico incluyendo el margen de seguridad (Figura 1).
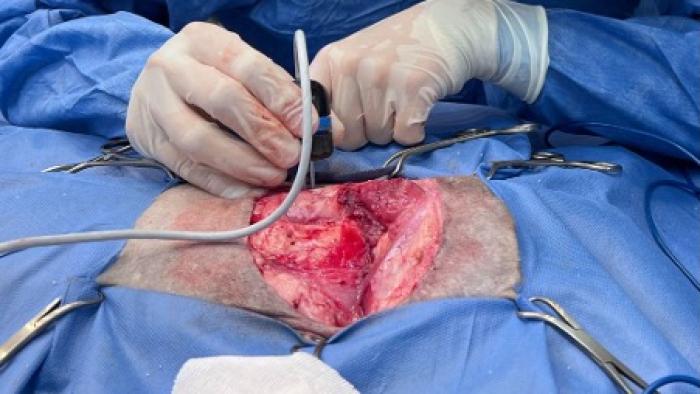
Figura 1. Felino de 5 años que luego de una recidiva de sarcoma posinyección que se trató de forma quirúrgica asociada a ECT, en este caso mediante un electrodo de agujas 20 G en la musculatura epiaxial.
Se utilizó un electroporador EPV-300 (BIOTEX SRL, Buenos Aires, Argentina) que entrega trenes de 8 pulsos monopolares de onda cuadrada, de 1000 V/cm, de 100 µs de duración a 5 kHz. Para aplicar el campo eléctrico en la zona quirúrgica se utilizaron dos modelos de electrodos provistos por el fabricante. Uno de 6 agujas descartables 20 G para casos que requerían una profundidad de tratamiento mayor a 2-3 mm. Para los casos en que se requiere una profundidad de tratamiento menor, se utilizó un electrodo de placas paralelas bañadas en oro (Figura 2A-B).

Figura 2. (A) Electrodo de placas para uso en lecho quirúrgico y (B) electrodo de 6 agujas para uso en casos que se requiera mayor profundidad.

Para todos los pacientes que fueron tratados con ECT se siguieron las recomendaciones del Manual de Electroquimioterapia en Oncología Veterinaria.
En el grupo 3, además de la cirugía, luego de finalizada la cicatrización, se trató a los pacientes mediante una unidad de radiación superficial Philips RT-100 de 100 kV. Considerando la limitación de profundidad de este tratamiento, se planificó para un máximo de 1.5 cm de profundidad en la zona costoabdominal. Se aseguró una dosis total en piel de 48 Gy y una dosis en profundidad de 28 Gy. Se usaron conos aplicadores que permitieron conformar el área tratada con un margen de 4-5 cm en torno a la cicatriz.
Se compararon las edades de los diferentes grupos mediante el test t-Student. Se comparó la sobrevida y el tiempo libre de progresión de cada grupo mediante curvas de Kaplan-Meier, y se determinó su significancia estadística mediante el test de Log Rank, tomando un p valor de 0.05.
Resultados
El tiempo libre de progresión del grupo 1 fue de una mediana de 4 meses (2-17 meses). Del grupo 2, de 14 meses (3-33 meses). Del grupo 3 de 10.5 meses (2-36 meses). Siendo superior el tratamiento combinado, ya sea con radioterapia (p=0.01) o ECT (p=0.047), que la cirugía sola, con una diferencia estadísticamente significativa en ambos casos. Sin embargo, la diferencia entre los grupos de radioterapia o ECT no resulta significativa (Figura 3).
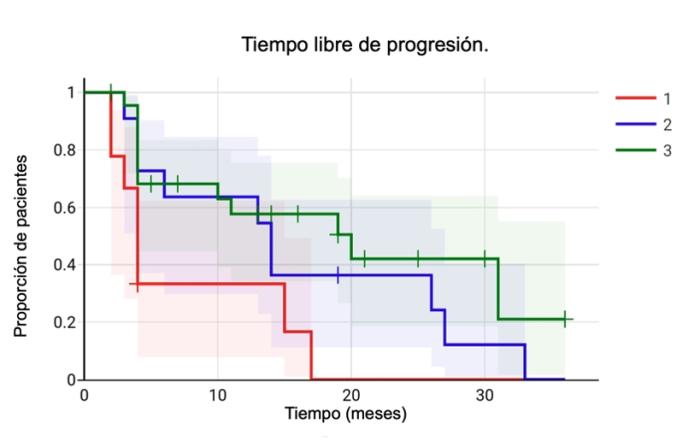
Figura 3. Curvas de Kaplan-Meier del tiempo libre de progresión. El tratamiento quirúrgico solo presenta un tiempo libre de progresión menor, estadísticamente significativo cuando se lo compara con el tratamiento combinado. La radioterapia y la ECT como adyuvantes no presentaron diferencias significativas.
La sobrevida global mediana fue de 6 meses (2-19 meses) para el grupo 1, de 14 meses (6-33 meses) para el grupo 2, y de 13 meses (2-36 meses) para el grupo 3.
Para el caso de la sobrevida global, esta resultó ser menor cuando se empleó la cirugía como única modalidad terapéutica, que cuando se combinó con radioterapia (p=0.033) o ECT (p=0.05). En ambos casos, las diferencias fueron estadísticamente significativas. Sin embargo, al igual que con el tiempo libre de enfermedad, la diferencia entre el grupo de radioterapia y el grupo de ECT no resultó estadísticamente significativa (Figura 4).
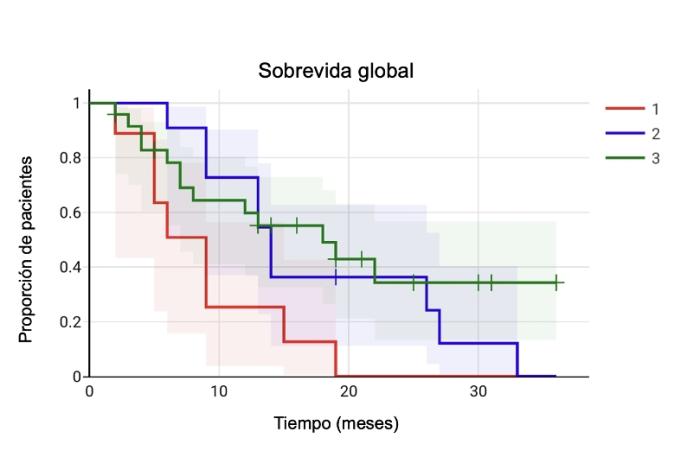
Figura 4. Curvas de Kaplan-Meier de sobrevida global. La sobrevida global resultó ser mayor en el tratamiento combinado cuando se lo compara con la cirugía sola, de forma estadísticamente significativa. No hubo diferencias estadísticas entre el grupo de radioterapia y ECT.
Una de las limitaciones de este estudio, es que, si bien la diferencia de edad entre el grupo 1 y 2 no es significativa, sí lo es, entre el grupo 2 y 3 (p=0.019), y 1 y 3 (p=0.04). Indicando que el grupo 3 es significativamente más joven que los demás grupos, pudiendo esto ser un factor confundidor a la hora de comparar la sobrevida. Otra limitación de este trabajo es que hay una diferencia importante en la distribución de los pacientes con enfermedad recurrente, siendo el grupo 2 el que mayor proporción de estos pacientes tiene, mientras que el grupo 1 son pacientes de primera consulta. Otra limitación de este estudio es que la radioterapia utilizada es de ortovoltaje, siendo su eficacia menor que la de megavoltaje cuando la profundidad de tratamiento supera los 1-2 cm.
El uso de ECT intraoperatoria no modificó la cicatrización de la herida quirúrgica, la cual se produjo en los tiempos y formas habituales. Todos los pacientes tratados con radioterapia presentaron radermitis, la cual se resolvió con tratamiento sintomático mediante antiinflamatorios y aplicaciones tópicas. Al finalizar, también desarrollaron alopecia temporal y leucotriquia persistente en la zona irradiada (Vídeo 1, Figura 5).
Vídeo 1. Felino con recidiva de SAPI. Abordaje quirúrgico de espesor completo en pared abdominal. Se utiliza el electrodo de placas anchas con colocación prolija, cubriendo el margen lateral y el lecho.
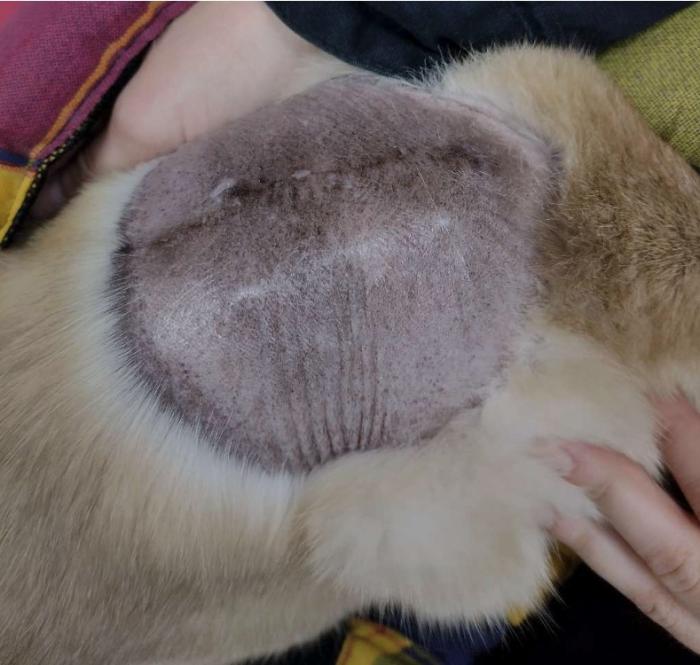
Figura 5. Paciente con SAPI luego de finalizar el tratamiento de cirugía con radioterapia se encuentra libre de enfermedad y persiste alopecia en la zona tratada.
Discusión
El presente trabajo brinda información relevante para decidir la conducta terapéutica de los pacientes felinos con SAPI. En el caso de la resección completa con márgenes limpios, este es el tratamiento de elección. Sin embargo, cuando la resección se realiza con márgenes estrechos o comprometidos, el tiempo libre de progresión y la sobrevida de los pacientes se ve seriamente afectada.
En estos casos es donde cobra relevancia la combinación de la cirugía con un tratamiento adyuvante.
En el presente trabajo podemos ver que resulta indistinto y el veterinario tratante deberá definir cuál es la conducta a seguir. Un aspecto interesante de la radioterapia es que puede realizarse en un segundo tiempo luego del análisis de la pieza quirúrgica. Esto permite seleccionar mejor los candidatos a este tratamiento adyuvante. Por el contrario, si se decide utilizar la ECT como tratamiento adyuvante, si bien es posible realizarla en un segundo acto, la complejidad de este procedimiento aumenta considerablemente. Esto se debe a que la zona cicatrizal es dura y extensa, y además cambian las relaciones anatómicas del tumor, haciendo muy difícil localizar el lecho tumoral original. Por este motivo, la ECT se suele realizar de forma intraoperatoria.
Es interesante destacar que los pacientes del grupo de ECT eran mayoritariamente tratamientos sobre recidivas, lo que hace que su pronóstico sea peor, por lo tanto, resulta muy importante la contribución de esta terapia al esquema de tratamiento de estos pacientes.
En el último tiempo, la ECT está cada vez más disponible, constituyéndose una opción de tratamiento de gran relevancia para el oncólogo, principalmente en los lugares donde la radioterapia resulta de muy difícil acceso. Sin embargo, una desventaja importante de la ECT es que su efectividad resulta mayor cuando se realiza sobre el lecho quirúrgico, ya que es posible ver claramente la localización original del tumor. Cuando se realiza en un segundo tiempo, el cierre quirúrgico o incluso la cicatriz puede quedar en una localización ligeramente diferente al tumor original y de esta forma comprometer el tratamiento de ECT. Esto se debe a que este tratamiento, si bien tiene una alta tasa de respuesta local, depende de la realización correcta de la técnica, y eso implica la cobertura adecuada y total del campo de tratamiento con el electrodo. Dejar, aunque sean pequeñas, áreas sin tratar, disminuye drásticamente la efectividad del tratamiento. Por lo que debemos decidir implementar la ECT antes de saber si los márgenes resultan comprometidos o estrechos. Por el contrario, la radioterapia se puede realizar con igual efectividad en un segundo tiempo, y ya contando con la pieza quirúrgica.
Finalmente, tanto la ECT como la radioterapia constituyen herramientas muy útiles para el cirujano oncólogo, especialmente en aquellos casos donde resulta difícil obtener un margen de resección adecuado.
Bibliografía
1. Wilcock B, Wilcock A, Bottoms K. Feline postvaccinal sarcoma: 20 years later. Can Vet J [Internet]. 2012 Apr [cited 2024 Oct 18];53(4):430. Available from: https://pmc.ncbi.nlm.nih.gov/articles/PMC3299519/
2. Feline Injection Site Sarcomas: Data from Switzerland 2009–2014. J Comp Pathol [Internet]. 2018 Aug 1 [cited 2024 Oct 18];163:1–5. Available from: http://dx.doi.org/10.1016/j.jcpa.2018.06.008
3. Martano M, Morello E, Ughetto M, Iussich S, Petterino C, Cascio P, et al. Surgery alone versus surgery and doxorubicin for the treatment of feline injection-site sarcomas: a report on 69 cases. Vet J [Internet]. 2005 Jul;170(1):84–90. Available from: http://dx.doi.org/10.1016/j.tvjl.2004.04.004
4. De Man MMG, Ducatelle RV. Bilateral subcutaneous fibrosarcomas in a cat following feline parvo-, herpes- and calicivirus vaccination. J Feline Med Surg [Internet]. 2007 Oct;9(5):432–4. Available from: http://dx.doi.org/10.1016/j.jfms.2007.05.002
5. Carminato A, Vascellari M, Marchioro W, Melchiotti E, Mutinelli F. Microchip-associated fibrosarcoma in a cat. Vet Dermatol [Internet]. 2011 Dec;22(6):565–9. Available from: http://dx.doi.org/10.1111/j.1365-3164.2011.00975.x
6. Macy DW, Hendrick MJ. The potential role of inflammation in the development of postvaccinal sarcomas in cats. Vet Clin North Am Small Anim Pract [Internet]. 1996 Jan;26(1):103–9. Available from: http://dx.doi.org/10.1016/s0195-5616(96)50009-4
7. Hendrick MJ, Kass PH, McGill LD, Tizard IR. Postvaccinal sarcomas in cats. J Natl Cancer Inst [Internet]. 1994 Mar 2;86(5):341–3. Available from: http://dx.doi.org/10.1093/jnci/86.5.341
8. Dean RS, Pfeiffer DU, Adams VJ. The incidence of feline injection site sarcomas in the United Kingdom. BMC Vet Res [Internet]. 2013 Jan 22 [cited 2024 Oct 18];9(1):1–6. Available from: https://link.springer.com/articles/10.1186/1746-6148-9-17
9. Kass PH, Barnes WG, Spangler WL, Chomel BB, Culbertson MR. Epidemiologic evidence for a causal relation between vaccination and fibrosarcoma tumorigenesis in cats. J Am Vet Med Assoc [Internet]. 1993 Aug 1;203(3):396–405. Available from: https://avmajournals.avma.org/view/journals/javma/203/3/javma.1993.203.03.396.xml
10. Madewell BR, Griffey SM, McEntee MC, Leppert VJ, Munn RJ. Feline vaccine-associated fibrosarcoma: an ultrastructural study of 20 tumors (1996-1999). Vet Pathol [Internet]. 2001 Mar;38(2):196–202. Available from: http://dx.doi.org/10.1354/vp.38-2-196
11. Romanelli G, Marconato L, Olivero D, Massari F, Zini E. Analysis of prognostic factors associated with injection-site sarcomas in cats: 57 cases (2001-2007). J Am Vet Med Assoc [Internet]. 2008 Apr 15;232(8):1193–9. Available from: http://dx.doi.org/10.2460/javma.232.8.1193
12. Kuntz CA, Dernell WS, Powers BE, Devitt C, Straw RC, Withrow SJ. Prognostic factors for surgical treatment of soft-tissue sarcomas in dogs: 75 cases (1986–1996). J Am Vet Med Assoc [Internet]. 1997 Nov 1;211(9):1147–51. Available from: https://avmajournals.avma.org/view/journals/javma/211/9/javma.1997.211.09.1147.xml
13. Zardo KM, Damiani LP, Matera JM, Fonseca-Pinto AC. Recurrent and non-recurrent feline injection-site sarcoma: computed tomographic and ultrasonographic findings. J Feline Med Surg [Internet]. 2016 Oct [cited 2024 Oct 18];18(10). Available from: https://pubmed.ncbi.nlm.nih.gov/26208864/
14. Spugnini EP, Vincenzi B, Carocci F, Bonichi C, Menicagli F, Baldi A. Combination of bleomycin and cisplatin as adjuvant electrochemotherapy protocol for the treatment of incompletely excised feline injection-site sarcomas: A retrospective study. Open Veterinary Journal [Internet]. 2020 Jul 31 [cited 2024 Oct 18];10(3):267. Available from: https://pmc.ncbi.nlm.nih.gov/articles/PMC7703611/
15. Phelps HA, Kuntz CA, Milner RJ, Powers BE, Bacon NJ. Radical excision with five-centimeter margins for treatment of feline injection-site sarcomas: 91 cases (1998-2002). J Am Vet Med Assoc [Internet]. 2011 Jul 1;239(1):97–106. Available from: http://dx.doi.org/10.2460/javma.239.1.97
16. Davidson EB, Gregory CR, Kass PH. Surgical excision of soft tissue fibrosarcomas in cats. Vet Surg [Internet]. 1997 Jul-Aug;26(4):265–9. Available from: http://dx.doi.org/10.1111/j.1532-950x.1997.tb01497.x
17. Banerji N, Kanjilal S. Somatic alterations of the p53 tumor suppressor gene in vaccine-associated feline sarcoma. Am J Vet Res [Internet]. 2006 Oct;67(10):1766–72. Available from: http://dx.doi.org/10.2460/ajvr.67.10.1766
18. Kobayashi T, Hauck ML, Dodge R, Page RL, Price GS, Williams LE, et al. Preoperative radiotherapy for vaccine associated sarcoma in 92 cats. Vet Radiol Ultrasound [Internet]. 2002 Sep [cited 2024 Oct 18];43(5). Available from: https://pubmed.ncbi.nlm.nih.gov/12375783/
19. Cronin K, Page RL, Spodnick G, Dodge R, Hardie EN, Price GS, et al. Radiation therapy and surgery for fibrosarcoma in 33 cats. Vet Radiol Ultrasound [Internet]. 1998 Jan-Feb;39(1):51–6. Available from: http://dx.doi.org/10.1111/j.1740-8261.1998.tb00325.x
20. Eckstein C, Guscetti F, Roos M, Martín de las Mulas J, Kaser-Hotz B, Rohrer Bley C. A retrospective analysis of radiation therapy for the treatment of feline vaccine-associated sarcoma. Vet Comp Oncol [Internet]. 2009 Mar;7(1):54–68. Available from: http://dx.doi.org/10.1111/j.1476-5829.2008.00173.x
21. Bregazzi VS, LaRue SM, McNiel E, Macy DW, Dernell WS, Powers BE, et al. Treatment with a combination of doxorubicin, surgery, and radiation versus surgery and radiation alone for cats with vaccine-associated sarcomas: 25 cases (1995-2000). J Am Vet Med Assoc [Internet]. 2001 Feb 15;218(4):547–50. Available from: http://dx.doi.org/10.2460/javma.2001.218.547
22. Bray J, Polton G. Neoadjuvant and adjuvant chemotherapy combined with anatomical resection of feline injection-site sarcoma: results in 21 cats. Vet Comp Oncol [Internet]. 2016 Jun;14(2):147–60. Available from: http://dx.doi.org/10.1111/vco.12083
23. Mir LM, Devauchelle P, Quintin-Colonna F, Delisle F, Doliger S, Fradelizi D, et al. First clinical trial of cat soft-tissue sarcomas treatment by electrochemotherapy. Br J Cancer [Internet]. 1997;76(12):1617–22. Available from: http://dx.doi.org/10.1038/bjc.1997.606
24. Squires RA, Crawford C, Marcondes M, Whitley N. 2024 guidelines for the vaccination of dogs and cats - compiled by the Vaccination Guidelines Group (VGG) of the World Small Animal Veterinary Association (WSAVA). J Small Anim Pract [Internet]. 2024 May;65(5):277–316. Available from: http://dx.doi.org/10.1111/jsap.13718
25. Carwardine D, Friend E, Toscano M, Bowlt K. UK owner preferences for treatment of feline injection site sarcomas. J Small Anim Pract [Internet]. 2014 Feb;55(2):84–8. Available from: http://dx.doi.org/10.1111/jsap.12162
 by Multimédica
by Multimédica