Tratamiento y evolución de un hemangiosarcoma muscular lumbar metastásico
Resumen breve
En este caso clínico, se examina la situación y evolución de un perro diagnosticado con hemangiosarcoma (HSA) muscular metastásico en la región lumbar, una neoplasia caracterizada por la proliferación descontrolada de precursores de las células endoteliales de los vasos sanguíneos.Índice de contenidos

Introducción
En este caso clínico, se examina la situación y evolución de un perro diagnosticado con hemangiosarcoma (HSA) muscular metastásico en la región lumbar, una neoplasia caracterizada por la proliferación descontrolada de precursores de las células endoteliales de los vasos sanguíneos. Este tipo de cáncer presenta un pronóstico reservado, ya que suele detectarse en etapas avanzadas, siendo localmente invasivo y con una marcada tendencia a la diseminación metastásica vía hematógena. Esta neoplasia puede aparecer en perros de cualquier raza y edad, pero es más habitual encontrarla en pacientes de tamaño mediano y grande, alrededor de los 10 años1.
Las localizaciones más habituales del HSA en el perro son la visceral (bazo, hígado principalmente), cardiaca (aurícula derecha), dérmica y músculo (sin predilección por la ubicación), aunque se pueden desarrollar en cualquier órgano u estructura del cuerpo1.
Como en cualquier neoplasia, la primera aproximación diagnóstica es la citología, pero la naturaleza vascular de estas lesiones puede contaminar de sangre las muestras (hemodilución) de manera severa, por lo que hay veces que son necesarias las biopsias incisionales. Al ser un tumor altamente metastásico, es necesaria la utilización de pruebas de imagen para la realización del estadio: radiografías torácicas, ecografía abdominal, tomografía computarizada (TC), etc2.
Como es norma en cualquier tumor sólido, la cirugía es la primera opción terapéutica, pero debido a su naturaleza metastásica, suele requerir tratamientos quimioterápicos posteriores. En el caso de lesiones inoperables, aunque son tumores muy quimiosensibles, no se ha visto en las distintas publicaciones que la supervivencia sea similar a los casos que combinan cirugía y quimioterapia.
La quimioterapia basada en doxorrubicina ha demostrado ser la más eficaz frente al HSA, ya sea como monoterapia o en combinación con otros agentes antineoplásicos. La tolerancia aguda de la doxorrubicina suele ser buena, aunque puede producir emesis. Por eso, habitualmente se acompaña su aplicación de antieméticos. Además, la mayor limitación de este fármaco es la cardiotoxicidad (cardiomiopatía dilatada irreversible) que se puede producir por dosis acumulativas (entre 180 a 240 mg/m2). Por esa razón, su utilización se suele limitar a 5 sesiones y siempre monitorizar con ecocardiografía la contractibilidad del corazón, sobre todo en razas predispuestas a esta enfermedad3. Cuando tenemos este problema, se tiende a cambiar a otras antraciclinas como son la epirrubicina (mayor toxicidad digestiva) o mitoxantrona, pero hay muy pocas referencias en la literatura en cuanto a su efectividad.
En la bibliografía consultada, la supervivencia media de perros con HSA con afectación muscular es de entre 6 a 11 meses con tratamiento quimioterápico4, manteniendo la calidad de vida del paciente en todo momento.
Caso clínico
Se presentó en la consulta un paciente de raza Bóxer, macho castrado de 8 años y 10 meses de edad, con antecedentes de mastocitomas de bajo grado operados de manera adecuada, y, como antecedente médico relevante, fue diagnosticado y tratado de leishmaniosis, de la cual en ese momento se encontraba bien clínica y analíticamente.
El motivo de la consulta fue la aparición de una masa en zona paralumbar izquierda, de más de 5 cm, no móvil y sin afectación de la piel que la recubría. Los propietarios reseñaron que había aparecido apenas dos semanas antes y que presentaba un crecimiento rápido.
Tras la exploración clínica, que no mostró ninguna otra alteración, se realizó una punción con aguja fina (PAF) de la lesión. Los resultados laboratoriales no fueron concluyentes debido a la intensa hemodilución y a la ausencia de células tisulares. Se realizó una radiografía laterolateral de la zona lumbar, en la que se apreció una imagen de masa en la región, pero sin lesiones líticas en las vértebras. El abdomen no mostró organomegalias ni imagen de masa. Se realizó una analítica sanguínea básica, que no arrojó ninguna alteración.
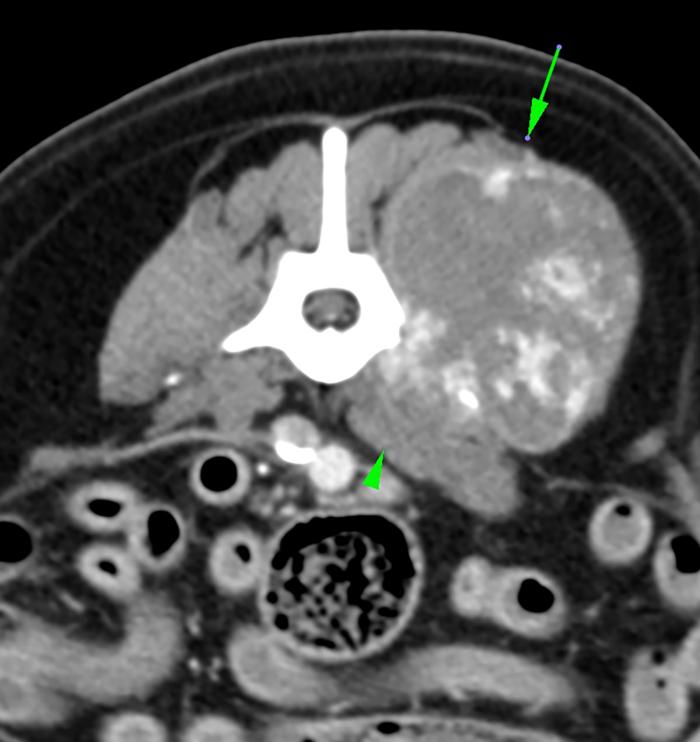
Ante la ausencia de datos concluyentes y, debido a la profundidad y adherencia de la lesión, se realizó una TC de abdomen y lumbares mediante adquisición helicoidal multicorte de 2 mm de espesor con algoritmo de tejido blando y hueso, repitiendo el estudio tras la administración de contraste yodado intravenoso. Los hallazgos más significativos se resumen en la presencia de una masa isoatenuante, con forma y márgenes irregulares, que captaba contraste de manera marcada y heterogénea y de dimensiones 8.5 (longitud) x 6 (altura) x 6.5 cm (anchura) en la musculatura epaxial e hipaxial izquierda a nivel lumbar caudal (Figura 1A). Esta lesión se extendía desde la zona de L7 a la de L5 y que además estaba produciendo una lisis de los procesos transversos izquierdos de las vértebras L6 y L7 (Figura 1B). Por otro lado, la lesión se extendía hacia el retroperitoneo izquierdo, formando otra masa isoatenuante con pequeños focos de mineralización distrófica y márgenes irregulares, con captación de contraste pobre en su centro y marcada en la periferia, con unas medidas de 11 cm (long.) x 3.7 cm (alt.) x 4.5 cm (anch.), llegando a desplazar ventralmente al riñón izquierdo (Figura 1C). Además, se apreciaban linfadenopatías periaórtica e ilíaca medial izquierda, posiblemente metastásicas, y múltiples nódulos pulmonares compatibles con metástasis pulmonares en la porción caudal del tórax, que aparece en el estudio realizado.
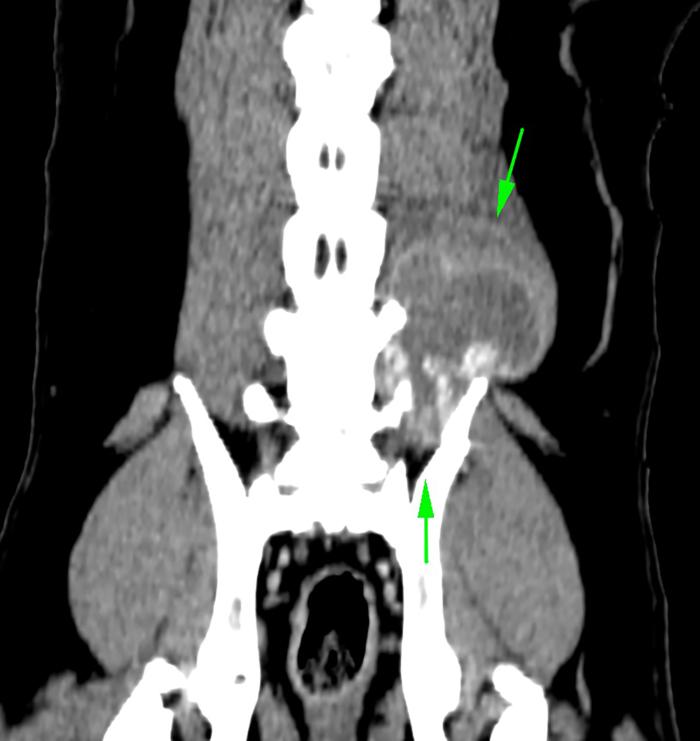
Figura 1. imágenes del TC inicial
Se aprovechó la sedación del TC para repetir toma de muestras citológicas de la lesión, obteniendo esta vez una hemodilución severa junto a algunas células de aspecto mesenquimal, que en ocasiones formaban agrupaciones, con núcleos grandes y de disposición central, con nucleolos evidentes y discreta vacuolización intracitoplasmática (Figura 2).
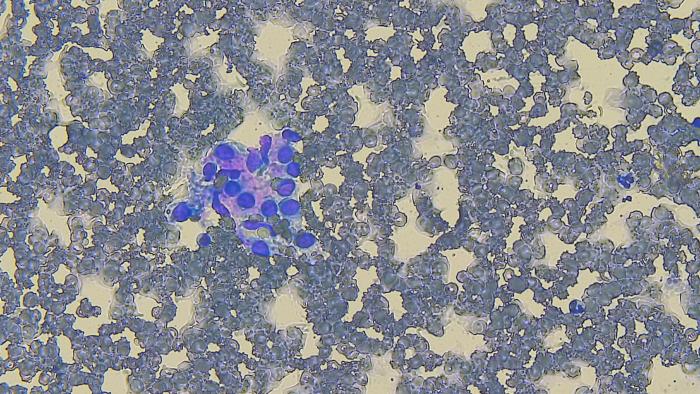
Figura 2. Detalle de la citología donde se aprecia un pseudogrupo de células mesenquimales.
Para terminar el estadiaje, se realizó un estudio radiográfico de la cavidad torácica en tres proyecciones, donde se observó una imagen compatible con metástasis (Figura 3).
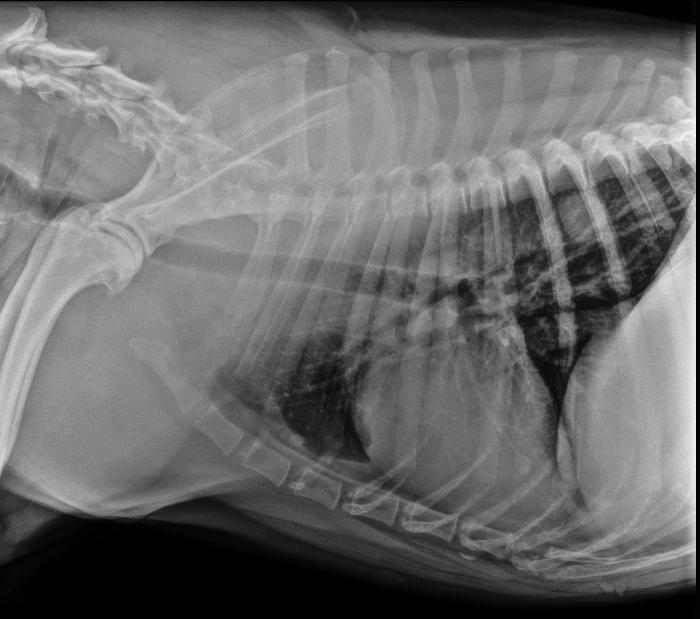
Figura 3. Radiografía laterolateral del tórax donde se aprecian lesiones compatibles con nódulos pulmonares.
El diagnóstico diferencial fue de tumor de estirpe mesenquimal, probablemente un HSA muscular, basado en la estirpe celular junto a la intensa hemodilución presente en todas las muestras citológicas y las numerosas metástasis.
Se discutió con los propietarios la posibilidad de toma de biopsia incisional, pero fue descartada debido a las posibles complicaciones hemorrágicas.
Se informó del diagnóstico presuntivo y de su extensión, pronóstico asociado, y de la imposibilidad de realizar un tratamiento quirúrgico. Se optó por tratamiento quimioterápico con protocolo VAC modificado, añadiendo ácido tranexámico (Amchafibrin® grageas).
Se modificó el protocolo VAC (doxorrubicina a 30 mg /m2 IV el día 1 del ciclo, vincristina a una dosis de 0.75 mg/m2 IV los días 8 y 15 y ciclofosfamida el día 10 del ciclo a una dosis de 200-300 mg/m2 PO, comenzando un nuevo ciclo el día 21) para minimizar toxicidad. El tratamiento modificado resultó en doxorrubicina IV a una dosis de 30 mg/m2 el primer día del ciclo, ciclofosfamida PO a una dosis de 200 mg/m2 el dia 8 y vincristina IV a una dosis de 0.7 mg/m2 el día 15, reiniciándose el ciclo el día 21. Se añade ácido tranexámico PO desde 3 días antes hasta 7 días después de la aplicación de la doxorrubicina con la intención de intentar disminuir eventos hemorrágicos por efecto del citostático. Además, para minimizar efectos secundarios, se añadió maropitant (Cerenia ®) PO los 4 primeros días tras la aplicación de doxorrubicina.
La tolerancia del paciente a la quimioterapia fue perfecta, pero al inicio del segundo ciclo desarrolló un cuadro de epistaxis. En la analítica no se encontraron alteraciones en la coagulación, pero sí una anemia leve no regenerativa y la radiografía torácica mostraba una disminución de las lesiones pulmonares. La epistaxis no se repitió y no se modificó el tratamiento hasta terminar el cuarto ciclo donde se le realizó una TC de revisión.
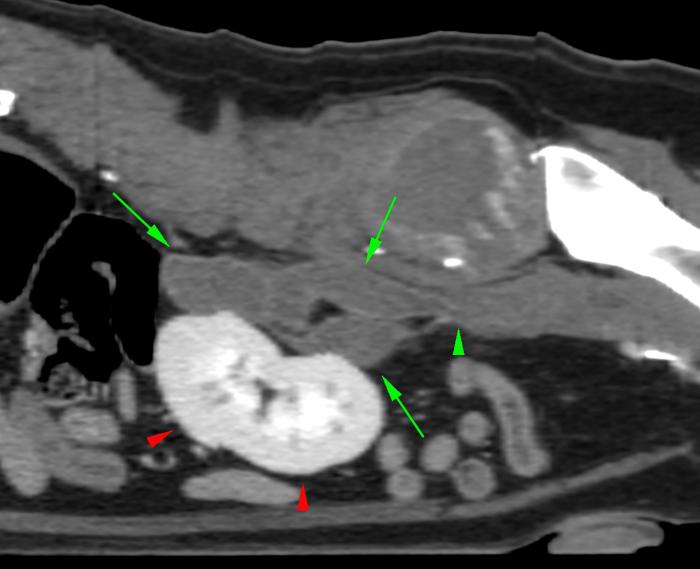
En esta segunda TC se observó una masa isoatenuante, de bordes irregulares, pero bien definidos, que mostraba un leve realce en anillo en fases de poscontraste, extendiéndose desde el borde caudal de L5 hasta el borde craneal de L7, centrada en la musculatura epaxial izquierda. Esta lesión ya no invadía la musculatura hipaxial ni el retroperitoneo, ni se observaba la lisis de los procesos transversos izquierdos de L7 y L6 descrita en el estudio anterior (Figura 4A). Sus dimensiones máximas en ese momento eran de 4.7 cm (long.) x 3.5 cm (alt.) x 3.4 cm (anch.). Además, no se apreciaron nodulaciones en la porción torácica escaneada. La conclusión de este estudio era que los cambios descritos en la musculatura epaxial de la región lumbar compatibles con neoplasia de tejidos blandos (HSA) se encontraban en remisión, sin invasión de musculatura hipaxial o espacio retroperitoneal ni linfadenopatías regionales (Figura 4B). Se realizó un estudio radiográfico torácico en el que ya no se apreciaron nodulaciones pulmonares (Figura 5).Se realizó ecocardiografía sin observarse alteraciones de la contractibilidad cardiaca.
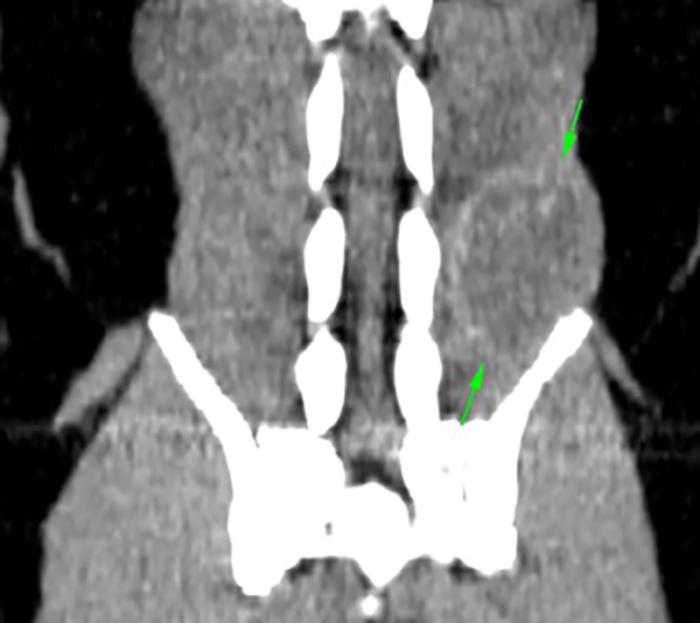
Figura 4. Imágenes del segundo TC.
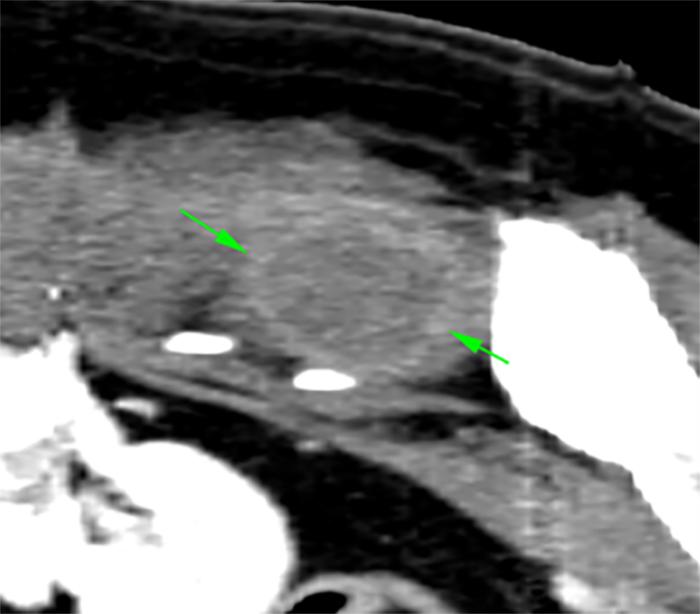
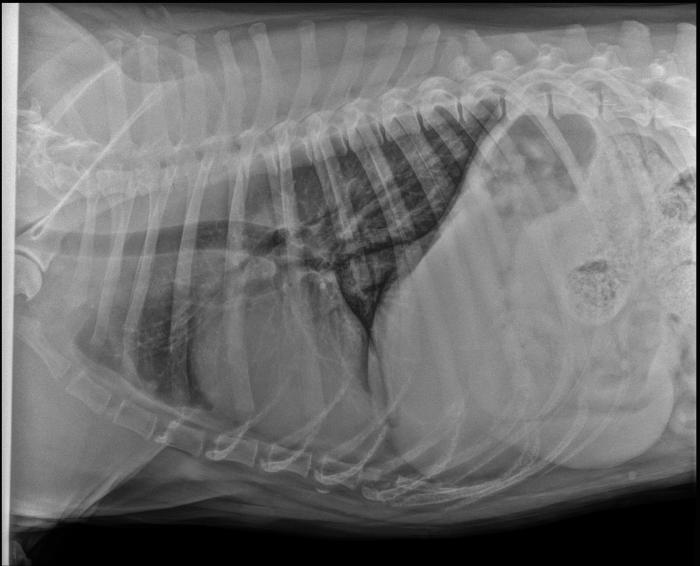
Figura 5. Radiografía laterolateral del tórax donde no se aprecian lesiones pulmonares.
Ante esta evolución, se decidió continuar con el mismo protocolo dos ciclos más. Tras el sexto ciclo, se realizó una ecocardiografía de control, hallando una enfermedad mitral degenerativa en fase B1, con disfunción sistólica moderada, identificando algunos complejos supraventriculares prematuros, por lo que se optó por cambiar de protocolo. Se barajó la utilización de epirrubicina aunque por dificultades en su obtención, se decidió administrar Carboplatino a una 300 mg/m2 IV cada 3 semanas, basándonos en un estudio retrospectivo sobre 18 casos realizado por Faulhaber EA y colaboradores del año 2021, en el que se vio una supervivencia similar en el grupo de esplenectomía más doxorrubicina y en el que se trató con esplenectomía y carboplatino en pacientes con HSA de bazo5. Además, se comenzó a administrar pimobendan (Vetmedin ®).
Se realizó una analítica sanguínea completa y se apreció un aumento importante de las globulinas. Ante la sospecha de un empeoramiento de su leishmaniosis previamente diagnosticada y tratada, se realizó una titulación y un proteinograma cuyos resultados reflejaron un aumento de dicha titulación y un pico monoclonal importante de gammaglobulinas. Se informó de este hecho a los propietarios y al tratamiento antineoplásico se le añadió el tratamiento de la leishmaniosis (alopurinol a 10 mg/kg PO BID sin fecha de retirada y antimoniato de meglumina (Glucantime ®) SC SID a 100 mg/kg durante 28 días).
Como macroscópicamente se había comprobado una disminución evidente de la masa palpable, se decidió no parar ni modificar el tratamiento antineoplásico.
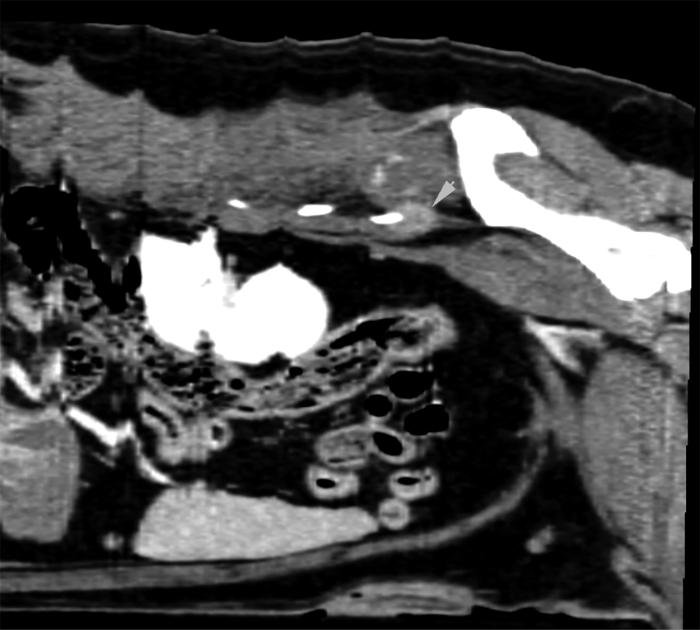
A los dos meses de este nuevo protocolo (3 ciclos) se realizó otra TC de control, hallando en este una lesión en músculo cuadrado lumbar izquierdo de 1.7 cm (long.) x 1,5 cm (anch.) x 1,2 cm (alt.), isoatenuante, de bordes irregulares y con leve realce en anillo en fases postcontraste (Figura 6A); además de cambios en musculatura epaxial izquierda a nivel de L6, donde se observaron cambios compatibles con infiltración grasa (Figura 6B). Estos cambios eran compatibles con remisión de la lesión inicial.
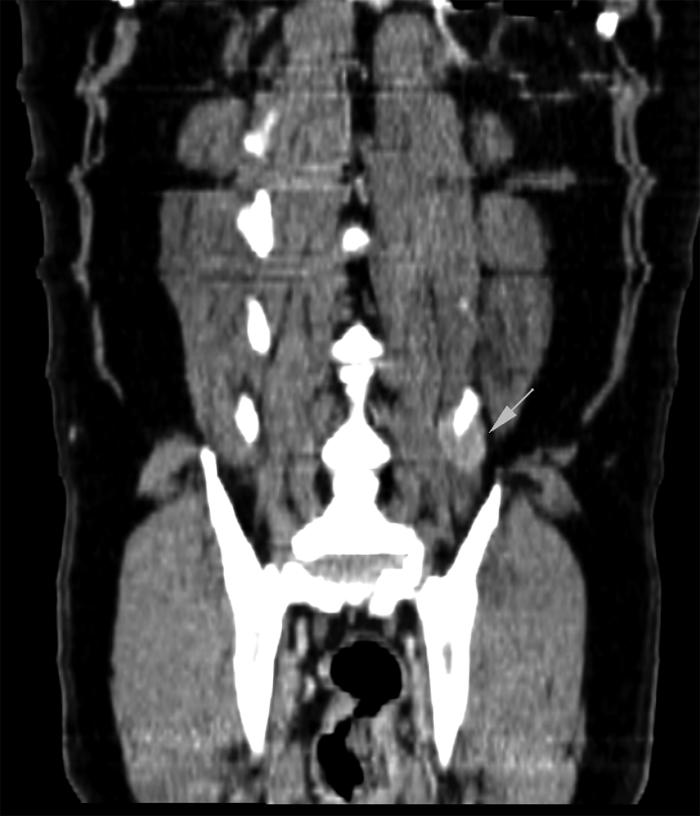
Figura 6. Imágenes del tercer TC.
A las 3 semanas, acudió de urgencias al hospital por presentar tos. En la exploración se apreció reflejo tusígeno positivo y en las radiografías torácicas se vio un patrón broncointersticial compatible con una bronconeumonía, por lo que se suspendió el tratamiento antineoplásico, comenzando con un tratamiento con cefalexina y enrofloxacina PO. En el hemograma solamente se apreció una anemia leve no regenerativa y una discreta leucocitosis con neutrofilia. Dieciséis días después, acudió de nuevo por haber presentado un síncope y melena, mostrando en analítica sanguínea una anemia no regenerativa severa y leve hipoalbuminemia. Se procedió a la realización de transfusión de concentrado eritrocitario (2 unidades), y se realizó una ecografía abdominal que no mostró datos reseñables. Se comenzó con tratamiento sintomático, pautando protector de estómago (Vetgastril ®) y metronidazol (Metrobactin ®) oral ambulatorio.
Se le revisó con hemograma a los 3 y 6 días, estando estable tanto clínica como analíticamente. Pero 6 días más tarde empeoró la sintomatología, confirmándose un empeoramiento de la anemia, pero esta vez fuertemente regenerativa, leucocitosis y neutrofilia, aunque acompañadas de una hipoalbuminemia severa, por lo que se estabilizó con transfusión de plasma fresco congelado (3 unidades) y se realizó una esófago-gastro-duodeno-endoscopia en la que no se apreciaron lesiones que justificaran la sintomatología, por lo que se continuó el tratamiento junto con la reintroducción del ácido tranexámico.
Al día siguiente empeoraron los síntomas y los propietarios optaron por la eutanasia humanitaria.
Conclusión
Este caso clínico detalla el manejo de una neoplasia compatible con un HSA muscular metastásico en un perro con una supervivencia de 9 meses. A pesar de la detección en etapas avanzadas, con evidencia de metástasis a distancia, el tratamiento inicial con el protocolo VAC modificado mostró una remisión parcial notoria y una tolerancia aguda adecuada, aunque la doxorrubicina fue probablemente el causante de la insuficiencia cardiaca desarrollada.
Con la transición al carboplatino, debido a la cardiotoxicidad desarrollada por la doxorrubicina, se buscó mantener la buena respuesta obtenida con el protocolo VAC, y durante su utilización se consiguió ya que el animal fue eutanasiado debido a otros eventos no relacionados con la neoplasia, aunque, posiblemente, el tratamiento, influyera en los eventos que desencadenaron la pérdida de calidad de vida.
Bibliografía
- del Castillo N, del Portillo I. Revisión del hemangiosarcoma canino [Internet]. Portalveterinaria.com. 2015. Disponible en https://www.portalveterinaria.com/animales-decompania/articulos/24909/revision-del-hemangiosarcoma-canino.html
- Couto G, Moreno N. Oncología Canina y Felina. De la Teoría a la práctica [Internet]. Issuu. 2018. Disponible en https://issuu.com/editorialservet/docs/oncologia_practica
- Clifford CA, Mackin A, Henry C. Treatment of canine hemangiosarcoma: 2000 and beyond. J Vet Intern Med [Internet]. 2000; 14: 479–85. Disponible en https://onlinelibrary.wiley.com/doi/10.1111/j.1939-1676.2000.tb02262.x
- Szivek A, Burns R, Gericota B, et al. Clinical outcome in 94 cases of dermal haemangiosarcoma in dogs treated with surgical excision: 1993–2007. Vet Compar Oncol 2012; 10(1): 65–73. Disponible en https://pubmed.ncbi.nlm.nih.gov/22236371/
- Faulhaber EA, Janik E, Thamm DH. Adjuvant carboplatin for treatment of splenic hemangiosarcoma in dogs: Retrospective evaluation of 18 cases (2011-2016) and comparison with doxorubicin-based chemotherapy. J Vet Intern Med. 2021 Jul;35(4):1929-1934. doi: 10.1111/jvim.16212. Epub 2021 Jul 5. Erratum in: J Vet Intern Med. 2021 Nov;35(6):3205. PMID: 34227148; PMCID: PMC8295674.
 by Multimédica
by Multimédica