Tumor del estroma gastrointestinal en un perro: descripción histopatológica y marcadores inmunohistoquímicos
Resumen breve
Los tumores del estroma gastrointestinal (GIST) son neoplasias mesenquimales que afectan el tracto digestivo de diversas especies. Se caracterizan por la expresión de c-KIT (CD117) y su origen en las células intersticiales de Cajal. Este caso subraya la importancia del diagnóstico preciso en neoplasias gastrointestinales mediante histopatología e inmunohistoquímica, optimizando el tratamiento y la calidad de vida del paciente.Índice de contenidos

Resumen
Los tumores del estroma gastrointestinal (GIST) son neoplasias mesenquimales que afectan el tracto digestivo de diversas especies. Se caracterizan por la expresión de c-KIT (CD117) y su origen en las células intersticiales de Cajal. En perros, suelen localizarse en intestino y presentan un comportamiento clínico variable, con potencial metastásico. Se presenta el caso de un perro American Staffordshire terrier de 12 años con diarreas hemorrágicas persistentes. La evaluación clínica y ecográfica identificó una masa en el ciego, requiriendo abordaje quirúrgico. El análisis histopatológico reveló una neoplasia mesenquimal de células fusiformes y epitelioides, con un patrón estoriforme. La inmunohistoquímica mostró positividad para c-KIT y SMA, y negatividad para S100, confirmando el diagnóstico de GIST. El diagnóstico diferencial incluye leiomiosarcomas y tumores de la vaina nerviosa, diferenciables mediante inmunomarcadores específicos. La distinción entre GIST y otras neoplasias mesenquimales es clave, puesto que los primeros pueden responder a inhibidores de tirosina quinasa (TKI), mientras que el resto no. En medicina veterinaria, aunque el uso de TKI en GIST es prometedor, aún no existen protocolos terapéuticos estandarizados. Este caso subraya la importancia del diagnóstico preciso en neoplasias gastrointestinales mediante histopatología e inmunohistoquímica, optimizando el tratamiento y la calidad de vida del paciente.
Introducción
Los tumores del estroma gastrointestinal (GIST) son neoplasias mesenquimales que afectan el tracto digestivo de los humanos, perros, gatos y caballos, entre otras especies1. Son tumores pleomórficos caracterizados por la expresión de la proteína c-KIT (antígeno CD117), que es un receptor tirosina quinasa codificada por el protooncogen c-KIT2. Se cree que estos tumores se originan en las células intersticiales de Cajal encargadas de regular la motilidad intestinal1-3. En perros, la mayoría de los GIST se originan en el intestino grueso, principalmente en el ciego, seguido en menor medida por el intestino delgado y el estómago1,2. Sin embargo, en humanos, los GIST se localizan predominantemente en el estómago y, con menor frecuencia, en el intestino delgado y grueso1,3. Estos tumores presentan un comportamiento clínico muy variable, que va desde casos asintomáticos hasta formas agresivas con alta capacidad metastásica. En aproximadamente el 28 % de los casos, se observa metástasis, afectando principalmente al hígado, los ganglios linfáticos mesentéricos y el omento4.
Caso clínico
En junio de 2024, un perro macho castrado de 12 años, de raza American Staffordshire terrier, fue remitido al Servicio de Oncología del Hospital IVC Evidensia Aúna Especialidades Veterinarias (Valencia) debido a la presencia de un cuadro de diarreas hemorrágicas persistentes durante un mes. Ante la cronicidad de los síntomas y la sospecha de una patología gastrointestinal subyacente, se realizaron más pruebas diagnósticas. Durante la evaluación clínica y ecográfica, se identificó una masa de aproximadamente 3 cm de diámetro en el ciego, localizada en proximidad a la válvula ileocecal. Este hallazgo sugería una posible obstrucción parcial o una alteración funcional en el tránsito intestinal, explicando el cuadro clínico del paciente.
La ubicación de la masa y la persistencia de los signos clínicos hicieron necesario un abordaje quirúrgico para su extirpación y posterior análisis histopatológico. Se realizó una enterectomia de íleon, ciego y colon, incluyendo la válvula ileocecal y la masa, y se llevó a cabo una anastomosis terminoterminal ileocólica. La cirugía permitió obtener muestras del tejido afectado, cuyo estudio histológico era fundamental para determinar la naturaleza de la lesión y establecer el tratamiento más adecuado. Se remite al Servicio de Anatomía Patológica del Hospital Clínico Veterinario CEU, un tramo de intestino fijado en formol al 10 %, que contenía una porción de íleon, ciego y colón de 11 x 2.5 x 1 cm con una masa de 3 cm de diámetro localizado en ciego junto con adherencias del omento (Figura 1).
![Figura 1. A la izquierda, masa localizada en el ciego de 3 cm de diámetro (flechas blancas) [imagen cedida por el Servicio de Oncología del Hospital Veterinario IVC Evidensia Aúna Especialidades Veterinarias (Valencia)]. A la derecha, pieza remitida y fijada en formol al 10 %. Corte transversal de la masa (asterisco), ciego (punta de flecha) y colon (flecha). La neoplasia tiene un color blanco homogéneo, y macroscópicamente se identifica que su origen está en la submucosa/muscular, sin involucrar la mucosa.](https://revistas-veterinaria.multimedica.es/fotografies/petites/41839figura-1.jpg)
Figura 1. A la izquierda, masa localizada en el ciego de 3 cm de diámetro (flechas blancas) [imagen cedida por el Servicio de Oncología del Hospital Veterinario IVC Evidensia Aúna Especialidades Veterinarias (Valencia)]. A la derecha, pieza remitida y fijada en formol al 10 %. Corte transversal de la masa (asterisco), ciego (punta de flecha) y colon (flecha). La neoplasia tiene un color blanco homogéneo, y macroscópicamente se identifica que su origen está en la submucosa/muscular, sin involucrar la mucosa.
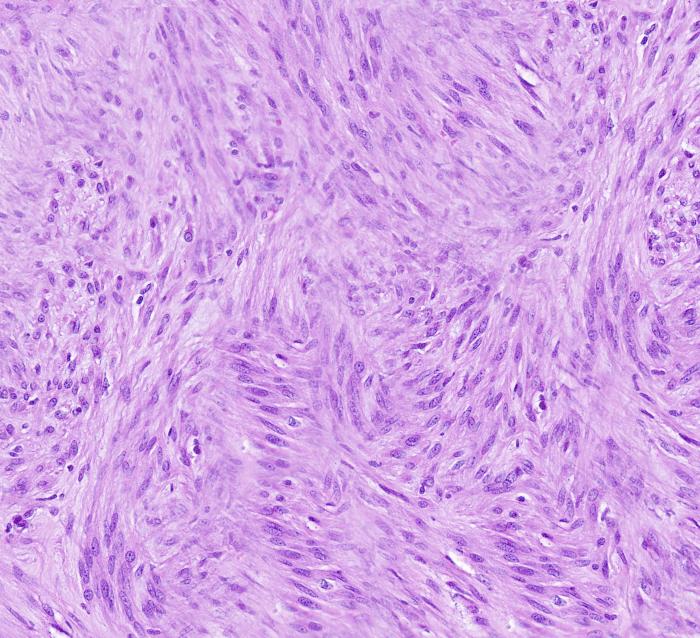
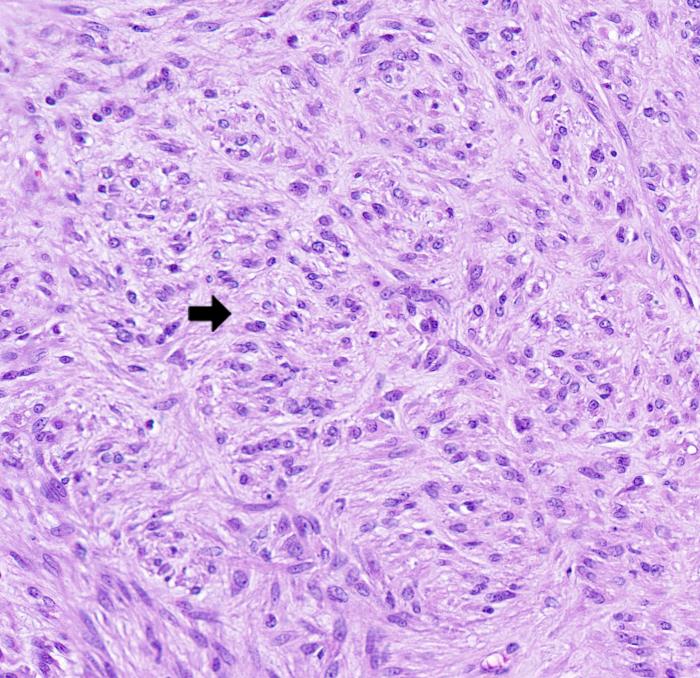
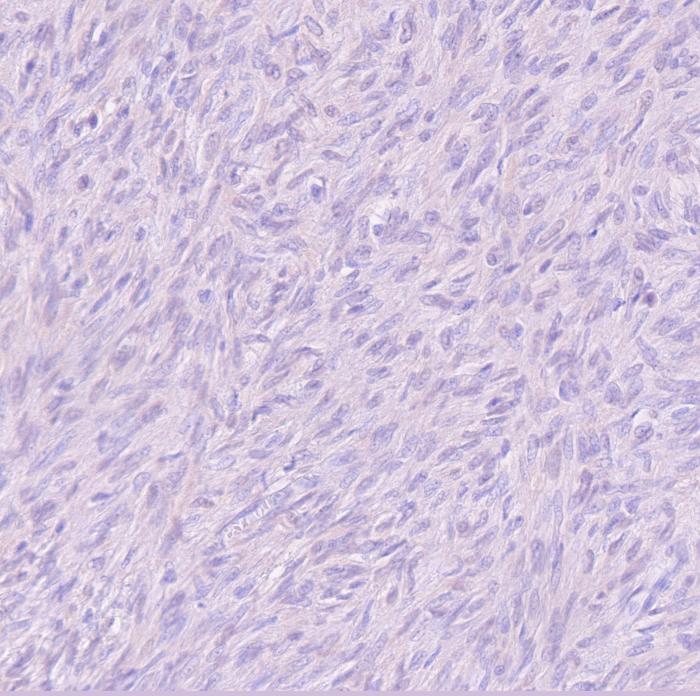
Histológicamente, en el ciego, expandiendo la submucosa, elevando la mucosa y reemplazando la túnica muscular, se observó una neoplasia moderadamente celular, bien delimitada y no encapsulada (Figura 2A). La neoplasia estaba formada por células fusiformes dispuestas de forma entremezclada en un patrón estoriforme o en espina de pescado y sustentadas por un abundante estroma fibroso (Figura 2B). Las células neoplásicas presentan una forma elongada, con márgenes pocos definidos, un moderado citoplasma eosinófilo con núcleo redondo-ovalado céntrico, 1-2 nucleolos y cromatina finamente punteada. Multifocalmente, entremezcladas con las células fusiformes se observaron células redondas poligonales organizadas en grupos. Estas células presentaban una forma redonda-poligonal, con márgenes pocos definidos, abundante citoplasma basófilo con un núcleo redondo-ovalado, 1-4 nucleolos y cromatina finamente dispersa (células epitelioides) (Figura 2C). Ambas poblaciones celulares presentan mínima anisocariosis y anisocitosis. No se observaron mitosis en 10 campos a 400x (2.37 mm2). Las células neoplásicas no invadieron los márgenes de resección. En la mucosa se observó la presencia de un infiltrado inflamatorio moderado formado principalmente por linfocitos y células plasmáticas. Estos hallazgos fueron compatibles con un tumor del estroma gastrointestinal (GIST). Histológicamente, el GIST es difícil de diferenciar de otros sarcomas de tejidos blandos como un leiomiosarcoma o un tumor de la vaina del nervio periférico. Por ello, se realizaron pruebas inmunohistoquímicas para la expresión de c-KIT, actina de músculo liso (SMA) y S100. Los GIST muestran marcaje positivo para c-KIT; el SMA suele expresarse en tumores de músculo liso como un leiomiosarcoma mientras que el S100 es un marcador inespecífico de células mesenquimales positivo en tumores de la vaina del nervio periférico. Estos dos últimos marcadores presentan un inmunomarcaje variable en el GIST. En este caso, la neoplasia fue positiva a c-KIT, SMA y negativo para S100 (Figura 2D-F).
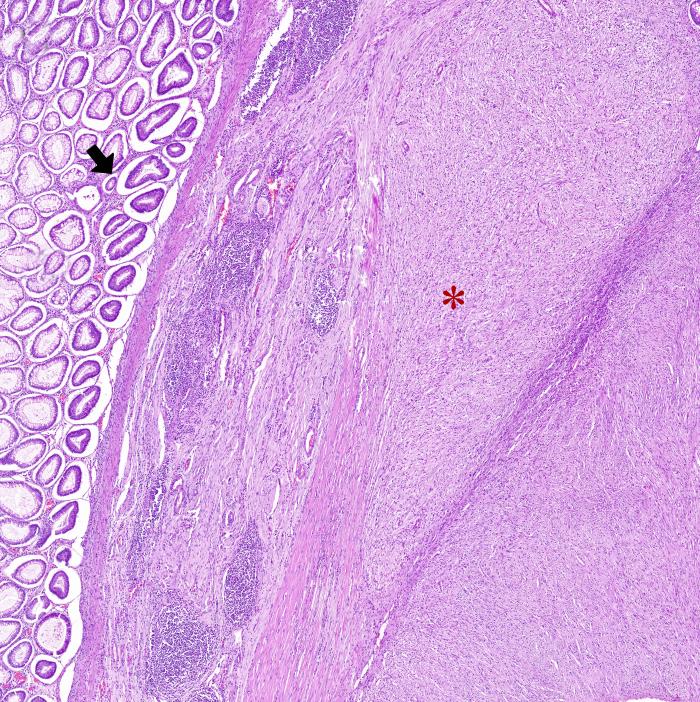
Figura 2. Imágenes histológicas de la neoplasia. (A) Neoplasia originada en la túnica muscular (asterisco) expandiendo la submucosa y sin infiltrar mucosa (flecha). Hematoxilina-Eosina (H-E). (B) Neoplasia compuesta por células fusiformes dispuestas de forma entremezclada. H-E. (C) Las células presentaban una forma redonda-poligonal (células epitelioides). H-E. (D) Inmunomarcaje positivo para c-KIT. (E) Inmunomarcaje positivo para SMA. (F) Inmunomarcaje negativo para S100.
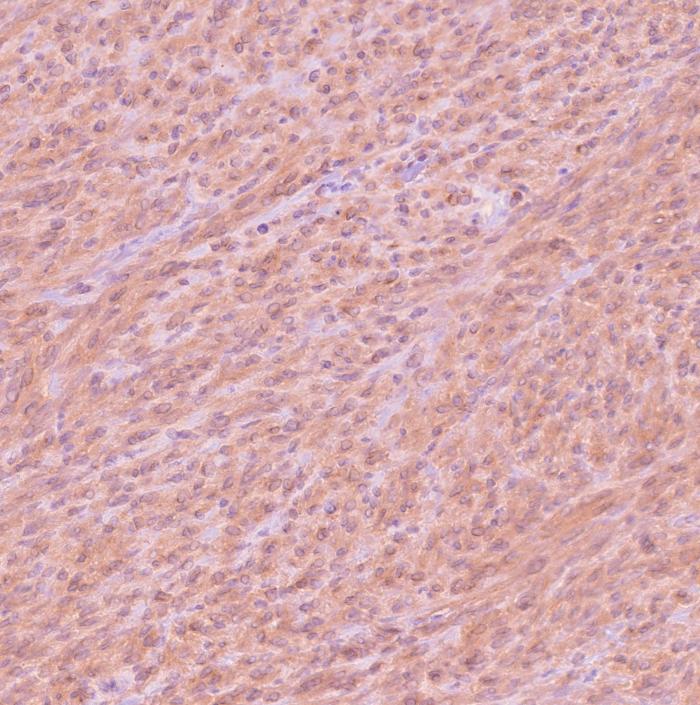
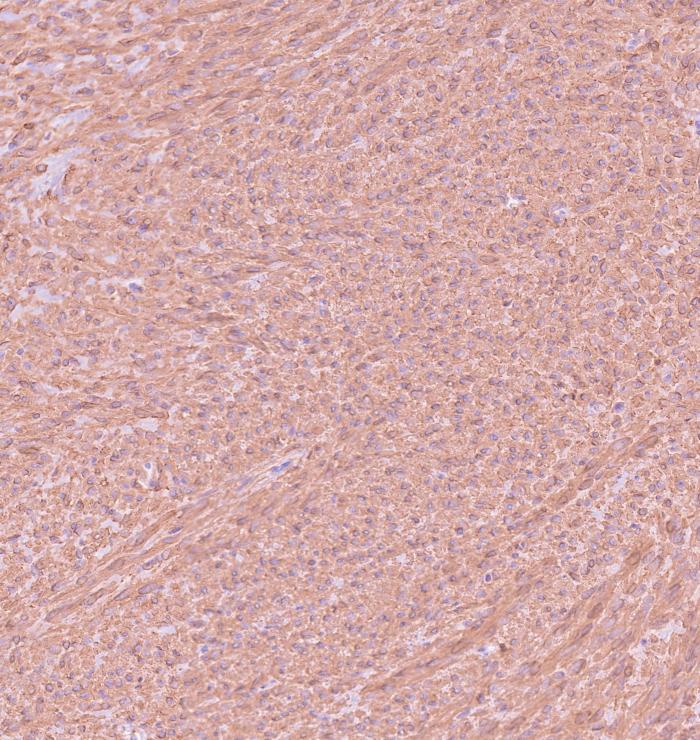
La presencia de inmunomarcaje positivo para c-KIT corroboró el diagnóstico de GIST. Estos hallazgos inmunohistoquímicos se resumen en la Tabla 1.
| Neoplasia | c-KIT | SMA | S100 |
|---|---|---|---|
| Tumor del estroma gastrointestinal (GIST) | + | +/- | +/- |
| Leiomiosarcoma | - | + | +/- |
| Tumor del nervio periférico | - | - | + |
Tabla 1. Marcadores inmunohistoquímicos utilizados en el caso clínico para el diagnóstico definitivo del GIST.
Discusión
Desde el punto de vista histológico, en humanos los GIST se subdividen en subtipos fusiformes, epitelioides, mixoides y fasciculares, mientras que en perros solo se han identificado los fusiformes y epitelioides, siendo el primero el más frecuente1-3. Los GIST fusiformes están formados por células alargadas dispuestas en un patrón estoriforme o de espina de pescado, rodeadas por un estroma denso de tejido conectivo fibroso1. Por otro lado, los GIST epitelioides, menos frecuentes, están compuestos por células redondas a poligonales, organizadas en láminas y separadas por un estroma fibroso o mixoide1,5. Estos patrones (fusiforme y epiteloide) se han observado en el caso clínico presentado.
Dado que los GIST y los leiomiosarcomas pueden presentar similitudes histológicas, su diferenciación precisa requiere una evaluación inmunohistoquímica2. Los leiomiosarcomas, a diferencia de los GIST, son tumores malignos que derivan del músculo liso y pueden encontrarse en el intestino y el estómago de los perros4. En términos de comportamiento, los leiomiosarcomas suelen ser más invasivos localmente, aunque con una menor tasa de metástasis en comparación con los GIST6. Histológicamente, están compuestos por células fusiformes dispuestas en haces, con citoplasma eosinofílico abundante y núcleos en forma alargada1.
La inmunohistoquímica es indispensable para distinguir un GIST de un leiomiosarcoma u otras neoplasias mesenquimales2,6,7. Los GIST son positivos para c-KIT (CD117), sin embargo, se estima que hasta el 10 % de los GIST humanos son negativos o solo débilmente positivos para la proteína c-KIT8-10. En estudios en medicina humana se ha identificado DOG1 como un marcador altamente sensible y específico para GIST humano10. Varios reportes recientes sugirieron que una evaluación combinada de tinción inmunohistoquímica para c-KIT y DOG1 es la forma más sensible para el diagnóstico de estos tumores en perros9. Por otro lado, los leiomiosarcomas son negativos para c-KIT, pero positivos para actina de músculo liso (SMA) y desmina8. Por lo tanto, un tumor de células fusiformes en el tracto digestivo que resulta positivo para c-KIT, independientemente de su positividad o negatividad para SMA, se clasifica como un GIST, como en el caso clínico descrito en este artículo. En cambio, si el tumor es positivo para SMA y desmina, pero negativo para KIT, se diagnostica como un leiomiosarcoma.
Otras neoplasias mesenquimales pueden formar parte del diagnóstico diferencial de los GIST además de los leiomiosarcomas, como los schwannomas, tumores malignos de la vaina nerviosa, fibrosarcomas o hemangiosarcomas. Los schwannomas y los tumores malignos de la vaina nerviosa son positivos para S100, pero negativos para c-KIT y SMA. En el caso clínico se realizó inmunohistoquímica para S100, un marcador útil para neoplasias de origen nervioso11. Dado que algunos patrones histológicos presentaban similitudes con un tumor maligno de nervio periférico, se decidió incluir este marcador en el análisis para ayudar con el diagnóstico. Los fibrosarcomas expresan vimentina, pero no c-KIT, SMA ni S100. En el caso de los hemangiosarcomas, la expresión de CD31 o Factor VIII es clave para diferenciarlos de otros tumores de células fusiformes1.
El avance en el conocimiento sobre los GIST ha permitido distinguirlos de los leiomiosarcomas, lo que es crucial no solo por razones diagnósticas, sino también terapéuticas. Esta diferenciación es de suma importancia, puesto que, a diferencia de los leiomiosarcomas, que no responden a los inhibidores de tirosina quinasa (TKI), los GIST con mutaciones en c-KIT pueden beneficiarse significativamente de este tratamiento12. Este hallazgo ha marcado una diferencia notable tanto en la medicina humana como en la veterinaria, subrayando la necesidad de un diagnóstico preciso para seleccionar el enfoque terapéutico más adecuado8.
En medicina humana, la terapia adyuvante basada en TKI se considera el estándar de cuidado para pacientes con alto riesgo de metástasis después de la cirugía, aquellos con metástasis presentes o para tumores no resecables o recurrentes2,12. Este enfoque terapéutico se basa en la efectividad de los TKI en GIST con mutaciones en c-KIT, diferenciándolos claramente de otras neoplasias mesenquimales que no responden a este tratamiento12,13.
En el ámbito veterinario, también se han observado beneficios clínicos con el uso de TKI en el tratamiento de GIST canino. En un caso reciente, un perro con un tumor no resecable tratado con TKI logró una remisión parcial durante 140 días2,13. Además, un estudio retrospectivo en 27 perros con GIST mostró beneficios clínicos significativos con el uso de TKI14. Sin embargo, aunque estos resultados son prometedores, aún no se han establecido protocolos estándar para el tratamiento médico de GIST con TKI en medicina veterinaria.
La resección completa con márgenes libres de tumor sigue siendo la mejor opción curativa tanto en perros como en humanos. Sin embargo, en más del 50 % de los pacientes humanos se observa recurrencia o metástasis tras la cirugía, y aproximadamente la mitad de los GIST presentan metástasis en el momento del diagnóstico5. En perros, aunque no existen marcadores establecidos para determinar la agresividad de estos tumores, algunos factores se han asociado con un comportamiento más invasivo, como un mayor tamaño tumoral, necrosis extensa, un índice mitótico elevado (≥ 5 mitosis por 10 campos de gran aumento) y una alta expresión del marcador de proliferación celular Ki-675,15,16. No obstante, aún no está claro si la localización específica dentro del tracto gastrointestinal influye en su evolución clínica. Además, hasta el momento no se dispone de datos concluyentes que permitan predecir con certeza el comportamiento clínico del GIST en perros tras la cirugía5,16.
Conclusión
En conclusión, los GIST y los leiomiosarcomas son neoplasias que, aunque comparten una apariencia histológica similar, difieren significativamente en sus orígenes celulares, comportamientos biológicos y opciones terapéuticas. La correcta caracterización de estas neoplasias mediante inmunohistoquímica es fundamental para establecer un diagnóstico preciso y determinar el tratamiento más adecuado para cada caso, ya que mientras los leiomiosarcomas no responden a inhibidores de tirosina quinasa (TKI), los GIST con mutaciones en c-KIT pueden beneficiarse significativamente de este tratamiento.
Este caso pone de relieve la importancia de una detección temprana y un manejo integral de las alteraciones gastrointestinales en perros. Síntomas como diarrea crónica, presencia de sangre en las heces o pérdida de peso pueden ser indicativos de patologías subyacentes que requieren una evaluación exhaustiva. La combinación de técnicas de imagen, y el análisis histopatológico desempeña un papel clave en la identificación de masas intestinales y en la toma de decisiones terapéuticas adecuadas.
Bibliografía
- Meuten DJ. Tumors in Domestic Animals. Fifth edition. Ames, IO: Wiley Blackwell. 2017.
- Montañés I, Vila A, Roura X, Santos LS, Canturri A, Verdes JM, Martín LZ, Bertrana CD, Roca AL. Gastrointestinal stromal tumors (GIST): retrospective study of 6 dogs. Clin Vet Peq Anim 2019; 39(3):155-161.
- Parab TM, DeRogatis MJ, Boaz AM, et al. Gastrointestinal stromal tumors: a comprehensive review. J Gastrointest Oncol 2019; 10:144-154.
- Hanazono K, Fukumoto S, Hirayama K, et al. Predicting metastatic potential of gastrointestinal stromal tumors in dogs by ultrasonography. J Vet Med Sci 2012; 74:1477-82.
- Irie M, Tomiyasu H, Tsujimoto H, Kita C, Kagawa Y. Prognostic factors for dogs with surgically resected gastrointestinal stromal tumors. J Vet Med Sci 2021; 83(9):1481-1484. doi: 10.1292/jvms.20-0727.
- Russell K, Mehler S, Skorupski K, et al. Clinical and immunohistochemical differentiation of gastrointestinal stromal tumors from leiomyosarcomas in dogs: 42 cases (1990–2003). J Am Vet Med Assoc 2007; 230(9):1329-1333.
- Maas CPHJ, Haar GT, Van Der Gaag I, Kirpensteijin J. Reclassification of small intestinal and cecal smooth muscle tumors in 72 dogs: clinical, histological, and immunohistochemical evaluation. Vet Surg 2007; 36:302-313.
- Corless CL. Gastrointestinal stromal tumors: what do we know now?.Modern Pathology 2014; 27:1-16.
- Dailey DD, Ehrhart EJ, Duval DL, Bass T, Powers BE. DOG1 is a sensitive and specific immunohistochemical marker for diagnosis of canine gastrointestinal stromal tumors. J Vet Diagn Invest 2014; 26:480-486.
- Novelli M, Rossi S, Rodriguez-Justo M, Tañere P, et al. DOG1 and CD117 are the antibodies of choice in the diagnosis of gastrointestinal stromal tumours. Histopathology2010; 57:259-270.
- Lanigan LG, Russell DS, et al. Comparative Pathology of the Peripheral Nervous System. Vet Pathol 2021; 58(1):10-33.
- Elliot JW, Swinbourne F, Parry A, Baines L. Successful treatment of a metastatic gastrointestinal stromal tumour in a dog with Toceranib phosphate (Palladia). J Small Anim Pract 2017; 58:416-418.
- Kobayashi M, Kuroki S, Ito K, et al. Imatinib-associated tumour response in a dog with a non-resectable gastrointestinal stromal tumour harbouring a c-kit exon 11 deletion mutation. Vet J 2013; 198:271-4.
- Berger EP, Johannes CM, Jergenes AE, et al. Retrospective evaluation of toceranib phosphate (Palladia) use in the treatment of gastrointestinal stromal tumors of dogs. J Vet Intern Med 2018; 32:2045-2053.
- Zhao WY, Xu J, Wang M, Zhang ZZ, Tu L, Wang CJ, Lin TL, Shen YY, Liu Q, Cao H. Prognostic value of Ki67 index in gastrointestinal stromal tumors. Int J Clin Exp Pathol. 2014 Apr 15;7(5):2298-304.
- Del Alcazar CM, Mahoney JA, Dittrich K, Stefanovski D, Church ME. Outcome, prognostic factors and histological characterization of canine gastrointestinal sarcomas. Vet Comp Oncol. 2021 Sep;19(3):578-586.
 by Multimédica
by Multimédica
