Factores clinicopatológicos asociados a mortalidad y duración de hospitalización en cachorros con gastroenteritis hemorrágica y leucopenia
Resumen breve
La gastroenteritis hemorrágica aguda (GHA) en cachorros es una causa común de hospitalización en unidades de cuidados intensivos veterinarios. Se han asociado múltiples posibles agentes etiológicos a estos cuadros siendo los de mayor gravedad los producidos en animales menores de 6 meses. El Parvovirus canino es uno de los agentes etiológicos más comúnmente asociado a los cuadros de GHA en los cachorros. La destrucción de las criptas intestinales producida por este virus junto con la destrucción…Índice de contenidos
Introducción
La gastroenteritis hemorrágica aguda (GHA) en cachorros es una causa común de hospitalización en unidades de cuidados intensivos veterinarios. Se han asociado múltiples posibles agentes etiológicos a estos cuadros siendo los de mayor gravedad los producidos en animales menores de 6 meses. El Parvovirus canino es uno de los agentes etiológicos más comúnmente asociado a los cuadros de GHA en los cachorros. La destrucción de las criptas intestinales producida por este virus junto con la destrucción de la médula ósea con la consecuente neutropenia hace que los cachorros afectados sean vulnerables a la translocación de bacterias y endotoxinas. En los casos más graves pueden aparecer complicaciones como el síndrome de respuesta inflamatoria sistémica, sepsis y fallo orgánico múltiple. Si bien la principal causa de GHA y neutropenia en cachorros es el parvovirus, esta no es la única ya que se ha reportado también la presencia de leucopenia y necrosis en la médula ósea en cachorros con gastroenteritis por coronavirus. Estos casos posiblemente resulten de la misma gravedad que los casos graves de parvovirus ya que la neutropenia junto con la hemorragia digestiva son los predisponentes a la sepsis. Por otro lado, no todos los casos de parvovirus se asocian a neutropenia. Esta alteración suele observarse fundamentalmente en los casos graves. Al conocimiento de los autores un solo trabajo ha caracterizado los factores de riesgo que afectan la mortalidad y la duración de la hospitalización en caninos con parvovirus. En ese trabajo se evaluaron factores clínico-patológicos al ingreso de la hospitalización encontrándose que aquellos caninos que cumplían 3 o más criterios de SIRS tenían una mayor mortalidad, mientras que aquellos que presentaban vómitos, depresión del sensorio, hipoalbuminemia y linfopenia tenían una mayor duración de la hospitalización. En ese trabajo se incluyeron 11% de caninos de más de 6 meses de edad, 18% de los incluidos no tenían diarrea hemorrágica y solo tenían leucopenia un 35 % de los casos. En otro estudio realizado en cachorros con parvovirus se encontró que el recuento total de leucocitos, y el de diferentes líneas celulares (particularmente linfocitos) tienen implicancias pronosticas importantes. Sin embargo, en este estudio, ningún animal del grupo de sobrevivientes presentó leucopenia. Teniendo en cuenta estos datos se podría concluir que la población de cachorros con mayor gravedad podría no estar del todo bien representada en esos estudios. Por otro lado, muchos cachorros con GHA requieren una hospitalización de varios días pudiendo presentar diferentes complicaciones graves que no presentaban al ingreso (insuficiencia renal aguda, requerimiento de vasopresores, requerimiento de transfusiones de plasma, etc) durante su estadía en cuidados intensivos. El objetivo del presente estudio fue evaluar factores clinicopatológicos al ingreso y durante la hospitalización asociados a la mortalidad y la duración de la internación en cachorros con GHA y leucopenia severa con neutropenia.
Materiales y métodos
Se realizó un estudio de cohorte retrospectiva. Se evaluaron los caninos hospitalizados entre el 1 de septiembre del 2014 al 29 de noviembre del 2018 en el centro de cuidados intensivos UCIcoop (Directorio 1308, CABA. Argentina). Se incluyeron en el estudio los caninos derivados para hospitalización con un cuadro de GHA que tuvieran una edad menor o igual a los 6 meses, que presentaran leucopenia con neutropenia y que presentaran registros de una evaluación de gases en sangre venosa al momento del ingreso hospitalario y múltiples evaluaciones de variables clinicopatológicas durante la hospitalización. Se excluyeron aquellos caninos con diagnóstico confirmado de Distemper, Ehrlichia y Hepatozoon y a aquellos caninos que se externaron por motivos económicos sin el alta médica. Todos los datos fueron recolectados de las historias clínicas y fueron pasados inicialmente a un standardized data sheet para posteriormente ser exportados a un software estadístico comercial (STATA.13.0).
Manejo médico
El manejo habitual de pacientes con GHA en UCIcoop incluye la administración endovenosa de cristaloides (solución Ringer Lactato), antieméticos (ondansetrón, maropitant y metoclopramida), antiácidos (ranitidina u omeprazol) y antibióticos. En pacientes que presentan neutropenia afebril se administra sulfadimetoxina - trimetoprima junto con metronidazol. En presencia de leucopenia y dos o más registros de hipertermia consecutivos se realiza un cambio de protocolo antibiótico a ceftriaxona combinada con amikacina y metronidazol. También se realiza el cambio de antibióticos ante la sospecha de disfunción orgánica por sepsis. Se recomienda la colocación de una sonda-nasogástrica en forma precoz durante la hospitalización para extraer el residuo gástrico y alimentar. La extracción del residuo gástrico se suele realizar cada 4 horas. Cuando este es menor a 0,5 ml/kg/hora se inicia una micronutrición enteral mediante la administración en forma continua o intermitente de una solución de dextrosa al 5%. Cuando el animal tolera durante 8 horas consecutivas la micronutrición enteral (sin presentar vómitos, regurgitaciones o aumentar el residuo gástrico a más de 0,5 ml/kg/hora) se inicia la administración de alimento líquido. Los niveles sanguíneos de glucemia se evalúan múltiples veces al día según necesidad. Ante un registro de hipoglucemia se administra un bolo de glucosa hipertónica (1 ml/kg de dextrosa al 25% diluida hasta llevarla al 10%) y posteriormente se suplementa el suero desde el 2,5% hasta 10% según necesidad (en el caso de utilizar concentraciones de dextrosa mayores al 5 % en la solución de ringer lactato se coloca un acceso vascular central para evita flebitis asociada a un aumento marcado de la osmolaridad de la solución). En aquellos pacientes que presentan trastornos hemodinámicos y/o de la perfusión tisular suele evaluarse en forma periódica los niveles de lactato en sangre con el objetivo de normalizarlo. Dicha medición se realiza habitualmente mediante extracción de sangre yugular por punción o mediante la extracción de sangre de la vena cava craneal desde un acceso vascular central. En aquellos pacientes que presentan hipotensión (presion arterial sistolica menor 90 mmHg) a pesar de estar adecuadamente resucitados con fluidos, se utiliza noradrenalina administrada a través de un acceso vascular central a dosis de 1 a 2 ug/kg/min. En presencia de hipotensión refractaria a la dosis máxima de noradrenalina suele agregarse dopamina (10 mcg/kg/min) junto con hidrocortisona (1 mg/kg cada 6 horas). Se realizan transfusiones de plasma ante valores de albúmina menores o iguales a 2 mg/dl y se realizan transfusiones de sangre ante valores de hematocrito menores a 20 % o valores de hemoglobina menores a 7 mg/dl, junto con la presencia de hiperlactatemia (mayor a 2,5 mmol/l) y/o disminución de la saturación venosa de oxígeno (SVO2) (menor o igual a 68%). Se utilizan como analgésicos de primera instancia tramadol (2 a 4 mg/kg) junto con maropintant. El dolor se evalúa periódicamente mediante el empleo de una escala de dolor previamente validada (Escala Melbourne). Cuando se requieren realizar rescates analgésicos suele utilizarse morfina (0,4 a 1 mg/kg IM cada 4 horas.) A aquellos pacientes que presentan valores de la escala de dolor mayores o iguales a 7 a pesar de recibir dosis altas de morfina se les administra un goteo analgésico Ketamina (10 μg/kg/min), xilacina (1,5 μg/kg/min) y lidocaína (20 μg/kg/min).. Se suplementa cloruro de potasio al suero utilizando como guía la concentración sérica del mismo según lo propuesto previamente (Di Bartola, 2012).
Se realizan evaluaciones de sangre cada 24 hs de las siguientes variables: Hemograma, recuento plaquetario, creatinina, albúmina y potasio. Cada 24 a 48 horas se realiza una evaluación de gases en sangre venosa que incluye lo valores de: pH, PCO2, PO2, bicarbonato, déficit de base extracelular, hematocrito, hemoglobina, cloro, sodio, potasio, calcio ionizado, lactato, glucemia y creatinina. Adicionalmente, se evalúan múltiples veces al día los valores de glucemia y de lactato según necesidad.
Principales Variables evaluadas
Para las siguientes variables se registró el menor valor obtenido durante la hospitalización: Recuento de Leucocitos, neutrófilos en banda, Linfocitos, recuento plaquetario, albúmina. Para las siguientes variables se registró el mayor valor obtenido durante la hospitalización: número de disfunciones orgánicas, creatininemia, lactatemia, número de hipoglucemias (se consideró hipoglucemia valores menores o iguales a 70 mg/dl). Se registró el valor al ingreso hospitalario de las siguientes variables: sodio (mEq/L), potasio (mEq/L), cloro (mEq/L), calcio ionizado (mmol/L), pH, bicarbonato (mmol/l), déficit de base extracelular, PCO2 (mmHg), SVO2 (%), anión gap (mmol/L), lactato (mmol/l).
Las siguientes variables obtenidas durante la hospitalización se registraron como variables dicotómicas (1:si/0:no): administración de plasma, transfusión de sangre, aumento de enzimas hepáticas (ALT y/o AST), aumento de bilirrubinas (>0.7 mg/dl) y/o presencia de suero ictérico, hipertermia (definida como la presencia de 2 o más registros de temperatura mayores o iguales a 39 °C, cambio de protocolo antibiótico, uso de micronutrición enteral, empleo de vasopresores, uso de morfina, uso de goteo analgésico.
Se definió la presencia de síndrome de respuesta inflamatoria sistémica (SIRS) tal como fue propuesto previamente por Iris Kalli (2010): presencia de tres o más de los siguientes parámetros al ingreso de la hospitalización: frecuencia cardíaca >140 latidos/min, frecuencia respiratoria >30 respiraciones/min, temperatura >39.2 C (102.5 F) or <37.8 C (100.0 F) y glóbulos blancos (WBC) >17,000 o <6000 celulas/lL. La presencia de disfunción orgánica fue definida realizando una adaptacion de lo propuesto previamente por Troia et al. (2018): Se definió la presencia de disfunción respiratoria como la presencia de valores de SpO2 menores a 95% respirando aire ambiental, o la presencia de suplementación con oxígeno o el empleo de asistencia ventilatoria mecánica. Se definió disfunción hepática como la presencia de valores de bilirrubina en suero mayores a 0.7 mg/dl o la presencia de suero ictérico en ausencia de obstrucción biliar y/o hemólisis. Injuria renal aguda se definió como la presencia de niveles séricos de creatinina (sCr) >1.8 mg/dl y/o un aumento de sCr de ⩾0.3 mg/dl desde los valores basales, o la presencia de oliguria (diuresis <1 ml/kg/h durante 6 h). La Disfunción cardiovascular se definió como la presencia de hipotensión (presión arterial sistólica <90 mmHg) en pacientes correctamente volemizados con requerimiento de vasopresores. Dentro de la evaluación de las disfunciones orgánicas no se incluyó el monitoreo de la coagulación debido a que no se realizó de manera rutinaria en esta cohorte de pacientes. No se consideró la caída del recuento plaquetario como indicador de disfunción de la coagulación debido a que esto podría ser provocado por la depleción de la médula ósea inducida por el virus y no necesariamente como una disfunción orgánica de la coagulación.
Análisis estadístico
Las variables cualitativas se expresaron en frecuencia absoluta y relativa. Las variables cuantitativas se expresaron en media y desvío standard o mediana e intervalo interquartilo según distribución. La distribución de las variables se evaluó mediante la observación de histogramas y el test de Shapiro-Wilk. Las comparaciones entre dos grupos se realizaron con el Wilcoxon Rank Sum test o el T test según distribución. Las variables que presentaron distribución normal pero que tuvieron varianzas desiguales se analizaron con el Test de Welch. Las variables cualitativas se evaluaron mediante el empleo del test exacto de Ficher o chi cuadrado según corresponda.
Manejo de datos faltantes
Para el análisis multivariable, las variables con poca cantidad de datos faltantes como: Peso 2/48 (4,16%), número de hipoglucemias 2/48 (4,16%), menor albúmina 1/48 (2,1%), creatinina 1/48 (2,1%), % cambio de creatinina 3/48 (6,25%), y calcio ionizado 3/48 (6,25%), fueron completadas mediante imputación simple utilizando la media de cada grupo (fallecido vs sobreviviente). Las variables con mayor número de datos faltantes fueron excluidas del análisis.
Análisis multivariable
Para evaluar factores asociados a la mortalidad hospitalaria se realizó una regresión logística. Se evaluaron como posibles variables explicativas todas las variables descriptas previamente, con excepción de aquellas que presentaron un alto número de datos faltantes ((neutrófilos en banda, segmentados y linfocitos 28/48 (58,3%), aumento de enzimas hepáticas 10/48 (20,83%), AGAP 11/48 (22,91%) y cloro 11/48 (22,91%)). Las variables predictoras candidatas se rankearon inicialmente de acuerdo a lo observado en el análisis bivariado. Para la selección del modelo final se utilizó el Bayesian In- formation Criterion (BIC). Se evaluó la presencia de múltiples interacciones. Se consideró como mejor modelo el que generó el menor valor de BIC. El test de Hosmer-Lemeshow se utilizó para evaluar el correcto ajuste del modelo. El área bajo la curva tipo ROC y la Tabla de clasificación (utilizando como punto de corte 0,5) se utilizaron para evaluar la capacidad predictiva del modelo final. Se reportaron los odds ratios (OR) y el 95% CI de las variables seleccionadas.
Para evaluar factores asociados a la duración de la hospitalización se construyó una regresión lineal múltiple. La variable dependiente fue duración de hospitalización medida en horas. Las variables independientes evaluadas fueron las mismas que fueron utilizadas en la regresión logística. Se evaluó la presencia de múltiples interacciones. El cumplimiento del supuesto de homocedasticidad de los residuos se confirmó mediante la evaluación del gráfico de residuos. El cumplimiento del supuesto de normalidad de los residuos se confirmó mediante el test de Shapiro Wilk y la evaluación de histogramas.
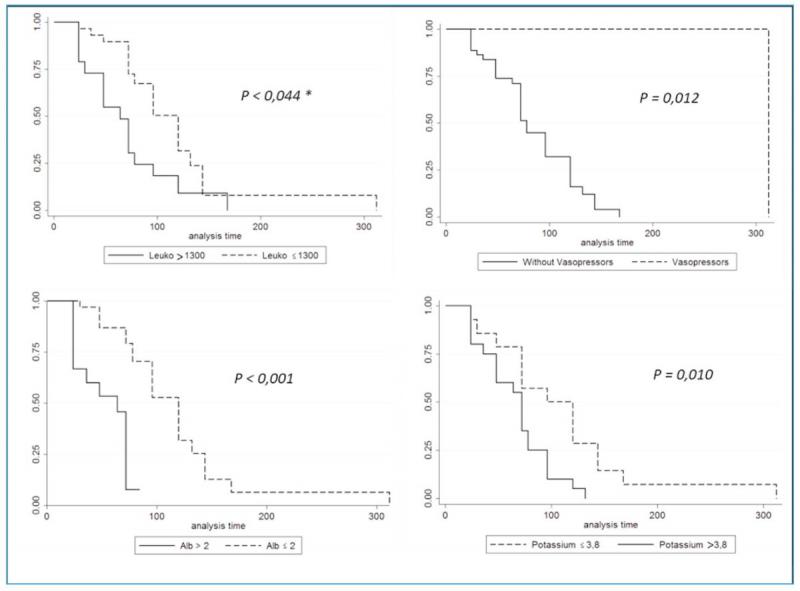
Finalmente, con las variables obtenidas en la regresión lineal que tuvieron significación estadística se construyeron gráficos de Kaplan Meier. Para la construcción de dichos gráficos se utilizaron puntos de corte de las variables analizadas según relevancia clínica o mediante la evaluación de curvas tipo ROC. Las curvas de los gráficos de Kaplan Meier se compararon mediante el log Rank test.
Resultados
Se evaluaron como población elegible un total de 51 caninos. Un canino fue excluido por presentar diagnóstico de Distemper, otro por presentar diagnóstico de Hepatozoon y un tercer canino por haber sido externado por motivos económicos. La población de estudio final fue de 48 caninos. Treinticuatro caninos fueron dados de alta (70,83%) y 14 (29,17%) fallecieron durante la hospitalización. Las razas registradas fueron: Beagle 3 (6,25%); Border collie 2 (4,17%); Boxer 1 (2,08%); Bull dog francés 2 (4,17%); Bull dog inglés 3 (6,25%); Bull terrier 1 (2,08%); Caniche 12 (25%); Cocker Spaniel 3 (6,25%); Daschund 1 (2,08%); Labrador 2 (4,17%); mestizo 13 (27,08%); Pitt Bull 2(4,17%); Schnauzer mini 1 (2,08%); Yorkshire 2 (4,17%).
Los caninos que fallecieron fueron significativamente más jóvenes y de menor peso que los que fueron dados de alta. (Ver tabla 1). El total de variables analizadas en el análisis bivariado se muestran en la Tabla 1.
| Tabla 1. Datos demográficos y variables clínico-patológicas de caninos de edad menor o igual a seis meses hospitalizados con gastroenteritis hemorrágica aguda y leucopenia con neutropenia. |
| Variable | Sobrevivió (N=34) | Falleció (N=14) | P valor |
| Edad (meses) N (%) | 3 (2-4) | 2 (1,66-3,00) | 0,036 |
| Peso (Kg) Mediana (IQR) | 3,05 (1,6-6,2) | 1,88 (0,8-2,7) | 0,017 |
| Hembras N (%) | 16 (34,4%) | 3 (6,12%) | 0,073 |
| Leucocitos* Mediana (IQR) | 1300 (928-2200) | 600 (300-1200) | 0,024 |
| Neutrófilos en banda* Mediana (IQR) | (0-60) N=14 | (0-64) N=3 | 0,717 |
| Neutrófilos* segmentados Mediana (IQR) | 720 (480-1640) N=17 | 1232 (806-1652) N=3 | 0,324 |
| Linfocitos* Mediana (IQR) | 576 (252-1120) N=16 | 610 (346-1912) N=3 | 0,570 |
| Plaquetas* Mediana (IQR) | 162500 (110000-218000) | 90000 (72000-18000) | 0.028 |
| SIRSβ N (%) | 12 (26,67) | 7 (14,28) | 0.187 |
| DFO€ mediana (IQR) | 0 (0-1) | 1 (0-1) | 0,051 |
| Creatinina (mg/dl)€ Mediana (IQR) | 0,62 (0,52-0,78) | 0,48 (0,4-0,82) | 0,385 |
| Disfunción respiratoria N (%) | 0 (0) | 1 (2,04) | 0,306 |
| IRA N (%) | 3 (6,12) | 4 (8,16) | 0,179 |
| Aumento enzimas hepáticas (ALT y/o AST) π N (%) | 6 (15,79) | 2 (5,26) | 0,65 |
| Aumento de bilirrubinas y/o presencia de suero ictérico. π N (%) | 4 (8,33) | 2 (4,08) | 1,00 |
| Número de Hipoglucemias (menor 70 mg/dl) € Mediana (IQR) | 1 (0-4) | 3 (1-4) | 0,078 |
| Albúmina (mg/dl)* Media (DS) | 1,98 (0,62) | 1,60 (0,44) | 0,040 |
| Administración de plasmaπ N (%) | 12 (25,53%) | 6 (12,4%) | 0,753 |
| Transfusión de sangreπ N (%) | 4 (8,51) | 4 (8,16) | 0,193 |
| Hipertermia π n (%) | 11 (9,4) | 2 (4,08) | 0,293 |
| Cambio de antibióticoπ N (%) | 4 (8,51) | 1 (2,04) | 1,00 |
| Micronutrición enteralπ N (%) | 7 (14,89) | 3 (6,12) | 1,00 |
| Vasopresoresπ N (%) | 1 (2,17) | 4 (8,16) | 0,026 |
| Morfinaπ N (%) | 3 (6,52) | 8 (16,33) | 0,001 |
| Goteo analgésicoπ N (%) | 1 (2,17) | 6 (12,24) | 0,002 |
| Sodio (mEq/L) β Mediana (IQR) | 140,5 (137-144) | 141 (138-142) | 0,777 |
| Potasio (mEq/L) β Mediana (IQR) | 3,44 (0,75) | 3,24 (0,51) | 0,352 |
| Cloro (mEq/L) β Mediana (IQR) | 106 (102-107) | 104 (102-108) | 0,615 |
| Calcio ionizado β (mmol/L) Media (DS) | 1,37 (0,15) | 1,38 (0,15) | 0,828 |
| pHβ Mediana (IQR) | 7,37 (7,32-7,4) | 7,34 (7,28-7,39) | 0,164 |
| Bicarbonato (mmol/l) β Media (DS) | 25,02 (3,37) | 24,9 (5,56) | 0,950 |
| BE(ecf) β Mediana (IQR) | 0,65 (-2,4-2,6) | -1,2 (-5,1-3,8) | 0,625 |
| PCO2 (mmHg) β Media (DS) | 43,35 (7,04) | 46,8 (6,72) | 0,106 |
| SVO2 (%)β Media (DS) | 58,59 (15.01) | 48,62 (9,66) | 0,026 |
| AGAP (mmol/L) β Media (DS) | 9,65 (2,58) | 10,42 (2,82) | 0,397 |
| Lactato β (mmol/l) Mediana (IQR) | 0,97 (0,58-1,19) | 1,06 (0,8-1,85) | 0,149 |
| Lactatomax€ (mmol/l) Mediana (IQR) | 1,03 (0,72-1,29) | 2,04 (0,93-3,97) | 0,013 |
| Duración hospitalización (Horas) Mediana (IQR) | 72 (48-120) | 48 (30-84) | 0,164 |
SIRS: síndrome de respuesta inflamatoria sistémica, DFO: número de disfunciones orgánicas, SVO2: saturación venosa de oxígeno, AGAP: anión gap; BE(ecf): déficit de base extracelular. *Menor valor de la variable registrado durante la hospitalización, € Mayor valor de la variable registrada durante la hospitalización, π variable dicotómica (si/no) registrada durante la hospitalización, β Variable registradas al ingreso de la hospitalización.
Regresión logística
En el modelo de regresión logística final se retuvieron 6 variables: peso, número de hipoglucemias, uso de vasopresores, uso de morfina, duración de la hospitalización y el máximo valor de lactato registrado (Tabla 2). Luego de ajustar por el resto de las co-variables puede concluirse que los pacientes a los que se les administró morfina y los pacientes que recibieron vasopresores tuvieron un odds significativamente mayor de fallecer en relación a los que no recibieron. En ambos casos el intervalo de confianza fue muy amplio, mostrando un nivel bajo de precisión para el odds ratio.
| Tabla 2: Resultados de la regresión logística. Variable dependiente: mortalidad hospitalaria. |
| Predictor | OR | P | IC Inferior | IC Superior |
| Peso (kg) | 0,143 | 0,073 | 0,017 | 1,197 |
| Número de hipoglucemias μ (menor o igual a 70 mg/dl) | 0,426 | 0,105 | 0,151 | 1,196 |
| Vasopresores Ω | 571577,7 | 0,045 | 1,361 | 15216,811 |
| Morfina Ω | 27,109 | 0,038 | 1,204 | 610,164 |
| Lactatomaxμ (mmol/l) | 2,162 | 0,087 | 0,893 | 5,232 |
| Duración Hospitalización (horas) | 0,964 | 0,014 | 0,828 | 28692,92 |
OR: ratio de posibilidad; IC: intervalo de confianza; μ mayor valor obtenido durante la hospitalización; Ω Variable dicotómica (si/no) registrada durante la hospitalización.
El test de Hosmer-Lemeshow demostró una adecuada calibración del modelo (P=0,947). El area bajo la curva ROC del modelo fue de 0,958. La tabla de clasificación demostró una adecuada capacidad de discriminación del modelo (Tabla 3).
| Tabla 3. Tabla de clasificación de la regresión logística. |
| Predicho | |||
| Observado | Si | No | % correcto |
| Si | 12 | 2 |
| No | 2 | 32 |
| % correcto general | 91.67 | |
Sensitividad = 12/(12 + 2) = 85.71 %; Especificidad = 32/(2 + 32) = 94.12 %, Falso positivo = 2/(2 + 32) = 5.88 %, Falso negativo = 2/(12 + 2) = 14.29 %.
En el modelo de regresión lineal se retuvieron 6 variables: leucocitos, número de hipoglucemias, uso de micronutrición enteral, albúmina, uso de vasopresores y potasio (Tabla 4). Luego de ajustar por el resto de las covariables puede concluirse que: por cada descenso de 1000 leucocitos la duración hospitalaria aumentó en promedio 12 horas; por cada unidad de descenso de albuminemia la duración hospitalaria se prolongó en promedio 39 horas; el requerimiento de vasopresores se asoció a un aumento en promedio de 144 horas la hospitalización y por último por cada mEq de descenso de la potasemia la duración de la hospitalización aumento en promedio 20 horas.
| Tabla 4. Regresión lineal múltiple. R2 ajustado: 0.841. Variable independiente: duración hospitalaria (en horas). |
| Predictor | B coeficiente | P | IC Inferior | IC Superior |
| Leucocitos α | -0.012 | 0.027 | -0.022 | -0.001 |
| Número de hipoglucemiasμ (menor o igual a 70 mg/dl) | 4.172 | 0.058 | -0.143 | 8.487 |
| Micronutrición enteralΩ | 20.713 | 0.064 | -1.258 | 42.685 |
| Albúminaα (mg/dl) | -38.796 | < 0.001 | -54.103 | -23.490 |
| VasopresoresΩ | 144.847 | < 0.001 | 84.042 | 205.653 |
| Potasioα (mEq/l) | 20.613 | 0.003 | 8.133 | 33.092 |
OR: ratio de posibilidad; IC: intervalo de confianza; μ mayor valor obtenido durante la hospitalización; Ω Variable dicotómica (si/no) registrada durante la hospitalización; α Menor valor registrado durante la hospitalización.
Las curvas de Kaplan Meier con los distintos puntos de corte para cada variable asociada significativamente a la duración hospitalaria se muestran en la figura 1.
Discusión
En el presente trabajo se encontró que el requerimiento de vasopresores o de rescate analgésico con morfina se asoció con una mayor mortalidad hospitalaria. Por otro lado, la presencia de hipoalbuminemia, hipopotasemia, el grado de leucopenia y el requerimiento de vasopresores se asociaron a una mayor duración de la hospitalización.
La morfina y sus derivados son ampliamente utilizados para el manejo del dolor moderado a severo en los pacientes en cuidados críticos tanto en medicina humana como en medicina veterinaria. Dentro de las complicaciones más frecuentes asociadas al empleo de estos fármacos se encuentran la emesis, la disfunción gastrointestinal asociada a opiáceos y la adicción. La constipación que se asocia a su uso prolongado es una de las principales causas de la reducción de la dosis o de la necesidad de realizar un cambio a otro fármaco analgésico en medicina humana. Se ha reportado previamente que la morfina reduce la secreción de fluidos por parte del epitelio intestinal, aumenta el tono del esfínter anal y disminuye la sensibilidad rectal. Los opiáceos en general reducen la contracción propulsiva a nivel del cólon y aumentan las contracciones colónicas no propulsivas, así como también aumentan del tono de las fibras musculares colónicas.
Dichos efectos son atribuidos a su acción a nivel de los receptores μ, κ y δ, siendo el efecto μ el más relevante. También se ha demostrado previamente que los opiáceos inhiben la acetilcolina, alterando la excitabilidad neuronal a dicho nivel.
Este tipo de alteraciones digestivas ha sido reportadas tanto en modelos animales murinos como caninos. Dentro de las complicaciones más comúnmente asociadas al íleo, se han reportado, las neumonías por aspiración (asociadas a vómitos y reflujo gastroesofágico), traslocación bacteriana, y el secuestro intestinal de líquidos (que puede generar a su vez hipovolemia y retraso en la implementación de nutrición enteral). Estos hallazgos descriptos previamente podrían explicar (al menos parcialmente) porque en nuestro estudio los pacientes que recibieron morfina tuvieron una mayor mortalidad. Debe tenerse en cuenta, sin embargo, que los pacientes a los que se les administró morfina tuvieron mayores valores en la escala de dolor utilizada, por lo cual presentaban mayor requerimiento de analgésicos. Se ha demostrado previamente que el dolor es una de las causas de las alteraciones de la funcionalidad gastrointestinal, pudiendo generar íleo, aumentando potencialmente el riesgo de traslocación bacteriana. Así mismo según la descripción ultrasonográfica realizada en 40 caninos con enteritis parvoviral, el 25% de ellos presentaba íleo con abundante contenido de líquido intraluminal, causado probablemente por la severa inflamación intestinal inducida por el virus. Debido a la naturaleza retrospectiva del presente estudio resulta imposible concluir si el empleo de morfina se asocia a una mayor mortalidad por posibles efectos perjudiciales asociados al fármaco, o es la presencia de dolor severo (posiblemente relacionada con el ileo intestinal) lo que genera el mayor riesgo de mortalidad. Se requieren estudios prospectivos a mayor escala para confirmar o rechazar esta hipótesis.
Otra de las variables que se asoció a mayor mortalidad fue el requerimiento de vasopresores debido a la presencia de falla circulatoria. En medicina humana se ha demostrado previamente que los pacientes con shock séptico tienen mayor mortalidad, pudiendo superar valores del 40%. Un trabajo que evaluó la sobrevida de pacientes caninos con falla multiorgánica y sepsis demostró que la mortalidad aumentaba cuanto mayor era el número de órganos afectados. A su vez en el análisis multivariado se informó que cada disfunción orgánica se asoció a mayor mortalidad en forma independiente. Las disfunciones orgánicas que más impacto tuvieron en mortalidad en ese trabajo fueron la falla circulatoria (OR: 3.39, CI: 2.71–6.1) 0.004 y la alteración de la coagulación (OR: 4.27, CI: 3.12–7.67). En el presente trabajo, la única disfunción orgánica que se asoció en forma independiente, tanto a la mortalidad hospitalaria, como a la duración de la hospitalización, fue el empleo de vasopresores. Debe tenerse en cuenta como limitaciones de nuestro estudio, que la coagulación no fue evaluada como disfunción orgánica, y que solo un canino requirió asistencia ventilatoria mecánica por el desarrollo de un síndrome de distrés respiratorio agudo. Debido al bajo número de pacientes que tuvieron alteraciones pulmonares, existe la posibilidad de la ocurrencia de un error estadístico de tipo II por la falta de poder para demostrar una asociación significativa entre esta disfunción orgánica y la mortalidad.
Los pacientes en cuidados críticos que presentan hipoalbuminemia, cualquiera sea su causa, tienen un mayor compromiso sistémico, aumentando así sus probabilidades de morir. La permeabilidad capilar aumenta en los pacientes sépticos lo que genera una pérdida de líquido al tercer espacio y mayor pérdida de albumina. Estos pacientes presentan disfunción endotelial por verse comprometido el glicocalyx, el cual es fundamental para mantener un equilibrio osmótico y evitar la pérdida de líquidos al tercer espacio. Ante la presencia de hipoalbuminemia sostenida, los pacientes pueden presentar edema pulmonar, intolerancia alimenticia, retraso de la cicatrización e hipercoagulabilidad. Además de presentar perdida de la albumina en el contexto de las diarreas hemorrágicas, la misma puede que no sea sintetizada adecuadamente por la falta de sustrato. Al ser una proteína de fase aguda negativa, esta disminuye su síntesis ante escenarios como la presencia de SIRS y Sepsis. En el presente trabajo no se observó una relación entre la presencia de hipoalbuminemia y la mortalidad hospitalaria, pero si se observó una asociación con la duración hospitalaria (por cada unidad de descenso de albuminemia la duración hospitalaria se prolongó en promedio 39 horas). Dado que en nuestra cohorte de pacientes se indicó la transfusión de plasma ante la presencia de valores de albúmina menores a 2 mg/dl, queda por determinarse en estudios posteriores si la corrección precoz de la hipoalbuminemia se asocia a una reducción de la duración de la hospitalización.
En el presente trabajo ni la presencia de injuria renal aguda ni la presencia de disfunción hepática se asociaron con un aumento de la mortalidad. Se ha sugerido previamente que la creatinina no es un buen marcador de IRA debido a que solo se ve alterada cuando se afecta un 75 % de la masa funcional renal o más. En un trabajo previo realizado en cachorros con parvovirus se evaluaron múltiples marcadores de función renal y se compararon con los niveles de creatinina en sangre. Como marcadores del filtrado glomerular se estudiaron los niveles urinarios de inmunoglobulina G y proteína C reactiva. Por otro lado, como marcadores de daño tubular se evaluaron los niveles urinarios de Neutrophil gelatinase-associated lipocalin (NGAL) y urinary retinol-binding protein. Se observó que en los caninos con Parvovirus estaban aumentados los niveles urinarios de todos estos marcadores en relación con el grupo control. Sin embargo, ningún animal manifestó un mayor nivel de los valores séricos de creatinina en relación al grupo control. Teniendo en consideración estos resultados no puede descartarse que los animales hayan sufrido cierto grado de injuria renal aguda que no haya podido detectarse con la medición seriada de creatinina. Se requieren estudios a mayor escala incluyendo múltiples marcadores de la función renal para poder obtener conclusiones definitivas sobre este punto.
En cachorros con GHA suele indicarse antibioticoterapia empírica para tratar posibles complicaciones asociadas a la alteración de la integridad de la barrera intestinal. Nuestro protocolo institucional indica la utilización de sulfadimetoxina-trimetroprim junto con metronidazol como primera línea en pacientes con leucopenia afebril. Esto contrasta con recomendaciones propuestas en revisiones de casos de parvovirus donde se suele recomendar el empleo de betalactámico (ampicilina-sulbactam) como antibióticos de primera línea. Nuestra elección del empleo de sulfonamidas como primera línea antibiótica se basa en un estudio previo realizado en pacientes oncológicos a los que se les realizo quimioterapia. En ese estudio, el empleo profiláctico de sulfadimetoxina -trimetroprim a la quimioterapia redujo marcadamente la tasa de complicaciones infecciosas, entre ellas las asociadas a la traslocación bacteriana a nivel gastrointestial. Debido a que muchos de estos pacientes presentaron neutropenia, y la administración de sulfadimetoxina -trimetoprim se asoció a una menor tasa de complicaciones, los autores concluimos que, si bien se trata de enfermedades diferentes, esta información podría ser empleada en los pacientes con GHA y neutropenia. Por otro lado, se ha demostrado previamente que en aquellos cachorros que fallecen de parvovirus suele observarse durante las necropsias, la colonizacion de distintos órganos (pulmón, hígado, etc.) por bacterias coliformes. Teniendo en cuenta esta información, en aquellos caninos que presentan neutropenia y dos o más registros de hipertermia, o signos clínicos compatibles con sepsis en nuestra institución hemos decidido realizar un cambio de antibiótico para cubrir específicamente bacterias coliformes (ceftriaxona más amikacina). Sin embargo, en el presente estudio no se observaron asociaciones entre la realización del cambio de antibiótico y la duración hospitalaria o la mortalidad.
El empleo de nutrición enteral se ha recomendado en cachorros con GHA debido a que un estudio previo ha demostrado que la nutrición precoz en cachorros con Parvovirus se asoció a una recuperación más temprana. La nutrición enteral se recomienda sobre la parenteral en estos casos debido a que la primera favorece la integridad de la mucosa intestinal y disminuye la traslocación bacteriana. Si bien no se han observado diferencias en la tasa de complicaciones entre el empleo de sondas de alimentación esofágica en relación a la gástrica, esta última permite la extracción del residuo favoreciendo la descompresión del estómago y disminuyendo la molestia abdominal asociada a la distensión de la viscera. El empleo de micronutrición enteral con soluciones dextrosadas ha demostrado disminuir el nivel de citoquinas proinflamatorias, incrementar la secreción de las hormonas incretinas beneficiosas derivadas del intestino y favorecer el metabolismo de la glucosa en un modelo murino de sepsis. Se está llevando a cabo un ensayo clínico controlado, con placebo, doble ciego, aleatorizado, prospectivo, para evaluar los efectos de la administración temprana de dextrosa enteral en pacientes humanos en estado crítico con sepsis. Si bien los trabajos que evaluaron la nutrición precoz en cachorros con parvovirus evaluaron el impacto de la administración de alimento y no de micronutrición con soluciones dextrosadas, en la institución donde se llevó a cabo el presente trabajo se propone comenzar con micronutrición enteral, y si el paciente lo tolera se realiza la transición a un alimento líquido. A pesar de dicha recomendacion institucional, la micronutrición enteral fue realizada solo en el 21% de los casos de manera que no pueden sacarse conclusiones definitivas sobre el impacto de la micronutrición y/o nutrición enteral con los datos obtenidos se este trabajo.
La presencia de hipopotasemia se asoció a un aumento de la duración de la hospitalización. Las potenciales causas de este desorden electrolítico en cachorros con GHA incluyen: la perdida de potasio producida a través de los vómitos, de las aspiraciones de residuo gástrico, las diarreas abundantes, la poliuria en pacientes con balances hídricos muy positivos y a la ausencia de una correcta nutrición. La asociación observada en el presente trabajo posiblemente se relacione con que los caninos que presentan mayores grados de hipokalemia probablemente también tengan una mayor severidad de pérdidas de fluidos gastrointestinales.
El presente trabajo presenta múltiples limitaciones que deben ser tenidas en cuenta. El diagnóstico etiológico no fue un criterio de inclusión en el presente estudio. Si bien es posible que un alto número de cachorros haya tenido Parvovirus debido a que es el agente que más se asocia a GHA y neutropenia, existe la posibilidad de que algunos caninos hayan sido infectados por otros agentes o de que hayan tenido incluso múltiples co-infecciones. Se han reportado casos fatales de GHA y depleción severa de la médula ósea en cachorros infectados con virus diferentes al parvovirus como por ejemplo el Coronavirus entérico. Por otro lado, las formas leves de Parvovirus pueden cursar sin leucopenia e incluso sin GHE. La inclusión de esos pacientes probablemente hubiese alterado la representatividad de la muestra para describir los factores de riesgo asociados a las formas graves de presentación. Por lo tanto, los autores decidimos estudiar la población que consideramos que se encuentra con un mayor riesgo de morbilidad y mortalidad que son los cachorros con GHA y neutropenia independientemente de su etiología específica.
Otra importante limitación del presente estudio se relaciona con el hecho de que no se realizaron evaluaciones sobre la coagulación de los pacientes. En un estudio previo donde se empleó tromboelastografía para el monitoreo de la coagulación, se observó que todos los caninos con parvovirus presentaban alteraciones sugestivas de hipercoagulabilidad. Sumado a que en ninguno de los caninos estudiados se registró evidencia de macrotrombosis o coagulación intravascular diseminada en su historia clínica, el impacto de las alteraciones en la coagulación sobre la mortalidad y/o duración hospitalaria no fue evaluado en nuestro estudio debido a que no se estudiaron de manera rutinaria en nuestros pacientes. Si bien se registró y analizó el recuento plaquetario, la presencia de trombocitopenia no fue considerada en nuestro estudio como un marcador de disfunción en la coagulación. La trombocitopenia reportada en los caninos con parvovirus, podría ser consecuencia de la destrucción de la medula por parte del virus, debido a la generación de necrosis en la medula ósea, o bien en parte, por consumo debido a la gravedad de las lesiones intestinales.
Por otro lado, no se pudieron realizar conteos absolutos o relativos de las distintas líneas de glóbulos blancos en muchos pacientes. Esta limitación se debe a que se requieren al menos 100 células de cada tipo para poder arrojar una cifra con cierta precisión al emplear el método de conteo manual de leucocitos que fue el método principalmente utilizado. Dada la severa leucopenia que presentaron muchos pacientes en alguna instancia de su hospitalización, el laboratorio reportaba solo el número total de recuento leucocitario. Debido a esta limitación, no se pudo contrastar nuestros resultados con lo reportado previamente por Goddard et al quienes reportaron que la ausencia de linfopenia se asoció a una mayor sobrevida a las 24 hs de la admisión, y que el aumento del recuento de linfocitos a las 24 hs se asoció a una mayor probabilidad de sobrevida.
Conclusión
En el presente trabajo se encontraron múltiples factores de riesgo en cachorros con GHA tanto para la mortalidad como la duración hospitalaria. Estos hallazgos pueden ayudar a categorizar mejor a los pacientes y abre nuevas hipótesis que deberían confirmarse con estudios prospectivos.
Bibliografía
- Prittie J. Canine parvoviral enteritis: a review of diagnosis, management, and prevention. Journal of Veterinary Emergency and Critical Care 2004;14:167-176.
- Goddard A, Leisewitz AL. Canine Parvovirus. Vet Clin North Am Small Anim Pract 2010;40:1041-53.
- Pinto LD, Barros IN, Budaszewski RF, et al. Characterization of pantropic canine coronavirus from Brazil. Vet J 2014;202:659-62.
- Castro TX, Cubel Garcia Rde C, Gonçalves LP, et al. Clinical, hematological, and biochemical findings in puppies with coronavirus and parvovirus enteritis. Can Vet J 2013;54:885-8.
- Kalli I, Leontides LS, Mylonakis ME, et al. Factors affecting the occurrence, duration of hospitalization and final outcome in canine parvovirus infection. Res Vet Sci 2010;89:174-8.
- Goddard A, Leisewitz AL, Christopher MM, et al. Prognostic usefulness of blood leukocyte changes in canine parvoviral enteritis. J Vet Intern Med 2008;22:309-16.
- Firth AM, Haldane SL. Development of a scale to evaluate postoperative pain in dogs. J Am Vet Med Assoc 1999;1:651-9.
- DiBartola SP, Autran de Morais H. Hypokalemia and hyperkalemia. In:2012. DiBartola SP, editor. Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice. Fourth ed. Saunders, Pennsylvania, 2012:88-113.
- Troìa R, Mascalzoni G, Calipa S. Multiorgan dysfunction syndrome in feline sepsis: prevalence and prognostic implication. J Feline Med Surg. 2019;21:559-565.
- Simon BT, Steagall PV. The present and future of opioid analgesics in small animal practice. J Vet Pharmacol Ther 2017;40:315-326.
- Takahashi T, Tsuchida, D, Pappas TN. Central effects of morphine on GI motility in conscious dogs. Brain Res 2007;29:29-34.
- Fruhwald S, Holzer P, Metzler H. Intestinal motility disturbances in intensive care patients pathogenesis and clinical impact. Intensive Care Med 2007;33:36.
- Beckett EA, Staikopoulos V, Hutchinson MR. Differential effect of morphine on gastrointestinal transit, colonic contractions and nerve-evoked relaxations in Toll-Like Receptor deficient mice. Scientific Reports 2018;12:5923.
- Bueno L, Fioramonti J, Hondé C, et al. Central and Peripheral Control of Gastrointestinal and Colonic Motility by Endogenous Opiates in Conscious Dogs. Gastroenterology 1985;88:549-56.
- Whitehead KM, Cortes Y, Eirmann L. Gastrointestinal dysmotility disorders in critically ill dogs and cats. Journal of Veterinary Emergency and Critical Care 2016;26:234–253.
- Stander N, Wagner WM, Goddard A, et al. Ultrasonographic appearance of canine Parvoviral enteritis in puppies. Veterinary Radiology & Ultrasound 2010;51:69–74.
- Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016;23:801–810.
- Kenney EM, Rozanski EA, Rush JE, et al. Association between outcome and organ system dysfunction in dogs with sepsis: 114 cases (2003–2007). J Am Vet Med Assoc 2010;236:83-7.
- Mazzaferro EM, Rudloff E, Kirby R. The role of albumin replacement in the critically ill veterinary patient. Journal of Veterinary Emergency and Critical Care 2002;12:113-124.
- Chelazzi C, Villa G, Mancinelli P, et al. Glycocalyx and sepsis-induced alterations in vascular permeability. Critical Care 2015;19:26.
- Finco DR, Brown SA, Brown CA, et al. Progression of chronic renal disease in the dog. J Vet Intern Med 1999;13:516-28.
- Van den Berg MF, Schoeman JP, Defauw P, et al. Assessment of acute kidney injury in canine parvovirus infection: Comparison of kidney injury biomarkers with routine renal functional parameters. Vet J. 2018;242:8-14.
- Chretin JD, Rassnick KM, Shaw NA, et al. Prophylactic trimethoprim-sulfadiazine during chemotherapy in dogs with lymphoma and osteosarcoma: a double-blind, placebo-controlled study. J Vet Intern Med 2007;21:141-8.
- Nivy R, Hahn S, Perl S, et al. A Fatal Outbreak of Parvovirus Infection: First Detection of Canine Parvovirus Type 2c in Israel with Secondary Escherichia coli Septicemia and Meningoencephalitis. Israel Journal of Veterinary Medicine 2011;66:96-102.
- Turk J, Miller M, Brown T, et al. Coliform septicemia and pulmonary disease associated with canine parvoviral enteritis: 88 cases (1987-1988). J Am Vet Med Assoc 1990;196:771-3.
- Mohr AJ, Leisewitz AL, Jacobson LS, et al. Effect of early enteral nutrition on intestinal permeability, intestinal protein loss, and outcome in dogs with severe parvoviral enteritis. J Vet Intern Med 2003;17:791-8.
- Elke G, van Zanten ARH, Lemieux M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care 2016;20:117.
- Yu MK, Freeman LM, Heinze CR, et al. Comparison of complication rates in dogs with nasoesophageal versus nasogastric feeding tubes. J Vet Emerg Crit Care 2013;23:300-4.
- Shah FA, Singamsetty S, Guo L, et al. Stimulation of the endogenous incretin glucose-dependent insulinotropic peptide by enteral dextrose improves glucose homeostasis and inflammation in murine endotoxemia. Transl Res 2018;193:1-12.
- Buonavoglia C, Decaro N, Martella V, et al. Canine Coronavirus Highly Pathogenic for Dogs. Emerging Infectus Diseas 2006;12:492-494.
- Otto CM, Rieser TM, Brooks MB, et al. Evidence of hypercoagulability in dogs with parvoviral enteritis. J Am Vet Med Assoc 2000;15:1500-4.
 by Multimédica
by Multimédica