Pancreatitis aguda con signos de autodigestión enzimática en un cuadro de DTVG, con sobrevida
Resumen breve
Se describe el hallazgo de pancreatitis aguda con signos visibles de autodigestión enzimática, observada durante la resolución quirúrgica de un cuadro de dilatación gástrica con vólvulo (DTVG) en un canino Boyero de Berna.Índice de contenidos
Resumen
Se describe el hallazgo de pancreatitis aguda con signos visibles de autodigestión enzimática, observada durante la resolución quirúrgica de un cuadro de dilatación gástrica con vólvulo (DTVG) en un canino Boyero de Berna.
Introducción
La pancreatitis aguda (PA), es la inflamación súbita del páncreas. En muchos pacientes la recuperación del cuadro no suele asociarse a daños permanentes. Sin embargo, existen potenciales complicaciones posibles como el shock séptico, la coagulación intravascular diseminada (CID) y el síndrome de distrés respiratorio agudo (SDRA). El grado de necrosis del páncreas guarda relación directa con el índice de mortandad1. Su desarrollo se explicaría a través de la activación de las enzimas en el interior del páncreas, produciendo su autodigestión. La característica macroscópica típica la constituye el hallazgo de necrosis grasa que puede comprometer vasos, células acinares y conductos, llevando a trombosis venosa, necrosis del parénquima y destrucción de conductos 1 .
La dilatación torsión vólvulo gástrica (DTVG), es una condición que afecta a los perros como consecuencia de la acumulación de gas en el estómago y la rotación anormal sobre su eje mesentérico longitudinal, o en menor medida transversal. Los mecanismos de vaciado pilórico, eructación y vómito se ven impedidos. DTVG debe considerarse una urgencia médicoquirúrgica donde a medida que el cuadro avanza se establece una disfunción cardiorrespiratoria caracterizada por cuadro de shock y el desarrollo de otros mecanismos deletéreos que ponen en grave riesgo la vida del paciente.
Respecto a las complicaciones cardíacas, habituales en DTVG, se presume que la hipoxia pancreática produce la liberación de un péptido conocido como factor depresor del miocardio, que ejercería efectos inotrópicos negativos. La aparición de arritmias cardíacas predominantemente ventriculares (taquicardia ventricular y complejos ventriculares prematuros), es una complicación que está bien documentada durante la ocurrencia de DTVG y hasta 72 horas luego de su resolución. Se deduce que el aumento de la demanda metabólica del miocardio mediado por las catecolaminas no puede ser satisfecha debido a que el acortamiento de la diástole (producto de la taquicardia), disminuye el flujo coronario y subendocárdico, desarrollando así cuadros de hipoxia miocárdica y necrosis subendocárdica2. El hallazgo de niveles aumentados de troponinas cardíacas en perros con DTVG parece apoyar esta teoría 2 .
| Tabla 1.Resultados de los valores de gases y electrolitos en sangre venosa obtenidos al ingreso en un paciente con dilatación torsión vólvulo gástrico y pancreatitis con autodigestión. |
| Medición | Resultado | Valor de referencia |
| pH | 7,46 | 7,35 a 7,45 |
| PCO 2 (mmHg) | 34 | 35 a 45 |
| HCO 3 - (mmol/l) | 22,1 | 21 a 28 |
| Déficit de base | -1,6 | + 2,5 a – 2,5 |
| SvO 2 (%) | 70,4 | 60 a 80 |
| Sodio (mmol/l) | 148 | 136 a 145 |
| Potasio (mmol/l) | 3,5 | 3,5 a 5 |
| Calcio ionizado (mmol/l) | 1,27 | 1,12 a 1,50 |
| Cloro (mmol/l) | 117 | 98 a 106 |
| Anion Gap (mmol/l) | 9 | 3 a 11 |
| Hematocrito (%) | 37 | 37 a 55 |
| Hemoglobina (Gr%) | 12,6 | 13 a 17 |
| Glucemia (mg/dl) | 112 | 60 a 80 |
| Lactato (mmol/l) | 4,15 | 1,1 a 1,4 |
| Creatinina (mg/dl) | 0,69 | 0,6 a 1,4 |
El tratamiento debe iniciarse precozmente a través de la reanimación con fluidos, descompresión del estómago, y la prevención de complicaciones relacionadas con el cuadro de shock, isquemia reperfusión, y sepsis, preparando al paciente para la cirugía. En caso de no tratarse, DTVG conducirá indefectiblemente al fallo orgánico múltiple (FOM) y a la muerte del paciente 3 .
El estado de hipoperfusión e hipoxia tisular en pacientes con DTVG es consecuencia del cuadro de shock inicialmente de tipo obstructivo, debido a la compresión que ejercen la distensión gástrica y el aumento de la presión intraabdominal sobre la vena cava caudal, la vena porta y todo el lecho esplácnico, afectando entre otros órganos, al páncreas. La pancreatitis se ha considerado como una de las posibles complicaciones de DTVG en los perros 4,5 . Al conocimiento de los autores, este es el primer reporte de pancreatitis con evidencia macroscópica de autodigestión observado durante la resolución quirúrgica de un paciente con DTVG. Al mismo tiempo, este es el primer caso observado de la casuística registrada por el autor principal (PS), sobre 1075 casos de DTVG intervenidos quirúrgicamente en el hospital CEVEDÉ durante el período 1996 a 2019.
Caso Clínico
Un canino de raza Boyero de Berna, hembra, de 9 años de edad, y 44 kg de peso fue derivado al Servicio de Urgencias del Centro Veterinario de Derivaciones CEVEDÉ, con cuadro de vómitos improductivos, distensión abdominal, y abdomen agudo, compatible con DTVG. La anamnesis puso en evidencia que la paciente había sufrido un episodio de exposición a pirotecnia la noche anterior, y su temor a los mismos provocó en ella un estado marcado de excitación, que podría haber intervenido como factor de riesgo de DTVG, sumado a su condición de raza gigante. Al examen inicial se observó un estado del sensorio alerta, mucosas rosadas, temperatura rectal de 38,9 oC, tiempo de relleno capilar 2 segundos, pulso femoral fuerte, pulso metatarsiano débil, presión arterial media (TAM) 76 mmHg, auscultación cardíaca normal, frecuencia cardíaca (FC) de140 lat/min., auscultación pulmonar normal, y una frecuencia respiratoria (FR) de 12 mov/min. Durante la evaluación del abdomen se detectó distensión marcada, dolor, y sonido timpánico a la percusión. Se realizó una evaluación de los niveles sanguíneos de glucemia, hematocrito y sólidos totales obteniéndose los siguientes resultados: 110 mg/dl, 36% y 6 gr% respectivamente.
Se realizó una evaluación de electrolitos y gases en sangre venosa mediante el empleo de un dispositivo de evaluación de gases portátil (EPOC, Neovet SA). Los resultados se muestran en la Tabla 1. Se canalizaron ambas venas cefálicas antebraquiales con catéteres 18 G, y se inició resucitación con fluidos guiada por metas, mediante la administración intravenosa de solución ringer lactato en bolos de 30 ml/kg, realizando una evaluación de la hemodinamia luego de cada expansión. Durante la resucitación hemodinámica se administró oxigenoterapia mediante el empleo de una máscara.
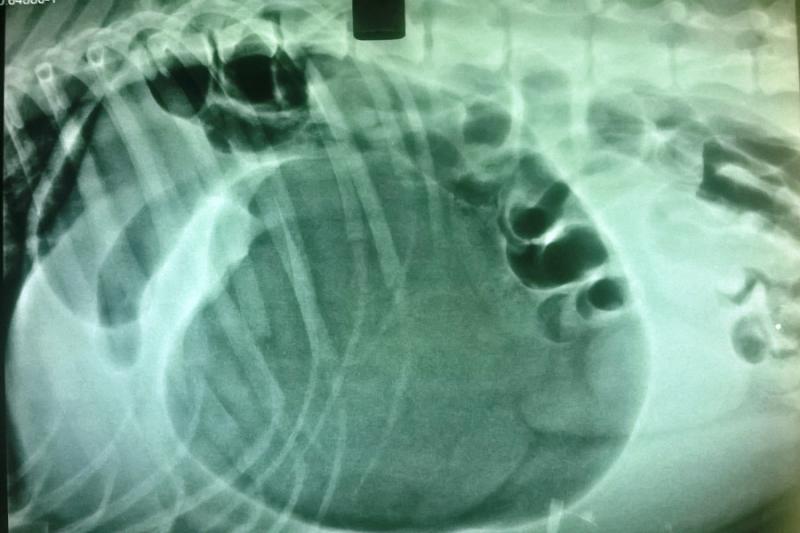
Se realizó una radiografía simple de abdomen, en incidencia latero lateral derecha, donde se observó compartimentalización del estómago con gran contenido gaseoso, y desplazamiento dorso craneal de la región pilórica, correspondiente a dilatación gástrica con torsión sobre su eje longitudinal (Figura 1).
Se administró lidocaína 2% IV en bolo de (2 mg/kg), y se continuó con una infusión continua a una velocidad de 0,05 mg/kg/minuto, con el objetivo de prevenir el síndrome de isquemia reperfusión 5 . Posteriormente, se administró propofol, a dosis 2 mg/kg y se realizó sondaje orogástrico con fines descompresivos, no pudiendo ingresar la sonda al estómago. Se realizaron cambios de posición del paciente repitiendo los intentos de sondaje, sin resultados positivos. Previa tricotomía, y antisepsia con clorhexidina, e iodopovidona tópica, se realizó gastrocentesis a nivel epimesogástrico superior, evacuando un gran volumen de gas. Una vez descomprimido el estómago, se volvió a intentar el sondaje orogástrico de manera infructuosa. A la palpación abdominal se detectó esplenomegalia significativa. Finalizada la administración del segundo bolo de ringer lactato (total acumulado 2640 ml), la paciente mejoró sus parámetros hemodinámicos, presentando pulso metatarsiano fuerte, TAM 96 mmHg, y FC 112 lat/min. Se decidió realizar la resolución en forma quirúrgica. Se realizó un análisis de sangre prequirúrgico donde se obtuvieron los siguientes resultados: hematíes 5.100.000/ mm 3 , hemoglobina 12,7 gr%, hematocrito 35%, plaquetas 195.000/mm 3 , VCM 69,9, HbCM 24,9, CHbCM 35,6, leucocitos 19.500/mm 3 , neutrófilos en cayado 0%, neutrófilos segmentados 81%, eosinófilos 6%, linfocitos 7%, monocitos 6%, uremia 48 mg/dl, creatinemia 1,6 mg/dl, proteínas totales 5,4 gr/%, albúminas 3 gr%, globulinas 2,4 gr%, GOT 129 U/L, GPT 75 U/L, FAS 328 U/L.
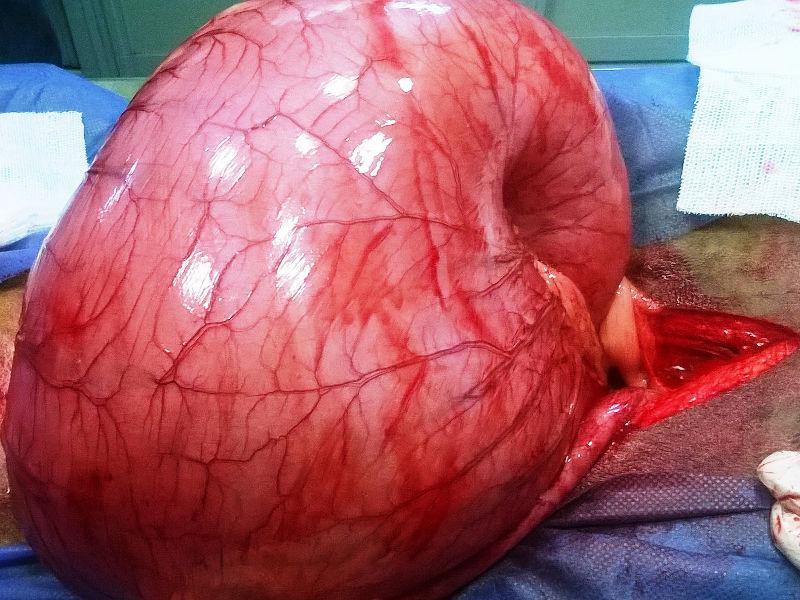
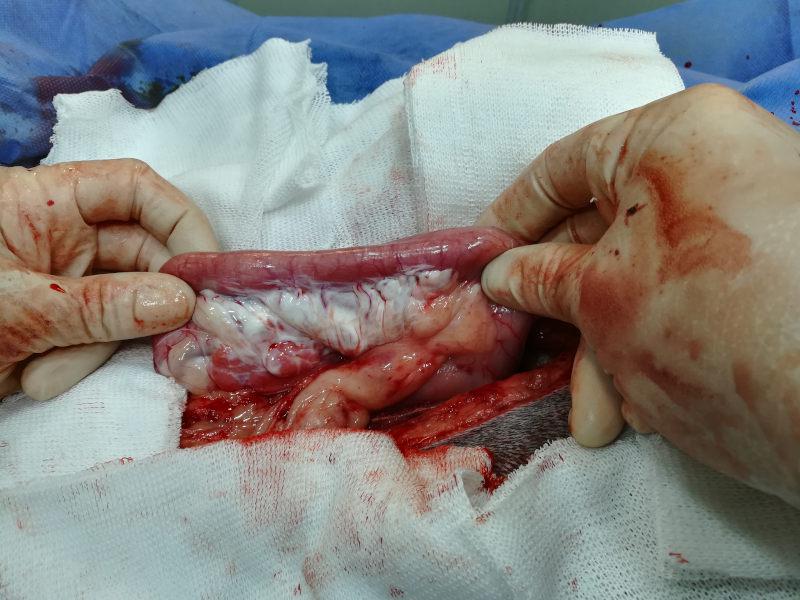
Una vez que la paciente estuvo hemodinámicamente estable, y el balance hidroelectrólitico y ácido base compensados, se decidió ingresarla a cirugía. Se implementó como protocolo anestésico la inducción con propofol a dosis 3 mg/kg, se intubó y se realizó anestesia inhalatoria con isofluorano, junto con el empleo de un goteo analgésico de fentanilo (4 mg/ kg/hora). Para el abordaje quirúrgico se realizó laparotomía mediana xifoumbilical. Se determinó la presencia de vólvulo gástrico con torsión dextrógira (Figura 2). Mediante manipulación de la zona del cardias por parte del cirujano, se logró introducir una sonda orogástrica (manejada por un auxiliar) en el estómago, y se procedió al vaciado y desrotación del mismo. El contenido presentó color amarillo, correspondiente a alimento balanceado o pienso semidigerido y contenido líquido (Figura 3). El procedimiento se complementó con lavajes gástricos, empleando solución fisiológica entibiada. Una vez reperfundido, el estómago no evidenció signos macroscópicos de necrosis. El bazo evidenció esplenomegalia marcada, posición de “herradura” debido a torsión y presencia de hematomas importantes a nivel del omento gastroesplénico, por lo que se realizó esplenectomía. Mediante gastropexia incisional se fijó la región pilórica del estómago a la pared abdominal derecha. El páncreas presentó signos evidentes de autodigestión enzimática, incluyendo cambios de color, edema, y grasa saponificada (Figuras 4 y 5).

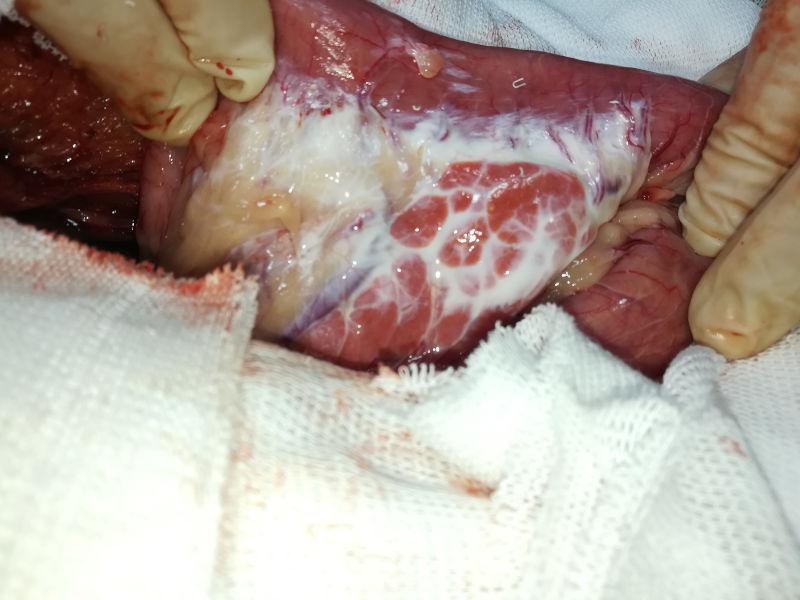
Durante el posquirúrgico, la paciente quedó internada, y debido a un cuadro de dolor severo cuantificado mediante el Score de Melbourne Modificado (18/27), se inició un protocolo de analgesia multimodal en base a una infusión IV continua de tramadol, ketamina y lidocaína. Durante la hospitalización además se administró antibióticoterapia combinada (Ceftriaxona 20 mg/kg/12h IV; Enrofloxacina 5 mg/ kg/12h IV y Metronidazol 15 mg/kg/12h IV), antiemético (Metoclopramida 0,2 mg/kg/8h IV), antiácido antagonista de receptores H 2 (Ranitidina 2 mg/kg/12h IV) y fluidoterapia de mantenimiento con solución Ringer lactato.
La paciente no presentó cuadro de vómitos durante la internación. A las 12h de realizada la cirugía comenzó a administrarse agua de a pequeñas cantidades. A las 36 horas aceptó comida. A las 24h posteriores a la cirugía se realizó un nuevo análisis de sangre que evidenció los siguientes resultados: hematíes 5.110.000/ mm 3 , hemoglobina 12,4 gr%, hematocrito 33%, plaquetas 211.000/mm 3 , VCM 65, HbCM 24,2, CHbCM 36, leucocitos 34.500/mm 3 , neutrófilos en cayado 2%, neutrófilos segmentados 84%, eosinófilos 0%, linfocitos 6%, monocitos 8%, uremia 16 mg/dl, creatinemia 0,82 mg/dl, proteínas totales 5,8 gr%, albúmina 3,4 gr%. A las 72h poscirugía se repitió el hemograma: hematíes 4.650.000/mm3. hemoglobina 11,3 gr%, hematocrito 31%, plaquetas 244.000/mm 3 , VCM 66,9, HbCM 24,3, CHbCM 36, leucocitos 23.100/mm 3 , neutrófilos en cayado 4%, neutrófilos segmentados 78%, eosinófilos 0%, linfocitos 10%, monocitos 8%.
En base a la buena evolución clínica, la paciente se externó a las 84h de la cirugía, y continuó los controles y el tratamiento en forma ambulatoria con el siguiente protocolo medicamentoso y dieta:
- Medicaciones orales: amoxiclavulámico cada 12h; enrofloxacina 5 mg/ kg/12h; metronidazol 15 mg/kg/12h; tramadol 2 mg/kg/8h; omeprazol 20 mg/kg/12h.
- Dieta: pollo cocido cortado en trocitos, suministrado a pequeños bocados, en 6 frecuencias diarias inicialmente. Incorporación gradual de balanceado medicado gastrointestinal. Disminución semanal de las frecuencias diarias hasta llegar a una frecuencia definitiva de dos comidas por día.
A los 10 días de la cirugía se extrajeron los puntos de sutura de piel, y se indicó el alta médica (Figura 6).
Discusión
En el presente reporte se describe el hallazgo de pancreatitis aguda con autodigestión enzimática, durante la resolución quirúrgica de un cuadro de DTVG enun canino, resultando motivo de discusión si la ocurrencia del cuadro de PA con autodigestión enzimática fue previa o posterior a la DTVG. De los datos de anamnesis no surgen evidencias que hagan sospechar que la PA pudo haber ocurrido antes de DTVG, dado que la paciente no manifestó previamente signos de malestar, vómitos, u otros que pudieran asociarse a la enfermedad, desarrollando sus hábitos conductuales con normalidad, y manteniendo su apetito habitual en base a una dieta estricta de alimento balanceado de alta calidad. Además, la paciente no tenía antecedentes de patologías de base y tampoco estaba medicada con ningún fármaco, por lo que también se descarta su hipotética participación en el desarrollo de la PA. La ocurrencia de PA en ocasión de DTVG está documentada en distintos trabajos 4,5,8,9 aunque en ninguno se menciona el hallazgo de autodigestión enzimática con signos evidentes durante la cirugía. Los perfiles hematológicos y bioquímicos no suelen ser específicos en pancreatitis, pero son útiles para descartar signos de dolor abdominal y vómitos debidos a hepatopatías, peritonitis y nefritis aguda6. Si bien existen pruebas más sensibles para el diagnóstico de PA, como la amilasa, la lipasa y la lipasa específica de especie ninguna presenta 100% de sensibilidad, por lo cual el diagnóstico debe integrar la evaluación clínica, el laboratorio y el diagnóstico por imágenes. Siendo la prueba de referencia diagnóstica la biopsia pancreática, no siempre disponible considerando el riesgo anestésico y la respuesta inflamatoria sistémica en estos pacientes 6 . La lipasa pancreática específica de especie (CPLi), tiene su origen exclusivamente en el páncreas y se la considera la prueba más sensible y específica para el diagnóstico de PA en perros y gatos. En algunos pacientes en estado de hipoperfusión del páncreas o inflamaciones no pancreáticas (enfermedad inflamatoria intestinal, gastritis e insuficiencia renal crónica) puede elevarse pero con valores menores que en una pancreatitis aguda. Existen dos pruebas que utilizan anticuerpos específicos contra la enzima, un ELISA que proporciona valores cuantitativos, y un kit rápido con valores cualitativos 6 . Neilson-Carley et al (2011), en un estudio realizado sobre un total de 40 perros, para evaluar la especificidad de la CPLi en el diagnóstico de pancreatitis sin evidencia clínica o histológica de enfermedad, encontró que la concentración de CPLi estuvo dentro de los límites de referencia en 38 de estos 40 perros y fue menor que el valor de corte para el diagnóstico de pancreatitis (400 Mg / L) en 39 de 40 perros, lo que resultó en una especificidad del 97,5% (95% de intervalo de confianza, 86,8% a 99%). El valor de corte de CPLi utilizado en este estudio puede ser útil para diagnosticar pancreatitis en perros con falta de lesiones histológicas compatibles con pancreatitis, y para las cuales la pancreatitis no se considera un diagnóstico diferencial importante 7.
En un trabajo publicado por Israeli I. et al (2012), hallaron que la concentración sérica de la enzima CPLi (lipasa inmunoreactiva específica canina) dio aumentada en DTVG en el 58% de 66 perros evaluados, y en el 18% estaba por encima del corte de pancreatitis actualmente aceptado (400 mg/l), sugiriendo que el páncreas se ve afectado adversamente durante DTVG. No obstante, la mayoría de los perros con aumento de cPLI en suero en este estudio no mostraron signos clínicos clásicos de pancreatitis, ni se detectó pancreatitis clínicamente después de la operación, con la excepción de un caso único. Este perro tenía la concentración sérica de CPLi más alta registrada (3,380 mg/l) en el estudio, aunque, durante la cirugía, su páncreas se había evaluado como normal 8.
Spinella et al (2018), mencionan que el daño pancreático puede ocurrir durante DTVG, pero sin afectar la condición clínica de los pacientes, aunque admiten que es posible que los síntomas de la pancreatitis estuvieran enmascarados por el tratamiento postoperatorio de DTVG, que es casi idéntico al tratamiento de la pancreatitis 9 .
En el presente reporte no se realizó prueba de CPLi debido a la contundencia de la evidencia macroscópica de pancreatitis aguda durante la cirugía de DTVG, que en todo caso hubiera servido simplemente para evaluar la sensibilidad de la prueba. Tampoco se realizó biopsia pancreática por el mismo motivo, sumado al contexto de gravedad del cuadro de DTVG.
La no ocurrencia de arritmias cardíacas en el presente reporte podría adjudicarse a la aplicación del protocolo en base a lidocaína recomendado por Bruchim et al, en prevención del síndrome de isquemia reperfusión previo a las maniobras de descompresión gástrica junto a la terapia de sostén implementada tendiente a la conservación del medio interno.
En relación al manejo nutricional de la PA, si bien no hay un manejo específico establecido, se sabe que el apoyo nutricional es fundamental para la recuperación, y la alimentación enteral se considera segura, efectiva y bien tolerada 10 por lo que debe restablecerse cuanto antes en ausencia de vómitos, siempre evitando las grasas debido a que estas podrían agravar la pancreatitis en los perros 11 .
La rápida recuperación de la paciente, externada tan solo 84h después de la cirugía, se atribuye al buen estado general de la misma, sumado a la metodología de trabajo implementada, incluyendo las maniobras, monitoreos y terapia prequirúrgicas, a la cirugía precoz una vez estabilizada la paciente, a la terapia y riguroso seguimiento posquirúrgico (en base a monitoreo hemodinámico, reevaluaciones de medio interno, hemograma y bioquímica sanguínea), y a la administración precoz de alimento por vía enteral.
Conclusiones
Si bien se desconoce con exactitud qué causas llevaron a la asociación de DTVG y PA con autodigestión enzimática, la hipótesis que manejan los autores, es que la PA se produjo en forma secundaria a la ocurrencia de DTVG, debido al estado de hipoxia isquémica del páncreas, dentro de un contexto de hipoxia generalizado derivado del cuadro de shock, inicialmente obstructivo. Si bien la PA en cuadros de DTVG está documentada en varios trabajos publicados 4,5,8,9 , ninguno describe el hallazgo de autodigestión enzimática evidente durante la cirugía; y en la vasta casuística de los autores (1075 casos de DTVG intervenidos quirúrgicamente, período 1996-2019), el presente constituye el único caso, no encontrando una explicación contundente al respecto.
Bibliografía
- Mouly J. Pancreatitis aguda. Emergencias y Cuidados Críticos en Pequeños Animales: 2018; 515-518. Ed. Multimédica Ediciones Veterinarias, Barcelona, España.
- Scorza FP. Dilatación Torsión Vólvulo Gástrica. Emergencias y Cuidados Críticos en Pequeños Animales: 2018; 497-513. Ed. Multimédica Ediciones Veterinarias, Barcelona, España.
- Schober KE, Cornand C, Kirbach B, Aupperle H, Oechtering G. Serum cardiac troponin I and cardiac troponin T concentrations in dogs with gastric dilatation-volvulus. J Am Vet Med Assoc. 2002 Aug 1;221(3):381-8. Leipzig, Alemania.
- Matthiesen DT. Gastric dilatation-volvulus syndrome. In:Slatter D, ed. Textbook of Small Animal Surgery, 2nd ed. Philadelphia, PA: WB Saunders; 1993;580–591. Philadelphia, USA.
- Bruchim Y, Itay S, Shira BH, Kelmer E, Sigal Y, Itamar A, Gilad S. Evaluation of lidocaine treatment on frequency of cardiac arrhythmias, acute kidney injury, and hospitalization time in dogs with gastric dilatation volvulus. J.Vet.Emerg.Crit.Care (San Antonio) 2012 Aug;(4):419-27. Israel.
- Pastor, Josep. Capítulo 12, Páncreas exócrino y tracto gastrointestinal. En: Cerón Madrigal JJ. Análisis clíncios en pequeños animales. 1ra edición. Ciudad Autónoma de Buenos Aires, Argentina. Ed. Inter-Médica, 2013,p,165-177.
- Neilson-Carley SC, Robertson JE, Newman SJ, Kutchmarick D, Relford R, Woosley K, Steiner JM. Specificity of a canine pancreas.specific lipase assay for diagnosing pancreatitis in dogs without clinical or histologic evidence of the disease, 2011. San Leandro, USA.
- Israeli I, Steiner J, Segev G, et al. Serum pepsinogen-A, Canine pancreatic lipase inmunoreactivity, and C-reactive protein as prognostic markers in dogs with gastric dilatation-volvulus. J Vet Intern Med 2012; 26: 920-928. Rehovot, Israel. Spinella G, Dondi F, Grassato L, Magna L, Cola V, Giunti M, Del Magno S, Valentini S. Prognostic value of canine pancreatic lipase immunoreactivity and lipase activity in dogs with gastric dilatation-volvulus. PLoS One. 2018 Sep 18. Bologna, Italia.
- Jensen K & Chan D, Nutritional management of acute pancreatitis in dogs and cats. Journal of Veterinary Emergency and Critical Care 24(3) 2014, pp 240–250.Londres, Reino Unido.
- Mazzaferro E. Capítulo 26, Pancreatitis. Emergencias en Pequeños Animales. Ciudad Autónoma de Buenos Aires, Argentina. Ed. InterMédica, 2013, pág.189-194.
 by Multimédica
by Multimédica