Peritonitis química por ruptura no traumática de vesícula biliar con colecistitis y presencia de un colelito de gran tamaño en un canino
Resumen breve
Se describe el hallazgo de peritonitis química en un canino Bull Terrier de 4 años, debido a la ruptura no traumática de la vesícula biliar, en presencia de un colelito de gran tamaño (3 cm de diámetro) y colecistitis. El cuadro clínico estuvo acompañado de decaimiento, vómitos, inestabilidad hemodinámica, ictericia, y dolor abdominal agudo. El diagnóstico de ruptura de la vesícula biliar se basó en el análisis del líquido de punción abdominal, asociado a imágenes ultrasonográficas.…Índice de contenidos
Resumen
Se describe el hallazgo de peritonitis química en un canino Bull Terrier de 4 años, debido a la ruptura no traumática de la vesícula biliar, en presencia de un colelito de gran tamaño (3 cm de diámetro) y colecistitis. El cuadro clínico estuvo acompañado de decaimiento, vómitos, inestabilidad hemodinámica, ictericia, y dolor abdominal agudo. El diagnóstico de ruptura de la vesícula biliar se basó en el análisis del líquido de punción abdominal, asociado a imágenes ultrasonográficas. La laparotomía exploratoria puso en evidencia la perforación de la vesícula biliar, y presencia de colelitiasis. La histopatología reveló colecistitis supurativa severa. Luego de la estabilización hemodinámica y la intervención quirúrgica, el paciente mostró una mejoría notable pudiéndose darse de alta a los 4 días del ingreso. En función de lo observado en el presente caso, la colelitiasis asociada a colecistitis debería ser considera una de las potenciales causas de peritonitis biliar por ruptura no traumática de la vesícula biliar.
Introducción
La peritonitis de origen biliar es una patología grave, que implica un serio riesgo de vida. La ruptura de la vesícula biliar es un episodio poco común en perros. Su origen puede ser traumático o no traumático. La ruptura no traumática tiene como causas posibles, al mucocele biliar, a la colelitiasis y a patologías tumorales. La colelitiasis representa una incidencia menor al 1 % en perros y gatos con patología hepática1, y se caracteriza por la formación de cálculos biliares (colelitos), que pueden producir obstrucción del tracto biliar extrahepático (OBEH). El origen y patogénesis de la colelitiasis no se conocen con precisión2. Se sabe que la colecistitis promueve la formación de colelitos, como así también la presencia de colelitos induce a la inflamación de la vesícula. La colelitiasis puede o no estar asociada con colecistitis en animales pequeños1. La éstasis biliar promueve la formación de barro biliar, compuesto por bilirrubina y mucina.
A medida que el porcentaje de mucina aumenta, las partículas de bilirrubina precipitan formando los colelitos. En humanos, la colecistitis aguda es mencionada como una de las complicaciones de la litiasis vesicular2, y se sabe que la colecistitis aguda grave puede evolucionar a colecistitis gangrenosa, con necrosis de la pared vesícal3, y su perforación es una de las posibles consecuencias4.
La signología clínica asociada a la ruptura de la vesícula biliar es inespecífica y resulta de la peritonitis química. En caso de bacterobilia, además del componente químico puede desarrollarse una peritonitis séptica. El análisis físico-químico y citológico del líquido de efusión peritoneal, obtenido mediante abdominocentesis, es de alto valor diagnóstico para peritonitis biliar. El tratamiento es quirúrgico y consiste en realizar una colecistectomía. Luego de la cirugía, el control y tratamiento del cuadro de peritonitis requiere de cuidados intensivos a través de internación. El pronóstico es de reservado a grave, dependiendo enforma sustancial del tiempo transcurrido entre la ruptura y la cirugía.
| Tabla 1. Resultados de los valores de gases y electrolitos en sangre venosa obtenidos al ingreso en un paciente con peritonitis química debido a rotura de vesícula biliar. |
| Medición | Rsultado | Valor de referncia |
| pH | 7.40 | 7.35-7.45 |
| PCO2 (mmHg) | 36 | 35-45 |
| HCO3-(mmol/l) | 24.3 | 21-28 |
| Déficit de base | -1.8 | +2.5 a -2.5 |
| SvO2 (%) | 69.4 | 60-80 |
| Sodio (mmol/l) | 143 | 136-145 |
| Potasio (mmol/l) | 3.65 | 3.5-5 |
| Calcio ionizado (mmol/l) | 1.39 | 1.12-1.50 |
| Cloro (mmol/l) | 111 | 98-106 |
| Anion Gap (mmol/l) | 8 | 3-11 |
| Hematocrito (%) | 38 | 37-55 |
| Hemoglobina (Gr%) | 13.1 | 13-17 |
| Glucemia (mg/dl) | 87 | 60-80 |
| Lactato (mmol/l) | 3.97 | 1.1-1.4 |
| Creatinina (mg/dl) | 1.42 | 60-80 |
Caso clínico
Un canino Bull Terrier macho, de 4 años, y 24 kg, fue derivado al Servicio de Urgencias del Centro Veterinarios de Derivaciones CEVEDÉ, derivado por su médico veterinario de cabecera, con indicación de laparotomía exploratoria.
Al momento de su arribo el paciente mostró un cuadro de decaimiento intenso, vómitos y abdomen agudo. La anamnesis puso en evidencia que desde hacía 2 semanas el paciente tenía vómitos de alimento sin digerir (cada 2 o 3 días), pero conservaba el apetito.
En las últimas 72 h había comenzado a decaer, en forma progresiva, y desde hacía 24 h ya no se levantaba. Adjuntado a la orden de derivación se recibió un informe de ecografía abdominal realizada ese mismo día, que informaba la presencia de líquido libre, reacción peritoneal difusa sugestiva de peritonitis y sospecha de rotura parietal de vesícula biliar.
También se recibió un tubo con contenido líquido de aspecto turbio y color marrón naranja obtenido mediante abdominocentesis.
Al examen inicial se observó un estado de sensorio deprimido, pero con conservación del estado de conciencia, temperatura rectal de 39.2 ºC, mucosas ictéricas, tiempo de relleno capilar 1.5”, pulso femoral fuerte y metatarsiano débil, presión arterial media (PAM) 78 mmHg, auscultación cardiopulmonar normal, frecuencia repiratoria (Fr) 12 mov/min., frecuencia cardíaca (Fc) 130 lat/min.

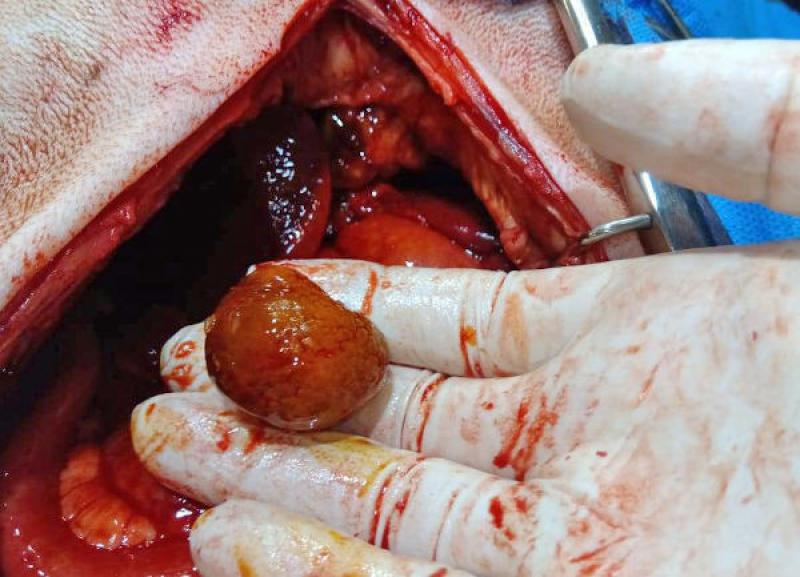
En la evaluación del abdomen se detectó distensión moderada, y puntaje elevado de la escala de dolor de Melbourne modificado (24/27) sugestivo de dolor severo. Se realizó una evaluación de los niveles sanguíneos de hematocrito, sólidos totales y glucemia, obteniéndose los siguientes resultados respectivamente: 42%, 8,5 gr% y 92 mg/dl respectivamente. Se realizó una evaluación de electrolitos y gases en sangre venosa mediante el empleo de un dispositivo de evaluación de gases portátil (EPOC, Neovet SA) (Tabla 1).
Se canalizó una vena cefálica antebraquial con catéter 18 G y se inició resucitación con fluidos guiada por metas, mediante la administración intravenosa de solución Ringer lactato en bolos de 30 ml/kg, evaluando la hemodinamia luego de cada expansión. Durante la resucitación hemodinámica se administró oxigenoterapia mediante el empleo de una máscara.
Finalizada la administración del primer bolo de Ringer lactato (total 2640 ml), el paciente mejoró sus parámetros hemodinámicos, presentando pulso metatarsiano fuerte, TAM 92 mmHg, y FC 108 lat/min. Una vez obtenida la optimización hemodinámica, se decidió realizar una laparotomía exploratoria.
Una vez en el quirófano, se implementó el siguiente protocolo anestésico: inducción con propofol a dosis 3 mg/kg, una vez intubado, se continuó con anestesia inhalatoria mediante isofluorano al 2 %, junto con el empleo de una infusión IV analgésica de fentanilo (4 mcg/ kg/h).
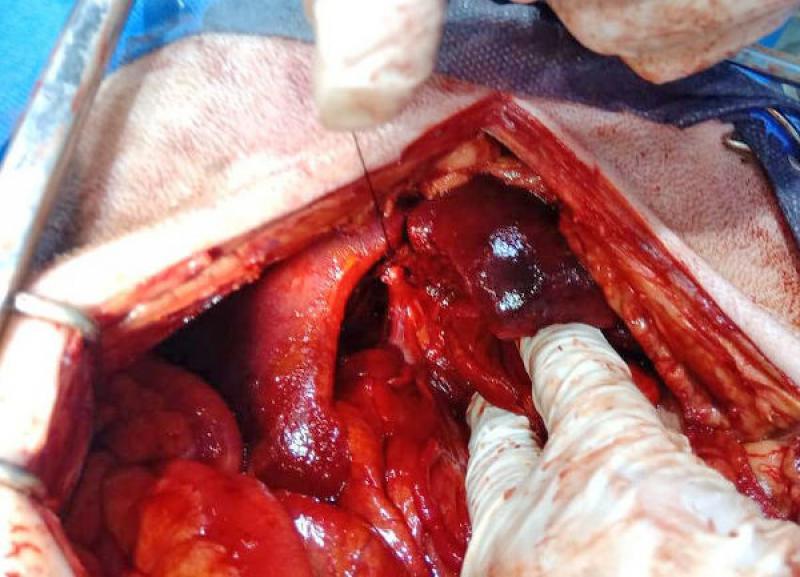
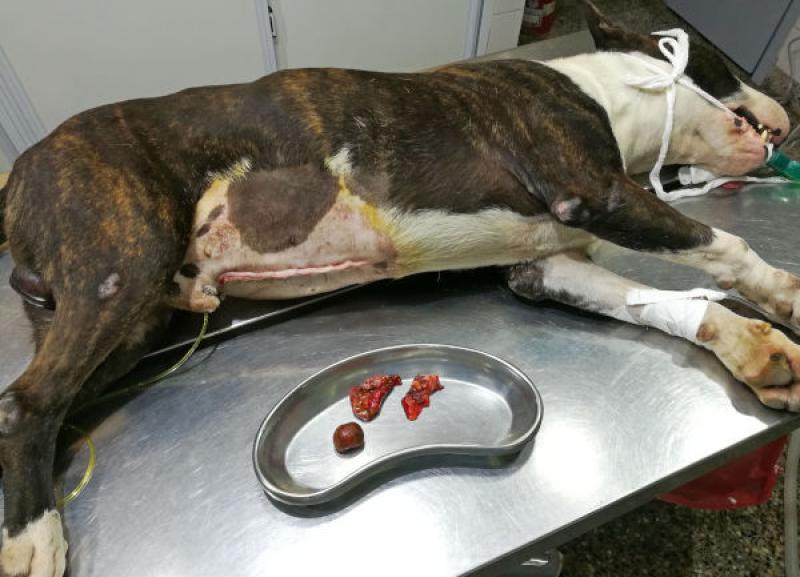
El abordaje quirúrgico se realizó mediante laparotomía mediana xifo retroumbilical, revelándose la presencia de efusión peritoneal profusa de color naranja, que se evacuó mediante el empleo de una bomba quirúrgica de succión. Una vez despejado el campo quirúrgico, se observó la vesícula biliar con una perforación amplia de aspecto desgarrante, y la exposición de un colelito de tamaño considerable (2.8 cm de diámetro), de color marrón verdoso, ambos omentados parcialmente por el epiplón.
El colelito se localizó en ubicación extraluminal, en cercanías de la vesícula. Ya desbridada la vesícula de la omentación y separada de su fijación al parénquima hepático, se comprobó la permeabilidad del colédoco, y se efectuó una colecistectomía. A continuación, se realizó lavaje peritoneal con 200 ml/kg de solución fisiológica, entibiada a 37 ºC, y se recuperó mediante aspiración con la bomba de succión. Se dejó instalado un drenaje cerrado.
Finalizada la cirugía, el paciente fue trasladado a la unidad de cuidados intensivos (UCI) donde quedó internado, instaurándose un protocolo analgésico multimodal, en base a una infusión IV continua de tramadol, ketamina y lidocaína.
Durante la hospitalización además se administró antibióticoterapia combinada (ceftriaxona 20 mg/kg/12h IV; enrofloxacina 5 mg/ kg/12h IV y metronidazol 15 mg/kg/12h IV), antiemético (metoclopramida 0.2 mg/kg/8h IV), antiácido antagonista de receptores H2 (ranitidina 2 mg/kg/12h IV) y fluidoterapia de mantenimiento con solución Ringer lactato. En la internación el paciente presentó un solo vómito y a las 12 h de finalizada la cirugía comenzó a administrarse agua de a pequeñas cantidades, que toleró.
| Tabla 2. Resultados de los análisis de sangre poscirugía. |
| Análisis | 24h | 48h* | 72h |
| Hemograma | |||
| Hermatíes/mm3 | 5.070.000 | 4.980.000 | 6.470.000 |
| Hemoglobina (Gr%) | 13,9 | 12,5 | 15,9 |
| Hermatocrito (%) | 37 | 36 | 45 |
| VCM | 74,7 | 70,4 | 69,6 |
| HbCM | 24,3 | 24,5 | 24,5 |
| CHbCM | 34,3 | 34,3 | 36 |
| Leucocitos/mm3 | 38.300 | 46.200 | 11.900 |
| Neutrófilos en banda (%) | 1 | 7 | 4 |
| Neutrófilos segmentados (%) | 75 | 80 | 76 |
| Eosinófilos (%) | 3 | 1 | 0 |
| Linfocitos (%) | 13 | 10 | 17 |
| Monocitos (%) | 9 | 2 | 7 |
| Bioquímica sanguínea | |||
| Urea (mg/dl) | 15 | 28 | |
| Creatinina (mg/dl) | 0,82 | 1,4 | |
| Proteinas totales (gr/dl) | 4,7 | 4,9 | |
| Albúminas (gr/dl) | 2,4 | 2,6 | 2,5 |
| Globulinas (gr/dl) | 2,3 | 2,3 | |
| AST/GOT (U/I) | 207 | 75 | 102 |
| ALT/GPT (U/I) | 2008 | 116 | |
| FAS (U/I) | 1.491 | 328 | 1.099 |
| Bilirrubina Total (mg/dl) | 1,6 | ||
| Bilirrubina Directa (mg/dl) | 0,80 | ||
| Bilirrubina Indirecta (mg/dl) | 0,80 | ||
A las 24 h aceptó un poco de comida, y a las 48 h se mostró animado y comió con ganas. Respecto a los controles de laboratorio, se realizaron análisis de sangre a las 24, 48 y 72 h luego de la cirugía (Tabla 2). Luego del tercer control de laboratorio, se retiró el drenaje abdominal y en base a la buena evolución clínica, el paciente se externó al día siguiente.
El tratamiento prosiguió en forma ambulatoria con las siguientes medicaciones orales: amoxiclavulámico 20 mg/kg/12h; enrofloxacina 5 mg/ kg/12h; metronidazol 15 mg/kg/12h; tramadol 2 mg/kg/8h; omeprazol 20 mg/kg/12h; y una dieta de alimento balanceado medicado hepático administrado a pequeños bocados, y repartido en 6 veces por día; con la indicación de disminuir semanalmente las frecuencias diarias hasta llegar a una frecuencia definitiva de dos comidas por día. A los 10 días de la cirugía se extrajeron los puntos de sutura de piel, y se dio el alta médica.
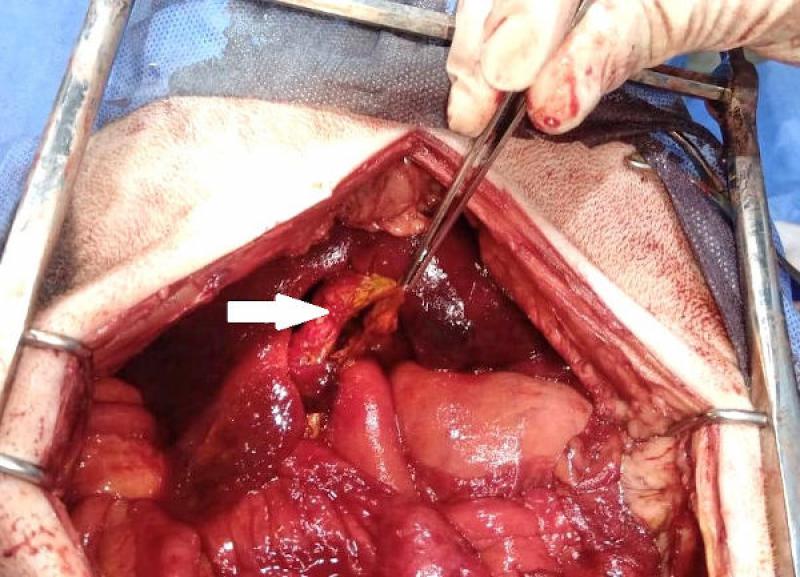
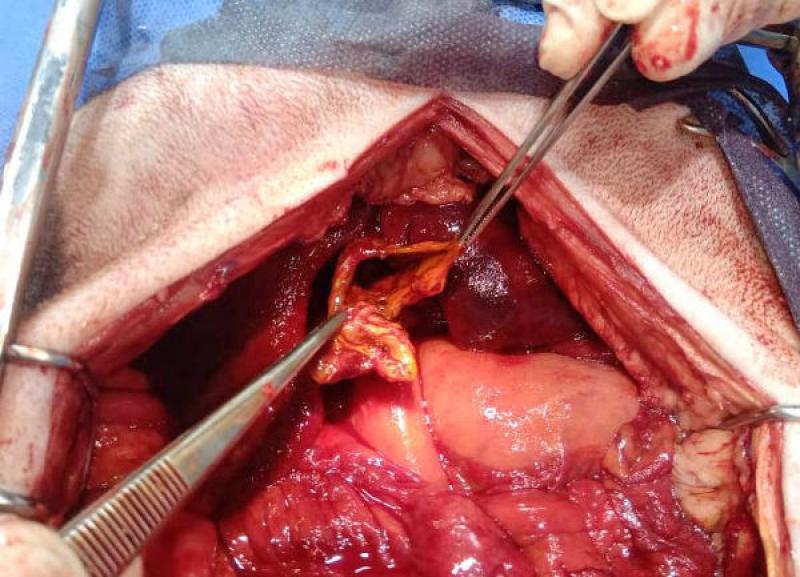
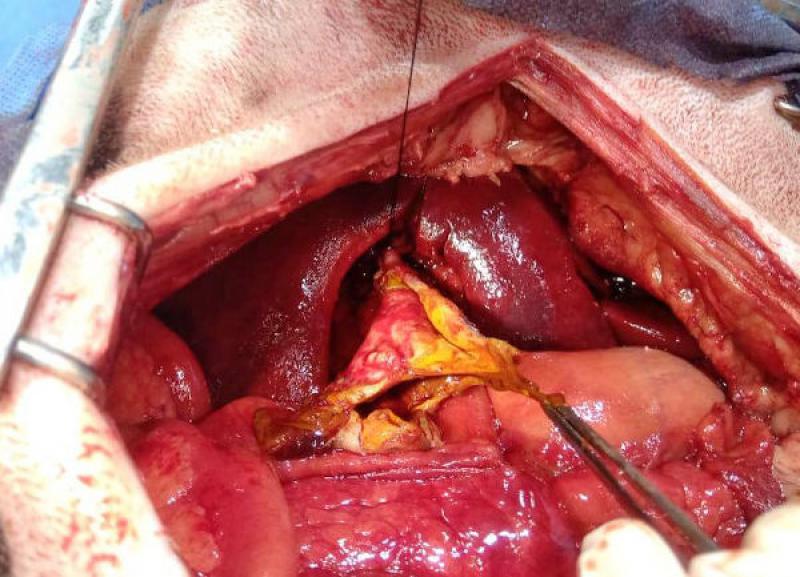

Los resultados del estudio histopatológico, y del cultivo del líquido de efusión arrojaron los siguientes resultados:
- Vesícula Biliar: consistencia firme. Aspecto heterogéneo. Color pardo oscuro.
- Descripción microscópica: lesión inflamatoria piógena en pared vesical, con necrosis licuefactiva.
- Afección peritoneal crónica con fibrosis. Ausencia de atipias. Ausencia de tejido sano.
- Diagnóstico: colecistitis supurativa severa. Peritonitis crónica secundaria.
- Cultivo del líquido de efusión peritoneal: sin desarrollo bacteriano.
- El análisis del colelito, dio los siguientes resultados:
- Color pardo, blando, y de superficie rugosa.
- Composición química: calcio, bilirrubina, hemoglobina.
Se determinó también el dosaje de bilirrubina total, directa e indirecta en el líquido de efusión arrojando los siguientes valores: bilirrubina total 38.4 mg/dl; bilirrubina directa 27.8 mg/dl; bilirrubina total 10.6 mg/dl.
Discusión
Se denomina peritonitis al proceso inflamatorio que involucra al peritoneo. El peritoneo es una membrana serosa constituida por dos hojas tisulares: una externa o parietal que recubre la pared de la cavidad abdominal, cavidad pelviana, y la cara abdominal del diafragma; y otra interna o visceral que recubre las vísceras abdominales y pelvianas.
Presenta pliegues dobles que conectan las partes parietales con las viscerales, y que se conocen como mesenterios1. Histológicamente está formada por una única capa de células mesoteliales, sostenidas por la fascia transversa. Se trata de una membrana semipermeable pasiva que cumple funciones de absorción, y exudación.
El líquido peritoneal es escaso, incoloro y translúcido, es producido por las células mesoteliales, y lubrica las vísceras, permitiéndoles deslizarse en forma libre una sobre otra o contra la pared abdominal6. La presencia de células en condiciones normales (mesoteliales, macrófagos, y linfocitos) es inferior a 1000/ µl; y la concentración de proteínas es menor a 2.5 gr%.
No coagula, pues no posee fibrinógeno, y tiene acción antibacteriana. Su circulación es de caudal a craneal en dirección hacia el diafragma. La peritonitis es una patología grave, que según su etiología se clasifica en primaria o secundaria. La secundaria a su vez puede ser de origen séptico o aséptico. La peritonitis química es aséptica, y se produce principalmente por la acción irritante de fluidos estériles sobre el peritoneo, como bilis, orina, jugo gástrico, y enzimas pancreáticas.
El jugo gástrico y las enzimas pancreáticas son marcadamente más irritantes sobre el peritoneo que la bilis y la orina. Otras causas involucran a ciertos tumores donde existen derrames (p. ej., mesoteliomas y adenocarcinomas), el empleo de sulfato de bario en radiografías gastrointestinales contrastadas cuando existe perforación visceral, y el empleo de antisépticos y antibióticos en la cavidad peritoneal durante actos quirúrgicos.
La vesícula biliar es un órgano que almacena, concentra y excreta bilis. Se localiza en la fosa vesicular en la cara visceral del hígado, entre los lóbulos medial derecho y cuadrado, adherida al parénquima hepático. Tiene forma piriforme, y está compuesta por fondo, cuerpo, y cuello que se continúa con el conducto cístico7.
La circulación de la bilis en el parénquima hepático una vez secretada por los hepatocitos, discurre a través de canalículos hacia los conductos interlobulares. Estos se unen para formar los conductos lobares, que emergen de los lóbulos hepáticos y vacían su contenido en el conducto cístico, que a su vez drena la bilis hacia la vesícula. Una vez que los conductos lobares desembocan en el cístico el conducto pasa a llamarse colédoco, que descarga su contenido en el duodeno proximal a través de la papila dudodenal mayor1.
En la parte distal del colédoco se encuentra el esfínter de Oddi, que regula la presión intraluminal, e impide el reflujo de contenido dudodenal o secreciones pancreáticas. La presencia de grasas en el contenido alimenticio a nivel duodenal induce a que los enterocitos liberen colecistoquinina, y como respuesta a la misma, la vesícula biliar se contrae, y el esfínter de Oddi se relaja, permitiendo la llegada de bilis al duodeno. La bilis actúa emulsionando las partículas de grasas en otras más pequeñas, aumentando así la superficie de acción de la lipasa pancreática8.
El principal constituyente de la bilis son los ácidos biliares, esteroides sintetizados a partir de colesterol que actúan como detergentes biológicos solubilizado las grasas presentes en el alimento favoreciendo su absorción en el intestino, son estas mismas propiedades fisicoquímicas que permiten que los ácidos biliares solubilicen las membranas biológicas cuando permanecen en contacto prolongado originando citotoxicidad6.
Las bilirrubinas son productos de la degradación de sustancias pirrólicas, 85 % a partir de la hemoglobina liberada por la destrucción de eritrocitos, 15 % de citocromos hepáticos y mioglobina9. En menor proporción se encuentra magnesio, oxalatos y calcio. Su presencia dentro de la cavidad abdominal provoca rápidamente una respuesta inflamatoria.
La ruptura de la vesícula biliar es un episodio poco común en medicina veterinaria. Su origen puede ser traumático o no traumático. Respecto a la ruptura no traumática, la presencia de colelitos es considerada como una de las causas de obstrucción biliar que puede desembocar en la perforación de la vesícula biliar, además de otras enfermedades como mucocele biliar y patologías tumorales.
La perforación de la vesícula biliar asociada con colelitiasis y colecistitis es rara en perros y la fisiopatología no está clara10. En un trabajo restrospectivo realizado sobre 15 perros con ruptura de vesícula biliar, se halló que en 9 casos se debió a ruptura de colédoco por trauma cerrado, y en los restantes 6 casos estuvo relacionada a colecistitis y/o colelitiasis11.
Brömel et al 1998, citan informes donde sobre 27 perros con colecistitis necrotizante, en 20 casos se produjo perforación de la vesícula biliar.
La signología clínica es inespecífica y resulta de la peritonitis química. En caso de bacterobilia, además del componente químico puede desarrollarse una peritonitis séptica.
El tratamiento es quirúrgico mediante la realización de una colecistectomía, y el pronóstico es de reservado a grave, dependiendo en forma sustancial del tiempo transcurrido entre la ruptura y la cirugía.
La obstrucción del tracto biliar extrahepático (OBEH), es el bloqueo del flujo de bilis desde el hígado hacia el duodeno. Las obstrucciones pueden ser extraluminales o intraluminales. Las obstrucciones extraluminales se deben a pancreatitis, o a la presencia de tumores hepáticos, pancreáticos, pilóricos, o duodenales. Las obstrucciones intraluminales incluyen a la colecistitis necrotizante, mucocele biliar, colelitiasis y coledocolitiasis.
La colelitiasis es una patología poco común, y representa menos del 1 % en perros y gatos con patología hepática1. Se caracteriza por la formación de cálculos biliares (colelitos), que pueden o no producir OBEH. Las obstrucciones pueden ocurrir a nivel de la ampolla vesical, en el conducto cístico o en el colédoco.
Los colelitos en perros son de color marrón oscuro o negro, consistencia blanda (son pobres en calcio comparado con los de humanos), y están compuestos la mayoría por bilirrubina, y en menor grado por colesterol. Respecto a su origen y patogénesis, no se conocen con precisión2. Se sabe que la colecistitis promueve la formación de colelitos, como así también la presencia de colelitos induce a la inflamación de la vesícula.
La colelitiasis puede o no estar asociada con colecistitis en animales pequeños1. La éstasis biliar promueve la formación de barro biliar, compuesto por bilirrubina y mucina. A medida que el porcentaje de mucina aumenta, las partículas de bilirrubina precipitan formando los colelitos.
En humanos la formación de cálculos es la principal causa de enfermedad biliar7. La colecistitis aguda es mencionada como una de las complicaciones de la litiasis vesicular2, y constituye el 20 % de las patologías del tracto biliar3. No se conoce la incidencia de colecistitis aguda en pacientes con cálculos biliares, pero alrededor del 95 % de las personas con colecistitis agudas tienen cálculos biliares3.
El papel de las bacterias en la patogénesis de la colecistitis aguda no está claro; se encuentran cultivos positivos de bilis o pared de la vesícula biliar en 50-75 % de los casos8. Los colelitos pueden obstruir la salida de la bilis de la vesícula en forma gradual u ocasional, y terminar en una obstrucción total, produciendo colecistitis aguda2. También se sabe que la colecistitis aguda grave puede evolucionar a colecistitis gangrenosa, con necrosis de la pared vesícal3 y su perforación es una de las posibles complicaciones9.
En las pruebas de laboratorio de sangre suele producirse aumento de bilirrubina; las enzimas GOT, GPT, GGT, FAS y los ácidos biliares pueden estar aumentados; y en el hemograma puede haber leucocitosis. Respecto al coagulograma, la obstrucción o ruptura del tracto biliar de larga data conduce a un déficit de los factores de coagulación K dependientes (II, VII, IX y X) por disminución de la absorción de vitaminas liposolubles.
Los hallazgos incluyen prolongación de los tiempos de protrombina (TP) y de tromboplastina parcial activada (KPTT), mientras que los recuentos plaquetarios son normales1.
La radiología es de utilidad relativa. La pérdida de detalle visceral debido a efusión peritoneal, asociada a una imagen descripta como de “vidrio esmerilado”, es sospechosa de peritonitis difusa. Cuando la efusión es significativa la pérdida de detalle visceral provoca que solo puedan distinguirse la burbuja gástrica, y las asas intestinales con contenido gaseoso, como imágenes radiolúcidas.
La vesícula biliar no se ve en una radiografía simple, y los colelitos pueden identificarse siempre que sean radiodensos, no así los radiolúcidos.
Ecográficamente la vesícula biliar se ve como una estructura anecogénica de forma redonda a ovalada, justo a la derecha de la línea media en la mayoría de los exámenes hepáticos. Su pared se ve muy poco o aparece como una línea ecogénica delgada, cuyo espesor es de 1-2 mm en perros12.
La ecografía es un método de alta sensibilidad para el diagnóstico de efusión peritoneal, peritonitis y para la detección de colelitos (97 %), pudiendo detectarse cálculos a partir de los 3 mm de diámetro2, (cabe mencionar que la ecografía reconoce fluidos cuando el líquido excede los 2 ml/kg, que es la mitad de lo que se necesita para hacer un diagnóstico radiológico); pero pierde valor en la detección de ruptura de vesícula biliar13.
Los colelitos se observan como formaciones hiperecogénicas acompañadas de sombra sónica posterior (incluye tanto a colelitos radiopacos como a radiolúcidos) y que se desplazan cuando se mueve al paciente. La abdominocentesis es una técnica cuyo objetivo es la obtención de líquído de efusión peritoneal y es de gran valor diagnóstico ante la sospecha de peritonitis biliar.
Se trata de una maniobra sencilla, rápida, mínimamente invasiva y que no requiere anestesia5. Para obtener líquido peritoneal (LP), debe haber una colecta mínima en abdomen de 5 ml/kg de peso. La preparación del paciente consiste en realizar la tricotomía y antisepsia de la zona a punzar. La punción se realiza con aguja hipodérmica acoplada a una llave de 3 vías y jeringa de 10 cc.
Se puede aplicar la técnica de punción única (sobre línea media, 1 a 2 cm caudal a la cicatriz umbilical) o a través de la técnica de los cuatro cuadrantes (tomando como centro la cicatriz umbilical, las punciones se realizan hacia craneo lateral derecho e izquierdo, y hacia caudolateral derecho e izquierdo). Una vez obtenido el LP, se distribuye en tubos secos, en tubos con anticoagulante (EDTA) para recuento celular, y en tubos estériles para cultivo.
Ante la presencia de peritonitis biliar aséptica el LP presentará características de exudado, con densidades mayores a 1025, proteínas de más de 3 gr/%, y recuentos celulares de más de 5000 células/mcl5. Suele ser inicialmente de color marrón amarillo, a verdoso, sin embargo, a medida que la respuesta se vuelve más celular puede tornarse más rojizo.
Por lo general, se pueden obtener grandes volúmenes de líquido. La concentración de bilirrubina puede medirse en el líquido abdominal y compararse con la concentración sérica: si el nivel de bilirrubina en el líquido abdominal es al menos dos veces mayor que los niveles de bilirrubina sérica concurrentes, es probable la peritonitis biliar.
Las concentraciones de bilirrubina líquida son varias veces más altas que las concentraciones séricas, un hallazgo que es 100 % diagnóstico. Por otro lado un valor de bilirrubina total (BT) mayor a 0.5 mg/dl en LP, o una relación de BT entre LP y sangre mayor a 0.5, es el mejor marcador de la presencia de bilirrubina en LP, e indicativo de ruptura de vías biliares5.
Debido a la presencia de bilirrubina conjugada en la bilis, puede ser válida tanto la medición de BT como de bilirrubina directa. En el caso clínico desarrollado se comprueban valores muy superiores a los mencionados. Datos a tener en cuenta: la determinación bioquímica es de gran utilidad para la indicación de laparatomía exploratoria; una diferencia en la concentración de glucosa mayor a 20 mg/dl entre sangre y LP sugiere peritonitis bacteriana; y un valor menor a 2 mmol/L en la relación lactato en sangre vs. lactato en LP, sugiere peritonitis bacteriana en caninos.
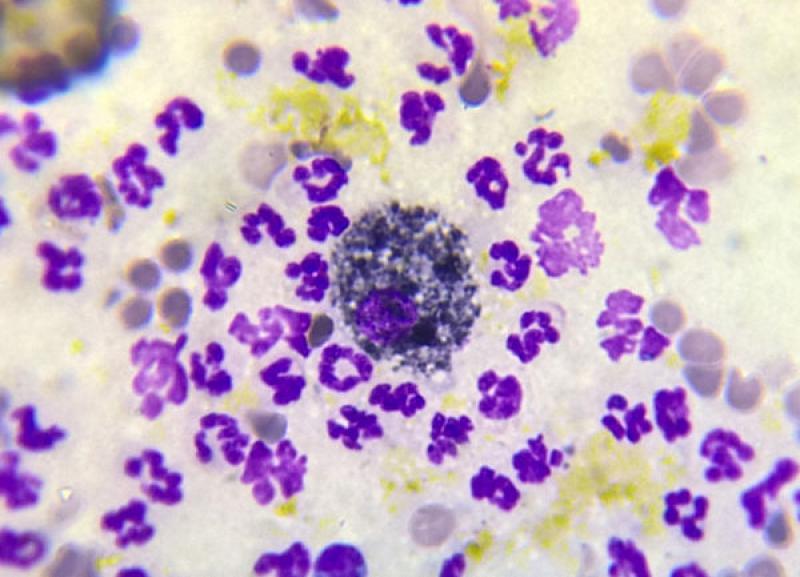
Microscópicamente la celularidad es exudativa y se compone principalmente de neutrófilos no degenerados a ligeramente degenerados con núcleos picnóticos y/o núcleos cariolíticos y un número bajo a moderado de macrófagos y células mesoteliales reactivas. Con frecuencia, la bilis se ve como material granular de color amarillo a verde a negro azulado disperso en el fondo del portaobjetos y en el citoplasma de neutrófilos, células mesoteliales reactivas y macrófagos.
En las reacciones de mayor duración, los gránulos biliares pueden haberse convertido en cristales romboidales a amorfos dorados de pigmento biliar. Estos pigmentos pueden parecerse a la hemosiderina observada en derrames hemorrágicos, y se debe tener precaución durante la interpretación. Si es necesaria una diferenciación definitiva, se puede usar tinción citoquímica para resaltar hierro en hemosiderina5-6.
Conclusiones
Pese a que la peritonitis química biliar es considerada una patología grave, el presente caso demuestra que abordada a tiempo y mediante la aplicación de protocolos adecuados, puede resolverse positivamente. Si bien hay cuadros de colelitiasis que cursan sin dolor, llama la atención en este caso que el paciente no lo haya puesto en evidencia previamente a la ruptura de la vesícula biliar, cuando el diagnóstico histopatológico describe una lesión inflamatoria piógena con necrosis licuefactiva de la misma.
Podrían contemplarse en este caso como atenuantes en su expresión, a la rusticidad de la raza, a la edad, y a las particularidades del propio individuo. En cuanto a las causas posibles de la ruptura vesical en ausencia de trauma, los autores consideran que la colecistitis necrotizante diagnosticada por histopatología guarda relación con la colelitiasis, y que la disrupción parietal se produjo como consecuencia del aumento de la presión intraluminal, debido a la ocupación de espacio por el colelito de gran tamaño, y/o por obstrucción a nivel de la ampolla vesical.
En diversos trabajos de medicina humana se ha reportado que la presencia de colelitos es una de las principales causas de colecistitis aguda debido a erosión e inflamación3, y también se sabe que la colecistitis aguda grave puede evolucionar a colecistitis gangrenosa con necrosis de la pared vesícal3, predisponiendo a su ruptura.
Bibliografia
- Neer T.M., A review of disorders of the gallbladder and extrahepatic biliary tract in the dog and cat. J Vet Intern Med, 6 (3), 186-92 May-Jun 1992.
- Almora Carbonell C., Arteaga Prado Y., Plaza González T., Prieto Ferro Y., Hernández Z. Diagnóstico clínico y epidemiológico de la litiasis vesicular. Revisión bibliográfica. Rev Ciencias Médicas vol.16 no.1 Pinar del Río ene.-feb. 2012.
- Halpin V. Acute cholecystitis. BMJ Clin Evid. 2014.
- Quevedo Guanche L. Complicaciones de la colecistitis aguda: diagnóstico y tratamiento. Rev Cubana Cir 2007; 46(2).
- D’Astek B., Tesina “Efusiones en caninos y felinos. Características físico químicas y citológicas”. Especialización en Diagnóstico Veterinario de Laboratorio. Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata (UNLP) 2019.
- Meyer, D. J., & Harvey, J. W. (1999). Capítulo 7 Evaluación del sistema hepatobiliar y anormalidades músculo esqueléticas y lipoideas. En: El laboratorio en medicina veterinaria: interpretación y diagnóstico. 2º Ed. Editiorial Inter-Médica. Pag169-201
- Céspedes R., Perozo Prieto E., Pérez-Arévalo M., Riera Nieves M., Vilá Valls V., y Reyes K. Anatomía del sistema biliar del hígado en el canino. Rev. Cient. (Maracaibo) v.18 n.6. Venezuela, dic. 2008.
- Guyton & Hall. Tratado de Fisiología Médica. Décimotercera edición, 2016.
- Quiroz Rocha G. y Bouda J. Patología clínica de hígado En: Núñez-Ochoa, L., & Bouda, J. (2007). Patología clínica veterinaria. 2ª. Segunda edición, 2007 DR© Universidad Nacional Autónoma de México. Facultad de Medicina Veterinaria y Zootecnia. Pag 120-135
- Brömel C., Léveillé R., Scrivani P.V., D.D. Smeak, Podell M.,Wagner S.O. Gallbladder perforation associated with cholelithiasis and cholecystitis in a dog. Journal of small animal practice, Volume39, Issue11. November 1998 .Pages 541-544.
- Parchman M.B., Flanders J.A. Rupture of the extrahepatic biliary tract: evaluation of the relationship between the rupture site and the cause of the rupture in 15 dogs. Cornell Vet. 1990 Jul;80(3):267-72.
- Nyland T., Moon Larson M., Mattoon J. Diagnóstico Ecográfico en Pequeños Animales, Capítulo 9, Hígado. 2da edición, 2004.
- Jaffey J.A., Graham A., VanEerde E., Hostnik E., Alvarez W., Arango J., Jacobs C., DeClue A.E. Gallbladder Mucocele: Variables Associated with Outcomeand the Utility of Ultrasonography to Identify GallbladderRupture in 219 Dogs (2007–2016). Vet Intern Med 2018;32:195–200.
 by Multimédica
by Multimédica