Analgesia perioperatoria en cirugía torácica en perros y gatos
Resumen breve
La cirugía torácica está asociada a un elevado nivel de dolor intra y posoperatorio, el cuál puede desencadenar complicaciones como hipoventilación y falta de movilidad de los pacientes, prolongar la estancia hospitalaria y aumentar la mortalidad. El diseño de un adecuado plan de analgesia es, por ello, esencial en pacientes sometidos a estos procedimientos.Índice de contenidos
Resumen
La cirugía torácica está asociada a un elevado nivel de dolor intra y postoperatorio, el cuál puede desencadenar complicaciones como hipoventilación y falta de movilidad de los pacientes, prolongar la estancia hospitalaria y aumentar la mortalidad. El diseño de un adecuado plan de analgesia es por ello esencial en pacientes sometidos a estos procedimientos. Los opioides han sido tradicionalmente la base para el tratamiento del dolor en el posoperatorio de cirugías torácicas en pequeños animales, pero estos fármacos se asocian a complicaciones como depresión respiratoria, sedación y jadeo, que no sólo retrasan la recuperación del paciente, si no que pueden confundirse con otras complicaciones asociadas a estas cirugías. Por esto, es necesario el empleo de planes de analgesia balanceada y multimodal que permitan reducir el uso de estos fármacos. En este artículo se realizará una revisión lo más completa y actualizada posible de las opciones terapéuticas indicadas para el manejo analgésico en cirugía torácica, tanto intraoperatorio como posoperatorio, incluyendo diferentes técnicas de anestesia locorregional.
Introducción
La cirugía que comprende la pared torácica, como la toracotomía, la esternotomía, la mastectomía y la exéresis de masas de gran tamaño, se considera uno de los procedimientos quirúrgicos más dolorosos. En este tipo de intervención, el dolor se genera a partir de diferentes mecanismos, como el daño muscular al realizar el abordaje quirúrgico, la retracción de las costillas o la lesión de los nervios intercostales1. La presencia de dolor perioperatorio en pacientes sometidos a cirugía torácica puede conducir a hipoventilación y, dificultar un adecuado reflejo tusígeno y movilización posoperatoria, lo que puede llevar a la aparición de complicaciones respiratorias, como son la formación de atelectasias o la aparición de neumonía2,3. Así mismo, puede conducir a la obtención de peores resultados, incluyendo un aumento del tiempo de estancia hospitalaria y de la mortalidad4-6. En medicina humana, la cirugía torácica se asocia con la aparición del síndrome de dolor crónico posoperatorio7 hasta en la mitad de los pacientes8, el cual está asociado, entre otros factores, a la presencia de dolor en el periodo posoperatorio inmediato8,9.
Es de vital importancia, por tanto, proporcionar una analgesia adecuada y evaluar correctamente la presencia de dolor durante el periodo perioperatorio para prevenir complicaciones y garantizar el confort del paciente. Tradicionalmente, el uso de opioides puros ha sido la base analgésica en la cirugía torácica, por ser los fármacos analgésicos disponibles más potentes. Sin embargo, sus efectos secundarios, como náuseas y depresión respiratoria10,11, resultan indeseables, especialmente en pacientes sometidos a cirugía torácica, en los que se ve afectada la función respiratoria por la propia cirugía y es primordial la pronta recuperación de la misma. Por ello, el uso de analgesia multimodal y balanceada es esencial en nuestro plan analgésico, ya que permite la reducción de dosis de la combinación de fármacos empleados10,11.
Por otro lado, la adecuada evaluación del dolor en el paciente es fundamental para su correcto tratamiento. En medicina veterinaria, disponemos de diversas escalas para valorar el dolor de una forma más objetiva que la mera observación del comportamiento y las constantes del paciente10,12,13(Tabla1).
| Especie | Escala | Validación |
|---|---|---|
| Gato | ||
| UNESP-Botucatu multidimensional composite pain scale | Sí | |
| Composite measure pain feline (CMP-feline) | Sí | |
| Feline grimace scale | Sí | |
| Perro | ||
| Glasgow composite measure pain scale (CMPS) y formato abreviado (CMPS-SF) | Sí | |
| Colorado State University (CSU) acute pain scale | Inicialmente, sí | |
| University of Melbourne pain scale | No | |
| Perro y gato | ||
| French Association for Animal Anaesthesia and Analgesia pain scoring system (4A-Vet) | No |
Tabla 1. Escalas de valoración de dolor agudo frecuentemente empleadas en el perro y en el gato.
Esta valoración se debe efectuar repetidamente durante el periodo posoperatorio, tanto previa como posteriormente a la administración de analgésicos. Así, puede realizarse un ajuste más preciso de las dosis empleadas, reduciéndolas o retirando fármacos (evitando sus efectos secundarios) cuando la analgesia es adecuada, y reducir la presencia de dolor, detectando a tiempo su tratamiento insuficiente y haciendo las modificaciones necesarias en el plan analgésico.
Con este artículo se pretende realizar una revisión lo más completa y actualizada posible de las diferentes técnicas de analgesia disponibles para cirugía torácica en pequeños animales.
Técnicas de analgesia para cirugía torácica
Analgesia sistémica
Opioides
Se trata de los fármacos más empleados tanto en medicina veterinaria como en humana para el tratamiento del dolor. Gracias a que actúan sobre distintos receptores y a la amplia distribución de los mismos, los opioides son capaces de interferir en la transmisión del dolor a nivel de la percepción, la modulación y la transducción, ayudando a prevenir de esta manera el estímulo doloroso14. En función del tipo de interacción farmacológica que ejercen sobre los receptores, los podemos clasificar en:
- Agonistas puros: actúan sobre el receptor µ. Son por ejemplo la morfina, la metadona, el fentanilo y la petidina.
- Agonistas parciales: actúan sobre el receptor µ. Un ejemplo es la buprenorfina.
- Agonistas/antagonistas: actúan como antagonistas de receptores µ y agonistas de receptores ĸ. Un ejemplo es el butorfanol.
Los efectos secundarios de estos fármacos dependen de la dosis y del fármaco a emplear, e incluyen sedación, depresión respiratoria, depresión cardiovascular, constipación y reducción de la motilidad intestinal, siendo estos efectos más marcados en el caso de los opioides agonistas puros11,14,15. Estas complicaciones no sólo retrasan la recuperación del paciente, si no que en el caso de la depresión respiratoria, sedación y jadeo, pueden confundirse con síntomas consecuencia de complicaciones propias de la cirugía torácica, como el neumotórax o derrame pleural. En caso de presentarse, puede ser difícil para el personal de cuidados intensivos distinguir si se están produciendo como parte de dichas complicaciones o por efecto de los opioides.
En experiencia de los autores, la metadona suele ser la opción más recomendada en premedicación por su buen efecto analgésico y duración15. La morfina tiene una potencia analgésica y duración similar a la metadona en perros y gatos15, pero debido a su efecto emético, su uso suele reservarse sólo para su administración por vía epidural o en infusión intravenosa continua (IIC)16,17. La petidina tiene escasa utilidad en cirugía torácica por su breve duración (40-60 minutos)15. Tanto la petidina como la morfina deberían evitarse en la resección de mastocitomas, ya que pueden provocar la liberación masiva de histamina14.
El fentanilo posee una potencia analgésica superior a la metadona, pero dada su corta duración15, se recomienda su uso sólo como rescate analgésico ante un estímulo nociceptivo intraoperatorio o en forma de ICC, lo que además permite una reducción significativa de la concentración alveolar mínima (CAM) de anestésicos inhalatorios18. Por otro lado, la administración de fentanilo en ICC debe usarse con mucha precaución en el posoperatorio de cirugías torácicas debido a la depresión respiratoria provocada por este fármaco15. El uso de fentanilo en forma de parches transdérmicos es interesante en el periodo posoperatorio tanto hospitalario como ambulatorio19, pero debe considerarse que las dosis terapéuticas se alcanzan aproximadamente a las 12 horas y empiezan a desaparecer al cabo de 3 días20.
El butorfanol tiene buen efecto sedante pero escaso efecto analgésico en pequeños animales14,15, por lo que en general se desaconseja su uso para proporcionar analgesia en cirugías de cualquier naturaleza. La buprenorfina, en cambio, ha demostrado ser un analgésico eficaz, especialmente en gatos, aunque puede ser insuficiente en cirugía torácica14,15.
Siempre que sea posible, deberían emplearse dosis menores de opioides en pacientes oncológicos, ya que pueden favorecen el desarrollo de neoplasias al promover la proliferación vascular, inhibir la apoptosis y las células natural-killer, además de ser estructuras que poseen más receptores opioides21.
A continuación se recogen las dosis y vías de administración de los diferentes fármacos descritos (Tabla 2).
| Fármaco | Dosis | Duración | Comentarios |
|---|---|---|---|
| Metadona | 0.1-0.5 mg/kg (P) 0.1-0.3 mg/kg (G) | 4-6 h | Jadeo y disforia en pacientes conscientes, especialmente en gatos |
| Morfina | 0.1-0.5 mg/kg (P y G) | 2-4 h | Emético por vía parenteral |
| Petidina | 3-5 mg/kg (P y G) | 40-60 min | Administración IM estricta (liberación de histamina por vía IV) |
| Fentanilo | 2-5 mcg/kg (bolo de carga) seguido de 5-20 mcg/kg/h intraoperatorio y 1-5 mcg/kg/h posoperatorio (P y G) | Bolo de carga: 20-30 minutos | Depresión respiratoria y taquifilaxia Reducir 25 % dosis en CRI intraoperatoria cada 30 min |
| Parches de fentanilo | 15 mcg/kg transcutáneo P y G <10 kg : 25 mcg/h P 10-20 kg: 50 mcg/h P 20-30 kg: 75 mcg/h P >30 kg: 100 mcg/h | Tarda alrededor de 12 horas en hacer efecto y dura un máximo de 3 días | Colocar en zonas donde el paciente no llegue a lamerse y cubrir con vendaje |
| Buprenorfina | 10-20 mcg/kg (P y G) | 4-8 h | Buena absorción oral en gatos Buen efecto analgésico incluso intraquirúrgico en gatos, más limitado en perros |
| Butorfanol | 0.1-0.4 mg/kg (P y G) | 1-2 h | Buen efecto sedante pero muy escaso efecto analgésico en perros y gatos |
Tabla 2. Principales opioides empleados en pequeños animales.
Agonistas ɑ-2 adrenérgicos
Los más empleados en pequeños animales son la dexmedetomidina y la medetomidina14. Estos fármacos actúan sobre los receptores adrenérgicos ɑ-2 localizados en el locus coeruleus del sistema nervioso central, y tienen efecto sedante, analgésico y relajante muscular11,22, siendo por ello especialmente útiles en cirugía torácica tanto en premedicación como en forma de IIC.
Sus principales efectos secundarios son cardiovasculares, ya que producen vasoconstricción inicial que cursa con bradicardia refleja e hipertensión. Otros efectos secundarios incluyen náuseas y emesis, disminución de la motilidad gastrointestinal e inhibición de la liberación de insulina, entre otros. Por ello, su uso está contraindicado o desaconsejado en patologías que impliquen una alteración de la función cardiovascular notoria, y en animales con alto riesgo de regurgitación o reflujo intraoperatorio y/o con patologías endocrinas relacionado con la regulación de la glucosa, así como en animales inestables14. Aunque no estén contraindicados, deben usarse con precaución en pacientes geriátricos y pediátricos (menos de 12 semanas)14.
Ketamina
Se trata de un anestésico y analgésico que ejerce su acción al unirse principalmente de manera no competitiva a los receptores N-metil-D-aspartato (NMDA), localizados en la región possináptica del sistema nervioso central. De esta forma, actúa sobre la modulación, previniendo la sensibilización central y la aparición del dolor crónico y neuropático14,22. Por ello, los autores recomiendan comenzar su administración uno o varios días antes de cirugías como las mastectomías radicales, para reducir el dolor basal del paciente. De cara a la cirugía, puede emplearse tanto en premedicación, como en inducción22,23 y como parte del mantenimiento anestésico en forma de IIC sola o en combinación con otros fármacos como fentanilo y lidocaína24,25, tanto por sus propiedades analgésicas como de reducción de la CAM de anestésicos inhalatorios26.
Como efectos secundarios encontramos el aumento de la frecuencia y contractilidad cardiaca y, por consiguiente, del gasto cardiaco, y depresión miocárdica, por lo que se desaconseja su uso en pacientes que son especialmente dependientes del trabajo miocárdico14. En perros y gatos suele provocar depresión respiratoria, característica14 que, si bien resultará útil para facilitar el acoplamiento del paciente a la ventilación mecánica controlada, puede ser problemática en el periodo posoperatorio.
Lidocaína
Es un anestésico local que puede emplearse en CRI para complementar el tratamiento analgésico, siendo especialmente útil en caso de dolor de origen visceral y neuropático22. Además, debido a sus propiedades antiarrítmicas, es especialmente útil en cirugía torácica en la que haya manipulación del corazón indirecta (lobectomía pulmonar, toracotomía exploratoria) o directa (pericardiectomia), la cuál puede conllevar la aparición de arritmias, como complejos prematuros ventriculares14,27. Su uso en IIC ha demostrado también efecto reductor de la CAM de anestésicos inhalatorios en perros26.
Se aconseja reducir y evitar su uso en IIC en gatos por poseer mayor toxicidad14,22 y no haber demostrado eficacia a las dosis recomendadas como analgésico28.
Antiinflamatorios no esteroideos (AINEs)
Actúan sobre la transducción del estímulo nociceptivo por inhibición de la enzima ciclooxigenasa 2 (COX-2), bloqueando de esta manera la síntesis de tromboxanos, prostaciclinas y prostaglandinas, entre las cuales se encuentran los principales mediadores de la inflamación. Esto les profiere propiedades antiinflamatorias, disminuyendo así el estímulo doloroso11,22. Se ha demostrado, además, que esta enzima está relacionada con la patogénesis y progresión de ciertos tipos de tumores, siendo beneficiosos sus efectos como terapia antitumoral11.
Se ha visto que algunos de estos fármacos también pueden inhibir la COX-1 y con ello, la síntesis de prostaglandinas endógenas en diferentes órganos y del tromboxano A2 en las membranas plaquetarias, lo cual provoca la mayoría de los efectos secundarios de los AINEs: úlceras gástricas, fallo renal, inhibición de la agregación plaquetaria, etc. Por ello, deben evitarse o emplearse con mucha precaución en pacientes con enfermedad renal crónica, enfermedad hepática, trastornos digestivos o coagulopatías. Además, hay que tener en cuenta que está contraindicado su uso en combinación con otros AINEs o corticosteroides, ya que se ejerce un efecto sinérgico que favorece sus efectos secundarios11.
Algunos de los AINEs más empleados en pequeños animales son el meloxicam, el carprofeno, el firocoxib o el robenacoxib. Los autores recomiendan su uso en cirugía torácica en el posoperatorio hospitalario y ambulatorio como parte de un protocolo de analgesia multimodal11.
Paracetamol
Se trata de un fármaco con propiedades analgésicas y antipiréticas, pero sin efecto antiinflamatorio11,29. Se han descrito diversos mecanismos de acción, entre ellos la inhibición de la isoenzima COX-3, la activación indirecta de los receptores cannabinoides CB1 y la inhibición de la vía descendente serotoninérgica29.
Se ha visto que la administración de paracetamol en las dosis recomendadas no produce efectos secundarios gastrointestinales, renales o relacionados con la agregación plaquetar en perros, mientras que en los gatos debe evitarse su uso por toxicidad debida a la deficiencia de glucuronil transferasa11.
En caso de cirugías torácicas, los autores recomiendan su uso en perros como parte de un protocolo de analgesia multimodal en el posoperatorio temprano y ambulatorio11.
Metamizol o dipirona
Es un AINE débil con potentes propiedades analgésicas, antipiréticas y espasmolíticas que no tiene las contraindicaciones ni limitaciones que se observan habitualmente en opioides o AINEs30. Su mecanismo de acción parece estar relacionado con la inhibición de las enzimas COX-3. Aunque no hay datos suficientes que demuestren la eficacia y efectos adversos del metamizol en perros y gatos, en medicina humana se ha visto que su uso en técnicas de analgesia multimodal puede reducir el consumo de opioides y, en consecuencia, sus efectos adversos30.
Gabapentina
Se trata de un fármaco neuromodulador que actúa bloqueando los canales de calcio que se encuentran en los ganglios dorsales y en la médula, ejerciendo su efecto en la modulación de la ruta de la nocicepción22.
Por sus propiedades, resulta útil para tratar el dolor crónico de diferente naturaleza (neuropático, oncológico, osteoartrosis, etc.)14. Su uso días previos a cirugías tales como la mastectomía radical, puede ser útil para reducir el nivel de dolor asociado a dicha cirugía, pero los estudios al respecto son aún limitados31.
Tiene escasos efectos secundarios, fundamentalmente sedación moderada y ataxia leve del tercio posterior32.
Maropitant
Se trata de un antagonista del receptor de neurokinina tipo 1 (NK-1), con efecto antiemético en perros y gatos debido a su acción sobre dicho receptor en la zona gatillo quimiocerreceptora del sistema nervioso central11,22. Su uso en pacientes bajo anestesia general ha mostrado tener efecto reductor de la CAM de anestésicos inhalatorios33, y se ha investigado también su potencial efecto analgésico. Un estudio mostró un efecto analgésico adyuvante del maropitant con CRI de lidocaína y ketamina en mastectomía en perras25, pero siguen siendo necesarios más estudios sobre las propiedades analgésicas de este fármaco.
A continuación se describen las dosis de los diferentes fármacos analgésicos mencionados (opioides aparte, pues se mencionan en la Tabla 2) (Tabla 3).
| Fármaco | Dosis | Comentarios |
|---|---|---|
| Ketamina | Bolo 0.5-2 mg/kg en premedicación e inducción CRI 0.2-1 mg/kg/h (P y G) | Induce depresión respiratoria Efecto analgésico sobre todo somático Evita sensibilización central |
| Lidocaína | Bolo 2-3 mg/kg CRI 20-50 mcg/kg/min (P) | Efecto analgésico neuropático y visceral Efecto antiarrítmico Evitar/reducir dosis en gatos |
| Dexmedetomidina | Bolo 0.5-1 mcg/kg CRI 0.5-2 mcg/kg/h (P y G) | Efecto sedante y analgésico visceral Reducción del gasto cardiaco Bradicardia refleja por vasoconstricción |
| Meloxicam | 0.2 mg/kg dosis inicial seguido de 0.1 mg/kg cada 24 h (P) 0.1 mg/kg dosis inicial seguido de 0.05 mg/kg cada 24 h (G) | Duración máxima recomendada de tratamiento en perros de 90 días |
| Robenacoxib | 2 mg/kg dosis inicial seguido de 1 mg/kg cada 24 h (P y G) | Uso de hasta 6 meses en perros y máximo 6 días en gatos |
| Firocoxib | 5 mg/kg cada 24 h VO (P) 1-2.5 mg/kg cada 24 h VO (G) | Sin presentación inyectable |
| Paracetamol | 10 – 15 mg/kg cada 8-12 h IV 15-20 mg/kg cada 8-12 h VO (P) | No emplear en gatos |
| Metamizol | 20-25 mg/kg cada 8-12 h (P y G) | Escasas evidencias de efectividad en pequeños animales |
| Gabapentina | 10-15 mg/kg cada 8-12 h VO (P y G) | Útil en dolor crónico de cualquier naturaleza |
Tabla 3. Dosis de diferentes analgésicos no opioides en cirugía torácica.
Técnicas de analgesia locorregional
La anestesia locorregional se puede emplear de manera complementaria o alternativa a la analgesia sistémica con el fin de evitar complicaciones del dolor, tanto agudo como crónico, causadas por una analgesia insuficiente11,14. En medicina humana, se ha demostrado que el empleo de técnicas locorregionales en toracotomía reduce la aparición de dolor crónico posoperatorio respecto al empleo de analgesia intravenosa7.
El uso de anestésicos locales como parte de una analgesia multimodal es cada vez más común en medicina veterinaria. Gracias a su mecanismo de acción, que consiste en la interrupción de la transmisión del impulso nervioso mediante el bloqueo de los canales de sodio, impiden la respuesta nociceptiva de forma más temprana que los opioides10,11, permitiendo reducir el uso de los mismos y, con ello, sus efectos secundarios.
Podemos emplear diferentes técnicas de analgesia locorregional en estos casos, todos ellos bajo anestesia general, con el paciente monitorizado y con la región a puncionar adecuadamente rasurada y desinfectada.
Epidural torácica
Se considera el gold standard en medicina humana para el control del dolor en cirugía torácica4. Sin embargo, se necesita personal cualificado para los cuidados perioperatorios que conlleva, y puede provocar efectos secundarios tales como bloqueo simpático, depresión respiratoria, retención urinaria y, de manera menos habitual, complicaciones locales tanto durante el procedimiento como después34.
Se trata de un procedimiento que no se suele realizar en medicina veterinaria debido a la dificultad técnica que supone, sus potenciales complicaciones y la falta de estudios que evalúen su riesgo-beneficio11,34.
Bloqueo paravertebral torácico
Este bloqueo proporciona analgesia a nivel somático y visceral, produciendo un efecto analgésico similar a lo que sería una epidural torácica unilateral. Esto se debe a que están implicados los nervios intercostales, las ramas comunicantes y la cadena simpática35,36.
Se han descrito tres abordajes en medicina veterinaria en función de la posición del paciente. Sin embargo, no se ha demostrado mayor eficacia en ninguno de ellos frente al resto36. En este artículo se describirá el abordaje con el paciente en decúbito lateral.
Se coloca el transductor lineal perpendicular a la columna vertebral, a la altura del espacio intercostal paravertebral donde se va a realizar el abordaje quirúrgico. Se deben identificar ecográficamente la pleura, la apófisis transversa y, en algunos casos, el ligamento costotransverso. Se introduce la aguja desde la parte caudal del transductor en dirección dorsomedial hasta llegar a la zona paravertebral, y se instila el anestésico local entre la membrana intercostal y la pleura parietal. El desplazamiento ventral de la pleura es un buen indicativo de haber realizado el bloqueo de manera adecuada (Figura 1)36.
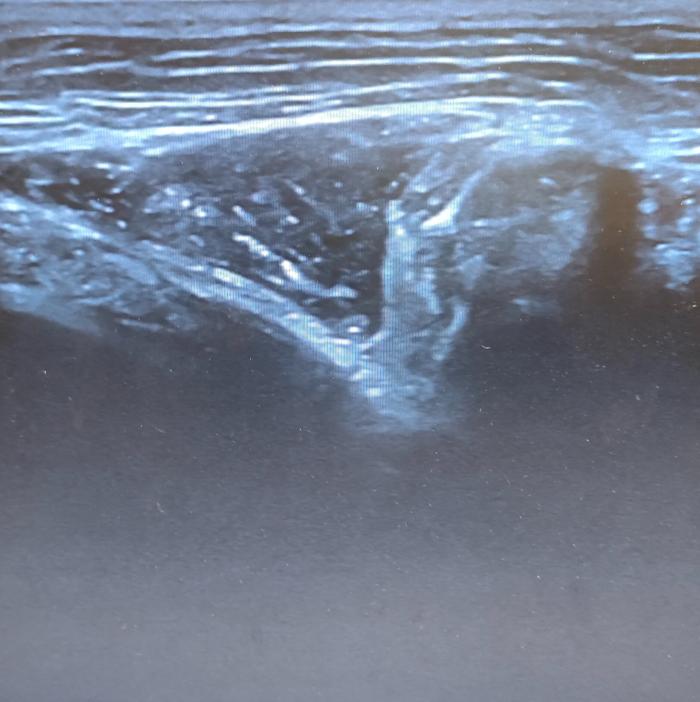
Figura 1.
Aunque aún no se han observado complicaciones de esta técnica en medicina veterinaria, en humana se han descrito neumotórax, sangrado e inyección interpleural por fallos en la punción, así como inyección directa o difusión del anestésico local al espacio epidural, causando cambios a nivel cardiovascular y respiratorio36.
Bloqueo intercostal
Los nervios intercostales suponen las ramas ventrales de las raíces nerviosas que surgen desde los agujeros intervertebrales de T1-T13 y se sitúan caudalmente a las costillas. Es importante realizar el bloqueo en la región más proximal posible, ya que distalmente se ramifican36,37.
Posicionando el transductor lineal perpendicularmente a las costillas (Figura 2), se observa la pleura, el músculo intercostal interno, la costilla y el músculo intercostal externo, en orden de más profundo a más superficial (Figura 3). Se introduce la aguja por la zona caudal de la costilla, en dirección craneomedial, hasta inocular el anestésico local entre el músculo intercostal interno y la pleura, observándose, al igual que en el caso anterior, el desplazamiento ventral de la pleura (Figura 4). El bloqueo se debe realizar en tantos espacios intercostales como sea necesario, siendo aconsejables 2 espacios craneales y 2 caudales al espacio intervenido36,37.
Como principal complicación descrita encontramos la punción de la cavidad torácica36,37. Además, la realización de bloqueos intercostales a nivel de las primeras costillas es complicada por la presencia de la escápula36.
Figura 2.
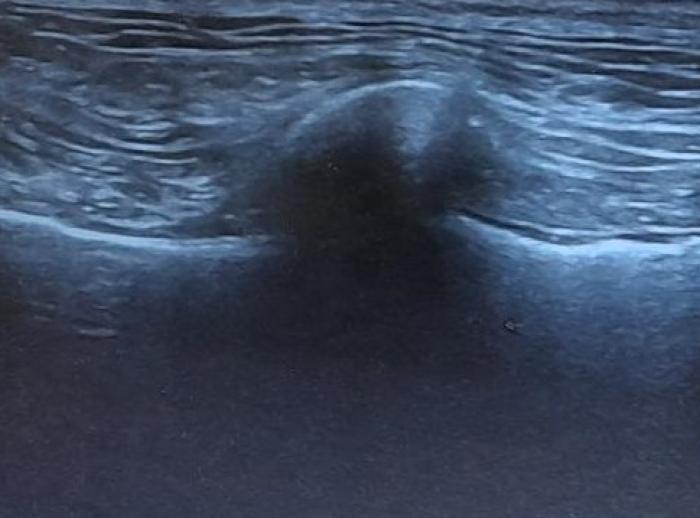
Figura 3.
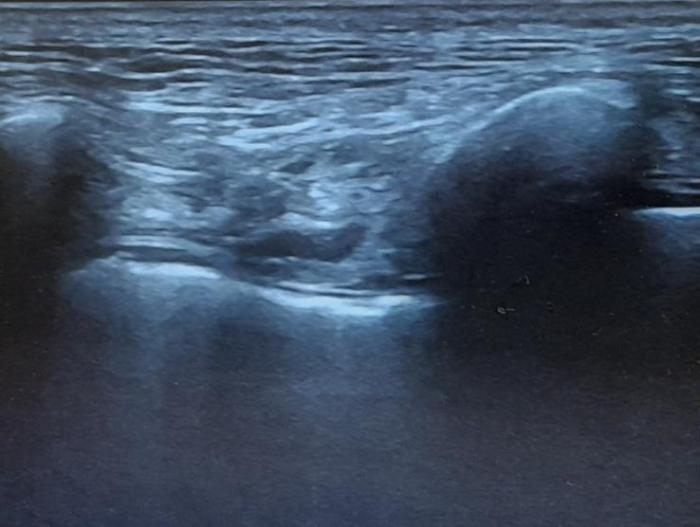
Figura 4.
Bloqueo del plano serrato
Permite bloquear las ramas cutáneas laterales de los nervios intercostales, consiguiendo analgesia de la pared torácica38,39.
Con el paciente en decúbito lateral, se coloca el transductor lineal sobre el 4º-5º espacio intercostal perpendicular a las costillas (Figura 5). Se localizan los músculos intercostales interno y externo, las costillas y el músculo serrato ventral (la capa más superficial). Se introduce una aguja espinal en el 4º espacio intercostal en dirección caudocraneal hasta posicionar la punta en la fascia situada entre los músculos serrato ventral e intercostal externo (Figura 6). El depósito de anestésico local producirá la separación de la fascia de dichos músculos (Figura 7). En caso de querer realizar el bloqueo de manera bilateral, se repartirá el volumen a instilar entre los dos hemitórax.
Al igual que el bloqueo intercostal, es fácil de realizar, pero a diferencia de este, el bloqueo del plano serrato requiere un menor número de inyecciones, lo cual reduce el riesgo de posibles punciones intravasculares o intratorácicas38. En comparación con la técnica gold standard (la epidural torácica) se ha visto un menor riesgo de hipotensión34,35.
La combinación de este bloqueo junto con el bloqueo del plano del músculo transverso del abdomen (TAP), es una buena opción para proporcionar analgesia en cirugías de mastectomía radical en perras36.
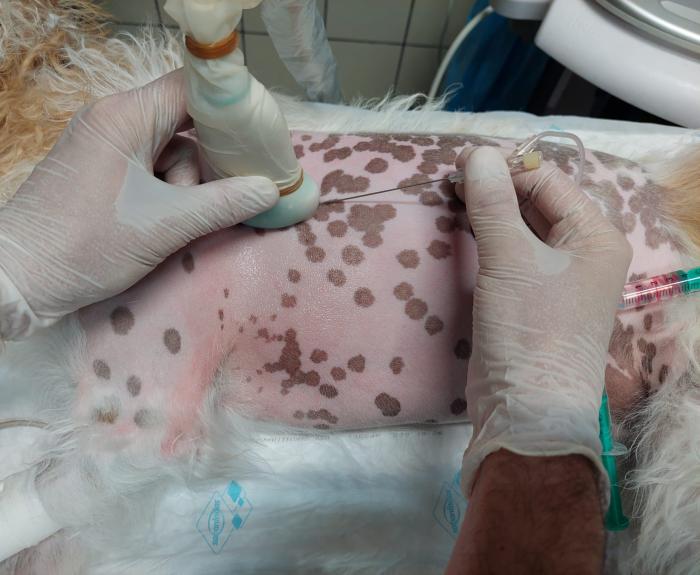
Figura 5.
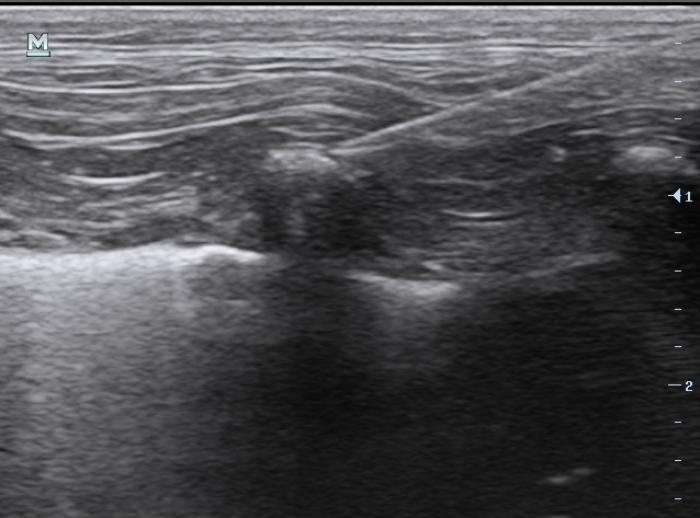
Figura 6.
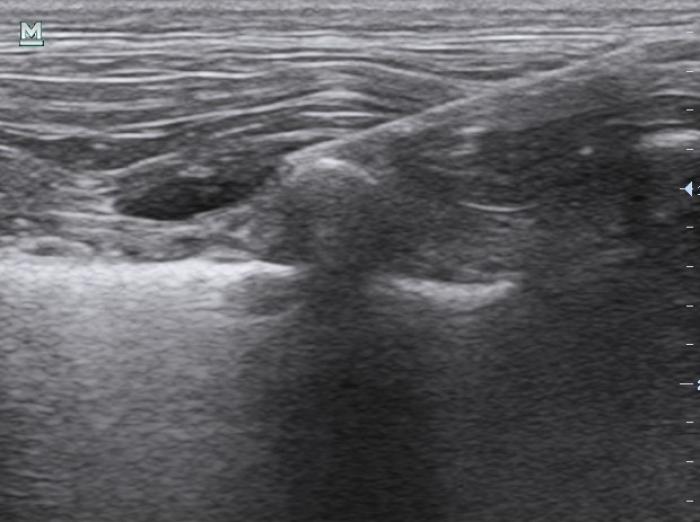
Figura 7.
Bloqueo del plano del transverso torácico
Recientemente descrito en medicina veterinaria, consiste en la inyección ecoguiada de anestésico en el plano fascial entre el músculo transverso torácico y los músculos intercostales internos40-44. Esta técnica permite la desensibilización de la parte distal de los nervios intercostales, que inervan el esternón y tejidos adyacentes. Se han descrito dos tipos de abordajes:
- Abordaje longitudinal: el transductor se coloca longitudinalmente sobre el espacio intercostal en la región paraesternal, paralelo al esternón. Se describe la administración de anestésico local en 6 puntos, los espacios intercostales segundo al séptimo40.
- Abordaje transversal: el transductor se coloca transversal al esternón, alineado longitudinalmente con los cartílagos intercostales. Se ha descrito la técnica en un punto, administrando el anestésico en el quinto espacio intercostal41, y en dos puntos, administrando el anestésico en el tercer y sexto espacios intercostales42,43. La mejor distribución del anestésico se observó con el abordaje en dos puntos y volúmenes de anestésico elevados42. Se han reportado dos casos clínicos en los que se empleó esta técnica locorregional como analgesia en esternotomía, con buenos resultados43,44.
Bloqueo interpleural
Consiste en la instilación de anestésico local directamente a la cavidad pleural a través de un tubo de drenaje torácico, difundiéndose el anestésico local e insensibilizando de esta manera los nervios intercostales2,45. Se trata de una técnica efectiva y segura para el manejo del dolor posquirúrgico en toracotomías, con mínimos efectos secundarios y sin hipoventilación ni sedación asociadas2,45. Los autores recomiendan diluir el anestésico local con suero salino fisiológico en proporción 1:1 o 1:2 para alcanzar suficiente volumen.
Dado que la instilación de anestésico local en la cavidad pleural puede causar molestia por el pH ácido del fármaco, se aconseja su dilución con bicarbonato sódico en proporción 1 parte de bicarbonato: 6-9 partes de anestésico local46.
Administración de anestésico local por catéteres regionales
Esta técnica es empleada como coadyuvante en el control del dolor posoperatorio en cirugías como mastectomías radicales y exéresis de masas de gran tamaño47,48. Consiste en la colocación de un catéter flexible cerca o a lo largo de la incisión quirúrgica que permite la administración de anestésico local en infusión continua47 o en bolos48. Su uso en el espacio preperitoneal ha mostrado una efectividad en el tratamiento del dolor similar a la metadona49 y a la epidural50 en perras sometidas a ovariohisterectomía. Posibles complicaciones asociadas a este tipo de catéteres son la desconexión de la infusión de anestésico local del catéter, formación de seromas, edema o toxicidad sistémica por anestésico local47.
Otras técnicas
En humana, un estudio comparó la eficacia analgésica del bloqueo del erector espinal bilateral a nivel de T5 con la epidural torácica en cirugía cardiaca, encontrándose resultados muy similares51, pero en conocimiento de los autores, aún no se ha probado la efectividad de esta técnica en cirugía torácica en pequeños animales.
A continuación, se recogen las referencias anatómicas y dosis de anestésico local empleadas para cada técnica (Tabla 4). Para garantizar que el efecto de estas técnicas permanezca durante el posoperatorio, los autores recomiendan emplear bupivacaína o ropivacaína por su mayor tiempo de duración que otros anestésicos locales.
Conclusiones
- Dado el elevado nivel de dolor asociado a la cirugía torácica, el diseño de un adecuado plan analgésico es esencial para mejorar la recuperación del paciente y acortar el tiempo de hospitalización.
- El empleo de analgesia balanceada y multimodal (siendo especialmente importantes las técnicas de anestesia locorregional) durante el perioperatorio permite una reducción del uso de opioides, disminuyendo así los efectos secundarios de los mismos tales como sedación y depresión respiratoria.
- Finalmente, debe destacarse que la bibliografía respecto a la evaluación y tratamiento del dolor torácico es escasa en medicina veterinaria, siendo necesarios más estudios para llegar al grado de evidencia científica existente actualmente en medicina humana.
Agradecimientos
- A Cristina Sánchez Vicente (Hospital Veterinario Puchol, servicio de anestesia y dolor), autora de la foto correspondiente a la Figura 1.
- A Víctor López Ramis (ACV, Hospital Clínico Veterinario Complutense, servicio de anestesia de pequeños animales), autor de las fotos correspondientes a las Figuras 5, 6 y 7.
Bibliografía
- Pavlidou K, Papazoglou L, Savvas I, Kazakos G. Analgesia for small animal thoracic surgery. Compend Contin Educ Vet. 2009;31(9):432-436.
- Conzemius MG, Brockman DJ, King LG, Perkowski SZ. Analgesia in dogs after intercostal thoracotomy: a clinical trial comparing intravenous buprenorphine and interpleural bupivacaine.Vet Surg. 1994;23(4):291-298.
- Read K, Khatun M, Murphy H. Comparison of transdermal fentanyl and oral tramadol for lateral thoracotomy in dogs: cardiovascular and behavioural data.Vet Anaesth Analg. 2019;46(1):116-125.
- Marshall K, McLaughlin K. Pain Management in Thoracic Surgery.Thorac Surg Clin. 2020;30(3):339-346.
- Mesbah A, Yeung J, Gao F. Pain after thoracotomy. BJA Education. 2016;16(1):1–7.
- Pennefather SH, McKevith J. Pain Management After Thoracic Surgery. In: Slinger, MD, FRCPC, P. (eds) Principles and Practice of Anesthesia for Thoracic Surgery. Springer. 2011. New York, NY.
- Reyad RM, Shaker EH, Ghobrial HZ, et al. The impact of ultrasound-guided continuous serratus anterior plane block versus intravenous patient-controlled analgesia on the incidence and severity of post-thoracotomy pain syndrome: A randomized, controlled study. Eur J Pain. 2020;24(1):159-170.
- Katz J, Jackson M, Kavanagh BP, Sandler AN. Acute pain after thoracic surgery predicts long-term post-thoracotomy pain. Clin J Pain. 1996;12(1):50-55.
- Bayman EO, Parekh KR, Keech J, Selte A, Brennan TJ. A Prospective Study of Chronic Pain after Thoracic Surgery. Anesthesiology. 2017;126(5):938-951.
- Epstein M, Rodan I, Griffenhagen G, et al. 2015 AAHA/AAFP Pain Management Guidelines for Dogs and Cats. J Am Anim Hosp Assoc. 2015;51(2):67-84.
- Mathews K, Kronen PW, Lascelles D, et al. Guidelines for recognition, assessment and treatment of pain: WSAVA Global Pain Council members and co-authors of this document:J Small Anim Pract. 2014;55(6): E10-E68.
- Calvo G, Holden E, Reid J, et al. Development of a behaviour-based measurement tool with defined intervention level for assessing acute pain in cats. J Small Anim Pract. 2014;55(12):622-9.
- Evangelista MC, Watanabe R, Leung VSY, et al. Facial expressions of pain in cats: the development and validation of a Feline Grimace Scale.Sci Rep. 2019;9(1):19128.
- Rioja-García E, Salazar-Nussio V, Martínez-Fernández M, Martínez-Taboada F. Manual de anestesia y analgesia de pequeños animales. Ed. Servet – Grupo Asís Biomedica SL. 2013. Zaragoza, España.
- Bradbrook CA, Clark L. State of the art analgesia- recent developments in pharmacological approaches to acute pain management in dogs and cats. Part 1. Vet J. 2018; 238:76-82.
- Carregaro AB, Freitas GC, Lopes C, et al. Evaluation of analgesic and physiologic effects of epidural morphine administered at a thoracic or lumbar level in dogs undergoing thoracotomy. Vet Anaesth Analg. 2014;41(2):205-11.
- Guedes AG, Rudé EP, Rider MA. Evaluation of histamine release during constant rate infusion of morphine in dogs. Vet Anaesth Analg. 2006;33(1):28-3.
- Suarez MA, Seddighi R, Egger CM, et al. Effect of fentanyl, with or without treatment of bradycardia, on the minimum alveolar concentration of isoflurane and cardiovascular function in dogs. Vet Anaesth Analg. 2022;49(1):26-35.
- Reed F, Burrow R, Poels KL, et al. Evaluation of transdermal fentanyl patch attachment in dogs and analysis of residual fentanyl content following removal. Vet Anaesth Analg. 2011;38(4):407-12.
- Egger CM, Duke T, Archer J, Cribb PH. Comparison of plasma fentanyl concentrations by using three transdermal fentanyl patch sizes in dogs. Vet Surg. 1998;27(2):159-66.
- Perry JA, Douglas H. Immunomodulatory Effects of Surgery, Pain, andOpioidsin Cancer Patients. Vet Clin North Am Small Anim Pract. 2019;49(6):981-991.
- Bradbrook C, Clark L. State of the art analgesia-Recent developments pharmacological approaches to acute pain management in dogs and cats: Part 2.Vet J. 2018;236:62-67.
- Ko JC, Murillo C, Weil AB, et al. Ketamine-propofol coadministration for induction and infusion maintenance in anesthetized dogs: effects on electroencephalography and antinociception. Animals (Basel). 2023;13(21):3391.
- De Moura RS, Bittar IP, Gomes JH, et al. Plasma concentration, cardiorespiratory and analgesic effects of ketamine-fentanyl infusion in dogs submitted to mastectomy.BMC Vet Res. 2022;18(1):225.
- Soares PCLR, Corrêa JMX, Niella RV, et al. Continuous Infusion of Ketamine and Lidocaine Either with or without Maropitant as an Adjuvant Agent for Analgesia in Female Dogs Undergoing Mastectomy. Vet Med Int. 2021; 2021:4747301.
- Muir WW 3rd, Wiese AJ, March PA. Effects of morphine, lidocaine, ketamine, and morphine-lidocaine-ketamine drug combination on minimum alveolar concentration in dogs anesthetized with isoflurane. Am J Vet Res. 2003;64(9):1155-60.
- Wright KN, Nguyenba T, Irvin HM. Lidocaine for chemical cardioversion of orthodromic atrioventricular reciprocating tachycardia in dogs. J Vet Intern Med. 2019;33(4):1585-1592.
- Pypendop BH, Ilkiw JE, Robertson SA. Effects of intravenous administration of lidocaine on the thermal threshold in cats. Am J Vet Res. 2006;67(1):16-20.
- Hernández-Avalos I, Valverde A, Ibancovichi-Camarillo JA, et al. Clinical evaluation of postoperative analgesia, cardiorespiratory parameters and changes in liver and renal function tests of paracetamol compared to meloxicam and carprofen in dogs undergoing ovariohysterectomy. PLoS One. 2020;15(2).
- Imagawa VH, Fantoni DT, Tatarunas AC, et al. The use of different doses of metamizol for post-operative analgesia in dogs. Vet Anaesth Analg. 2011;38(4):385-393.
- Crociolli GC, Cassu RN, Barbero RC, et al. Gabapentin as an adjuvant for postoperative pain management in dogs undergoing mastectomy. J Vet Med Sci.2015;77(8):1011-5.
- Di Cesare F, Negro V, Ravasio G, et al. Gabapentin: clinical use andPharmacokineticsindogs, cats, and horses. Animals (Basel). 2023;13(12):2045.
- Alvillar BM, Boscan P, Mama KR, et al. Effect of epidural and intravenous use of the neurokinin-1 (NK-1) receptor antagonist maropitant on the sevoflurane minimum alveolar concentration (MAC) in dogs. Vet Anaesth Analg. 2012;39(2):201-205.
- Khalil AE, Abdallah NM, Bashandy GM, Kaddah TA. Ultrasound-Guided Serratus Anterior Plane Block Versus Thoracic Epidural Analgesia for Thoracotomy Pain. J Cardiothorac Vasc Anesth. 2017;31(1):152-158.
- Blanco R, Parras T, McDonnell JG, Prats-Galino A. Serratus plane block: a novel ultrasound-guided thoracic wall nerve block. Anaesthesia. 2013;68(11):1107-1113.
- Laredo FG, Belda E, Viscasillas J. Bloqueos locorregionales ecoguiados más utilizados en la especie canina. Parte I: miembro anterior y tórax. Clínica Veterinaria de pequeños animales AVEPA. 2019;39(3):135-144.
- Otero PE, Portela DA. Manual de anestesia regional en animales de compañía (anatomía para bloqueos guiados por ecografía y neuroestimulación). Ed. Intermédica. 2017; pág. 236-247. Buenos Aires, Argentina.
- Asorey I, Sambugaro B, Bhalla RJ, Drozdzynska M. Ultrasound-guided serratus plane block as an effective adjunct to systemic analgesia in four dogs undergoing thoracotomy. Open Vet J. 2021;10(4):407-411.
- Liu X, Song T, Xu HY, et al. The serratus anterior plane block for analgesia after thoracic surgery: A meta-analysis of randomized controlled trails. Medicine (Baltimore). 2020;99(21):e20286.
- Zublena F, Briganti A, De Gennaro C, Corletto F. Ultrasound-guided parasternal injection in dogs: a cadaver study. Vet Anaesth Analg. 2021;48(4):563-569.
- Alaman M, González-Marrón A, Lorente C, et al. Description of an Ultrasound-Guided Transverse Approach to the Transversus Thoracis Plane Block and Evaluation of Injectate Spread in Canine Cadavers. Animals (Basel). 2021;11(9):2657.
- Alaman M, Bonastre C, González-Marrón A, et al. A Two-Point Ultrasound-Guided Injection Technique for the Transversus Thoracis Plane Block: A Canine Cadaveric Study. Animals (Basel). 2022;12(17):2165.
- Alaman M, Lence R, Bonastre C, et al. An ultrasound-guided two-point transversus thoracic plane block for canine sternotomy. Vet Anaesth Analg. 2023;50(6):524-526.
- Fernández-Barrientos MA, Merlin T. Ultrasound-guided transversus thoracis plane block as part of multimodal analgesia in a dog undergoing median sternotomy. Vet Anaesth Analg. 2022;49(6):674-676.
- Thompson SE, Johnson JM. Analgesia in dogs after intercostal thoracotomy. A Comparison of morphine, selective intercostal nerve block, and interpleural regional analgesia with bupivacaine. Vet Surg. 1991;20(1):73-77.
- Fragío C. Manual de urgencias en pequeños animales. Multimédica ediciones veterinarias. 2011.
- Abelson AL, McCobb EC, Shaw S, et al. Use of wound soaker catheters for the administration of local anesthetic for post-operative analgesia: 56 cases. Vet Anaesth Analg. 2009;36(6):597-602.
- Kazmir-Lysak K, Torres-Cantó L, Ingraffia S, et al. Use of wound infusion catheters for postoperative local anaesthetic administration in cats. J Feline Med Surg. 2023;25(9):1098612X231193534.
- Morgaz J, Muñoz-Rascón P, Serrano-Rodríguez JM, et al. Effectiveness of pre-peritoneal continuous wound infusion with lidocaine for pain control following ovariohysterectomy in dogs. Vet J. 2014;202(3):522-526.
- Morgaz J, Latorre DF, Serrano-Rodríguez JM, et al. Preperitoneal ropivacaine infusion versus epidural ropivacaine-morphine for postoperative analgesia in dogs undergoing ovariohysterectomy: a randomized clinical trial. Vet Anaesth Analg. 2021;48(6):935-942.
- Nagaraja PS, Ragavendran S, Singh NG, et al. Comparison of Continuous Thoracic Epidural Analgesia with Bilateral Erector Spinae Plane Block for Perioperative Pain Management in Cardiac Surgery. Ann Card Anaesth. 2018;21(3):323-327.
 by Multimédica
by Multimédica