Anestesia en enfermedad renal crónica
Resumen breve
La enfermedad renal constituye un desafío en el campo de la anestesia veterinaria, siendo la finalidad de este artículo la aproximación al manejo anestésico de esta patología, pretendiendo realizar un recorrido inductivo desde los conceptos principales de la fisiología renal y la conexión que existe entre la anestesia y la función renal, a los efectos contra la apoptosis, la necrosis y la inflamación que producen algunos de estos fármacos, constituyendo dicha protección renal un punto…Índice de contenidos
Resumen
La enfermedad renal constituye un desafío en el campo de la anestesia veterinaria, siendo la finalidad de este artículo la aproximación al manejo anestésico de esta patología, pretendiendo realizar un recorrido inductivo desde los conceptos principales de la fisiología renal y la conexión que existe entre la anestesia y la función renal, a los efectos contra la apoptosis, la necrosis y la inflamación que producen algunos de estos fármacos, constituyendo dicha protección renal un punto determinante en el periodo perioperatorio de estos pacientes.
Introducción
La enfermedad renal crónica es un proceso frecuente en pequeños animales, observándose una prevalencia entre 2 y 3 veces mayor en gatos que en perros, constituyendo la segunda causa de enfermedad más común en gatos mayores de 5 años1 y afectando a uno de cada 5 animales geriátricos2, viéndose afectados el 31 % de los gatos mayores de 15 años3,4, mientras que en lo que respecta a la especie canina el 45 % de los animales con esta entidad clínica son mayores de 10 años4.
El objetivo en estos pacientes es garantizar un protocolo anestésico balanceado que permita minimizar la depresión cardiovascular, favorecer la circulación y el transporte de oxígeno a los riñones para prevenir un daño renal sobrevenido y la progresión de la enfermedad debida a factores tales como la hipotensión, evitando el uso de fármacos nefrotóxicos o que precisen de la excreción renal de metabolitos activos.
Fisiología renal: importancia del flujo sanguíneo y la tasa de filtración glomerular.
Los riñones juegan un papel fundamental en la excreción de los productos de desecho, toxinas, regulación de fluidos y del volumen sanguíneo, la eritropoyesis, activación de la vitamina D y secreción hormonal, así como la regulación ácido-base, el balance de electrolitos y el aclaramiento de ciertos fármacos5.
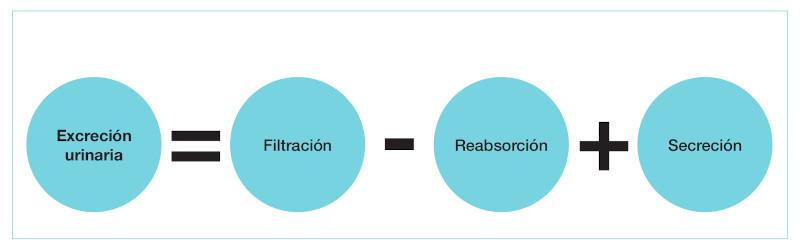
La unidad funcional del riñón es la nefrona5, que se encuentra en la corteza renal, con más de 550.000 unidades en el perro6 frente a las 190.000 presentes en el gato7, produciéndose la filtración de sangre a nivel glomerular ante las altas presiones hidrostáticas y la reabsorción desde túbulos renales por capilares peritubulares, así como la secreción de sustancias desde los capilares peritubulares a los túbulos renales (Figura 1).
En lo que respecta a estos procesos mórbidos, se produce una reducción de la masa funcional renal, así como del flujo sanguíneo y de la tasa de filtración glomerular, habiendo de tener en cuenta que en situaciones normales los riñones reciben el 25 % del gasto cardiaco a través de las arterias renales8, siendo altamente susceptibles a periodos de isquemia dada su elevada tasa metabólica y los altos requerimientos de oxígeno, destacando la dualidad en el flujo sanguíneo renal en el que la médula recibe aproximadamente la décima parte del mismo, mientras que alrededor del 95 % de este queda destinado a la perfusión de la corteza renal8, viéndose favorecidas aquellas áreas flujo-dependientes destinadas a la filtración altamente eficiente9,10.
El flujo sanguíneo renal se encuentra regulado por mecanismos extrínsecos nerviosos (fundamentalmente mediante fibras simpáticas constrictoras originadas entre T4 y L1, careciendo de inervación parasimpática) y control hormonal (p. ej., de los receptores de dopamina DA-1 y DA-2 en los vasos renales que permiten regular la vasodilatación si bien en gatos estos receptores no están presentes, encontrándose un receptor D-1-like diferente a aquel presente en perros y humanos11), así como por una autorregulación intrínseca en un rango de presiones arteriales de entre 80 y 180 mmHg12 en las que el riñón puede controlar el flujo sanguíneo mediante la adaptación de los vasos glomerulares aferentes, protegiendo la homeostasis renal durante los periodos de hipotensión e hipertensión moderadas, viéndose además una influencia tanto de factores inherentes (enfermedad renal previa) o extrínsecos al mismo (fundamentalmente hormonales o farmacológicos), y cabiendo destacar que a pesar de una presión arterial normal a consecuencia de una correcta autorregulación renal, se podrían desarrollar episodios de isquemia renal especialmente en aquellas situaciones que conducen a vasoconstricción.
En lo que respecta al aparato yuxtaglomerular, este está localizado de manera adyacente al glomérulo entre la arteriola aferente y eferente siendo responsable de la activación del sistema renina-angiotensina-aldosterona, importante tanto en la regulación del flujo sanguíneo renal como de la tasa de filtración glomerular, presentando acción sobre el tono vascular de los vasos aferentes y eferentes y actuando de manera directa sobre la presión de filtración13.
La renina facilita la conversión del angiotensinógeno producido en el hígado a angiotensina I, que se verá transformada en angiotensina II (AT-II, con capacidad vasoconstrictora) por la enzima convertidora de angiotensina que fundamentalmente se encuentra en el endotelio vascular de los pulmones y que provocará una vasoconstricción arteriolar que estará asociada con la disminución del flujo sanguíneo renal y la tasa de filtración glomerular.
Además la AT-II promueve la captación de sodio, permitiendo la retención de fluidos, aumentando por tanto volumen sanguíneo, promoviendo además la liberación de vasopresina que también produce vasoconstricción e induce la liberación prostaglandinas vasodilatadoras como la PGE2 y la prostaciclina con la finalidad de compensar los efectos vasoconstrictores de la AT-II y minimizar la isquemia local ante el incremento de la resistencia vascular a nivel renal, siendo además relevante para el mantenimiento de la tasa de filtración glomerular.
A la hora de proceder a la anestesia de estos pacientes es de especial relevancia la liberación de catecolaminas (Figura 2), bien sea por enfermedad concomitante (p. ej., feocromocitoma14) o ante estímulos nociceptivos de diversa magnitud15 que pueden presentar efectos deletéreos sobre el paciente y negativos sobre la función renal, ya que en condiciones normales estas ejercen acción en la regulación del flujo sanguíneo renal (sobre el que actúa tanto la epinefrina como la norepinefrina) causando cambios dosis-dependientes tanto en este como en la tasa de filtración glomerular.
Así, mientras que concentraciones bajas incrementan la presión arterial y el gasto cardíaco, aumentando a consecuencia el flujo sanguíneo renal sin producirse cambios en la tasa de filtración glomerular, concentraciones altas conducen junto a la liberación de aldosterona o vasopresina al incremento de la resistencia vascular periférica, la disminución del flujo sanguíneo renal y de la tasa de filtración glomerular16 por lo que el uso de una pauta de analgesia preventiva y multimodal que incluya el uso de anestésicos locales beneficiará a estos pacientes tal y como ha demostrado un estudio en medicina humana en el que la infiltración de estos disminuye la liberación de norepinefrina, renina y vasopresina.
En pequeños animales, los riñones expresan tanto la vía COX-1 como la COX-2, si bien la expresión de la COX-2 es significativamente mayor en la especie canina que en otras especies17, resultando relevante en el mantenimiento del flujo sanguíneo y la tasa de filtración glomerular cuando se activa el sistema renina-angiotensina-aldosterona.
Respecto a la COX-1, esta se encuentra en la región medular y cortical de los conductos colectores y en las arteriolas aferentes y eferentes18, lo que permite el mantenimiento de las funciones fisiológicas del riñón (fundamentalmente la regulación hemodinámica y la tasa de filtración glomerular19-21), ya que produce prostaglandinas a partir del ácido araquidónico que juegan un papel relevante en la regulación del flujo sanguíneo renal y que inhiben la liberación de norepinefrina y contrarrestan la acción de la angiotensina y la vasopresina, por lo que en condiciones normales promueven la vasodilatación e incrementan la perfusión renal, produciendo una redistribución del flujo a la región intramedular e incrementando la tasa de filtración glomerular, presentando algunas de ellas efectos natriuréticos y diuréticos.
Si bien la COX-2, fue inicialmente considerada patológica, también es constitutiva, situándose en mayor proporción en la mácula densa, y en menor medida en otras zonas de la región medular y la región cortical22, demostrando estudios experimentales sobre animales knock-out COX-2 un defecto grave en la formación y función renal23.
Del mismo modo, ciertas prostaglandinas que derivan de la COX-2 modulan el tono vascular y el equilibrio hídrico de los riñones24,25, permitiendo el transporte de cloruro y sodio y facilitando tanto el transporte de agua como la correcta circulación sanguínea.
Finalmente, la tasa de filtración glomerular es también objeto de estudio en aquellos centros en los que se dispongan de los medios, ya que describe el volumen de fluido que los capilares glomerulares filtran en un minuto26, parte del cual se eliminará a través de la orina, y aporta una información relevante para la evaluación clínica de la función excretora, viniendo determinado volumen final por la concentración, reabsorción y dilución en los túbulos proximales, asa de Henle y los túbulos distales.
Etiopatogenia y diagnóstico
La enfermedad renal crónica (ERC) es el resultado final de un amplio rango de desórdenes primarios que causan el daño irreversible de las nefronas y que conducen al deterioro de la función renal observándose una heterogenicidad variable entre nefronas (p. ej., atrofia severa, hipertrofia o fibrosis renal) y en la que puede haber anomalías morfológicas y funcionales, identificándose o no la causa o mecanismo causal (p. ej., neoplasia, amiloidosis renal, enfermedad renal poliquística) constituyendo los procesos glomerulares la principal causa de enfermedad renal en el perro, en los que como se citaba con anterioridad se produce una pérdida de nefronas y de la tasa de filtración glomerular que provoca un incremento en las concentraciones plasmáticas de sustancias como la urea y la creatinina que normalmente se eliminan durante la excreción que pueden conducir al consecuente desarrollo de síndrome urémico.
La enfermedad renal se encuentra infradiagnosticada, por lo que además de realizar una anamnesis y un examen clínico minucioso durante la consulta médica o preanestésica, se deberán de realizar exámenes analíticos completos (fundamentalmente hemograma, bioquímica y urianálisis) y pruebas de diagnóstico por imagen (p. ej., ecografía o tomografía axial computerizada) (Figura 3) realizando la medición de la presión arterial basal previamente a la anestesia, generalmente mediante el Doppler o métodos oscilométricos, habiendo de tener en cuenta el estado cardiovascular del paciente (Tabla 1).
| Tabla 1. Principales anomalías asociadas a la insuficiencia renal crónica. |
|
Aquellos pacientes con ERC, manifestarán signos inespecíficos como baja condición corporal, pérdida de musculatura, disorexia y emanciación que se verán acompañados en mayor o menor medida de la presencia de deshidratación, así como signos de bajo volumen circulante, anemia generalmente no regenerativa normocítica normocrómica (ante una baja producción de eritropoyetina, supresión de la médula ósea y disminución de la longevidad de los glóbulos rojos), hipertensión arterial, hiperfosfatemia (ante la incapacidad del riñón para excretar el fósforo), hipoalbuminemia (causada ante el daño glomerular y la disminución de la reabsorción por parte de las células epiteliales de los túbulos renales en nefropatía perdedora de proteínas), acidosis metabólica (fundamentalmente ante la reducción de la habilidad para secretar hidrogeniones y reabsorber iones bicarbonato, lo que exacerba tanto el catabolismo muscular como la azotemia, disminuyendo la unión a la albúmina de los principales principios activos, encontrándose una fracción de fármaco libre y activa mayor), osteodistrofia o coagulopatías, debiendo de realizarse una valoración conjunta mediante la determinación de la urea, la creatinina (considerándose por la IRIS –International Renal Interest Society- valores de 1,4 mg/dl y 1,6 mg/dl como el rango superior para la mayoría de perros y gatos, a excepción de galgos y razas musculadas) y el SDMA (symmetric dimethylarginine) tanto en perros como en gatos, ya que la elevación de los parámetros anteriormente citados se produce en aquellos casos en los que se reduce entre un 60 y un 75 % de la masa funcional renal mientras que un SDMA > 14 mcg/dl es sugerente de una disminución de la función renal en gatos con valores de creatinina < de 1,6 mg/dl y perros con valores < de 1,4 mg/dl27,28 debiendo de valorarse la presencia de otras entidades clínicas como la hipertensión sistémica, patología cardiovascular, diabetes mellitus o hipertiroidismo, resultando por lo tanto determinante una valoración analítica y global del paciente para el correcto manejo anestésico9.
Además, durante el examen de orina, la densidad urinaria permitirá la valoración de la función tubular, si bien no es una técnica que presente una elevada sensibilidad o especificidad, no evidenciándose una disminución de la concentración de orina relevante hasta que el 66 % de las nefronas no son funcionales y viéndose además afectada por factores como la disminución de las concentraciones de ADH o enfermedades como el hiperadrenocorticismo, debiendo de realizarse cultivo de orina en aquellos casos en los que sea necesario.
Del mismo modo, la proteinuria puede encontrarse asociada con la alteración de la filtración en casos de patología glomerular o ante la disminución de la reabsorción por las células epiteliales tubulares, por lo que es considerada como una de las piedras angulares en el diagnóstico de la insuficiencia renal crónica28, habiéndose de realizar el ratio o cociente proteína/creatinina29 (UPC, del inglés Urine Protein Creatinine ratio) que también se considera indicador temprano de enfermedad renal en pequeños animales, y que junto a los anteriormente citados contribuye a la clasificación y estadiaje de la patología renal del paciente según las directrices de la IRIS (Tablas 2 ,3 y 4).
| Tabla 2. Clasificación IRIS en función de las concentraciones de creatinina sérica. |
| Creatinina sérica (mg/dl) | ||||
| Etapa 1 ERC no azotémica | Etapa 2 Azotemia renal leve | Etapa 3 Azotemia renal moderada | Etapa 4 Azotemia renal severa |
| Perro | <1,4 mg/dl | 1,4-2,0 mg/dl | 2,1-5,0 mg/dl | >5,0 mg/dl |
| Gato | <1,6 mg/dl | 1,6-2,8 mg/dl | 2,9-5,0 mg/dl | >5,0 mg/dl |
| Tabla 3. Subestadiaje IRIS en función del grado de hiperten sión en perros y gatos. |
| <140 mmHg | Normotenso |
| 140-160 mmHg | Borderline hipertenso |
| >160 | Hipertenso |
| Tabla 4. Subestadiaje IRIS en función del grado ratio proteína creatinina en orina (UPC). |
| <0,2 (perros y gatos) | No proteinúrico |
| 10,2-0,5 (perros); 0,2-0,4 (gatos) | Borderline proteinúrico |
| >0,5 (perros); >0,4 (gatos) | Proteinúrico |
Manejo anestésico del paciente con patología renal crónica.
El manejo anestésico de estos pacientes ha de ser individualizado a sus necesidades específicas, ya que generalmente el estado del animal es muy variable, incluyendo desde pacientes asintomáticos a comprometidos, habiendo de valorar siempre su estado cardiovascular, así como los procesos concomitantes y la presión arterial, resultando la estabilización previa en aquellos casos que es posible esencial para el éxito anestésico y quirúrgico, realizando especial hincapié en la corrección de las anomalías anteriormente citadas, así como la evaluación del volumen sanguíneo circulante, del estado de hidratación del animal, y de los desequilibrios electrolíticos y ácido-base, beneficiándose los paciente azotémicos de la administración de fluidoterapia previa a la cirugía para garantizar tanto la correcta hidratación, como la diuresis que contribuyen al mantenimiento del flujo sanguíneo renal y la tasa de filtración glomerular para evitar el deterioro del paciente preservando la función renal30,31, habiéndose de valorar la administración de hemoderivados en función del hematocrito, el estado clínico del paciente y las posibilidades o presencia de sangrado intraoperatorio.
Generalmente, el ayuno será de entre 6 y 8 horas ante el retraso del vaciado gástrico, debiendo de disponer de agua ad libitum hasta el periodo previo a la premedicación, resultando apropiada una tasa de administración de fluidos de 5-10 ml/Kg/h, en aquellos pacientes que no presenten anemia severa, hipoproteinemia o enfermedad cardiaca, ajustándose en casos de anuria y siendo ajustada a tiempo real con la finalidad de evitar la sobrecarga de fluidos.
Además, la preoxigenación podría prevenir la hipoxia y evitar la desaturación temprana32, siendo importante valorar la presencia de arritmias o hipoventilación que podrían presentar un impacto negativo sobre el pronóstico del animal, por lo que sería necesaria la monitorización estricta del electrocardiograma, fundamentalmente para detectar cambios en el mismo (p. ej., anomalías electrolíticas), así como de la presión arterial invasiva y no invasiva tratando de evitar episodios de hipotensión sistémica, ya que la presión arterial presenta correlación directa sobre la perfusión renal debido a que como se citaba con anterioridad la autorregulación se encuentra alterada cuando esta es menor de 80 mmHg, situación en la cual los riñones no regulan el flujo sanguíneo renal, resultando directamente proporcional a la misma y razón por la que debería mantenerse entre 70 y 80 mmHg, mientras que en pacientes hipertensos, el objetivo sería preservarla en un rango superior a fin de garantizar la correcta perfusión renal.
Del mismo modo, el correcto manejo del paciente será fundamental ante la posible disminución de la funcionalidad renal (p. ej., nefrotomías) ante la compresión directa de la arteria y vena renal o indirecta mediante el incremento de la presión intrabdominal, habiendo de tener en cuenta que técnicas como la ventilación con presión positiva o la PEEP podrían disminuir el gasto cardíaco y afectar al flujo sanguíneo renal y a la tasa de filtración glomerular30.
Farmacología anestésica en enfermedad renal
Estos pacientes requieren de una pauta anestésica balanceada y multimodal para minimizar la depresión cardiovascular que permita prevenir la progresión de la enfermedad a consecuencia de alteraciones en la presión arterial, mediante el envío adecuado de oxígeno y el mantenimiento del flujo sanguíneo renal, incluyendo en la pauta farmacológica anestésicos locales que resultan de utilidad en estos casos al disminuir la liberación de norepinefrina, renina y vasopresina, evitando el uso de fármacos nefrotóxicos o que precisen de la excreción de metabolitos activos por vía renal, además de aquellos que produzcan hipotensión y conduzcan a la disminución del gasto cardiaco, siendo ideal prevenir la respuesta simpático-adrenal y debiendo de tener en cuenta las interacciones en la farmacocinética y farmacodinámica que se producirán y la mayor sensibilidad a los diferentes fármacos anestésicos ante la presencia de hipoalbuminemia ya que ante el descenso de esta habrá una fracción libre de fármaco mayor que es la que se considera activa por lo que se ha de tener precaución a fin de evitar sobredosificaciones, habiendo también de destacar el incremento de la permeabilidad de la membrana hematoencefálica a los sedantes y anestésicos en situaciones de uremia (Tabla 5).
| Tabla 5. Interacciones y mecanismos de algunos anestésicos respecto a la función renal y el daño por isquemia-reperfusión. |
| Tipo de fármaco | Fármacos | Interacciones propuestas |
| Anestésicos inhalatorios | Metoxiflurano | Nefrotoxicidad 33 |
| Isoflurano | Efectos nefroprotectores en el ser humano 34 | |
| Sevoflurano | Nefrotoxicidad ante la producción del compuesto A (cal sodada) Mantiene la función renal estable 35 Efectos nefroprotectores 36 | |
| Sedantes, inductores y anestésicos disociativos | Dexmedetomidina | Inhibe el estrés oxidativo y la inflamación 37 |
| Midazolam | Retraso del metabolismo del fármaco en enfermedad renal aguda ante la disminución de la enzima CYP3A 38 | |
| Acepromacina | Reducción del daño histopatológico en los riñones en síndrome isquemia-reperfusión 39 Dosis elevadas (0,1 mg/Kg) producen variaciones notables en la presión arterial sistémica | |
| Propofol | Reducción de los riesgos de isquemia-reperfusión en animales de experimentación 40 Protección de las células de la apoptosis inducida por el síndrome de isquemia-reperfusión | |
| Ketamina | Acción sobre la inflamación y la alteración del metabolismo ante la hipoxia renal 41 | |
Del mismo modo y conociendo la fisiopatología de esta enfermedad, se han de valorar los efectos de los diferentes fármacos sobre el flujo sanguíneo renal o de manera indirecta ante cambios en diversos órganos y sistemas42 (p. ej., cardiovascular como algunos sedantes que actúan sobre el gasto cardiaco y el tono vasomotor43 o el sistema endocrino ante la liberación de catecolaminas), produciéndose en algunos casos un descenso de la tasa de filtración glomerular (Tabla 6).
| Tabla 6. Influencia de los anestésicos sobre el flujo sanguíneo renal y la tasa de filtración glomerular. |
| Fármaco | Flujo sanguíneo renal | Tasa de filtración glomerular |
| Benzodiacepinas | Impacto mínimo | Impacto mínimo |
| Opioides | Impacto mínimo | Impacto mínimo |
| Propofol | Impacto mínimo o leve | Impacto mínimo o leve |
| Etomidato | Sin impacto | Sin impacto |
| Tiopental sódico | Impacto mínimo | Leve disminución |
| Ketamina | Incremento | Sin variación/disminución |
| Isoflurano | Ligera disminución | Disminución |
| Sevoflurano | Ligera disminución | Disminución |
Premedicación
Alfa 2 agonistas
El uso de estos agentes puede provocar efectos depresores dosis-dependientes sobre la frecuencia cardíaca y el gasto cardíaco, incrementando la resistencia vascular sistémica44-46, debiendo de tener especial cautela ante las variaciones en la presión arterial que pueden tener impacto directo sobre la perfusión renal y la natriuresis como determina un estudio en el que el uso de una infusión de dexmedetomidina a corto plazo disminuyó el flujo sanguíneo renal un 30 %47 mientras que otro estudio describió que la medetomidina en combinación con un anticolinérgico presentaba poco impacto en la tasa de filtración glomerular en perros43, habiéndose observado un efecto diurético probablemente debido a la diuresis osmótica inducida por la inhibición de insulina y de la vasopresina, si bien intervienen mecanismos adicionales48, siendo relevante en pacientes con deshidratación, hipovolemia y obstrucción de tracto urinario en los que su administración puede causar efectos deletéreos.
La resistencia vascular se encuentra mediada en pequeños animales por los receptores alfa-1 y alfa-2, siendo los primeros más potentes49, por lo que tanto la dexmedetomidina como la medetomidina pueden alterar el flujo sanguíneo renal, aunque se considera nefroprotectora en casos de isquemia-reperfusión ante la disminución del metabolismo y sus efectos antioxidantes en animales de experimentación50.
Resulta relevante la vía de administración ya que mientras que la administración endovenosa incrementa el flujo sanguíneo renal y la tasa de filtración glomerular probablemente debido a la hipertensión inicial relativa a la misma, la administración intramuscular produce la disminución de los mismos51 habiéndose registrado una depleción de aproximadamente el 50 % del flujo sanguíneo renal asociada al descenso del gasto cardiaco en perros a los que se les administraba un alfa-2 adrenérgico en la premedicación y propofol en la inducción52.
El uso de agonistas alfa-2 en pacientes con obstrucción urinaria debería evitarse, mientras que un estudio recomienda el uso de medetomidina en gatos con enfermedad renal crónica, obstrucción dinámica del ventrículo izquierdo y cardiomiopatía hipertrófica concomitantes53.
Fenotiacinas
La acepromacina (0,01-0,03 mg/kg) produce el bloqueo de los receptores alfa-1 adrenérgicos y dopaminérgicos que desencadena una situación de vasodilatación que puede a su vez conducir junto a la administración de inductores y anestésicos volátiles a una hipotensión tan severa que se encuentre fuera de la capacidad de autorregulación renal54,55.
A pesar de ello, ciertos autores determinan cierto efecto protector renal fundamentalmente debido a que la acepromacina actúa como antagonista alfa-1 reduciendo la presión arterial al producir vasodilatación, permitiendo conservar el flujo sanguíneo renal y tasa de filtración glomerular39,54 con efecto sedante dosis dependiente56, debiendo evitarse en cualquier caso su administración a dosis altas.
A pesar de no ser considerado un agente de elección en el caso de pacientes con enfermedad renal diagnosticada se ha de valorar su utilización en función del estado preoperatorio y estadiaje de la enfermedad, resultando útil durante el postoperatorio en la recuperación dosis de 0,01 mg/kg IM/IV especialmente en casos de disforia.
Benzodiacepinas.
Presentan unos efectos sedantes mediante la acción sobre el neurotransmisor gamma-aminobutírico57 siendo además relajantes musculares, con una baja repercusión sobre el gasto cardíaco, la resistencia vascular sistémica y la presión arterial, considerándose de elección para pacientes con enfermedad renal prexistente58, habiéndose de administrar sin embargo de manera conjunta a opioides u otros sedantes ante la posible excitación paradójica que podría causar su uso aislado59.
Las benzodiacepinas no permiten la sedación efectiva en pacientes nerviosos y no son analgésicas, debiendo de evitarse en casos de enfermedad hepática concomitante, habiendo de reducirse su dosis en animales con azotemia severa, acidosis metabólica e hipoalbuminemia, debiendo de tener en cuenta que el diazepam incluye propilenglicol que puede producir daños a nivel del túbulo renal proximal60,61, por lo que en estos pacientes se prefiere el midazolam, que es hidrosoluble y no contiene propilenglicol en su formulación.
Opioides
Los opioides constituyen una opción interesante ante su escaso impacto sobre el flujo sanguíneo renal y la tasa de filtración glomerular, utilizándose en la premedicación bien sea como agentes únicos o en combinación en animales con enfermedad renal62 ya que se pueden ajustar a dosis-efecto, debiendo de ajustarse la dosis ante la alteración de la farmacocinética (lo que es especialmente importante en opioides de larga duración), habiéndose descrito un efecto más prolongado en el ser humano ante el uso de la morfina probablemente debido a la menor tasa de eliminación de sus metabolitos63.
Además, estos presentarán mínimos efectos cardiovasculares (p. ej., bradicardia), y una capacidad analgésica que atenúa la respuesta simpática asociada a los episodios de nocicepción disminuyendo la vasoconstricción renal, permitiendo la reducción de la concentración alveolar mínima (CAM) y siendo antagonizables mediante naloxona, pudiendo optarse en función del estado del paciente y nivel de analgesia que se precise tanto por agonistas parciales, como por agonistas puros, como por los agonistas-antagonistas65. Algunos de ellos son metabolizados mediante mecanismos extrarrenales63, mientras que otros pueden producir una sedación de mayor intensidad y duración con efectos impredecibles como depresión neurológica o respiratoria (como la meperidina) no debiendo utilizarse en ningún caso la vía intravenosa tanto en el caso de esta como de la morfina debido a la potencial liberación de histamina que tendrá como consecuencia la disminución drástica de la presión arterial y la reducción potencial del flujo sanguíneo renal que puede verse complicada por el estado de hipovolemia presente, realizándose siempre una valoración analgésica con la finalidad de establecer el intervalo de administración en aquellos casos de dosificación pulsátil o adaptar la velocidad de la infusión continua.
Ketamina
La ketamina, antagonista NMDA que se puede utilizar a dosis subanestésicas produce un incremento en el flujo sanguíneo renal y la resistencia vascular renal66, si bien puede causar una alteración en la distribución del flujo sanguíneo renal y ante el uso de dosis elevadas puede disminuir el flujo sanguíneo renal ante el incremento de la resistencia vascular renal y la actividad simpática renal67.
Mientras que el 53 % de la ketamina se encuentra unida a proteínas durante el periodo de distribución del fármaco, la fracción libre aumenta en animales con enfermedad renal, ya que durante el metabolismo más del 60 % de la ketamina es biotransformada por hidroxilación, n-desmetilación y glucuronidación por el citocromo P450 al metabolito norketamina y otros metabolitos inactivos que se excretan por vía urinaria68,69 cobrando importancia que en gatos la biotransformación da lugar únicamente al metabolito norketamina70, pudiéndose producir ante la presencia de tales metabolitos activos un retraso en la excreción renal más acentuada en gatos debido a que el metabolito norketamina es activo.
Adicionalmente, la coinducción anestésica con dosis bajas de ketamina no está contraindicada aunque como se deduce de lo anteriormente citado su administración en bolo podría conducir a la acumulación en el organismo debido a la alteración de la excreción renal.
Agentes inductores.
Propofol
El propofol es un alquilfenol liposoluble con una rápida distribución que permite una inducción rápida, produciendo cambios dosis-dependientes en la presión arterial, no provocando alteraciones significativas en el flujo sanguíneo renal o la tasa de filtración glomerular durante su uso a dosis bajas71-73 por lo que se utiliza con frecuencia en pacientes con enfermedad renal, extrapolándose su uso de medicina humana donde se ha utilizado junto a técnicas de anestesia total intravenosa74 aunque en ciertas ocasiones puede causar hipotensión y un descenso de la perfusión renal por lo que es determinante la correcta selección de la premedicación y coinducción (p. ej., en asociación con una benzodiacepina, ketamina a dosis bajas o un opioide de corta duración) a la hora de disminuir las necesidades de dicho inductor anestésico75, realizando una administración lenta para evitar la sobredosis anestésica, los efectos cardiovasculares pronunciados y la apnea.
Del mismo modo, los metabolitos del propofol se excretan principalmente por orina y también por vías extrarrenales como en las heces, aunque en el perro existe una excreción biliar con ciclo enterohepático que da lugar a compuestos sulfurados poco relevantes.
Alfaxalona
El uso de alfaxalona en la inducción anestésica en pacientes renales se considera seguro, habiendo de administrarse por vía intravenosa lenta a dosis-efecto produciendo vasodilatación con la consecuente reducción de la resistencia vascular sistémica y bajo impacto sobre el gasto cardiaco si bien se precisa de más estudios sobre la farmacodinámica y farmacocinética en estos pacientes.
Etomidato
El etomidato, agente hipnótico de corta duración, es considerado uno de los agentes más seguros en pacientes con patología renal debido a su mínima repercusión sobre la frecuencia cardiaca, presión arterial y gasto cardiaco ejerciendo sus efectos ante la interacción con el receptor GABA, habiendo de plantearse un correcto protocolo anestésico que permita una inducción suave, debiendo adaptar la dosificación en función de la severidad de la enfermedad, utilizando dosis bajas en aquellos pacientes con enfermedad renal avanzada en los que produce alteraciones en el flujo sanguíneo renal o en la tasa de filtración glomerular72. Sin embargo, debe considerarse su administración en animales con enfermedad renal existente y sepsis ya que puede producir un impacto sobre la tasa de mortalidad ante la inhibición de la función adrenal, desarrollando en esos casos hipotensión, aunque principios activos como el metoxicarbonil-etomidato y el carboetomidato producen una depresión adrenocortical menor.
El riesgo de reacciones tóxicas puede ser mayor en pacientes con enfermedad renal avanzada ya que la excreción es renal por lo que ante su uso se debe seleccionar la dosis fundamentalmente en función del estado la progresión de la enfermedad.
Tiopental sódico
El tiopental no produce cambios en el flujo sanguíneo renal a pesar del incremento de la resistencia vascular renal produciendo cambios en los procesos LADME (liberación, absorción, distribución, metabolización y excreción), especialmente en la distribución ya que presentan una alta afinidad a las proteínas y en casos de azotemia hay una menor unión a las proteínas plasmáticas, lo que unido a situaciones de hipoproteinemia presentes en estos animales produce que haya una mayor cantidad de fármaco libre y que por lo tanto pueda producirse una sobredosis accidental sobre todo en casos de administración rápida del principio activo76, por lo que se recomienda evitar su uso en pacientes con azotemia o enfermedad renal.
Anestésicos inhalatorios
En lo que respecta a los anestésicos inhalatorios, el metoxiflurano fue el primer anestésico halogenado sintetizado, que causaba efectos secundarios tales como poliuria resistente a la vasopresina, hipernatremia, incrementos de la urea, e hiperosmolaridad que a su vez conducían a una disminución de la tasa de filtración glomerular y flujo sanguíneo renal. Ante tales características fue relegado por agentes con menor nefrotoxicidad como el sevofluorano, isofluorano o desfluorano.
No obstante, el sevofluorano en su reacción con la cal sodada utilizada en el pasado daba lugar al compuesto A, considerado como agente potencialmente nefrotóxico, habiendo desarrollado nuevas cales sodadas que disminuyen la formación de este compuesto en gran parte por el menor contenido de hidróxido de sodio y potasio de las mismas, no habiéndose registrado la aparición de este compuesto en el uso del isofluorano y el desfluorano que son mínimamente metabolizados a iones fluor inorgánicos (0,2 % y 0,02 % respectivamente).
En todo caso, se debe evitar el uso de flujos de gases frescos elevados, así como de absorbentes de dióxido de carbono con elevado contenido de hidróxido de sodio y potasio, disminuyendo la desecación del absorbente y la formación de productos de degradación nefrotóxicos.
Por lo tanto, ante estas condiciones todos los agentes volátiles pueden considerarse aptos para el mantenimiento anestésico de los pacientes con patología renal, determinando algunos estudios sobre medicina humana su efecto protector sobre el síndrome isquemia reperfusión77,78 por lo que estos podrían disminuir el impacto de esta sobre cerebro, corazón y pulmones79 así como efectos de protección renal a través de acciones antiapoptóticas y antiinflamatorias en modelos animales.
Otros fármacos
AINES
Ejercen su acción sobre las vías ciclooxigenasa y la lipooxigenasa, inhibiendo la liberación de mediadores del dolor y la inflamación como la PGE2 y la prostaciclina.
Sin embargo y tal como se describía con anterioridad las prostaglandinas permiten el desarrollo de ciertas funciones fisiológicas y fundamentalmente aquellas derivadas de la COX-1 pueden ser protectoras ya que durante el periodo perioperatorio el flujo sanguíneo renal puede ser dependiente de las prostaglandinas, que pueden considerarse nefroprotectoras en ciertos casos de isquemia renal, por lo que se ha de tomar en consideración a la hora de administrar antinflamatorios no esteroideos (AINEs), considerándose los agentes inhibidores COX-2 selectivos terapéuticamente superiores a otros antinflamatorios no preferenciales en estos pacientes80,81, debiendo de valorarse su administración acorde al estado del paciente fundamentalmente en casos de hipotensión intraquirúrgica aunque su administración a animales con patología renal se considera relativamente segura.
Cabe destacar que los riñones son considerados como los órganos con la segunda mayor tasa de efectos adversos ante la administración de fármacos como los AINEs81 (Tabla 7), que generalmente aparecen entre los 15 y los 30 días de administración, pero que pueden ser detectados hasta los 182 días posteriores a la administración82,83. Generalmente se manifiesta en cambios funcionales (p. ej., necrosis papilar), encontrándose incrementado el riesgo en animales con enfermedad renal crónica en los que tanto la hipertensión como la deshidratación pueden producir un descenso de la perfusión renal, siendo el riñón más dependiente de la COX-2 para la producción de prostaglandinas para mantener el balance de fluidos y el flujo sanguíneo renal83.
Además, ante las posibles situaciones de hipovolemia e hipotensión que pueden producirse durante el periodo perioperatorio, con el consecuente incremento de los efectos adversos potenciales de los AINEs y la alteración el flujo sanguíneo renal, se han de administrar fluidos y monitorizar la presión arterial, sobre todo para evitar un deterioro notable en animales en los que ya hay una disminución relativa de la función renal84.
| Tabla 7. Prostaglandinas, efectos renales y efectos adversos potenciales asociados a la administración de AINEs. |
| Efectos renales de las prostaglandinas | Efectos adversos asociados a la administración de AINEs |
| Incremento de la excreción de sodio y agua | Disminución de la excreción de sodio y agua con edema, hipertensión y retención de fluidos |
| Vasodilatación renal (incremento del flujo sanguíneo renal con aumento de TFG) | Vasoconstricción renal (azotemia, necrosis papilar, lesión tubular aguda) |
Dopamina y dobutamina.
A pesar de los potenciales efectos de la dopamina a dosis baja, fundamentalmente vasodilatadores renales y al incremento del flujo sanguíneo renal, a dosis menores de 2 mcg/Kg/min , estudios realizados en medicina humana no han determinado un mejor pronóstico de los pacientes, probablemente ante factores como la hipoxemia, la hipovolemia o la enfermedad concomitante pudiendo incluso presentar efectos negativos asociados como el incremento de la demanda de oxígeno en el túbulo proximal ante la estimulación de la diuresis y al incremento de la resistencia vascular.
En medicina veterinaria, la infusión de dopamina (1-10 mcg/kg/min) se considera de utilidad para la mejora del gasto cardíaco y la función miocárdica, habiéndose utilizado en el pasado de manera rutinaria en perros dosis de 1-3 mcg/kg/min para mejorar el flujo sanguíneo renal y tasa de filtración glomerular, no debiendo usarse dosis mayores a 10 mcg/kg/min ante la vasoconstricción renal asociada a su acción sobre los receptores alfa adrenérgicos, siendo una alternativa la dobutamina (2-20 mcg/kg/min), que incrementará el gasto cardíaco y la presión arterial careciendo de efectos dopaminérgicos.
Conclusión
El presente artículo, pretende adaptar los crecientes avances en criterios de diagnóstico, clasificación y tratamiento de los pacientes con enfermedad renal y que han constituido un punto de inflexión en la medicina de pequeños animales, realizando especial énfasis en la fisiopatología del proceso y la farmacoterapia anestésica, tratando de contribuir así a la mejor comprensión y manejo perioperatorio de esta patología, especialmente ante el aumento de la esperanza de vida de estos pacientes y de la tasa de incidencia quirúrgica y anestésica de los mismos.
Bibliografía
- O’Neill DG, Elliott J. Chronic Kidney Disease in Dogs in UK Veterinary Practices: Prevalence, Risk Factors, and Survival. JAVMA 2013;27(4), 814–821.
- Burkholder WJ. Dietary considerations for dogs and cats with renal disease. JAVMA, 2010;216: 1730–1734.
- Lulich JP. Feline renal failure: questions, answers, questions. Compendium on Continuing Education for the Practising Veterinarian. 1992;2: 127-152.
- Polzin DJ, Osborne CA. Crónico renal failure. En: Ettinger SJ, Feldman EC, eds. Textbook of Veterinary Internal Medicine, 5ª edición. Philadelphia: WB Saunders, 2000; 1634–1662
- Hall JE. Urine formation by the kidneys: I. Glomerular filtration, renal blood flow, and their control. En: Hall JE, editor. Guyton and Hall Textbook of Medical Physiology, 12th ed. Philadephia: Saunders Elsevier. 2002; 303–22.
- Williams RH, Thomas C, Bell D. Autoregulation of nephron filtration rate in the dog assessed by indicator-dilution technique. American Journal of Physiology-Renal Physiology, 1977;233(4), F282–F289
- Christie BA.Anatomy of the Urinary System. En D. Slatter (Ed.),Textbook of Small Animal Surgery. Great Britain: Saunders Elsevier. Online source
- Stoelting RK, Hillier SC. Kidneys. En: Pharmacology & Physiology in Anesthetic Practice.. Philadelphia: Lippincott Williams & Wilkins. 2006; 4th ed. pp. 817–30
- Greene SA, Grauer GF. Renal disease. En Tranquilli WJ, Thurmon JC, Grimm KA (eds): Lumb & Jones' Veterinary Anesthesia and Analgesia, 4th ed—Ames: Blackwell Publishing, 2007.
- Giebish G, Windhager E. Glomerular filtration and renal blood flow.. En Boron W, Boulpaep EL (eds): Medical Physiology—Philadelphia: Elsevier Saunders, 2005. Online source.
- Flournoy WS, Wohl JS, Albrecht‐Schmitt TJ. Pharmacologic identification of putative D1 dopamine receptors in feline kidneys. Journal if Veterinary Pharmacology and Theraphy 2003; 26(4): 283–290.
- Miles BE, Venton MG, De Wardener HE. Observations on mechanism of circulatory autoregulation in the perfused dog’s kidney. Journal if Physiology 1954;123:143–7.
- Weber P.Reaction constants of renin in juxtaglomerular apparatus and plasma renin activity after renal ischemia and hemorrhage. Kidney Internacional 1975;7(5), 331–341.
- Sonntagbauer M. .Catecholamine crisis during induction of general anesthesia. Der Anaesthesist, 2018;67(3), 209–215.
- Ledowski T.Effects of acute postoperative pain on catecholamine plasma levels, hemodynamic parameters, and cardiac autonomic control. Pain, 2000;153(4), 759–764
- Morgan GE, Mikhali MS, Murray MJ. Renal physiology & anesthesia. En: Clinical Anesthesiology. 4th ed. pp. Columbus: McGraw-Hill Medical, 2000;662-688
- Radi ZA. Patophysiology of cyclooxigenase inhibition in animal models. Toxicology and Pathology 2009;37;34-36
- Norregaard R, Kwon TH, Frokiaer J.Physiology and pathophysiology of cyclooxygenase-2 and prostaglandin E2 in the kidney. Kidney research and clinical practice 2015;34:194-200.
- Nantel F, Meadows E, Denis D, Connolly B, Metters KM, Giaid A.Immunolocalization of cyclooxygenase-2 in the macula densa of human elderly. FEBS letters 1999;457:475-477.
- DeMaria AN, Weir MR.Coxibs—beyond the GI tract: renal and cardiovascular issues. Journal of Pain and Sympthom Management 2003;25:S41-49.
- Moore N, Pollack C, Butkerait P.Adverse drug reactions and drug-drug interactions with over-the-counter NSAIDs. Therapeutics and clinical risk management 2015;11:1061-1075.
- Ahmetaj-Shala B, Kirkby NS, Knowles R.Evidence that links loss of cyclooxygenase-2 withincreased asymmetric dimethylarginine: novel explanation of cardiovascular side effects associatedwith anti-inflammatory drugs. Circulation 2015;131:633-642.
- Zhang MZ, Wang JL, Cheng HF, Harris RC, McKanna JA.Cyclooxygenase-2 in rat nephron development. The American Journal of Physiology 1997;273:F994-1002
- Khan KN, Venturini CM, Bunch RT.Interspecies differences in renal localization of cyclooxygenase isoforms: implications in nonsteroidal antiinflammatory drug-related nephrotoxicity. Toxicologic pathology 1998;26:612-620.
- Dubois RN, Abramson SB, Crofford L.Cyclooxygenase in biology and disease. FASEB journal: official publication of the Federation of American Societies for Experimental Biology 1998;12:1063-1073
- Von Hendy-Willson, VE.An overview of glomerular filtration rate testing in dogs and cats. The Veterinary Journal. 2011;188(2), 156–165.
- Relford R. Dimethylarginine. Veterinary Clinics of North America: Small Animal Practice, 2015;46(6), 941–960.
- Lees GE.Assessment and Management of Proteinuria in Dogs and Cats: 2004 ACVIM Forum Consensus Statement (Small Animal). Journal of Veterinary Internal Medicine, 2004;19(3), 377–385
- Harley L, Langston C. Proteinuria in dogs and cats.Canadian Veterinary Journal. 2012;53(6):631–638.
- Wagener G, Brentjens TE. Anesthetic concerns in patients presenting with renal failure. Anesthesiology. 2010; 28(1): 39–54.
- Lassnigg A, Donner E, Grubhofer G. Lack of renoprotective effects of dopamine and furosemide during cardiac surgery. Journal of the American Society if Nephrology 2000; 11(1): 97–104.
- McNally EM. Comparison of time to desaturation between preoxygenated and nonpreoxygenated dogs following sedation with acepromazine maleate and morphine and induction of anesthesia with propofol. American Journal of Veterinary Research, Online source
- Cousins MJ, Mazze RI: Methoxyflurane nephrotoxicity. A study of dose response in man. JAVMA 1973;225:1611–1616.
- Baxi V, Jain A, Dasgupta D.Anaesthesia for renal transplantation: an update. Indian Journal of Anaesthesia 2009;53:139–147.
- Conzen PF, Súnchele M, Melotte A. Renal function and serum fluoride concentrations in patients with stable renal insufficiency after anesthesia with sevoflurane or enflurane. Anesthesia and Analgesia 1995;81:569–575
- Faure A, Bruzzese L, Steinberg JG. Effectiveness of pure argon for renal transplant preservation in a preclinical pig model of heterotopic autotransplantation. J Transl Med 2016;14:40.
- Yuzbasioglu MF, Aykas A, Kurutas EB, Sahinkanat T. Protective effects of propofol against ischemia/reperfusion injury in rat kidneys. Renal Failure 2010;32:578–583
- Kirwan CJ, MacPhee. Acute kidney injury reduces the hepatic metabolism of midazolam in critically ill patients. Intensive Care Medicine 2012; 38(1): 76–84
- Pazoki‐Toroudi HR, Ajami M, Habibey R. Premedication and renal preconditioning: a role for alprazolam, atropine, morphine and promethazine. Fundamentals of Clinical Pathology. 2010; 24(2): 189–198.
- Yang S, Chou WP, Pei L. Effects of propofol on renal ischemia/reperfusion injury in rats. Expeeimental Therapy Medicine 2013;6:1177–1183.
- Chang EI, Zarate MA, Rabaglino MB. Ketamine suppresses hypoxia-induced inflammatory responses in the late-gestation ovine fetal kidney cortex. Journal of Physiology. 2016;594: 1295–1310
- Hall JA. Renal effects of the inhalation agents. En: Faust RJ, ed. Anesthesiology Review, 3rd edn. Philadelphia: Churchill Livingstone, 2002; 103–104
- Grimm JB, Grimm KA, Kneller SK. The effect of a combination of medetomidine–butorphanol and medetomidine, butorphanol, atropine on glomerular filtration rate in dogs. Veterinary Radiology and Ultrasound 2001; 42(5): 458–462
- Congdon JM, Marquez M, Niyom S. Evaluation of the sedative and cardiovascular effects of intramuscular administration of dexmedetomidine with and without concurrent atropine administration in dogs. JAMVA. 2011;239:81–9.
- Murrell JC, Hellebrekers LJ. Medetomidine and dexmedetomidine: a review of cardiovascular effects and antinociceptive properties in the dog. Veterinary Anesthesia and Analgesia 2005;32:117–27.
- Selmi AL, Mendes GM, Lins BT. Evaluation of the sedative and cardiorespiratory effects of dexmedetomidine, dexmedetomidine-butorphanol, and dexmedetomidine-ketamine in cats. JAMVA. 2003;222:37–41
- Lawrence CJ, Prinzen FW, de Lange S. The effect of dexmedetomidine on nutrient organ blood flow. Anesthesia and Analgesia 1996; 83(6): 1160–1165.
- Murahata Y, Hikasa Y. Comparison of the diuretic effects of medetomidine hydrochloride and xylazine hydrochloride in healthy cats. American Journal of Veterinary Research. 2012; 73(12): 1871–1880
- Strandhoy, JW. Role of alpha‐2 receptors in the regulation of renal function. Journal of Cardiovascular Pharmacology. 1985:7( 8): S28–S33
- Kilic K, Hanci V, Selek S. The effects of dexmedetomidine on mesenteric arterial occlusion‐associated gut ischemia and reperfusion‐induced gut and kidney injury in rabbits. Journal of Surgery Research 2012; 178(1): 223–232
- Anoki M, Shimada T. Renal effects of medetomidine in isoflurane-anesthetized dogs with special reference to its diuretic action. Journal of Veterinary Medical Science 2005;67:461–5
- Frendin JH, Bostrom IM, Kampa N. Effects of carprofen on renal function during medetomidine-propofol-isoflurane anesthesia in dogs. American Journal of Veterinary Research 2006; 67:1967–73.
- Lamont, LA, Bulmer BJ., Sisson D, Tranquilli, WJ.Doppler echocardiographic effects of medetomidine on dynamic left ventricular outflow tract obstruction in cats. Journal of the American Veterinary Medical Association, 2002; 221(9), 1276–1281.
- Bostrom I, Nyman G, Kampa N. Effects of acepromazine on renal function in anesthetized dogs. American Journal of Veterinary Research. 2003; 64:590–8.
- Stepien RL, Bonagura JD, Bednarski RM. Cardiorespiratory effects of acepromazine maleate and buprenorphine hydrochloride in clinically normal dogs. American Journal of Veterinary Research1995; 56:78–84.
- Brock N. Acepromazine revisited. Canadian Veterinary Journal. 1994;1935:458–9
- Tanelian DL, Kosek P, Mody I. The role of GABAa receptor/chloride channel complex in anesthesia. Anesthesiology 1993; 78:757–76.
- Jones DJ, Stehling LC, Zauder HL. Cardiovascular responses to diazepam and midazolam maleate in the dog. Anesthesiology 1979; 51:430–4.
- Ilkiw JE, Suter CM, Farver TB. The behaviour of healthy awake cats following intravenous and intramuscular administration of midazolam. Journal of Veterinary Pharmacology and Theraphy. 1996;19:205–16.
- Yorgin PD, Theodorou AA, Al‐Uzri A. Propylene glycol‐induced proximal renal tubular cell injury. American Journal of Kidney Disease. 1997; 30(1): 134–139.
- Hayman M, Seidl EC, Ali M. Acute tubular necrosis associated with propylene glycol from concomitant administration of intravenous lorazepam and trimethoprim–sulfaethoxazole. Pharmacotherapy 2003; 23(9): 1190–1194
- Weil AB. Anesthesia for patients with renal/hepatic disease. Topics on Companion Animal Medicine. 2010; 25(2): 87–91
- Davies G, Kingswood C, Street M. Pharmacokinetics of opioids in renal dysfunction. Clinical Pharmacokinetics. 1996; 31(6): 410–422.
- Danesh S, Walker LA. Effects of central administration of morphine on renal function in conscious rats. Journal of Pharmacology and Experimental Therapy 1998;244:640–5. 25
- Kongara K, Chambers P, Johnson CB. Glomerular filtration rate after tramadol, parecoxib and pindolol following anaesthesia and analgesia in comparison with morphine in dogs. Veterinary Anesthesia and Analgesia. 2009;36:86–94.
- Priano LL. Alteration of renal hemodynamics by thiopental, diazepam, and ketamine in conscious dogs. anesthesia and Analgesia 1982; 61(10): 853–862
- Chien CT, Cheng YJ, Chen CF. Differentiation of ketamine effects on renal nerve activity and renal blood flow in rats. Acta Anaesthesia. 2004; 42(4): 185–189.
- Kaka, JS, Hayton WL.Pharmacokinetics of ketamine and two metabolites in the dog. Journal of Pharmacokinetics, 1980; 8: 193–202.
- Capponi L. In vitro evaluation of differences in phase 1 metabolism of ketamine and other analgesics among humans, horses, and dogs. American Journal of Veterinary Research. 2009;70: 777–786.
- Hanna, RM. Pharmacokinetics of ketamine HCl and metabolite I in the cat: A comparison of I.V., I.M., and rectal administration. Journal of Veterinary Pharmacology and Therapy 1988; 11: 84–93
- Booke M, Armstrong C, Hinder F. The effects of propofol on hemodynamics and renal blood flow in healthy and in septic sheep, and combined with fentanyl in septic sheep. Anesthesia and Analgesia.1996; 82(4): 738–743.
- Kim S, Jung J. Evaluation of the effects of thiopental, propofol, and etomidate on glomerular filtration rate measured by the use of dynamic computed tomography in dogs. American Journal of Veterinary Research.2011; 72(1): 146–15
- Shiga Y, Minami K, Uezono Y. Effects of the intravenously administered anaesthetics ketamine, propofol, and thiamylal on the cortical renal blood flow in rats. Pharmacology 2003; 68(1): 17–23
- de Gasperi A, Mazza E, Noe L.. Pharmacokinetic profile of the induction dose of propofol in chronic renal failure patients undergoing renal transpalantation. Minerva Anesthesiology 1996; 62(1): 25–31
- Ilkiw JE, Pascoe PJ, Haskins SC. Cardiovascular and respiratory effects of propofol administration in hypovolemic dogs. American Journal of Veterinary Research. 1992;53:2323–7.
- Danhof M, Levy G. Kinetics of drug action in disease states. V. Acute effect of urea infusion on phenobarbital concentrations in rats at onset of loss of righting reflex. Journal of Pharmacology and Experimental Therapy 1985; 232(2): 430–434
- Hashiguchi H, Morooka H, Miyoshi H. Isoflurane protects renal function against ischemia and reperfusion through inhibition of protein kinases, JNK and ERK. Anesthesia and Analgesia. 2005;101:1584–1589.
- Vianna PT, Castiglia YM, Braz JR. Remifentanil, isoflurane, and preconditioning attenuate renal ischemia/reperfusion injury in rats. Transplant Procedured 2009;41:4080–4082.
- Motayagheni N, Phan S, Eshraghi C, Eghbali M: Inhibition of leptin receptor abolishes intralipid-induced cardioprotection against ischemia-reperfusion injury. Cardiology 2016;134:241.
- Papich MG. An update on nonsteroidal anti-inflammatory drugs (NSAIDs) in small animals. Veterinary Clínics of North América. Small Animal Practice. 2008;38:1243–66.
- Jones CJ, Budsberg SC. Physiologic characteristics and clinical importance of the cyclooxigenase isforms in dogs and cats. JAVMA 2009;217:721-729
- Lomas A, Lyon S, Sanderson M. Acute and chronic effects of tepoxalin on kidney function in dogs with chronic kidney disease and osteoarthritis. American Journal of Veterinary Research. 2013;74:939–44
- Yabuki A, Mitani S, Sawa M. A comparative study of chronic kidney disease in dogs and cats: induction of cyclooxygenases. Research on Veterinary Science.2012;93:893–7.
- Ko JC, Miyabiyashi T, Mandsager. Renal effects of carpofen administered to healthy dogs anesthetized with propofol and isoflurane. JAVMA 2000;217:346–9.
 by Multimédica
by Multimédica