Anestesia para traqueobroncoscopia en pequeños animales
Resumen breve
La traqueobroncoscopia es el método de elección para el diagnóstico de múltiples patologías de las vías respiratorias bajas ya que, aunque se trata de una técnica que debe realizarse bajo anestesia general, proporciona información diagnóstica fundamental que, junto con la historia clínica, el examen físico y otros estudios de imagen, ofrece una evaluación complementaria en el diagnóstico de patologías respiratorias.Esta técnica permite una visualización directa de la estructura y…Índice de contenidos
Resumen
La traqueobroncoscopia es el método de elección para el diagnóstico de múltiples patologías de las vías respiratorias bajas ya que, aunque se trata de una técnica que debe realizarse bajo anestesia general, proporciona información diagnóstica fundamental que, junto con la historia clínica, el examen físico y otros estudios de imagen, ofrece una evaluación complementaria en el diagnóstico de patologías respiratorias.
Esta técnica permite una visualización directa de la estructura y dinámica de los distintos tramos de las vías respiratorias bajas, del aspecto de la mucosa, así como el empleo de técnicas auxiliares para la obtención de muestras para su posterior estudio laboratorial.
En el presente artículo además de una breve descripción de la técnica se describen las consideraciones anestésicas que deben de tenerse en cuenta para poder realizar la traqueobroncoscopia de manera segura tanto para el animal como para el equipamiento y minimizando la aparición de posibles complicaciones sobretodo en animales que por su reducido tamaño haya que realizar la técnica sin intubación.
Introducción
El sistema respiratorio se encarga de oxigenar la sangre y eliminar el dióxido de carbono procedente del metabolismo celular. Los animales que presentan patologías respiratorias tienen una ventilación y/o una oxigenación insuficiente. Estos pacientes presentan, además, un aumento del trabajo respiratorio, que puede desencadenar en una insuficiencia respiratoria ya sea antes, durante o después de la anestesia general.
El riesgo anestésico en pacientes con patología respiratoria está incrementado por distintos motivos: pueden descompensarse durante periodos de estrés, tienen una capacidad de reserva pulmonar limitada, los fármacos anestésicos producen una depresión respiratoria que puede empeorar los gases arteriales (hipoxemia e hipercapnia), posibilidad de empeoramiento de la patología respiratoria por la anestesia (p. ej., inflamación vías aéreas, broncoconstricción, barotrauma), empeoramiento de los niveles de gases arteriales por atelectasias pulmonares y aumento del riesgo de infecciones pulmonares postanestésicas (Tabla 1).
La traqueobroncoscopia es la técnica de elección en humana para documentar todos los tipos de colapsos de las vías aéreas, por lo que, en los últimos 20 años, la endoscopia respiratoria se ha convertido en una importante técnica diagnóstica en la práctica veterinaria. Además, en ocasiones puede emplearse la traqueobroncoscopia de manera terapéutica (p. ej., extracción de cuerpos extraños en tráquea o bronquios). Antes de la aparición de la endoscopia respiratoria, aquellos pacientes con signos respiratorios se evaluaban mediante auscultación, radiografías de tórax y lavados transtraqueales, pero el empleo de la endoscopia no debe de sustituir tanto la exploración física, incluyendo la auscultación, así como la realización de otras pruebas de imagen. Existen además estudios que indican que las radiografías pueden subestimar el grado de colapso traqueal en comparación con la fluoroscopia. A pesar de que la traqueobroncoscopia requiere de anestesia, es el método más fiable para diagnosticar colapsos traqueales y es la única técnica disponible para poder valorar los bronquios principales, secundarios y bronquiolos, incluyendo el aspecto de su mucosa.
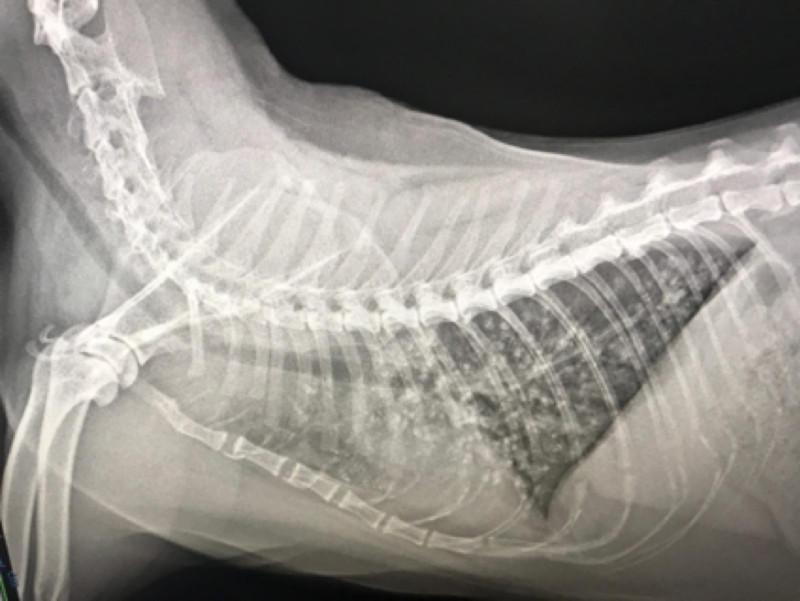
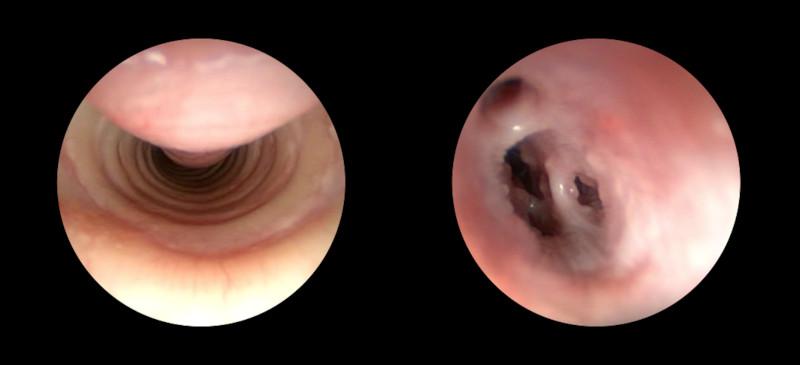
La exploración endoscópica de las vías respiratorias bajas está indicada en todos aquellos procesos que dentro de los signos clínicos presentes se encuentre uno o varios de los siguientes: tos crónica, productiva o no, asociada o no a hemoptisis, infiltrados pulmonares (Figura 1), patrones respiratorios alterados, diagnóstico de metástasis o tumores pulmonares, graduación de bronquitis crónica, cuadros tusígenos en los que se sospeche de cuerpo extraño, estridor respiratorio no laríngeo así como para confirmar o descartar colapsos traqueales o bronquiales (Figura 2) (Tabla 2).
| Tabla 1. Factores de riesgo anestésico en pacientes con pa- tología respiratoria. |
|
| Tabla 2. Indicaciones traqueobroncoscopia. |
|
Manejo anestésico
No está descrito un protocolo anestésico concreto para las traqueobroncoscopias, por lo que éste se diseñará en función de la condición del paciente, edad de este, presencia de arritmias o enfermedad cardiaca y otras patologías preexistentes. Además, en base a todo ello, se determinará el riesgo anestésico del paciente y por lo tanto el protocolo anestésico a emplear. Es importante en estos pacientes, previo a la anestesia, además de realizar un examen físico completo, hemograma, bioquímica y radiografías de tórax, llevar a cabo un estudio cardiológico completo para descartar posibles causas cardiacas que puedan ser responsables de los signos clínicos motivo de la exploración endoscópica. En casos de disfunción respiratoria grave, se recomienda realizar una gasometría arterial para evaluar la capacidad de intercambio gaseoso pulmonar siempre y cuando no suponga estrés para el paciente. En casos en los que esto no sea posible, se puede evaluar el grado de saturación de la hemoglobina mediante pulsioximetría y determinar si debe de iniciarse la suplementación con oxígeno o si previo a la realización de la traqueobroncoscopia ese paciente debe ser estabilizado.
Hay autores que recomiendan emplear lidocaína tópica (sin epinefrina) en la laringe de todos los gatos y en la tráquea de todos los perros y gatos para minimizar la sensibilidad traqueal y el reflejo tusígeno al igual que para reducir los niveles de anestesia general necesarios para realizar la prueba.
Además, los gatos pueden desarrollar un broncoespasmo con mayor facilidad que los perros durante el lavado broncoalveolar aumentando la resistencia en vías aéreas y por tanto pudiendo aparecer complicaciones en la recuperación. Por lo tanto, en estos pacientes puede ser interesante el realizar un reclutamiento alveolar tras el lavado broncoalveolar para poder abrir los posibles alveolos colapsados, seguidas por la aplicación de presión positiva al final de la espiración (PEEP) para mantener esos alveolos abiertos. Estas maniobras de reclutamiento alveolar tras la realización de la endoscopia y de la obtención de muestras mejoran la mecánica pulmonar y el intercambio gaseoso.
Muchos de los pacientes a los que se les va realizar una traqueobroncoscopia pueden estar tomando medicación de forma previa a la prueba. Si se trata de antibióticos se recomienda suspenderlos al menos una semana antes de la prueba, en caso contrario, habrá que tenerlo en cuenta de cara al estudio microbiológico (cultivo y antibiograma) para evitar falsos negativos. Sin embargo, el resto de tratamientos pueden mantenerse hasta el día de la prueba sin problemas.
La traqueobroncoscopia está contraindicada en todos aquellos pacientes que presenten coagulopatías, arritmias severas, fallo cardiaco o hipoxia severa. En aquellos pacientes en los que exista cierto grado de obstrucción parcial traqueal, marcada hipoxemia, uremia o disfunción hepática severa, hipertensión pulmonar, abscesos pulmonares, asma inestable y/o inmunosupresión puede existir un mayor riesgo de desarrollo de complicaciones, tanto durante el procedimiento como durante la recuperación anestésica.
En la premedicación de estos pacientes se deben de evitar fármacos que puedan desencadenar broncoconstricción y también todos aquellos que produzcan una liberación de histamina como la petidina y la morfina por vía intravenosa. La acepromacina inhibe la liberación de histamina, por lo que puede ser una buena opción en estos pacientes, pero a veces puede no proporcionar el grado de sedación deseado. Por su parte, los opioides puros producen depresión respiratoria y jadeo por lo que no es una buena opción en estos animales. En cambio, el butorfanol produce una menor depresión respiratoria, un mayor grado de sedación y tiene propiedades antitusígenas superiores a los opioides, por lo que al tratarse de un procedimiento no doloroso es una buena opción. En cuanto a los agonistas alfa-2 adrenérgicos, éstos son una buena opción en animales que no presenten patologías cardiovasculares ni inestabilidad cardiovascular ya que proporcionan una buena sedación y se pueden antagonizar al final del procedimiento. En casos de pacientes con patologías cardiovasculares o inestabilidad cardiovascular, puede optarse por la combinación de una benzodiacepina junto con butorfanol en la premedicación de estos pacientes.

A pesar de describirse el uso de una anestesia general intravenosa para la exploración de vías respiratorias bajas, sobretodo para la exploración traqueal, existen adaptadores que permiten acceder endoscópicamente a través del tubo endotraqueal pudiendo garantizar una anestesia general inhalatoria de forma segura (Figura 3). Estos adaptadores permiten proporcionar un flujo constante de oxígeno al 100% junto al agente anestésico inhalatorio mientras el endoscopio es introducido a través del tubo endotraqueal, garantizando un plano anestésico estable durante todo el procedimiento. Sin embargo, si el paciente es muy pequeño para poder introducir de manera cómoda un endoscopio a través del tubo endotraqueal, entonces es mejor optar por la anestesia total intravenosa (TIVA)
En el caso de optar por una TIVA, debe garantizarse un plano lo suficientemente profundo para inhibir el reflejo tusígeno ya que, si se desencadena, puede provocar tanto arcadas como el despertar del paciente durante la exploración y si esto ocurriera puede producirse no sólo el daño al equipo sino también iatrogenias al propio paciente (Tabla 3).
| Tabla 3. Fármacos empleados en traqueobroncoscopia. |
| Fármaco | Dosis | Vía de Administración |
| Agentes anestésicos Midazolam Ketamina + |
0,1-0, 3 mg/kg 1 mg/kg | Intravenosa Intravenosa |
| Anestésicos locales Lidocaina (2%) Lidocaina aerosol (10%) | 1 gota cada ventrículo laríngeo 1 spray | Tópica Aerosol |
| Broncodilatador |
|
|
| Antiinflamatorio Dexametasona | 0,05-0,2 mg/kg | Intravenosa, intramuscular o subcutánea |
Además, el uso de abrebocas evitará el daño del equipo en el caso de que el paciente estuviera bajo un plano anestésico insuficiente e intentara morder.
Es muy importante que exista una buena comunicación entre el endoscopista y el anestesista ya que hay momentos en los que es importante superficializar al paciente sin que llegue a recuperar la conciencia y se produzca un despertar durante el procedimiento, para poder hacer una valoración endoscópica de la dinámica respiratoria a nivel de las vías aéreas bajas. Si se deprime la función respiratoria del paciente de forma excesiva pueden pasar desapercibidos ciertos colapsos a nivel traqueobronquial o subestimar el grado de colapso.
El endoscopio no debe de permanecer en la vía aérea durante más de 30-50 segundos ya que puede interferir con la ventilación y generar hipercapnia, sobreinsuflación de los pulmones, trauma o broncospasmo. Incluso pueden aparecer bajadas en la frecuencia cardiaca secundarias a la obstrucción de la vía aérea por parte del endoscopio que normalmente no necesitan de la administración de atropina, sino que al retirar el endoscopio transcurridos un par de minutos se estabilice por completo. Además, debe tenerse en cuenta que en aquellos casos en los que el oxígeno se está administrando a través del canal del endoscopio el CO2 no es capaz de ser eliminado a través del mismo canal por lo que debe de administrarse el oxígeno a través del tubo endotraqueal o a través de los puertos del endoscopio. También existe la opción de administrar el oxígeno vía nasal o a través de un catéter de goma naranja colocado en la tráquea junto con el endoscopio. Pueden emplearse flujos de 1-3 litros/minuto con seguridad, los flujos más elevados se han relacionado con la sobreinsuflación de las vías aéreas, rotura de alveolos y neumotórax. Es fundamental proporcionar una adecuada ventilación durante todo el procedimiento y minimizar la depresión cardiopulmonar.
Debido al compromiso en el intercambio de gases del paciente, generalmente secundario a la obstrucción de flujo debido a la presencia del endoscopio en la vía aérea es fundamental emplear oxígeno al 100 % durante la realización del procedimiento. En casos en los que el grado de obstrucción del endoscopio a través del tubo endotraqueal sea elevado puede compensarse dicha obstrucción administrando oxígeno al 100 % a través del canal de trabajo pero con precaución para evitar barotraumas como mencionado anteriormente.
Durante la exploración endoscópica puede inducirse la aparición de broncoespasmo, especialmente en gatos como mencionado anteriormente, siendo aconsejable el empleo de broncodilatadores como la teofilina a 5 mg/kg intravenosa lenta (para evitar la aparición de taquicardias) durante los 10-15 minutos previos al procedimiento. En casos en los que aun así se produjera un broncoespasmo es aconsejable antes de despertar al paciente ventilar al paciente a ser posible con ventilación mecánica e incluso realizar un reclutamiento alveolar para garantizar la apertura del mayor número de alveolos posible.
Una vez finalizada la exploración endoscópica de las vías respiratorias, se procede al lavado traqueobronquial o broncoalveolar con suero fisiológico estéril. Es fundamental en este punto que el animal se encuentre en un plano anestésico lo suficientemente profundo para evitar cuadros tusígenos que puedan dificultar el lavado y su posterior recolección para citología y cultivo. Dado que no es posible recuperar el 100 % del líquido del lavado este volumen será absorbido por el epitelio respiratorio siempre y cuando no sea excesivo y en algunos casos puede persistir un burbujeo hasta 24 horas después correspondiente al líquido del lavado traqueobronquial o broncoalveolar que haya quedado sin poderse recuperar.
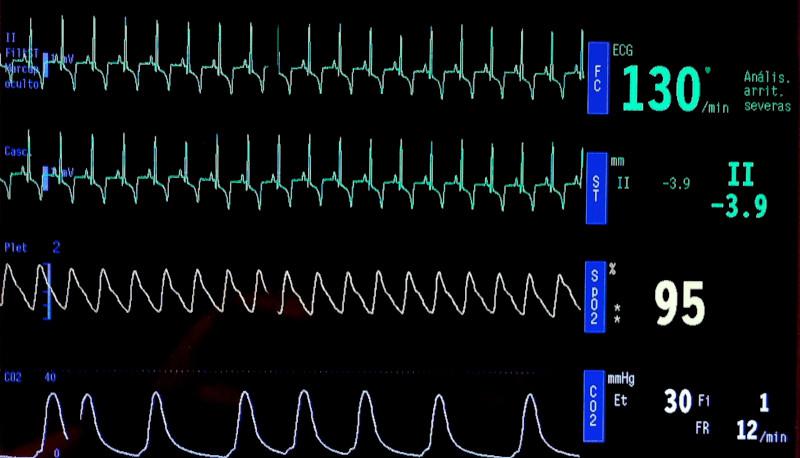
Todos los pacientes deben de monitorizarse antes durante y después del procedimiento debiendo incluir como mínimo ECG junto con pulsioximetría, presión arterial y capnografía. La capnografía es muy útil para detectar hipoventilación y posible broncoconstricción (curva con aleta de tiburón) (Figura 4). En aquellos casos en los cuales el endoscopio ocluya en gran medida el lumen del tubo endotraqueal puede llegar a perderse la curva de capnografía por completo y habrá que vigilar el tórax del paciente para ver el patrón respiratorio y descartar o confirmar posibles apneas. La preoxigenación es muy importante, sobretodo en aquellos pacientes que tengan un compromiso respiratorio y en paciente canino de pequeño tamaño y felino ya que como en estos pacientes normalmente no puede hacerse la traqueobroncoscopia con el paciente intubado por el tamaño tan reducido de su diámetro traqueal pueden desaturarse con mayor facilidad.
Una vez finalizado el procedimiento, el paciente debe permanecer intubado y bajo oxigenación al 100% durante al menos 10 minutos para así poder resolver la hipoxemia secundaria a la traqueobroncoscopia en el caso de haberse desarrollado.
La pulsioximetría debe emplearse para valorar la oxigenación del paciente durante la recuperación, aunque la temperatura, la frecuencia respiratoria, así como la profundidad y esfuerzos respiratorios deben de valorarse de forma continuada durante las primeras horas después del procedimiento. Una vez que la saturación de la hemoglobina es estable (> 96-97 % con oxígeno suplementado) se puede hacer una prueba de respiración de aire ambiente durante unos minutos para comprobar si la saturación se mantiene en valores aceptables (> 95 %) o si cae. Puede llegar a ser necesaria la suplementación de oxígeno durante varias horas hasta que se resuelvan las posibles atelectasias, se reabsorba el líquido en el pulmón (procedente del lavado broncoalveolar) y se eliminen por completo los fármacos anestésicos que producen depresión respiratoria.
Complicaciones
Cuando la técnica se realiza de manera adecuada las complicaciones son raras y todas ellas suelen ser relacionadas con la anestesia como arritmias e hipotensión. Las complicaciones relacionadas con la traqueobroncoscopia son hipoxemia, sangrados e infección. La hipoxemia es transitoria, ya que una vez finalizado el procedimiento manteniendo al paciente intubado y con oxígeno al 100 % durante 10 minutos suele resolverse. El sangrado es poco común si la manipulación se realiza de forma cuidadosa y la infección siguiendo procedimientos de esterilización es raro que aparezca.
Otras potenciales complicaciones son las toses y el broncoespasmo especialmente en gatos, secundario a la irritación de las vías respiratorias por la exploración con el endoscopio. El control de las toses puede llevarse a cabo empleando butorfanol a 0,1 mg/kg subcutáneo o intramuscular y el broncoespasmo puede controlarse con el uso de broncodilatadores como la teofilina a 5 mg/kg intravenosa lenta durante los 10-15 minutos previos al procedimiento.
Conclusiones
La traqueobroncoscopia cada vez presenta una mayor demanda en la clínica veterinaria diaria no solo por su poder para diagnosticar colapsos traqueales, valorar los bronquios principales, secundarios y bronquiolos, incluyendo el aspecto de su mucosa, sino también para el empleo de técnicas auxiliares para la obtención de muestras para su posterior estudio laboratorial. Además, en ocasiones también por su potencial terapeútico como por ejemplo en la extracción de cuerpos extraños y se ha convertido en el método de elección para el estudio de patologías de vías aéreas bajas a pesar de tratarse de una técnica que tenga que llevarse a cabo siempre bajo anestesia.
Por otro lado, cabe señalar, que se trata de una técnica donde es muy importante la comunicación entre el endoscopista y el anestesista ya que en función de la fase de traqueobroncoscopia es necesario un plano anestésico más superficial o más profundo evitando en todo momento el despertar del paciente con el posible daño al equipo y iatrogenia al paciente.
A pesar de ser una técnica relativamente segura y no necesitar de un protocolo anestésico concreto siempre debemos adaptarnos al tipo de paciente y a la condición ASA para evitar la aparición de posibles complicaciones.
Bibliografía
- Casas García DL, Santana González AJ. Técnicas de Mínima Invasión en Pequeños Animales Ediciones Multimédica Ediciones 2018; 44-45.
- Dear DJ, Johnson LR. Lower respiratory tract endoscopy in the cat: Diagnostic approach to bronchial disease. Journal of Feline Medicine and Surgery (2013) 15, 1019-1027.
- Johnson LR, Drazenovich TL. Flexible Bronchoscopy and Bronchoalveolar Lavage in 68 Cats (2001–2006) J Vet Intern Med 2007; 21: 219–22.5
- Johnson LR, Pollard RE. Tracheal Collapse and Bronchomalacia in Dogs: 58 Cases (7 /2001 –1 /2008) J Vet Intern Med 2010; 24:298–305.
- Johnson LR, Singh MK, Pollard RE. Agreement Among Radiographs, Fluoroscopy and Bronchoscopy in Documentation of Airway Collapse in Dogs. J Vet Intern Med 2015; 29: 1619–1626.
- Johnson LR, Vernau W. Bronchoscopic Findings in 48 Cats with Spontaneous Lower Respiratory Tract Disease (2002 –2009) J Vet Intern Med 2011; 25:236–243.
- Lhermette P, Sobel D. BSAVA Canine and Feline Endoscopy and Endosurgery 2008; 84-87.
- Macready DM, Johnson LR, Pollard RE. Fluoroscopic and radiographic evaluation of tracheal collapse in dogs: 62 cases (2001– 2006). J Am Vet Med Assoc 2007; 230:1870–1876.
- Rioja García E, Salazar Nussio V, Martínez Fernández M, Martínez Taboada F. Manual de anestesia y analgesia de pequeños animales con patologías o condiciones específicas Servet 2016; 14-16, 21-22.
- Seymour C, Duke-Novakovski T. BSAVA Canine and Feline Anesthesia and Analgesia Second Edition 2011; 220-224-228.
- Tams TR, Rawlings CA. Small Animal Endoscopy Elsevier 3rd Edition 2011; 339-342
- Tenwolde AC, Johnson LR, Hunt GB, Vernau W, Zwingenberger AL. The Role of Bronchoscopy in Foreign Body Removal in Dogs and Cats: 37 Cases (2000 –2008) J Vet Intern Med 2010; 24: 1063-1068
- Zhu BY, Johnson LR, Vernau W. Tracheobronchial Brush Cytology and Bronchoalveolar Lavage in Dogs and Cats with Chronic Cough: 45 Cases (2012–2014) J Vet Intern Med 2015;29:526–532
 by Multimédica
by Multimédica