Aplicación clínica de la presión positiva al final de la espiración (PEEP) durante la ventilación mecánica en pequeños animales
Resumen breve
La presión positiva al final de la espiración (PEEP) es una presión positiva que se aplica al final de cada espiración durante la ventilación mecánica con el objetivo de evitar el colapso alveolar durante la anestesia general. En medicina humana, se recomienda programar PEEP, ya que su aplicación mantiene el volumen de gas en los alveolos al final de la espiración.Índice de contenidos
Resumen
La presión positiva al final de la espiración (PEEP) es una presión positiva que se aplica al final de cada espiración durante la ventilación mecánica con el objetivo de evitar el colapso alveolar durante la anestesia general. En medicina humana, se recomienda programar PEEP, ya que su aplicación mantiene el volumen de gas en los alveolos al final de la espiración. Sin embargo, el empleo de PEEP es controvertido, ya que la PEEP no abre los alveolos colapsados y puede producir sobredistensión de los alveolos abiertos si no va precedida de una maniobra de reclutamiento alveolar previa que abra los alveolos. Por ello, en el paciente humano quirúrgico se recomienda iniciar la ventilación mecánica con una PEEP de 5 cmH2O y posteriormente individualizar la PEEP en cada paciente después de haber realizado una maniobra de reclutamiento alveolar. En animales sanos, suele programarse una PEEP en torno a 4-5 cmH2O en perros y 2 cmH2O en gatos, pero actualmente no existe consenso sobre qué nivel de PEEP debe aplicarse y cuándo, así como cuándo debe ir precedido de una maniobra de reclutamiento alveolar previa. En este artículo se revisan las bases fisiológicas de la aplicación de PEEP y la evidencia científica actual sobre los efectos de su aplicación durante la anestesia en perros y gatos.
Introducción: fisiología del colapso pulmonar
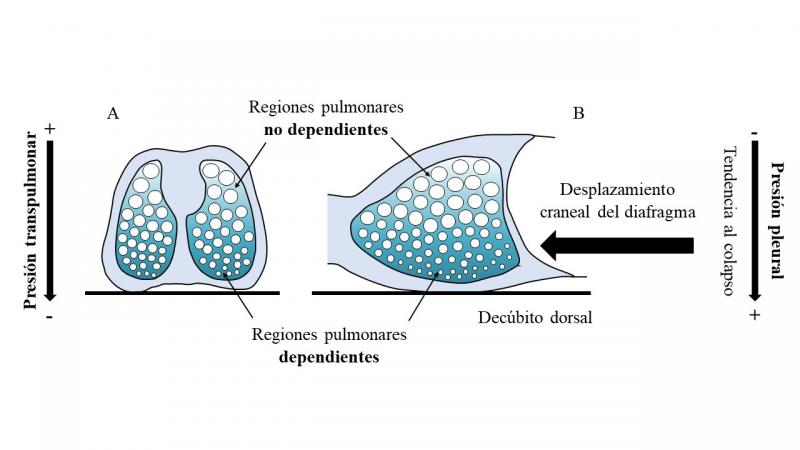
La presión transpulmonar es la presión de distensión del parénquima pulmonar, que contribuye a estabilizarlo y evitar su colapso1. Se define como la diferencia entre la presión alveolar y la presión pleural en cada ciclo respiratorio. Mientras que la presión alveolar se distribuye de forma homogénea en el pulmón, la presión pleural aumenta progresivamente a medida que se desciende en el eje vertical del pulmón debido al peso del parénquima pulmonar (Figura 1). Por tanto, la presión transpulmonar disminuye en las regiones pulmonares dependientes, que son aquellas que se sitúan en la parte más declive del pulmón dependiendo de la posición del paciente2. Durante la anestesia general, el gradiente vertical de presión pleural se incrementa aún más debido a la relajación muscular del diafragma, que se desplaza cranealmente. El desplazamiento del diafragma hacia la cavidad torácica permite que la presión abdominal se transmita a la cavidad torácica y comprima las regiones pulmonares dependientes, que tendrán una mayor tendencia al colapso3,4. Como consecuencia, la capacidad residual funcional, que es el volumen de gas que queda en los alveolos al final de una espiración normal, disminuye5. Si la capacidad residual funcional cae por debajo de la capacidad de cierre del alveolo, que es el volumen por debajo del cual el alveolo comienza a colapsarse6, el alveolo se colapsa, lo que se conoce con el nombre de atelectasia. La mayor tendencia al colapso pulmonar se produce al final de la espiración, ya que es el momento en que se alcanza la presión transpulmonar más baja7.
En medicina humana la formación de atelectasias durante la anestesia puede tener las siguientes consecuencias negativas para el paciente, aunque en perros solo se han demostrado las dos primeras:
- Disminución de la distensibilidad del sistema respiratorio, que representa la facilidad del pulmón y de la cavidad torácica para expandirse y se calcula como el volumen corriente dividido entre el gradiente de presión aplicado durante la ventilación mecánica.
- Deterioro del intercambio gaseoso.
- Aumento de la resistencia vascular pulmonar.
- Aumento del riesgo de lesión pulmonar.
- Desarrollo de complicaciones pulmonares postoperatorias.
El aumento de presión pleural en las regiones pulmonares dependientes debido a la compresión ejercida por los órganos abdominales sobre el diafragma es el mecanismo principal de formación de atelectasias por compresión durante la anestesia. En algunos tipos de pacientes, como aquellos sometidos a cirugía laparoscópica o pacientes obesos, la compresión del diafragma y el parénquima pulmonar se intensifica aún más por el aumento de presión ejercido por la insuflación de gas o la acumulación de tejido adiposo en la cavidad abdominal, respectivamente8,9, por lo que tienen una mayor tendencia a la formación de atelectasias y pueden ser más susceptibles a sus consecuencias negativas.
Presión positiva al final de la espiración (peep)
Definición
Para evitar la formación de atelectasias por compresión durante la ventilación mecánica, puede aplicarse presión positiva al final de la espiración (del inglés, positive end-expiratory pressure, PEEP). La PEEP consiste en una presión positiva que se mantiene al final de cada espiración para evitar que la presión de la vía aérea caiga a cero y la presión transpulmonar disminuya por debajo de la presión crítica de cierre del alveolo, que es la presión por debajo de la cual el alveolo comienza a colapsarse. Al prevenir el colapso alveolar, permite que la presión necesaria para mantener los alveolos abiertos al final de la espiración sea más baja, ya que, según la ecuación de Young-Laplace, la presión necesaria para mantener los alveolos abiertos es inversamente proporcional a su radio10. En medicina humana se recomienda aplicar PEEP durante la anestesia, ya que la ausencia de PEEP reduce el volumen al final de la espiración y aumenta el porcentaje de tejido pulmonar no aireado. Esto disminuye la distensibilidad de las áreas colapsadas y aumenta el riesgo de sobredistensión del tejido pulmonar bien aireado11.
Programación
La PEEP es un parámetro ventilatorio que se puede programar tanto en ventilación controlada por volumen, en la que se programa el volumen corriente que se entrega al paciente, como en ventilación controlada por presión, en la que, en vez de programar directamente el volumen corriente, se programa la presión inspiratoria o máxima que permita suministrar al paciente el volumen corriente deseado12. Al programar PEEP en ventilación controlada por presión, es importante que nos aseguremos de que el ventilador mecánico empleado aumente automáticamente en la misma medida la presión inspiratoria aplicada para que el diferencial de presión entre la presión inspiratoria y la PEEP se mantenga constante y el volumen corriente entregado no se modifique. Si, al programar cierto nivel de PEEP, nuestro modelo de ventilador no aumenta proporcionalmente la presión inspiratoria, debemos hacerlo nosotros, ya que, si no el diferencial de presión disminuiría y el volumen corriente suministrado sería menor, pudiendo hipoventilar al paciente.
En medicina humana, en el último consenso sobre ventilación mecánica protectora en el paciente quirúrgico se recomienda iniciar la ventilación con una PEEP de 5 cmH2O y después individualizar la PEEP. Además, se recomienda reajustar la PEEP en aquellos escenarios que impliquen cambios en la presión abdominal como la ventilación de pacientes obesos o durante el neumoperitoneo en cirugía laparoscópica11. En animales sanos, suelen programarse valores de PEEP en torno a 4-5 cmH2O en perros13,14 y 2 cmH2O en gatos15, pero en la literatura no existe un consenso sobre qué nivel de PEEP debe aplicarse y cuándo debe emplearse.
Monitorización
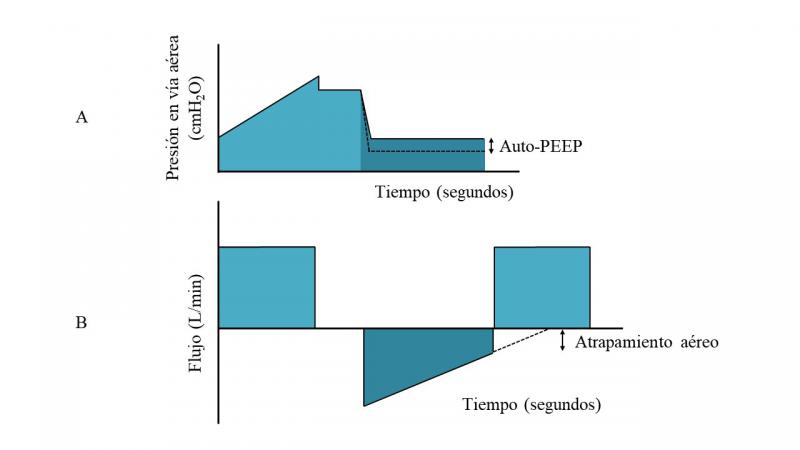
La mayoría de ventiladores mecánicos modernos pueden medir el nivel de PEEP en cada ciclo respiratorio con un sistema de medición (manómetro, transductor piezorresistivo u otro). La pantalla del ventilador muestra el valor numérico de la presión que alcanza la vía aérea al final de la espiración o su representación gráfica en la curva de presión-tiempo. Si el nivel de PEEP representado en la curva de presión-tiempo es mayor que el nivel de PEEP programado, se habla de auto-PEEP o PEEP intrínseca, que se produce cuando el gas queda atrapado en la vía aérea al final de la espiración (Figura 2). Este fenómeno puede ocurrir con tiempos espiratorios cortos, frecuencias respiratorias altas o en situaciones de aumento de la resistencia en la vía aérea (tubo endotraqueal estrecho, broncoespasmo o aumento de secreciones)16. Una forma de valorar si el tiempo espiratorio es suficiente para permitir la salida completa de gas de los pulmones antes del siguiente ciclo respiratorio es monitorizar la curva de flujo-tiempo. Si la curva de flujo espiratorio no llega a cero antes de que comience el flujo inspiratorio del siguiente ciclo respiratorio, debe aumentarse rápidamente la duración del tiempo espiratorio y/o reducirse la frecuencia respiratoria hasta observar que el flujo espiratorio llegue a cero (Figura 2).
Efectos generales de la aplicación de peep
En medicina humana, la aplicación de PEEP puede aumentar el volumen al final de la espiración17 y mejorar la mecánica respiratoria18 y la oxigenación arterial19 durante la anestesia. Sin embargo, aunque mantiene la capacidad residual funcional, no la restablece, por lo que, si se emplea de forma aislada y no va precedida de una maniobra de reclutamiento alveolar (MRA), que es la única estrategia que abre los alveolos colapsados, la aplicación de PEEP puede tener efectos contradictorios sobre la función pulmonar, el intercambio gaseoso y la prevención de la formación de atelectasias durante la anestesia en adultos20, niños21, pacientes obesos22,23 y pacientes sometidos a cirugía torácica24.
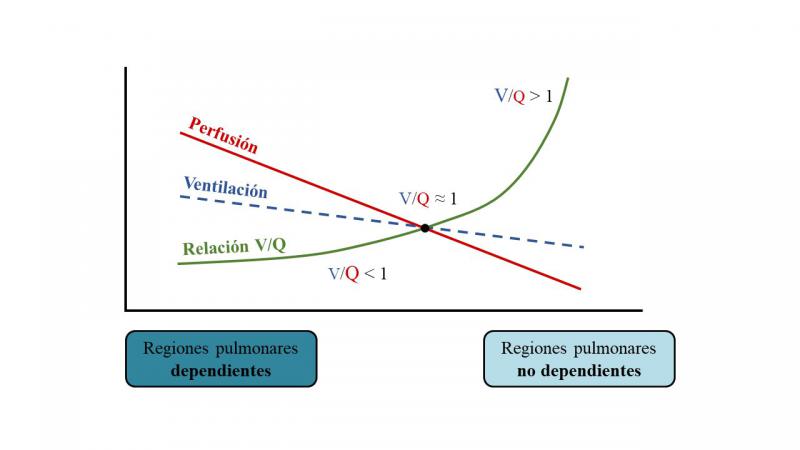
Para entender los efectos contradictorios de la PEEP, conviene recordar cómo se distribuyen la ventilación y la perfusión en el pulmón y cómo se afecta la relación entre ambas durante la anestesia. El intercambio gaseoso se produce a través de la membrana alveolo-capilar. Para que se produzca un intercambio gaseoso adecuado debe existir un equilibrio entre la ventilación y la perfusión que llega a cada alveolo. En condiciones normales, la relación entre la ventilación y la perfusión (V/Q) global del pulmón es 0.8. Sin embargo, este cociente no es el mismo en todas las zonas del pulmón, sino que, en las regiones pulmonares no dependientes, que están más ventiladas que perfundidas, es mayor (V/Q > 0.8), mientras que en las regiones pulmonares más dependientes, que están proporcionalmente más perfundidas que ventiladas, es menor (V/Q < 0.8) (Figura 3)25.
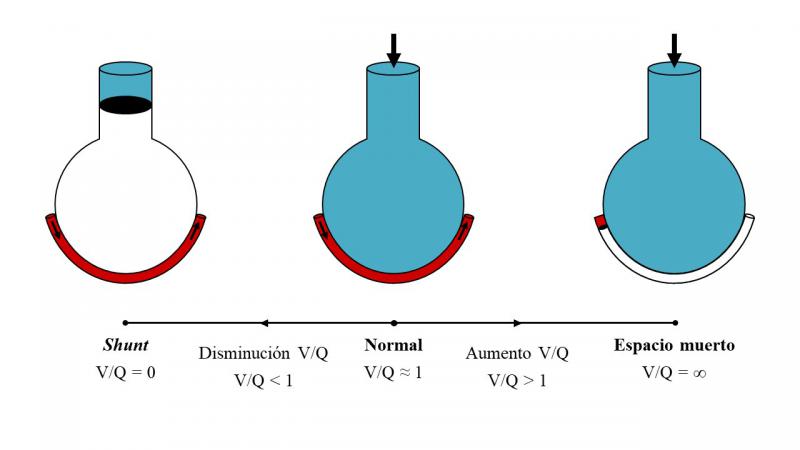
Durante la anestesia, las diferencias regionales en la relación V/Q a lo largo del eje vertical del pulmón se intensifican más. Por un lado, el gas inspirado se redistribuye desde las regiones pulmonares dependientes a las no dependientes. Por tanto, la ventilación se dirige principalmente hacia estas últimas y disminuye a medida que se desciende hacia las regiones pulmonares dependientes, que son aquellas con mayor predisposición al colapso26. Si la ventilación alveolar en estas regiones disminuye tanto que cesa (V/Q = 0), la sangre venosa mixta que perfunde los alveolos no ventilados se mezcla con la sangre oxigenada procedente de los alveolos ventilados y se produce una situación que se conoce con el nombre de shunt y que puede dar lugar a alteraciones del intercambio gaseoso25. De forma fisiológica, para compensar tal desequilibrio en la relación V/Q, se produce una redistribución del flujo sanguíneo pulmonar desde las zonas poco o nada ventiladas del pulmón hacia aquellas que están mejor ventiladas, mejorando así la relación V/Q27. Este mecanismo se conoce con el nombre de vasoconstricción pulmonar hipóxica y permite compensar la situación de shunt en las regiones pulmonares dependientes28. Algunos anestésicos inhalatorios como el isoflurano reducen este mecanismo29. Por otro lado, la perfusión disminuye progresivamente a medida que se asciende hacia las regiones pulmonares no dependientes, que reciben proporcionalmente más ventilación. Si la presión dentro de los alveolos excede la presión de los capilares pulmonares estos pueden llegar a colapsarse y la perfusión cesa (V/Q = ∞), lo que se conoce como espacio muerto alveolar, alveolos ventilados pero poco o nada perfundidos25,30. Por tanto, las alteraciones observadas en la relación V/Q se deben, por un lado, a la existencia de regiones con una disminución de la relación V/Q y al desarrollo de shunt (V/Q = 0) como consecuencia del colapso de los alveolos, y por otro, a la existencia de regiones con un aumento de la relación V/Q y de espacio muerto alveolar (V/Q = ∞) como consecuencia del colapso de los capilares (Figura 4).
La aplicación de PEEP puede acentuar las diferencias en la relación V/Q en el pulmón. Por un lado, la PEEP produce una redistribución del flujo sanguíneo hacia las regiones pulmonares dependientes, que ya de por sí están más perfundidas que ventiladas (V/Q << 0.8). Por otro lado, puede causar un exceso de ventilación en las regiones pulmonares no dependientes, que ya de por sí están proporcionalmente más ventiladas que perfundidas (V/Q >> 0.8). Por tanto, la PEEP puede favorecer el desarrollo de regiones con una disminución de la relación V/Q, lo que puede explicar su efecto contradictorio sobre el shunt31, y a su vez favorecer el desarrollo de regiones con un aumento de la relación V/Q y el espacio muerto alveolar32. Además, la aplicación de niveles altos de PEEP puede comprometer el retorno venoso y producir un descenso del gasto cardiaco33, lo que también puede contribuir a disminuir la oxigenación arterial34. Sin embargo, el empleo de PEEP reduce la respuesta inflamatoria asociada a la lesión pulmonar secundaria a la apertura y cierre cíclicos de los alveolos cuando se usan volúmenes corrientes bajos35. Además, la aplicación de PEEP podría reducir la incidencia de atelectasias y mejorar la oxigenación arterial en el periodo postoperatorio en pacientes humanos sanos36,37.
En medicina humana, los efectos de la PEEP dependen del nivel de PEEP aplicado. El nivel de PEEP aplicado normalmente durante la anestesia no suele superar 10 cmH2O y no puede abrir los alveolos colapsados, por lo que no mejora la mecánica respiratoria ni el intercambio gaseoso si no va precedido de una MRA21,38. El empleo de niveles más altos de PEEP puede mejorar la mecánica respiratoria y la oxigenación arterial, pero es posible que los efectos beneficiosos observados con una PEEP de 10 cmH2O se deban a la apertura de los alveolos colapsados por el aumento de presión inspiratoria asociado, en vez de al efecto de la PEEP por sí mismo18.
Aplicación de peep en perros
En perros sanos suelen programarse valores de PEEP en torno a 4-5 cmH2O13,14. Existen varios estudios que han evaluado los efectos de la aplicación de PEEP sobre la formación de atelectasias, la oxigenación arterial o la distensibilidad del sistema respiratorio, con resultados contradictorios. Primero nos centraremos en los estudios que han evaluado la aplicación de PEEP de forma aislada, y después en aquellos que han evaluado los efectos de la PEEP precedida de una MRA.
PEEP no precedida de maniobra de reclutamiento alveolar
En perros sanos sometidos a laparotomía, otras cirugías de tejidos blandos o cirugía ortopédica, la aplicación de una PEEP de 5 cmH2O no mejoró la distensibilidad del sistema respiratorio en comparación con la ausencia de PEEP. No obstante, aunque no mejoró la distensibilidad, la mantuvo estable y evitó que disminuyera durante al menos 60 minutos de ventilación mecánica, al contrario que cuando no se aplicó PEEP, que fue disminuyendo progresivamente la distensibilidad39. En otro estudio realizado en perros sin enfermedad pulmonar sometidos a tomografía computarizada de tórax, se comparó el efecto de diferentes combinaciones de volúmenes corrientes (8 y 15 mL/kg) y PEEP (0 y 5 cmH2O) durante 30 minutos de anestesia. La ventilación con un volumen corriente de 15 mL/kg y una PEEP de 5 cmH2O mejoró la distensibilidad pulmonar y redujo el porcentaje de áreas pulmonares no aireadas (atelectásicas) y pobremente aireadas en comparación con las otras combinaciones, aunque estos efectos no se reflejaron en una mejora de la oxigenación arterial40. En perros sometidos a ventilación unipulmonar, que tienen un mayor porcentaje de áreas de shunt al ventilar solo uno de los pulmones, el empleo de 5 cmH2O de PEEP durante 15 minutos de toracoscopia mejoró la presión parcial de oxígeno en sangre arterial (PaO2) y redujo la fracción de shunt, el espacio muerto fisiológico y el gradiente alveolo-arterial de oxígeno en comparación con la ausencia de PEEP. Sin embargo, estos efectos no se observaron cuando se aplicaron 2.5 cmH2O de PEEP41. En otro estudio similar, pero en el que la cavidad torácica se mantuvo cerrada durante la ventilación unipulmonar, el empleo de 5 cmH2O de PEEP durante 15 minutos mejoró la saturación arterial de oxígeno y disminuyó la fracción de shunt, aunque el empleo de 2.5 cmH2O de PEEP solo redujo la fracción de shunt. Sin embargo, la aplicación de cualquiera de estos dos niveles de PEEP no mejoró la PaO2, el contenido arterial de oxígeno o el gradiente alveolo-arterial de oxígeno42. En otro estudio en perros sometidos a toracotomía, en la que la pared torácica deja de contribuir eficazmente a mantener el pulmón abierto y hay una mayor tendencia a la formación de atelectasias, la aplicación de una PEEP de 5 cmH2O no evitó que la PaO2 disminuyese durante la cirugía, pero la disminución fue menor que la observada en los perros que no habían recibido PEEP. Además, la aplicación de PEEP no disminuyó la incidencia de hipoxemia postoperatoria43. A pesar de los resultados contradictorios en cuanto al efecto de la PEEP, recientemente se ha demostrado que, en perros sanos, la aplicación de un nivel moderado de PEEP de 5 cmH2O aumenta el volumen pulmonar al final de la espiración y la distensibilidad del sistema respiratorio y reduce la deformación pulmonar dinámica global y regional asociada con lesión pulmonar, pudiendo tener cierto efecto de protección pulmonar44.
También existen estudios que han evaluado la eficacia de niveles más altos de PEEP para reducir la formación de atelectasias y mejorar la visualización del pulmón durante estudios de tomografía computarizada del tórax, en los que se aplica cierto nivel de PEEP durante una maniobra de hiperventilación manual y durante el periodo de apnea posterior. En un estudio la aplicación de 10 cmH2O de PEEP aumentó el volumen pulmonar un 60 % y redujo la formación de atelectasias45. En otro estudio similar, el empleo de una PEEP de 10-12 cmH2O redujo el porcentaje de áreas no aireadas y pobremente aireadas y aumentó el porcentaje de áreas con aireación normal46. Sin embargo, es posible que los efectos beneficiosos de estos niveles de PEEP no se deban al efecto de la PEEP por sí mismo, sino a la apertura de alveolos por el incremento de presión inspiratoria asociado.
En perros obesos no existen estudios que hayan evaluado el efecto del empleo de PEEP. En perros sometidos a cirugía laparoscópica, solo existe un estudio que comprobó que la aplicación de una PEEP de 8 cmH2O durante el neumoperitoneo (10-15 mmHg) tiene un marcado impacto hemodinámico47.
Por tanto, son pocos los estudios que incluyen técnicas de imagen para evaluar la cantidad de atelectasias y la gran mayoría han evaluado el empleo de una PEEP de 5 cmH2O. Además, son necesarios estudios que evalúen el efecto de diferentes niveles de PEEP en distintos tipos de pacientes y cirugías, sobre todo aquellos con una mayor predisposición a la formación de atelectasias.
PEEP precedida de maniobra de reclutamiento alveolar
La PEEP también puede emplearse para mantener los alveolos abiertos después de una MRA previa, cuyo objetivo, como hemos comentado, es abrir los alveolos colapsados. El nivel de PEEP empleado después de una MRA puede ser un valor fijo o individualizado al paciente.
La mayoría de estudios realizados hasta la fecha han evaluado el efecto de la aplicación de un nivel de PEEP fijo (4 o 5 cmH2O). En perros sanos sometidos a cirugía electiva en decúbito dorsal, la aplicación de una PEEP de 4 cmH2O precedida de una MRA mejoró la distensibilidad del sistema respiratorio y la oxigenación arterial durante al menos 60 minutos tras la MRA en comparación con la ventilación mecánica sin PEEP ni MRA48. En perras sanas sometidas a ovariohisterectomía, la aplicación de una PEEP de 5 cmH2O precedida de una MRA mejoró la distensibilidad del sistema respiratorio, la aireación pulmonar y la oxigenación arterial durante al menos 30 minutos49,50. En perras sanas sometidas a ovariectomía laparoscópica, la aplicación de una PEEP de 5 cmH2O precedida de una MRA mejoró la distensibilidad y la oxigenación arterial y redujo la fracción de shunt a los 30 minutos después de la instauración del neumoperitoneo y a los 20 minutos después de su cese, en comparación con la ventilación mecánica sin PEEP ni MRA51. Recientemente, se ha evaluado el efecto de la aplicación de una PEEP de 5 cmH2O precedida de una MRA sobre la oxigenación arterial postoperatoria en perros sanos sometidos a cirugía ortopédica, no observando ningún beneficio sobre la oxigenación arterial durante las primeras cuatro horas después de la extubación52.
Sin embargo, la aplicación de un nivel de PEEP fijo puede resultar excesivo o insuficiente dependiendo del paciente. Un valor de PEEP demasiado alto podría sobredistender los alveolos, mientras que un valor demasiado bajo podría no mantenerlos completamente abiertos, aumentando su tendencia a colapsarse de nuevo10. Por ello, en medicina humana se recomienda individualizar el nivel de PEEP empleado después de una MRA en cada paciente, en vez de aplicar de forma sistemática un determinado nivel de PEEP53. El mínimo valor de PEEP necesario para mantener los alveolos abiertos después de una MRA, evitando la sobredistensión, se denomina PEEP individualizada, óptima o de “pulmón abierto” (del inglés, open-lung)54,55. En medicina humana, la aplicación de un nivel de PEEP individualizado después de una MRA ha demostrado mejorar la distensibilidad del sistema respiratorio y la oxigenación arterial en comparación con la aplicación de una PEEP fija de 4 o 5 cmH2O precedida de una MRA previa56,57. En perros sanos, no existen muchos estudios que hayan evaluado el efecto de la aplicación de una PEEP individualizada después de una MRA. En perros sanos sometidos a cirugía electiva en decúbito dorsal o lateral, el empleo de una PEEP individualizada después de una MRA mejoró la distensibilidad durante al menos 50 minutos en comparación con la ventilación mecánica sin PEEP ni MRA y durante 20 minutos en comparación con la aplicación de una PEEP de 5 cmH2O sin MRA previa39. En perros sanos sometidos a cirugía electiva en decúbito dorsal, la aplicación de una PEEP individualizada después de una MRA no mejoró la oxigenación arterial al final de la cirugía ni durante los primeros 60 minutos después de la extubación en comparación con la ventilación espontánea o la ventilación mecánica sin PEEP ni MRA58. Por ello, el uso de MRA seguidas de PEEP no parece tener ninguna ventaja clínicamente relevante para mejorar la oxigenación arterial postoperatoria temprana en perros sanos, por lo que su uso rutinario en estos pacientes no parece estar justificado. No obstante, no se puede descartar que la falta de beneficio en la oxigenación arterial postoperatoria temprana pueda deberse a que la formación de atelectasias sea mínima en perros sanos59. Además, no implica que el empleo de MRA seguidas de PEEP individualizada no pueda tener beneficios clínicos en otro tipo de pacientes (con hipoxemia, obesidad o enfermedad pulmonar) o sometidos a otro tipo de cirugía (torácica o laparoscópica). Tampoco se pueden descartar beneficios a largo plazo sobre otros parámetros como la necesidad de soporte ventilatorio o el desarrollo de complicaciones pulmonares postoperatorias60.
En perros sanos no sometidos a cirugía torácica o laparoscópica, los valores de PEEP óptima oscilan entre 4 y 10 cmH2O y la mediana se sitúa en 6 cmH2O39,58,61. Estos estudios no emplearon técnicas de imagen para confirmar los valores de PEEP óptima, pero otro estudio posterior que utilizó tomografía de impedancia eléctrica obtuvo un rango similar62. En un estudio experimental en perros de raza Beagle, la mediana de la PEEP óptima fue ligeramente más alta, probablemente debido a diferencias metodológicas con los otros estudios63. El valor de PEEP individualizada es similar en perros con una condición corporal normal y perros con sobrepeso, pero es más alto en perros colocados en decúbito lateral que en aquellos en decúbito dorsal61.
Individualización de la PEEP
Tanto en medicina humana como en veterinaria se han descrito dos tipos principales de MRA: las maniobras de insuflación sostenida, que consisten en aplicar un nivel elevado de presión positiva en la vía aérea de forma continuada durante un corto periodo de tiempo (normalmente no más de 40 segundos)49,64, y las maniobras progresivas o escalonadas, que consisten en aplicar incrementos progresivos de la presión en la vía aérea cada varios ciclos respiratorios38,48. Una de las principales ventajas de las maniobras progresivas es que, una vez realizada la fase de apertura pulmonar, permiten reducir la presión en la vía aérea de forma escalonada para calcular la PEEP individualizada a cada paciente.
La técnica utilizada para individualizar la PEEP en perros sanos ha sido extrapolada de la descrita por Tusman y Böhm (2010) en pacientes humanos (Figura 5)65.
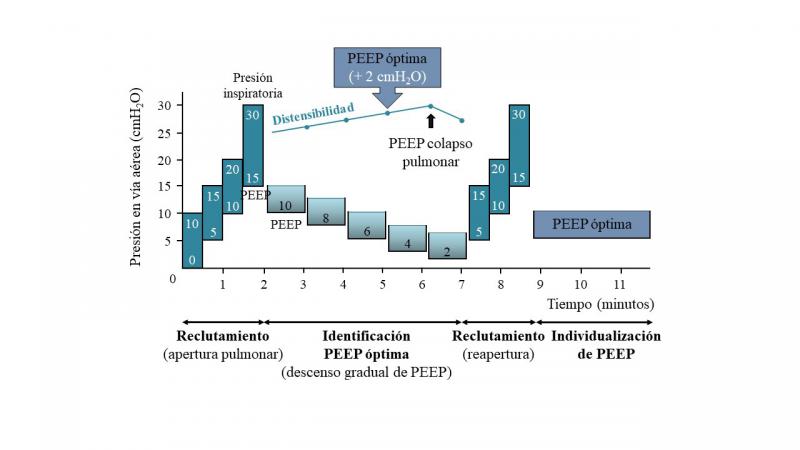
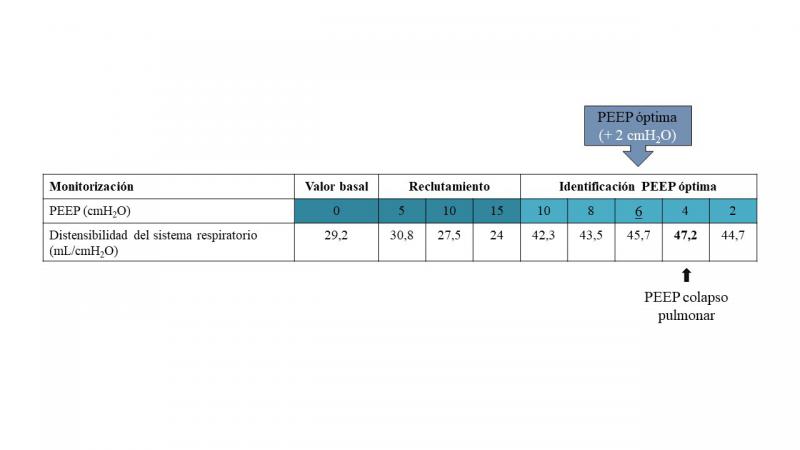
Una vez finalizada la fase de apertura pulmonar, en que se llevan a cabo incrementos progresivos de la presión inspiratoria y la PEEP cada varios ciclos respiratorios hasta alcanzar la presión de apertura pulmonar, se realizan descensos progresivos de la PEEP de 2 en 2 cmH2O para determinar la PEEP de colapso pulmonar, que es el nivel de PEEP en que algunos alveolos comienzan a colapsarse10. Cada escalón de PEEP debe mantenerse al menos un minuto para obtener valores estables de las variables respiratorias. La PEEP de colapso puede determinarse por diferentes métodos, incluyendo técnicas de imagen (tomografía computarizada, tomografía de impedancia eléctrica o ecografía pulmonar), y la monitorización de la oxigenación arterial, el espacio muerto o la distensibilidad del sistema respiratorio. Uno de los métodos más utilizados en la práctica clínica es la monitorización de la distensibilidad, ya que no requiere la realización de técnicas de imagen ni la extracción de sangre arterial, además de que es un parámetro que puede calcularse fácilmente y que es proporcionado por la mayoría de ventiladores mecánicos modernos. Según este método, se monitoriza la distensibilidad durante cada escalón de descenso de PEEP, de forma que el valor de PEEP en que se alcanza el valor más alto de distensibilidad se corresponde con la PEEP de colapso66. Para ello, debe reducirse la PEEP hasta que la distensibilidad disminuya respecto a su valor anterior, que sería el más alto. Son pocos estudios los que incluyen un criterio para considerar relevante la diferencia en la distensibilidad entre dos escalones de PEEP para así considerarla diferente o no de la anterior, pero algunos autores han propuesto que la diferencia debe ser de al menos 1 mL/cmH2O67 o del 5 %68. Después de haber determinado el valor más alto de distensibilidad, se repite la fase de apertura pulmonar para reabrir posibles áreas de colapso producidas por el descenso de la PEEP en la fase anterior, y se programa una PEEP 2 cmH2O por encima de la PEEP de colapso, individualizándola así al paciente39,69 (Figura 6). Otra opción, en vez de aplicar la PEEP 2 cmH2O por encima de la PEEP de colapso, es programar directamente la PEEP en que se alcanza el valor más alto de distensibilidad70.
Aplicación de peep en gatos
En gatos, existe muy poca información sobre el empleo de PEEP. Si se decide emplearla, se han recomendado valores de 2 cmH2O15 o de 5 cmH2O en caso de querer mejorar la visualización del pulmón durante estudios de tomografía computarizada del tórax con una maniobra de hiperventilación manual71.
Efectos negativos de la aplicación de peep
La aplicación de ventilación mecánica mediante presión positiva produce un aumento de presión intratorácica que ejerce compresión sobre los capilares pulmonares, disminuyendo el retorno venoso y la precarga de los ventrículos derecho e izquierdo y aumentando la poscarga del ventrículo derecho, lo que produce un descenso del gasto cardiaco y la presión arterial72. La aplicación de PEEP aumenta la presión intratorácica al final de la espiración, lo que puede favorecer la aparición de estos efectos hemodinámicos, sobre todo si se emplean niveles altos de PEEP en pacientes hipovolémicos73,74. Por tanto, en pacientes bajo anestesia general, debe monitorizarse la presión arterial durante la ventilación mecánica y especialmente durante la aplicación de PEEP.
La aplicación de PEEP puede aumentar la presión intracraneal y disminuir la presión de perfusión cerebral dependiendo del nivel de PEEP aplicado, la volemia y la mecánica respiratoria del paciente75,76, por lo que debe emplearse con precaución en pacientes con enfermedad intracraneal.
Por último, como ya hemos comentado, la aplicación de un nivel de PEEP fijo puede producir sobredistensión de las áreas pulmonares no colapsadas y conducir al colapso de los alveolos de alrededor77, lo que podría explicar el efecto contradictorio del empleo de PEEP sin MRA previa sobre la disminución del shunt20,69.
Bibliografía
- Loring SH, Topulos GP, Hubmayr RD. Transpulmonary Pressure: The Importance of Precise Definitions and Limiting Assumptions. Am J Respir Crit Care Med. 2016;194(12):1452-7.
- Sutherland PW, Katsura T, Milic-Emili J. Previous volume history of the lung and regional distribution of gas. J Appl Physiol. 1968;25(5):566-74.
- Brismar B, Hedenstierna G, Lundquist H, Strandberg A, Svensson L, Tokics L. Pulmonary densities during anesthesia with muscular relaxation - a proposal of atelectasis. Anesthesiology. 1985;62(4):422-8.
- Hedenstierna G, Strandberg A, Brismar B, Lundquist H, Svensson L, Tokics L. Functional residual capacity, thoracoabdominal dimensions, and central blood volume during general anesthesia with muscle paralysis and mechanical ventilation. Anesthesiology. 1985;62(3):247-54.
- Strandberg A, Tokics L, Brismar B, Lundquist H, Hedenstierna G. Atelectasis during anaesthesia and in the postoperative period. Acta Anaesthesiol Scand. 1986;30(2):154-8.
- Salmon RB, Primiano FP, Jr., Saidel GM, Niewoehner DE. Human lung pressure-volume relationships: alveolar collapse and airway closure. J Appl Physiol Respir Environ Exerc Physiol. 1981;51(2):353-62
- Agostoni E, D'Angelo E. Comparative features of the transpulmonary pressure. Respir Physiol. 1970;11(1):76-83.
- Pelosi P, Croci M, Ravagnan I, Cerisara M, Vicardi P, Lissoni A, et al. Respiratory system mechanics in sedated, paralyzed, morbidly obese patients. J Appl Physiol (1985). 1997;82(3):811-8.
- Andersson LE, Baath M, Thorne A, Aspelin P, Odeberg-Wernerman S. Effect of carbon dioxide pneumoperitoneum on development of atelectasis during anesthesia, examined by spiral computed tomography. Anesthesiology. 2005;102(2):293-9.
- Tusman G, Belda JF. Treatment of anesthesia-induced lung collapse with lung recruitment maneuvers. Curr Anaesth Crit Care. 2010;21(5-6):244-9.
- Young CC, Harris EM, Vacchiano C, Bodnar S, Bukowy B, Elliott RRD, et al. Lung-protective ventilation for the surgical patient: international expert panel-based consensus recommendations. Br J Anaesth. 2019;123(6):898-913.
- Garnero AJ, Abbona H, Gordo-Vidal F, Hermosa-Gelbard C. Pressure versus volume controlled modes in invasive mechanical ventilation. Medicina Intensiva (English Edition). 2013;37(4):292-8.
- Fantoni DT, Ida KK, Lopes TF, Otsuki DA, Auler JO, Jr., Ambrosio AM. A comparison of the cardiopulmonary effects of pressure controlled ventilation and volume controlled ventilation in healthy anesthetized dogs. J Vet Emerg Crit Care (San Antonio). 2016;26(4):524-30.
- Hopper K, Powell LL. Basics of mechanical ventilation for dogs and cats. Vet Clin North Am Small Anim Pract. 2013;43(4):955-69.
- Bernhard C, Masseau I, Dodam J, Outi H, Krumme S, Bishop K, et al. Effects of positive end-expiratory pressure and 30% inspired oxygen on pulmonary mechanics and atelectasis in cats undergoing non-bronchoscopic bronchoalveolar lavage. J Feline Med Surg. 2017;19(6):665-71.
- Corona TM, Aumann M. Ventilator waveform interpretation in mechanically ventilated small animals. J Vet Emerg Crit Care (San Antonio). 2011;21(5):496-514.
- Maisch S, Reissmann H, Fuellekrug B, Weismann D, Rutkowski T, Tusman G, et al. Compliance and dead space fraction indicate an optimal level of positive end-expiratory pressure after recruitment in anesthetized patients. Anesth Analg. 2008;106(1):175-81.
- Maracaja-Neto LF, Vercosa N, Roncally AC, Giannella A, Bozza FA, Lessa MA. Beneficial effects of high positive end-expiratory pressure in lung respiratory mechanics during laparoscopic surgery. Acta Anaesthesiol Scand. 2009;53(2):210-7.
- Meininger D, Byhahn C, Mierdl S, Westphal K, Zwissler B. Positive end-expiratory pressure improves arterial oxygenation during prolonged pneumoperitoneum. Acta Anaesthesiol Scand. 2005;49(6):778-83.
- Tokics L, Hedenstierna G, Strandberg A, Brismar B, Lundquist H. Lung collapse and gas exchange during general anesthesia: effects of spontaneous breathing, muscle paralysis, and positive end-expiratory pressure. Anesthesiology. 1987;66(2):157-67.
- Tusman G, Bohm SH, Tempra A, Melkun F, Garcia E, Turchetto E, et al. Effects of recruitment maneuver on atelectasis in anesthetized children. Anesthesiology. 2003;98(1):14-22.
- Reinius H, Jonsson L, Gustafsson S, Sundbom M, Duvernoy O, Pelosi P, et al. Prevention of atelectasis in morbidly obese patients during general anesthesia and paralysis: a computerized tomography study. Anesthesiology. 2009;111(5):979-87.
- Erlandsson K, Odenstedt H, Lundin S, Stenqvist O. Positive end-expiratory pressure optimization using electric impedance tomography in morbidly obese patients during laparoscopic gastric bypass surgery. Acta Anaesthesiol Scand. 2006;50(7):833-9.
- Mascotto G, Bizzarri M, Messina M, Cerchierini E, Torri G, Carozzo A, et al. Prospective, randomized, controlled evaluation of the preventive effects of positive end-expiratory pressure on patient oxygenation during one-lung ventilation. Eur J Anaesthesiol. 2003;20(9):704-10.
- West JB. Ventilation-perfusion relationships. Respiratory Physiology: The Essentials. 9th ed. Philadelphia, USA: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2012. p. 56-76.
- Tokics L, Hedenstierna G, Svensson L, Brismar B, Cederlund T, Lundquist H, et al. V/Q distribution and correlation to atelectasis in anesthetized paralyzed humans. J Appl Physiol (1985). 1996;81(4):1822-33.
- Benumof JL. Mechanism of decreased blood flow to atelectatic lung. J Appl Physiol Respir Environ Exerc Physiol. 1979;46(6):1047-8.
- Euler USv, Liljestrand G. Observations on the pulmonary arterial blood pressure in the cat. Acta Physiol Scand. 1946;12(4):301-20.
- Domino KB, Borowec L, Alexander CM, Williams JJ, Chen L, Marshall C, et al. Influence of isoflurane on hypoxic pulmonary vasoconstriction in dogs. Anesthesiology. 1986;64(4):423-9.
- West JB, Dollery CT, Naimark A. Distribution of blood flow in isolated lung; relation to vascular and alveolar pressures. J Appl Physiol. 1964;19:713-24.
- Sánchez De León R, Orchard C, Sykes K, Brajkovich I. Positive end-expiratory pressure may decrease arterial oxygen tension in the presence of a collapsed lung region. Crit Care Med. 1985;13(5):392-4.
- Hedenstierna G. Contribution of multiple inert gas elimination technique to pulmonary medicine. 6. Ventilation-perfusion relationships during anaesthesia. Thorax. 1995;50:85-91.
- Luecke T, Pelosi P. Clinical review: Positive end-expiratory pressure and cardiac output. Crit Care. 2005;9(6):607-21.
- Takala J. Hypoxemia due to increased venous admixture: influence of cardiac output on oxygenation. Intensive Care Med. 2007;33(5):908-11.
- Pelosi P, Rocco PRM, Gama de Abreu M. Close down the lungs and keep them resting to minimize ventilator-induced lung injury. Crit Care. 2018;22(1):72.
- Imberger G, McIlroy D, Pace NL, Wetterslev J, Brok J, Moller AM. Positive end-expiratory pressure (PEEP) during anaesthesia for the prevention of mortality and postoperative pulmonary complications. The Cochrane database of systematic reviews. 2010(9):CD007922.
- Barbosa FT, Castro AA, de Sousa-Rodrigues CF. Positive end-expiratory pressure (PEEP) during anaesthesia for prevention of mortality and postoperative pulmonary complications. The Cochrane database of systematic reviews. 2014(6):CD007922.
- Tusman G, Bohm SH, Vazquez de Anda GF, do Campo JL, Lachmann B. 'Alveolar recruitment strategy' improves arterial oxygenation during general anaesthesia. Br J Anaesth. 1999;82(1):8-13.
- García-Sanz V, Aguado D, Gómez de Segura IA, Canfrán S. Comparative effects of open-lung positive end-expiratory pressure (PEEP) and fixed PEEP on respiratory system compliance in the isoflurane anaesthetised healthy dog. Res Vet Sci. 2019;127:91-8.
- De Monte V, Bufalari A, Grasso S, Ferrulli F, Crovace AM, Lacitignola L, et al. Respiratory effects of low versus high tidal volume with or without positive end-expiratory pressure in anesthetized dogs with healthy lungs. Am J Vet Res. 2018;79(5):496-504.
- Kudnig ST, Monnet E, Riquelme M, Gaynor JS, Corliss D, Salman MD. Effect of positive end-expiratory pressure on oxygen delivery during 1-lung ventilation for thoracoscopy in normal dogs. Vet Surg. 2006;35(6):534-42.
- Riquelme M, Monnet E, T Kudnig S, Gaynor J, Wagner A, Corliss D, et al. Cardiopulmonary effects of positive end-expiratory pressure during one-lung ventilation in anesthetized dogs with a closed thoracic cavity. Am J Vet Res. 2005;66:978-83.
- Rustomjee T, Wagner A, Orton EC. Effect of 5 cm of water positive end-expiratory pressure on arterial oxygen tension in dogs during and after thoracotomy. Vet Surg. 1994;23(4):307-10.
- Araos J, Cruces P, Martin-Flores M, Donati P, Gleed RD, Boullhesen-Williams T, et al. Distribution and Magnitude of Regional Volumetric Lung Strain and Its Modification by PEEP in Healthy Anesthetized and Mechanically Ventilated Dogs. Frontiers in veterinary science. 2022;9:839406.
- Allison A, Huizing X, Jolliffe C, Schaafsma I. Effect of fixed value positive end expiratory pressure valves on canine thoracic volume and atelectasis. J Small Anim Pract. 2017;58(11):645-51.
- Guarracino A, Lacitignola L, Auriemma E, De Monte V, Grasso S, Crovace A, et al. Which airway pressure should be applied during breath-hold in dogs undergoing thoracic computed tomography? Vet Radiol Ultrasound. 2016;57(5):475-81.
- Luz CM, Polarz H, Böhrer H, Hundt G, Dörsam J, Martin E. Hemodynamic and respiratory effects of pneumoperitoneum and PEEP during laparoscopic pelvic lymphadenectomy in dogs. Surg Endosc. 1994;8(1):25-7.
- Canfrán S, Gómez de Segura IA, Cediel R, Garcia-Fernandez J. Effects of a stepwise lung recruitment manoeuvre and positive end-expiratory pressure on lung compliance and arterial blood oxygenation in healthy dogs. Vet J. 2012;194(1):89-93.
- De Monte V, Grasso S, De Marzo C, Crovace A, Staffieri F. Effects of reduction of inspired oxygen fraction or application of positive end-expiratory pressure after an alveolar recruitment maneuver on respiratory mechanics, gas exchange, and lung aeration in dogs during anesthesia and neuromuscular blockade. Am J Vet Res. 2013;74(1):25-33.
- Ambrosio AM, Carvalho-Kamakura TPA, Ida KK, Varela B, Andrade FSRM, Facó LL, et al. Ventilation distribution assessed with electrical impedance tomography and the influence of tidal volume, recruitment and positive end-expiratory pressure in isoflurane-anesthetized dogs. Vet Anaesth Analg. 2017;44(2):254-63.
- Di Bella C, Lacitignola L, Grasso S, Centonze P, Greco A, Ostuni R, et al. An alveolar recruitment maneuver followed by positive end-expiratory pressure improves lung function in healthy dogs undergoing laparoscopy. Vet Anaesth Analg. 2018;45(5):618-29.
- Martin-Flores M, Araos JD, Daniels ZS, Newman A, Nugen SA, Campoy L. Effects of intraoperative positive end-expiratory pressure and fraction of inspired oxygen on postoperative oxygenation in dogs undergoing stifle surgery. Vet Anaesth Analg. 2022.
- Godet T, Futier E. Setting positive end-expiratory pressure in mechanically ventilated patients undergoing surgery. JAMA. 2019;321(23):2285-7.
- Caramez MP, Kacmarek RM, Helmy M, Miyoshi E, Malhotra A, Amato MBP, et al. A comparison of methods to identify open-lung PEEP. Intensive Care Med. 2009;35(4):740-7.
- Karsten J, Voigt N, Gillmann HJ, Stueber T. Determination of optimal positive end-expiratory pressure based on respiratory compliance and electrical impedance tomography: a pilot clinical comparative trial. Biomed Tech (Berl). 2019;64(2):135-45.
- Pereira SM, Tucci MR, Morais CCA, Simoes CM, Tonelotto BFF, Pompeo MS, et al. Individual positive end-expiratory pressure settings optimize intraoperative mechanical ventilation and reduce postoperative atelectasis. Anesthesiology. 2018;129(6):1070-81.
- Ferrando C, Suarez-Sipmann F, Tusman G, Leon I, Romero E, Gracia E, et al. Open lung approach versus standard protective strategies: effects on driving pressure and ventilatory efficiency during anesthesia - a pilot, randomized controlled trial. PLoS One. 2017;12(5):e0177399.
- García-Sanz V, Aguado D, Gómez de Segura IA, Canfrán S. Individualized positive end-expiratory pressure following alveolar recruitment manoeuvres in lung-healthy anaesthetized dogs: a randomized clinical trial on early postoperative arterial oxygenation. Vet Anaesth Analg. 2021;48(6):841-53.
- Araos J, Lacitignola L, Acquafredda C, DiBella C, Stabile M, Guacci E, et al. Definition and clinical evaluation of a recruiting airway pressure based on the specific lung elastance in anesthetized dogs. Vet Anaesth Analg. 2021;48(4):484-92.
- Futier E, Constantin J-M, Paugam-Burtz C, Pascal J, Eurin M, Neuschwander A, et al. A trial of intraoperative low-tidal-volume ventilation in abdominal surgery. N Engl J Med. 2013;369(5):428-37.
- García-Sanz V, Canfrán S, Gómez de Segura IA, Aguado D. Effect of recumbency and body condition score on open-lung positive end-expiratory pressure and respiratory system compliance following a stepwise lung recruitment manoeuvre in healthy dogs during general anaesthesia. Res Vet Sci. 2020;132:177-85.
- Ambrósio AM, Sanchez AF, Pereira MAA, Andrade FSRMD, Rodrigues RR, Vitorasso RdL, et al. Assessment of Regional Ventilation During Recruitment Maneuver by Electrical Impedance Tomography in Dogs. 2022;8.
- Soares JHN, Braun C, Machado ML, Oliveira RL, Henao-Guerrero N, Countermash-Ott S, et al. Cardiovascular function, pulmonary gas exchange and tissue oxygenation in isoflurane-anesthetized, mechanically ventilated Beagle dogs with four levels of positive end-expiratory pressure. Vet Anaesth Analg. 2021;48(3):324-33.
- Rothen HU, Sporre B, Engberg G, Wegenius G, Hedenstierna G. Re-expansion of atelectasis during general anaesthesia: a computed tomography study. Br J Anaesth. 1993;71(6):788-95.
- García-Sanz V. Efectos del reclutamiento alveolar y la presión positiva al final de la espiración óptima sobre la distensibilidad del sistema respiratorio y la oxigenación arterial en perros durante la anestesia general [Tesis Doctoral]. Madrid: Universidad Complutense de Madrid; 2022.
- Suarez-Sipmann F, Bohm SH, Tusman G, Pesch T, Thamm O, Reissmann H, et al. Use of dynamic compliance for open lung positive end-expiratory pressure titration in an experimental study. Crit Care Med. 2007;35(1):214-21.
- Cavalcanti AB, Suzumura EA, Laranjeira LN, Paisani DM, Damiani LP, Guimaraes HP, et al. Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2017;318(14):1335-45.
- Soares JHN, Carvalho AR, Bergamini BC, Gress MAK, Jandre FC, Zin WA, et al. Alveolar tidal recruitment/derecruitment and overdistension during four levels of end-expiratory pressure with protective tidal volume during anesthesia in a murine lung-healthy model. Lung. 2018;196(3):335-42.
- Tusman G, Bohm SH. Prevention and reversal of lung collapse during the intra-operative period. Best Pract Res Clin Anaesthesiol. 2010;24(2):183-97.
- Soares JH, Machado M, Coutermarsh-Ott S, Allen I, Grant D, de Oliveira R, et al., editors. Respiratory mechanics effects of different levels of end-expiratory pressure in anesthetized and mechanically ventilated beagles. 13th World Congress of Veterinary Anaesthesiology; 2018 September 25th - 29th, 2018; Venice.
- Henao-Guerrero N, Ricco C, Jones JC, Buechner-Maxwell V, Daniel GB. Comparison of four ventilatory protocols for computed tomography of the thorax in healthy cats. Am J Vet Res. 2012;73(5):646-53.
- Pinsky MR. The hemodynamic consequences of mechanical ventilation: an evolving story. Intensive Care Med. 1997;23(5):493-503.
- Johnston WE, Vinten-Johansen J, Santamore WP, Case LD, Little WC. Mechanism of reduced cardiac output during positive end-expiratory pressure in the dog. Am Rev Respir Dis. 1989;140(5):1257-64.
- Cassidy SS, Robertson CH, Jr., Pierce AK, Johnson RL, Jr. Cardiovascular effects of positive end-expiratory pressure in dogs. J Appl Physiol Respir Environ Exerc Physiol. 1978;44(5):743-50.
- Huseby JS, Pavlin EG, Butler J. Effect of positive end-expiratory pressure on intracranial pressure in dogs. J Appl Physiol Respir Environ Exerc Physiol. 1978;44(1):25-7.
- Luce JM, Huseby JS, Kirk W, Butler J. Mechanism by which positive end-expiratory pressure increases cerebrospinal fluid pressure in dogs. J Appl Physiol Respir Environ Exerc Physiol. 1982;52(1):231-5.
- Carvalho AR, Pacheco SA, de Souza Rocha PV, Bergamini BC, Paula LF, Jandre FC, et al. Detection of tidal recruitment/overdistension in lung-healthy mechanically ventilated patients under general anesthesia. Anesth Analg. 2013;116(3):677-84.
 by Multimédica
by Multimédica