Consideraciones anestésicas para el manejo de la vía aérea, monitorización, evaluación del dolor y bloqueos locorregionales en conejos
Resumen breve
En la primera parte “consideraciones anestésicas y farmacoterapia durante el periodo perioperatorio en conejos”, se describieron los fármacos más utilizados durante la premedicación, inducción y mantenimiento. En la segunda parte, nos centraremos en las consideraciones anestésicas específicas para el manejo de la vía aérea, monitorización y actualización en la evaluación del dolor, su tratamiento mediante bloqueos locorregionales y las complicaciones postoperatorias en conejos.Índice de contenidos
Resumen
En la primera parte “consideraciones anestésicas y farmacoterapia durante el periodo perioperatorio en conejos”, se describieron los fármacos más utilizados durante la premedicación, inducción y mantenimiento. En la segunda parte, nos centraremos en las consideraciones anestésicas específicas para el manejo de la vía aérea, monitorización y actualización en la evaluación del dolor, su tratamiento mediante bloqueos locorregionales y las complicaciones postoperatorias en conejos.
Anatomía del sistema respiratorio
Los conejos presentan peculiaridades anatómicas en su tracto respiratorio, es importante conocerlas ya que condicionan su manejo durante el periodo perianestésico. Estos individuos son respiradores nasales obligados debido a que su epiglotis se posiciona rostral al paladar blando, conectando en posición fisiológica la nasofaringe con la laringe1.
Este hecho permite que el flujo de aire se mueva sin obstrucciones desde las fosas nasales a través de la cavidad nasal hacia la glotis. Otras peculiaridades anatómicas son su limitada apertura de la cavidad oral, incisivos prominentes y una base carnosa de la lengua denominada “lingual torus”.
Estas características dificultan, durante la intubación, la correcta visualización de la glotis, ya de por si pequeña y propensa al laringoespasmo2,3. Su cavidad torácica es proporcionalmente pequeña en comparación con la cavidad abdominal, y a diferencia de otros mamíferos, su timo no involuciona con la edad, por lo que el campo pulmonar es reducido. Las contracciones musculares del diafragma son las principales responsables del movimiento respiratorio, en lugar de los músculos intercostales, por lo que grandes aumentos de la presión abdominal pueden causar restricción respiratoria4,5.
Elevaciones severas de la frecuencia respiratoria (FR) o respiraciones a través de la cavidad oral deben considerarse indicadores de alguna patología, agravando el pronóstico de los pacientes que lo presenten4.
Manejo de la vía aérea
Es fundamental durante el mantenimiento anestésico tener una vía aérea permeable con el objetivo de evitar obstrucciones, prevenir la timpanización gástrica, aportar gases anestésicos y soporte ventilatorio6,7. El mejor método para el control de la vía aérea es la intubación endotraqueal, pero, debido a su dificultad, se han descrito técnicas alternativas, en particular los dispositivos supraglóticos (V-GEL®).
Antes de aplicar alguna de las técnicas de manejo de la vía aérea, las autoras recomiendan realizar un periodo de ayuno de 20-30 minutos y limpiar la cavidad oral con bastoncillos (humedecidos con suero o clorhexidina) una vez iniciada la sedación. De esta manera reducimos la cantidad de alimento dentro de la cavidad oral y la probabilidad de aspiración o introducción iatrogénica durante la intubación (Figura 1).
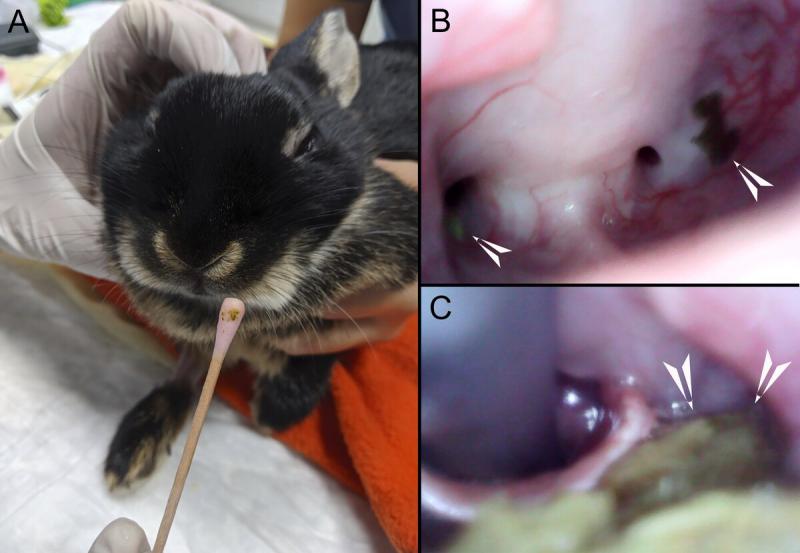
Metodos de intubación orotraqueal
Como se ha explicado anteriormente la intubación endotraqueal en conejos supone un desafío. Esta práctica requiere cierta experiencia por parte del anestesista ya que la realización de intentos repetidos se asocia a complicaciones como laringoespasmo2, daño traumático en la mucosa traqueal y laríngea, congestión, edema de glotis y hemorragia8,9 (Figura 2).
Las autoras recomiendan proceder cuando el individuo pierda el tono mandibular, aplicar lidocaína 2% (0,05-0,2 ml) tópica 60-90 segundos antes de la intubación10 y realizar un máximo de 3 intentos para evitar las complicaciones descritas. Los tubos endotraqueales recomendados son los de poliuretano de 2-3,5 mm de diámetro interno sin balón de neumotaponamiento y que dispongan de ojo de Murphy para evitar obstrucciones, se aconseja su lubricación previa con gel estéril.
El control de la vía aérea mediante intubación se puede realizar a partir de diferentes métodos.
Metodo a ciegas
Es el método generalmente más empleado, se define como la introducción de un tubo endotraqueal (ETT) a través de la boca sin visualizar la glotis. Para la intubación se debe posicionar el paciente en decúbito esternal con el cuello extendido en posición cráneo-dorsal para alinear la laringe con la orofaringe.
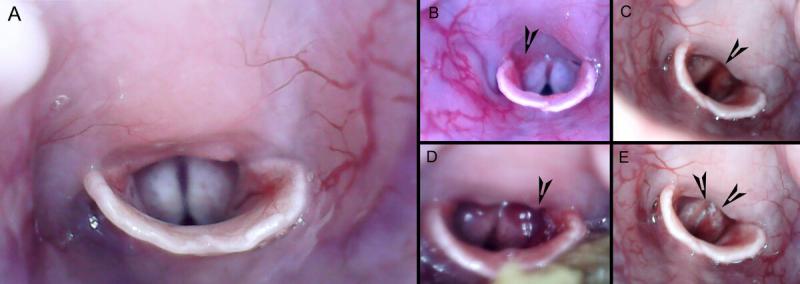
Se introduce el ETT a través de la boca hasta encontrar resistencia en la glotis, se retira unos milímetros y se comprueba la posición bien visualizando el vaho en el ETT o bien acercando el oído al tubo para notar la salida de aire, adentrando el tubo en la tráquea en la fase inspiratoria6,11,12 (Figura 3A).
Este método requiere de poco equipamiento adicional, pero de un anestesista experimentado en la técnica debido a su dificultad. La falta de experiencia puede desembocar en traumatismo tisular, introducción iatrogénica de alimentos y desechos en las vías respiratorias o producir intubación esofágica inadvertida que puede provocar dilatación gástrica posterior.Para la comprobación del correcto posicionamiento del ETT se emplea la capnografía o, en su ausencia, se puede observar el movimiento del balón reservorio del circuito anestésico sincronizado con los movimientos torácicos respiratorios6.
Metodo de visualización directa
Los métodos de visualización directa incluyen el uso de un otoscopio con cono pequeño/mediano o de laringoscopio. El paciente debe posicionarse de la misma manera que para el método anterior y se introduce el otoscopio o laringoscopio por el diastema hasta visualizar la glotis. La utilización del otoscopio permite dos métodos de intubación: mediante la visualización directa de la glotis guiando visualmente el ETT situado lateral al otoscopio o mediante la introducción del tubo por la luz del otoscopio a modo de guía (Figura 3B).).
La utilización de un estilete (catéter de polipropileno o catéter urinario semirígido) puede facilitar la intubación ya que añade rigidez al ETT y permite dirigirlo con más precisión a la laringe. El estilete se introduce en el ETT y se usa como guía, retirándolo una vez la intubación traqueal se ha completado. El método de visualización directa no necesita un equipamiento costoso, y la curva de aprendizaje es rápida6,11,13.
Metodo de visualización indirecta
Este método permite la visualización de la laringe a partir de un endoscopio. Permite la intubación del paciente mediante la técnica “side by side”, la cual utiliza el endoscopio para visualizar la entrada de la glotis y dirigir el ETT de manera independiente, o mediante la técnica “over the endoscope”, que utiliza el endoscopio como guía para introducir el tubo en la tráquea. Se pueden utilizar endoscopios rígidos o semiflexibles de 1,1-2,7 mm.
Estas técnicas proporcionan un método versátil, seguro y efectivo de intubación endotraqueal, pero se necesita una inversión económica importante para disponer del equipamiento, que a su vez es frágil y puede romperse si se realiza una excesiva presión o el paciente se mueve6,11,14. Existen alternativas low-cost como los endoscopios rígidos USB de 3,5-5,5 mm de diámetro, que presentan buena calidad de imagen, bajo precio y fácil disponibilidad15 (Figura 3C).
Metodos de intubación nastroqueal
La intubación nasotraqueal está indicada en pacientes que requieran de un amplio manejo de la cavidad oral por parte del cirujano como procedimientos quirúrgicos de mandíbula, maxila o dentales, entre otros. Para realizarla el paciente se sitúa en decúbito esternal, posicionando el cuello en hiperextensión con la cabeza hacia dorsal o en decúbito dorsal, posicionando la cabeza en dorsoflexión con la nariz apuntando hacia arriba.
Se puede utilizar un ETT lubricado de 1-1,5 mm (conejos de <2 kg) o de 2-2,5 mm en conejos más grandes, también se pueden utilizar tubos nasogástricos de 3-4F. El tubo se introduce a través de la narina en dirección ventromedial, se recomienda la aplicación de anestésico local previamente6. Los métodos para comprobar el correcto posicionamiento del tubo son los mismos que en técnicas anteriores6,16.
Las contraindicaciones de este método son la posibilidad de introducción iatrogénica de patógenos de la cavidad nasal a los pulmones y un aumento de la resistencia en las vías aéreas debido al pequeño tamaño del tubo. Las autoras consideran que esta técnica no debe sustituir a la intubación orotraqueal, dado que esta última consigue un mayor sellado traqueal y por tanto mayor efectividad con ventilación con presión positiva intermitente, pero es importante conocerla para aquellos casos en que sea necesaria.
Alternativas a la intubación endotraqueal
Dispositivo supraglótico
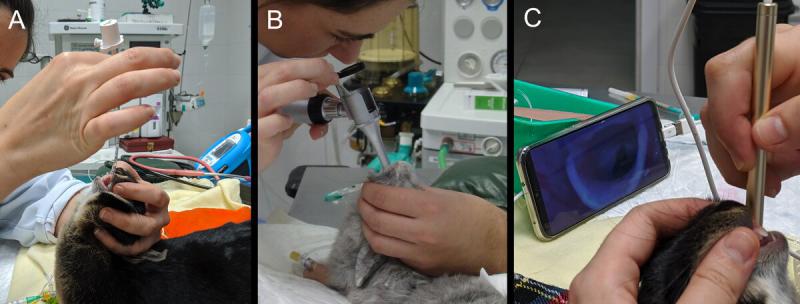
En la ultima década se ha desarrollado un dispositivo supraglótico específico para conejos (V-GEL®), disponible en varios tamaños para diferentes rangos de peso17. Para su introducción el paciente debe situarse en decúbito esternal con la cabeza extendida y su lengua exteriorizada. Se avanza el dispositivo, lubricado con gel a base de agua, por la cavidad oral hasta que sus extremos laterales lleguen al arco palatogloso y quede apoyado en la laringe (Figura 4A y B).
Su diseño permite el bloqueo parcial de la entrada del esófago, impidiendo el paso de gases al estómago15. La inserción del V-GEL® permite un control de la vía aérea más rápido y fácil, con mínimo traumatismo de la mucosa orofaringea, a diferencia de la técnica a ciegas18. Las autoras lo consideran una herramienta útil en casos de emergencia como reanimación cardiopulmonar o en pacientes que presenten apnea inesperada tras la aplicación de fármacos.
El correcto posicionamiento se debe comprobar mediante capnografía tanto al introducir el dispositivo como tras realizar cambios de posición del paciente, ya que el dispositivo se puede desplazar fácilmente. Las complicaciones asociadas a esta técnica son distensión gástrica, compresión de la laringe, dificultad en el posicionamiento por afecciones dentales y cianosis lingual por compresión y oclusión del flujo sanguíneo15,18.
| Tabla 1. Rangos fisiológicos de constantes vitales en Consejos20. |
| Constante | Rango |
| Frecuencia cardiaca | 180-300 lpm |
| Frecuencia respiratoria | 30-60 rpm |
| Temperatura | 38,5-40 ºC |
| PAS/PAD (PAM) | 130-90/80-60 (90-80) mmHg |
PAS: presión arterial sistólica; PAD: presión arterial diatólica; PAM:presión arterial media; lpm: latidos por minuto; rpm: respiraciones por minuto.
Mediante tomografía axial computarizada se ha observado que en el 50-85% de los conejos la punta del dispositivo se desvía ventralmente hacia el vestíbulo laríngeo en lugar de hacia el esófago, provocando una reducción en el flujo de las vías respiratorias18,19. La colocación adecuada del V-GEL® es esencial para garantizar el suministro de agentes inhalatorios y un buen resultado anestésico.
Múltiples estudios han demostrado que, correctamente situados, estos dispositivos son una herramienta útil para el control y mantenimiento de la vía aérea en conejos, tanto en ventilación espontánea como mecánica. Aunque, Wenger et al.(2017) comprobaron que bajo ventilación mecánica a bajas (6 cmH2O) y altas presiones (16 cmH2O), el 44% y 55% de los pacientes,respectivamente, presentaban fugas mayores al 25% del volumen tidal, mientras que entre 7-15 cmH2O, no se observaron fugas de más del 25% de volumen tidal19.
Mascarilla
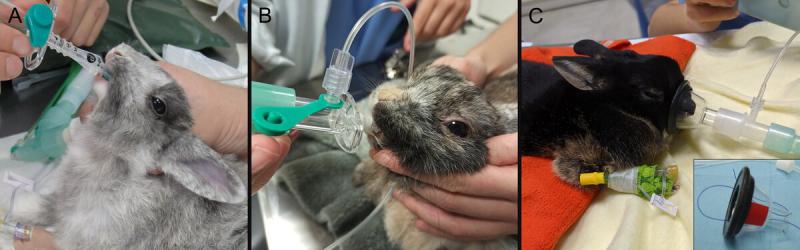
La inducción y mantenimiento directamente con mascarilla es un método utilizado en conejos de pequeño tamaño en los que la intubación presenta mayor dificultad o no es posible (Figura 4C). Este método no permite el control de la vía aérea, por lo que se asocia a hipercapnia y presión arterial de oxígeno baja, mayor riesgo de aspiración e impide la ventilación manual o mecánica efectiva7,20.
Monitorización
La monitorización es uno de los aspectos más importantes durante el manejo anestésico. En cualquier paciente bajo anestesia la evaluación de los parámetros fisiológicos (Tabla 1) debe ser continua e intensiva (mínimo cada 5-10 minutos), con la finalidad de reconocer y corregir tendencias anormales de forma precoz, antes de que puedan producir un daño irrecuperable.
Una monitorización exhaustiva disminuye las complicaciones y mortalidad perianestésicas21,22. El American College of Veterinary Anesthesia and Analgesia (ACVAA) publicó en 2009 unas guías recomendando unos estándares mínimos de monitorización mediante un registro intensivo del plano anestésico, el sistema cardiovascular, la ventilación, la oxigenación y la temperatura23.
Plano anestésico
Existen varios parámetros para evaluar la profundidad del plano anestésico en conejos, difiriendo en algunos aspectos de otras especies. La pérdida de tono mandibular y del reflejo de retirada indican un plano anestésico adecuado, en cambio el reflejo palpebral puede no perderse hasta alcanzar una profundidad anestésica a veces excesiva, por lo que no debería considerarse un reflejo fiable como en perros y gatos para la valoración de la profundidad anestésica19.
sistema cardiovascular
La valoración del tiempo de relleno capilar, el color de las mucosas, el ritmo y frecuencia cardíaca (FC) y la presión arterial (PA) proporcionan los mejores índices de función cardiovascular22. En pacientes anestesiados, la medición de la FC se puede realizar mediante la auscultación con estetoscopio precordial o esofágico, pulsioximetría o el empleo de electrocardiograma.
La auscultación permite la valoración del ritmo y FC, así como la detección de soplos y arritmias. El empleo del estetoscopio esofágico facilita la auscultación del paciente evitando manipularlo durante la cirugía, se debe introducir por el esófago posicionando el extremo distal a nivel de la carina, aunque debe evitarse su utilización en procedimientos quirúrgicos orales o cervicales5.
El electrocardiograma aporta información de la actividad eléctrica del corazón y permite por tanto interpretar arritmias. La presencia de pelo en la zona ventral de las extremidades dificulta la colocación de los electrodos, pero en ningún caso se debe rasurar esa región ya que predispone a pododermatitis.
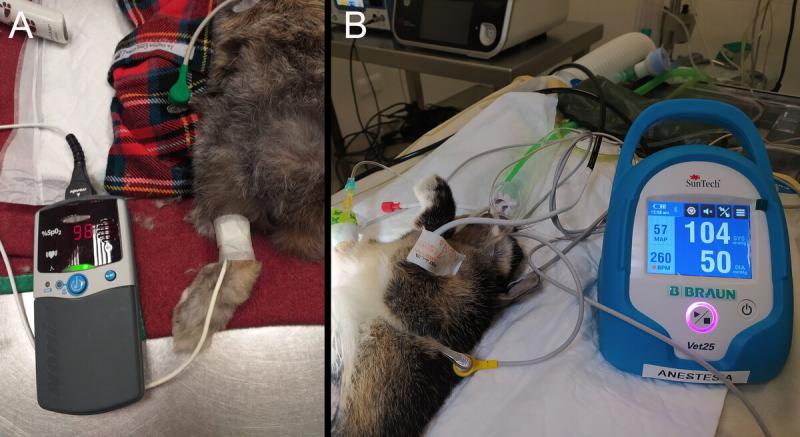
Se recomienda la utilización de pinzas atraumáticas con gel en ambas axilas y pliegue inguinal izquierdo. La pulsioximetría es un método no invasivo que proporciona la FC y saturación de oxígeno de la hemoglobina en sangre arterial, el dispositivo se puede situar en las orejas, lengua, mucosa bucal, vulva, saco escrotal, prepucio o en las extremidades21 (Figura 5 y 6A).

Ya que la mayoría de los agentes anestésicos causan depresión cardiovascular dosis dependiente a través de sus efectos sobre la contractibilidad, el gasto cardiaco y la resistencia vascular periférica24, la monitorización de la PA es una herramienta fundamental durante la anestesia. La PA se puede medir a través de técnicas invasivas y no invasivas. Los métodos invasivos se consideran el gold estándar e implican la colocación de un catéter arterial conectado a un transductor de presión.
Las arterias auriculares y femorales son las más utilizadas en conejos25 y, generalmente, pueden acomodar catéteres de 22-24G. En caso de cateterizar la arteria auricular, al ser una arteria terminal, se debe tener precaución debido al riesgo de trombosis y necrosis isquémica de la oreja. Las ventajas del método invasivo son su precisión, y la información “latido a latido” que permite mayor rapidez de acción en caso de complicaciones.
Por otro lado, su colocación requiere de técnica y tiempo, y puede conllevar complicaciones como hematomas, infecciones, eritema y la cateterización resultar complicada en ocasiones debido al tamaño del paciente15.
Los métodos no invasivos incluyen Doppler, sistemas oscilométricos regulares y de alta definición (Figura 6B). El tamaño del manguito debe ser aproximadamente el 40% de la circunferencia del tarso, carpo o húmero21. La exactitud de sus mediciones puede verse influenciada por múltiples factores ajenos al dispositivo, como tamaño y localización del manguito, movimientos del paciente, densidad del pelo, vasoconstricción, arritmias o compromiso hemodinámico15.
Harvey et al. (2012) no encontraron diferencias clínicamente significativas entre las PA obtenidas mediante métodos invasivos en la arteria auricular y Doppler en extremidades anteriores en conejos anestesiados y establecieron la medición Doppler inferior a 80 mmHg como un indicador fiable de hipotensión26. Otro estudio comprobó que las mediciones realizadas mediante oscilométrico en extremidades anteriores son útiles en pacientes hipo- y normotensos, perdiendo precisión en extremidades posteriores o presiones elevadas25.
Sistema respiratorio
La FR, su calidad y ritmo son indicadores útiles de la profundidad del plano anestésico y su evaluación es necesaria para asegurar una anestesia adecuada23. Su valoración directa puede verse comprometida por la falta de visualización del paciente bajo paños quirúrgicos, pero hay alternativas para obviar este problema, como la visualización del movimiento de la bolsa reservorio o el uso de paños quirúrgicos transparentes.
El empleo de monitores respiratorios de apnea, que detectan el aire caliente exhalado y emiten una señal audible por cada espiración, constituyen una alternativa viable21.
La capnografía permite la valoración de la FR y la visualización gráfica de la cantidad de CO2 espirado (EtCO2) proporcionando información sobre la calidad de la ventilación del paciente. Los casos de hipercapnia (EtCO2>45 mmHg), pueden deberse a hipoventilación, reinhalación o aumento en la producción (sepsis/fiebre), en cambio la hipocapnia (EtCO2<30mmHg) se puede ver en casos de hiperventilación, obstrucción del tubo endotraqueal, disminución de gasto cardiaco, tromboembolismo pulmonar o fugas del sistema.
En pacientes menores a 5 kg, el espacio muerto asociado a la conexión al ETT puede ser la causa de la rehinalación y debe minimizarse. Se considera clínicamente significativo cuando el CO2 inspirado es mayor de 4 mmHg. Sustituir la conexión por una aguja de calibre 18G insertada en la luz del ETT puede ser una solución a este problema, siempre que no obstruya el flujo de aire. Este remedio dañará el ETT, por lo que se tendrá que descartar tras su uso. Existen también conectores de ETT con puerto para la línea del capnógrafo incluida, que causan mínimo espacio muerto21 (Figura 7).

Temperatura corporal
La hipotermia es una de las complicaciones anestésicas más comunes, especialmente en los conejos, debido a su tamaño y su alto ratio superficie-volumen. Por lo tanto, es importante monitorizar la temperatura de nuestros pacientes para mantener la homeostasis y poder solucionar alteraciones significativas. Su medición se realiza con termómetros digitales, sondas esofágicas, rectales o termómetros auriculares3.
Los termómetros esofágicos son el método más fiable para la medición de la temperatura real del paciente bajo anestesia general27, aunque no existen estudios en conejos al respeto. Existen varios métodos para controlar la hipotermia como por ejemplo minimizar el rasurado prequirúrgico, el uso de soluciones atemperadas para preparar la zona quirúrgica, el uso de sacos de semillas, guantes calientes o las mantas de calentamiento de aire (Figura 8).
Postoperatorio
Generalmente se aconseja retirar el ETT cuando el paciente recupera el reflejo de deglución. Si la recuperación parece prolongada, se pueden antagonizar los fármacos sedantes. Esto permite un retorno más rápido a la normotermia y ayuda a que el paciente empiece a comer lo antes posible28.
La administración preventiva de agentes procinéticos (ranitidina 2-4 mg/kg/12 horas y metoclorpramida 2 mg/kg/8 horas) favorece el retorno a una motilidad gastroentérica normal.
Los conejos que no reanuden sus hábitos de alimentación dentro de las 2-3 horas desde inicio de la recuperación deben comenzar con un régimen de alimentación asistida con jeringa utilizando una dieta herbívora (Oxbow Critical Care® o Emeraid intensive Care® a 50 ml/kg/día, separado en 3 o 4 tomas) hasta que empiecen a comer por si mismos. Se debe introducir el heno y agua una vez el paciente está alerta. La coprofagia es un comportamiento normal e importante para una nutrición adecuada por lo que el uso de collares isabelinos no está recomendado en esta especie20.
Evaluación del dolor
Identificar el dolor y cuantificarlo no es una tarea fácil, ya que interfieren tanto factores fisiológicos como de comportamiento, haciendo que su evaluación sea poco fiable y subjetiva. No existe un método infalible que detecte con precisión la calidad del dolor en conejos, por lo que su reconocimiento se basa en la habilidad, experiencia y juicio profesional del veterinario junto con la tolerancia al dolor individualizada de cada paciente29,30.
| Tabla 2. Indicadores fisiológicos y de comportamiento considerados fiables para la evaluación del dolor en conejos según una encuesta publicada en 202031. |
|
|
Los conejos a su vez presentan una habilidad innata para enmascarar signos de dolor y tienden a estresarse durante el manejo, limitando el uso de parámetros fisiológicos (FC y FR) para el reconocimiento del dolor21. Esta limitación hace que el método más fiable para evaluar el dolor en esta especie sea la observación de cambios comportamentales, tales como reticencia al movimiento, falta de acicalamiento y coprofagia, distanciamiento de su entorno o bruxismo.
Es esencial también controlar la ingesta de agua y comida, la cantidad de heces producidas y el peso diario durante la hospitalización29,31-33(Tabla 2). El retorno a un comportamiento normal se considera un indicador ausencia de dolor y el tratamiento analgésico es efectivo29.
Sin embargo, tras una encuesta realizada a veterinarios, parece que la evaluación del dolor en conejos es todavía limitada, la falta de escalas de dolor (EDD) específicas hace de esta tarea un desafío31. Las autoras recomiendan que la evaluación del paciente sea llevada a cabo, en lo posible, siempre por el mismo observador, para realizar una interpretación más objetiva de la evolución del dolor.
Escalas de dolor
Las EDD nos permiten cuantificar la intensidad del dolor desde el punto de vista clínico, a través de la información que nos aporta el comportamiento y, en menor medida, los parámetros fisiológicos del paciente. Cuanto mayor sea el valor numérico, mayor será la intensidad de dolor que el paciente padece. Se crearon para tratar de objetivar la evaluación de dolor y la respuesta al tratamiento analgésico, pero ninguna escala es suficientemente sensible por si misma y siempre se debe complementar con la valoración de otros aspectos anteriormente explicados29,34,35.
Otro inconveniente es la extensa cantidad de tiempo de observación que requieren, limitando su aplicación en la clínica diaria33,34.
Las limitaciones de los métodos convencionales de identificación del dolor han llevado a la búsqueda de nuevos indicadores como los cambios en la expresión facial, desarrollando la “Rabbit Grimace Scale” (Figura 9) o la “CANCRS”, que se han demostrado una forma precisa, rápida y valida de cuantificar el dolor36-38. Benato et al. (2020) observaron que el 29 % de los veterinarios no se sentían seguros reconociendo el dolor en conejos, de hecho, el 77% de ellos no utilizaba escalas para evaluar el dolor, en su lugar se basaban en cambios fisiológicos y comportamentales.

Control del dolor
El control del dolor es de gran importancia en la práctica clínica diaria durante el periodo perioperatorio, tal y como comentamos en la primera parte de este artículo. En las últimas décadas el tratamiento del dolor se ha orientado a una “analgesia multimodal” o “balanceada”, que implica la combinación de diferentes fármacos o técnicas anestésicas con el fin de potenciar la analgesia, proporcionar seguridad y disminuir las complicaciones3,19,29.
Por ello, se ha intensificado la búsqueda de nuevas técnicas de anestesia locorregional en conejos, ya que permiten la reducción de la dosis de opioides, disminuyendo el riesgo de íleo paralítico en el periodo postoperatorio39.
Anestesia locorregional
A pesar de ser uno de los campos con mayor crecimiento en los últimos años, la anestesia locorregional en conejos es una técnica poco utilizada y son escasas las publicaciones referentes a este tema (Tabla 3).
La técnica consiste en el bloqueo reversible de la conducción nerviosa mediante anestésicos locales administrados vía neuroaxial o perineural, permitiendo la pérdida de sensibilidad en la región en la que se realizará la intervención quirúrgica. Los bloqueos locorregionales pueden realizarse mediante una técnica a ciegas, menos recomendadaya que puede resultar en una inyección intraneural o intravenosa inadvertida, o en una localización fuera del área objetivo.
Existen métodos más seguros, como el empleo de un neuroestimulador o un ecógrafo de forma independiente o en combinación15. La mayoría de los bloqueos en conejos son relativamente fáciles y rápidos de dominar, y tienen una incidencia de complicaciones baja40.
En la mayoría de los bloqueos se recomienda el empleo de agujas hipodérmicas de entre 25-27G dependiendo del tamaño del paciente, sinembargo, en otros casos serán necesarias agujas más largas con bisel atraumático (Touhy) de 26G o espinales de 22G según la localización anatómica donde depositar el anestésico local.
Las dosis de anestésicos locales habitualmente empleadas (lidocaína 2-4 mg/kg, bupivacaína 0,5-2 mg/kg y ropivacaína 2 mg/kg)19,41 resultan en volúmenes muy pequeños utilizando las formulaciones comercializadas, por eso se deberá realizar diluciones hasta alcanzar el volumen deseado, siendo un volumen de inyección adecuado de 0,05-0,1 ml/kg42.
A continuación, se describen los bloqueos que presentan mayor utilidad en la clínica diaria.
Bloqueos Auriculares
Debido a la conformación del canal auditivo de los conejos, a menudo sufren otitis externa u otitis media refractaria, siendo pacientes susceptibles a la resección total o parcial del canal auditivo y osteotomía de la bulla timpánica.
El bloqueo del nervio auricular mayor y nervio auriculo-temporal proporciona anestesia local a la pinna y al canal auditivo vertical. La utilización del neuroestimulador nos permite observar el posicionamiento correcto de la aguja en el caso de bloquear el nervio auriculo-temporal, por el desplazamiento caudal del pabellón auricular (estimulación del nervio auricular caudal), para ello se debe introducir la aguja perpendicular a la piel entre el borde caudodorsal de la apófisis coronoides de la rama de la mandíbula y el conducto auditivo.
En el caso del nervio auricular mayor se realiza guiado por referencias anatómicas introduciendo la aguja entre la vena maxilar y el ala del atlas41. Un estudio en cadáveres sugiere que se pueden localizar y teñir con éxito el nervio auricular mayor y nervio auriculo-temporal utilizando la técnica a ciegas43.
Bloqueos dentales
Los conejos presentan con frecuencia patologías dentales que necesitan de intervenciones quirúrgicas maxilofaciales, como extracciones de piezas dentales o marsupialización de abscesos. Están descritos varios bloqueos dentales: del nervio infraorbitario (maxilar), del nervio mentoniano y del nervio alveolar inferior (mandibular). Los nervios mentoniano, alveolar inferior, infraorbitario y maxilar se pueden bloquear solos o en combinación para proporcionar analgesia en cualquier región de la cavidad oral32.
Bloque del nervio maxilar (N. infraorbitario)
El nervio maxilar se ramifica en los nervios cigomático, palatino, alveolar inferior e infraorbitario, proporcionando inervación al parpado inferior, paladar duro y blando, arcada dentaria superior y la porción rostral y maxilar de la cara, respectivamente.
El bloqueo del nervio infraorbitario mediante la aplicación de anestésico local dentro del agujero infraorbitario es una técnica compleja y de difícil acceso debido a las características anatómicas de los conejos32.
A su vez, dicho abordaje implicala posibilidad de dañar el nervio por lo que se recomienda realizar un abordaje subcigomático (maxilar), para ello la aguja se introduce por debajo del arco cigomático, detrás del canto lateral del ojo, en dirección a la fosa pterigopalatina y se avanza lentamente hasta contactar con el hueso, retrocediendo unos milímetros y depositando el anestésico local41,42.
Este bloqueo se puede realizar con la ayuda del ecógrafo, colocando el transductor sobre el párpado superior obteniendo un corte que permite visualizar la distribución periconal del anestésico local (localización del nervio maxilar)41.
El bloqueo del nervio infraorbitario insensibiliza incisivos superiores, labio superior, tejidos blandos adyacentes (nervio infraorbitario) y parte lateral de la cabeza (nervio cigomático)32, mientras que el bloqueo del nervio maxilar a nivel subcigomático desensibiliza el hueso maxilar y tejidos blandos asociados, paladar duro y blando, arcada dentaria superior, labio superior y narinas.
Las indicaciones para realizarlo incluyen extracciones dentales ipsilaterales del cuadrante maxilar, cirugía periodontal, biopsias, terapia endodóntica, maxilectomías, rinotomías, rinoscopias o cirugía del paladar, entre otras42.
Bloqueo del nervio mandibular
El nervio mandibular se ramifica en los nervios sensitivos alveolar inferior, lingual y bucal, inervando la mandíbula, arcada dentaria inferior, lengua y la mejilla, respectivamente. El bloqueo del nervio mandibular, a diferencia del nervio maxilar, es fácil de realizar por similitud de referencias anatómicas con otras especies.
Consiste en aplicar anestésico local en el agujero mandibular entre la parte distal del último molar y la parte ventral de la mandíbula. Este bloqueo se puede realizar mediante el neuroestimulador, introduciendo la aguja a nivel de la articulación temporo-mandibular, en dirección caudolateral a rostromedial, hasta evocar la respuesta de los músculos masticatorios41.
Debido a la limitación para abrir la boca en esta especie, se recomienda el abordaje extraoral para este bloqueo, que insensibiliza la mandíbula y arcada dentaria inferior32,42,44.
Bloque del nervio mentoniano
Consiste en aplicar anestésico local en el agujero mentoniano localizado rostral al primer premolar inferior y en el tercio dorsal del cuerpo de la mandíbula. Este bloqueo insensibiliza la parte ventral y lateral de la mandíbula, el labio y el incisivo inferior32.
Bloque testicular
Es un bloqueo comúnmente empleado en orquiectomías escrotales, aplicando anestésico local através del testículo desde el polo caudal hacia el cordón espermático. En el caso de realizar orquidectomías preescrotales (las más habituales) se puede aplicar anestésico a nivel subcutáneo en la zona de la incisión32.
Epidural
La administración de fármacos en el espacio epidural es una técnica locorregional ampliamente utilizada en la anestesia veterinaria. Los fármacos más utilizados son los anestésicos locales, solos o combinados con opioides45. El opioide más utilizado es la morfina, a dosis de 0,1 mg/kg, que puede prolongar la analgesia, según nuestra experiencia, hasta 24 horas.
Esta técnica se puede asociar a ciertas complicaciones al realizarla en el espacio lumbosacro, como la administración inadvertida de fármacos en el espacio subaracnoideo o intravascular o lesiones en la medula espinal47 (Figura 10).
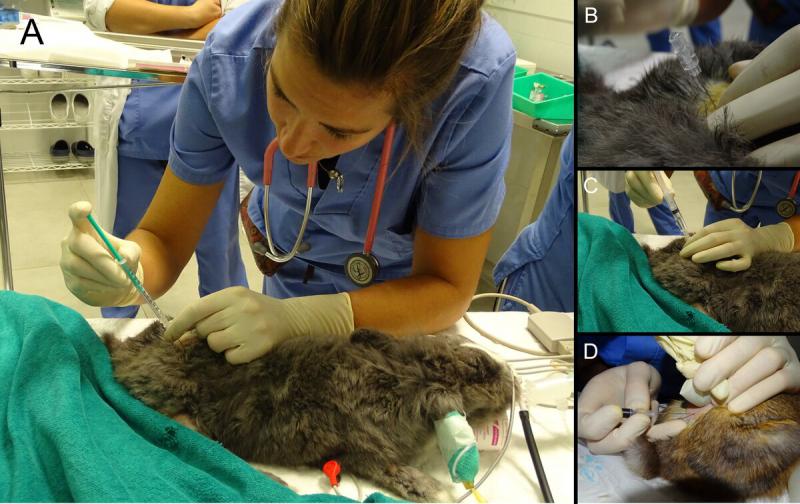
Esto se debe a que las técnicas para la identificación del espacio epidural no garantizan la posición de la aguja y a que la medula espinal de los conejos acaba en las vértebras sacras. Con el fin de obtener mayor seguridad, se recomienda realizar la técnica epidural a nivel sacrocoxígeo41.
El procedimiento es similar al descrito en perros y gatos, se posiciona al paciente en decúbito esternal con las extremidades posteriores extendidas hacia craneal y se avanza una aguja espinal o de Thuoy de calibre 22 G por vía transcutánea en un ángulo de 90º con respecto a la piel32,41, accediendo a través del espacio intercoxígeo.
Esta técnica proporciona pérdida de sensibilidad de las extremidades posteriores, región perineal y cola47. El efecto se prolonga de 60 a 90 minutos con lidocaína y de 4 a 8 horas con bupivacaína32.
La utilización del neuroestimulador es una técnica útil para determinar la colocación de la aguja a nivel intratecal en conejos, pero no detecta la correcta localización del espacio epidural a nivel lumbosacro48.
La aguja electroestimulada del tamaño necesario (normalmente 25 mm, 22-24G) se avanza hasta perforar el ligamento amarillo, lo que provoca contracción de los músculos de la cola. Se puede complementar con la utilización del ecógrafo posicionado el transductor en el plano parasagital oblicuo, lo que permite detectar la ubicación de los espacios intervertebrales y certificar la inyección epidural mediante la visualización de los signos ecográficos41.
Bloqueo plano transverso abdominal (TAP)
Consiste en la infiltración de anestésico local en el plano interfascial formado entre los músculos transverso abdominal y oblicuo abdominal interno, esta técnica debe realizarse con el transductor obteniendo un corte transversal de la pared abdominal.
Está indicado en procedimientos a nivel de la pared abdominal, por lo que se emplea tanto en cirugías que impliquen la apertura de esta como en mastectomías o nodulectomías en la zona abdominal. Para insensibilizar la pared abdominal de forma bilateral, se debe realizar el procedimiento en ambos hemiabdómenes, y por esto normalmente hay que diluir mucho el anestésico local, siendo necesarias cuatro inyecciones41.
Complicaciones anestésicas
A pesar de adaptar el protocolo anestésico a las necesidades de cada paciente y de realizar una monitorización intensiva, pueden presentarse complicaciones, las cuales en conejos se caracterizan por aparecer de forma rápida, disponiendo de un tiempo más corto para intervenir. La depresión cardiorrespiratoria (hipoventilación, apnea, bradicardia o hipotensión) producida por la administración de agentes anestésicos o por mantener al paciente en un plano anestésico demasiado profundo es la complicación a la que se asocia una mayor tasa de mortalidad anestésica49,50.
La obstrucción del tubo endotraqueal por el aumento de las secreciones o por un posicionamiento inadecuado del paciente también se describe dentro de las complicaciones anestésicas, así como la hipotermia la cual aparece tras la premedicación, y aumenta con el rasurado, el lavado excesivo con alcohol y la potencial apertura de las cavidades durante procedimientos quirúrgicos20.
La complicación más importante en el postoperatorio es la hipomotilidad gastrointestinal, la cual debe evitarse controlando el dolor y el estrés de nuestro paciente, así como introduciendo la nutrición lo antes posible49,50.
La anestesia da lugar a una disminución de la producción de lagrima y ausencia de parpadeo por lo que es posible observar ulceras corneales en el postoperatorio.Para prevenirlo se recomienda utilizar lagrima artificial en gel durante la anestesia y hospitalización del paciente20.
El daño traqueal producido durante la intubación o causado por un incorrecto posicionamiento durante el procedimiento quirúrgico o por cambios bruscos durante la anestesia puede causar estenosis traqueales. Estos pacientes pueden presentarse después de varios días o incluso semanas con sintomatología de dificultad respiratoria o cianosis9.
Conclusión
Las peculiaridades anatómicas y fisiológicas de los conejos suponen un reto para el anestesista, siendo por tanto de vital importancia conocerlas con el fin de prevenir futuras complicaciones.
La intubación traqueal a ciegas supone un desafío en conejos, por lo que se han desarrollado diversas técnicas para facilitar este procedimiento (visualización directa con otoscopio o laringoscopio, indirecta con endoscopio/USB).
Una monitorización anestésica exhaustiva es importante ya que permite reaccionar rápidamente ante alteraciones hemodinámicas del paciente disminuyendo así las complicaciones y mortalidad perianestésica.
La evaluación del dolor engloba tanto parámetros comportamentales como fisiológicos, existen escalas, “Rabbit Grimace Scale” o la “CANCRS”, que han demostrado ser una herramienta útil y rápida para cuantificar el dolor en conejos. Las técnicas de anestesia locorregional forman parte del concepto de analgesia multimodal y pueden realizarse mediante técnicas a ciegas, con la utilización del neuroestimulador o el ecógrafo.
Bibliografia
- Johnson-Delaney CA, Orosz SE; Rabbit Respiratory System: Clinical Anatomy, Physiology and Disease; Veterinary Clin North Am Exot Anim Pract; 2011; 14: 257–266.
- Grint NJ, Murison PJ; A comparison of ketamine-midazolam and ketamine-medetomidine combinations for induction of anaesthesia in rabbits; Vet Anaesth Analg; 2008; 35: 113-21
- Longley LA; Rabbit Anaesthesia; En: Anaesthesia of Exotic Pets; 1er ed; Longley LA (eds); Saunders Elsevier; St. Louis; 2008; 27-35.
- Vennen KM, Mitchell MA; Rabbits; En: Manual of Exotic Pet Practice; 1er ed; Mitchell MA, Tully TN (eds); Saunders Elsevier; St. Louis; 2009; 375- 405.
- Harcourt-Brown F; Anaesthesia and analgesia; En: Textbook of rabbit medicine; 1er ed; Harcourt-Brown F (eds); Alden Press; Oxford; 2001; 121-139.
- Varga M; Airway management in the rabbit; J Exot Pet Med; 2017; 26: 29–35.
- Bateman L, Ludders JW, Gleed RD, Erb HN; Comparison between facemask and laryngeal mask airway in rabbit during isoflurane anesthesia; Vet Anaesth Analg; 2005; 32: 280–288.
- Phaneuf LR, Barker S, Groleau MA, Turner PV; Tracheal Injury after Endotracheal Intubation and Anesthesia in Rabbits; J Am Assoc Lab Anim Sci; 2006; 45: 67-72.
- Grint NJ, Sayers IR, Cecchi R, Harley R, Day MJ; Postanaesthetic tracheal strictures in three rabbits; Lab Anim; 2006; 40: 301-308.
- Robertson SA, Gogolski SM, Shafford HL, Pascoe P, Shafford HL, Sager J, Grinffenhagen GM; AAFP Feline Anesthesia Guidelines; J Feline Med Surg; 2018; 20: 602-634.
- Lennox AM, Capello V; Tracheal Intubation in Exotic Companion Mammals; J Exot Pet Med; 2008; 17: 221–227.
- Fick TE, Schalm SW; A simple technique for endotracheal intubation in rabbits; Lab Anim; 1987; 21: 265–266.
- Thompson KL, Meier TR, Scholz JA; Endotracheal intubation of Rabbits Using a Polypropylene Catheter; J Vis Exp; 2017; 129: 1-8.
- Worthley SG, Roque M, Helft G; Soundararajan K; Siddiqui M, Reis ED; Rapid oral endotracheal intubation with a fibre-optic scope in rabbits: a simple and reliable technique; Lab Anim; 2000; 34: 199-201.
- Comolli J, D´Ovidio D, Adami C, Schnellbacher R; Technological Advances in Exotic Pet Anesthesia and Analgesia; Vet Clin Exot Anim; 2019; 22: 419–439.
- Stephens De Valle JM; Successful management of rabbit anaesthesia through the use of nasotracheal intubation; J Am Assoc Lab Anim Sci; 2009; 48: 166-170.
- Crotaz IR; An observational clinical study in cats and rabbits of an anatomically designed supraglottic airway device for use in companion animal veterinary anaesthesia; Vet Rec; 2013; 172: 606.
- Engbers S, Larkin A, Rousset N, Prebble M, Jonnalagadda M, Knight CG, Pang DS; Comparison of a supraglottic Airway device (V- Gel) with Blind Orotracheal intubation in Rabbits; Front Vet Sci; 2017; 49: 1-8.
- Wenger S; Anesthesia and Analgesia in Rabbits and Rodents; J Exot Pet Med; 2012; 21: 7-16.
- Vilalta S, García de Carellán Mateo A; Anestesia en los pequeños mamíferos; En: Manuales clínicos de Veterinaria: Anestesiología y cuidados intensivos; Muñoz P; Granados MM; Navarrete- Calvo R (eds); Elsevier; España; 2019; 202-217.
- Allweiler SI; How to improve anesthesia and analgesia in small mammals; Vet Clin Exot Anim; 2016; 19: 361-377.
- Grubb T, Sager J, Gaynor JS, Montgomery E, Parker JA, Shafford H, Tearney C; 2020 AAHA Anesthesia and Monitoring Guidelines for Dogs and Cats; 2020; J Am Anim Hosp Assoc; 56: 59-82.
- American College of Veterinary Anaesthesia and Analgesia (ACVAA); Recommendation for monitoring anesthetized patients. ACVAA Monitoring Guidelines Update; 2009. https://acvaa.org/wp-content/uploads/2019/05/Small-Animal-Monitoring Guidlines.pdf.
- Barter LS, Epstein SE; Cardiopulmonary effects of the three concentrations of isoflurane with or without mechanical ventilation and supramaximal noxious stimulation in New Zealand White rabbits; Am J Vet Res; 2013; 74: 1274-1280.
- Ypsilantis P, Didilis VN, Politou M, Bougioukas I, Bougioukas G, Simopoulos C; A comparative study of invasive and oscillometric methods of arterial blood pressure measurement in the anesthetized rabbit; Res Vet Sci; 2005; 78: 269–75.
- Harvey L, Knowles T, Murison PJ; Comparison of direct and Doppler arterial blood pressure measurements in rabbits during. Isoflurane anaesthesia; Vet Anaesth Analg; 2012; 39: 174-184.
- Brodeur A, Wright A, Cortes Y; Hypotermia and targeted temperature management in cats and dogs; J Vet Emerg Crit Care; 2017; 27: 151-163.
- Orr HE, Roughan JV, Flecknell PA; Assessment of ketamine and medetomidine anaesthesia in the domestic rabbit; Vet Anaesth Analg; 2005; 32: 271–279.
- Benato L, Rooney NJ, Murrel JC; Pain and analgesia in pet rabbits within the veterinary environment: a review; Vet Anaesth Analg; 2019; 46: 151-162.
- Kohn DF, Martin TE, Foley PL, Morris TH, Swindle MM, Vogler GA, Wixson SK; Guidelines for the Assessment and Management of Pain in Rodents and Rabbits; J Am Assoc Lab Anim Sci; 2007; 46: 97-108.
- Benato L, Murrell JC, Blackwell EJ, Saunders R, Rooney N; Analgesia in Pet Rabbits: A Survey Study on How Pain is Assessed and Ameliorated by Veterinary Surgeons; Vet Rec; 2020. Doi: 10.1136/vr.105071.
- Lichtenberger M, Ko J; Anesthesia and analgesia for small mammals and birds, Veterinary Clin North Am Exot Anim Pract; 2007; 10: 293–315.
- Mayer J; Use of behaviour analysis to recognize pain in small mammals; Lab Anim; 2007; 36: 43-48.
- Leach MC, Allweiler S, Richardson C, Roughan JV, Narbe R, Flecknell PA; Behavioural effects of ovariohysterectomy and oral administration of meloxicam in laboratory housed rabbits; Res Vet Sci; 2009; 87: 336-347.
- Morton DB, Griffiths PH; Guidelines on the recognition of pain, distress and discomfort in experimental-animals and an hypothesis for assessment; Vet Rec; 1985; 116: 431-436.
- Banchi P, Quaranta G, Ricci A, Mauthe M; Development and validation of a multidimensional composite pain scale for Rabbit (CANCRS) in a clinical environment; PLoS One; 2020. Doi: 10.1371/journal.pone.0221377.
- DiVicenti L, Meirelles LA, Westcott RA; Safety and effectiveness of a compounded sustained-release formulation of buprenorphine for postoperative analgesia in New Zealand White rabbits; J Am Vet Med Assoc; 2016; 248: 795-801.
- Keating SC, Thomas AA, Flecknell PA, Leach MC; Evaluation of EMLA Cream for preventing Pain during Tattooing of Rabbits: Changes in Physiological, Behavioural and Facial Expression Responses. PLoS One; 2012, Doi: 10.1371/journal.pone.0044437.
- Martin-Flores M, Singh B, Walsh CA, Brooks EP, Taylor LC, Mitchell LM; Effects of Buprenorphine, Methylnaltrexone, and Their Combination on Gastrointestinal Transit in Healthy New Zealand White Rabbits; J Am Assoc Lab Anim Sci; 2017; 56: 155–159.
- Schumacher M; Local anesthesia in rabbit dentistry: An important component of perioperative (multimodal) pain management; Book of proceeding of 28 European Veterinary Dental Forum; 2019; 84-85.
- Otero PE, Portela DA; Bloqueos regionales en el conejo. En: Anestesia regional en animales de compañía (Anatomía para bloqueos guiados por ecografía y neuroestimulación); 1rd ed; Otero PE, Portela DA (eds); Intermedica; Republica Argentina; 2017; 395-426.
- Campoy L: Bloqueo de los nervios maxilar y alveolar mandibular en el conejo; Clin. Vet. Peq. Anim; 2018; 38: 71-75.
- De Miguel Garcia C, Radkey DI, Hetzel S, Doss G; Injection techniques for auricular nerve blocks in the rabbit cadaver; Vet Anaesth Analg; 2019; 47: 274-279.
- Yong-Di L, Zheng-Long T, Jian-Qin T, Dong-Xiang W, You-Li C; Anatomy of the Inferior Alveolar Nerve in Rabbits and its Block Anesthesia; Int J Oral Dent Health; 2018; 4: 1-5.
- Campoy L, Read M, Peralta S; Canine and Feline Local Anesthetic and Analgesic Techniques; En: Lumb and Jones Veterinary Anesthesia; 4th ed; Thurmon JC, William JT, Grimm KA, Lumb VL, Jones EW (eds); Iowa; USA; 2015; 847-851.
- Gusak V, Turkovic V, Nesek-Adam V, Lerotic I, Popovic M, Brajenovic N, BrcicKaraconji I, Vnuk D; Lidocaine serum concentration after epidural administration in combination with morphine and fentanyl in rabbit – A preliminary study; Res Vet Sci; 2012; 93: 651-655.
- Ong BH, Hidaka Y, Kaneko Y, Yamamoto S, Mizutani S, Sekiguchi S, Torisu S, Naganobu K; Effects of a single-bolus bupivacaine injection into the coccygeal spinal canal of rabbits; J Vet Med Sci; 2020; 82:197-203.
- Otero PE, Portela DA, Brinkyer JA, Tarragona L, Zaccagnini AS, Fuensalida SE, Ceballos MR; Use of electrical stimulation to monitor lumbosacral epidural and intrathecal needle placement in rabbits; Am J Vet Res; 2012; 73: 1137–1141.
- Broadbelt D, Blissett K, Hammond R; The risk of death: the confidential enquiry into perioperative small animal fatalities; Vet Anaesth Analg; 2008; 35: 365–73.
- Lee HW, Machin H, Adami C; Peri-anaesthetic mortality and non-fatal gastrointestinal complications in pet rabbits: a retrospective study on 210 cases; Vet Anaesth Analg; 2018; 45: 520-528.
 by Multimédica
by Multimédica