Manejo analgésico perioperatorio en un caso de amputación de la extremidad anterior en la especie canina
Resumen breve
La amputación del miembro anterior es una cirugía muy agresiva que debe ser manejada con protocolos de anestesia balanceada y analgesia multimodal contundentes. Sólo la combinación de diferentes tipos de analgésicos resultará en una terapia efectiva y acorde a la invasividad del procedimiento.Índice de contenidos
Resumen
La amputación del miembro anterior es una cirugía muy agresiva que debe ser manejada con protocolos de anestesia balanceada y analgesia multimodal contundentes. Sólo la combinación de diferentes tipos de analgésicos resultará en una terapia efectiva y acorde a la invasividad del procedimiento. En esta línea, el empleo de técnicas de anestesia locorregional es preceptivo, ya que la interrupción de la transmisión nerviosa, a nivel de troncos nerviosos periféricos, evita de manera altamente eficiente la instauración de un cuadro de sensibilización central que contribuya a la exacerbación y cronificación del dolor postquirúrgico. Entre las diferentes alternativas existentes, el bloqueo del plexo braquial mediante abordaje subescalénico es una de las opciones más viables al combinar a partes iguales efectividad, grado de dificultad técnica y efectos adversos potenciales. En el periodo postoperatorio, el empleo de catéteres de infiltración de heridas permite además el aporte de anestésicos locorregionales de manera continua o repetida, disminuyendo notablemente el consumo de opioides y sus efectos indeseables. En el presente trabajo, se describe un caso clínico de amputación de miembro anterior en el que el paciente recibió una terapia analgésica combinada, que facilitó su correcto manejo aportando un elevado grado de confort y un alta hospitalaria temprana.
Introducción
La amputación de una extremidad es un procedimiento quirúrgico altamente invasivo, que implica la manipulación y lesión quirúrgica de una gran variedad de tejidos, incluida la sección de nervios periféricos. La piel es un órgano altamente inervado, que presenta una elevada concentración de nociceptores. Así pues, su manipulación junto con la desinserción y sección de músculos, fascias y en ocasiones tejido óseo va a suponer durante el periodo intraoperatorio, la aparición de una respuesta nociceptiva somática de alta intensidad (mediada por fibras A delta). Adicionalmente, durante el periodo postoperatorio, los pacientes se ven sometidos a la presencia de un intenso dolor de tipo inflamatorio, consecuencia de la sensibilización periférica originada por la cascada del ácido araquidónico (proveniente de las membranas celulares) y la liberación de sustancias proinflamatorias y vasoactivas (histamina, serotonina, sustancia P, etc.). En cualquier caso, lo que hace a estas intervenciones diferentes a otras es la implicación de troncos nerviosos periféricos de gran entidad que deben ser seccionados. Este hecho conlleva la introducción de un componente neuropático del dolor, con la posibilidad de perpetuarse y ocasionar el síndrome del miembro fantasma. De no ser tratado en condiciones, la suma de los diferentes tipos de dolor que supone esta cirugía puede conducir a un cuadro de sensibilización central, generando alodinia y facilitando la cronificación del dolor.
La técnica quirúrgica para la amputación de la extremidad anterior implica habitualmente la escapulectomía, y por tanto la sección del plexo braquial a nivel axilar. El plexo braquial se encuentra conformado por los ramos ventrales de los nervios espinales provenientes de C6, C7, C8 y T1, aunque en ocasiones C5 y T2 pueden también contribuir. Tras la interconexión de diferentes ramos ventrales surgen los troncos nerviosos mixtos, que aportan inervación sensitiva y motora a la extremidad anterior y que se individualizan en los nervios supraescapular, subescapular, axilar, musculocutáneo, radial, mediano y cubital.
La combinación de diferentes tipos de analgésicos, en una técnica de analgesia preventiva multimodal, resulta fundamental de cara al correcto manejo analgésico de estos pacientes. El empleo de fármacos como AINE, opioides, agonistas α2 adrenérgicos, antagonistas NMDA, anticonvulsivos y anestésicos generales van a permitir actuar sobre los procesos de transducción, modulación y percepción. Pero lo que marca una gran diferencia en el manejo de cirugías muy agresivas es el uso de anestésicos locales, con el objetivo de abolir la génesis y/o transmisión del estímulo nervioso. En la actualidad, existen estrategias que permiten administrar anestésicos locales tanto en el periodo intra- como postoperatorio, y así facilitar una cobertura analgésica de calidad a los pacientes.
En el presente trabajo se describe el manejo analgésico en un caso de amputación con escapulectomía en un perro, centrando la base de la analgesia multimodal en el bloqueo del plexo braquial, con abordaje subescalénico, y la colocación de un catéter de infiltración de heridas.
Caso clínico
Se admitió en el Hospital Veterinario de la Universidad de Murcia (HVUMU) un perro mestizo macho de 13 años de edad y 16 kg de peso. El paciente había sido atropellado meses antes por un tren. De manera urgente e inmediatamente tras el accidente se realizó (en otro centro) una esplenectomía y la amputación de la extremidad anterior izquierda mediante ostectomía de húmero a nivel de la diáfisis. En la primera visita al HVUMU el animal vino aquejado de anorexia, cierta letargia y febrícula, con origen en un absceso en el extremo distal (muñón) de la extremidad parcialmente amputada. Tras el examen físico y la realización de radiografías se recomendó la amputación con escapulectomía de la extremidadremanente. Se prescribió la administración de antibióticos (amoxicilina/ácido clavulánico 12.5 mg/kg/24 h PO) e inhibidores de la bomba de protones (omeprazol 1 mg/kg/12 h PO), y se programó la cirugía una semana más tarde. La tarde antes de la cirugía el paciente ingresó y se realizó suevaluación preanestésica (examen físico y analítica sanguínea) sin observar alteraciones relevantes, por lo que se clasificó como ASA II.
La mañana de la cirugía, tras un ayuno de sólidos de 8 h y de 2 h de líquido, el paciente se premedicó con dexmedetomidina (2 µg/kg) y metadona (0,2 mg/kg) IM. Transcurridos 15 minutos desde la premedicación se cateterizó la vena safena de la extremidad posterior izquierda, se preoxigenó al paciente durante 5 min (O2 100 %) y la anestesia se indujo con propofol a efecto (1,2 mg/kg) IV. Se intubó la tráquea (tubo endotraqueal 9 mm DI) y se conectó a un circuito circular (flujo de gas fresco O2/Aire 50 %, 1 L/min). El mantenimiento anestésico se realizó con isoflurano 1-1.5 % y la fluidoterapia con Ringer lactato (5 ml/kg/h) IV. Se monitorizó al paciente (FC, FR, ECG, PAS, PAM, PAD, SpO2, EtCO2 y temperatura), y a continuación se rasuró y preparó asépticamente el muñón de la extremidad a amputar para proceder con el bloqueo del plexo braquial a nivel subescalénico (Figura 1).
Figura 1. Paciente bajo anestesia general con preparación aséptica para el bloqueo locorregional subescalénico del plexo braquial.
Para ello se colocó un transductor lineal(3–13 mHz) sobre los músculos escalenos y tras los ajustes correspondientes, la sonda ecográfíca se dirigió en sentido caudal hasta localizar la primera costilla (Figura 2).
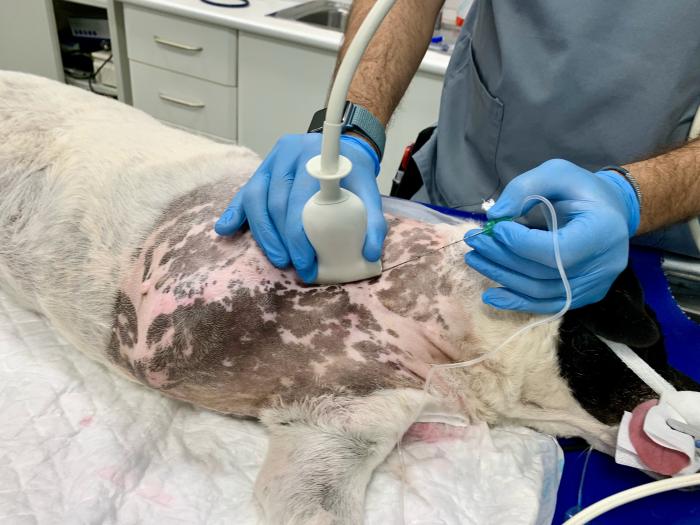
Figura 2. Abordaje “en plano” para el bloqueo subescalénico del plexo braquial. El posicionamiento del transductor permite el corte transversal del plexo braquial.
En este punto, se visualizaron los escalenos y medialmente a ellos el plexo braquial (ramos ventrales de C6-T1) así como la arteria axilar, encontrándose el paquete neuro-vascular contenido entre la fascia profunda del cuello (lateral) y la fascia prevertebral (medial) (Figura 3).
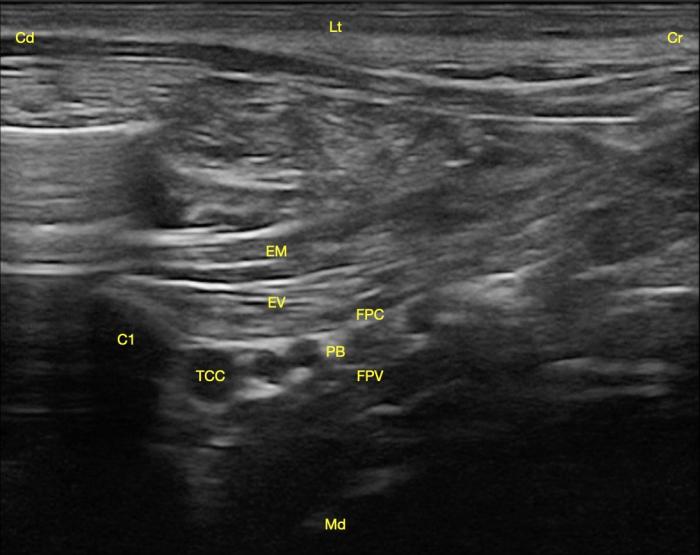
Figura 3. Corte transversal del plexo braquial con abordaje subescalénico. Se observa la primera costilla (C1), los músculos escalenos medio (EM) y ventral (EV), la fascia profunda del cuello (FPC), la fascia prevertebral (FPV) y entre ellas el plexo braquial (PB) junto con el tronco costocervical (TCC). Craneal (Cr), caudal (Cd), lateral (Lt) y medial (Md).
El bloqueo anestésico se realizó con la combinación de bupivacaína 0.5 % (2 mg/kg) y dexmedetomidina (0.5 µg/ml de bupivacaína), obteniendo un volumen total de 6.5 ml. Se introdujo una aguja sonovisible (100 mm de longitud y bisel de 30º) con abordaje “en plano” en la dirección de los ramos ventrales de C8-T1. Una vez perforada la fascia profunda del cuello (sensación de “pop”) y tras aspirar para corroborar la ausencia de punción vascular accidental, se administró 1/3 del volumen calculado. Se modifico la posición de la aguja para aproximar la punta a C7, donde se administró otro 1/3 del volumen. Por último, volvió a modificarse la posición de la aguja para poder administrar el último 1/3 en C6 (Figura 4) (Video 1).
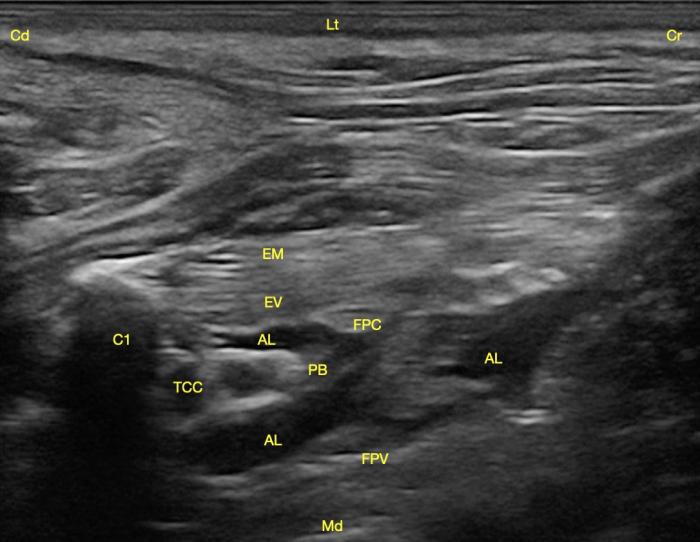
Figura 4. Corte transversal del plexo braquial con abordaje subescalénico tras la infiltración con anestésico local. Se observa la primera costilla (C1), los músculos escaleno medio (EM) y ventral (EV), la fascia profunda del cuello (FPC), la fascia prevertebral (FPV) y entre ellas el plexo braquial (PB) junto con el tronco costocervical (TCC) bañados por el anestésico local (AL). Craneal (Cr), caudal (Cd), lateral (Lt) y medial (Md).
Vídeo 1. Ejecución del bloqueo subescalénico del plexo braquial de cara a la amputación del miembro anterior.
El paciente se trasladó al quirófano donde volvió a monitorizarse (incluyendo PA invasiva, espirometría y EtIso) y se inició una ventilación mecánica (SIMV: FR 12 rpm, Vt 240 ml, Ppic 14 cm H2O, Pplat 13 cm H2O, PEEP 5 cm H2O, Compl. 32 ml/cm H2O). Durante el transcurso de la cirugía, se mantuvo una buena estabilidad hemodinámica y ventilatoria, siendo necesaria la administración de un bolo de ketamina (0.5 mg/kg) IV y metadona (0.1 mg/kg) IV, durante el periodo de manipulación de la zona más dorsal de la escápula (Figura 5).
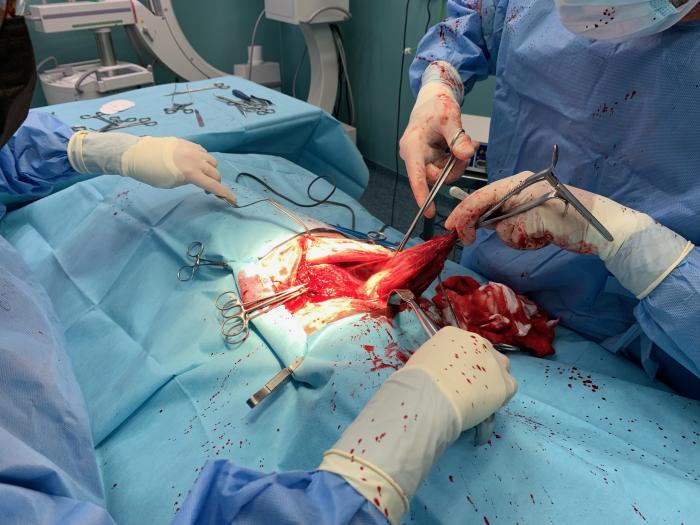
Finalmente, y antes del cierre de la herida quirúrgica, se colocó un catéter de infiltración de heridas, para posibilitar la administración repetida de bupivacaína en el postoperatorio (Figura 6).
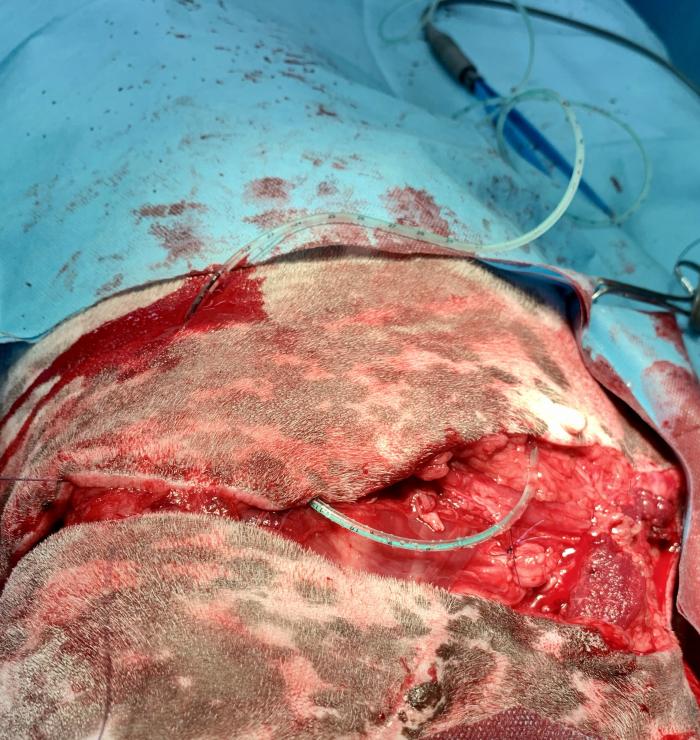
Figura 6. Amputación de la extremidad anterior izquierda.
De manera previa a la recuperación anestésica se administró dexmedetomidina (0.5 µg/kg) IV para prevenir la aparición de un posible delirio de emergencia. El paciente recuperó la ventilación espontánea y se trasladó a hospitalización donde se le administró meloxicam (0.2 mg/kg) IV (Figura 7).
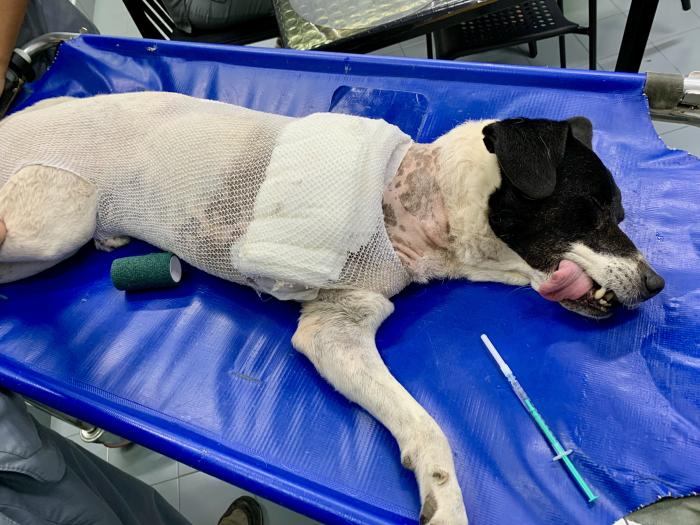
Figura 7. Catéter de infiltración de heridas para la administración de anestésico local en el periodo postoperatorio.
Se pautó la valoración del dolor postoperatorio (escala CMPS-SF Glasgow) cada 4 horas, y se prescribió la administración de bupivacaína 0.25 % (1 mg/kg, 6.5 ml totales/6 h) cuando la prueba de Glasgow alcanzase un valor 5/20, dado que no se estimó adecuado valorar al paciente caminando en estas fases tempranas de la recuperación. Si transcurridos 30 minutos desde la administración de bupivacaína resultaba necesario, se programó como analgesia de rescate metadona (0.1 mg/kg) IV, seguida, si se estimaba oportuno, de una infusión continua con ketamina (5 µg/kg/min) IV.
Durante las siguientes 24 h el paciente recibió una fluidoterapia de mantenimiento (SteroVet 1.5 ml/kg/h), y se mantuvo con terapia antibiótica (ampicilina 22 mg/kg/8 h/5 días y amoxicilina/ácido clavulánico 12.5 mg/kg/14 días) y omeprazol (1 mg/kg/12 h/14 días). La primera administración de bupivacaína a través del catéter de infiltración se consideró necesaria transcurridas 14 horas después de la recuperación anestésica, repitiéndose en un total de 4 ocasiones a intervalos de 6 horas. El paciente comenzó a ingerir alimentos a las 6 horas de la cirugía, y no se consideró necesaria la administración de metadona ni ketamina, como rescate analgésico, manteniendo el meloxicam (0.1 mg/kg) PO durante los siguientes 14 días. A las 48 horas de la intervención se retiró el catéter de infiltración y se dio el alta al paciente. En las revisiones pautadas a los 7 y 14 días, se observó una evolución favorable, sin signos de dolor, por lo que no se estimó necesaria la administración de ninguna medicación adicional.
Discusión
Dentro de los protocolos de analgesia multimodal, destinados al control analgésico perioperatorio, los opioides han ocupado, tradicionalmente, una posición destacada. Sin embargo, en los últimos años se está produciendo un cambio de tendencia, adquiriendo un papel cada vez más destacado los protocolos basados en la anestesia libre de opioides (OFA). Este cambio de paradigma surge de los numerosos efectos adversos asociados al empleo de opioides (constipación, náusea, emesis, anorexia, disforia, hiperalgesia, etc.), escasamente descritos en la literatura científica veterinaria, pero muy documentados en pacientes humanos. En medicina veterinaria, durante la hospitalización de los pacientes, se pueden observar alteraciones similares, que se manifiestan con frecuencia como cambios de conducta (excitación, disforia, anorexia, etc.), y que pueden derivarse del empleo de opioides de forma inadecuada. En la actualidad, la OFA es una estrategia cade vez más frecuente en anestesiología veterinaria, aunque se debe ser consciente de que la no inclusión de opioides en los protocolos anestésico/analgésicos requiere ser compensada adecuadamente mediante el uso de otros analgésicos. En el HVUMU, los opioides siguen empleándose de manera rutinaria, aunque se han reducido considerablemente tanto las dosis como la frecuencia de administración, siendo guiados por las necesidades individuales de cada paciente,estimadas mediante la aplicación repetida de sistemas de evaluación del dolor. En el caso descrito, el paciente recibió metadona (0.2 mg/kg) en la premedicación, y un segundo bolo (0.1 mg/kg) en el periodo intraquirúrgico, no siendo necesario el uso de más opioides. Aun no tratándose propiamente de una OFA, el manejo anestésico de este animal se acercó bastante a estas técnicas. La correcta cobertura analgésica ofrecida por las técnicas de anestesia regional empleadas, y probablemente la ausencia de opioides en el postoperatorio, facilitó la introducción de alimentación oral trascurridas escasamente 6 horas desde la cirugía.
Los agonistas α2 adrenérgicos presentan una actividad analgésica similar a la aportada por los opioides, afectando al proceso de modulación a nivel de médula espinal, contribuyendo a la hiperpolarización neuronal y al aumento del umbral de excitabilidad neuronal. Esto hace que la dexmedetomidina sea una alternativa muy interesante de cara a la contribución analgésica dentro de un protocolo multimodal. La corta duración de sus efectos analgésicos (inferior a la de su actividad sedante) hace que, en caso de querer aportar una analgesia duradera, se deba instaurar una infusión continua (0,5-1 µg/kg/h IV). Sin embargo, en los últimos años, y aunque el mecanismo de acción no esté del todo claro, se ha documentado que la dexmedetomidina administrada junto con anestésicos locales prolonga considerablemente la duración de sus efectos. Por este motivo, se optó por la administración de dexmedetomidina en combinación con bupivacaína. En este caso, no fue necesaria la administración de analgesia adicional hasta pasadas 14 horas desde la recuperación del paciente.
La ketamina es un anestésico disociativo que facilita la desconexión entre el sistema límbico y el córtex cerebral. Aunque su uso como anestésico en pequeños animales ha descendido notablemente en las últimas décadas, su empleo como analgésico goza de una creciente popularidad. Esta actividad se debe a su capacidad antagonista de los receptores NMDA a nivel del asta dorsal de la médula espinal. El bloqueo de estos receptores, relacionados directamente con la instauración de cuadros de sensibilización central, va a contribuir generosamente a una correcta cobertura analgésica, sobre todo en lo referente a analgesia de tipo somático. Es por ello por lo que su administración en pacientes con quemaduras extensas, politraumatizados, sometidos a amputaciones o mastectomías radicales puede ser de gran ayuda. Al igual que los agonistas α2 adrenérgicos presenta una duración de efectos breve, por lo que su uso en infusión continua resulta necesario si se pretende que su acción analgésica se prolongue más allá de 20-30 minutos. Aunque en este protocolo de rescate analgésico, el empleo de ketamina se encontraba pautado, sólo fue necesaria su administración en bolo (0.5 mg/kg IV) en una ocasión durante el procedimiento quirúrgico. En este punto el paciente respondió a la intervención, probablemente como consecuencia de la estimulación de los ramos dorsales de los nervios espinales implicados en inervación de las porciones más dorsales de los tejidos adyacentes a la escápula.
Sin lugar a duda, la clave de la cobertura analgésica de este caso fue la anestesia locorregional. La bupivacaína es un anestésico local de tipo amida, con un periodo de latencia lento (20 min.) y una larga duración de efectos (4-6 h). El mecanismo de acción de los anestésicos locales se basa en su unión a los canales del Na+, que impide la despolarización neuronal. El bloqueo del plexo braquial propiciado por este anestésico local en combinación con dexmedetomidina, y su posterior administración periódica, a través del catéter de infiltración de heridas, aportó una magnífica cobertura analgésica durante el periodo perioperatorio. El bloqueo subescalénico del plexo braquial es una alternativa válida para proporcionaranalgesia del miembro anterior distalmente a las porciones mediales de la escápula. En amputaciones del miembro anterior con escapulectomía, los ramos dorsales de los nervios espinales quedan fuera del área de influencia del bloqueo, y por tanto, la cobertura analgésica en este área resulta de peor calidad. Una alternativa hubiese sido realizar un bloqueo paravertebral de los ramos ventrales C6 y C7. Sin embargo, en el abordaje paravertebral siguen sin implicarse los ramos dorsales de los nervios espinales C6 y C7, y el bloqueo de C8 y T1 se realiza en localizaciones muy similares a las practicadas mediante abordaje subescalénico, con lo que no presenta claras ventajas. Además, el bloqueo paravertebral se asocia con mayor incidencia de afección del nervio frénico y de distribución epidural del anestésico local. Otra posible alternativa sería la combinación del bloqueo subescalénico con un bloqueo del erector espinal realizado en T1, destinado a la desensibilización de los ramos dorsales de los nervios implicados en la inervación de los aspectos más dorsales del área quirúrgica. Esta técnica, por lo general sencilla, se complica al realizarla en ubicaciones tan craneales, ya que la escápula, y sobre todo la profundidad de las apófisis transversas de las primeras vértebras torácicas dificulta el procedimiento. Así pues, y en experiencia de los autores, el bloqueo mediante abordaje subescalénico del plexo braquial resulta la alternativa más viable de cara a este tipo de cirugías, al aportar una buena cobertura analgésica de la mayor parte del área quirúrgica, y tratarse de una técnica locorregional con una dificultad media de ejecución.
La colocación de catéteres que permiten la administración continua o repetida de anestésicos locales supone una enorme ventaja de cara al control analgésico postoperatorio. Dependiendo de su ubicación, los catéteres puedes ser colocados de manera ciega, ecoguiada o por cirugía abierta. En el caso de una amputación de miembro anterior, la exposición del plexo braquial hace que la opción más sencilla sea su colocación durante la cirugía, en un plano profundo, junto a los ramos nerviosos seccionados. El mantenimiento del catéter durante 24-48 h tras la cirugía suele ser suficiente para aportar una cobertura analgésica adecuada durante el periodo más comprometido. En este caso la administración de bupivacaína a través del catéter en 4 ocasiones (24 h) se estimó suficiente.
En ocasiones tras este tipo de intervenciones, pueden aparecer signos de dolor neuropático de naturaleza persistente. La administración de gabapentina, es una buena alternativa en el manejo analgésico de estos pacientes. Se trata de un fármaco anticonvulsivo empleado originalmente en el tratamiento de la epilepsia. Sin embargo, en las últimas décadas se utiliza de manera rutinaria en el tratamiento del dolor neuropático. Aunque su mecanismo de acción no está aclarado, su efecto analgésico podría deberse a su actividad sobre los canales de calcio tipo N dependientes de voltaje. En caso de utilizarla se debe considerar que sobre todo al inicio del tratamiento, puede producir somnolencia. En el caso descrito, y dada suevolución favorable, no fue necesaria la administración de gabapentina.
En las últimas dos décadas la evolución de las técnicas de anestesia locorregional, tanto en anestesiología humana como veterinaria, ha sido exponencial. El uso de la electroestimulación y, sobre todo, de la ecografía para guiar estos bloqueos ha permitido desarrollar nuevas técnicas que antes resultaban imposibles de realizar o presentaban una baja tasa de éxito. Sin embargo, no por ello deben desestimarse otras técnicas sencillas como los catéteres de infiltración de heridas, que resultan prácticos, baratos y generan una cobertura analgésica de gran calidad en el postoperatorio. Finalmente, y aunque se base la estrategia analgésica principalmente en técnicas locorregionales, estas deben englobarse dentro de protocolos de analgesia multimodal. Sólo de esta forma se conseguirá tratar a nuestros pacientes de una forma eficaz, y proporcionales un confort postoperatorio adecuado que les permita recuperar una actividad diaria normal en el menor tiempo posible.
Bibliografía
- Abelson AL, McCobb EC, Shaw S, Armitage-Chan E, Wetmore LA, Karas AZ, Blaze C. Use of woud soaker catheters for the administration of local anesthetic for post-operative analgesia: 56 cases. (2009). Veterinary Anaesthesia & Analgesia. 36: 597-602
- Acquafredda C, Stabile M, Lacitignola L, Centonze P, Di Bella C, Crevice A, Florentino M, Staffieri. Clinical efficacy of dexmedetomidine combined with lidocaine for femoral and sciatic nerve blocks in dogs undergoing stifle surgery. (2021). Veterinary Anaesthesia & Analgesia. 48: 962-971.
- Carty S, Nicholls B. Ultrasound-guided regional anaesthesia. Continuing Education in Anaesthesia Critical Care and Pain (2007). 7, 20–24.
- Evans HE, de Lahunta A. Spinal nerves. En: Miller’s anatomy of the dog. Editado por Evans HE y de Lahunta A. Pp 611-657. Ed: Elsevier Saunders. (2013). St Louis. Missouri. USA.
- Gelfand HJ, Ouanes JP, Lesley MR, Ko PS, Murphy JD, Sumida SM, Isaac GR, Kumar K, Wu CL. Analgesic efficacy of ultrasound-guided regional anesthesia: a meta-analysis. (2011). Journal of Clinical Anesthesia. 23(2):90–96.
- Kissin I. Preemptive analgesia. Anesthesiology. (2000). 93: 1138–1143.
- Laredo FG, Belda E, Viscasillas J. Bloqueos locorregionales ecoguiados más utilizados en la especie canina. Parte I: miembro anterior y tórax. Clinica Veterinario de Pequeños Animales. Revista oficial de AVEPA. (2019). 39(3): 135-144.
- Marolf V, Selz J, Picavet P, Spadavecchia C, Tutunary A, Sandersen C. Effects of perineurial dexmedetomidine combined with ropivacaine on postoperative methadone requirements in dogs after tibial plateau leveling osteotomy: a two-center study. (2022). Veterinary Anaesthesia & Analgesia. 49: 313-322.
- Monticelli P, Fitzgerald E, Viscasillas J. A sonographic investigation for the development of ultrasound-guided para vertebral brachial plexus block in dogs: cadaveric study. (2018). Veterinary Anaesthesia & Analgesia. 45: 195-202.
- Otero PE, Fuensalida SE, Portela DA. Bloqueo del plano del erector espinal. En: Anestesia Regional en animales de compañía. Editado por Otero PE y Pórtela DA. Pp 242-247. Ed: Inter-médica S.A.I.C.I. (2017). Buenos Aires. República Argentina.
- Otero PE, Fuensalida SE, Portela DA. Bloqueo subescalénico del plexo braquial. En: Anestesia Regional en animales de compañía. Editado por Otero PE y Pórtela DA. Pp 71-76. Ed: Inter-médica S.A.I.C.I. (2017). Buenos Aires. República Argentina.
- Portela DA, Castro D, Romano M, Gallastegui A, García -Pereira F, Otero PE. Ultrasound-guided erector sane plane block in canine cadavers: relevant anatomi and injectate distribution. (2020). Veterinary Anaesthesia & Analgesia. 47(2): 229-237.
- Portela DA, Romano M, Otero PE. Locoregional anesthesia of the thoracic limbs and thorax in small animals. Veterinary Clinics of North America Small Animal Practice. (2019). 49(6): 1063-1083.
- Portela DA, Verdier N, Otero PE. Regional anesthetic techniques for the thoracic limb and thorax in small animals: A review of the literature and technique description. (2018). The Veterinary Journal. 241: 8-19.
- Rioja E. Local Anesthetics. En: Veterinary anesthesia and analgesia. 5ª ed Lumb and Jones. Editado por Grimm KA, Lamont LA, Tranquilli WJ, Greene SA y Robertson S. Pp 332-356. Ed: John Wiley & Sons, Inc. (2015). Ames. Iowa. USA.
 by Multimédica
by Multimédica