Manejo anestésico de un perro con fibrilación atrial
Resumen breve
Un manejo anestésico a base de metadona en la premedicación, propofol-midazolam o etomidato-midazolam en la inducción, el uso de agentes halogenados en el mantenimiento, el control de la presión arterial con dobutamina y la inclusión de técnicas de anestesia locorregional (vaina interna del recto e intratesticular) se mostró eficaz para lograr la estabilidad hemodinámica de este paciente con FA.Índice de contenidos
Resumen
La fibrilación atrial (FA) es una arritmia común en pacientes caninos que puede inducir alteraciones hemodinámicas importantes, resultando un reto para el anestesista. El ritmo rápido e irregularmente irregular que la caracteriza provoca diferencias en el llenado ventricular entre latidos que reducen gravemente el gasto cardíaco. Los objetivos principales de la anestesia del paciente con FA son la optimización del tiempo diastólico a través del control de la frecuencia cardiaca (gracias al uso de antiarrítmicos) y una analgesia multimodal y equilibrada. En este caso el paciente, un perro mastín macho entero, fue anestesiado en tres momentos diferentes en nuestro centro. En la primera anestesia el ritmo cardiaco fue sinusal, desarrollando en el trascurso del siguiente año la FA, que se manifestó en los dos procedimientos posteriores. Un manejo anestésico a base de metadona en la premedicación, propofol-midazolam o etomidato-midazolam en la inducción, el uso de agentes halogenados en el mantenimiento, el control de la presión arterial con dobutamina y la inclusión de técnicas de anestesia locorregional (vaina interna del recto e intratesticular) se mostró eficaz para lograr la estabilidad hemodinámica de este paciente con FA.
Introducción
La fibrilación atrial (FA) es la arritmia patológica más prevalente en pacientes caninos1. Se caracteriza por una despolarización caótica del atrio, con uno o múltiples focos ectópicos que se transmiten de forma heterogénea a través del miocardio atrial. Esto provoca una contracción descoordinada de los atrios, lo que disminuye el llenado ventricular previo a la sístole2. Además, el potencial de acción es transmitido de forma anárquica a los ventrículos a través del nodo atrioventricular (NAV), provocando un ritmo rápido e irregular3. Ambos factores provocan una falta de llenado ventricular y con ello, una reducción drástica del gasto cardíaco que se manifiesta con intolerancia al ejercicio, tos, taquipnea, letargia y síncopes4. El hallazgo clínico que debe alertar al veterinario es la presencia de un ritmo cardíaco irregularmente irregular con diferencias en la amplitud de pulso entre latidos3. El diagnóstico definitivo de la FA se realiza mediante electrocardiograma (ECG) en la cual se observa una ausencia de ondas P, las cuales son reemplazadas por ondas f fibrilatorias de amplitud variable y complejos QRS de morfología y duración normal pero cuyas distancias R-R se muestran irregulares (Figura 1).
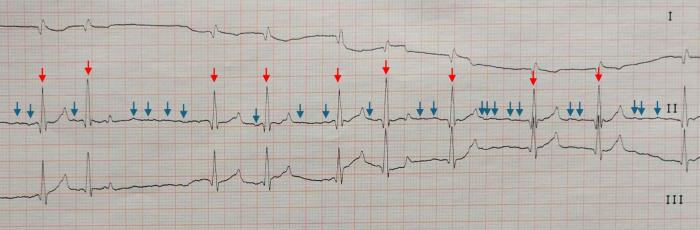
Figura 1. Electrocardiograma con presencia de fibrilación atrial en tres derivaciones a 50 mm/s y 10 mm/mV perteneciente a un perro Mastín macho de 7 años. Se observa la presencia de ondas f atriales (flechas azules) y un ritmo ventricular irregularmente irregular (flechas rojas).
El tratamiento de esta condición busca reducir la conducción a través del NAV para reducir la frecuencia ventricular y con ello aumentar el tiempo diastólico y la precarga ventricular y, en consecuencia, el gasto cardíaco. El tratamiento farmacológico incluye el uso de bloqueantes de los canales del calcio (p. ej.: diltiazem), glucósidos cardiotónicos (p. ej.: digoxina) y beta-bloqueantes (p. ej.: esmolol)5.
La anestesia general puede agravar el estado hemodinámico del paciente con FA al reducir la resistencia vascular periférica y la fuerza de contracción miocárdica, empeorando el gasto cardíaco, la presión arterial y, por tanto, el aporte de oxígeno a los tejidos. Por otro lado, los estímulos nociceptivos producidos durante la cirugía, si no se controlan de forma adecuada, pueden provocar un aumento del tono simpático y la frecuencia cardíaca (FC), reduciendo el tiempo diastólico y el gasto cardíaco.
Pese a la prevalencia de esta arritmia, el manejo anestésico de los animales con esta patología está escasamente documentado6,7 y, en conocimiento de los autores, aún no se han publicado guías clínicas al respecto. El caso clínico aquí presentado analiza los principales objetivos, riesgos y complicaciones a tener en cuenta al someter a un paciente con FA a un procedimiento anestésico.
Caso clínico
Se recibió en tres ocasiones distintas, en el Servicio de Anestesia del Hospital Veterinario de la Universidad de Murcia, un perro Mastín macho entero (Figura 2) que acabó desarrollando FA, para la realización de tres procedimientos anestésicos, en tiempos diferentes.
Figura 2. Paciente canino macho Mastín.
Primer procedimiento anestésico
En una primera ocasión, se recibió al paciente en el Servicio de Urgencias por distensión abdominal, vómitos improductivos y timpanismo abdominal con signos de shock compensado. En la estabilización inicial, se administró un bolo de Ringer lactato a 10 ml/kg en 10 minutos (Lactato de Ringer, B.Braun, Rubí, Barcelona, España) y, una vez asegurada la estabilización hemodinámica, se realizaron radiografías de abdomen (dos proyecciones) mostrando dilatación-vólvulo gástrica. Tras ello, se administró un bolo de lidocaína a 2 mg/kg IV (Lidocaína 20 mg/ml B. Braun, Barcelona, España), seguido de una infusión continua a 50 microgramos/kg/min y, tras intentar sin éxito sondar orogástricamente, se trocarizó percutáneamente el estómago, logrando reducir el grado de distensión abdominal y gástrico.
Se remite posteriormente al Servicio de Anestesia para la resolución quirúrgica de la patología mediante gastrotomía, para vaciado gástrico, recolocación del estómago en su posición anatómica y gastropexia incisional a la pared abdominal derecha. En el examen preanestésico se detectó un ritmo sinusal en el ECG. El paciente fue premedicado con metadona 0.3 mg/kg IV (Metasedin® 10 mg/ml, Esteve, Barcelona, España). Posteriormente, tras cinco minutos de preoxigenación, se realizó una coinducción con propofol 2 mg/kg (Propovet multidosis® 10 mg/ml, Zoetis, Madrid, España) y ketamina 2 mg/kg (Anesketin® 10 mg/ml, Dechra, Barcelona, España). Una vez en el plano adecuado de anestesia, se intubó orotraquealmente con una sonda high volume-low pressure de 14 mm de diámetro interno y se mantuvo la anestesia con isofluorano 1.3-1.5 % (IsoFlo®, Zoetis, Madrid, España) vehiculado en una mezcla de oxígeno y aire. Se cateterizó la arteria dorsal pedal con un catéter de 20 G y se monitorizó al paciente con ECG, presión arterial invasiva (PAI), presión arterial no invasiva, pletismografía, saturación parcial de oxígeno (SpO2), capnografía, espirometría y temperatura esofágica. La fluidoterapia consistió en Ringer lactato (RL) a 10 ml/kg/h.
Durante el procedimiento quirúrgico, se observó un bloqueo atrioventricular de segundo grado Mobitz 2 aislado y, más tarde, extrasístoles ventriculares aisladas sin repercusión hemodinámica. En el posoperatorio se mantuvo la infusión continua de lidocaína durante 16 horas y, debido a la evolución favorable, fue dado de alta a las 48 horas del ingreso.
Segundo procedimiento anestésico
Dieciocho meses más tarde, el paciente acudió al mismo centro por recidiva de distensión abdominal con la misma sintomatología que la ocasión anterior junto con la presencia de hematuria. Durante la estabilización inicial se detectó una FC a 200 lpm con un ritmo irregularmente irregular a la auscultación, pulso de amplitud irregular y un soplo sistólico apical izquierdo de grado II/VI. Se realizó un ECG y una ecocardiografía de urgencias en los que se detectó FA, función sistólica mantenida con fracción de acortamiento 32.7 % (rango fisiológico 25-50 %)8 y fracción de eyección 50 % (rango fisiológico 50-65)8, con una ratio aorta/aurícula izquierda (Ao:AI) de 1.8 (normalidad < 1.6)8 y regurgitación mitral sin signos de fallo cardíaco congestivo.
Tras esta evaluación y debido a la emergencia del proceso, el paciente fue sometido a anestesia para laparotomía exploratoria. En esta segunda ocasión, el paciente fue premedicado con metadona a 0.3 mg/ kg, preoxigenado durante 5 minutos y se realizó coinducción con propofol a dosis efecto (3 mg/kg totales) y midazolam 0.3 mg/kg IV (Midazolam 5 mg/ml, Normon, Tres Cantos, Madrid, España). Una vez intubado como en el caso previo, se mantuvo con isofluorano (1.2-1.5 %). La fluidoterapia consistió de nuevo en RL a 10 ml/kg/h. Una vez anestesiado se realizó un bloqueo ecoguiado de la vaina interna del recto con bupivacaína 0.5 % (Bupivacaína 5 mg/ml, B. Braun, Barcelona, España) a 0.4 ml/kg por hemiabdomen. La monitorización se realizó de la misma manera que en el caso precedente.
Durante la cirugía se observó dilatación gástrica sin torsión con la gastropexia en su posición anterior, por lo que se realizó gastrotomía y vaciado del estómago. La monitorización reveló fibrilación atrial persistente (FC 90-145 lpm) durante todo el periodo perianestésico, con amplitudes de presión y pulso variables (Figura 3).
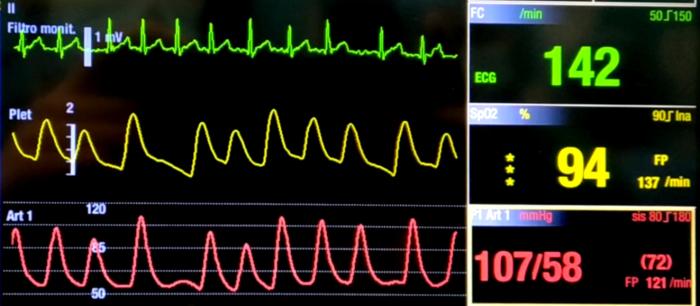
Figura 3. Monitorización hemodinámica del paciente durante el segundo procedimiento anestésico. De arriba abajo, electrocardiograma (verde), pletismografía (amarillo) y presión arterial invasiva (rojo). En el electrocardiograma, se observa la presencia de ondas f y ritmo ventricular irregularmente irregular. Tanto en la pletismografía y presión arterial se observa la diferencia de amplitud de pulso y presión, respectivamente, entre latidos.
Se observó un periodo de hipotensión. Para tratarlo se redujo la concentración de isofluorano y al no observar efecto sobre la presión arterial, se administró una infusión de dobutamina a 3 microgramos/kg/min(DOBUTamine 250 mg/20 ml, Hospira, Lake Forest, Illinois, EE. UU.), logrando corregir esta complicación.
En el periodo posoperatorio, y una vez asegurada la estabilidad posanestésica, el paciente fue evaluado por el Servicio de Cardiología del hospital. Se inició tratamiento con digoxina 0.22 mg/m2/12 h VO (Digoxina 0.25 mg comprimidos, Kern Pharma, Terrassa, Barcelona, España), diltiazem 1 mg/kg/8 h VO (Diltiazem Sandoz 60 mg comprimidos, Lacer, Cerdanyola del Vallés, Barcelona, España) y se administró una única dosis de pimobendan 0.15 mg/kg IV (Vetmedin® 0.75 mg/ml solución inyectable, Boehringer Ingelheim, Sant Cugat del Vallès, Barcelona, España) para mejorar temporalmente la funcionalidad cardíaca durante la recuperación posoperatoria. Durante la hospitalización el paciente fue inicialmente tratado con buprenofina a 0.02 mg/kg IV (Bupredine 0.3 mg/ml multidosis, Dechra, Barcelona, España) y fue evaluado con la escala de dolor de Glasgow mostrando valores entre 0-2/24, por lo que posteriormente no se aportó más analgesia. Tras 48 horas desde su admisión, el paciente fue dado de alta con tratamiento domiciliario a base de diltazem y digoxina con la pauta anteriormente descrita.
Seguimiento posterior
Durante el siguiente año el perro fue revisado regularmente por el Servicio de Cardiología. Los propietarios accedieron a realizar un examen Holter de 24 horas que mostró FA y una FC media de 164 lpm. También se observaron complejos ventriculares aislados, en dobletes y bigeminismos de forma frecuente. La concentración de digoxina en sangre era de 1.15 ng/ml (rango de referencia: 0.8-1.5).
Además, el paciente continuaba presentando episodios de hematuria por lo que se realizó una ecografía abdominal observándose hiperplasia benigna de próstata con presencia de quistes prostáticos de gran tamaño. Se comenzó con tratamiento médico a base de acetato de osaterona (Ypozane® 15 mg comprimidos, Virbac, Carros, Francia) 15 mg/24 h VO.
Tercer procedimiento anestésico
Catorce meses después de la anterior cirugía, y una vez constatada la falta de respuesta al tratamiento con osaterona y el aumento del tamaño de los quistes prostáticos, se decidió someter al paciente a anestesia general para drenaje ecoguiado de los quistes y orquiectomía bilateral. Previamente a la realización de la cirugía, se realizó una revisión completa. El ECG y ecocardiografía revelaron la persistencia de la FA, esta vez sin alteración de la estructura cardíaca (Ao:AI 1.38, fracción de acortamiento 36.2 % y fracción de eyección 37.4 %), dando como efectivo el tratamiento (Figura 4).
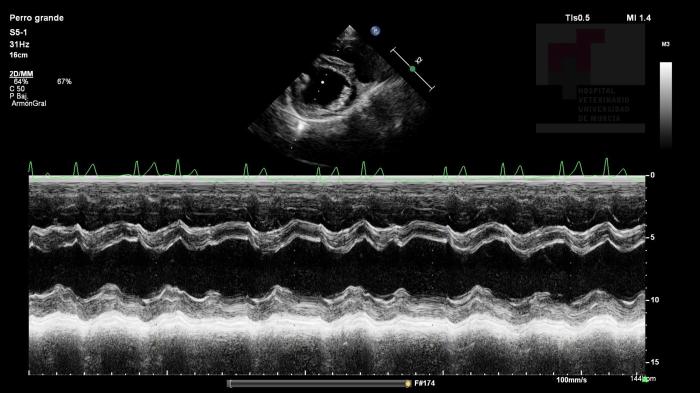
Figura 4. Corte paraesternal derecho en eje corto en modo M, función sistólica adecuada: fracción de acortamiento de 36.2 %. Se observa fibrilación atrial en el electrocardiograma.
El hemograma y la bioquímica preanestésica mostraron valores en rango fisiológico. Al examen preanestésico, el paciente se mostraba alerta y activo, con una FC a 140 lpm y un ritmo irregularmente irregular con pulso de amplitud variable sin presencia de soplo y FA al ECG (Figura 5).
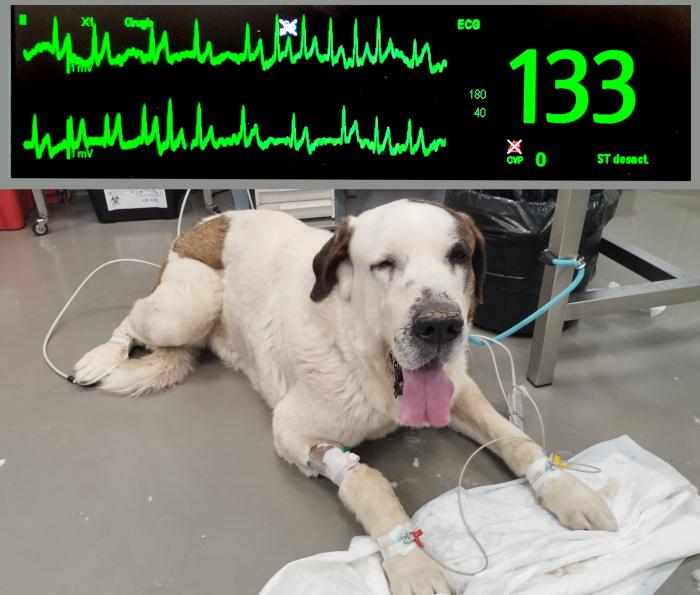
Figura 5. Evaluación preanestésica del paciente, previa al tercer procedimiento quirúrgico. El electrocadiograma (imagen superior) muestra de fibrilación atrial con presencia de ondas f y ritmo ventricular irregularmente irregular.
La premedicación se realizó con metadona a 0.3 mg/kg IV. Tras 5 minutos de preoxigenación, se realizó una coinducción con etomidato a 1 mg/kg (Etomidato-Lipuro 2 mg/ml emulsión inyectable, B. Braun, Melsungen, Alemania) y midazolam a 0.3 mg/kg. Tras ello se intubó de la misma manera que en las ocasiones anteriores y se mantuvo la anestesia con sevofluorano 2.0-2.4 % (SevoFlo®, Zoetis, Madrid, España). Una vez asegurada la estabilidad anestésica se realizó bloqueo intratesticular con lidocaína 2 % a 1 mg/kg por testículo y un bloqueo incisional con el mismo fármaco a 0.5 mg/kg. La monitorización se realizó de la misma manera que en los dos procedimientos anestésicos anteriores y la fluidoterapia se mantuvo con RL a 3 ml/kg/h.
Durante el periodo peranestésico se observó FA constante, de baja frecuencia, (90-150 lpm) sin presencia de otras arritmias. Al igual que en la anestesia previa, la amplitud de presión y pulso se mostró variable dependiendo de la distancia R-R. Además, se produjo un breve episodio hipotensivo resuelto tras la reducción de la concentración de sevofluorano. No se observaron más complicaciones.
El paciente se recuperó con normalidad, con monitorización continua del ERG (mostrando FA) y oscilometría sin detectarse ninguna complicación. Como analgesia posoperatoria se administró meloxicam a 0.2 mg/kg subcutáneo (Metacam® 5 mg/ml, Boehringer Ingelheim, Ingelheim/Rhein, Alemania) y buprenorfina 0.02 mg/kg IV. Tras 8 horas de hospitalización y constatando la recuperación completa del animal, se dio el alta hospitalaria (Figura 6).
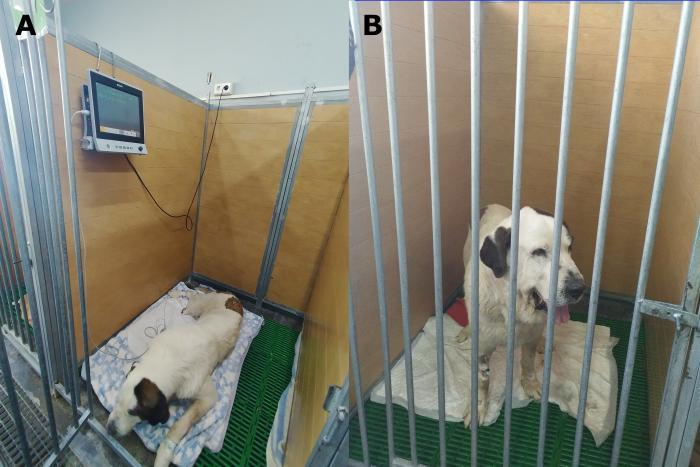
Figura 6. Recuperación anestésica del paciente tras el tercer procedimiento anestésico. (A) Monitorización hemodinámica con electrocardiograma y oscilometría posanestésica. (B) Paciente recuperado, previo al alta.
Discusión
Este caso describe la evolución clínica y el manejo anestésico de un mismo paciente sometido a tres procedimientos diferentes, en dos de los cuales la FA supuso un factor determinante a tener en cuenta en el manejo anestésico.
El perro fue recibido en una primera ocasión por presencia de dilatación-vólvulo gástrico sin detectarse FA durante la monitorización ecocardiográfica, la cual mostró un ritmo sinusal. Sin embargo, se observaron otras arritmias (bloqueo atrioventricular y complejos ventriculares) consideradas comunes en asociación a esta patología9. El uso de lidocaína, un antiarrítmico de clase Ib bloqueante de los canales de sodio, ha demostrado reducir el síndrome de isquemia-reperfusión10 y la incidencia de arritmias y fallo renal en esta patología11. Para evitar este síndrome, se administró previo a la trocarización. El tratamiento con lidocaína continuó en el posoperatorio para prevenir la aparición de extrasístoles ventriculares y reducir el consumo de opioides12. Considerando el posible estado de shock distributivo y obstructivo asociado con la dilatación-vólvulo gástrico13, la coinducción con ketamina-propofol se realizó para reducir el descenso de la FC y presión arterial, comunes con el uso único de propofol14.
La presencia de FA en la segunda visita resultó un hallazgo inesperado. Si bien la recidiva de dilatación gástrica varía entre el 6.0-10.8 % según el estudio15,16, la aparición de una FA tras la primera cirugía está escasamente documentada. Las causas por las cuales el paciente pudo desarrollar esta arritmia son diversas; isquemia atrial17 o inflamación (debidas a sus procesos patológicos previos), factores genéticos o su condición racial (gigante)2,18. La ausencia de signos clínicos durante el tiempo transcurrido entre la primera y segunda cirugía, algo habitual en pacientes con esta arritmia4, hace complejo determinar la etiología de la FA en el presente caso.
El manejo anestésico en situaciones de FA debe basarse en el control de la frecuencia ventricular, asegurando un adecuado tiempo de llenado ventricular y gasto cardíaco, así como disminuyendo la necesidad de oxígeno del miocardio19. Para ello la reducción de la FC a niveles fisiológicos resulta determinante. En los tres procedimientos anestésicos, se decidió premedicar con metadona, la cual, además de aportar una anestesia adecuada para el procedimiento quirúrgico20, posee un efecto cronotropo negativo leve que podría resultar beneficioso para reducir la FC durante la FA6,7 y, por tanto, aumentar el tiempo de llenado diastólico y con ello el gasto cardíaco.
La inducción se realizó con diferentes fármacos en las dos anestesias con FA debido a las diferencias en la fisiopatología y estabilidad hemodinámica de ambos procesos. En la primera anestesia con FA, el paciente fue atendido en urgencias por dilatación gástrica. La coinducción con propofol-ketamina no se consideró indicada en esta ocasión debido al efecto simpaticomimético de la ketamina, el cual podría aumentar la conducción del NAV, incrementando la FC y reduciendo con ello el tiempo de llenado ventricular14,21. En esta ocasión se realizó una coinducción con propofol-midazolam con el objetivo de reducir la dosis total de propofol y mejorar la calidad de la inducción22. Pese a estos beneficios, esta combinación no ha demostrado mejorar las variables hemodinámicas respecto a la inducción única con propofol en perros en estado crítico23.
En la segunda anestesia con FA, el paciente se encontraba hemodinámicamente estable gracias al tratamiento con digoxina y diltiazem. Estos fármacos, cuya combinación resulta superior al tratamiento con uno solo de ellos24, reducen la conducción del NAV logrando reducir la frecuencia ventricular3. Debido a estos factores, se realizó una coinducción con etomidato-midazolam. El etomidato produce una mínima depresión cardiovascular, manteniendo el gasto cardíaco, la presión arterial media y el índice cardíaco25. Sin embargo, la inducción única con etomidato puede producir mioclonos y excitación26. La combinación de midazolam-etomidato ha demostrado reducir la presencia de mioclonos en humanos27, pero aún no ha sido demostrado en perros28,29. Pese a sus potenciales beneficios, esta combinación no se consideró adecuada para la inducción del primer caso de FA (dilatación gástrica) debido a la potencial supresión del eje adrenocortical causada por el etomidato21, lo que podría haber aumentado la morbilidad del proceso al desestabilizar los mecanismos de compensación del paciente.
El mantenimiento de la anestesia se realizó con agentes halogenados. Tanto el isofluorano como sevofluorano producen una depresión cardiorrespiratoria dosis-dependiente similar30. Sin embargo, el sevofluorano, debido a su baja solubilidad en sangre, es capaz de producir una recuperación anestésica más rápida31. Durante el periodo perianestésico, la principal complicación de los procedimientos con FA fue la hipotensión. En ambos casos se redujo inicialmente la dosis aportada de isofluorano o sevofluorano, para reducir su efecto vasodilatador e inotropo negativo dosis-dependiente30,31. El paciente recuperó la normotensión tras la reducción de sevofluorano en la cirugía por orquiectomía, pero este no fue el caso del isofluorano en la cirugía por dilatación gástrica. Esta diferencia puede deberse a varios factores; en el caso de la dilatación gástrica, la falta de estabilización de la FA, el estado de shock distributivo u obstructivo, la regurgitación mitral y la dilatación de los atrios podrían haber sido factores determinantes en la ausencia de respuesta. Ante esta situación y debido al posible agravamiento del estado hemodinámico, el bolo de fluidos fue descartado para evitar una sobrecarga vascular y un fallo cardíaco congestivo. Se inició entonces una infusión con dobutamina. Este fármaco es una catecolamina sintética con efecto principalmente beta-1 y leve efecto beta-2. Produce un aumento de la contractilidad cardíaca y un ligero descenso de la resistencia vascular periférica32, demostrando su eficacia en la mejora de la funcionalidad cardíaca en perros con enfermedad mitral33. Pese a ello, es recomendable utilizar la menor dosis posible debido a que es capaz de aumentar la velocidad de conducción del NAV34 incrementando la frecuencia ventricular.
El control de la conducción del NAV y la frecuencia ventricular puede lograrse gracias a la administración de otros fármacos. Los antiarrítmicos de clase II o beta-bloqueantes, como el esmolol, han demostrado su utilidad en la reducción de la frecuencia ventricular3, sin embargo, su potencial efecto inotropo negativo podría haber resultado perjudicial en este caso. La amiodarona, un antiarrítmico de clase III bloqueante de los canales de potasio, con cierto efecto bloqueante del canal de sodio, canal de calcio y beta-bloqueante35, se ha mostrado efectivo para el tratamiento de la FA en perros36. Sin embargo, los solventes que presenta (polisorbato 80 y alcohol bencílico) poseen un gran efecto vasoactivo que puede provocar hipotensión grave, anafilaxis y bradicardia en pacientes caninos36,37.
La inclusión de la anestesia locorregional en el manejo anestésico ha demostrado reducir la morbi-mortalidad anestésica en pacientes caninos38 y mejorar los tiempos de recuperación posanestésica39. El uso del bloqueo ecoguiado de la vaina del recto con bupivacaína podría desensibilizar la línea media craneal en pacientes caninos40. En nuestro caso, esta técnica demostró ser eficaz durante la cirugía por vólvulo gástrico, obteniendo ausencia de fenómenos nociceptivos durante el procedimiento y valores de la escala de dolor de Glasgow compatibles con la ausencia de dolor posoperatorio. Otras alternativas al uso del bloqueo de la vaina del recto podrían haber sido realizadas. La epidural hubiera aportado analgesia a la región abdominal pero debido al posible agravamiento de la hipotensión y al mayor tiempo de preparación y ejecución de la técnica fue desestimada ante esta situación de urgencia41. Por otro lado, el bloqueo cuadrado lumbar es una técnica que aporta analgesia visceral y somática42, sin embargo, estudios cadavéricos43,44 demuestran que su efecto no desensibiliza los nervios que reciben información nociceptiva del tercio craneal del abdomen (zona de incisión en cirugía gástrica). Además, su uso en pacientes de gran tamaño hace difícil su ejecución debido a la profundidad de las estructuras y la falta de definición ecográfica (observación del autor). De cara a la orquiectomía, se realizó un bloqueo intratesticular e incisional con lidocaína45 mostrando eficacia analgésica en el perioperatorio. La bupivacaína y la lidocaína varían entre sí en su inicio de acción y duración46. La adición de coadyuvantes tales como la dexmedetomidina ha demostrado prolongar la duración del efecto anestésico45, aunque no fueron usados en este caso debido a su posible efecto sistémico47. El uso de dexmedetomidina, un agonista del adrenorreceptor alfa-2, para el control de la FC en pacientes con FA se considera controvertido. Pese a haberse mostrado eficaz en pacientes humanos con fibrilación atrial48, otros estudios49,50 concluyen que la dexmedetomidina no previene la FA posoperatoria sin aportar datos sobre su efecto hemodinámico. Debido a la escasa evidencia científica en medicina veterinaria y a los potenciales efectos cardiovasculares, se decidió no administrarla a nuestro paciente.
En conclusión, el control efectivo de la FC junto con el desarrollo de una analgesia multimodal, en el seno de una anestesia equilibrada resultaron en un control hemodinámico efectivo y en correcto manejo anestésico de este paciente con FA.
Bibliografía
1. Noszczyk-Nowak A, Michałek M, Kałuża E, Cepiel A, Pasławska U. Prevalence of arrhythmias in dogs examined between 2008 and 2014. Journal of Veterinary Research. 1 de marzo de 2017;61(1):103-10.
2. Pedro B, Fontes-Sousa AP, Gelzer AR. Canine atrial fibrillation: Pathophysiology, epidemiology and classification. The Veterinary Journal. noviembre de 2020;265:105548.
3. Pedro B, Fontes-Sousa AP, Gelzer AR. Diagnosis and management of canine atrial fibrillation. The Veterinary Journal. noviembre de 2020;265:105549.
4. Menaut P, Bélanger MC, Beauchamp G, Ponzio NM, Moïse NS. Atrial fibrillation in dogs with and without structural or functional cardiac disease: A retrospective study of 109 cases. Journal of Veterinary Cardiology. noviembre de 2005;7(2):75-83.
5. Luis Fuentes V, Johnson LR, Dennis S. BSAVA manual of canine and feline cardiorespiratory medicine. 2nd ed. Quedgeley: British small animal veterinary association; 2010. (BSAVA manuals series).
6. Arenillas M, Caro-Vadillo A, De Segura IAG. Anesthetic management of a dog with severe subaortic stenosis and mitral valve disease complicated with atrial fibrillation undergoing ovariohysterectomy. Open Vet J. 3 de julio de 2019;9(2):157.
7. Parra Martínez C, Charlesworth TM, Francis A. Anaesthetic management in a dog with constrictive pericarditis complicated with bi‐atrial enlargement and atrial fibrillation undergoing subtotal pericardiectomy. Vet Record Case Reports. diciembre de 2022;10(4):e485.
8. Luis Fuentes, Virginia. Chapter 11 - Echocardiography. En: BSAVA manual of canine and feline cardiorespiratory medicine. 2nd ed. Quedgeley: British small animal veterinary association; 2010. p. 79-97. (BSAVA manuals series).
9. Beck JJ, Staatz AJ, Pelsue DH, Kudnig ST, MacPhail CM, Seim HB, etal. Risk factors associated with short-term outcome and development of perioperative complications in dogs undergoing surgery because of gastric dilatation-volvulus: 166 cases (1992–2003). javma. 15 de diciembre de 2006;229(12):1934-9.
10. Cassutto BH, Gfeller RW. Use of intravenous lidocaine to prevent reperfusion injury and subsequent multiple organ dysfunction syndrome. J Vet Emergen Crit Care. septiembre de 2003;13(3):137-48.
11. Bruchim Y, Itay S, Shira B, Kelmer E, Sigal Y, Itamar A, etal. Evaluation of lidocaine treatment on frequency of cardiac arrhythmias, acute kidney injury, and hospitalization time in dogs with gastric dilatation volvulus. J Vet Emergen Crit Care. agosto de 2012;22(4):419-27.
12. Bruchim Y, Kelmer E. Postoperative Management of Dogs With Gastric Dilatation and Volvulus. Topics in Companion Animal Medicine. septiembre de 2014;29(3):81-5.
13. Sharp CR, Rozanski EA. Cardiovascular and Systemic Effects of Gastric Dilatation and Volvulus in Dogs. Topics in Companion Animal Medicine. septiembre de 2014;29(3):67-70.
14. Martinez-Taboada F, Leece EA. Comparison of propofol with ketofol, a propofol-ketamine admixture, for induction of anaesthesia in healthy dogs. Veterinary Anaesthesia and Analgesia. noviembre de 2014;41(6):575-82.
15. Ullmann B, Seehaus N, Hungerbühler S, Meyer‐Lindenberg A. Gastric dilatation volvulus: a retrospective study of 203 dogs with ventral midline gastropexy. J of Small Animal Practice. enero de 2016;57(1):18-22.
16. Glickman L, Lantz G, Schellenberg D, Glickman N. A prospective study of survival and recurrence following the acute gastric dilatation-volvulus syndrome in 136 dogs. Journal of the American Animal Hospital Association. 1 de mayo de 1998;34(3):253-9.
17. Sinno H, Derakhchan K, Libersan D, Merhi Y, Leung TK, Nattel S. Atrial Ischemia Promotes Atrial Fibrillation in Dogs. Circulation. 15 de abril de 2003;107(14):1930-6.
18. Arcuri G, Valente C, Perini C, Guglielmini C. Risk Factors for Atrial Fibrillation in the Dog: A Systematic Review. Veterinary Sciences. 21 de enero de 2024;11(1):47.
19. Perkowski SZ, Oyama MA. Pathophysiology and Anesthetic Management of Patients with Cardiovascular Disease. En: Grimm KA, Lamont LA, Tranquilli WJ, Greene SA, Robertson SA, editores. Veterinary Anesthesia and Analgesia [Internet]. 1.a ed. Wiley; 2015 [citado 16 de junio de 2024]. p. 496-510. Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/9781119421375.ch26
20. Kerr CL. Pain management I: systemic analgesics. En: Duke-Novakovski, De Vries, Seymour, editores. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia [Internet]. British Small Animal Veterinary Association; 2016 [citado 16 de junio de 2024]. p. 124-42. Disponible en: http://bsavalibrary.com/content/chapter/10.22233/9781910443231.chap10
21. Kästner SBR. Injectable anaesthetics. En: Duke-Novakovski, De Vries, Seymour, editores. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia [Internet]. British Small Animal Veterinary Association; 2016 [citado 16 de junio de 2024]. p. 190-206. Disponible en: http://bsavalibrary.com/content/chapter/10.22233/9781910443231.chap14
22. Sánchez A, Belda E, Escobar M, Agut A, Soler M, Laredo FG. Effects of altering the sequence of midazolam and propofol during co‐induction of anaesthesia. Veterinary Anaesthesia and Analgesia. julio de 2013;40(4):359-66.
23. Aguilera R, Sinclair M, Valverde A, Bateman S, Hanna B. Dose and cardiopulmonary effects of propofol alone or with midazolam for induction of anesthesia in critically ill dogs. Veterinary Anaesthesia and Analgesia. julio de 2020;47(4):472-80.
24. Gelzer ARM, Kraus MS, Rishniw M, Moïse NS, Pariaut R, Jesty SA, etal. Combination Therapy with Digoxin and Diltiazem Controls Ventricular Rate in Chronic Atrial Fibrillation in Dogs Better than Digoxin or Diltiazem Monotherapy: A Randomized Crossover Study in 18 Dogs. Veterinary Internal Medicne. mayo de 2009;23(3):499-508.
25. Berry SH. Injectable Anesthetics. En: Grimm KA, Lamont LA, Tranquilli WJ, Greene SA, Robertson SA, editores. Veterinary Anesthesia and Analgesia [Internet]. 1.a ed. Wiley; 2015 [citado 16 de junio de 2024]. p. 277-96. Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/9781119421375.ch15
26. Muir WW, Mason DE. Side effects of etomidate in dogs. J Am Vet Med Assoc. 15 de mayo de 1989;194(10):1430-4.
27. Schwarzkopf KRG, Hueter L, Simon M, Fritz HG. Midazolam Pretreatment Reduces Etomidate-induced Myoclonic Movements. Anaesth Intensive Care. febrero de 2003;31(1):18-20.
28. Keating SCj, Sage AM, Ambrisko TD, Somrak A, Carroll MQ, Oba PM, etal. The effect of midazolam or lidocaine administration prior to etomidate induction of anesthesia on heart rate, arterial pressure, intraocular pressure and serum cortisol concentration in healthy dogs. Veterinary Anaesthesia and Analgesia. marzo de 2020;47(2):160-7.
29. Jones TL, Calbay R, Da Cunha AF, Hofmeister EH. Descriptive assessment of adverse events associated with midazolam‐etomidate versus saline‐etomidate in healthy hydromorphone premedicated dogs. J of Small Animal Practice. junio de 2021;62(6):437-41.
30. Galloway DS, Ko JCH, Reaugh HF, Mandsager RE, Payton ME, Inoue T, etal. Anesthetic indices of sevoflurane and isoflurane in unpremedicated dogs. javma. 1 de septiembre de 2004;225(5):700-4.
31. Pang DSJ. Inhalant anaesthetic agents. En: Duke-Novakovski, De Vries, Seymour, editores. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia [Internet]. British Small Animal Veterinary Association; 2016 [citado 16 de junio de 2024]. p. 207-13. Disponible en: http://bsavalibrary.com/content/chapter/10.22233/9781910443231.chap15
32. Skelding AM, Valverde A. Sympathomimetics in veterinary species under anesthesia. The Veterinary Journal. abril de 2020;258:105455.
33. Goya S, Wada T, Shimada K, Hirao D, Tanaka R. Dose-dependent effects of isoflurane and dobutamine on cardiovascular function in dogs with experimental mitral regurgitation. Veterinary Anaesthesia and Analgesia. julio de 2018;45(4):432-42.
34. Peck T, Harris B. Pharmacology for Anaesthesia and Intensive Care [Internet]. 5.a ed. Cambridge University Press; 2021 [citado 16 de junio de 2024]. Disponible en: https://www.cambridge.org/core/product/identifier/9781108591317/type/book
35. Wright, N. Kathy. Chapter 168 - Antiarrhythmic Agents. En: Small animal Critical Care Medicine. Third Edition. St. Louis, Missouri: Elsevier; 2023. p. 961-6.
36. Pedro B, López‐Alvarez J, Fonfara S, Stephenson H, Dukes‐McEwan J. Retrospective evaluation of the use of amiodarone in dogs with arrhythmias (from 2003 to 2010). J of Small Animal Practice. enero de 2012;53(1):19-26.
37. Cober RE, Schober KE, Hildebrandt N, Sikorska E, Riesen SC. Adverse Effects of Intravenous Amiodarone in 5 Dogs. Veterinary Internal Medicne. mayo de 2009;23(3):657-61.
38. Redondo JI, Otero PE, Martínez‐Taboada F, Doménech L, Hernández‐Magaña EZ, Viscasillas J. Anaesthetic mortality in dogs: A worldwide analysis and risk assessment. Veterinary Record. 13 de noviembre de 2023;e3604.
39. Campoy L. Development of Enhanced Recovery After Surgery (ERAS) protocols in veterinary medicine through a one-health approach: the role of anesthesia and locoregional techniques. JAVMA. 1 de noviembre de 2022;260(14):1751-9.
40. St James M, Ferreira TH, Schroeder CA, Hershberger-Braker KL, Schroeder KM. Ultrasound-guided rectus sheath block: an anatomic study in dog cadavers. Veterinary Anaesthesia and Analgesia. enero de 2020;47(1):95-102.
41. Read M, Fischer BL, Campoy L. Ultrasound‐Assisted Epidural Anesthesia. En: Read M, Campoy L, Fischer B, editores. Small Animal Regional Anesthesia and Analgesia [Internet]. 1.a ed. Wiley; 2024 [citado 22 de junio de 2024]. p. 255-65. Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/9781119514183.ch27
42. Garbin M. Ultrasound‐Guided Quadratus Lumborum Block. En: Read M, Campoy L, Fischer B, editores. Small Animal Regional Anesthesia and Analgesia [Internet]. 1.a ed. Wiley; 2024 [citado 22 de junio de 2024]. p. 177-88. Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/9781119514183.ch18
43. Marchina-Gonçalves A, Gil F, Laredo FG, Soler M, Agut A, Belda E. Evaluation of High-Volume Injections Using a Modified Dorsal Quadratus Lumborum Block Approach in Canine Cadavers. Animals. 22 de diciembre de 2021;12(1):18.
44. Alaman M, Bonastre C, de Blas I, Gomez-Alvarez CM, Laborda A. Description of a novel ultrasound-guided approach for a dorsal quadratus lumborum block: a canine cadaver study. Veterinary Anaesthesia and Analgesia. enero de 2022;49(1):118-25.
45. Otero PE, Portela DA. Manual de anestesia regional en animales de compañía: anatomía para bloqueos guiados por ecografía y neuroestimulación. Buenas Aires, República Argentina: Editorial Inter-Média; 2017.
46. Grubb T, Lobprise H. Local and regional anaesthesia in dogs and cats: Overview of concepts and drugs (Part 1). Veterinary Medicine & Sci. mayo de 2020;6(2):209-17.
47. Martin‐Flores M, Lorenzutti AM. Local Anesthetic Pharmacology. En: Read M, Campoy L, Fischer B, editores. Small Animal Regional Anesthesia and Analgesia [Internet]. 1.a ed. Wiley; 2024 [citado 17 de junio de 2024]. p. 35-44. Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/9781119514183.ch4
48. Heo MH, Cho MJ, Lee SI, Kim KW. Dexmedetomidine as an effective alternative tool for heart rate control in atrial fibrillation during general anesthesia—A case report. Saudi Journal of Anaesthesia. 2024;18(2):299-301.
49. Turan A, Duncan A, Leung S, Karimi N, Fang J, Mao G, etal. Dexmedetomidine for reduction of atrial fibrillation and delirium after cardiac surgery (DECADE): a randomised placebo-controlled trial. The Lancet. julio de 2020;396(10245):177-85.
50. Zhu Z, Zhou H, Ni Y, Wu C, Zhang C, Ling X. Can dexmedetomidine reduce atrial fibrillation after cardiac surgery? A systematic review and meta-analysis. DDDT. marzo de 2018;Volume 12:521-31.
 by Multimédica
by Multimédica
