Neumotórax a tensión y colocación de un catéter epidural torácico para una esternotomía en un perro
Resumen breve
Un neumotórax a tensión es un acúmulo severo de aire en el espacio pleural que es capaz de reducir el gasto cardiaco del paciente pudiendo ocasionar un colapso cardiovascular y su muerte si no es drenado a tiempo.El dolor perioperatorio en esternotomías puede ser difícil de manejar. El uso de catéteres epidurales permite la administración repetida o constante de anestésicos locales y/o analgésicos a la médula espinal para aportar analgesia durante y después de procedimientos quirúrgicos,…Índice de contenidos
Introducción
Un neumotórax a tensión es un acúmulo severo de aire en el espacio pleural que es capaz de reducir el gasto cardiaco del paciente pudiendo ocasionar un colapso cardiovascular y su muerte si no es drenado a tiempo.
El dolor perioperatorio en esternotomías puede ser difícil de manejar. El uso de catéteres epidurales permite la administración repetida o constante de anestésicos locales y/o analgésicos a la médula espinal para aportar analgesia durante y después de procedimientos quirúrgicos, así como para procesos dolorosos no quirúrgicos1. Estos catéteres son normalmente introducidos en el espacio lumbosacro y luego avanzados1 cranealmente pero también se ha descrito su uso en veterinaria a nivel torácico para aportar analgesia en el perioperatorio de toracotomías con mínimas complicaciones2,3.
Este caso clínico pretende describir los cambios cardiopulmonares secundarios a un neumotórax a tensión, así como su manejo anestésico. Además, se detalla el uso de un catéter epidural torácico para el manejo analgésico perioperatorio en un perro al que se le realizó una esternotomía media exploratoria para el tratamiento de un neumotórax cerrado.
Caso clínico
Se refiere al hospital un caniche gigante de 8 años y 2 meses de edad, con un peso de 28,2 Kg y una condición corporal de 5/9 (http://www.wsava.org/nutrition-toolkit) para el diagnóstico y tratamiento de un neumotórax agudo espontáneo. El perro comenzó con taquipnea y disnea severa de 48 h de evolución requiriendo 3 toracentesis en las 12 h antes de ser remitido. En el momento de admisión todos los parámetros cardiorrespiratorios se encontraban dentro de la normalidad con una frecuencia respiratoria (FR) de 32 respiraciones por minuto (rpm) y un patrón respiratorio normal.
Se colocaron bilateralmente drenajes torácicos bajo anestesia general tras la confirmación de la presencia de un neumotórax moderado bilateral mediante ecografía torácica (TFAST) que se conectaron de forma estéril a un sistema de drenaje digital ininterrumpido (Thopaz, Medela Italia SRL).
A la mañana siguiente se identificó mediante tomografía computarizada (TC) una bulla en el borde craneal del lóbulo pulmonar craneal derecho y varias burbujas de gas entre el lóbulo caudal izquierdo y el mediastino. Debido a los hallazgos de la TC, se programó para el día siguiente una esternotomía exploratoria para la resolución del neumotórax, por lo que se restringió el acceso a comida, pero no a agua 12 horas antes de la intervención.
La mañana de la cirugía el perro se encontraba alerta y responsivo, la frecuencia cardiaca (FC) era de 81 latidos por minuto (lpm) y el pulso dorsopedal fuerte y sincrónico. Las membranas mucosas estaban rosadas y húmedas con un tiempo de relleno capilar menor de 2 segundos. La FR era de 32 rpm mostrando un patrón respiratorio eupneico. Los resultados de la gasometría venosa no mostraron ninguna alteración y el paciente se clasificó como ASA (American Society of Anesthesiologist status) III.
Como premedicación, se administró metadona (0,2 mg/kg intravenoso (IV); Confortan, Dechra) y dexmedetomidina (1,5 μg/kg IV; Dexdomitor; Orion Pharma). Tras la preoxigenación del paciente mediante la aplicación de flujo directo de oxígeno al 100% durante 5 minutos, se procedió a la inducción anestésica con propofol dosis-efecto (dosis final: 2,4 mg/kg IV). El paciente fue intubado con un tubo de 12 mm de diámetro interno con balón de neumotamponamiento y conectado a un circuito circular con cal sodada para comenzar la administración de oxígeno 100% con un flujo de gas fresco de 35 ml/kg/min dejando al paciente que ventilara de forma espontánea. Una combinación de propofol (0,3 mg/kg/min) y dexmedetomidina (0,5 μg/kg/h) fue empleado como mantenimiento anestésico. La fluidoterapia de soporte consistió en una solución cristaloide de Hartmann’s a un ritmo de infusión de 10 ml/kg/h durante la realización de la epidural y de 5 ml/kg/h durante el resto del procedimiento. Se monitorizó (T5 BeneView; Mindray) el electrocardiograma (ECG), pulsioximetría (spO2), capnografía y presiones arteriales mediante oscilometría durante el periodo de preparación del campo quirúrgico e instrumentalización.
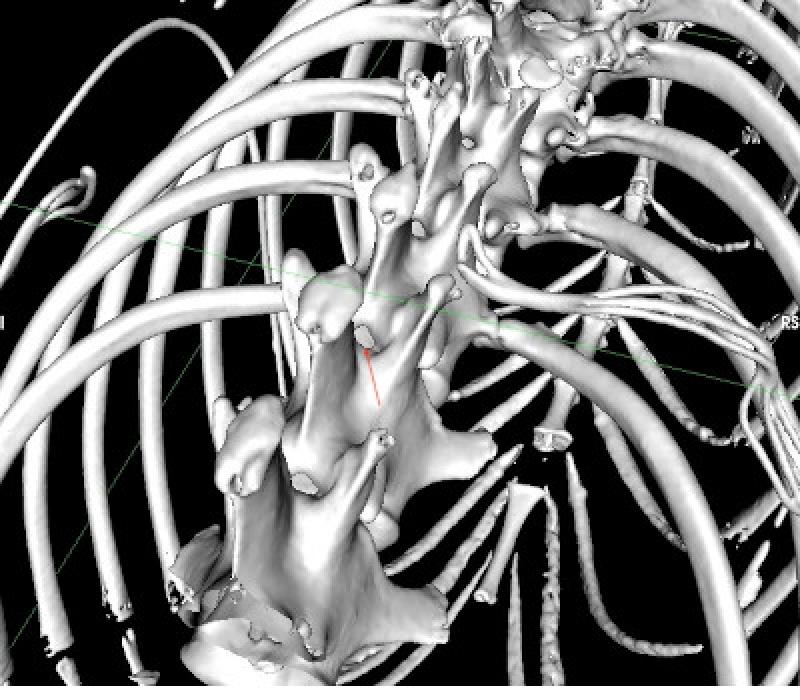
Con el perro en decúbito esternal y su extremidades posteriores extendidas cranealmente se colocó un catéter epidural (Perifix One Paed Set 20; B.Braun) entre la última vértebra torácica (T13) y la primera lumbar (L1) utilizando el abordaje paramedial descrito por Franci y col. 2012. Se comprobó la ausencia de sangre o líquido cefalorraquídeo en la aguja y se confirmó su posición en el espacio epidural mediante la técnica de pérdida de resistencia con solución salina4. El catéter se avanzó 10 cm alcanzando T11.
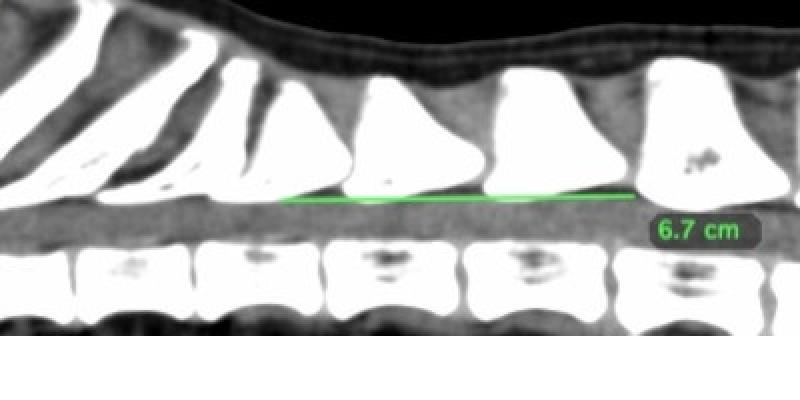
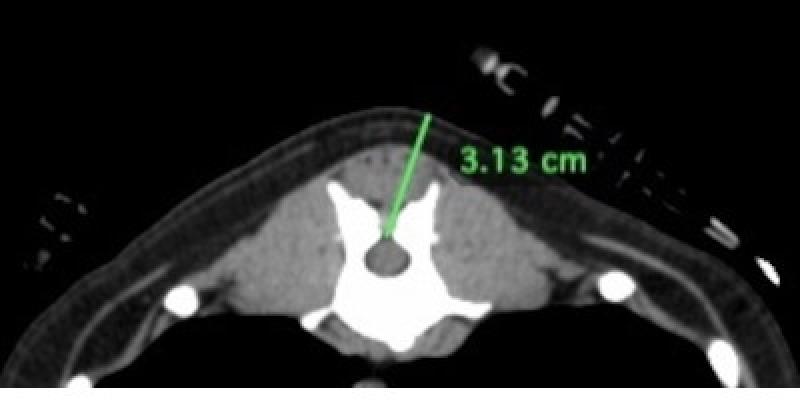
La distancia que se avanzó el catéter epidural dentro el espacio epidural se estimó mediante el análisis de las imágenes del TC (Figura 1 y 2) así como se valoró si el espacio intervertebral toracolumbar era suficientemente amplio como para permitir la introducción de una aguja Tuohy de 20 G (Figura 3). No se realizó epidurografía para confirmar la posición del catéter y se administró una combinación de 5 μg/kg de buprenorfina libre de preservativos (Buprevet 0,3 mg/ml, Virbac) y 2.5 ml de levobupivacaína 0,5% (Chirocaine, AbbVie). Un catéter de 20G (introcan, B Braun) fue colocado en la arterial dorsopedal izquierda y un catéter intravenoso adicional 18G (introcan, B Braun) fue colocado en la vena safena izquierda para la administración de fármacos en caso de emergencia.
Durante la instrumentalización la FC se mantuvo entre 68-80 lpm, la presión arterial media (PAM) entre 68 y 100 mmHg, la fracción espirada de oxígeno (FeCO2) entre 40-50 mmHg y la spO2 en 97% con una FR de 20 rpm. En el momento del trasladado a quirófano, el paciente desarrolló una apnea con una frecuencia de pulso de 22 pulsaciones por minuto (ppm) por lo que se interrumpió la administración de propofol y dexmedetomidina, se administró atropina (20 μg/Kg IV; Atropine Sulfate, Martindale Pharma), se comenzaron a realizar compresiones torácicas, se inició ventilación mecánica controlada por presión (Presión pico 10 cmH2O, FR 20 rpm) con oxígeno al 100% (Fracción inspirada de oxígeno (FiO2) 0,87) y se monitorizó spO2, ECG, presión arterial no invasiva, capnografía (Beneview T5; Mindray) y espirometría (Wato EX65; Mindray, UK). Un minuto después, la FC era de 120 latidos por minuto, pero la FeCO2 era de 32 mmHg y la spO2 estaba a 90%. En este momento se detectó que el sistema de drenaje digital ininterrumpido no estaba funcionando por lo que se inició el drenaje manual del tórax mientras que se realizaba una gasometría arterial que reveló una acidosis respiratoria severa (pH 7,063, presión arterial de CO2 (PaCO2) 72,9 mmHg, presión arterial de oxígeno (PaO2) 106,6 mmHg, bicarbonato (HCO3-) 20,8 mmol/L, saturación arterial de oxígeno (SaO2) 94,8%).
El drenaje torácico se completó al reconectar el sistema de drenaje ininterrumpido digital comprobando que funcionaba correctamente de nuevo. Estabilizado el paciente con una FeCO2 de 46 mmHg y un spO2 del 96%, se reinició la infusión de propofol y dexmedetomidina y se comenzó a monitorizar presiones arteriales invasivas, el índice cardiaco (IC= gasto cardiaco (GC)/superficie corporal) y la variación de presión de pulso utilizando un método que analiza la morfología de la onda de presión arterial (MostCare UP, Vygon, UK). Antes de iniciar la cirugía, el paciente presentaba 107 lpm, 45 mmHg de FeCO2, spO2 de 95%, un volumen corriente (VC) de 256 ml con una presión pico de 10 cmH2O, un CI de 4,4 l/min/m2 y PAM de 73 mmHg respectivamente.
Cuando la cavidad pleural se encontraba abierta se realizó un reclutamiento alveolar escalonado como describen Canfrán y colaboradores (2012), se redujo la FiO2 a 0,72 manteniéndose una adecuada spO2 y se cambio el modo ventilatorio a ventilación controlada por volumen con un VC de 340 ml, alcanzándose una presión pico de 12-15 cmH20 y peep de 5 cmH20 siendo ajustada la FR para mantener normocapnia. En la exploración de la cavidad torácica se encontró la rotura de una bulla pulmonar situada en el borde del lóbulo craneal derecho como única causa del neumotórax no detectándose ninguna alteración en el resto del parénquima pulmonar por lo que se procedió a la realización de una lobectomía parcial. Los parámetros cardiorrespiratorios se mantuvieron estables durante todo el procedimiento quirúrgico manifestando sólo un descenso del IC con valores de entre 2,1-3,3 l/min/m2 acompañado por un descenso del FeCO2 a 34 mmHg durante la manipulación de las vísceras torácicas.
El CI volvió a 4,1 l/min/m2 al cesar la manipulación quirúrgica. Al inicio del cierre de la cavidad torácica se detectó un descenso de la spO2 pudiéndose visualizar en la cavidad torácica unos pulmones no suficientemente insuflados. Por este motivo se realizó un reclutamiento alveolar escalonado de la misma forma que se realizó al principio de la cirugía e inmediatamente después se realizó una gasometría arterial (FiO2 0,72, EtCO2 33 mmHg, pH 7,12, PaCO2 72 mmHg, paO2 372 mmHg, SaO2 99,9%), estos resultados se consideraron secundarios al efecto cardiovascular del reclutamiento alveolar realizado inmediatamente antes de la toma de la muestra. Al cerrar la cavidad torácica se realizó el drenaje de tórax y la dosis de propofol infundida fue disminuida gradualmente hasta ser interrumpida junto con la infusión de dexmedetomidina al finalizar el procedimiento quirúrgico. Cuando el paciente inicio la ventilación espontánea con una FeCO2 de 55 mmHg y una spO2 del 100% (FiO2 0,7), se vació la vejiga de la orina y se drenó de nuevo el tórax en decúbito esternal. Los tiempos anestésico y quirúrgicos totales fueron 150 y 60 minutos respectivamente. A pesar de haber usado una manta eléctrica (Hot Dog, Augustine Temperature Management), la temperatura esofágica al final de la cirugía fue de 35,9°C por lo que el perro fue calentado activamente mediante un sistema de aire forzado durante la recuperación anestésica (Bair Hugger System, 3M).
En el posoperatorio, se monitorizó la FR y el patrón respiratorio cada hora, la FC cada 2h y la temperatura cada 8h. Tras la extubación y respirando aire ambiental (FIO2 0,21) la spO2 descendió a 92%, se descartó la presencia de un neumotórax al detectar presión negativa en los drenajes torácicos por lo que se suplementó el oxígeno mediante gafas nasales a un flujo de 2L/min (FIO2 aproximada 0,4) normalizándose la saturación a 99%. Tras 1h, cuando el paciente estaba completamente recuperado de la anestesia y respirando aire ambiental (FiO2 0,21) la spO2 era 100% con un patrón respiratorio normal por lo que no se consideró necesario la realización de una gasometría arterial y se interrumpió la suplementación de oxígeno. En este momento, el tórax fue drenado de nuevo, no detectándose el acúmulo de aire y se pautó el uso de los drenajes torácicos sólo si se detectaba un aumento de la FR o un cambio en el patrón respiratorio. La fluidoterapia se mantuvo a 2 ml/kg/h durante 48h.
Se monitorizó cada dos horas la analgesia mediante una escala de dolor validada en perros (Glasgow Composite Pain Scale-Short Form5) y como tratamiento analgésico, se continuó la administración de paracetamol (10 mg/kg/12h IV las primeras 12h y después per os (PO)), se inició el tratamiento con carprofeno (2 mg/kg/12h PO) 24h después de la cirugía cuando se comprobó que permanecía cardiovascularmente estable y se administró 2,5 ml de levobupivacaína 0,15% cada 6 horas durante las primeras 24h cuando se detectó una gran resistencia que impedía la administración de fluidos a través del catéter epidural por lo que fue retirado. A pesar de que el catéter no se pudo utilizar en las 24h siguientes, no fue necesaria la administración adicional de otros analgésicos ya que la escala del dolor Glasgow se mantuvo 0-3/24 y el perro presentó un buen apetito y estado de ánimo en el posoperatorio inmediato. Los drenajes torácicos se retiraron 24 horas tras la cirugía y el paciente fue dado de alta 24h después no presentando ninguna complicación durante el posoperatorio.
Discusión
Este caso clínico documenta el manejo anestésico de un perro que desarrolló un colapso cardiorrespiratorio secundario a un neumotórax a tensión. Los neumotórax a tensión generalmente se producen cuando el gas alveolar entra en la cavidad pleural a través de un defecto de la pleura visceral que actúa como una válvula unidireccional que no permite que salga el aire de la cavidad6. Esto ocasiona un aumento progresivo de la presión pleural que comprime los pulmones reduciendo el volumen corriente del paciente hasta ocasionar el colapso pulmonar completo en pacientes en ventilación espontánea. Esto ocasiona una rápida y severa hipoxia hipoxémica y como consecuencia una parada cardiorrespiratoria7. También, a medida que aumenta la presión intrapleural se comprime el pulmón contralateral por desplazamiento del mediastino, comprimiéndose el corazón derecho y ocasionando un shock cardiogénico por taponamiento cardiaco7.
El empleo de ventilación mecánica a presión positiva incrementa la presión de la vía aérea pudiendo empeorar el neumotórax, reduciendo el retorno venoso y empeorando el gasto cardiaco8. Pero a su vez, cerdos a los que se les indujo un neumotórax a tensión y que recibieron ventilación controlada por volumen mantuvieron mejor la saturación arterial de oxígeno7. Por lo que generalmente el colapso cardiorrespiratorio en presencia de neumotórax a tensión se ocasiona principalmente por hipoxemia en animales que se encuentra en ventilación espontánea y por un shock cardiogénico en animales a los que se mantiene el volumen corriente mediante ventilación mecánica7. En este caso, el paciente se mantuvo en ventilación espontánea durante el periodo de instrumentalización para evitar un empeoramiento del neumotórax, pero cuando se produjo el colapso cardiorrespiratorio se inició ventilación controlada por presión permitiendo mediante compresiones torácicas y la administración de atropina el restablecimiento de la circulación espontánea.
Probablemente, el uso de ventilación controlada por volumen hubiera mantenido mejor la oxigenación arterial que una ventilación controlada por presión y puede que con ello reducir/prevenir el desarrollo del colapso cardiovascular por hipoxemia. Aunque a su vez, una ventilación controlada por volumen podría haber producido un aumento de la presión intrapleural y con ello promover el desarrollo de un shock cardiogénico por compresión cardiaca, ya que hasta que no se restableció la función cardiovascular no se inició el drenaje pleural que redujo la presión pleural y con ello la compresión cardiaca.
En este caso, si el sistema de drenaje hubiera permanecido encendido en el periodo preoperatorio muy probablemente no se hubiera producido este desequilibrio cardiorrespiratorio. Por este motivo se hace imprescindible en estos pacientes la utilización de drenajes torácicos, la comprobación de su correcto funcionamiento, el mantenimiento de una monitorización continua que permita detectar cualquier signo que indique la presencia de un neumotórax a tensión y un correcto entrenamiento y equipamiento para la realización de una maniobra de resucitación cardiopulmonar.
Cuando el paciente presentaba el neumotórax a tensión, el elevado gradiente de PAO2-PaO2 pudo ser debido a un desequilibrio de ventilación/perfusión (V/Q) producido por compresión alveolar y por tanto el desarrollo de shunt pulmonar (alvéolos perfundidos pero no ventilados) pero también por una mala perfusión pulmonar debida a un bajo gasto cardiaco ocasionando espacio muerto alveolar (alvéolos ventilados pero no perfundidos). El elevado gradiente PaCO2-FeCO2 fue secundario a la presencia de espacio muerto alveolar que impidió el intercambio alvéolo-capilar de CO2, no eliminándose el CO2 y por tanto incrementado el PaCO29. Por este motivo, cuando la presión intrapleural descendió tras la apertura de la cavidad torácica y el paciente se presentaba estable cardiovascularmente se realizó una maniobra de reclutamiento alveolar reduciendo la atelectasia pulmonar y mejorando la ventilación que aceleró la eliminación de CO2 y la oxigenación del paciente. Al final de la cirugía, con la cavidad torácica abierta, se repitió la maniobra de reclutamiento alveolar ya que se detectó visualmente la presencia de atelectasia pulmonar y se produjo un descenso de la spO2.
La maniobra de reclutamiento alveolar seguida del uso de PEEP mejora la oxigenación arterial10 pero también deteriora la función cardiovascular durante la aplicación de presiones intrapulmonares relativamente altas11 lo que ocasiona la presencia de un desequilibrio de V/Q por la presencia de espacio muerto alveolar. Esto explica el elevado gradiente PaCO2-FeCO2 que se identificó en la ultima gasometría, que se realizó inmediatamente tras la maniobra de reclutamiento alveolar. Este deterioro de la función cardiovascular es transitorio11 por lo que no se consideró necesario repetir la gasometría arterial pero también, la realización de esta gasometría arterial hubiera tenido un mayor valor clínico para el posoperatorio si se hubiera realizado tiempo después de la maniobra de reclutamiento evitando sus efectos inmediatos cardiovasculares.
Siendo descartada la presencia de un neumotórax y teniendo en cuenta que no se detectó ninguna alteración en el parénquima pulmonar en la TC ni durante la exploración quirúrgica la reducción de spO2 del paciente durante la recuperación anestésica pudo ser producida por presencia de atelectasia pulmonar y por hipoventilación secundaria a la administración de propofol/dexmedetomidina12,13 que puede durar varios minutos después del final de la anestesia13. Esta hipoventilación ocasiona un incremento de la presión alveolar de CO2, por lo que, aplicando la ecuación de gases alveolares, se reduce la PAO2 y por tanto hipoxemia. Al tener un parénquima pulmonar sano sin problemas de difusión alvéolo-capilar, la suplementación de oxígeno, incrementó la FiO2 y con ello la PAO2 y la PaO2 mientras el paciente presentaba hipoventilación.
En perros, la parte ventral de la pared torácica incluyendo el esternón se encuentra inervada por la parte distal de los nervios intercostales T2-T914,15. Tradicionalmente el bloqueo bilateral de los nervios intercostales de T2 a T9 ha sido empleados para aportar analgesia somática para la realización de estereotomías en perros14, habiéndose descrito recientemente en cadáveres otros bloqueos ecoguiados que podrían ser efectivos para aportar analgesia en esternotomías14,15. El uso de catéteres epidurales tiene como ventaja que además de aportar analgesia intraoperatoria, esta analgesia se puede extender en el posoperatorio en cirugías torácicas2,3. La inserción de catéteres epidurales en el espacio lumbosacro y su avance craneal ha sido descrita en cirugías torácicas en perros16.
Este estudio no describe ninguna complicación relativa a tal avance de catéteres en el espacio epidural, aunque la inserción de una distancia excesiva del catéter en el espacio epidural puede promover complicaciones como bucles, nudos, la salida del catéter fuera del canal vertebral o punción dural o venosa17. Por lo que la inserción de catéteres epidurales en el espacio toracolumbar para aportar analgesia en cirugías torácicas evitaría estas complicaciones. Sin embargo, las inyecciones peridurales en el espacio toracolumbar tienen un mayor riesgo potencial de dañar la médula espinal2. El empleo de agujas tuohy reduce el riesgo de punción dural pero es esencial experiencia en la realización de esta técnica así como una inserción cuidadosa de la aguja y comprobar su posición en el espacio epidural no detectando la presencia de sangre o líquido cefalorraquídeo antes de la inserción del catéter o la administración de algún fármaco.
A pesar de que la región de T12-L2 de la columna vertebral es más móvil permitiendo una mayor apertura del espacio intervertebral durante su flexión2, por experiencia de la autora, algunos perros presentan un espacio intervertebral menor impidiendo la realización de esta técnica loco-regional por lo que el análisis de las imágenes tomadas por TC ayuda a decidir si esta técnica analgésica es posible en el paciente.
El uso de las imágenes de TC es útil para el cálculo de la distancia que se debe avanzar el catéter pero se tiene que tener en cuenta que es subjetivo y se debe de usar sólo como una guía, ya que el lugar y la angulación de inserción de la aguja y el catéter en el tejido inmediatamente dorsolateral al espacio epidural y la posición del catéter dentro del espacio epidural puede variar en el momento de la aplicación de esta técnica haciendo la epidurografía la mejor alternativa para comprobar su correcta colocación en el momento de su realización.
El uso de concentraciones bajas de anestésicos locales puede aportar bloqueo sensorial evitando producir un bloqueo motor18, este bloqueo selectivo puede ser debido a que las fibras motoras Aα están más mielinizadas y por tanto tienen un diámetro mayor que las fibras sensitivas Aδ y C19. Además, el uso de concentraciones bajas reduce el riesgo de alcanzar dosis acumulativas tóxicas de anestésicos locales y sus efectos adversos como alteraciones neurológicas recientemente descritas en veterinaria20.
La complicación más frecuente en veterinaria es el desplazamiento del catéter epidural durante el posoperatorio16 pudiendo no ser completa la cobertura analgesia, en este caso afortunadamente no se necesitó analgesia adicional de rescate tras la retirada del catéter epidural por esta complicación.
Anestesiar pacientes con neumotórax puede llegar a ser complicado ya que pueden desarrollar un neumotórax a tensión y como consecuencia severas alteraciones cardiorrespiratorias. El empleo de forma adecuada de drenajes torácicos en el perioperatorio es esencial como método de prevención. Hay varias opciones de manejo analgésico en esternotomías siendo el uso de catéteres epidurales torácicos una buena opción por permitir extender su efecto analgésico en el posoperatorio, pero es necesaria experiencia en su colocación.
Bibliografía
- Hansen BD: epidural catheter analgesia in dogs and cats: technique and review of 182 cases (1991 - 1999). J Vet Emerg Crit Care 2001;11:95–103.
- Franci P, Leece EA, Corletto F. Thoracic epidural catheter placement using a paramedian approach with cephalad angulation in three dogs. Vet Surg. 2012;41(7):884-9.
- Corona D, Lorenzo N. Segmental thoracic epidural anaesthesia in a dog undergoing intercostal thoracotomy and lung lobectomy. Vet Rec Case Rep. 2018; 6.3: e000598.
- Iseri T, Nishimura R, Nagahama S, Mochizuki M, Nakagawa T, Fujimoto Y, et al. Epidural spread of iohexol following the use of air or saline in the ‘loss of resistance’ test. Vet Anaesth Analg. 2010;37(6):526–30.
- Reid J, Nolan AM, Hughes JML, Lascelles D, Pawson P, Scott EM. Development of the short-form Glasgow Composite Measure Pain Scale (CMPS-SF) and derivation of an analgesic intervention score. Animal Welfare 2007;16(S): 97-104.
- Giordano P, Kirby BM, Bennett RC, Bernard F. Tension pneumothorax secondary to nasojejunal feeding tube misplacement in a mechanically ventilated dog. Aust Vet J. 2014 Oct;92(10):400-4.
- Nelson D, Porta C, Satterly S, Blair K, Johnson E, Inaba K, Martin M. Physiology and cardiovascular effect of severe tension pneumothorax in a porcine model. J Surg Res. 2013 Sep;184(1):450-7.
- Slinger PD, JH Campos. Anesthesia for thoracic surgery. In: Miller RD, Cohen NH, Eriksson LI et al. editors. Miller's anesthesia, 8th ed. Canada Elsevier Saunders; 2015 pp.1823-1831.
- Fletcher, R., and B. Jonson. "Deadspace and the single breath test for carbon dioxide during anaesthesia and artificial ventilation: effects of tidal volume and frequency of respiration." British journal of anaesthesia 56.2 (1984): 109-119.
- Canfrán S, Gómez de Segura IA, Cediel R, García-Fernández J. Effects of a stepwise lung recruitment manoeuvre and positive end-expiratory pressure on lung compliance and arterial blood oxygenation in healthy dogs. Vet J. 2012;194(1):89-93.
- Canfrán S, Gómez de Segura IA, Cediel R, García-Fernández J. Effects of fluid load on cardiovascular function during stepwise lung recruitment manoeuvre in healthy dogs. Vet J. 2013 Sep;197(3):800-5.
- Suarez MA, Dzikiti BT, Stegmann FG, Hartman M. Comparison of alfaxalone and propofol administered as total intravenous anaesthesia for ovariohysterectomy in dogs. Vet Anaesth Analg. 2012 May;39(3):236-44.
- Kuusela E, Vainio O, Short CE, Leppäluoto J, Huttunen P, Ström S, Huju V, Valtonen A, Raekallio M. A comparison of propofol infusion and propofol/isoflurane anaesthesia in dexmedetomidine premedicated dogs. J Vet Pharmacol Ther. 2003 Jun;26(3):199-204.
- Alaman M, González-Marrón A, Lorente C, Bonastre C, Laborda A. Description of an Ultrasound-Guided Transverse Approach to the Transversus Thoracis Plane Block and Evaluation of Injectate Spread in Canine Cadavers. Animals (Basel). 2021 Sep 10;11(9):2657.
- Zublena F, Briganti A, De Gennaro C, Corletto F. Ultrasound-guided parasternal injection in dogs: a cadaver study. Vet Anaesth Analg. 2021 Jul;48(4):563-569.
- Swalander DB, Crowe DT Jr, Hittenmiller DH, Jahn PJ. Complications associated with the use of indwelling epidural catheters in dogs: 81 cases (1996-1999). J Am Vet Med Assoc. 2000 Feb 1;216(3):368-70.
- Armitage EN. Lumbar and thoracic epidural anesthesia, in Wildsmith JAW, Armitage EN (eds): Principles and practice of regional anesthesia. Edinburgh, Churchill Livingstone, 1990;81–102.
- Lacassie HJ, Habib AS, Lacassie HP, Columb MO. Motor blocking minimum local anesthetic concentrations of bupivacaine, levobpivacaine, and ropivacaine in labor. Reg Anesth Pain Med (2007) 32:323–9.
- Ford DJ, Raj PP, Singh P, Regan KM, Ohlweiler D. Differential peripheral nerve block by local anesthetics in the cat. Anesthesiology (1984) 60:28–33.
- Quesada, N., Pelligand, L., Doig, M., & Sanchis‐Mora, S. (2021). Suspected local anaesthetic systemic toxicity (LAST) after several bupivacaine injections through an epidural catheter in a cat. Veterinary Record Case Reports, 9(4), e197.
 by Multimédica
by Multimédica