Protocolo de anestesia y analgesia para un Anas platyrhynchos (Ánade real) por una fractura de fémur: Caso clínico
Resumen breve
En este caso se optó por una premedicación intramuscular, una inducción intravenosa y un mantenimiento inhalatorio como se explicará más adelante, siendo clave el manejo de sus particularidades más que los fármacos utilizados en el procedimiento. El manejo quirúrgico también presentaba complicaciones añadidas por tratarse de una fractura antigua y en una zona muy compleja.Índice de contenidos
Resumen
En este caso se optó por una premedicación intramuscular, una inducción intravenosa y un mantenimiento inhalatorio como se explicará más adelante, siendo clave el manejo de sus particularidades más que los fármacos utilizados en el procedimiento. El manejo quirúrgico también presentaba complicaciones añadidas por tratarse de una fractura antigua y en una zona muy compleja.
Introducción
Las fracturas en las aves suelen ser accidentes bastante frecuentes en el día a día. Problemas con las anillas, ataques de aves más grandes o de otras mascotas, animales posados sobre puertas que se cierran, fracturas casi espontáneas por hipocalcemias severas, enganchones con los barrotes de las jaulas, choques contra superficies, etc. Cierto es que un gran porcentaje de ellas se observan a la altura del tibio-tarso, pero también en las alas, las falanges, el coracoides, o como en este caso, en la porción proximal del fémur, más difícil de abordar y de fijar quirúrgicamente.
Las aves son animales muy drásticos para todo, tienen una tasa metabólica muy elevada, un rápido agotamiento de las reservas energéticas y una escasa capacidad de expresar el dolor (por su carácter de “presa” en la naturaleza). Se debe prestar especial atención a los 5 puntos críticos que pueden comprometer la vida del animal: shock, hipotermia, hipoglucemia, hipoxemia e hipotensión.
En el caso de las anátidas, además, la condición corporal influye mucho en la mortalidad anestésica y son aves con mucha variabilidad en función del momento de su ciclo de vida. Los patos domésticos tienden a la obesidad, lo que reduce el volumen tidal por compresión de los sacos aéreos, se produce hipercapnia, hipoxemia, acidosis respiratoria y la posible muerte del animal. En aves, al principio de la migración, también es frecuente los acúmulos de grasa intracelómica, con el mismo resultado, mientras que en aves en periodo de incubación o en aves al final de la migración ocurre lo contrario, pueden aparecer deshidratadas y con baja condición corporal, predisponiendo a hipoglucemias e hipotermias.
Caso clínico
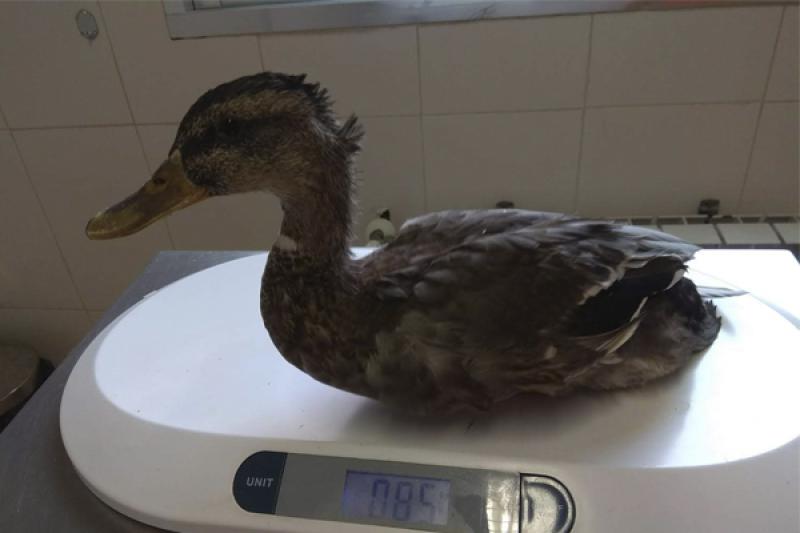
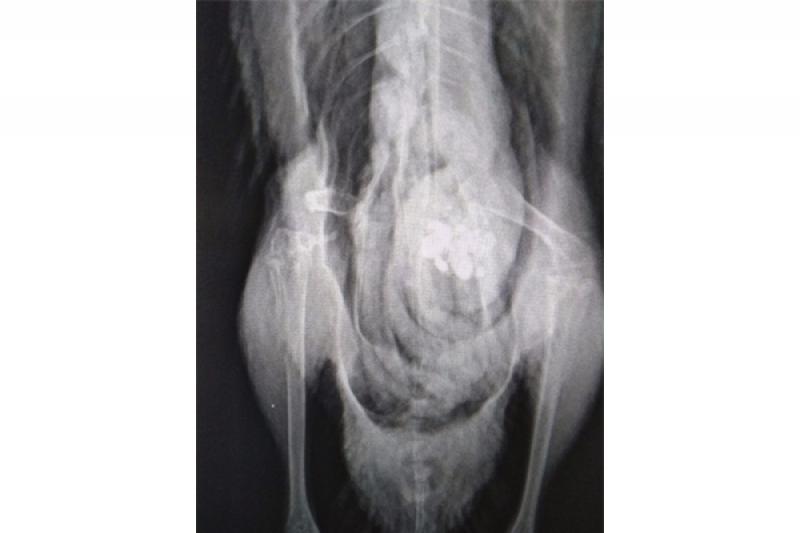
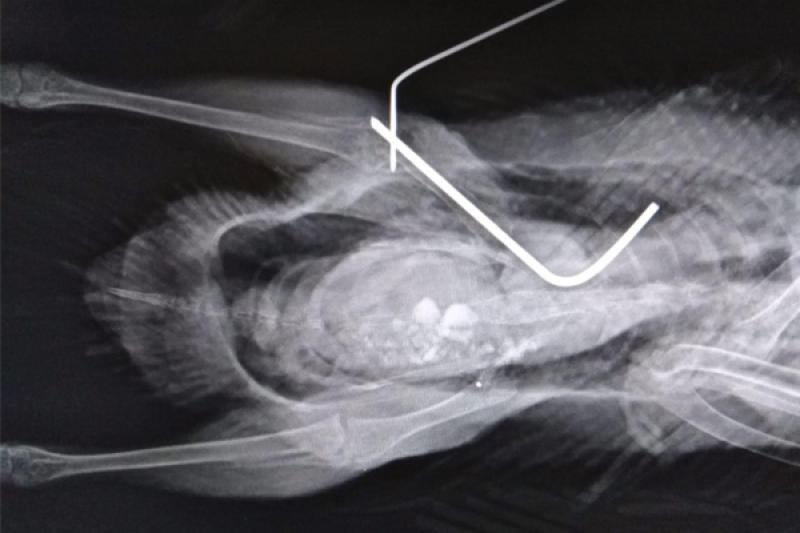
El paciente es una hembra de ánade real de 850 gramos rescatada por un centro de recogida de animales, de la cual no se conoce la edad ni historia previa, que presenta una fractura diafisaria proximal del fémur derecho, sin ningún tratamiento previo desde hace dos meses que se conoce la fractura. Se aportan radiografías de mala calidad (Figura 2) porque se realizaron con el animal despierto y el nivel de contractura de la extremidad era muy elevado. El pronóstico era reservado debido a la antigüedad de la lesión, pero se optó por intentar mejorar la calidad de vida del animal.
Protocolo de anestesia y analgesia
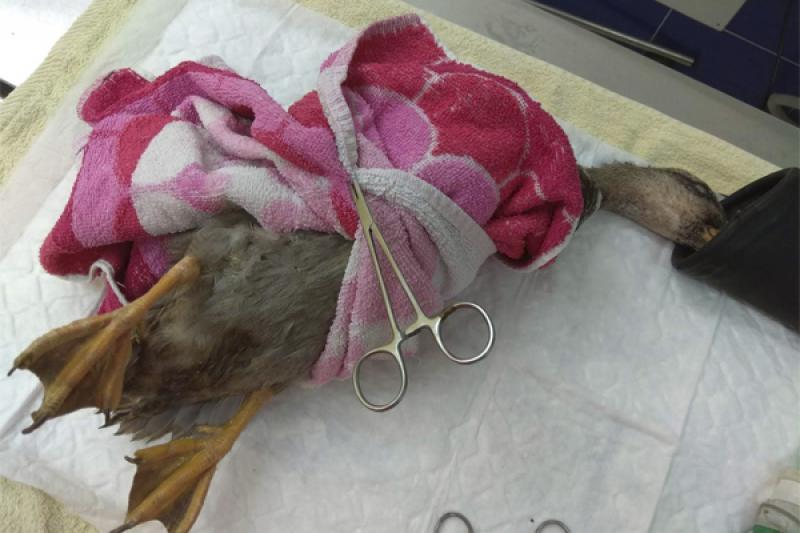
Hay muchas formas de anestesiar un ave, en función de la especie, el tipo de procedimiento y el estado en el que se encuentre. En este caso se trata de un pato, un ave de difícil manejo por ser un animal grande y fuerte, que golpea con las alas cuando intenta huir, algunos son agresivos y atacan, por lo que se hace necesaria su inmovilización física mediante toallas, por ejemplo, rodeando el cuerpo para inmovilizar las alas y en algunos casos cubriendo también los ojos. Se administró midazolam a 1,5 mg/Kg junto con butorfanol a 1 mg/Kg de forma intramuscular en los pectorales, paramedial a la quilla (Figura 3), y se inmovilizó con una toalla y un mosquito mientras se esperó a que le hiciera efecto (Figura 4).

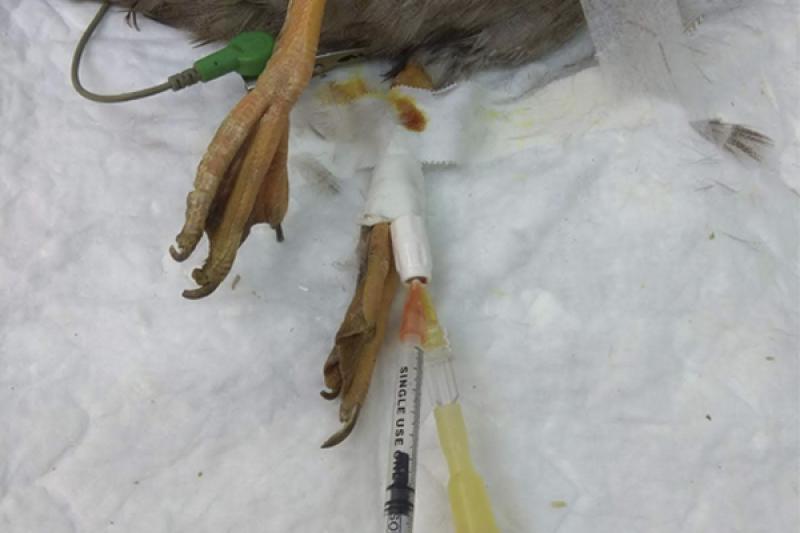
Una vez sedado se procedió a cateterizar un acceso venoso, en la vena metatarsal medial, para la administración de los inductores y de fluidoterapia de mantenimiento (Figura 5). Se administró suero glucosado al 5 % a un ritmo de 7 ml/Kg/hora, para prevenir en la medida de lo posible la aparición de hipoglucemia e hipotensión. Durante este procedimiento se preoxigena al animal, pero se debe tener en cuenta el tipo de mascarilla que se va a utilizar. Estas aves presentan el llamado “reflejo de buceo”, en el que se produce apnea y bradicardia debido a la estimulación del nervio trigémino con la mascarilla a la altura del pico y las narinas, por esa razón, y porque son animales semi-acuáticos que aguantan muy bien la respiración, no se puede intentar inducirlos mediante agentes inhalatorios directamente, se va a necesitar una inducción intravenosa para su intubación, al contrario que en la gran mayoría de las aves. En este caso se utilizó una mascarilla de látex en forma de embudo para su preoxigenación.
Como ya se ha comentado, son de las pocas aves que requieren una inducción intravenosa, se administra al paciente propofol intravenoso lento a bolos de 1 mg/Kg junto con medetomidina a un máximo de 20 mcg/Kg diluida también de forma intravenosa lenta, ambos hasta alcanzar un efecto de relajación suficiente para realizar la intubación. En este caso se requieren 2 mg/Kg de propofol y 10 mcg/Kg de medetomidina. La intubación en estas especies es bastante sencilla gracias a que tienen la glotis en la base de la lengua y carecen de epiglotis (Figura 6).
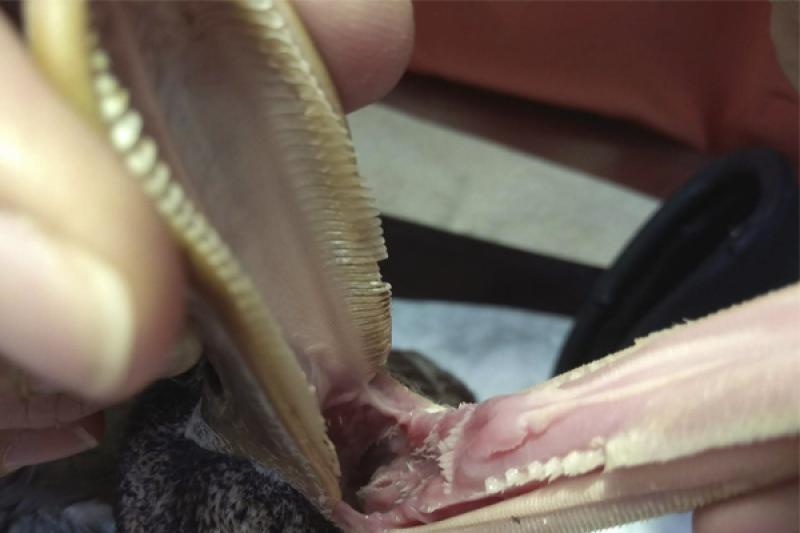
La tráquea es muy larga, con mucho espacio muerto, pero proporcionalmente ancha, por lo que compensa con la baja resistencia al paso del aire. Sus anillos son completos y presentan bastantes particularidades anatómicas entre las distintas especies y en el caso de los patos machos, al final de la tráquea se forman unas bullas cartilaginosas que tienen que ver con la fonación. Se intuba con un tubo del 3,5 sin cuff, traccionando ligeramente la lengua con un laringoscopio para facilitar el proceso, se fija el tubo con esparadrapo, se conecta al capnógrafo y al circuito anestésico, en este caso una T de Ayre. Se utiliza un flujo bastante alto en proporción, a un litro por minuto de oxígeno 100 % y se enciende el vaporizador de isoflurano al 2 %. Se realiza ventilación asistida intermitente de forma manual para evitar la hipoventilación durante la cirugía.
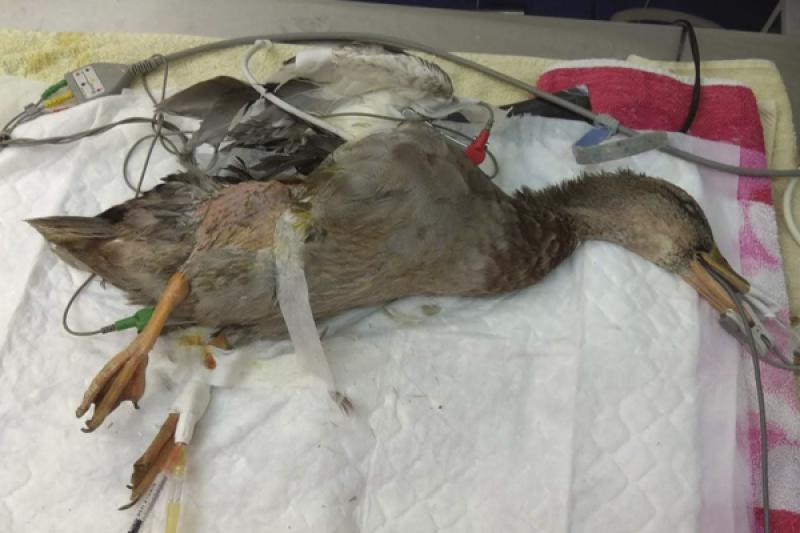
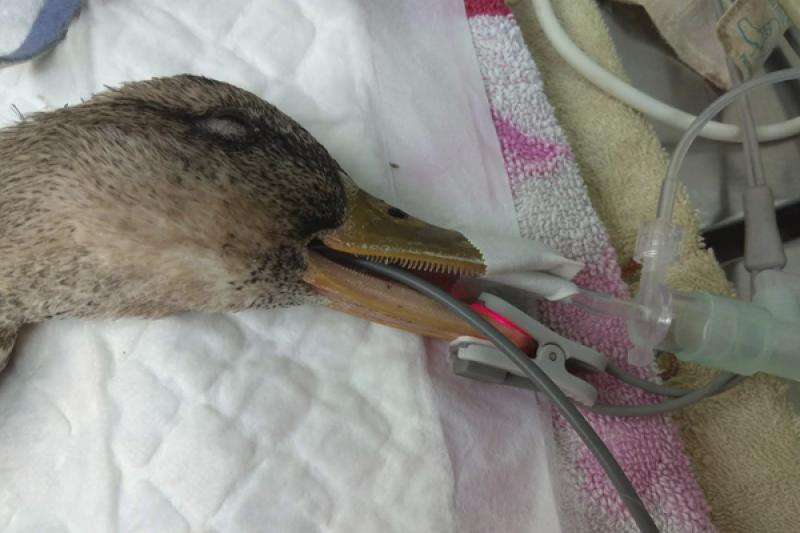
La monitorización se realiza mediante electrocardiograma con pinzas atraumáticas, pulsioxímetro colocado en la lengua y el pico inferior, manguito oscilométrico rodeando el húmero para medir la presión arterial no invasiva en la arteria cubital, siendo comprobados los valores en varias ocasiones con el Doppler. Sonda de temperatura flexible intraesofágica y capnografía a la salida del tubo endotraqueal (Figura 7).
Procedimiento quirúrgico
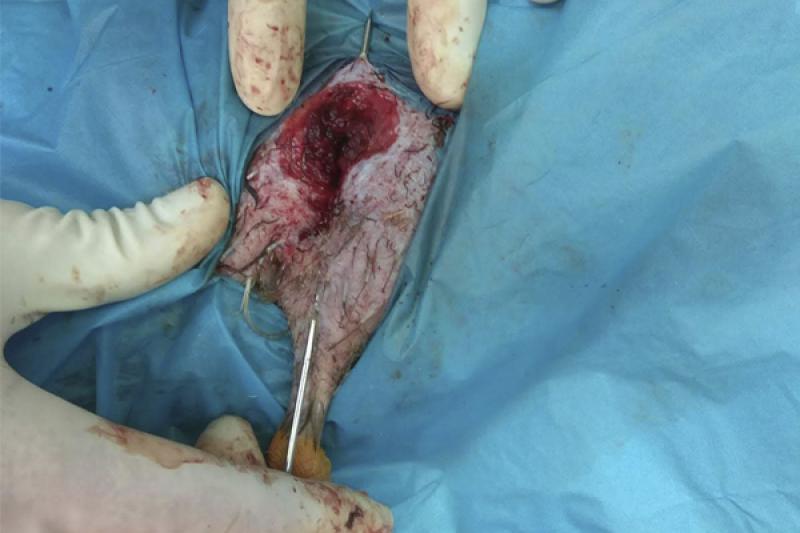
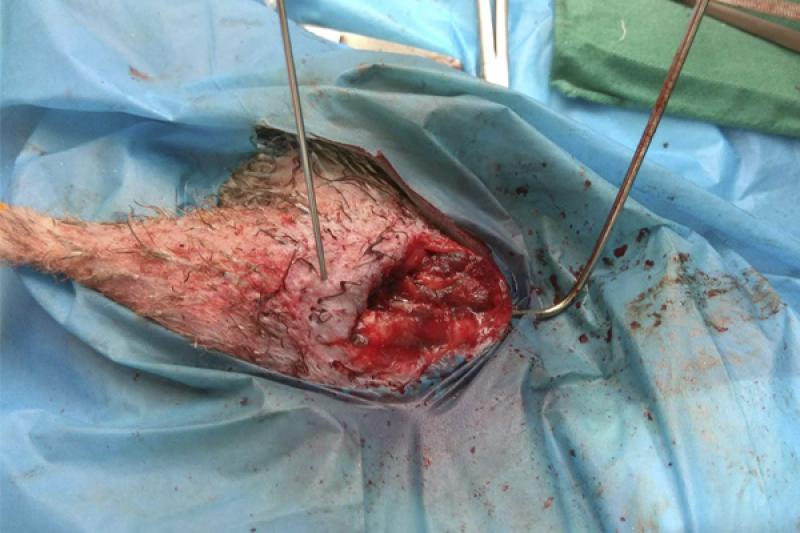
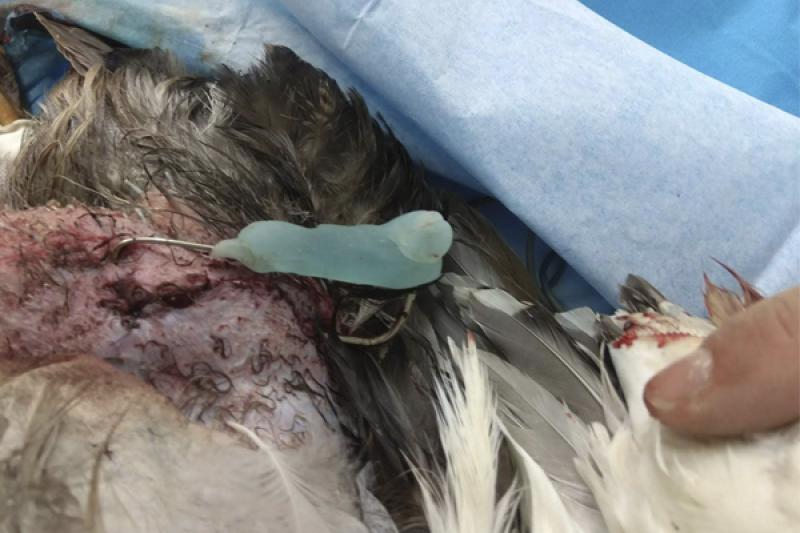
Se realiza la fijación de la fractura mediante un fijador externo tipo “Tie-In”, que consiste en una aguja intramedular (Figura 8) de 2 mm que se dobla en su extremo proximal para actuar de barra conectora (Figura 9) con las agujas transversales. En este caso se coloca una única aguja transversal en la zona distal, cuando lo ideal serían dos, debido a que el fragmento distal es muy pequeño. Se realiza una radiografía para ver el afronte de la fractura y la correcta colocación de las agujas (Figura 10). Se une la aguja transversal con la aguja intramedular utilizando un hidroplástico de fraguado rápido en forma de perlas (Figura 11) que se calienta con agua caliente y solidifica dándole la forma que necesite para fijar ambas agujas.
Postoperatorio
Las aves por lo general son animales que se recuperan bastante rápido, a los pocos minutos de apagar el vaporizador. Al terminar el procedimiento se coloca al animal en posición lo más fisiológica posible, para evitar el peso de las vísceras sobre pulmones y sacos aéreos. Se mantiene la intubación hasta que el animal recupera reflejos, no tose el tubo y mantiene la cabeza más o menos erguida. Si fuera necesario se podrían revertir los fármacos utilizados, pero gracias a su rápido metabolismo no suele necesitarse. Se coloca al paciente en una incubadora para aportar temperatura, humedad y oxigenación durante su recuperación y se comienza con la terapia postoperatoria; en este caso se administra amoxicilina-clavulánico (125 mg/Kg/12 h) junto con meloxicam (1 mg/Kg/12 h).
Discusión
La elección del protocolo anestésico se basa en los principios de anestesia balanceada, para bajar los requerimientos de gases inhalatorios durante la intervención, sumando los efectos sedantes, analgésicos e hipnóticos de los distintos fármacos, reduciendo en lo posible los efectos secundarios de cada uno y confiriendo la mayor estabilidad cardiovascular posible. En el paciente se utilizó midazolam en la premedicación buscando tanto su efecto relajante muscular para disminuir la contractura de la musculatura cercana al foco de fractura como su efecto ansiolítico, disminuyendo la posibilidad de que el animal entre en shock debido al estrés. La reducción del estrés disminuye la liberación de catecolaminas endógenas y el riesgo de alteraciones cardio-circulatorias (como aumentos de presión arterial, arritmias o roturas aórticas y hemorragias).
Como analgésico se eligió el butorfanol por ser K agonista, ya que está descrito un mayor número de receptores opioides K que µ en estas aves, pero como todos los opioides produce depresión cardio-respiratoria, con disminución de la frecuencia cardiaca y del volumen tidal, por lo que se deben compensar estos efectos secundarios durante el procedimiento.
Se usó la combinación de propofol junto con microdosis de medetomidina para disminuir la posibilidad de apnea y realizar la intubación lo más rápido posible. En cuanto al agente inhalatorio, se usó isoflurano por ser el que se maneja habitualmente en el lugar de trabajo. En aves no existe una CAM como tal porque no presentan alveolos, en este caso se refiere a la concentración anestésica requerida que evita movimientos en un ave ante un estímulo nociceptivo, y en el isoflurano se encuentra en 1,32 % en patos.
Todas las aves anestesiadas tienden a hipoventilar por varios motivos: carecen de diafragma, los movimientos respiratorios son activos y la posición del animal dificulta la respiración. Si el animal se posiciona en decúbito dorsal, la presión de las vísceras sobre los sacos aéreos caudales disminuye el volumen tidal y los músculos respiratorios deben elevar toda la masa muscular de los pectorales. El decúbito esternal también restringe los movimientos esternales. Además, la respiración de las aves, de forma fisiológica, necesita un flujo de aire unidireccional que atraviese los pulmones de caudal a craneal. El ciclo completo se realiza en dos movimientos respiratorios: en el primero el aire inspirado entra hacia los sacos aéreos caudales (torácicos y abdominales) y durante la espiración pasa a los pulmones. Y en el segundo, durante la inspiración el aire pasa de los pulmones a los sacos aéreos craneales y al espirar se expulsa al exterior. Como durante la anestesia el ave apenas consigue llenar de aire los sacos aéreos caudales, se realiza ventilación asistida intermitente: si mantienen la respiración espontánea se realizarán 2-3 respiraciones forzadas por minuto y si se encuentra en apnea realizaremos entre 10 y 20 respiraciones por minuto. En resumen, las aves tienen una eficiencia respiratoria muy alta (10 veces más que los mamíferos) gracias a su gran superficie de intercambio y gran volumen tidal, por lo que necesitan una frecuencia respiratoria relativamente baja. Sin embargo, tienen mucho espacio muerto y muy poca capacidad residual funcional, y si no se produce el flujo de aire por el pulmón, no se produce el intercambio y se hipoxemian muy rápido.
Es muy importante monitorizar la temperatura corporal. En el caso de las aves acuáticas presentan un buen plumaje de aislamiento que va a impedir tanto perder calor como ganarlo de forma exógena. Con el animal despierto se debe tener cuidado con las técnicas de inmovilización (toallas, mantas…) que sumado al grado de estrés, a las movilizaciones del animal y la incapacidad de perder calor pueden producir situaciones de hipertermia, muy graves, incluso drásticas. Durante la anestesia es más frecuente que se produzca hipotermia por las siguientes razones: generan menos calor por contracción muscular, la diferencia con la temperatura ambiental, los gases respiratorios demasiado fríos y secos, la exposición y mojado de las áreas quirúrgicas y la apertura de cavidades corporales. La pérdida de temperatura será muy difícil de recuperar, por lo que será más eficiente minimizar las pérdidas de calor utilizando mantas térmicas y sacos o guantes de semillas que ayudarán al posicionamiento del animal y colocados sobre el circuito anestésico atemperarán el aire que respiran.
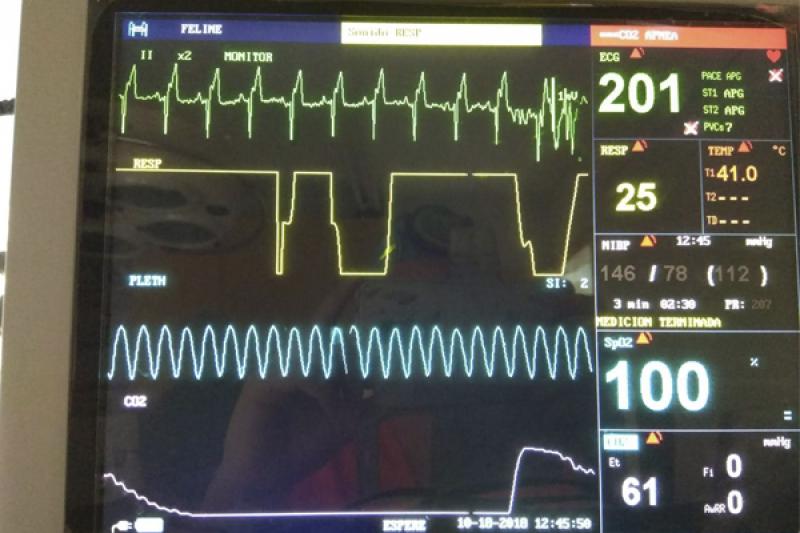
En la monitorización cardiovascular se debrá prestar atención a la auscultación, la frecuencia cardiaca y la presión arterial. Como son animales con una tasa metabólica muy alta, presentan una frecuencia cardiaca, un gasto cardiaco y una presión arterial muy elevadas (entre 90-140 mmHg en aves anestesiadas y 140-155 mm Hg en aves despiertas) (Figura 12), pero a lo largo de las cirugías, el efecto de los agentes inhalatorios, las pérdidas de sangre y la hipotermia pueden provocar situaciones de hipotensión y bradicardia que pueden llegar a ser fatales. Cuando se detecta un principio de hipotensión y bradicardia, además de administrar un bolo de fluidos de 10 ml/Kg se realizarán maniobras de bajar o incluso apagar el vaporizador durante unos segundos para recuperar valores al disminuir la profundidad anestésica.
En la monitorización respiratoria se observará la frecuencia, la profundidad y el ritmo respiratorio. El pulsioxímetro puede ser útil para valorar la tendencia pero el valor absoluto de la saturación no es real, ya que la hemoglobina de las aves es diferente a la de mamíferos, el valor está subestimado. La capnografía es más fiable para interpretar la eficacia respiratoria, las aves producen elevadas concentraciones de CO2 en el aire espirado (EtCO2), además de su acumulación en el espacio muerto, por lo que será mayor que la PaCO2 arterial (Figura 13).
La monitorización del plano anestésico es quizá lo más complejo, las aves son muy drásticas y pueden sufrir variaciones muy grandes en cuestión de segundos. Existen escalas de puntuación para evaluar la profundidad anestésica valorando reflejos como el palpebral, el pupilar, el corneal, el tono muscular y los reflejos nociceptivos mediante pinzamiento (en prepatagio, interdigital o en la cloaca), pero en la práctica no resulta tan sencillo. Cuando resulte difícil profundizar el plano y mantenerlo se debe comprobar todo el circuito anestésico en busca de fugas. La más frecuente suele deberse a tubos endotraqueales más pequeños de lo que le corresponde al calibre de la tráquea, por lo cual el tubo debe ajustarse lo máximo posible sin llegar a dañar la mucosa. En un plano superficial aumentará drásticamente la frecuencia respiratoria, la frecuencia cardiaca y la presión arterial, y se producirá un tremor característico de las plumas y los párpados. En un plano excesivamente profundo disminuirán la frecuencia respiratoria, la cardiaca y la presión arterial, y en estos casos, como se ha comentado antes, se procederá a bajar el vaporizador de agente inhalatorio y a aumentar el flujo de aire para limpiar el espacio muerto de CO2 y de gas inhalatorio acumulados, con precaución para que no se despierte.
Bibliografía
- "Anestesia y analgesia de los pequeños animales domésticos" Erhardt, henke, haberstroh. 2006. ESMONpharma
- Anesthesia of exotic pets. L.A.Longley. Sounders. Elsevier. 2008
- Zoo Animal & Wildlife. Inmobilization and anesthesia. Gary West, Darryl Heard, & Nigel Caulkett. 2007. Blackwell Publishing.
- Avian Medicine and Surgery in practice. Bob Doneley. Manson Plublishing. 2010
- Veterinary Anesthesia and Analgesia. The Fifth edition of Lumb and Jones. 2015. Ed Offices.
- Avian Analgesia. Michelle G. Hawkins, Joanne Paul-Murphy. vetexotic.theclinics.com
- Clinical Avian Medicine. Greg J. Harrison. Teresa Lightfoot.
- Evaluation of thermal antinociceptive effects and pharmacokinetis after intramuscular administration of butorphanol tartate to American kestrels (Falco sparverius). David Sanchez-Migallon Guzman. Tracy L. Drazenovich, Glenn H.Olsen, Neil H. Willits, Joanne R Paul-Murphy. American journal of veterinary research 75 (1), 11-18, 2014.
- Effects of midazolam on ketamine-xylazine anesthesia in guinea fowl (Numida meleagris galeata)
- Sedative effects of medetomidine in pigeons (columba livia). Christal G. Pollock, J. Schumacher, Susan E.Orosz, EC Ramay. Journal of Avian Medicine and Surgery 15 (2), 95-101, 2001
- Pharmacokinetics of butorphanol after intravenous, intramuscular, and oral administration in Hispaniolan Amazon parrots (Amazona ventralis)
 by Multimédica
by Multimédica