Uso de infusiones analgésicas
Resumen breve
El uso de infusiones continuas de fármacos durante la anestesia general de pequeños animales se define como anestesia parcial intravenosa (PIVA ––en inglés, por las siglas Partial IntraVenous Anaesthesia). La administración multimodal de fármacos analgésicos mejora el alivio del dolor mediante el uso de fármacos con diferentes mecanismos farmacológicos. El uso de infusiones intraoperatorias durante una anestesia general permite llevar a cabo una anestesia equilibrada.Índice de contenidos
Introducción
El uso de infusiones continuas de fármacos durante la anestesia general de pequeños animales se define como anestesia parcial intravenosa (PIVA ––en inglés, por las siglas Partial IntraVenous Anaesthesia)1. La administración multimodal de fármacos analgésicos mejora el alivio del dolor mediante el uso de fármacos con diferentes mecanismos farmacológicos. El uso de infusiones intraoperatorias durante una anestesia general permite llevar a cabo una anestesia equilibrada. Esto permite aportar analgesia y reducir las dosis de anestésicos generales2, pudiendo reducir así los potenciales efectos adversos cardiorrespiratorios asociados a la dosis utilizada3. Además, la utilización de infusiones continuas de fármacos no sólo se limita al periodo intraoperatorio, sino que pueden emplearse durante el postoperatorio en hospitalización para proporcionar analgesia postoperatoria adicional, ansiolisis o sedación al paciente4,5, y por supuesto en pacientes que no se hayan sometido a una intervención quirúrgica pero sufran una condición médica en la que sea necesario administrar analgesia como pancreatitis, quemaduras, dermatitis severas, entre muchas otras4. Aunque la utilización de infusiones analgésicas puede tener diversas ventajas e indicaciones en perros y gatos, su uso puede presentar otros inconvenientes o riesgos potenciales para el paciente6 (Tabla 1). Siempre se debe evaluar de forma individual a cada paciente para ajustar la dosis necesaria según cada estado y condición.
Farmacocinética: por qué infusión continua
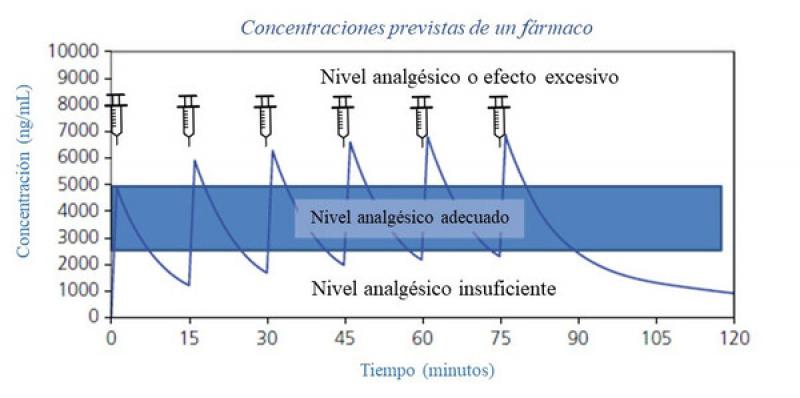
El objetivo de la administración en infusión continua es conseguir una concentración plasmática estable, lo que permite proporcionar una analgesia estable sin las oscilaciones que pueden ocurrir debido a la administración repetida de bolos intravenosos6. El inconveniente de la administración mediante bolos es la variación de la concentración plasmática del fármaco debida a su distribución y metabolismo. Esto da lugar a un efecto pico inicial de mayor concentración plasmática que puede producir más efectos adversos, seguido de un efecto valle en el que se reduce la concentración plasmática del fármaco y se produce una falta de efecto7 (Figura 1). Así, la administración mediante infusión continua permite el mantenimiento de concentraciones plasmáticas estables, con menor oscilación de los efectos analgésicos y adversos, principalmente hemodinámicos y respiratorios, lo que aumenta la seguridad de la técnica8,9.
Para conseguir una concentración plasmática estable de manera efectiva, la infusión debe ser precedida por lo general de un bolo de carga de una dosis analgésica de cada uno de los fármacos que se empleen. Esto permitirá alcanzar rápidamente una concentración plasmática efectiva debido a la elevada biodisponibilidad del fármaco, que luego puede ser mantenida con la infusión continua de los fármacos10. Existe una excepción a esto, como es el caso del remifentanilo, en el que no es necesario administrar un bolo de carga (ver más adelante).
| Tabla 1. Riesgo del uso de infusiones analgésicas y como prevenirlos. |
| Problema o inconveniente | Acción encaminada a prevenirla |
| Desconexión del catéter u oclusión | Asegurar la correcta conexión y comprobar el catéter regularmente durante la anestesia o en hospitalización. |
| Extravasación del catéter | Comprobar el catéter regularmente durante la anestesia o en hospitalización (en cada evaluación o exploración del paciente y siempre que aparezca alarma en la bomba de infusión). |
| Fallo en la batería (bomba de infusión) | Dispone de cable de conexión y acceso a la corriente eléctrica. |
| Embolismo gaseoso | Purgar correctamente el sistema de infusión y comprobar periódicamente la integridad de la vía venosa. |
| Dosis o velocidad de infusión de fármacos concomitantes | No administrar bolos de fármacos en la misma línea de la infusión continua, y emplear el acceso más cercano a la vena del paciente para evitar dar una dosis extra del fármaco en infusión. |
| Fallo en la dosificación de los fármacos o sobredosis de estos | Calcular y revisar la dosis y velocidad de infusión resultante, y rotular siempre las infusiones preparadas con el fármaco, dosis utilizada, concentración de la infusión y velocidad. Si se preparan para un paciente concreto, identificar la infusión con los datos del paciente. |
| Error en la administración del fármaco o infusión (confusión de uno u otro) | Rotular siempre las infusiones preparadas con el fármaco, dosis utilizada, concentración de la infusión y velocidad. Si se preparan para un paciente concreto, identificar la infusión con los datos del paciente. |
| Efecto excesivo (aparición de efectos adversos) | Reevaluar el estado del paciente, monitorización regular de variables fisiológicas, plano anestésico, plano analgésico o evaluación del dolor según corresponda. |
Farmacología: principales fármacos empleados
Opioides
Estos fármacos producen un efecto analgésico potente y también reducen las necesidades de anestésicos generales durante la cirugía de forma dosis-dependiente11. También pueden utilizarse para proveer analgesia en pacientes conscientes. Los opioides de elección para su utilización con infusión continua analgésica son los agonistas totales de los receptores µ opioides. Pueden emplearse desde la premedicación, teniendo en cuenta la duración de cada uno de cara al momento de inicio de la infusión continua. Sus principales efectos adversos incluyen depresión respiratoria, bradicardia, disforia, hipertemia (gatos), retención urinaria, íleo, náuseas y vómitos. Sin embargo, la presencia de disforia, náuseas y vómitos es bastante infrecuente. En este grupo se hallan fármacos como metadona, fentanilo o remifentanilo.
Fentanilo: es un fármaco agonista puro del receptor µ opioide con elevada liposolubilidad y corta duración de acción (aproximadamente 20 minutos cuando se administra en bolo único). El uso de fentanilo en infusión continua permite aportar analgesia intra y postoperatoria12, y disminuir los requerimientos de anestésicos generales a nivel intraoperatorio13-16. El uso de fentanilo en infusión continua produce una reducción dosis-dependiente de la concentración alveolar mínima en perros de hasta el 70 %11,13,14. Tiene un efecto analgésico potente y sus características farmacocinéticas permiten su administración en bolo como analgesia de rescate, así como en infusión continua. Se ha descrito que infusiones prolongadas de fentanilo (>180 minutos) producen cierto efecto acumulativo en la especie canina, por lo que puede tener efecto antinociceptivo tras cesar su administración. En perros, se ha descrito este efecto para infusiones de duración entre 180 y 240 minutos10. Este efecto no se ha demostrado en gatos, en los que parece que no se mantiene una concentración plasmática estable de fentanilo tras interrumpir la administración del mismo después de 180 o 360 minutos de infusión continua17,18.
Se emplea para el tratamiento del dolor de moderado a severo. Se ha descrito su utilización en pacientes anestesiados a dosis entre 5-20 µg/kg/h, y entre 1-5 µg/kg/h en pacientes conscientes, previo bolo de carga de 1-5 µg/kg IV17-19, tanto en cirugía traumatológica como de tejidos blandos, y puede ser una opción adecuada para proveer analgesia intraoperatoria en pacientes en los que no se pueda realizar una técnica locorregional. Entre los principales efectos adversos, principalmente cuando se administra en bolo, se encuentran bradicardia y depresión respiratoria. Además, se ha descrito la presencia de disforia durante la recuperación en perros tras la administración intraoperatoria de fentanilo en infusión continua20. En gatos, los efectos centrales de los opioides pueden evidenciarse por la presencia de midriasis y signos de disforia en el animal consciente, en cuyo caso será necesario interrumpir la infusión durante 1-6 horas, e iniciarla de nuevo a dosis más bajas o emplear otro fármaco4.
Metadona: aunque más comúnmente empleado en la premedicación del paciente (0.3 mg/kg IM o IV lento), puede utilizarse en infusión continua a nivel intra o postoperatorio a 0.1 mg/kg/h con bolos de 0.05 mg/kg en caso de necesitar incrementar rápidamente la concentración plasmática. Por sus características farmacocinéticas, puede producir efecto acumulativo dando lugar a una excesiva sedación en perros o disforia en gatos.
Remifentanilo: es un análogo estructural del fentanilo con acción directa sobre los receptores µ opioides21,22. El remifentanilo tiene un efecto analgésico potente, y permite reducir los requerimientos de anestésicos generales23-27. Está implicado en el desarrollo de hiperalgesia inducida por opioides, aunque esto no está claramente demostrado en pequeños animales28. En cualquier caso, dado que se ha descrito que la ketamina y el paracetamol pueden prevenir el desarrollo de hiperalgesia inducida por opioides, algunos autores sugieren su utilización cuando se administra remifentanilo. El remifentanilo es único entre los opioides porque es metabolizado por esterasas sanguíneas y tisulares, por lo que la presencia de disfunción hepática o renal tiene poco impacto en la metabolización del fármaco. Por ello, se recomienda su uso frente a otros opioides en pacientes con problemas hepáticos o con shunt porto-sistémicos29. Dadas sus características farmacocinéticas, debido a su inicio de acción rápido, así como eliminación, no se recomienda la administración de bolo de carga21,22. La dosis de infusión recomendada intraoperatoria es de 0.1-0.5 µg/kg/min (aunque se ha señalado un efecto techo para la reducción de los requerimientos anestésicos a partir de 0.25 µg/kg/min25, no obstante, no se ha evaluado para efecto analgésico). Se debe tener especial precaución con la depresión respiratoria y bradicardia que produce. Debido a su efecto ultracorto, debe asegurarse la correcta provisión de analgesia al paciente mediante otros fármacos antes de cesar la administración de la infusión continua de remifentanilo.
Además de estos fármacos, también pueden emplearse infusiones continuas de morfina, buprenorfina, alfentanilo, sufentanilo con efectos y características similares6,30, aunque se ha preferido tratar en este artículo los opioides más habitualmente empleados o aquellos con características diferenciales.
Agonistas de los receptores adrenérgicos α2
Estos fármacos, entre los que se encuentran la medetomidina y dexmedetomidina, actúan interaccionando con los receptores adrenérgicos α2 localizados en el asta dorsal de la médula espinal y en el locus coeruleus del tronco encefálico, dando lugar a efectos sedantes, analgésicos y relajantes musculares31-34. Permiten aportar sedación, analgesia y reducir los requerimientos de anestésicos generales35 cuando se emplean a nivel intraoperatorio, y en el postoperatorio permiten aportar analgesia, ansiolisis y sedación al paciente, lo que favorece una recuperación tranquila. Además, sus efectos analgésicos se potencian cuando se administran de forma concurrente con fármacos opioides y se ha descrito que podrían tener un efecto aditivo13. Sus principales efectos secundarios son a nivel cardiovascular, ya que inicialmente producen vasoconstricción periférica con bradicardia refleja31,36, y disminución del gasto cardiaco, por lo que deben utilizarse con precaución en pacientes con poca reserva cardiovascular y/o debilitados32. Para el uso de dexmedetomidina, se recomienda administrar una dosis como bolo de carga (0.5-1.0 µg/kg IV), seguido de la infusión continua entre 0.5-1.5 µg/kg/h a nivel intraoperatorio, y 0.5-1.5 µg/kg en el postoperatorio. Para medetomidina, se recomienda como bolo de carga inicial 2-5 µg/kg IV, seguido de la infusión continua entre 2.5-5.0 µg/kg/h, a nivel intraoperatorio, y 1.0-2.5 µg/kg/h en el postoperatorio.
Ketamina
Es un fármaco que actúa como anestésico disociativo y posee efectos sedantes, analgésicos e hipnóticos, debido a su antagonismo no competitivo de los receptores de N-Metil-D-Aspartato (NMDA)37, en el asta dorsal de la médula espinal y el encéfalo38. Su utilización intraoperatoria permite aportar analgesia multimodal y reducir los requerimientos de anestésicos inhalatorios, además de potenciar los efectos antinociceptivos de opioides y agonistas de los receptores adrenérgicos α2. Reduce la tolerancia a los opioides, el desarrollo de hiperalgesia y de sensibilización central39,40. Por lo tanto, es útil en pacientes que ya experimentan dolor crónico (artritis, dolor oncológico) o en pacientes que vayan a someterse a procedimientos que pueden implicar el desarrollo de dolor crónico (por ejemplo, toracotomías, mastectomías, cirugía de columna)41.
Se recomienda la administración de un bolo de carga (0.1-0.5 mg/kg IV) seguido de infusión continua 10-20 µg/kg/min a nivel intraoperatorio o 2-5 µg/kg/min en el postoperatorio42. Como efectos adversos, puede producir bradipnea especialmente si el bolo de carga se administra rápido, y un incremento de salivación que puede indicar la presencia de náusea en el paciente despierto. En este caso, debe evaluarse la posibilidad de reducir la dosis administrada y/o administrar un fármaco antiemético.
Puede producir, a dosis elevadas, estimulación del sistema nervioso central y cardiovascular y depresión respiratoria, aunque no suelen observarse estos efectos a dosis bajas de efecto analgésico. Cuando se emplee de forma intraoperatoria, debe tenerse en cuenta que produce centralización del globo ocular y supresión del reflejo palpebral, por lo que se deberá tener en cuenta en la monitorización del plano anestésico43. La utilización de dosis elevadas también puede producir excitación y disforia en el paciente durante el postoperatorio, especialmente en la especie felina, y en ese caso se recomienda reducir la dosis4.
Anestésicos locales: lidocaína
Aunque su uso está muy extendido en anestesia locorregional, la lidocaína también puede emplearse en infusión continua en perros para aportar analgesia intra y postoperatoria y disminuir la dosis necesaria de anestésicos generales44-46. Sin embargo, no se recomienda su uso en gatos debido a la mayor sensibilidad a los efectos tóxicos a nivel cardiovascular47. Su mecanismo de acción no está completamente dilucidado, pero se ha sugerido que produce una activación de las vías descendentes inhibitorias al unirse a receptores muscarínicos M3; también inhibe receptores de glicina y promueve la liberación de opioides endógenos48. Además de su efecto analgésico, también se ha descrito sus propiedades antiinflamatorias, citoprotectoras y antiendotóxicas, a través de su acción sobre radicales libres de oxígeno y puede tener efectos beneficiosos en situaciones como el síndrome de respuesta inflamatoria sistémica (SIRS)48. Su utilización también permite reducir los requerimientos de anestésicos inhalatorios entre un 10-22 %46,47,49. En perros, se recomienda administrar 1-2 mg/kg IV como bolo de carga, seguido de 3-6 mg/kg/h intraoperatorio o 1.5-3.0 mg/kg/hora, en postoperatorio. Los signos de toxicidad debido a lidocaína incluyen alteraciones cardiovasculares como bradicardia e hipotensión severa y neurológicos con espasmos musculares que progresan en algunos casos a convulsiones generalizadas.
Combinaciones de fármacos en infusión continua
También pueden emplearse combinaciones de estos fármacos, lo que permite llevar a cabo una analgesia multimodal y disminuir los requerimientos de anestésicos inhalatorios o intravenosos debido al efecto sinérgico. Se ha descrito la utilización de diversas combinaciones de fármacos tanto en la especie canina como felina: morfina-lidocaína-ketamina (MLK) (perros)50-52, lidocaína-morfina (perros)53,54, fentanilo-lidocaína-ketamina (FLK) (perros)2,30,55, fentanilo-ketamina (perros y gatos)56, dexmedetomidina-lidocaína-ketamina (perros)13,57,58, etc. Aunque pueden prepararse soluciones de dichas combinaciones de fármacos, en experiencia de la autora, emplear soluciones separadas puede ser más útil, ya que permite modificar las dosis utilizadas individualmente en caso de la presentación de efectos adversos.
En la Tabla 2 se resumen los fármacos y dosis de las infusiones continuas habitualmente empleadas durante la anestesia general en perros y gatos, indicando si es necesaria o no la administración de un bolo de carga del fármaco, el rango recomendado de dosis de carga y de infusión y las principales observaciones del uso de estos fármacos.
| Tabla 2. Fármacos y dosis de las infusiones continuas habitualmente empleadas durante la anestesia general en perros y gatos. |
| Fármaco | Dosis bolo de carga (IV) | Dosis de mantenimiento (IV) | Observaciones |
| Opioides Fentanilo Remifentanilo Metadona | 3-5 μg/kg No 0.3 mg/kg | 5-20 μg/kg/h 0.1-0.6 μg/kg/min 0.1 mg/kg/h | Bradicardia y depresión respiratoria Bradicardia y depresión respiratoria Bradicardia y depresión respiratoria |
| Agonistas α2 Dexmedetomidina Medetomidina | 0.5-1.0 μg/kg en bolo lento (5 min) 2-5 μg/kg en bolo lento (5 min) | 0.5-1.5 μg/kg/h 2.5-5.0 μg/kg/h | Bradicardia Bradicardia |
| Antagonista NMDA Ketamina | 0.3-0.5 mg/kg | 2-20 µg/kg/min | Modificación del plano anestésico (ojo centrado, sin reflejo palpebral). Posibles signos de ketaminización a dosis alta |
| Anestésicos locales Lidocaína | Perro: 1-2 mg/kg | Perro: 1,5-3 mg/kg/h | Cuidado en gatos ya que la lidocaína puede producir toxicidad (convulsiones y bradicardia severa) |
| Combinaciones Morfina+Lidocaína+Ketamina | Aparte de la infusión preparada*1 Morfina 0,24 m/kg Lidocaína 2 mg/kg Ketamina 0,6 mg/kg | Morfina 0,24 mg/kg/h Lidocaína 3 mg/kg/h Ketamina 0,6 mg/kg/h Velocidad = 3 mL/kg/h | “Receta”: en un bote de 500 ml de NaCl0,9%, añadir 40 mg de morfina, 100 mg de ketamina y 500 mg de lidocaína.*2 |
| Combinaciones Fentanilo+Lidocaína+Ketamina | Aparte de la infusión preparada*1 Fentanilo 2 µg/kg Lidocaína 2 mg/kg Ketamina 0,6 mg/kg | Fentanilo 4,5 μg/kg/h Lidocaína 3 mg/kg/h Ketamina 0,6 mg/kg/h Velocidad = 3 mL/kg/h | “Receta”: en un bote de 500 ml de NaCl0,9%, añadir 0,75 mg de fentanilo, 100 mg de ketamina y 500 mg de lidocaína.* |
*1. Nota 1: La administración del bolo de carga deberá realizarse empleando el volumen necesario del fármaco según la presentación disponible, no a partir de la solución preparada. *2. Nota 2: Tener en cuenta que las cantidades indicadas de fármacos a añadir en el bote de 500 mL son válidas para la dosis y velocidad indicadas en este caso. Esta indicación en cuanto a cantidad de fármacos puede adaptarse según volumen deseado de la infusión o velocidad requerida.
Material necesario
La administración de esta técnica es tan sencilla como administrar fluidoterapia.
- Para el uso de infusiones analgésicas, es necesario disponer de:
- Vía venosa permeable en el paciente al que se pretenda administrar.
- Infusión o fármacos a administrar, que será preparada con la concentración deseada en un bote o jeringa de suero salino NaCl 0.9 % estéril.
- Bomba o perfusor de fluidos.
- Sistema de fluidoterapia adecuado a la bomba a emplear (Figura 2).
Es recomendable la utilización de una bomba de infusión o perfusor de jeringa siempre que sea posible, puesto que permitirá asegurarse de que se administra la dosis y cantidad especificada. Los fármacos a emplear pueden administrarse juntos en el mismo suero (excepto benzodiacepinas, si se desean emplear para aportar sedación) a una velocidad de administración de entre 1-5 ml/kg/h, para poder modificar la velocidad en caso necesario. Así, será posible incrementar la velocidad de administración en caso de querer incrementar la dosis del fármaco para obtener un mayor efecto analgésico.
Se recomienda administrar la fluidoterapia complementaria en un suero diferente para poder corregir déficits de fluidos de forma independiente.
La elección de los fármacos a emplear o la combinación de estos depende de varios factores como el efecto que se desee en el paciente, estado del mismo y patologías previas. Se puede administrar un único fármaco analgésico (p. ej., fentanilo o lidocaína) o una combinación de varios, lo que permite complementar sus efectos analgésicos mediante la realización de analgesia multimodal, reducir las dosis de lestosy permite reducir la dosis de anestésicos inhalatorios o intravenosos empleados (reducción de la concentración alveolar mínima o la tasa mínima de infusión), como se ha indicado previamente.
Cálculos y preparación de la infusión
Existen dos formas de preparar una infusión. Por un lado, se puede calcular la velocidad deseada, para lo cual se requiere calcular los mL/h necesarios. Por otro lado, puede haber situaciones en las que se requiera determinar la duración de la infusión en horas (p. ej., en hospitalización), para lo cual se elegirá la velocidad deseada en mL/h según la duración que se quiera (ver más adelante).
Preparación de la infusión:
- Partiendo de una velocidad deseada. Se deberá conocer:
- Dosis del fármaco. En general se manejarán unidades de mg/kg/h o mg/kg/min. Si la dosis se tiene en microgramos (μg/kg/h o μg/kg/min) se realizará la conversión adecuada recordando que 1 mg = 1000 μg y que 1 μg = 0,001 mg.
- Velocidad de infusión. Lo más habitual es el empleo de velocidades bajas de infusión para poder usar junto a la fluidoterapia convencional: 0.5-3.0 mL/kg/h. Una recomendación es emplear una velocidad de 1 mL/kg/h, con lo cual se simplifican los cálculos a la hora de administrar la infusión preparada a cualquier paciente.
- Volumen a preparar. Pueden prepararse en botellas de suero (500, 250 o 100 mL) o en jeringas (50, 20 o 10 mL).
- Concentración del fármaco. En general se manejarán unidades de mg/mL.
El cálculo del volumen del fármaco a administrar en el suero en el que se diluirá se realizará en dos pasos:
- Para calcular la concentración del fármaco en la infusión (mg/mL) deben utilizarse los datos de dosis de infusión (mg/kg/h) y de velocidad de la infusión (mL/Kg/h), y ambos datos ya se conocen. Se realizará la siguiente fórmula. *Nota: si la dosis de infusión está en μg/kg/h la concentración resultante será en μg/mL.
Concentración infusión (mg/mL)=(Dosis infusión (mg⁄kg/h))/(Velocidad infusión ((mL⁄kg)⁄h))
Si la dosis de infusión se conoce en mg/kg/min el cálculo sería el siguiente, para cambiar de horas a minutos:
Concentración infusión (mg/mL)=(Dosis infusión ((mg⁄kg)⁄min)x 60 (min⁄h))/(Velocidad infusión ((mL⁄kg)⁄h))
- Para calcular el volumen del fármaco que se introducirá en el volumen de infusión (bote de suero o jeringa), hay que tener en cuenta la cantidad de suero en la que se diluye el fármaco (mL) y la concentración del fármaco de la que se parte (mg/mL): en la ecuación anterior se halla la concentración en mg/mL de la infusión, y ahora se quiere tener esa concentración en un volumen determinado “X mL” por lo que se deberá multiplicar por ese volumen. Así, se obtendrán “Y mg” y sólo quedaría realizar otro factor de conversión para saber cuántos mL se tienen que obtener del fármaco. Si se representa en una fórmula, sería la siguiente:
Volumen fármaco (mL)=(Concentración infusión (mg⁄mL)x volumen jerinja o suero (mL))/(Concentración fármaco (mg/mL))
Si se quiere realizar en una sola operación:
Volumen fármaco (mL)=(Dosis infusión ((mg⁄kg)⁄h)x Volumen jerinja o suero (mL))/(Velocidad infusión ((mL⁄kg)⁄h)x Concentración fármaco (mg/mL))
Con esta aproximación, la infusión preparada puede utilizarse en un animal que tenga un peso diferente, ya que no se aplica en la ecuación. Por tanto, solo se deberá aplicar la dosis deseada y utilizar la infusión a la concentración obtenida.
- Partiendo de una duración determinada. Se deberá conocer:
- Dosis del fármaco.
- Duración de la infusión: 24, 12, 10 horas.
- Volumen a preparar. Pueden prepararse en botellas de suero (500, 250 o 100 mL) o en jeringas (50, 20 o 10 mL). Cuanto mayor sea el volumen empleado, mayor duración tendrá para una velocidad determinada y viceversa.
- Concentración del fármaco.
- Peso del paciente.
El cálculo en este caso parte de la duración de la infusión, por lo cual la velocidad de administración variará en función de ello. En este punto es importante recordar el empleo de velocidades bajas de infusión para poder usar junto a la fluidoterapia convencional y no superar la cantidad diaria de fluidos recomendada en perros y gatos. Por ejemplo, si se utiliza una botella de suero de 100 mL, para una duración de 10 horas se obtendrrá una velocidad de 10 mL/kg/h, lo cual es adecuado para un perro mediano-grande pero no para un gato o un perro pequeño. En ese caso, la infusión tendrá una mayor duración o bien se empleará un bote de suero más pequeño.
- En primer lugar se determinará la velocidad de administración (mL/h), que dependerá de la cantidad de suero a administrar y de la duración deseada de la infusión. Con ello, se podrá calcular la concentración de la solución, teniendo en cuenta en este caso el peso del paciente:
Velocidad infusión para un peso determinado (mL/h)=(Cantidad de suero (mL))/(Duración infusión (h))
Concentración infusión (mg/mL)=(Dosis infusión ((mg⁄kg)⁄h)x Peso (kg))/(Velocidad infusión (mL⁄h))
- A continuación, se deberá calcular el volumen de fármaco que se introducirá en el volumen de infusión (bote de suero o jeringa), para lo cual se usa la misma aproximación que en el caso anterior:
Volumen fármaco (mL)=(Concentración infusión (mg⁄mL)x volumen jeringa o suero (mL))/(Concentración fármaco (mg⁄mL))
Si se quiere realizar en una sola operación:
Volumen fármaco (mL)=(Dosis infusión ((mg⁄kg)⁄h) x Peso (kg) x Volumen jeringa o suero (mL) x Duración (h))/(Volumen jeringa o suero (mL) x Concentración fármaco (mg/mL))
En este caso, al haberse incluido el peso en la ecuación, la infusión preparada no podría emplearse en un paciente de peso diferente a la misma velocidad, puesto que variaría la dosis. Por ello, siempre es necesario conocer la concentración de la infusión y así poder adaptarlo según las necesidades.
En cuanto a la duración de la solución preparada, existen pocos estudios al respecto que indique el tiempo de estabilidad de la misma. Hay un estudio que indica que, con metadona, podría aguantar 10 días en condiciones clínicas y 48 horas si se combina con fentanilo y ketamina59. Otro estudio que evaluó la estabilidad de midazolam y fentanilo indicaba estabilidad de la infusión durante 4 días60. Aunque la estabilidad de la infusión depende de las condiciones en las que se almacene (temperatura, exposición a la luz), material y composición del diluyente, no existe una recomendación clara, aunque siempre será mejor preparar la infusión a utilizar en el momento que se vaya a utilizar.
| Tabla 3. Ejemplo de preparación de una infusión de fentanilo. |
| Velocidad deseada: 1 mL/kg/h Dosis: 5 μg/kg/h | 1º. Se calcula la concentración de la infusión: concentración infusión (mg/mL) = dosis (0.005 mg/kg/h)/ velocidad infusión (1 mL/kg/h) |
| Volumen a preparar: 100 mL Concentración disponible: 0.05 mg/mL | 2º. Se calcula el volumen de fentanilo a añadir al bote de 100 mL de suero: volumen fármaco (mL) = [concentración infusión (0.005 mg/mL) x volumen suero (100 mL)]/concentración fármaco (0.05 mg/mL) |
| El volumen a añadir de fentanilo a un bote de suero de 100 mL es de 10 mL, se deberán retirar previamente 10 mL de suero para no modificar la concentración ni el volumen final de la solución. | |
|---|---|
| Tabla 4. Ejemplo de preparación de una infusión de dexmedetomidina. |
| Dosis: 1 μg/kg/h Duración de la infusión: 10 horas | 1º. Se calcula la velocidad de la infusión: velocidad infusión (mL/h) = cantidad de suero (100 mL)/duración infusión (10 h) |
| Volumen a preparar: 100 mL Concentración disponible: 0.05 mg/mL | 2º. Se calcula el volumen de fentanilo a añadir al bote de 100 mL de suero: volumen fármaco (mL) = [concentración infusión (0.005 mg/mL) x volumen suero (100 mL)]/concentración fármaco (0.05 mg/mL) |
| Peso del paciente: 10 kg | 3º. Se calcula el volumen de dexmedetomidina a añadir al bote de 100 mL de suero: volumen fármaco (mL) = concentración infusión (0.001 mg/mL) x volumen jeringa o suero (100 mL)/concentración fármaco (0.5 mg/mL) |
| El volumen a añadir de fentanilo a un bote de suero de 100 mL es de 10 mL, se deberán retirar previamente 10 mL de suero para no modificar la concentración ni el volumen final de la solución. | |
|---|---|
Administración de la infusión
Para poder administrar una infusión ya preparada (mL/h), se necesitará saber:
- Dosis del fármaco a administrar, que irá en función de una unidad de tiempo (minutos u horas). En general se manejarán unidades de mg/kg/h o mg/kg/min. Si la dosis es en microgramos (μg/kg/h o μg/kg/min) se realizará la conversión adecuada recordando que 1 mg = 1000 μg y que 1 μg = 0.001 mg. Es importante revisar que tanto dosis como concentración se encuentre en las mismas unidades: mg o μg.
- Peso del animal. Se trabajará con kilogramos (kg).
- Concentración del fármaco a utilizar o a emplear. Aquí se usarán tanto frascos ya preparados para infundir, como infusiones preparadas por uno. En general, Se usarán unidades de mg/mL. El cálculo se realiza igual que cuando se calcula cualquier administración de fármacos, solo que ahora se tendrá en cuenta la unidad de tiempo:
Velocidad infusión (mL/h)=(Dosis infusión (mg⁄kg/h) x Peso (kg))/(Concentración infusión (mg⁄mL) )
Si la velocidad de infusión es en función de minutos, se deberá cambiar a horas, ya que todas las bombas se programan en mL/h:
Velocidad infusión (mL/h)=(Dosis infusión (mg⁄kg/h) x Peso (kg))/(Concentración infusión (mg⁄mL))
Si la velocidad de infusión es en función de minutos, se deberá cambiar a horas, ya que todas las bombas se programan en mL/h:
Velocidad infusión (mL/h)=(Dosis infusión (mg⁄kg/min)x Peso (kg) x 60 (minutos⁄h))/(Concentración infusión (mg⁄mL))(Tabla 5)
| Tabla 5. Ejemplo de utilización de una infusión ya preparada (dexmedetomidina). |
| Peso del paciente: 15 kg. Dosis de infusión: 1 μg/kg/h. Concentración de la infusión: 0.001 mg/mL (misma que en Tabla 4). Duración de la infusión: 10 horas | velocidad infusión (mL/h) = [dosis infusión (0.001 mg/kg/h) x peso (15 kg)] / concentración infusión (0.001 mg/mL) |
| En este caso, la velocidad de la infusión es de 15 mL/h. | |
|---|---|
Uso intraoperatorio y postoperatorio
Aunque ya se han señalado previamente las indicaciones y ventajas del uso de infusiones continuas, su administración debe realizarse llevando a cabo una monitorización del efecto obtenido en el paciente, así como de la presentación de posibles efectos adversos del fármaco o fármacos empleados. Durante el periodo intraoperatorio, se deberá prestar atención a la monitorización de las variables fisiológicas para detectar la presencia de depresión cardiovascular o respiratoria, también es importante la monitorización del plano anestésico, ya que muchos de los fármacos indicados poseen también efectos sedantes y de reducción de los anestésicos generales. Por ello, será fundamental evaluar el plano anestésico y realizar ajustes de los anestésicos inhalatorios o intravenosos empleados, con el objetivo de poder reducir su dosis, aprovechar las ventajas de la infusión analgésica y evitar sobredosis en el paciente.
Es importante proveer de una analgesia adecuada al paciente también durante el periodo postoperatorio. Generalmente se emplean opioides, añadiendo infusiones de lidocaína y/o ketamina en caso necesario5. Hay que tener en cuenta que los opioides pueden causar íleo, así como tener efectos inmunomoduladores negativos, por lo que es importante realizar valoraciones de dolor seriadas, mediante escalas apropiadas a cada especie y procedimiento, para reducir la dosis de opioides al mínimo necesario. Las infusiones de agonistas de receptores adrenérgicos α2 a dosis bajas pueden ser útiles en pacientes con altos requerimientos de analgésicos o que sufran de disforia a causa de los opioides, pero hay que tener en cuenta los efectos cardiovasculares adversos de estos fármacos, que van a contraindicar su uso en numerosos pacientes en estado crítico4. Y, por supuesto, la utilización de infusiones analgésicas no exime de la necesidad de realizar una analgesia multimodal, y del uso de terapias no farmacológicas para conseguir un tratamiento adecuado del dolor en el paciente4,38,61,62.
Bibliografía
- Duke T. Partial intravenous anesthesia in cats and dogs. The Canadian veterinary journal. 2013;54(3):276.
- Aguado D, Benito J, de Segura IAG. Reduction of the minimum alveolar concentration of isoflurane in dogs using a constant rate of infusion of lidocaine–ketamine in combination with either morphine or fentanyl. The Veterinary Journal. 2011;189(1):63-6.
- Steffey E, Mama K, Brosnan R. Inhalation anesthetics. In: Grimm K, Lamont L, Tranquilli W, Greene S, Robertson S, editors. Lumb and Jones Veterinary Anesthesia and Analgesia. 5th ed2015. p. 297-323.
- Hansen B. Analgesia for the critically ill dog or cat: an update. Vet Clin North Am Small Anim Pract. 2008;38(6):1353-63.
- Gutierrez‐Blanco E, Victoria‐Mora JM, Ibancovichi‐Camarillo JA, Sauri‐Arceo CH, Bolio‐González ME, Acevedo‐Arcique CM, et al. Postoperative analgesic effects of either a constant rate infusion of fentanyl, lidocaine, ketamine, dexmedetomidine, or the combination lidocaine‐ketamine‐dexmedetomidine after ovariohysterectomy in dogs. Vet Anaesth Analg. 2015;42(3):309-18.
- Zoff A, Bradbrook C. Constant rate infusions in small animal practice. Companion Animal. 2016;21(9):516-22.
- Hill S. Pharmacokinetics of drug infusions. Continuing education in anaesthesia, critical care & Pain. 2004;4(3):76-80.
- Fragen RJ. Drug infusions in anesthesiology: Raven Press (ID); 1991.
- Kästner SB. Injectable Anaesthetics. In: Duke-Novakovski T, Vries Md, Seymour C, editors. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Third ed. Gloucester, UK2016. p. 190-206.
- Sano T, Nishimura R, Kanazawa H, Igarashi E, Nagata Y, Mochizuki M, et al. Pharmacokinetics of fentanyl after single intravenous injection and constant rate infusion in dogs. Vet Anaesth Analg. 2006;33(4):266-73.
- Steagall PV, Neto FJT, Minto BW, Campagnol D, Corrêa MA. Evaluation of the isoflurane-sparing effects of lidocaine and fentanyl during surgery in dogs. J Am Vet Med Assoc. 2006;229(4):522-7.
- Grimm KA, Tranquilli WJ, Gross DR, Sisson DD, Bulmer BJ, Benson GJ, et al. Cardiopulmonary effects of fentanyl in conscious dogs and dogs sedated with a continuous rate infusion of medetomidine. Am J Vet Res. 2005;66(7):1222-6.
- Gutierrez-Blanco E, Victoria-Mora JM, Ibancovichi-Camarillo JA, Sauri-Arceo CH, Bolio-Gonzalez ME, Acevedo-Arcique CM, et al. Evaluation of the isoflurane-sparing effects of fentanyl, lidocaine, ketamine, dexmedetomidine, or the combination lidocaine-ketamine-dexmedetomidine during ovariohysterectomy in dogs. Vet Anaesth Analg. 2013;40(6):599-609.
- Simoes CR, Monteiro ER, Rangel JP, Nunes-Junior JS, Campagnol D. Effects of a prolonged infusion of fentanyl, with or without atropine, on the minimum alveolar concentration of isoflurane in dogs. Vet Anaesth Analg. 2016;43(2):136-44.
- Reilly S, Seddighi R, Egger CM, Rohrbach BW, Doherty TJ, Qu W, et al. The effect of fentanyl on the end-tidal sevoflurane concentration needed to prevent motor movement in dogs. Vet Anaesth Analg. 2013;40(3):290-6.
- Davis CA, Seddighi R, Cox SK, Sun X, Egger CM, Doherty TJ. Effect of fentanyl on the induction dose and minimum infusion rate of propofol preventing movement in dogs. Vet Anaesth Analg. 2017;44(4):727-37.
- Ambros B, Alcorn J, Duke-Novakovski T, Livingston A, Dowling PM. Pharmacokinetics and pharmacodynamics of a constant rate infusion of fentanyl (5 μg/kg/h) in awake cats. Am J Vet Res. 2014;75(8):716-21.
- Carrozzo MV, Alcorn J, Ambros B. Effects of two fentanyl constant rate infusions on thermal thresholds and plasma fentanyl concentrations in awake cats. Vet Anaesth Analg. 2018;45(6):831-8.
- Andreoni V, Hughes JL. Propofol and fentanyl infusions in dogs of various breeds undergoing surgery. Vet Anaesth Analg. 2009;36(6):523-31.
- Becker WM, Mama KR, Rao S, Palmer RH, Egger EL. Prevalence of dysphoria after fentanyl in dogs undergoing stifle surgery. Vet Surg. 2013;42(3):302-7.
- Michelsen LG, Hug Jr CC. The pharmacokinetics of remifentanil. J Clin Anesth. 1996;8(8):679-82.
- Michelsen LG, Salmenpera M, Hug J, Szlam F, VanderMeer D. Anesthetic potency of remifentanil in dogs. The Journal of the American Society of Anesthesiologists. 1996;84(4):865-72.
- Monteiro ER, Teixeira-Neto FJ, Campagnol D, Alvaides RK, Garofalo NA, Matsubara LM. Effects of remifentanil on the minimum alveolar concentration of isoflurane in dogs. Am J Vet Res. 2010;71(2):150-6.
- Murrell J, Wesselink van Notten R, Hellebrekers L. Clinical investigation of remifentanil and propofol for the total intravenous anaesthesia of dogs. Vet Rec. 2005;156(25):804-8.
- Ferreira TH, Aguiar AJ, Valverde A, Neto FJT, Steagall PV, Soares JH. Effect of remifentanil hydrochloride administered via constant rate infusion on the minimum alveolar concentration of isoflurane in cats. Am J Vet Res. 2009;70(5):581-8.
- Allweiler S, Brodbelt DC, Borer K, Hammond RA, Alibhai HI. The isoflurane-sparing and clinical effects of a constant rate infusion of remifentanil in dogs. Vet Anaesth Analg. 2007;34(6):388-93.
- Steagall PV, Aucoin M, Monteiro BP, Moreau M, Simon BT, Burns PM. Clinical effects of a constant rate infusion of remifentanil, alone or in combination with ketamine, in cats anesthetized with isoflurane. J Am Vet Med Assoc. 2015;246(9):976-81.
- Ruíz-López P, Navarrete-Calvo R, Morgaz J, Domínguez JM, Quirós-Carmona S, Muñoz-Rascón P, et al. Determination of acute tolerance and hyperalgesia to remifentanil constant rate infusion in dogs undergoing sevoflurane anaesthesia. Vet Anaesth Analg. 2020;47(2):183-90.
- Anagnostou TL, Kazakos GM, Savvas I, Papazoglou LG, Rallis TS, Raptopoulos D. Remifentanil/isoflurane anesthesia in five dogs with liver disease undergoing liver biopsy. J Am Anim Hosp Assoc. 2011;47(6):e103-e9.
- Van Wijnsberghe A-S, Marolf V, Claeys S, Sandersen C, Ida KK. Effects of fentanyl–lidocaine–ketamine versus sufentanil–lidocaine–ketamine on the isoflurane requirements in dogs undergoing total ear canal ablation and lateral bulla osteotomy. Vet Anaesth Analg. 2020;47(5):595-603.
- Murrell JC, Hellebrekers LJ. Medetomidine and dexmedetomidine: a review of cardiovascular effects and antinociceptive properties in the dog. Vet Anaesth Analg. 2005;32(3):117-27.
- Sinclair MD. A review of the physiological effects of alpha2-agonists related to the clinical use of medetomidine in small animal practice. Can Vet J. 2003;44(11):885-97.
- Pascoe PJ, Raekallio M, Kuusela E, McKusick B, Granholm M. Changes in the minimum alveolar concentration of isoflurane and some cardiopulmonary measurements during three continuous infusion rates of dexmedetomidine in dogs. Vet Anaesth Analg. 2006;33(2):97-103.
- Rioja E, Gianotti G, Valverde A. Clinical use of a low-dose medetomidine infusion in healthy dogs undergoing ovariohysterectomy. Canadian Veterinary Journal-Revue Veterinaire Canadienne. 2013;54(9):864-8.
- Souza SS, Intelisano TR, De Biaggi CP, Moura CA, Selmi AL, Dias RA, et al. Cardiopulmonary and isoflurane-sparing effects of epidural or intravenous infusion of dexmedetomidine in cats undergoing surgery with epidural lidocaine. Vet Anaesth Analg. 2010;37(2):106-15.
- Uilenreef JJ, Murrell JC, McKusick BC, Hellebrekers LJ. Dexmedetomidine continuous rate infusion during isoflurane anaesthesia in canine surgical patients. Vet Anaesth Analg. 2008;35(1):1-12.
- Martinez-Taboada F, Leece EA. Comparison of propofol with ketofol, a propofol-ketamine admixture, for induction of anaesthesia in healthy dogs. Vet Anaesth Analg. 2014;41(6):575-82.
- Lamont LA. Adjunctive analgesic therapy in veterinary medicine. Vet Clin North Am Small Anim Pract. 2008;38(6):1187-203.
- Kaka U, Saifullah B, Abubakar AA, Goh YM, Fakurazi S, Kaka A, et al. Serum concentration of ketamine and antinociceptive effects of ketamine and ketamine-lidocaine infusions in conscious dogs. BMC Vet Res. 2016;12(1):198.
- Kaka U, Rahman N-A, Abubakar AA, Goh YM, Fakurazi S, Omar MA, et al. Pre-emptive multimodal analgesia with tramadol and ketamine–lidocaine infusion for suppression of central sensitization in a dog model of ovariohysterectomy. J Pain Res. 2018;11:743.
- Sarrau S, Jourdan J, Dupuis‐Soyris F, Verwaerde P. Effects of postoperative ketamine infusion on pain control and feeding behaviour in bitches undergoing mastectomy. J Small Anim Pract. 2007;48(12):670-6.
- Wagner AE, Walton JA, Hellyer PW, Gaynor JS, Mama KR. Use of low doses of ketamine administered by constant rate infusion as an adjunct for postoperative analgesia in dogs. J Am Vet Med Assoc. 2002;221(1):72-5.
- Haskins S. Monitoring Anesthetized Patients. In: Grimm K, Lamont L, Tranquilli W, Greene S, Robertson S, editors. Lumb and Jones Veterinary Anesthesia and Analgesia. 5th ed: John Wiley and Sons; 2015. p. 297-323.
- Ortega M, Cruz I. Evaluation of a constant rate infusion of lidocaine for balanced anesthesia in dogs undergoing surgery. The Canadian Veterinary Journal. 2011;52(8):856.
- Tsai TY, Chang SK, Chou PY, Yeh LS. Comparison of postoperative effects between lidocaine infusion, meloxicam, and their combination in dogs undergoing ovariohysterectomy. Vet Anaesth Analg. 2013;40(6):615-22.
- Valverde A, Doherty TJ, Hernández J, Davies W. Effect of lidocaine on the minimum alveolar concentration of isoflurane in dogs. Vet Anaesth Analg. 2004;31(4):264-71.
- Pypendop BH, Ilkiw JE. The effects of intravenous lidocaine administration on the minimum alveolar concentration of isoflurane in cats. Anesth Analg. 2005;100(1):97-101.
- Lauretti GR. Mechanisms of analgesia of intravenous lidocaine. Rev Bras Anestesiol. 2008;58(3):280-6.
- Matsubara LM, Oliva VN, Gabas DT, Oliveira GC, Cassetari ML. Effect of lidocaine on the minimum alveolar concentration of sevoflurane in dogs. Vet Anaesth Analg. 2009;36(5):407-13.
- Muir WW, Wiese AJ, March PA. Effects of morphine, lidocaine, ketamine, and morphine-lidocaine-ketamine drug combination on minimum alveolar concentration in dogs anesthetized with isoflurane. Am J Vet Res. 2003;64(9):1155-60.
- Ebner LS, Lerche P, Bednarski RM, Hubbell JA. Effect of dexmedetomidine, morphine-lidocaine-ketamine, and dexmedetomidine-morphine-lidocaine-ketamine constant rate infusions on the minimum alveolar concentration of isoflurane and bispectral index in dogs. Am J Vet Res. 2013;74(7):963-70.
- Kalamaras AB, Aarnes TK, Moore SA, Jones SC, Pereira CR, Peng J, et al. Effects of perioperative saphenous and sciatic nerve blocks, lumbosacral epidural or morphine–lidocaine–ketamine infusion on postoperative pain and sedation in dogs undergoing tibial plateau leveling osteotomy. Vet Anaesth Analg. 2021;48(3):415-21.
- Alves IPG, Nicácio GM, Diniz MS, Rocha TLA, Kanashiro GP, Cassu RN. Analgesic comparison of systemic lidocaine, morphine or lidocaine plus morphine infusion in dogs undergoing fracture repair. Acta Cir Bras. 2014;29:245-51.
- Wilson J, Doherty TJ, Egger CM, Fidler A, Cox S, Rohrbach B. Effects of intravenous lidocaine, ketamine, and the combination on the minimum alveolar concentration of sevoflurane in dogs. Vet Anaesth Analg. 2008;35(4):289-96.
- Mitra A, Thorat M, Raulkar R, Tayade K, Jadhav A, Pawar K, et al. Clinical evaluation of multimodal analgesia for optimum post-operative pain management in dogs undergoing ovariohysterectomy. 2021.
- Corrêa JMX, Niella RV, Oliveira JNSd, Silva Junior AC, Marques CSdC, Pinto TM, et al. Antinociceptive and analgesic effect of continuous intravenous infusion of maropitant, lidocaine and ketamine alone or in combination in cats undergoing ovariohysterectomy. Acta Vet Scand. 2021;63(1):1-8.
- Moran-Muñoz R, Ibancovichi JA, Gutierrez-Blanco E, Acevedo-Arcique CM, Victoria Mora JM, Tendillo FJ, et al. Effects of Lidocaine, Dexmedetomidine or Their Combination on the Minimum Alveolar Concentration of Sevoflurane in Dogs. J Vet Med Sci. 2014;76(6):847-53.
- Acevedo-Arcique CM, Ibancovichi JA, Chavez JR, Gutierrez-Blanco E, Moran-Munoz R, Victoria-Mora JM, et al. Lidocaine, Dexmedetomidine and Their Combination Reduce Isoflurane Minimum Alveolar Concentration in Dogs. PLoS One. 2014;9(9):5.
- Gomez A, Al‐Tannak N, Auckburally A, Watson D, Flaherty D. Stability of dilutions of methadone alone, and in combination with lidocaine and ketamine. J Small Anim Pract. 2022.
- Wilson KM, Schneider JJ, Ravenscroft PJ. Stability of midazolam and fentanyl in infusion solutions. J Pain Symptom Manage. 1998;16(1):52-8.
- Johnson JA. Treatment of acute pain in cats. Pain management in veterinary practice. 2013:275-88.
- Lamont L, Mathews K. Opioids, nonsteriodal antiinflammatories, and analgesic adjuvants. In: Tranquilli W, Thurmon J, Grimm K, editors. Lumb & Jones’ Veterinary Anesthesia and Analgesia. 4th ed. Ames, IA, USA: Blackwell; 2007. p. 241-71.
 by Multimédica
by Multimédica