Manejo anestésico en pacientes con obstrucción urinaria
Resumen breve
La obstrucción urinaria comprende un conjunto de patologías que dan lugar a la imposibilidad de micción espontánea por parte del paciente. La obstrucción urinaria puede ser debida a una obstrucción física o anatómica, como presencia de cálculos o tapones a nivel ureteral o uretral, presencia de masas o inflamación; o bien de tipo funcional, como la disinergia refleja. Lo más frecuente es la obstrucción urinaria debida a la presencia de cálculos, y suele ocurrir en machos debido al menor…Índice de contenidos
Introducción
La obstrucción urinaria comprende un conjunto de patologías que dan lugar a la imposibilidad de micción espontánea por parte del paciente. La obstrucción urinaria puede ser debida a una obstrucción física o anatómica, como presencia de cálculos o tapones a nivel ureteral o uretral, presencia de masas o inflamación; o bien de tipo funcional, como la disinergia refleja. Lo más frecuente es la obstrucción urinaria debida a la presencia de cálculos, y suele ocurrir en machos debido al menor diámetro de la uretra a nivel postprostático o peneano1.
En gatos, se reconoce como entidad propia la enfermedad del tracto urinario inferior felino o síndrome urológico felino (FLUTD, por sus siglas en inglés, “(Feline Lower Urinary Tract Disease”), que da lugar a obstrucción urinaria2. Aunque en muchos casos de FLUTD no se identifica la causa específica y se reconocen como idiopáticas, en otros casos la obstrucción se produce por tapones uretrales compuestos por una matriz proteica procedentes de células de descamación combinadas con cristales urinarios, y en otros casos la obstrucción es debida a cálculos. En cualquier caso, tanto en la especie canina como felina, es fundamental resolver de forma temprana la obstrucción para evitar una mayor descompensación del paciente debido a fallo renal y desequilibrios electrolíticos y de ácido-base3.
Además, en casos de obstrucción urinaria prolongada puede llegar a producirse la rotura de la vejiga, dando lugar a uroabdomen. Éste también puede producirse por un traumatismo4.
Estos pacientes suelen requerir sedación para realizar el sondaje de la uretra y resolver la obstrucción urinaria, aunque a veces no es suficiente con una sedación y es necesario realizar anestesia general5. También será necesario realizar anestesia general en caso de no poder resolver la obstrucción mediante sondaje de la uretra, si la obstrucción se localiza en uréteres o si es necesario realizar cistotomía para extraer los cálculos retropropulsados a la vejiga, p. ej. En estos casos, debe llevarse a cabo un procedimiento quirúrgico como p. ej. uretrostomía, ureterotomía o cistotomía6. Son numerosos los procedimientos que pueden requerirse para llevar a cabo la resolución de la obstrucción urinaria, según la etiopatogenia de la misma (Figuras 1 y 2).
Fisiopatología de la obstrucción urinaria
La obstrucción uretral aguda se asemeja a la obstrucción ureteral en cuanto a cambios fisiopatológicos que afectan a los riñones. La obstrucción del flujo de orina, a nivel uretral, da lugar a un incremento de la presión vesical y uretral proximal al sitio o sitios de la obstrucción2. Por un lado, la presión local debida a la presencia de urolitos o tapones de matriz cristalina daña la mucosa uretral. A medida que aumenta la presión intravesical, se produce daño en el urotelio y el músculo detrusor7. Los nervios ubicados en la pared de la vejiga también se dañan y se produce un infiltrado de células inflamatorias. Conforme persiste el incremento de presión, se ven afectados uréteres y riñones, de forma semejante ocurre en el caso de una obstrucción ureteral bilateral7.
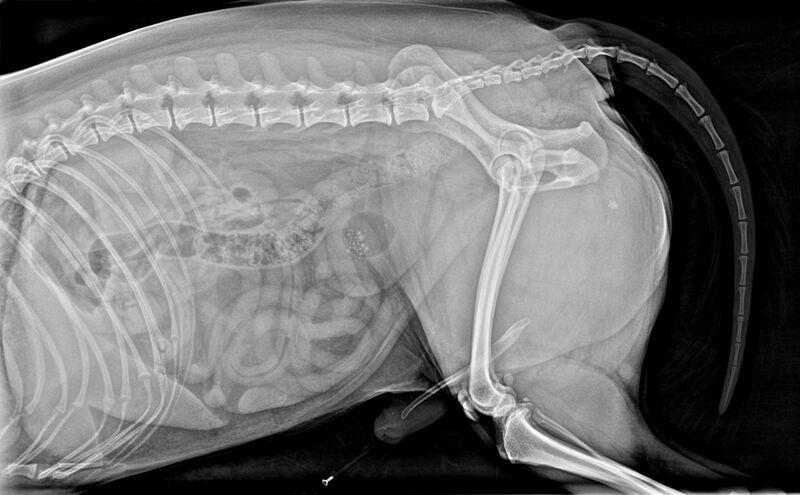
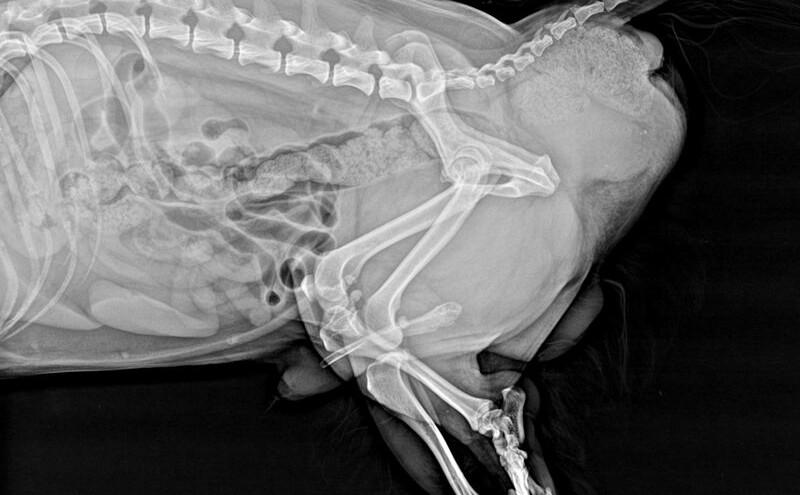
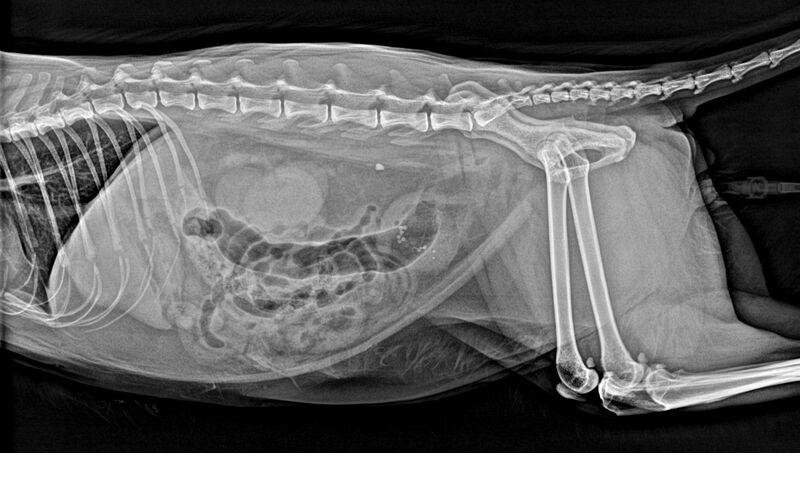
A medida que aumenta la presión en los uréteres, inicialmente se produce un incremento del flujo sanguíneo renal debido a la liberación de prostaglandinas vasodilatadoras, que producen una vasodilatación de las arteriolas aferentes renales. Posteriormente, se produce vasoconstricción preglomerular y disminución del flujo sanguíneo renal, disminuyendo la tasa de filtración glomerular7.
La disminución de la tasa de filtración glomerular y del flujo sanguíneo renal produce azotemia, hiperkalemia e hiperfosfatemia, y el daño renal derivado de estos cambios dependerá de la duración de la obstrucción. El daño de las nefronas puede producir tanto un fallo renal agudo como una insuficiencia renal crónica. Por tanto, es fundamental realizar un tratamiento rápido, de cara a reducir el daño potencial sobre el parénquima renal y la probabilidad de fallo renal. De hecho, la capacidad de recuperación de la tasa de filtración glomerular tras la resolución de la obstrucción disminuye conforme aumenta el tiempo de obstrucción2.
Tras la resolución de la obstrucción, aumenta el flujo sanguíneo renal, lo que aumenta el filtrado glomerular, pero con un déficit en la capacidad de concentración de la orina y, por la acumulación de urea y productos nitrogenados, se da lugar a una diuresis osmótica que requiere de monitorización para evitar un déficit de fluidos en el paciente. Por otra parte, tras la obstrucción se incrementa la excreción de potasio debido a una alteración de los mecanismos homeostáticos de excreción. Así, los pacientes pueden desarrollar un aumento de la diuresis, junto con hipokalemia, por lo que será recomendable monitorizar la diuresis y la concentración de potasio en sangre tras el procedimiento.
Signos clínicos y valoración preanestésica
La presentación clínica del animal y la gravedad de la sintomatología, así como de las alteraciones analíticas guardan relación con la duración de la obstrucción urinaria y/o uroabdomen y también dependen de si la obstrucción es total o parcial8. Así, animales con obstrucciones agudas, de menos de 24 horas, habitualmente presentan alteraciones mínimas y no suelen presentar inestabilidad a nivel cardiovascular, mientras que obstrucciones más prolongadas, de más de 36 horas, pueden ocasionar un estado de shock con alteraciones analíticas severas que requieren una estabilización y tratamiento rápidos del paciente, previos a la sedación o anestesia9,10.
En perros, los signos clínicos incluyen estranguria en la mayoría de los pacientes, seguido de disuria, polaquiuria o incontinencia urinaria por rebosamiento, hematuria, anorexia y, en menor frecuencia, vómitos11.
Los gatos con FLUTD se caracterizan por presentar signos clínicos tales como depresión, vómitos, deshidratación, anorexia, estranguria y cambios comportamentales como maullidos insistentes y visitas frecuentes al cajón de arena o eliminación inadecuada9. Algunos de los signos referidos o descritos en consulta en estudios previos en gatos con FLUTD se recogen en la Tabla 1. En consulta estos pacientes acuden principalmente por estranguria o hematuria9.En este punto cabe destacar el hecho de que la obstrucción urinaria es una patología muy dolorosa, por lo que debe tenerse en cuenta de cara al tratamiento y evaluación posterior del paciente.
| Tabla 1. Signos clínicos descritos en gatos con FLUTD. |
| Presentación clínica en gatos con FLUTD | Porcentaje de aparición |
| Estranguria | 84% |
| Retención urinaria con distensión vesical | 42% |
| Anorexia | 39% |
| Vómitos | 31% |
| Oligodipsia | 19% |
| Hematuria | 12% |
| Adipsia, babeo y eliminación inadecuada | 4% |
Exploración física
Los pacientes que presentan obstrucción urinaria pueden presentarse con hipotermia, fundamentalmente en gatos con obstrucción urinaria prolongada (de más de 36 horas). La hipotermia es un signo clínico muy común, describiéndose con una frecuencia de entre 39-68% en estudios previos en pacientes de la especie felina3,10. También se ha descrito la presencia de taquicardia pese a presentar hiperkalemia, lo cual puede deberse a la situación de estrés y dolor en el paciente, que desencadena una activación de la respuesta simpática y podría contrarrestar la posible bradicardia debida a hiperkalemia.
Aunque no es muy frecuente la presencia de taquipnea en gatos, puede observarse fundamentalmente debida al estrés y dolor del paciente, así como a una posible respuesta compensadora a la acidosis metabólica del paciente. En cuanto al estado mental, cabe destacar que este puede verse ampliamente modificado según la duración del proceso obstructivo, de tal manera que, en obstrucciones agudas de menos de 24 horas de evolución, la mayoría de los pacientes se presentan alertas, pero también en estados de depresión o letargia.
Sin embargo, en pacientes con obstrucción urinaria de más de 36 horas de evolución, aumenta la proporción de pacientes que presentan depresión del estado mental, con letargia o estupor9. Esto debe tenerse en cuenta a la hora de realizar la sedación y/o anestesia general del paciente, puesto que son pacientes debilitados en los que los requerimientos de fármacos sedantes y/o anestésicos están disminuidos y, por consiguiente, la probabilidad de producir una sobredosis farmacológica está incrementada.
Aquellos pacientes con uroabdomen presentarán signos clínicos asociados a la causa que lo provoque. En casos de uroabdomen por causas no traumáticas, como es el caso de la obstrucción urinaria (a nivel uretral), los pacientes presentarán incapacidad para orinar con dolor en cavidad abdominal4,12.
Analítica sanguínea
Ante un paciente en el que se sospeche de obstrucción urinaria y/o uroabdomen, se recomienda obtener una muestra de sangre para realizar, al menos, hematocrito, urea, creatinina, potasio y lactato. Esto permitirá conocer de qué valores se parte de cara a estabilizar al paciente y poder realizar un seguimiento de los cambios durante el tratamiento. Lo ideal será realizar un hemograma y bioquímica completos, con especial atención a la concentración sérica de electrolitos (potasio principalmente y también fósforo y calcio). Si es posible la obtención de sangre venosa central (vena yugular) para realización de gasometría permitirá conocer el valor de pH, la presión de dióxido de carbono, exceso de base y concentración de bicarbonato para valorar la presencia de acidosis o alcalosis.
Tanto la obstrucción urinaria como el uroabdomen dan lugar a azotemia postrenal con incrementos marcados tanto de urea como de creatinina, hiperkalemia y acidosis metabólica, que pueden empeorar el pronóstico del paciente si no se corrigen8. Es frecuente encontrar alteraciones de ácido-base mixtas, con acidosis metabólica (acidosis urémica y láctica) y acidosis o alcalosis respiratoria (dependiendo de factores como la condición del sistema respiratorio, el grado de dolor en el paciente o la depresión del sistema nervioso central, entre otros).
Otras alteraciones analíticas frecuentes en pacientes con obstrucción urinaria son hiperfosfatemia, hipocalcemia, hiperlactatemia, exceso de bases negativo (relacionado con acidosis metabólica) o anemia. Además, la existencia de otras alteraciones analíticas dependerá de la presencia de patologías concomitantes. Así, si presentan insuficiencia renal crónica, pueden presentar anemia (por pérdidas digestivas debidas a ulceración gástrica, o deficiencia de eritropoyetina), hipoalbuminemia e hipertensión sistémica.
Pruebas complementarias
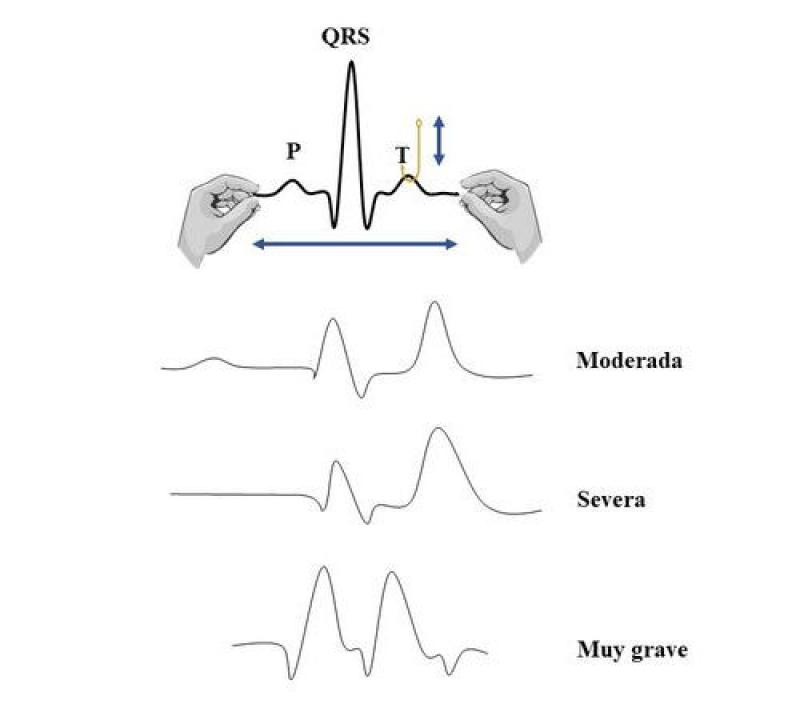
También está indicada la realización de electrocardiograma (ECG) como parte de la evaluación preanestésica del paciente, ya que la presencia de hiperkalemia o hipocalcemia puede dar lugar a alteraciones en el ECG, aunque un ECG normal no excluye la presencia de tales alteraciones. Normalmente las alteraciones en el ECG ocurren cuando la concentración de potasio es superior a 7 mmol o mEq/L6. Las alteraciones electrocardiográficas a consecuencia del incremento de potasio en sangre suelen comenzar con bradicardia que progresa a un incremento marcado de la amplitud de la onda T que adquiere un aspecto estrecho y puntiagudo, reducción o desaparición de la onda P, mayor duración del complejo QRS con acortamiento del intervalo QT hasta aparición de onda sinusoidal, que es cuando el complejo QRS se fusiona con la onda T en valores superiores a 10 mEq/L13 (Figura 3).
En pacientes con hiperkalemia aguda puede observarse taquicardia sinusal, taquicardia ventricular y taquicardia de complejo ancho. Aunque inicialmente se describe bradicardia en casos de hiperkalemia, el estrés, dolor o compensación hemodinámica del paciente pueden enmascarar dicha bradicardia9. En estas situaciones el tratamiento con lidocaína está contraindicado, ya que puede desencadenar fibrilación ventricular o asistolia.
Estabilización preanestésica
Antes de administrar fármacos sedantes, se debe llevar a cabo una estabilización previa del paciente, encaminada a disminuir la concentración sérica de potasio. La hiperkalemia puede producir debilidad muscular, disminución de la excitabilidad miocárdica y disminución de la conducción intracardiaca, por lo que es una situación grave por la mayor predisposición a arritmias14.
Los tratamientos para disminuir la concentración sérica de potasio pretenden llevar a cabo bien una dilución del mismo o bien la movilización de potasio al interior celular. El tratamiento de la hiperkalemia incluye la administración de fluidos, la administración de dextrosa junto con insulina, y la administración de bicarbonato15 (Tabla 2).
| Tabla 2. Resumen de los tratamientos para disminuir la concentración de potasio en sangre. |
| Tratamiento | Dosis o pauta recomendad | Comentarios |
| Fluidoterapia (NaCI 0,9%, Ringer Lactato, Isofundin) | 20 ml/kg (perros) o 10-15 ml/kg (gatos) en bolo durante 20 o 30 minutos seguido de 5-10 ml/kg/h según estado del paciente* | En pacientes con la vejiga llena se debe tener precaución y/o realizar cristocentesis |
| Insulina | 0,25-0,5 UI/kg, IV en boleto lento. Otros autores describen una dosis de 0,1-0,5 UI/kg de insulina regular6. | Administrar glucosa/dextrosa de forma simultánea y monitoritzar glucemia. |
| Glucosa | 1-2 gramos de glucosa al 50% por cada UI de insulina administrada, en bolo IV lento = 2-4 mL de glucosa, diluido en 8-16 mL de suero cristaloide isotónico. Seguido de una infusión intravenosa continua de glucosa (2,5-5% en cristaloide isotónico) | No administrar una solución de dextrosa concentrada a más del 10% en una vena periférica por riesgo de flebitis. |
| Bicarbonato de sodio | Dosis total = defecto de bases (BE) x 0,3 x peso corporal (kg). Comezar por 1/3 y reevaluar. O bien administrar 0,5-2 mmol/kg IV y reevaluar. | Solo si pH<7,1, BE≤12 mmol/L o bicarbonato < 12 mol/L |
*Recomendacióngeneral, que puede modificarse según estado del paciente y plan de fluidoterapia a establecer (ver apartado de fluidoterapia).
La administración de fluidoterapia por vía intravenosa (IV) puede realizarse mediante cristaloides isotónicos que no contienen potasio en su composición, como solución salina (NaCl 0,9%) para tratar de diluir el potasio en sangre, o mediante soluciones tamponadas (Ringer Lactato o Isofundin) para corregir la acidosis metabólica16.
La administración de solución NaCl 0,9% puede producir acidosis hiperclorémica, por lo que en animales con acidosis puede ser más recomendable administrar soluciones tamponadas como Ringer Lactato o Isofundin17. Aunque estas tienen una mayor concentración de potasio, su administración tiene un efecto de dilución de la concentración de potasio17,18. En la tabla 3 se observa la composición electrolítica y osmolaridad de los fluidos cristaloides indicados.
| Tabla 3. Característiques de osmolaridad y composición de fluidos cristaloides isotónicos. |
| Características | NaCI 0,9% | Ringer Lactato | Isofundin |
| Osmolaridad | 308 | 275 | 309 |
| Na* | 154 | 131 | 145 |
| K* | - | 5 | 4 |
| CI | 154 | 112 | 127 |
| Ca ionizado | - | 3 | 2,5 |
| Sustancia tampón | - | Lactato | Acetato, malato |
Otro tratamiento para corregir la hiperkalemia consiste en la administración de una solución de insulina para movilizar el potasio al interior celular19, junto con dextrosa o glucosa para evitar producir hipoglucemia. En este caso, debe monitorizarse estrechamente la glucemia para evitar hipoglucemia.
La administración de bicarbonato de sodio se recomienda únicamente en animales cuya función ventilatoria está mantenida, puesto que será necesaria para eliminar el exceso de dióxido de carbono generado de forma compensatoria tras la administración de bicarbonato, y en pacientes con acidosis metabólica grave. Su administración está asociada a efectos adversos tales como acidosis intracelular paradójica, disminución de la concentración de calcio ionizado, hipotensión y descenso del gasto cardiaco16.
Otro tratamiento encaminado a evitar los efectos cardiotóxicos de la hiperkalemia es la administración de gluconato cálcico. Este estabiliza el potencial de membrana en reposo y disminuye el umbral del potencial de acción, evitando la aparición de arritmias que amenacen la vida del paciente16. Su administración está indicada cuando se observan alteraciones en el ECG, junto con la administración de tratamientos encaminados a disminuir la concentración plasmática de potasio19. Se administra en bolo intravenoso lento al 10% (50-100 mg/kg; 0,5-1,0 mL/kg en 5-10 minutos) mientras se monitorizan los cambios en el ECG6, 8. Sus efectos duran entre 20 y 30 minutos.
Manejo anestésico
En general, en la sedación y/o anestesia general de estos pacientes deben tenerse en cuenta las mismas consideraciones que para un paciente con enfermedad renal, puesto que se presentan azotémicos y con cierto compromiso en estos órganos, lo que incrementa la morbi-mortalidad anestésica. Además, como en todo procedimiento anestésico, se recomienda realizar una anestesia equilibrada con el fin de reducir la dosis de fármacos y con ello sus potenciales efectos adversos asociados a la dosis utilizada20.
Es fundamental conseguir un acceso venoso permeable para poder estabilizar al animal previamente con fluidoterapia, y para administrar la sedación, aunque en pacientes poco cooperativos o agresivos será necesario administrar la sedación por vía intramuscular.
Premedicación
La obstrucción urinaria es un proceso muy doloroso, por lo que se debe incluir un fármaco analgésico en el protocolo de sedación/anestesia general, preferentemente un opioide agonista de los receptores mu (metadona, fentanilo o petidina), por su mayor efecto analgésico. Su utilización permitirá producir ansiolisis y sedación en el paciente, así como una mejor cobertura analgésica en caso de requerir un procedimiento quirúrgico posterior al sondaje. El uso de opioides agonistas mu también permite reducir la dosis de otros fármacos anestésicos durante la inducción y mantenimiento anestésicos21.
Respecto a fármacos sedantes, su utilización dependerá del carácter y el estado del paciente. En pacientes en estado de shock, no se recomienda usar fármacos agonistas de los receptores adrenérgicos α2, como la medetomidina o dexmedetomidina, ni fenotiacinas como acepromacina ya que pueden descompensar más al paciente a nivel cardiovascular. En pacientes debilitados o en shock puede ser suficiente con un fármaco opioide únicamente o combinado con benzodiacepina, que puede ayudar a relajar la uretra y favorecer su cateterización, además de ser seguras desde el punto de vista cardiorrespiratorio y disminuir las dosis de fármacos anestésicos durante la inducción y mantenimiento anestésicos.
En aquellos pacientes con obstrucción aguda, que no presenten inestabilidad cardiorrespiratoria o cuyo carácter requiera un mayor grado de sedación, pueden emplearse fármacos agonistas de los receptores adrenérgicos α2, ya que la menor duración de su efecto sedante permitirá una recuperación más rápida del paciente frente a otros sedantes de mayor duración como la acepromacina. En la Tabla 4 se incluyen algunos ejemplos de protocolos de sedación empleados en experiencia de la autora, en pacientes no descompensados. En este punto, cabe destacar que estos protocolos simplemente son orientativos, y deben utilizarse siempre previa evaluación del paciente y justificarse según el procedimiento, estado del paciente y experiencia del anestesiólogo.
| Tabla 4. Ejemplos de protocolos de sedación en perro y gato con obstrucción urinaria. |
| Via de administración | Fármacos (dosis) | Especie | Comentario |
| IM | Alfaxalona (1 mg/kg) Metadona (0,3 mg/kg) o petidina (5 mg/Kg) Midazolam (0,2 mg/kg) | Gato | En paciente agresivo, se puede combinar con dexmedetomidina 5-8 µg/kg. |
| IV | Alfaxalona (0,5 mg/kg) Metadona (0,3 mg/kg) Midazolam (0,2 mg/kg) | Gato | Nunca administrar petidina por vía intravenosa. En paciente poco cooperativo que esté estable puede añadirse dexmedetomidina 1-2 µg/kg. |
| IM | Metadona (0,3 mg/kg) Midazolam (0,3-0,4 mg/kg) | Perro | En paciente agresivo, se puede combinar con dexmedetomidina 3 µg/kg. En pacientes que no están debilitados, el uso de midazolam como único sedante puede producir excitación paradójica. |
| IV | Metadona (0,2 mg/kg) Midazolam (0,2 mg/kg) | Perro | En paciente poco cooperativo que esté estable puede añadirse dexmedetomidina 1-2 µg/kg. |
La ketamina en gatos se elimina de forma inalterada por los riñones, por lo que puede retrasarse su eliminación en pacientes con fallo renal. Aunque su uso ha sido tradicionalmente muy extendido para la sedación en pacientes felinos agresivos, actualmente se disponen de otras opciones para potenciar la sedación como la alfaxalona, que puede administrarse por vía intramuscular22,23, sin los efectos adversos de la ketamina como la mayor duración de la recuperación y el mayor riesgo a nivel renal24.
Para facilitar el sondaje uretral, además de sedar al paciente para evitar mayor daño a la uretra, se ha descrito la utilización de atracurio administrado vía intrauretral para producir relajación de la musculatura estriada uretral y facilitar la resolución de la obstrucción25, sin los efectos asociados a su administración a nivel sistémico. Los autores de este artículo emplearon 0,2 mL de atracurio diluido en 3,8 mL de suero NaCl 0,9% estéril, con un volumen final de 4 mL y una concentración de 0,5 mg/mL previo al flushing retrógrado de la uretra para movilizar tapones uretrales. Aunque el uso de este fármaco se ha descrito en gatos para obstrucciones uretrales distales, podría ser efectivo en perros.
Inducción
En estos pacientes tiene especial importancia realizar una preoxigenación adecuada, ya que pueden presentarse anémicos. La acidosis da lugar a una disminución de la afinidad de la hemoglobina por el oxígeno y desplaza la curva de disociación de la hemoglobina hacia la derecha, lo que puede dar lugar a hipoxemia24,26.
En estos pacientes, es recomendable no incrementar la posible depresión cardiovascular que presente el paciente. Por ello, deberá realizarse una monitorización previa del animal, especialmente encaminada a la detección de arritmias y la medición de la presión arterial. En cuanto a fármacos, pueden emplearse propofol (0,5-4 mg/kg), alfaxalona (0,5-3 mg/kg) o etomidato (1-2 mg/kg) por vía intravenosa, administrados a dosis efecto. También se pueden llevar a cabo combinaciones de estos fármacos hipnóticos junto con benzodiacepinas (midazolam 0,2-0,3 mg/kg) u opioides (fentanilo 2-4 µg/kg) IV.
La combinación con estos fármacos permitirá reducir la dosis del hipnótico principal y, con ello, sus posibles efectos adversos. Para realizar una inducción anestésica mediante la combinación de fármacos, se recomienda administrar inicialmente una dosis menor del hipnótico principal, seguida del fármaco adyuvante (benzodiacepina o fentanilo, p. ej.) y evaluar el efecto. En caso necesario, se administrarán dosis incrementales a efecto hasta obtener las condiciones adecuadas para la intubación endotraqueal del paciente, siguiendo las recomendaciones generales de cualquier anestesia (como p. ej., la instilación de lidocaína para la intubación en gatos).
Un aspecto a tener en cuenta en estos pacientes es el riesgo de sobredosis con los fármacos anestésicos debido a cambios en ionización, perfil farmacocinético y excreción disminuida en casos de fallo renal24. La presencia de uremia produce un incremento de la permeabilidad de la barrera hematoencefálica, por lo que pueden tener una mayor sensibilidad a los anestésicos. Esto debe tenerse en cuenta a la hora de dosificar los fármacos anestésicos en todo momento (premedicación, inducción, mantenimiento), por lo que las dosis indicadas son orientativas y debe evaluarse el estado de cada paciente de forma individualizada27.
Mantenimiento
Pueden emplearse anestésicos inhalatorios como isoflurano o sevoflurano, llevando a cabo una técnica de anestesia equilibrada que permita reducir la incidencia de los efectos adversos de estos fármacos20. El uso de sedantes en la premedicación, así como la administración concurrente de otros fármacos durante el mantenimiento anestésico (infusiones analgésicas, anestesia local) permitirá reducir la concentración espirada de anestésicos inhalatorios.
Otra opción para el mantenimiento de la anestesia general es la utilización de anestesia intravenosa total, mediante propofol en infusión continua (0,2-0,4 mg/kg/minuto)28,29, aunque su uso en infusiones prolongadas (>120 minutos) en gatos no se recomienda por la formación de cuerpos de Heinz, posible anemia por lesión oxidativa y retraso en la recuperación30. De nuevo, la administración de propofol puede combinarse con otros fármacos sedantes, hipnóticos o analgésicos que permitan reducir la dosis y no sean perjudiciales para el estado del paciente, como benzodiacepinas u opioides. Aunque la administración de alfaxalona en infusión continua produce hipnosis con buena estabilidad cardiovascular, se ha descrito una recuperación anestésica de baja calidad31.
Fluidoterapia
Es necesaria la administración de fluidoterapia en estos pacientes, tanto de cara a realizar una estabilización previa, corregir la acidosis, azotemia e hiperkalemia, y para compensar las pérdidas de fluidos que puedan producirse (intangibles y urinarias) (Figura 4). Además, cobra especial importancia en pacientes con enfermedad renal crónica, que presentan frecuentemente deshidratación e hipovolemia.


Sin embargo, la administración de fluidos debe ser racional y guiada por objetivos para no producir hemodilución en el paciente o peores consecuencias como una sobrecarga de fluidos27.
No existe una recomendación concreta sobre la tasa de fluidoterapia más adecuada en estos pacientes. En la fase preanestésica o de estabilización, puede ser necesario administrar dosis de shock en forma de bolos repetidos según sea necesario, seguido posteriormente de una velocidad para seguir compensando o reemplazando el déficit de fluidos, y junto con una velocidad de mantenimiento32, que es la cantidad de líquido estimada para mantener el equilibrio normal de líquidos del paciente33. La velocidad de mantenimiento recomendada en perros es de 2-6 mL/kg/h y en gatos de 2-3 mL/kg/h34.
En general, las recomendaciones al instaurar un plan de fluidoterapia son emplear fluidos de composición, en cantidad y velocidad similar al de las pérdidas producidas y evaluadas de forma individual en el paciente. La velocidad de administración de fluidos puede calcularse según las pérdidas estimadas o medidas de líquido en el paciente, para lo cual se tendrán en cuenta las pérdidas insensibles (por respiración fundamentalmente, cuya velocidad de reposición es de 1 mL/kg/h), las pérdidas digestivas (en caso de diarrea o vómito) y urinarias (según la producción normal de orina que es de 1-2 mL/kg/h), el grado de deshidratación preexistente [Deshidratación (%) x Peso corporal (kg) x 1000 = Déficit de líquidos (mililitros)] o pérdidas de sangre (dependerá de la cantidad de sangre perdida)33. En el caso concreto de pacientes con obstrucción urinaria, se deberán tener en cuenta el estado físico del paciente y la presencia de alteraciones electrolíticas y el tratamiento de las mismas35,36.
Monitorización y complicaciones
Las principales complicaciones anestésicas descritas en pacientes con obstrucción urinaria son hipotermia (fundamentalmente en gatos)27,37, hipotensión y bradicardia8.En estos pacientes, se recomienda llevar a cabo una monitorización completa de los sistemas cardiovascular, respiratorio y la temperatura corporal. Por tanto, se deberá monitorizar frecuencia cardiaca y ritmo mediante ECG, presión arterial preferentemente de forma invasiva, saturación de oxígeno de la hemoglobina mediante pulsioximetría, frecuencia respiratoria, nivel de dióxido de carbono espirado mediante capnometría y capnografía, parámetros de mecánica ventilatoria del paciente (en cuanto a volúmenes y presiones) y temperatura rectal o esofágica38.
La monitorización de ECG se recomienda para poder detectar la presencia de arritmias y alteraciones en la frecuencia cardiaca. La capnografía permitirá determinar la idoneidad de la ventilación y la necesidad de ventilación mecánica, ya que en estos pacientes es importante evitar la hipercapnia para no producir un mayor grado de acidosis. La pulsioximetría debe utilizarse tanto durante la anestesia como durante la recuperación del paciente, ya que la anemia presente en muchos de ellos disminuirá la capacidad de transporte de oxígeno, por lo que la saturación de oxígeno de la hemoglobina deberá mantenerse por encima del 96% e incluso realizar suplementación de oxígeno de más del 50% en caso necesario.
La duración de la anestesia es uno de los factores que se ha asociado a la aparición de hipotermia y al desarrollo de complicaciones intraoperatorias37,39. Por ello, es fundamental prestar especial atención a instaurar medidas encaminadas a limitar las pérdidas de temperatura en el paciente, y a tratar la hipotermia de forma temprana para minimizar su impacto40, como utilizar mantas de aire o agua caliente, aislantes con la mesa de quirófano o tratar de cubrir al animal con una manta durante la preparación para minimizar las pérdidas de temperatura.
Además, el riesgo de aparición de complicaciones durante o después de la anestesia guardia relación con el estado físico previo del paciente y la gravedad de la patología. Se ha descrito que factores como edad avanzada, estado físico deficiente, presencia de acidosis severa, hiperkalemia y aumento de creatinina son factores que podrían utilizarse como factores pronóstico en pacientes con obstrucción urinaria8. Por otro lado, la presencia de patología concomitantes, como p. ej., cardiomiopatía hipertrófica en gatos, puede incrementar la morbi-mortalidad anestésica41,42.
Como se ha comentado previamente, en la anestesia de los pacientes con obstrucción urinaria deben tenerse en cuenta las mismas consideraciones que para un paciente con enfermedad renal, y ello incluye la monitorización y tratamiento de las complicaciones intraoperatorias con especial atención a la hipotensión, para evitar hipoxia renal durante la anestesia y evitar producir un mayor daño renal19.
A nivel postoperatorio, las complicaciones más frecuentes descritas son dolor, anorexia, náuseas, hipertensión y problemas relacionados con el tracto urinario. Por tanto, esto refleja de nuevo que el componente nociceptivo-doloroso está muy presente en estos pacientes y es necesario su adecuado reconocimiento, valoración y tratamiento27, de cara a un procedimiento exitoso y una recuperación temprana del paciente43.
Además, dados los tratamientos instaurados para el tratamiento de la hiperpotasemia, será necesario:
- Monitorizar la glucemia tras la administración de insulina.
- Determinar la producción urinaria.
- Monitorizar el ECG hasta la normalización de la concentración sérica de potasio.
- Reevaluar la concentración sérica de potasio.
- Reevaluar la necesidad de continuar con los tratamientos instaurados y reevaluar la velocidad y tipo de fluidoterapia.
Este último punto también dependerá del estado físico del animal, que debe evaluarse posteriormente como en cualquier otro paciente, prestando especial atención a las alteraciones analíticas presentes antes del procedimiento.
Diuresis postobstructiva
En pacientes con obstrucción urinaria es fundamental monitorizar la producción de orina tras el procedimiento para poder establecer el régimen de fluidoterapia más adecuado según las pérdidas de líquido en el paciente y para detectar un posible fallo renal oligúrico o anúrico. En pacientes en los que se resuelve la obstrucción urinaria, puede ocurrir un aumento de la diuresis postobstructiva, que se define como una producción urinaria superior a 2 mL/kg/h tras 6 horas después de la obstrucción44.
Esta diuresis postobstructiva se acompaña de un incremento de la excreción de potasio, por lo que se puede producir hipokalemia. Por ello, será recomendable monitorizar la concentración sérica de potasio de forma regular tras el procedimiento, a fin de determinar si es necesario llevar a cabo una suplementación de potasio8. En la tabla 5 se indica la suplementación de potasio por vía parenteral en pacientes con hipokalemia.
| Tabla 5. Suplementación de potasio en pacientes con hipokalemia. |
| Potasio sérico (mmol/L o mEq/L) | Cloruro potásico (KCI) en mEq a añadir a 1 L de NaCI 0,9%* | Velocidad máxima de infusión (mL/kG/h) |
| <2 | 80 | 6 |
| 2,1-2,5 | 60 | 8 |
| 2,6-3 | 40 | 12 |
| 3,1-3,5 | 28 | 18 |
Analgesia
Además del uso de fármacos opioides agonistas de los receptores mu opioides, será recomendable la realización de técnicas de anestesia local, siempre y cuando el estado clínico del paciente lo permita, ya que bloquean totalmente el estímulo nociceptivo, permite disminuir los requerimientos de anestésicos y sus efectos adversos relacionados con la dosis, así como la respuesta de estrés a la estimulación quirúrgica45.
En aquellos pacientes con obstrucción urinaria a nivel uretral, puede realizarse una anestesia epidural a nivel lumbosacro (perros) (Figura 5) o sacrococcígeo (más recomendable en gatos, aunque también puede emplearse en perros), que permite bloquear el estímulo nociceptivo procedente de la cola, pene o vulva, ano y periné mediante el bloqueo sensitivo de los nervios pudendos, pelvianos y caudales46. Además, puede ayudar a la desobstrucción de la uretra y la cateterización uretral47.


Sin embargo, la administración neuraxial de anestésicos locales puede producir bloqueo simpático y vasodilatación con hipotensión. Por otro lado, la administración neuraxial de fármacos está contraindicada en animales urémicos por la predisposición a trombocitopatías y hemorragia asociada a nivel epidural. Por tanto, debe realizarse una evaluación y selección del paciente. Como fármacos, se pueden emplear lidocaína o bupivacaína como anestésicos locales (a 0,2 mL/kg), en función de la duración del bloqueo deseada, combinada con un opioide como morfina (sin conservantes, a dosis de 0,1 mg/kg), para prolongar el efecto analgésico (de 12 a 24 horas). Sin embargo, la administración de morfina puede producir retención urinaria48, lo que deberá tenerse en cuenta si el paciente no va a permanecer sondado durante el postoperatorio. Otra opción es la administración de buprenorfina (4 µg/kg), que disminuye el riesgo de retención urinaria48,49.
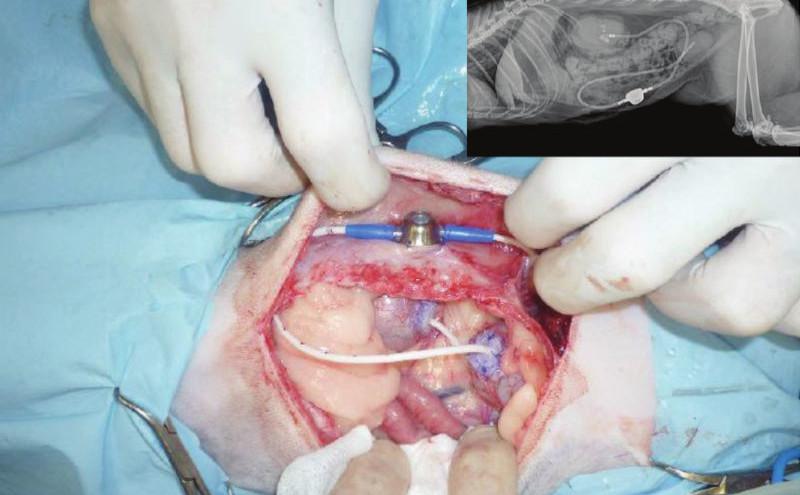
En aquellos procedimientos que involucren cavidad abdominal como cistotomía o colocación de bypass ureteral subcutáneo, se puede emplear bupivacaína a nivel intraperitoneal. Esta técnica sencilla permite aportar analgesia sin los efectos cardiovasculares de la anestesia epidural, y se ha visto que ha sido efectiva en perros y gatos sometidos a ovariohisterectomía50,51. La dosis empleada de bupivacaína es de 2 mg/kg en gatos y 3-4 mg/kg en perros, diluida en suero NaCl 0,9% estéril, en proporción 1:1, y se administra previamente al cierre de las capas musculares abdominales.
Cuidados postoperatorios
Aunque ya se han adelantado diversos aspectos sobre la monitorización y cuidados del paciente en el periodo postoperatorio, de cara a seguimiento y estabilización de alteraciones electrolíticas y acidosis, cabe destacar de nuevo la importancia de la analgesia postoperatoria. Esta es fundamental para mejorar el bienestar del paciente y favorecer una recuperación rápida, dada la importancia del componente de estrés-nociceptivo en parte de la etiología de la obstrucción urinaria, sobre todo en pacientes felinos. Además, es importante disminuir la respuesta al estrés porque puede producir una mayor hipoperfusión renal.
Durante el periodo postoperatorio, se deberá evaluar el dolor y administrar analgésicos. En casos de dolor severo, se recomienda administrar analgésicos opioides agonistas mu como metadona por vía IV o IM (0,2 o 0,3 mg/kg, respectivamente, cada 4 horas). En pacientes con dolor leve, puede emplearse buprenorfina (8-12 µg/kg, vía IV, IM u oral transmucosa)52.
Bibliografía
- Filippich LJ. Chapter 11 - The cat straining to urinate. In: Rand J, editor. Problem-Based Feline Medicine. Edinburgh: W.B. Saunders; 2006. p. 173-92.
- Bartges J. Pathophysiology of urinary obstruction. Nephrology and Urology of Small Animals. 2011:707-9.
- Lee JA, Drobatz KJ. Characterization of the clinical characteristics, electrolytes, acid–base, and renal parameters in male cats with urethral obstruction. Journal of Veterinary Emergency and Critical Care. 2003;13(4):227-33.
- Stafford JR, Bartges JW. A clinical review of pathophysiology, diagnosis, and treatment of uroabdomen in the dog and cat. J Vet Emerg Crit Care (San Antonio). 2013;23(2):216-29.
- Osborne CA, Kruger JM, Lulich JP, Bartges JW, Polzin DJ. Medical Management of Feline Urethral Obstruction. Vet Clin North Am Small Anim Pract. 1996;26(3):483-98.
- George CM, Grauer GF. Feline urethral obstruction: Diagnosis & management. Today’s Veterinary Practice. 2016;6(4):36-46.
- Klahr S. Obstructive nephropathy. Intern Med. 2000;39(5):355-61.
- Garcia de Carellan Mateo A, Brodbelt D, Kulendra N, Alibhai H. Retrospective study of the perioperative management and complications of ureteral obstruction in 37 cats. Vet Anaesth Analg. 2015;42(6):570-9.
- Neri AM, de Araújo Machado LH, Guimarães Okamoto PT, Filippi MG, Takahira RK, Melchert A, et al. Routine Screening Examinations in Attendance of Cats With Obstructive Lower Urinary Tract Disease. Top Companion Anim Med. 2016;31(4):140-5.
- Segev G, Livne H, Ranen E, Lavy E. Urethral obstruction in cats: predisposing factors, clinical, clinicopathological characteristics and prognosis. J Feline Med Surg. 2011;13(2):101-8.
- McMillan SK, Knapp DW, Ramos-Vara JA, Bonney PL, Adams LG. Outcome of urethral stent placement for management of urethral obstruction secondary to transitional cell carcinoma in dogs: 19 cases (2007–2010). J Am Vet Med Assoc. 2012;241(12):1627-32.
- Grimes JA, Fletcher JM, Schmiedt CW. Outcomes in dogs with uroabdomen: 43 cases (2006-2015). J Am Vet Med Assoc. 2018;252(1):92-7.
- Tilley LP, Smith FWK. Electrocardiography. In: Tilley LP, editor. Manual of Canine and Feline Cardiology: Elsevier Health Sciences; 2008. p. 49-77.
- Kogika MM, de Morais HA. A Quick Reference on Hyperkalemia. Vet Clin North Am Small Anim Pract. 2017;47(2):223-8.
- Ettinger SJ, Feldman EC, Cote E. Textbook of Veterinary Internal Medicine-eBook: Elsevier health sciences; 2017.
- Chambers D, Huang C, Matthews G. Basic physiology for anaesthetists: Cambridge University Press; 2019.
- Drobatz KJ, Cole SG. The influence of crystalloid type on acid–base and electrolyte status of cats with urethral obstruction. Journal of Veterinary Emergency and Critical Care. 2008;18(4):355-61.
- Cunha MG, Freitas GC, Carregaro AB, Gomes K, Cunha JPM, Beckmann DV, et al. Renal and cardiorespiratory effects of treatment with lactated Ringer's solution or physiologic saline (0.9% NaCl) solution in cats with experimentally induced urethral obstruction. Am J Vet Res. 2010;71(7):840-6.
- Dobromylskyj P. Urogenital disease. In: Duke-Novakovski T, Vries Md, Seymour C, editors. BSAVA manual of canine and feline anaesthesia and analgesia: British Small Animal Veterinary Association; 2016. p. 257-64.
- Ilkiw JE. Balanced anesthetic techniques in dogs and cats. Clin Tech Small Anim Pract. 1999;14(1):27-37.
- Kerr CL. Pain management I: systemic analgesics. BSAVA Manual of canine and feline anaesthesia and analgesia. 2016:124-42.
- Tamura J, Ishizuka T, Fukui S, Oyama N, Kawase K, Itami T, et al. Sedative effects of intramuscular alfaxalone administered to cats. J Vet Med Sci. 2015;77(8):897-904.
- Tamura J, Ishizuka T, Fukui S, Oyama N, Kawase K, Miyoshi K, et al. The pharmacological effects of the anesthetic alfaxalone after intramuscular administration to dogs. J Vet Med Sci. 2015;77(3):289-96.
- Freitas GC, da Cunha MG, Gomes K, da Cunha JP, Togni M, Pippi NL, et al. Acid-base and biochemical stabilization and quality of recovery in male cats with urethral obstruction and anesthetized with propofol or a combination of ketamine and diazepam. Can J Vet Res. 2012;76(3):201-8.
- Galluzzi F, De Rensis F, Menozzi A, Spattini G. Effect of intraurethral administration of atracurium besylate in male cats with urethral plugs. J Small Anim Pract. 2012;53(7):411-5.
- Shepard M, Brainard B. Hematologic disorders. Canine and Feline Anesthesia and Co‐Existing Disease. 2022:395-425.
- Luca GC, Monteiro BP, Dunn M, Steagall PV. A retrospective study of anesthesia for subcutaneous ureteral bypass placement in cats: 27 cases. J Vet Med Sci. 2017:16-0382.
- Caines D, Sinclair M, Valverde A, Dyson D, Gaitero L, Wood D. Comparison of isoflurane and propofol for maintenance of anesthesia in dogs with intracranial disease undergoing magnetic resonance imaging. Vet Anaesth Analg. 2014;41(5):468-79.
- Beths T. TIVA/TCI in Veterinary Practice. Total Intravenous Anesthesia and Target Controlled Infusions: Springer; 2017. p. 589-618.
- Court MH. Feline drug metabolism and disposition: pharmacokinetic evidence for species differences and molecular mechanisms. Vet Clin North Am Small Anim Pract. 2013;43(5):1039-54.
- Bustamante R, Gómez de Segura IA, Canfrán S, Aguado D. Effects of ketamine or midazolam continuous rate infusions on alfaxalone total intravenous anaesthesia requirements and recovery quality in healthy dogs: a randomized clinical trial. Vet Anaesth Analg. 2020;47(4):437-46.
- Cooper ES. Controversies in the management of feline urethral obstruction. Journal of Veterinary Emergency and Critical Care. 2015;25(1):130-7.
- Davis H, Jensen T, Johnson A, Knowles P, Meyer R, Rucinsky R, et al. 2013 AAHA/AAFP fluid therapy guidelines for dogs and cats. J Am Anim Hosp Assoc. 2013;49(3):149-59.
- DiBartola SP, Bateman S. Introduction to fluid therapy. Fluid Therapy in Small Animal Practice, ed. 2006;2:265-80.
- DiBartola SP. Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice-E-Book: Elsevier Health Sciences; 2011.
- Fantoni D, Shih AC. Perioperative fluid therapy. Veterinary Clinics: Small Animal Practice. 2017;47(2):423-34.
- Redondo JI, Suesta P, Gil L, Soler G, Serra I, Soler C. Retrospective study of the prevalence of postanaesthetic hypothermia in cats. Vet Rec. 2012;170(8):206.
- Haskins S. Monitoring Anesthetized Patients. In: Grimm K, Lamont L, Tranquilli W, Greene S, Robertson S, editors. Lumb and Jones Veterinary Anesthesia and Analgesia. 5th ed: John Wiley and Sons; 2015. p. 297-323.
- Brodbelt DC, Blissitt KJ, Hammond RA, Neath PJ, Young LE, Pfeiffer DU, et al. The risk of death: the confidential enquiry into perioperative small animal fatalities. Vet Anaesth Analg. 2008;35(5):365-73.
- Armstrong SR, Roberts BK, Aronsohn M. Perioperative hypothermia. Journal of Veterinary Emergency and Critical Care. 2005;15(1):32-7.
- Hreybe H, Zahid M, Sonel A, Good CB, Shaver J, Saba S. Noncardiac surgery and the risk of death and other cardiovascular events in patients with hypertrophic cardiomyopathy. Clinical Cardiology: An International Indexed and Peer‐Reviewed Journal for Advances in the Treatment of Cardiovascular Disease. 2006;29(2):65-8.
- Roberts SF, Aronson LR, Brown DC. Postoperative mortality in cats after ureterolithotomy. Vet Surg. 2011;40(4):438-43.
- Hellyer P, Rodan I, Brunt J, Downing R, Hagedorn JE, Robertson SA, et al. AAHA/AAFP pain management guidelines or dogs and cats. J Feline Med Surg. 2007;9(6):466-80.
- Francis BJ, Wells RJ, Rao S, Hackett TB. Retrospective study to characterize post-obstructive diuresis in cats with urethral obstruction. J Feline Med Surg. 2010;12(8):606-8.
- Grubb T, Lobprise H. Local and regional anaesthesia in dogs and cats: Descriptions of specific local and regional techniques (Part 2). Vet Med Sci. 2020;6(2):218-34.
- Otero PE, Portela DA. Manual de anestesia regional en animales de compañia. Anatomia para bloqueos guiados por ecografía y neuroestimulación: Inter-Médica; 2017.
- O'Hearn AK, Wright BD. Coccygeal epidural with local anesthetic for catheterization and pain management in the treatment of feline urethral obstruction. J Vet Emerg Crit Care (San Antonio). 2011;21(1):50-2.
- Steagall PVM, Simon BT, Teixeira Neto FJ, Luna SPL. An Update on Drugs Used for Lumbosacral Epidural Anesthesia and Analgesia in Dogs. Front Vet Sci. 2017;4:68.
- Smith LJ, Yu JK-A. A comparison of epidural buprenorphine with epidural morphine for postoperative analgesia following stifle surgery in dogs. Vet Anaesth Analg. 2001;28(2):87-96.
- Guerrero KSK, Campagna I, Bruhl-Day R, Hegamin-Younger C, Guerrero TG. Intraperitoneal bupivacaine with or without incisional bupivacaine for postoperative analgesia in dogs undergoing ovariohysterectomy. Vet Anaesth Analg. 2016;43(5):571-8.
- Benito J, Monteiro B, Lavoie A-M, Beauchamp G, Lascelles BDX, Steagall PV. Analgesic efficacy of intraperitoneal administration of bupivacaine in cats. J Feline Med Surg. 2016;18(11):906-12.
- Giordano T, Steagall PV, Ferreira TH, Minto BW, de Sa Lorena SE, Brondani J, et al. Postoperative analgesic effects of intravenous, intramuscular, subcutaneous or oral transmucosal buprenorphine administered to cats undergoing ovariohysterectomy. Vet Anaesth Analg. 2010;37(4):357-66.
 by Multimédica
by Multimédica