Introducción a los equipos de tomografía computarizada y resonancia magnética nuclear y aspectos comparativos en la obtención de imágenes
Resumen breve
Alejandro López MoralesÍndice de contenidos
Introducción
resonancia magnética nuclear y aspectos comparativos en la obtención de imágenes
Alejandro López Morales
Hospital veterinari Molins. Sant Vicenç dels Horts, Barcelona.
Resumen
El acceso a nuevas tecnologías por parte de los hospitales veterinarios para la obtención de imágenes que permitan el diagnóstico de los pacientes en veterinaria, pone de manifiesto la necesidad de conocer los principios de funcionamiento y características de estos equipos. Estos son los equipos de tomografía computarizada y resonancia magnética nuclear.
Son técnicas de imagen que aportan diferente información y pueden complementarse entre ellas, también en conjunto con otras técnicas y pruebas diagnósticas, brindando un amplio abanico de recursos para los profesionales veterinarios.
Ambas técnicas emplean principios físicos diferentes y serán fundamentales las medidas de seguridad como una parte importante de los aspectos a conocer. Las ventajas e inconvenientes de cada técnica serán expuestas de manera comparativa entre ellas con el fin de ofrecer una visión general de su funcionamiento.
El presente artículo tiene un carácter claramente introductorio en la descripción de ambas tecnologías, aportando una descripción general de sus aplicaciones en la clínica veterinaria y con un enfoque visual en la comparativa entre las imágenes de las técnicas presentadas.
Las imágenes de los estudios de TC del presente artículo han sido obtenidas con un equipo de tercera generación de 2 cortes. Las imágenes de resonancia magnética nuclear han sido obtenidas con un equipo de bajo campo de 0,5T.
Introducción
La tomografía computarizada y la resonancia magnética nuclear irrumpen en la historia de la medicina distanciadas por pocos años y se consolidan como instrumentos indispensables para el diagnóstico inmediatamente, ofreciendo un nuevo campo de conocimiento en la medicina veterinaria.
Con el objetivo de detallar los puntos fuertes y también las limitaciones de cada técnica se describe el funcionamiento del equipo de tomografía computarizada (TC) y del equipo de resonancia magnética nuclear (RMN), aportando variada documentación gráfica para apoyar las explicaciones con las que los auxiliares veterinarios pueden estar menos familiarizados.
Las posibilidades de emplear una modalidad de imagen u otra responden a diversos factores, siempre a criterio facultativo, y supeditado a la disponibilidad de dichos equipos en el centro veterinario.
Introducción a la tomografía computarizada
En su origen, recibe el nombre de tomografía axial computarizada (TAC) debido a que sólo permite la realización de cortes en plano axial. Este término queda en desuso actualmente, denominándose tomografía computarizada (TC), ya que los estudios de TC de los nuevos equipos permiten la visualización de las imágenes en cualquier plano del espacio. La tomografía computarizada permite obtener imágenes de las regiones sometidas a estudio mediante el uso de radiación ionizante, al igual que en radiología convencional, pero con la ventaja de eliminar la superposición de estructuras.
Favorece la realización de estudios en tiempos cortos lo cual reduce el tiempo anestésico del paciente y los datos adquiridos pueden procesarse posteriormente sin necesidad de mantener al paciente bajo sedación.
El equipo de TC
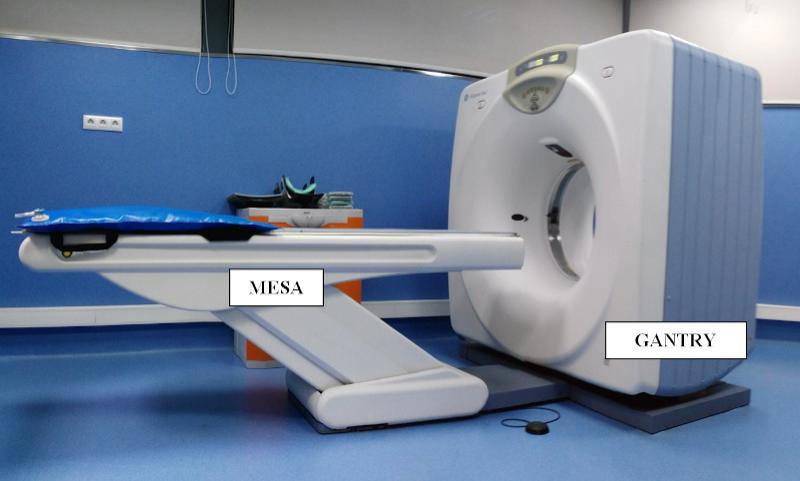
Gantry
El gantry, o estativo en español, es la estructura de mayor tamaño del equipo y da soporte al sistema de detectores y al tubo emisor de rayos X (Figura 1). Al conjunto de tubo emisor y detectores se le denomina sistema tubo-detector. El orificio central es la zona donde se realiza el estudio, permitiendo el paso de la mesa y el paciente a través de él. El sistema tubo-detector rota en el interior del gantry a alta velocidad y la combinación del sistema tubo-detector junto con el desplazamiento de la mesa de exploraciones permite la adquisición de estudios en modo secuencial (también denominado axial) o helicoidal.
La mesa motorizada se desplaza durante el posicionamiento del paciente y también durante la adquisición de las imágenes. Dos haces láser se proyectan sobre el paciente en el orificio central del gantry permitiendo situar el isocentro del estudio, el punto de referencia a partir del cual se realizará la adquisición de imágenes. La figura 2 y la figura 3 muestran un gantry sin armazón para la realización de su mantenimiento.


Tubo de rayos X
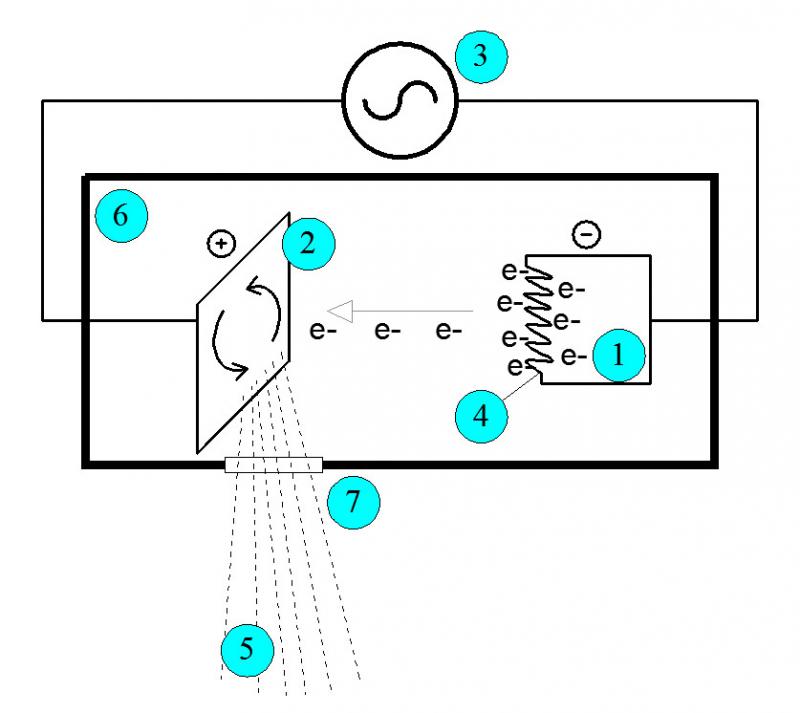
Los equipos de TC emplean un tubo emisor de rayos X. Su funcionamiento, de manera simplificada, es el siguiente (Figura 4).
Se disponen dos electrodos, cátodo (1) y ánodo (2), en un tubo de vidrio al vacío. Ambos electrodos están conectados a una fuente de energía eléctrica (3). El cátodo, con carga negativa, está compuesto por un filamento de tungsteno (número atómico elevado) (4) y el ánodo, con carga positiva, es una pieza sólida, también de tungsteno. Se aplica una corriente eléctrica de baja intensidad por el filamento de tungsteno del cátodo con el fin de facilitar la emisión de los electrones de sus átomos, formando una nube de electrones alrededor del filamento mediante un fenómeno físico denominado efecto termoiónico.
A continuación, se hace circular una corriente eléctrica de alta intensidad (40-125 kV) entre ánodo y cátodo, volviendo el ánodo muy positivo. Esto provoca que los electrones evaporados, los cuales tienen carga eléctrica negativa, se sientan atraídos por el ánodo. Los electrones se desplazan hasta el ánodo, adquiriendo energía cinética.
Los electrones impactan contra el ánodo de tungsteno y, debido a la interacción de los electrones incidentes con los átomos de tungsteno, se produce la emisión de fotones de rayos X (5). Un armazón de plomo (6) blinda el tubo y sólo permite la salida del haz de fotones de rayos X por una pequeña superficie denominada ventana (7), en dirección al paciente y al sistema detector.
Sistema de detección
En posición opuesta al tubo emisor de rayos X se sitúan los detectores. Pueden estar compuestos por una sola fila de celdillas detectoras (TC monocorte) o por varias filas (TC multicorte). Los TC multicorte permiten adquirir varios cortes (imágenes) por cada giro del sistema tubo-detector.
Filtros y colimadores
Los filtros permiten homogeneizar la energía del haz, evitando que los fotones menos energéticos lleguen al paciente pues no tendrán utilidad en la formación de la imagen. El haz homogeneizado se denomina haz monocromático ya que los fotones que lo componen tienen energías similares.
Los colimadores definirán la forma y tamaño del haz y reducirán la radiación dispersa que llega al detector.
Adquisición de imágenes en TC
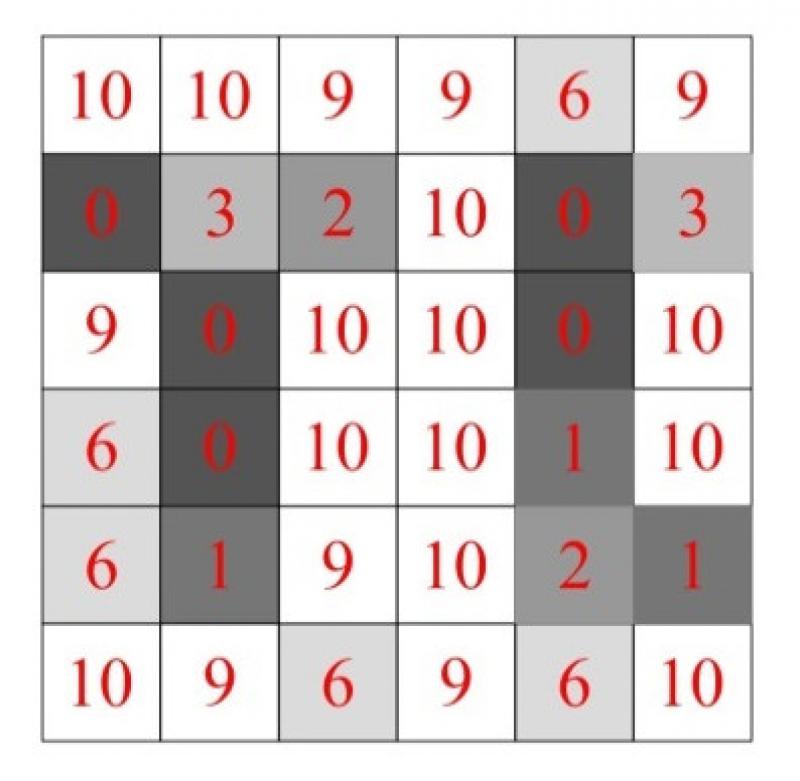
El haz de rayos X, al atravesar el tejido biológico del paciente, forma un mapa de atenuaciones (expresado en unidades Hounsfield, en adelante UH). Los tejidos de mayor densidad atenúan en mayor grado el haz, por lo que los fotones atenuados alcanzan el detector con menor energía. La energía con la que los fotones llegan al detector es transformada en una señal eléctrica cuantificable, que tiene relación directa con la energía del fotón incidente. La medida de esta señal eléctrica será expresada como un valor de densidad (en UH) y será recogida en una matriz de datos, que posteriormente será utilizada para generar una imagen asignando un valor UH a cada pixel de la matriz de imagen (Figura 5).
La matriz de imagen de los equipos de TC es fija y define el número de píxeles que tendrá cada imagen adquirida. El tamaño de matriz habitual es de 512x512 píxeles.
Modo secuencial y modo helicoidal
La sincronización del movimiento de la mesa donde se sitúa el paciente y la velocidad de giro del sistema tubo-detector nos permite obtener las imágenes de dos modos:
- Secuencial, o axial: la mesa se desplaza, se detiene y el sistema tubo-detector realiza un giro de 360º alrededor del paciente, obteniendo la imagen. A continuación, se repite el proceso.
- Helicoidal: la mesa se desplaza de manera ininterrumpida a la vez que el sistema tubo-detector rota a alta velocidad. Forma un movimiento en espiral. Es el modo más utilizado ya que permite el estudio de estructuras grandes como tórax o abdomen en tiempos cortos.
El equipo permite la selección del modo deseado en el momento de programar el estudio.
Sistemas monocorte y multicorte
El sistema detector puede disponer de una sola fila de detectores o bien, varias filas alineadas que permiten la obtención de un número mayor de cortes por cada giro completo del sistema tubo-detector. Los equipos más modernos disponen de detectores con 64, 128 o 256 filas, reduciendo los tiempos de exploración. En el ámbito veterinario se dispone de equipos más modestos, como el empleado para la adquisición de las imágenes del presente artículo, que consta de 2 cortes.
Parámetros
El voltaje (expresado en kV) define la energía de los electrones acelerados en el tubo de rayos X, la capacidad de penetración de los fotones de rayos X y el contraste de la imagen.
El amperaje (expresado en mA) define el número de electrones generados en el filamento de tungsteno y, por tanto, la cantidad de fotones que tendrá el haz de rayos X. Un aumento del miliamperaje implica una mayor cantidad de fotones en el haz que alcanzará el sistema detector, reduce el ruido de la imagen mejorando la calidad pero también supone un aumento en la dosis recibida por el paciente.
La carga (expresada como mA/s) es el producto del miliamperaje por el tiempo de exposición. Expresa la dosis de radiación que recibe el paciente.
La duración del estudio dependerá de la zona abarcada. Será interesante reducir el tiempo de exposición tanto como sea posible para la radioprotección del paciente y para evitar artefactos por movimiento en tórax y abdomen. Tiempos largos de exposición reducen la expectativa de vida del tubo de rayos X.
La imagen en TC
En TC cada imagen se divide en pequeñas porciones denominas píxeles. La cantidad de píxeles dependerá de la matriz de imagen, que es fija para cada equipo y no puede alterarse.
Cada pixel que forma la imagen obtenida tiene una profundidad determinada por el grosor de corte (el espesor de la rebanada, con la que se ha “cortado” al paciente). Las dimensiones del pixel (altura y anchura) y el grosor de corte forman el voxel. Se podría decir que un voxel es un cubo (x, y, z) que contiene información sobre una pequeña región del corte anatómico que se ha estudiado. Todas las imágenes de TC tienen profundidad (son tridimensionales), por lo que cada imagen está compuesta por miles de voxels. Cada voxel tiene asociado un coeficiente de atenuación (UH), valor promediado a partir de todos los datos de la matriz de datos obtenida durante la adquisición del estudio. El voxel es el determinante de la resolución espacial en TC.
El concepto “ventana” en TC y las unidades Hounsfield
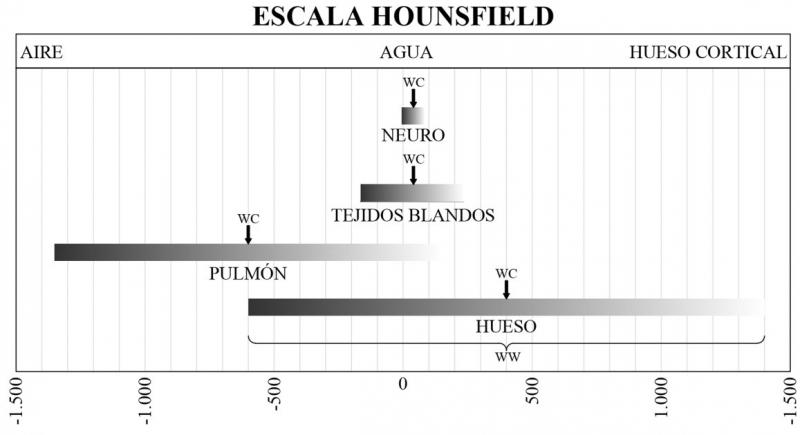
Un equipo de TC puede registrar más de 3.000 tonalidades de gris de las diferentes densidades de los tejidos del organismo, expresando los diferentes coeficientes de atenuación (UH) según la absorción de los fotones de rayos X por parte de los tejidos (depende de su composición química). Estas tonalidades de gris se expresan en unidades Hounsfield. La escala Hounsfield es la disposición de todos los tonos de gris capaces de ser representados por el equipo de TC asignándoles un valor numérico. Por ejemplo, desde -1.000 hasta 1.000, correspondiendo a -1.000 los tejidos de menor densidad y a 1.000 los tejidos más densos.
El monitor de la estación de trabajo mostrará las imágenes con hasta 256 tonos diferentes, desde el blanco hasta el negro, pero por cuestiones fisiológicas la visión humana no es capaz de diferenciar más de 40 tonos de gris. Ante la imposibilidad de ver todos los tonos mostrados por el equipo, hay que asociar cada UH con un determinado número de tonos de gris, acotando así el rango de densidades visibles en pantalla. Este rango de UH visibles se denominan “ventana”.
La ventana de visualización determina cómo se ve la imagen de TC. Las ventanas tienen rangos definidos para la visualización de regiones o tejidos determinados. Por ejemplo, la ventana “abdomen” permite la visualización de los tejidos blandos. Es una ventana con un rango estrecho ya que las densidades a valorar son muy similares entre ellas; la composición química es muy parecida. La ventana “hueso”, al contrario, está configurada con un rango de unidades Hounsfield mucho mayor para poder valorar tejidos de muy diferente densidad. Cada ventana lleva asociada un valor que indica su amplitud (WW) y también un nivel (WC), o centro, que expresa en qué UH de la escala Hounsfield se sitúa el punto medio del rango (Tabla 1 y Figura 6).
| Tabla 1. Unidades Hounsfield de las ventanas más habituales. |
| Tejido | WW | WC | Tipo de ventana |
| Hueso | 2.000 | 400 | Ancha |
| Pulmón | 1.500 | -600 | Ancha |
| Tejidos blandos | 400 | 35 | Estrecha |
| Neuro | 90 | -40 | Estrecha |
A las imágenes del estudio realizado se les aplica un filtro, también denominado kernel o algoritmo de reconstrucción, que tiene como finalidad mejorar la visualización de las imágenes. Es un procesamiento matemático de los datos adquiridos.
Existen varios tipos de kernel pero pueden reducirse a dos tipos: duro y blando. El kernel duro es más restrictivo (filtra más información de la matriz de datos), mejora la resolución espacial pero introduce ruido en la imagen. El kernel blando es menos restrictivo, reduce el ruido de la imagen pero también reduce la resolución espacial.
Debe existir congruencia entre la ventana de visualización y el kernel aplicado. En ventanas “pulmón” y “hueso” se emplea un kernel duro y en ventanas “abdomen” y “neuro” uno blando (Figuras 7 y 8).
El kernel es un filtro de postprocesado y no tiene incidencia en la dosis de radiación absorbida por el paciente ya que no altera los parámetros de exposición de la adquisición.
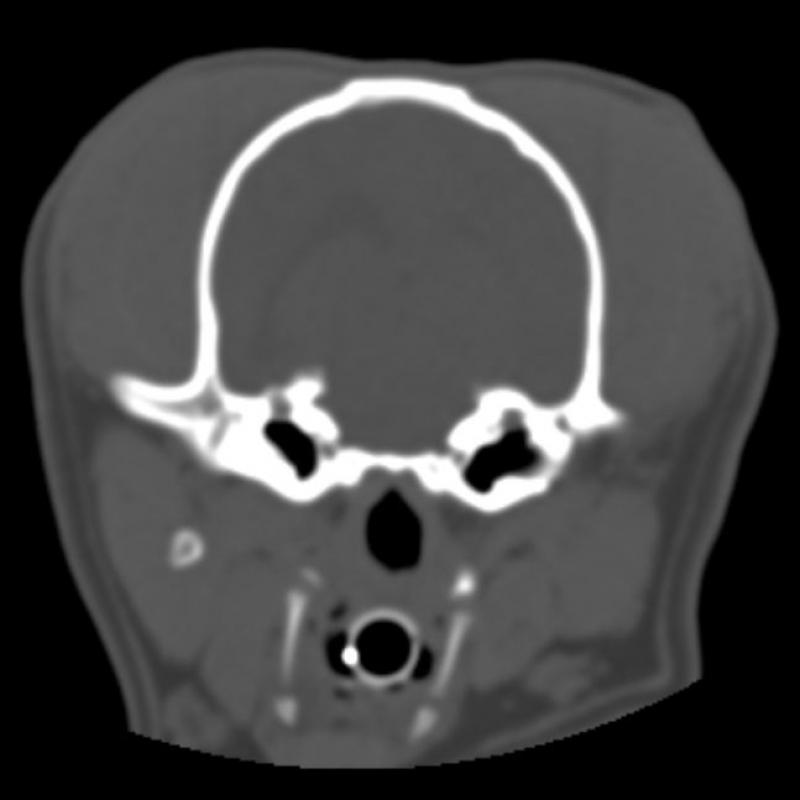
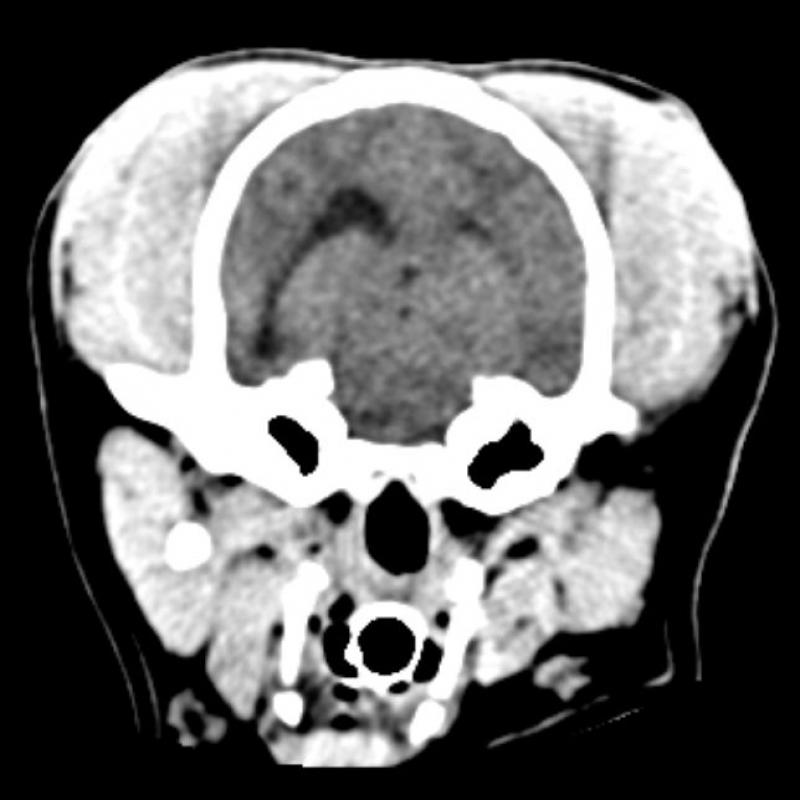
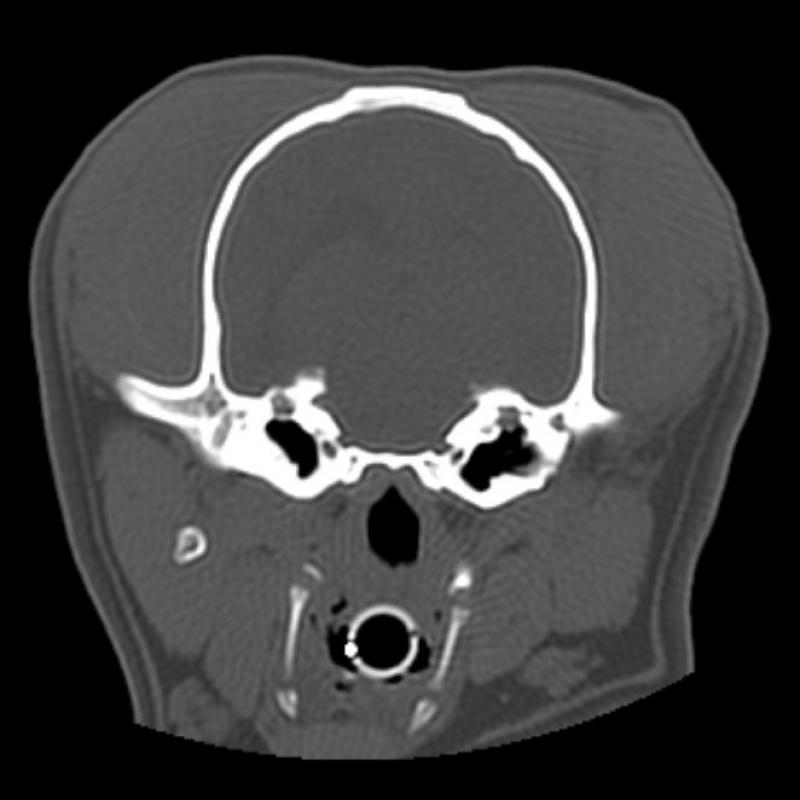
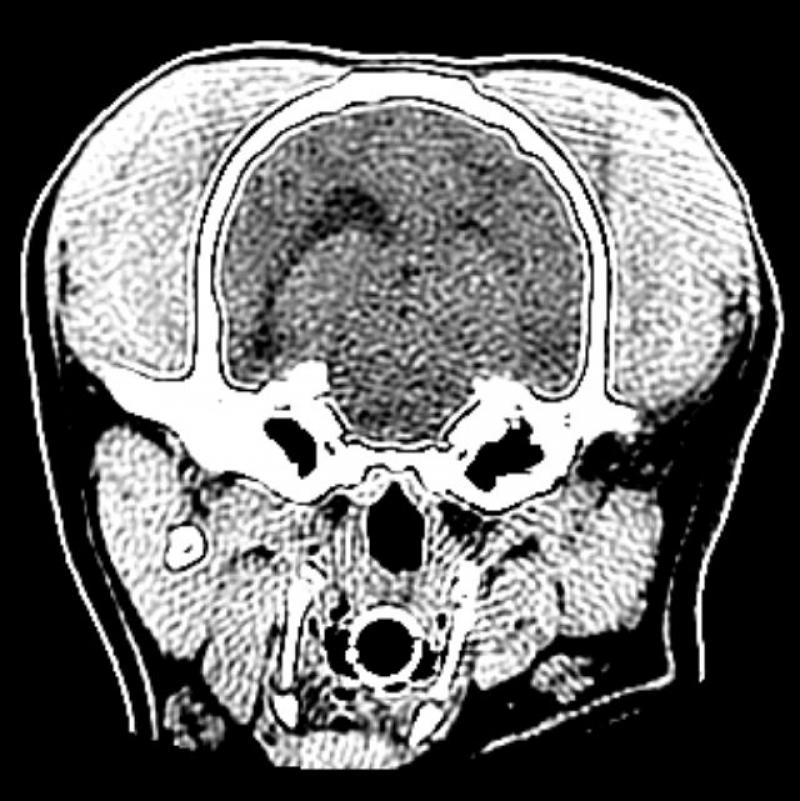
Figura 7. Comparativa de ventanas y kernel en cráneo.
En la figura 7 se ha aplicado un kernel blando a las imágenes A y B y un kernel duro a las imágenes C y D. Las imágenes A y D evidencian la falta de congruencia entre ventana y kernel. En la imagen A es difícil valorar los límites de las estructuras óseas y en la imagen D, pese a visualizarse en ventana “neuro”, la introducción de ruido disminuye significativamente la calidad de la imagen.
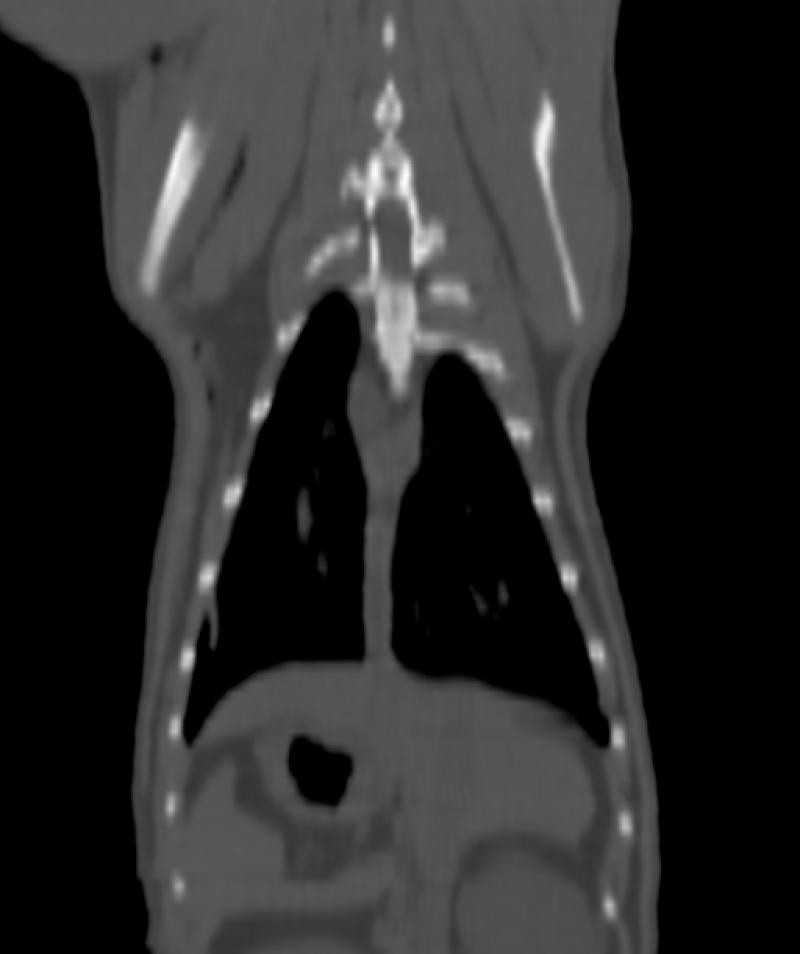
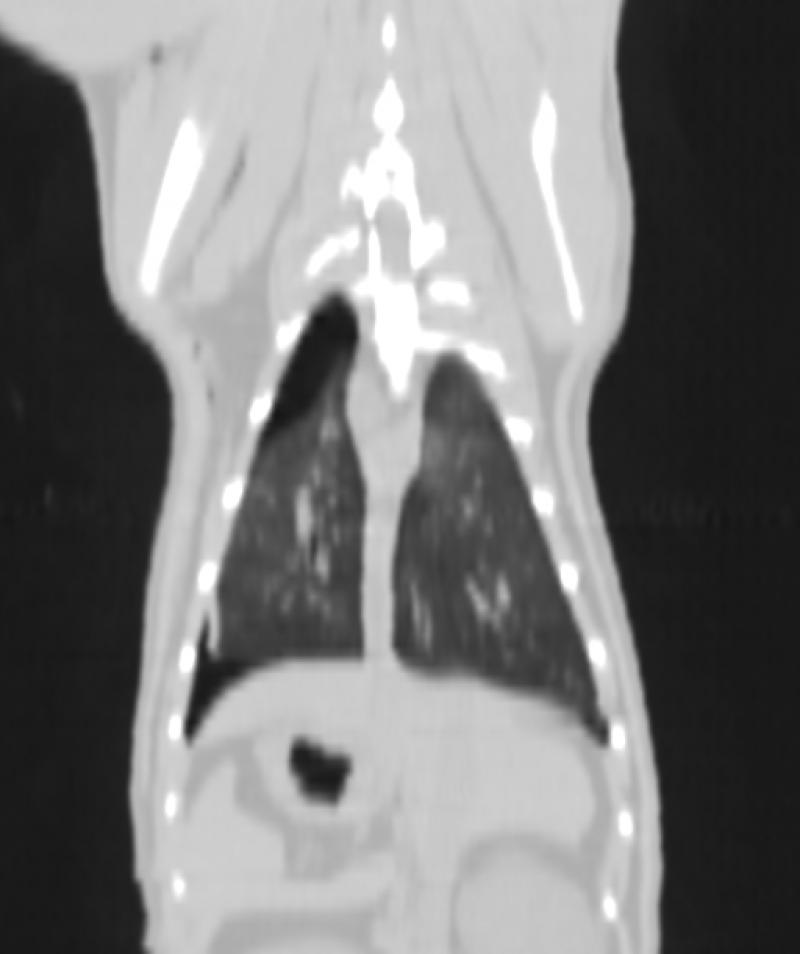
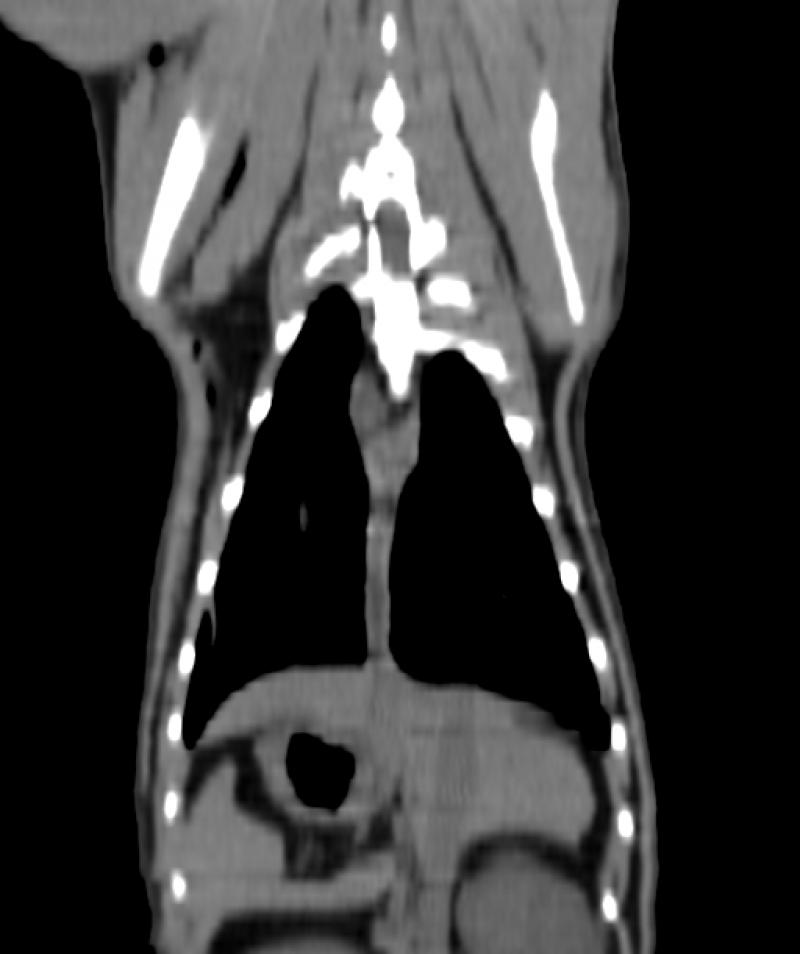
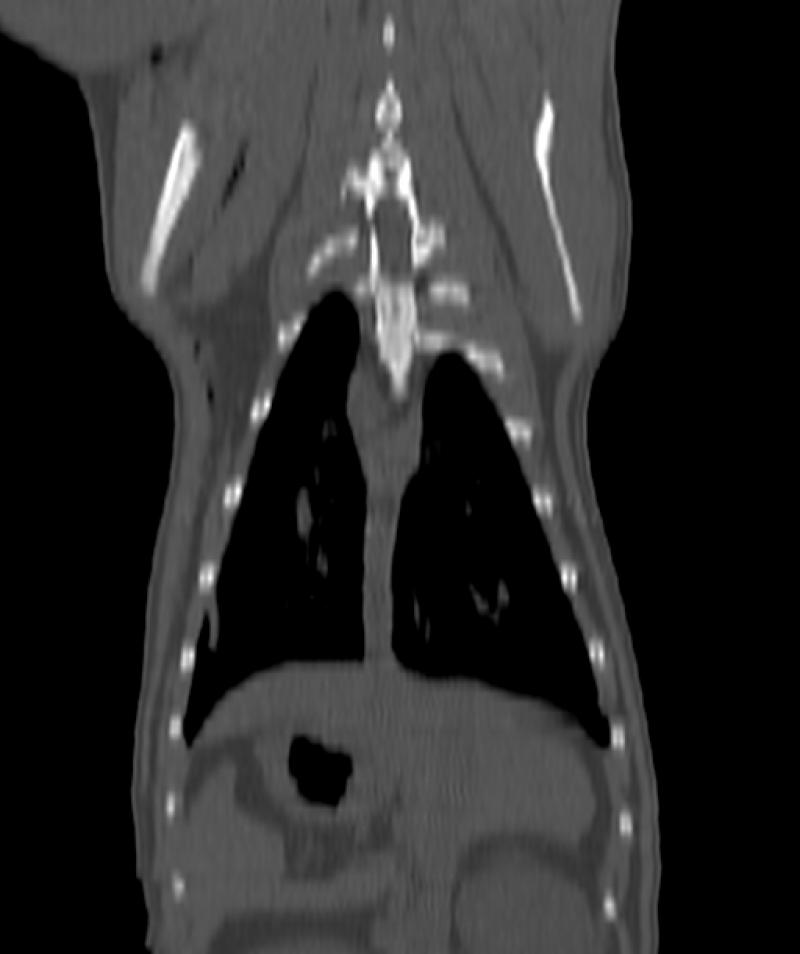
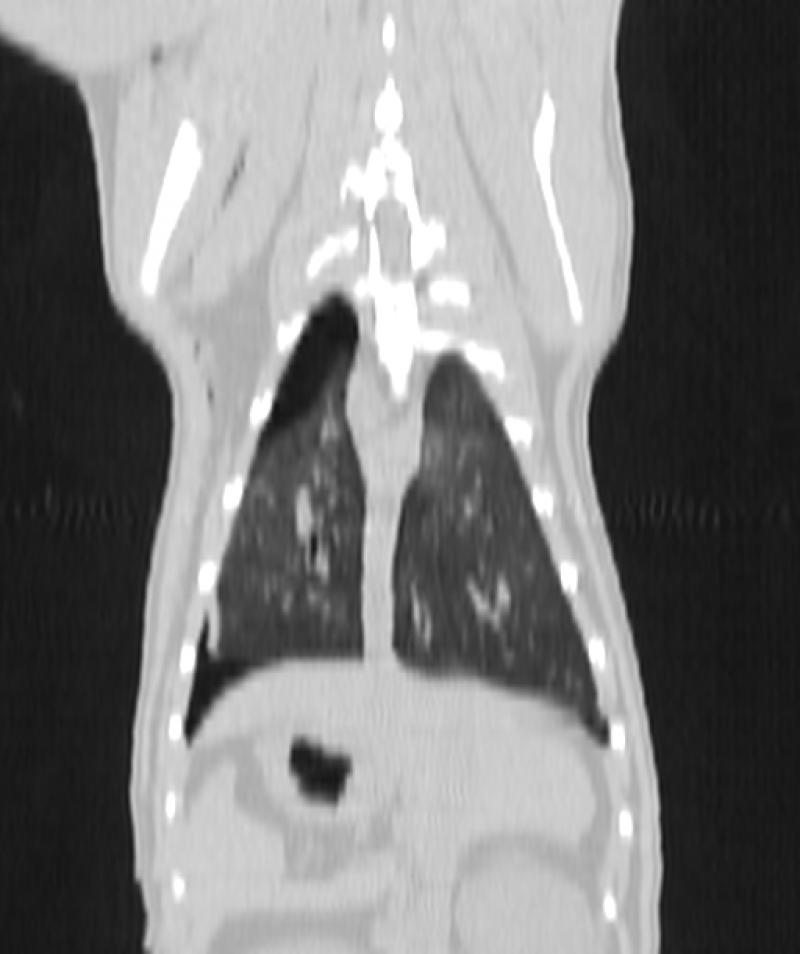
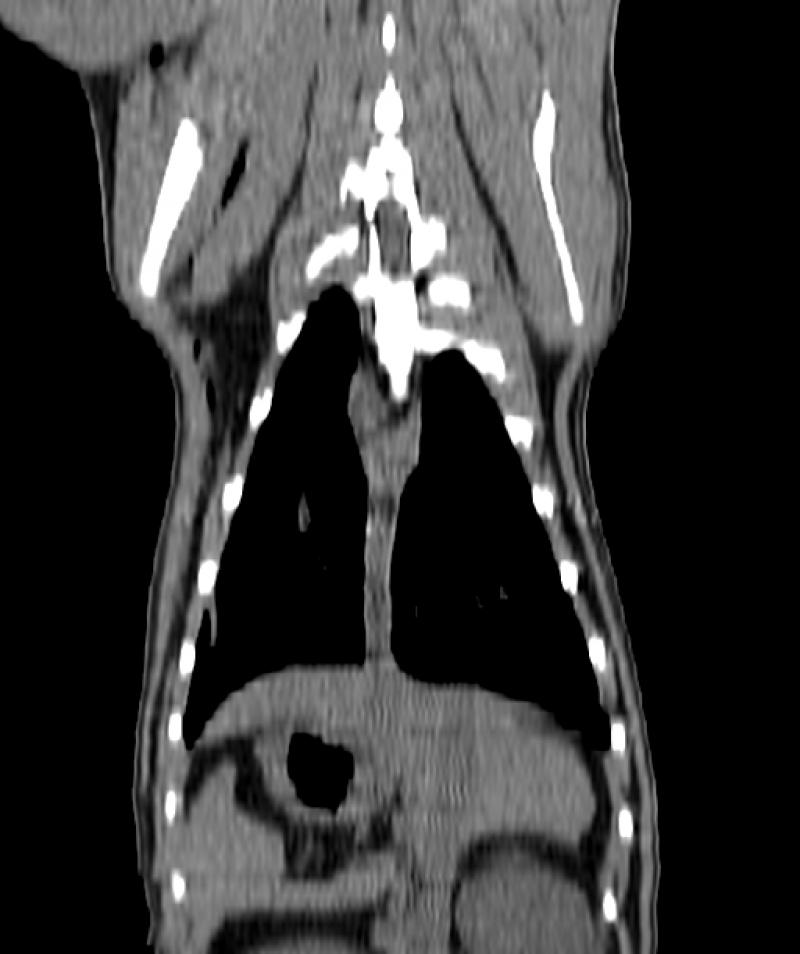
Figura 8. Comparativa de ventana y kernel en tórax
En la figura 8 la primera fila (imágenes A, B y C) muestra un tórax visualizado con ventana “hueso”, “pulmón” y “abdomen”, respectivamente. Se les ha aplicado un filtro, o kernel, de tipo blando. La segunda fila (imágenes D, E y F) muestra el mismo tórax visualizado con las mismas ventanas pero con un filtro de tipo duro. El kernel duro mejora la visualización de imágenes de parénquima pulmonar y tejido óseo, así como el kernel blando permite visualizar mejor algunas estructuras del mediastino y las vísceras abdominales.
Artefactos
Los artefactos son imágenes que no corresponden con la realidad y pueden dificultar la correcta valoración diagnóstica de la imagen (Figura 9).
Artefacto metálico: la presencia de objetos metálicos (cuerpos extraños, microchip, implantes) provoca dos fenómenos, el endurecimiento del haz y el secuestro fotónico. Como resultado, la zona donde se encuentra el objeto y su alrededor no pueden visualizarse correctamente.
Artefacto en diana: si alguna de las celdillas que componen las filas de detectores está dañada se obtendrá un punto fijo en el campo de visión sin información ya que la señal producida por el haz no puede ser leída. Se observa un punto a partir del cual se describen círculos concéntricos, a modo de diana.
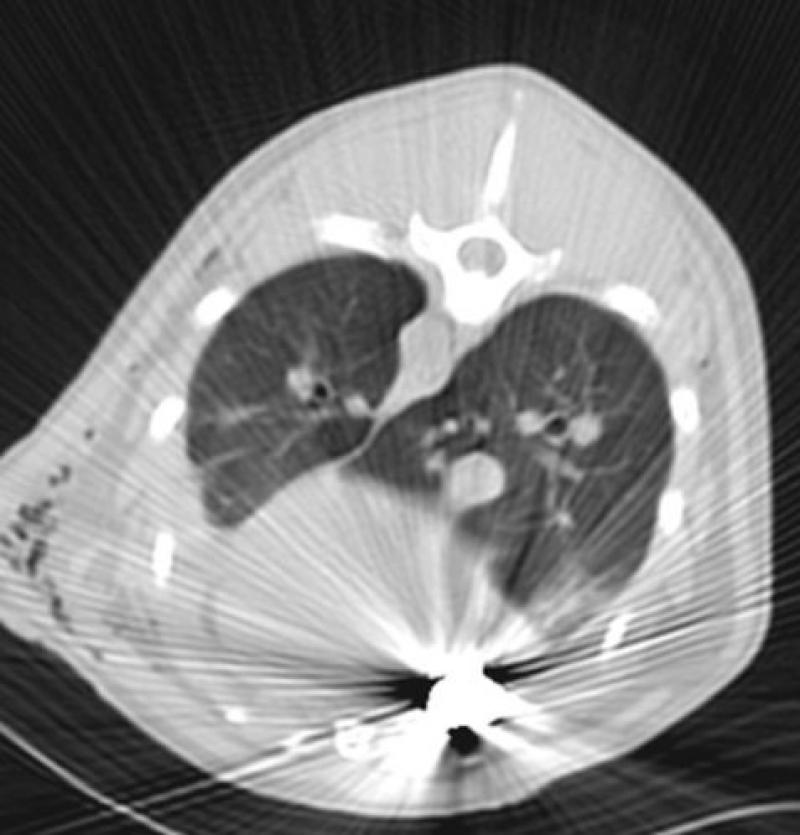
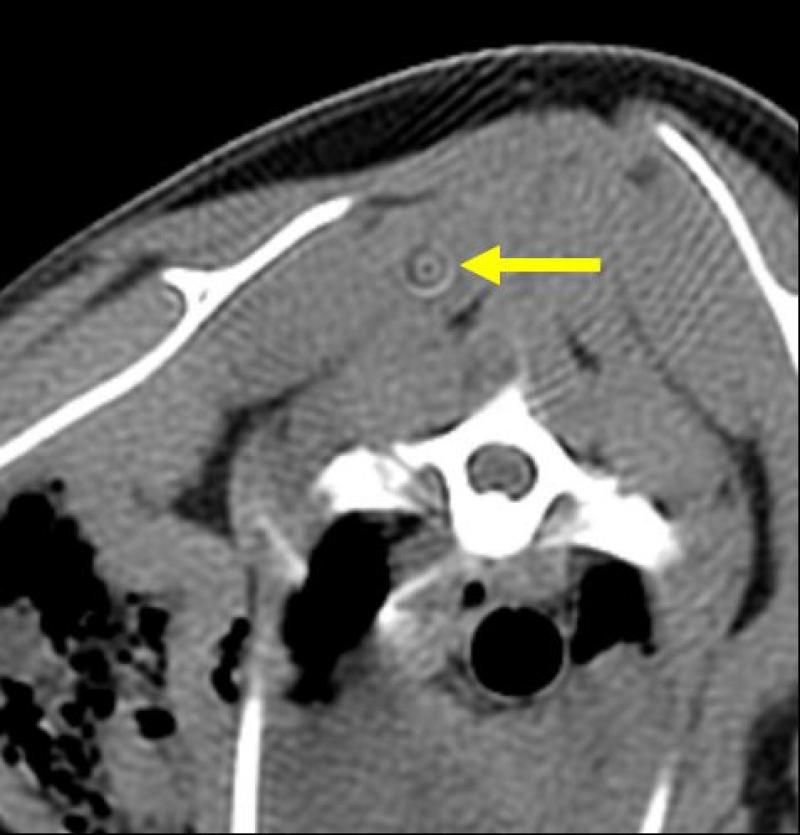
Figura 9. Artefactos de TC.
Reconstrucciones
Las reconstrucciones que se pueden realizar con la estación de trabajo (ordenador o terminal asociado al equipo de TC) tras la adquisición del estudio permiten valorar las imágenes y componer diferentes maneras de visualizar el estudio (Figura 10). De manera general, las reconstrucciones más habituales son las siguientes:
- MPR, o reconstrucción multiplanar: las imágenes son originalmente obtenidas en plano axial. Con las reconstrucciones MPR se puede visualizar el estudio en cualquier plano del espacio (axial, sagital, coronal y sus oblicuidades). La calidad de las reconstrucciones es ligeramente inferior a las imágenes adquiridas en axial.
- MIP, o proyección de máxima intensidad: es un tipo de reconstrucción que permite destacar las estructuras con mayor densidad (UH). Es útil para los estudios del sistema cardiovascular con administración de contraste.
- mIP, o proyección de mínima intensidad: a diferencia del MIP, esta reconstrucción realza los voxels de menor UH. Se emplea para valorar alveolos, presencia de aire, enfisema.
- Reconstrucción volumétrica: recrea una imagen en volumen asignando una escala de color según la densidad de los tejidos. La imagen puede ser estudiada desde cualquier ángulo deseado. Requiere cortes finos y solapados para que la calidad sea óptima.
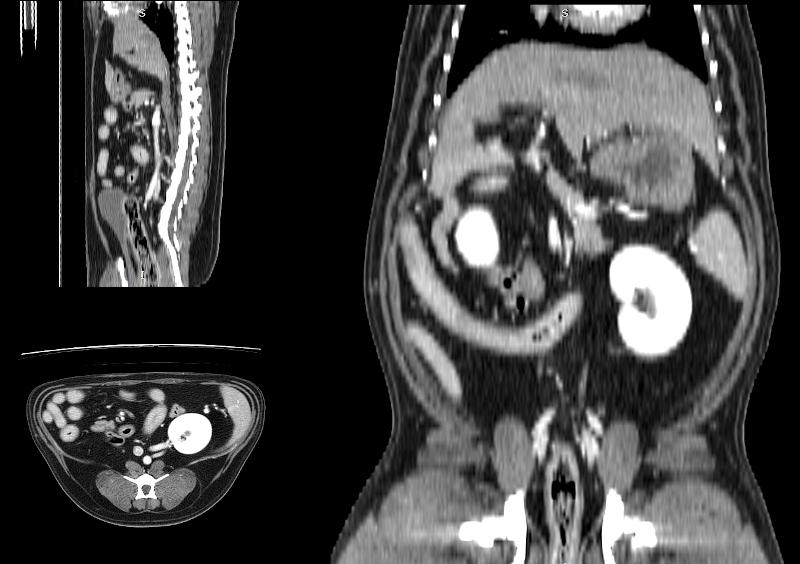
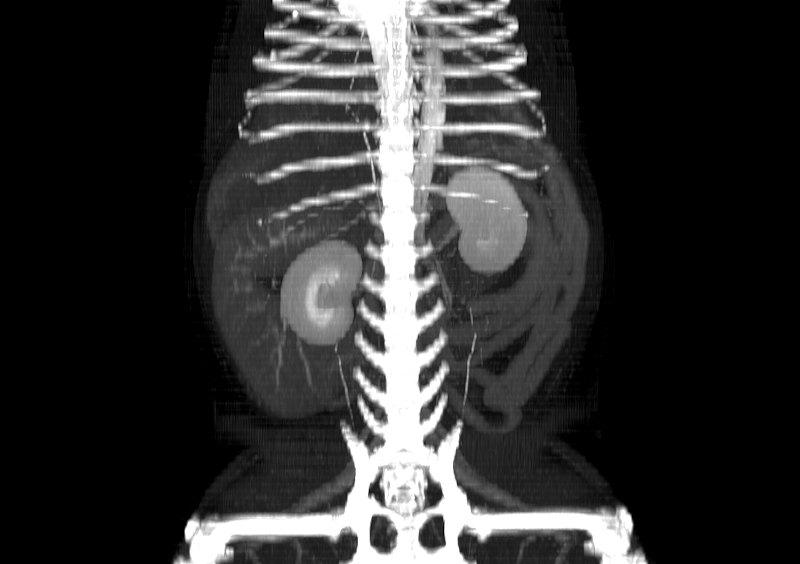
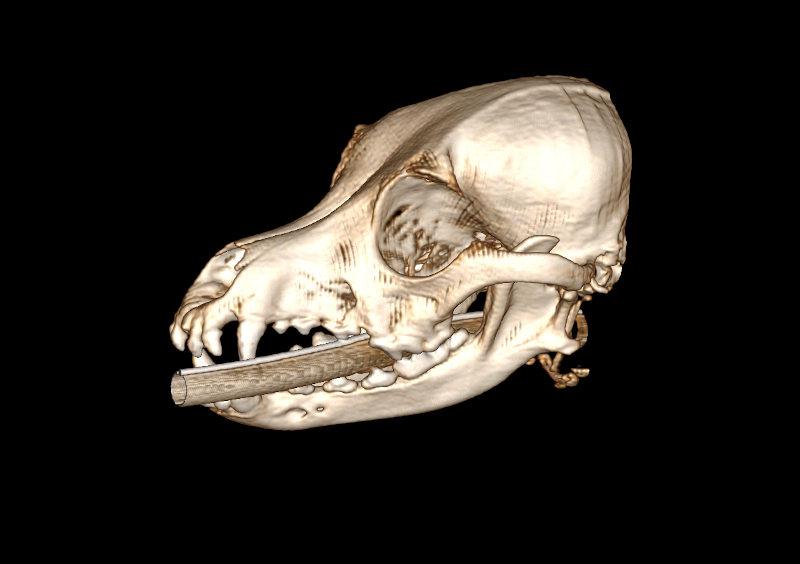
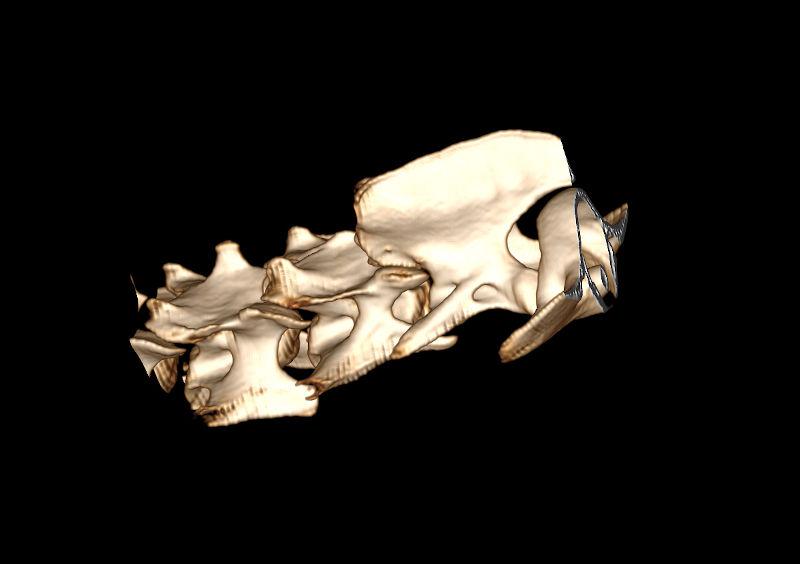
Figura 10. Diferentes reconstrucciones de TC.
Las reconstrucciones tendrán menor calidad que las imágenes obtenidas en plano axial durante la adquisición (en la exploración radiológica con TC) debido a la extrapolación de datos a partir de la imagen original.
Seguridad en el uso de equipos de TC
Protección radiológica
El TC requiere instalaciones blindadas, tanto en paredes como suelos y techos. Durante el uso del equipo (emisión de radiación) nadie, excepto el paciente, debe permanecer en el interior de la sala donde se halle el equipo. El paciente será observado y monitorizado a través de una ventana de vidrio plomado. Las instalaciones de TC deben disponer de mecanismos acústicos y visuales que alerten cuando los equipos están siendo usados y eviten el acceso.
Introducción a la resonancia magnética nuclear
La resonancia magnética nuclear (RMN) obtiene imágenes a partir de la lectura de la energía liberada por los núcleos de hidrógeno del organismo de un paciente tras haber sido excitados (absorción de energía) con una señal de radiofrecuencia y encontrándose bajo la acción de un campo magnético definido.
A diferencia de la tomografía computada, esta técnica de diagnóstico no emplea radiaciones ionizantes (nocivas para los tejidos biológicos) sino campos magnéticos generados por un imán y ondas de radiofrecuencia que, aún siendo de la misma naturaleza que los rayos gamma ya que ambas son ondas electromagnéticas, su energía (frecuencia) es significativamente inferior y, por tanto, sin capacidad de ionizar.
El tiempo de estudio es mayor que en TC y por lo tanto prolonga el tiempo anestésico del paciente. En equipos de alto campo la generación de calor puede ser un factor condicionante durante el estudio.
El equipo de RMN
Imán y campo magnético
Los equipos de RMN emplean un imán que genera un campo magnético de potencia definida (Figuras 11 y 12). Es necesario para permitir el fenómeno de resonancia magnética en los núcleos de hidrógeno. El campo magnético debe ser homogéneo por lo que la zona del imán está provista de una jaula de Faraday que lo protege de interferencias externas. Si el paciente debe ser monitorizado cerca del imán se deberá evitar realizar movimientos durante la adquisición de las secuencias.
Los imanes permanentes mantienen siempre su campo magnético por lo que hay que ser precavido y seguir las normas obligatorias de seguridad cuando se trabaje cerca de ellos.


Equipos de alto campo y bajo campo
Son las dos principales categorías en las que se clasifican los imanes empleados en los equipos de RMN. La unidad con la que se mide la intensidad de un campo magnético se denomina Tesla, en honor al investigador y científico Nikola Tesla (Croacia, 1.856). Los equipos más comunes en el ámbito veterinario son de bajo campo: 0,2T, 0,3T, 0,5T y 0,7T. Los equipos de alto campo alcanzan 1,5T y 3T.
Los equipos de bajo campo permiten realizar estudios de columna, articulaciones y cráneo. Estudios de funcionalidad cardiaca, espectroscopia o técnicas más avanzadas quedan relegados a equipos de alto campo.
Bobinas
Se sitúan en la región a estudiar (cráneo, articulaciones, columna) y actúan tanto como emisoras de radiofrecuencia como receptoras de señal.
Existen diversos modelos para adaptarse a pacientes y regiones y cada bobina tiene características que la hacen idónea según el estudio a realizar.
Adquisición de imágenes en RM
Secuencias
Las secuencias son la configuración de los pulsos de radiofrecuencia emitidos y que permiten la obtención de imágenes con diferente valor diagnóstico. Algunas secuencias permitirán valorar la anatomía de la región estudiada, como las secuencias potenciadas en T1. Otras secuencias, potenciadas en T2, permitirán valorar mejor la patología (protrusión de disco, hemorragia, neoplasias). Existen multitud de secuencias diseñadas para las necesidades requeridas de los estudios permitiendo la supresión de la grasa o agua, visualización del líquido cefalorraquídeo, realce de algunos tejidos, etc.
En la imagen potencia en T2 (Figura 14) puede apreciarse como la patología tumoral (macroadenoma hipofisario), señalada con flecha amarilla, es mucho más visible en comparación con la imagen potenciada en T1 (Figura 13).
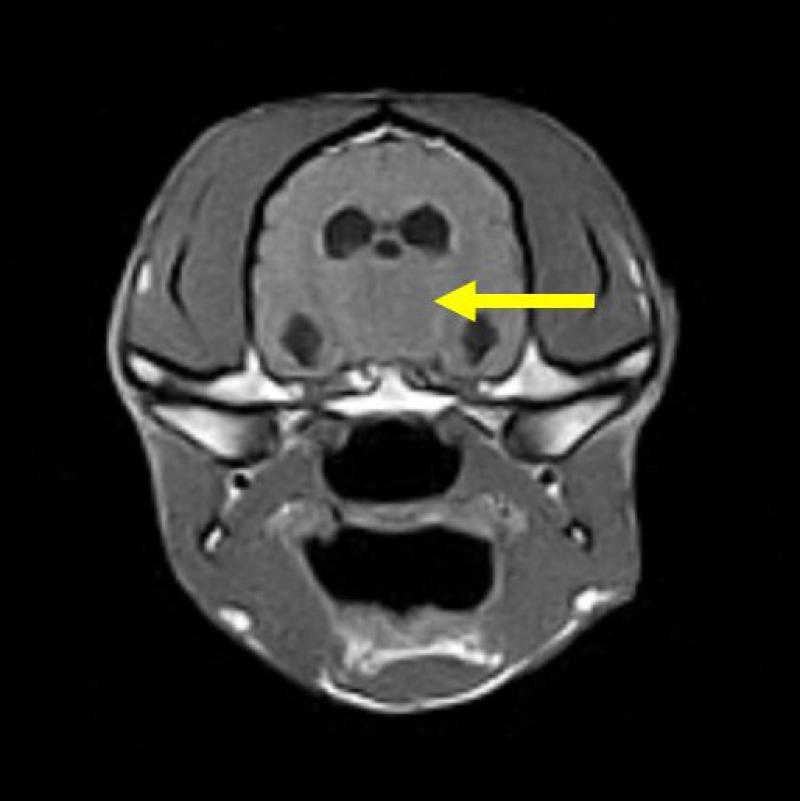
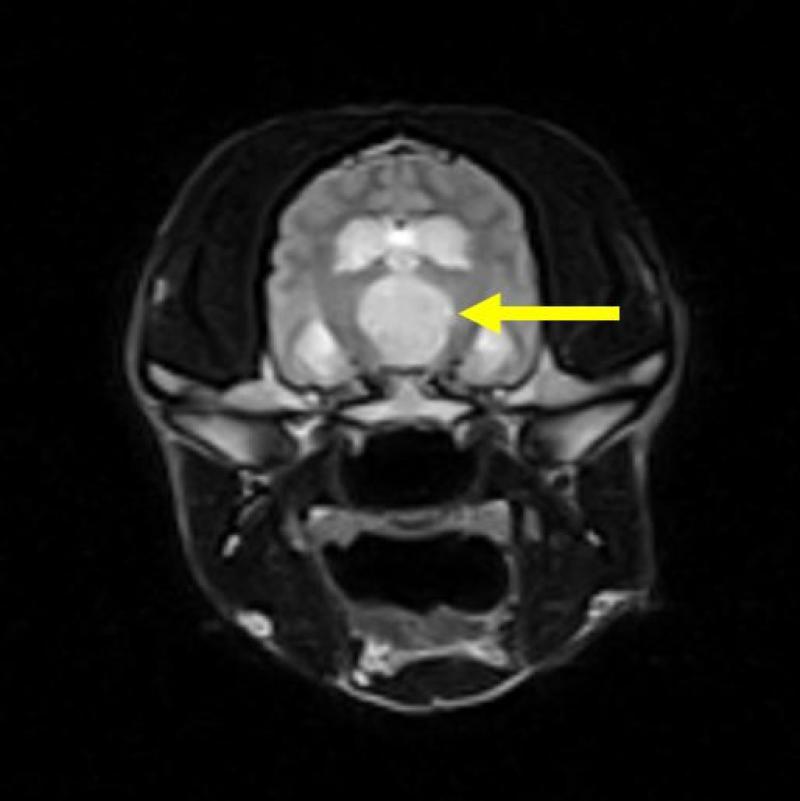
Las secuencias parten, generalmente, de dos tipos de secuencias originales: la secuencia Spin Eco y la secuencia Gradient Eco.
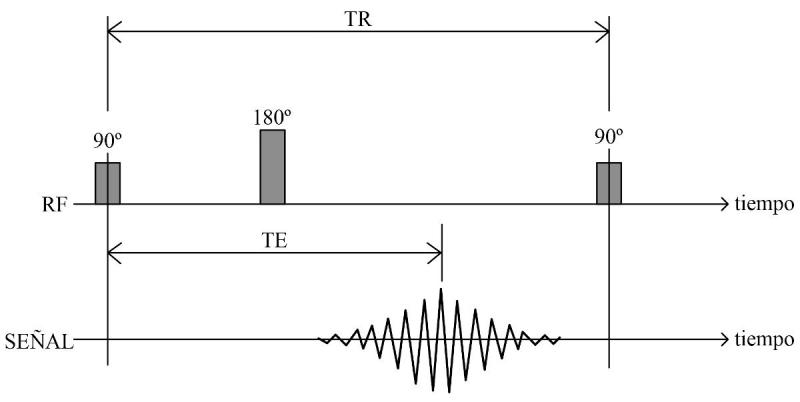
Spin Eco, o SE (Figura 15)
Recibe la misma denominación en todas las casas comerciales. Permite la corrección de heterogeneidades del campo mediante pulsos de radiofrecuencia de 180º. Aumenta la relación señal-ruido (SNR) y ofrece un buen contraste de imagen. Los tiempos de exploración son largos.
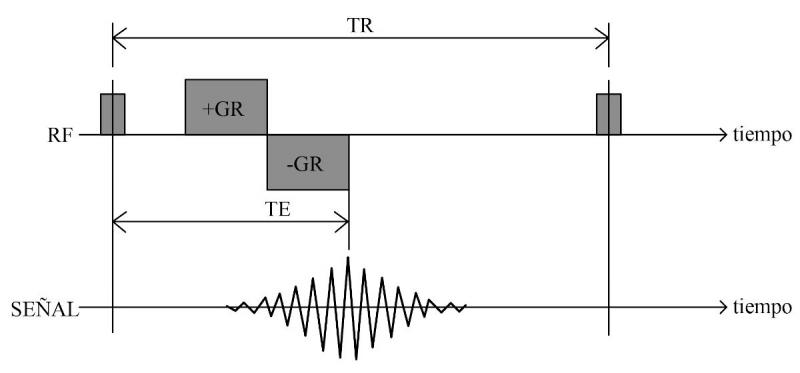
Gradient Eco, o GRE (Figura 16)
Surge con la finalidad de reducir los tiempos de estudio. No corrige heterogeneidades del campo magnético ya que no emplea pulsos de 180º, por lo que su calidad generalmente es menor que las secuencias SE. Obtiene las imágenes mediante la inversión de gradientes (pulsos de radiofrecuencia), lo que genera niveles acústicos altos. En equipos de alto campo las secuencias GRE disminuyen el calor generado (depósito calórico). En equipos de bajo campo, los más habituales en el ámbito veterinario, la generación de calor en el paciente es un factor menos condicionante.
Parámetros de las secuencias
Los parámetros son variables que permiten configurar las secuencias.
- Tiempo de repetición, o TR: es el tiempo transcurrido desde que se emite un pulso de 90º hasta la emisión de otro pulso de radiofrecuencia. Determina la duración de la secuencia. Se expresa en milisegundos.
- Tiempo de eco, o TE: es el tiempo transcurrido desde que se emite un pulso de radiofrecuencia hasta que se recoge la señal de energía liberada de los núcleos de hidrógeno. Este valor define el contraste de la imagen. Se expresa en milisegundos.
- Flip angle, o ángulo de inclinación: define la posición del vector longitudinal producido por la magnetización longitudinal. Es el ángulo de inicio del primer pulso de radiofrecuencia. Se expresa en grados.
- Banda de saturación (Figura 17): permite seleccionar un área dentro del campo de visión de la zona anatómica a estudiar donde no se desea obtener lectura de señal, evitando así artefactos de movimiento. La zona donde se sitúa la banda de saturación se observa con un vacío de señal (señalizada con flechas amarillas).
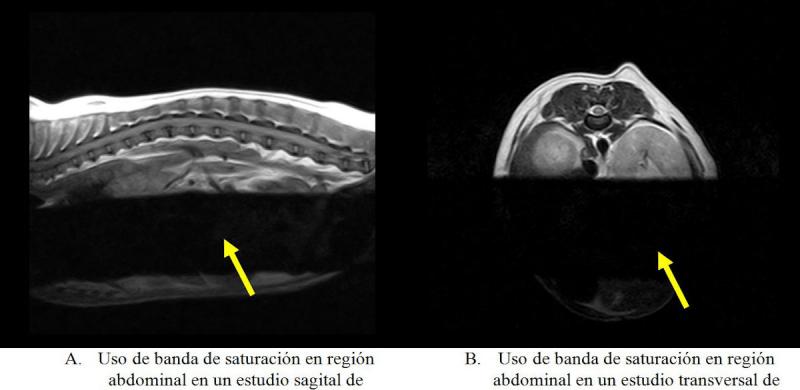
Seguridad en el uso de equipos de RMN
Campo magnético y emisión de radiofrecuencia
La resonancia magnética es una técnica relativamente reciente y las acciones de la radiofrecuencia y campos magnéticos en los tejidos biológicos se consideran actualmente inocuas.
Debe evitarse el acceso a la sala del imán portando objetos metálicos de susceptibilidad magnética alta (cobre, hierro, acero) ya que pueden ser atraídos por el campo magnético del imán, especialmente aquellos punzantes como porta agujas, mosquitos o tijeras. A cierta distancia serán atraídos hacia el centro del imán a alta velocidad suponiendo un riesgo para pacientes y el personal que opere el equipo. También deben evitarse todos aquellos dispositivos electrónicos como teléfonos móviles, relojes u objetos con bandas magnéticas (tarjetas identificativas o bancarias).
Los pacientes así como el personal con marcapasos tendrán prohibido el acceso al interior de la sala del imán.
Aspectos comparativos de tc y rm
La principal ventaja de los equipos de TC es la eliminación de estructuras. En radiología convencional, la imagen producida es el resultado de plasmar de manera bidimensional sobre un soporte radiográfico (película radiográfica o sistema digital) un objeto tridimensional. Esto implica la imposibilidad de observar estructuras de manera individual.
La tomografía computarizada resuelve este problema generando sucesivas imágenes contiguas (cortes), de grosor definido por las necesidades del estudio a realizar, en plano axial. El posterior procesamiento de los datos obtenidos durante el estudio en una estación de trabajo permitirá reconstruir las imágenes en todos los planos necesarios, como en el caso de las reconstrucciones multiplanares, así como permitir técnicas de procesado avanzadas, reconstrucciones volumétricas y realce de densidades. Las posibilidades del procesado de las imágenes ha quedado detallado en puntos anteriores.
La TC también permite diferenciar densidades de los tejidos estudiados mediante el uso de ventanas. Son estudios rápidos, que reducen el tiempo anestésico de los pacientes y con los que se obtienen una gran densidad de datos que permitirán trabajar a posteriori.
En contra partida, el uso de radiación ionizante y las contraindicaciones asociadas al uso de medios de contraste son aspectos a considerar y en los que se deberán trabajar para minimizar sus efectos negativos.
La obtención de imágenes mediante RMN, al igual que en TC, permite eliminar la superposición de estructuras y obtener imágenes en los planos del espacio deseados, según el estudio a realizar, pero con la diferencia de que deben programarse secuencias para cada plano a estudiar. Si se requiere un estudio transversal, sagital y dorsal de cráneo se deberán programar tres secuencias diferentes, cada una de ellas con un tiempo de estudio. Serán adquisiciones y no reconstrucciones, a diferencia de la TC. Los estudios de RMN conllevan más tiempo de exploración y por tanto, requieren de mayor tiempo dedicado al paciente, una colocación del paciente en la mesa del imán y en la bobina más precisa y un mayor tiempo anestésico que en TC.
Los siguientes puntos comparativos describen el principio físico de cada técnica, la visualización de las imágenes, el uso de medios de contraste y los artefactos.
Principio físico de TC y RMN
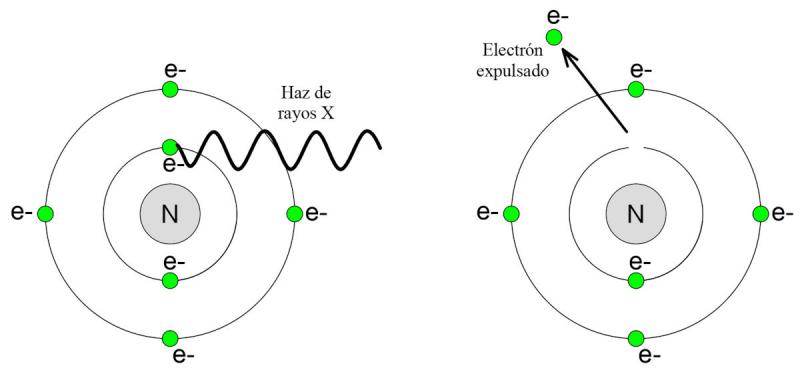
Los rayos X, empleados en TC, son un tipo de energía electromagnética (compuesta por un componente eléctrico y un componente magnético). Su elevada energía hace que tenga capacidad de ionizar la materia, produciendo efectos nocivos sobre los tejidos biológicos de los seres vivos expuestos.
La ionización es la capacidad de un fotón de rayos X de expulsar electrones de un átomo cuando incide sobre ellos. Esto desestabiliza la carga eléctrica del átomo, que en condiciones estables es neutra. La ionización produce daños en los tejidos biológicos que pueden llegar a ser reparados por el organismo, o bien, pueden provocar la mutación y/o muerte de sus células.
En la Figura 18 se observa, a la izquierda, la incidencia de un haz de rayos X sobre uno de los electrones del átomo. A la derecha, como resultado de la interacción del haz con el átomo, uno de los electrones es expulsado.
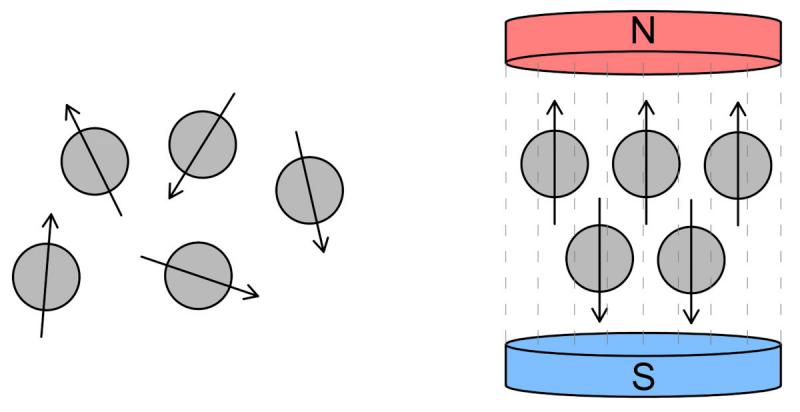
En RMN se trabaja con ondas de radiofrecuencia y campos magnéticos de alta o baja intensidad. Los núcleos de hidrógeno pueden considerarse un diminuto imán y, bajo la acción de un campo magnético producido por un imán, se orientan con las líneas del campo magnético. Esta orientación se produce siempre en la misma dirección pero una parte de los núcleos se orientarán en sentido paralelo (mismo sentido que las líneas de campo) y otra parte de los núcleos se orientarán en sentido antiparalelo. No lo hacen en una proporción igual y la diferencia entre núcleos en paralelo y núcleos en antiparalelo da como resultado un vector, denominado vector longitudinal. A medida que los núcleos absorben la energía emitida en forma de pulsos de radiofrecuencia se provocan alteraciones en el vector longitudinal y, dado que cada tipo de tejido liberará la energía absorbida en momentos diferentes, se podrán obtener lecturas diferentes de señal para cada tejido.
En la figura 19, a la izquierda, el vector magnético de los núcleos de hidrógeno no está alineado. En cambio, bajo la acción de un campo magnético, los núcleos orientan su vector en paralelo y antiparalelo con respecto a las líneas de campo.
Visualización de las imágenes
En general, los estudios de RMN permiten una visualización y valoración de los tejidos blandos con mayor resolución que mediante TC. Debido a la baja presencia de núcleos de hidrógeno en el tejido óseo cortical este no puede ser valorado en RMN ya que su señal es débil (señal hipointensa). En este aspecto, el TC destaca sobre la RMN.
Las siguientes imágenes permiten comparar visualmente imágenes axiales y sagitales de cráneo obtenidas con ambas modalidades (Figura 20).
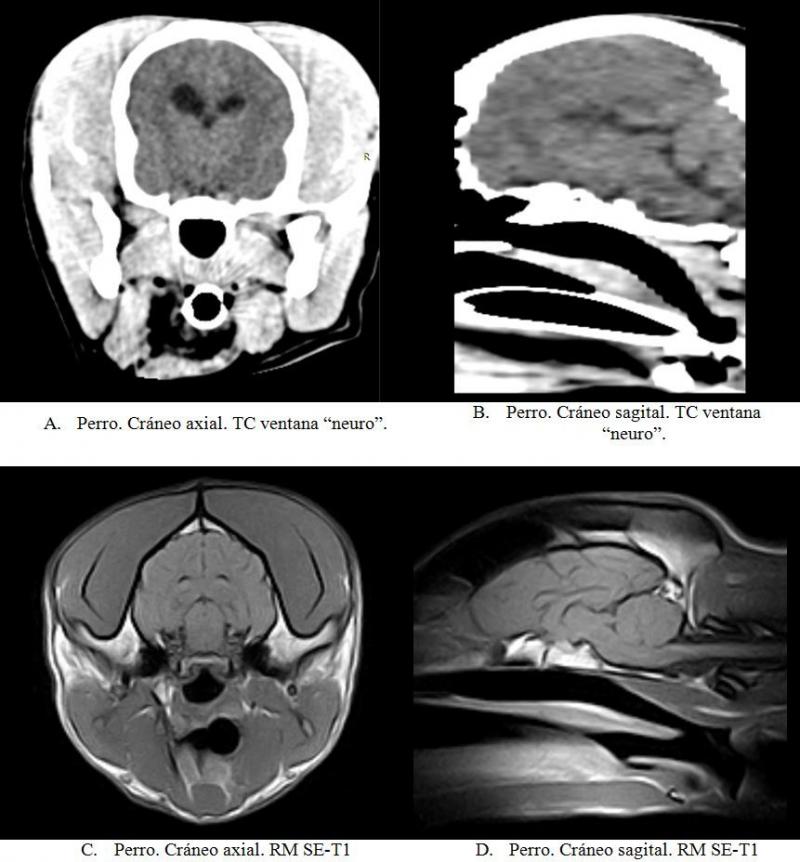
La RMN se muestra superior para la visualización del tejido cerebral y medular. Los estudios de TC pueden complementarse con estudios de RMN.
Las siguientes imágenes permiten comparar visualmente imágenes axiales y sagitales de columna obtenidas con ambas modalidades (Figura 21).
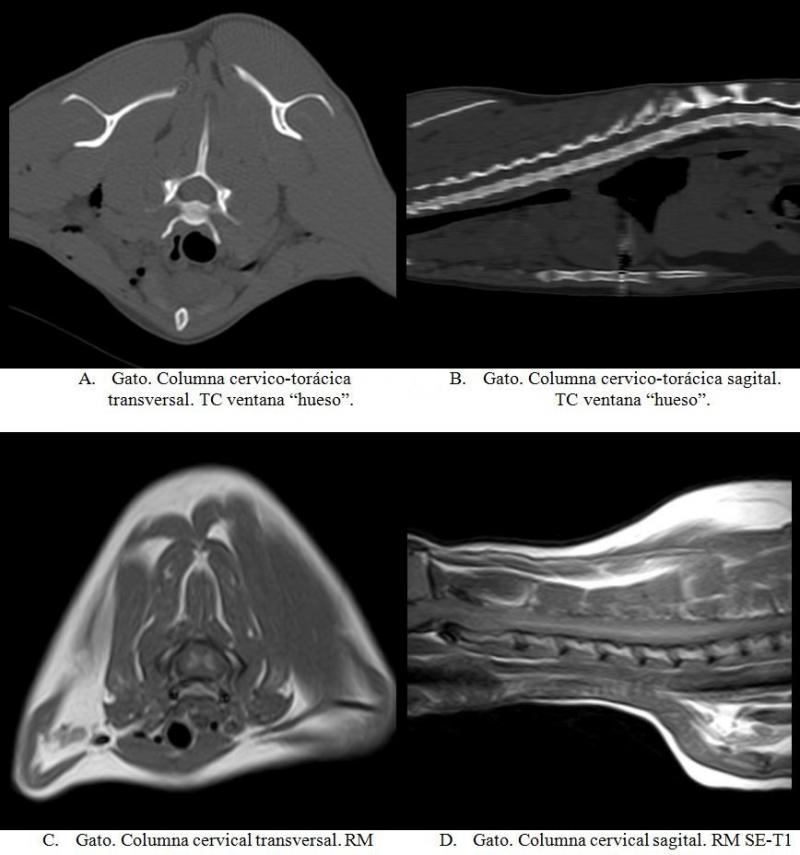
En RMN se observa una buena diferenciación, a nivel del SNC, de sustancia blanca y sustancia gris en médula y encéfalo. En TC se puede valorar hueso trabecular y hueso cortical, especialmente con el uso de la ventana y filtro adecuado.
Contraste en TC y RMN
Los contrastes habitualmente empleados para estudios de TC son soluciones de yodo y se administran de manera endovenosa. Son sustancias radiopacas, atenúan el haz de rayos X y permiten observar las estructuras en las que está contenido el contraste. También resaltan tejidos al difundir en sus capilares. Debido a la rápida difusión del contraste por el sistema cardiovascular, los estudios de TC con contraste requieren sincronización entre el momento de administración y el de adquisición, haciendo así posible adquirir en fase arterial, fase portal o en difusión de los tejidos.
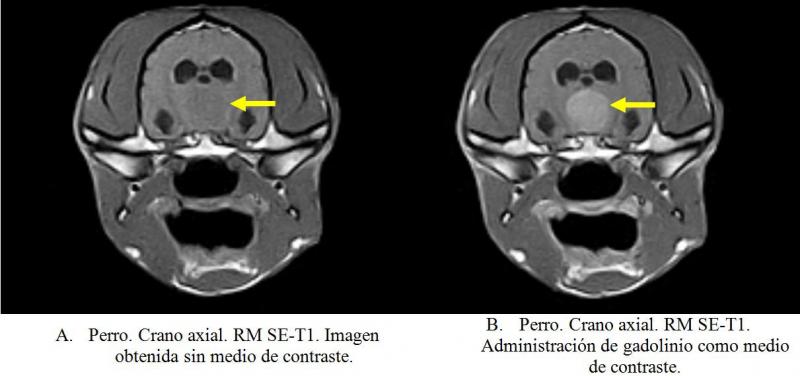
En estudios de RMN se emplean sustancias paramagnéticas (de elevada susceptibilidad magnética) como el gadolinio, administrado por vía endovenosa. A diferencia de los medios empleados en TC, el contraste empleado en RMN altera los tiempos de relajación de los tejidos por lo que en la visualización de imágenes con contraste se observará un aumento de la señal (señal hiperintensa) en las estructuras con captación de contraste. El tiempo de relajación es el tiempo que requiere cada tejido para liberar la energía absorbida.
En la figura 22 puede apreciarse como la patología tumoral (macroadenoma hipofisario) en T1 sin contraste es muy sutil mientras que la misma secuencia T1 pero con el uso de contraste (gadolinio) se hace mucho más evidente.
Artefactos
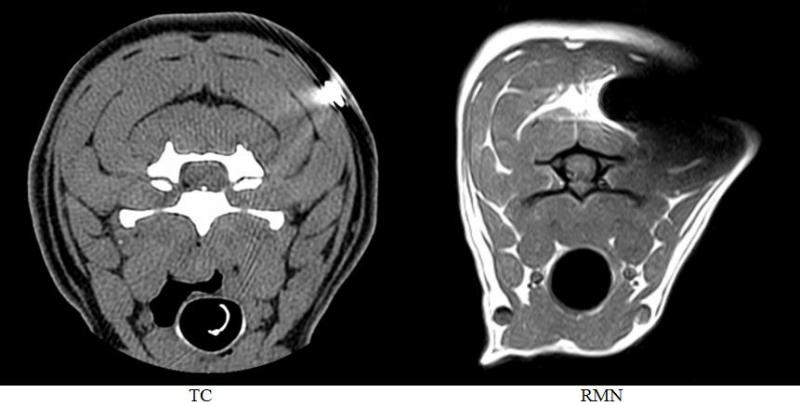
Los artefactos son defectos en la imagen que no corresponden con la realidad y que pueden degradar el valor diagnóstico del estudio. Las causas son muy variadas y afectan de diferente manera a cada técnica. La presencia de un microchip identificador del paciente, un cuerpo extraño, un fallo en el sistema detector o la interferencia de radiofrecuencia externa provocará una imagen artefactuada.
Obsérvese el artefacto producido por la presencia del microchip en ambas técnicas. En estudios de TC, la zona mostrará una imagen hiperintensa (blanco) acompañada de líneas radiales hipointensas (Figura 23). Este artefacto se denomina artefacto por endurecimiento del haz ya que el objeto metálico provoca un aumento de la energía media del haz debido a la absorción de los fotones de menor energía. En estudios de RMN la presencia del microchip identificador provoca artefacto debido a la diferencia de susceptibilidad magnética del microchip y los tejidos adyacentes. Se aprecia una zona amplia de hiposeñal acompañada de una zona de hiperseñal.
Conclusión
Aunque por separado tanto TC como RMN son técnicas eficaces, la combinación de ambas técnicas amplía el abanico de posibilidades en el diagnóstico.
Se debe trabajar de manera responsable con los equipos emisores de radiación ionizante y familiarizarse con las medidas de seguridad al trabajar con campos magnéticos y fuentes emisoras de radiofrecuencia.
El diagnóstico por la imagen es un campo amplio y el uso de tecnologías complejas requiere formación específica y constante para su correcto manejo.
Los auxiliares veterinarios pueden ser introducidos en este ámbito y adquirir nuevas competencias a la vez que asumen el compromiso de ampliar su formación como técnicos en radiodiagnóstico, mejorando como profesionales y superando nuevos retos.
Agradecimientos
Agradecer al Dr. Laín García (HV Molins) por ofrecerme la oportunidad de escribir el presente artículo y al Dr. Pablo Menéndez (HV Molins) por su asesoramiento y revisión del contenido. También agradecer a la dirección del Hospital Veterinario Molins por la cesión de las imágenes.
Bibliografía
Costa J, J.A. Soria; Tomografía computarizada dirigida a técnicos superiores en imagen para el diagnóstico, Editorial Elsevier; 2.015; Barcelona
Erik Wisner, Allison Zwingenberger; Atlas of small animals CT and MRI; Editorial Wiley Blackwell; 2015; Reino Unido.
Jaume Gili i Planas; Introducción biofísica a la resonancia magnética en neuroimagen; 2.009; Barcelona.
Tobias Schwarz, Jimmy Saunders; Veterinary computed tomography, Editorial Wiley Blackwell; 2011; Reino Unido.
Wilfried Mai; Diagnostic MRI in dogs and cats; Editorial CRC Press, 2018; EEUU
 by Multimédica
by Multimédica