Protocolo de cuidados periquirúrgicos en pequeños mamíferos herbívoros: conejos, cobayas y chinchillas
Resumen breve
Dentro del amplio mundo de los animales exóticos encontramos a los pequeños mamíferos herbívoros, como son los conejos (Oryctolagus cuniculus), cobayas (Cavia porcellus) y chinchillas (Chinchilla lanigera). Estos dos últimos pertenecen al orden de los roedores histricomorfos y los conejos al de lagomorfos, pero a la hora de afrontar sus cuidados pre- y post-quirúrgicos no son muy diferentes. Tienen en común que son animales delicados, con unas necesidades muy específicas debido a su anatomía…Índice de contenidos
Resumen
Dentro del amplio mundo de los animales exóticos encontramos a los pequeños mamíferos herbívoros, como son los conejos (Oryctolagus cuniculus), cobayas (Cavia porcellus) y chinchillas (Chinchilla lanigera).
Estos dos últimos pertenecen al orden de los roedores histricomorfos y los conejos al de lagomorfos, pero a la hora de afrontar sus cuidados pre- y post-quirúrgicos no son muy diferentes.
Tienen en común que son animales delicados, con unas necesidades muy específicas debido a su anatomía y fisiología de herbívoro, por lo que a la hora de una intervención quirúrgica es muy importante realizar un protocolo adaptado singularmente para ellos y que el ATV esté familiarizado con este tipo de pacientes.
Introducción
Hay múltiples protocolos prequirúrgicos, quirúrgicos y postquirúrgicos que el ATV debe tener en cuenta y que pueden variar en función del centro y de la especie del paciente. En este artículo se describen algunos de los procedimientos realizados en el centro de la autora, especializado en animales exóticos, para pequeños mamíferos herbívoros: conejos, cobayas y chinchillas.
La monitorización del paciente durante la cirugía se llevará a cabo por un veterinario anestesista, aunque pueden recaer en el ATV algunas tareas auxilares. La monitorización durante la cirugía, dada su complejidad y extensión, queda fuera del objetivo de este artículo. Aquí se describirá el papel del ATV en los cuidados pre- y post-quirúrgicos del paciente.
La fase prequirúrgica se inicia con una exploración física realizada por el veterinario y las pruebas específicas para valorar el estado del paciente, y de si se encuentra o no en condiciones de afrontar una cirugía.
Si el veterinario considera que el paciente es apto, deben tenerse en cuenta varias cuestiones antes de entrar al quirófano: ¿es necesario el ayuno?, ¿qué fármacos se utilizan para premedicar al paciente?, ¿cómo se realiza la cateterización intravenosa en este tipo de animales? ¿se les puede realizar una intubación endotraqueal? Estas y otras cuestiones se explicarán a continuación.
Por último, en la fase postoperatoria, el ATV debe vigilar que el paciente evolucione correctamente tras la anestesia, controlar el riesgo de hipotermia, administrar el tratamiento pautado por el veterinario y valorar en qué momento puede ser ofrecida comida y agua y monitorizar su consumo.
Cuidados prequirúrgicos
Pruebas prequirúrgicas:
- Examen físico realizado por un veterinario especialista.
- Análisis completo de sangre, el cual incluye (Figura 1):
- Hematología y proteinograma (sangre entera y plasma en EDTA)
- Análisis bioquímico (plasma heparinizado)
- Factores de coagulación en conejos (plasma en citrato)
Debido al menor tamaño y mayor complicación para obtención de muestras de sangre en cobayas y chinchillas, no se incluyen los factores de coagulación en su analítica de manera rutinaria.
En caso de no ser posible realizar una analítica completa, se recomienda como mínimo realizar un hemograma y bioquímica sanguínea básica para comprobar el estado y funcionamiento del hígado y los riñones, dado que son los órganos encargados de eliminar el anestésico del cuerpo y es importante que estén bien para afrontar la cirugía.
Extraccion de sangre
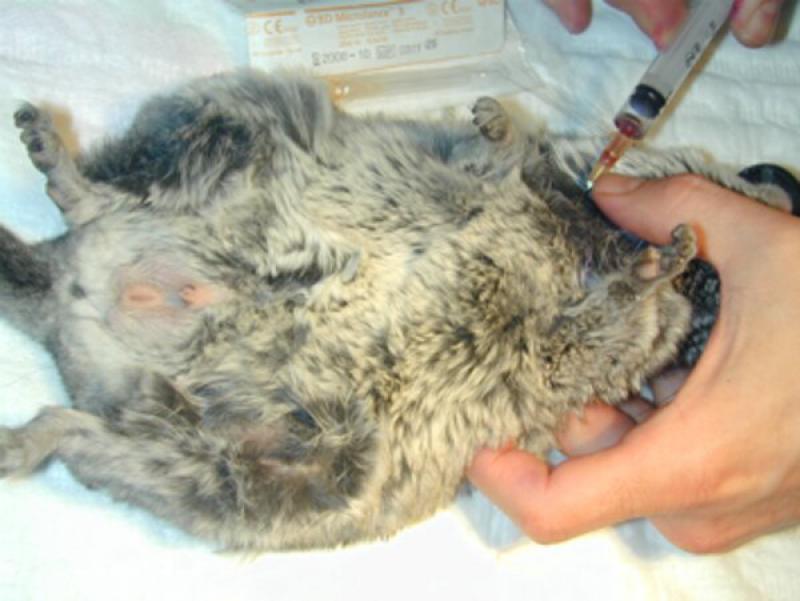
La extracción en los conejos (Figura 2) se realiza de la vena safena lateral de la extremidad posterior. Es mejor no recurrir a la vena cefálica del brazo ni a las venas auriculares, ya que es preferible reservarlas para colocación de catéter intravenoso.
En cobayas y chinchillas (Figuras 3 y 4) las venas de las extremidades suelen ser pequeñas y no siempre permiten obtención de una muestra adecuada en calidad y volumen.
En muchas cobayas puede obtenerse sangre de la vena safena o de la yugular.
En las chinchillas suele hacerse de la yugular. A la hora de extraer sangre de la vena yugular hay que extremar las precauciones y evitar introducir la aguja en la cavidad torácica donde se podrían lacerar accidentalmente los vasos sanguíneos e incluso en que en estas especies está en una posición bastante craneal en el tórax.
Dado que es mejor disponer de un análisis en las 24 horas previas a la cirugía, es preferible realizar el mismo en la propia clínica siempre que sea posible. Existen numerosos aparatos que permiten procesar rápidamente muestras de sangre de pequeño volumen. Muchas clínicas especializadas disponen de al menos alguno de ellos. En caso no existir la opción de realizar un análisis en la clínica, las muestras se remiten a un laboratorio que trabaje habitualmente con muestras de estas especies.

Preparación del paciente
El protocolo de preparación del paciente antes de la cirugía es el siguiente:

- Alojamiento y aclimatación: los pacientes deben ingresar con unas horas de antelación y son alojados en jaulas de hospitalización individuales.
Es importante aportarles un refugio para que se sientan más seguros y paliar así el estrés. Con el mismo fin también se recomienda que el animal ingrese con su compañero, si lo tiene, o un elemento de consuelo como su mantita, su casita o su juguete preferido.
También se colocará una bandeja de aseo con un poco de sustrato de pellets prensados y un pequeño manojo de heno (Figura 5).
A los animales ya tranquilizados para la inducción, se les deja en una jaula lo más diáfana posible y sin bebedero para evitar que se golpeen con los objetos y ahogamientos accidentales en el cuenco del agua. - Medicación: los animales llevarán la medicación prescrita por el veterinario. Pero de forma rutinaria y salvo que existan contraindicaciones, suele emplearse ranitidina (para paliar la hipomotilidad gástrica) y meloxicam (como analgésico previo a la intervención) (Tabla 1).
| Tabla 1. Fármacos utilizados. |
| Fármacos / Especie | Oryctolagus cuniculus | Cavia porcellus | Chinchilla lanigera |
| Ranitidina | 4 mg/kg SC/IVL TID | 4 mg/kg SC/IVL TID | 4 mg/kg SC/IVL TID |
| Meloxicam | 0,3 mg/kg SC/IM/IVL BID | 0,5-1 mg/kg SC/IM/IVL BID | 0,5-1 mg/kg SC/IM/IVL BID |
| Midazolam | 0,5-1 mg/kg SC/IM/IVL | 0,5-1 mg/kg SC/IM/IVL | 0,5-1 mg/kg SC/IM/IVL |
| Buprenorfina | 0,02-0,05 mg/kg SC/IM/IVL TID | 0,05 mg/kg SC/IM/IVL TID | 0,05 mg/kg SC/IM/IVL TID |
| Lidocaína | 3 mg/kg/h | 3 mg/kg/h | 3 mg/kg/h |
| Fentanilo | 10-15 mg/kg/h (parche)* | 10-15 mg/kg/h (parche)* | 10-15 mg/kg/h (parche)* |
| Metoclopramida | 2 mg/kg PO/SC TID | 0,5 mg/kg PO/SC TID | 0,5 mg/kg PO/SC TID |
| Domperidona | 0,3-0,5 mg/kg PO TID | 0,3-0,5 mg/kg PO TID | 0,3-0,5 mg/kg PO TID |
* Elegir el parche de fentanilo adecuado en función del peso del animal para que la dosis de absorción esté a esa dosis.
1 SID: cada 24 h; BID cada 12 h; TID: cada 8 h.
- Ayuno: en estas especies no es necesario el ayuno porque fisiológicamente no vomitan ya que tienen un cardias muy desarrollado. Como precaución, se retira la comida una hora previa a la intervención para que disminuya ligeramente el volumen del estómago y no lleguen al quirófano con contenido en la boca y no coman una vez que se le ha inducido con el midazolam, ya que este fármaco estimula el apetito y frecuentemente desencadena la respuesta de comer.
Sin embargo, se debe dejarles el agua para que beban antes de la cirugía y tengan la boca lo más limpia posible.
Existen situaciones que requieren precauciones especiales:
- En animales con polidipsia, se consultará con el veterinario si puede ser recomendable retirar el agua para que no entren al quirófano con el estómago muy lleno de líquido.
- En animales con obstrucciones intestinales no deberían tener acceso ni a comida ni agua para no empeorar el cuadro.
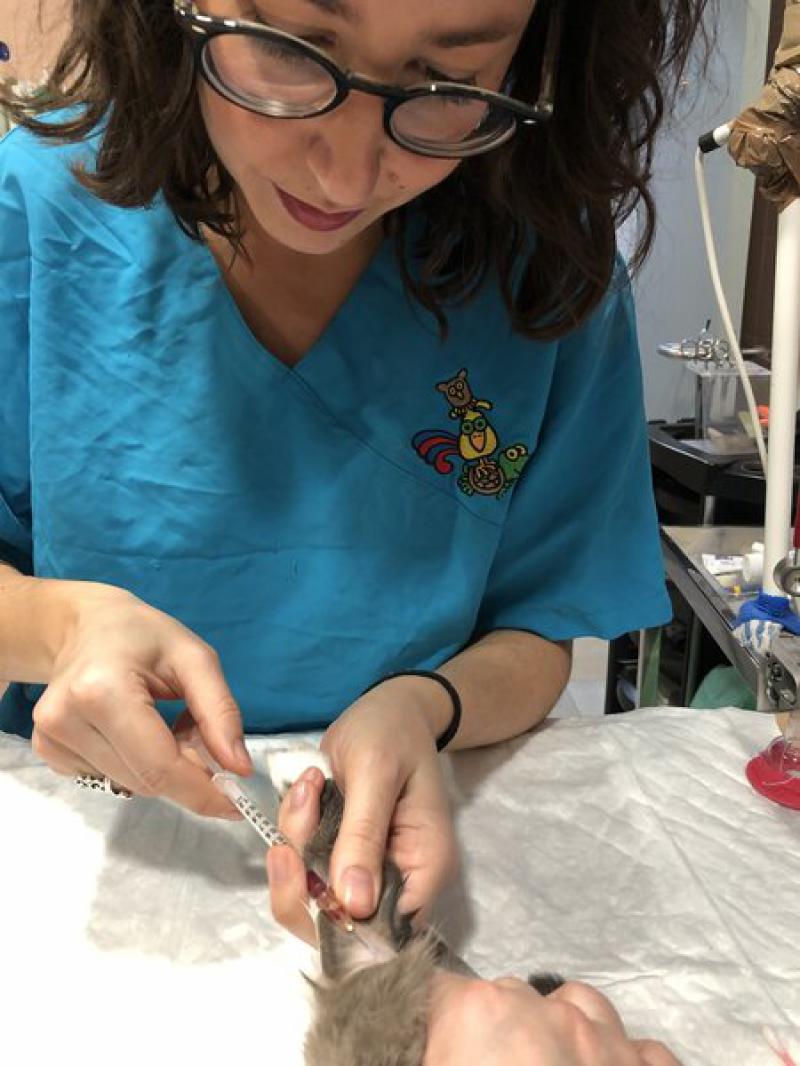
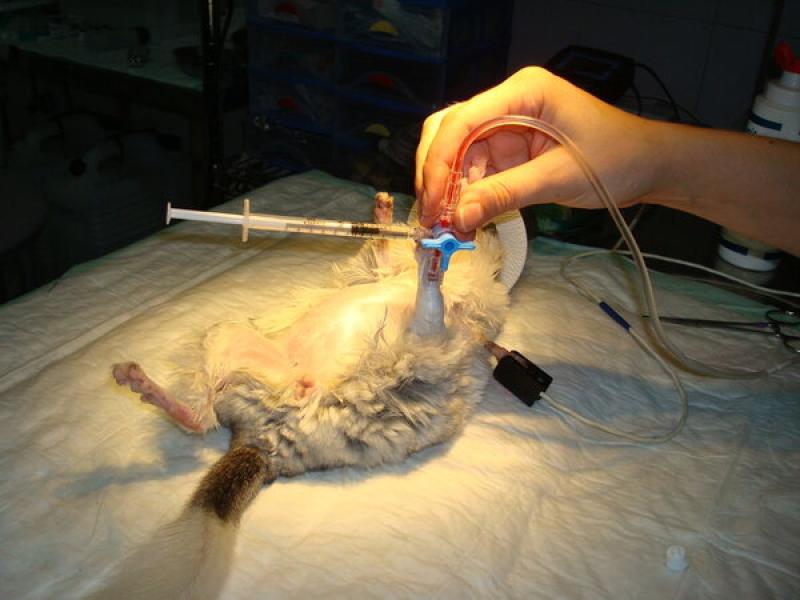
Antes de inducir la anestesia se debe comprobar el estado de la cavidad oral con un bastoncillo de algodón y, si se observan restos de heces o comida, se les administrarán 3-5 ml de suero oral con jeringuilla para limpiarles la boca (Figura 6). Las cobayas son especialmente propensas a realizar coprofagia estando en ayunas o tras la administración de midazolam, por lo que generalmente se mantendrán en brazos una vez limpia su boca y premedicadas. - Cateterización intravenosa: todos los pacientes reciben fluidoterapia intravenosa intraoperatoria con fluidos elegidos por el veterinario según cada caso. La fluidoterapia intravenosa es recomendable para controlar la tensión y la perfusión sanguínea durante la anestesia.
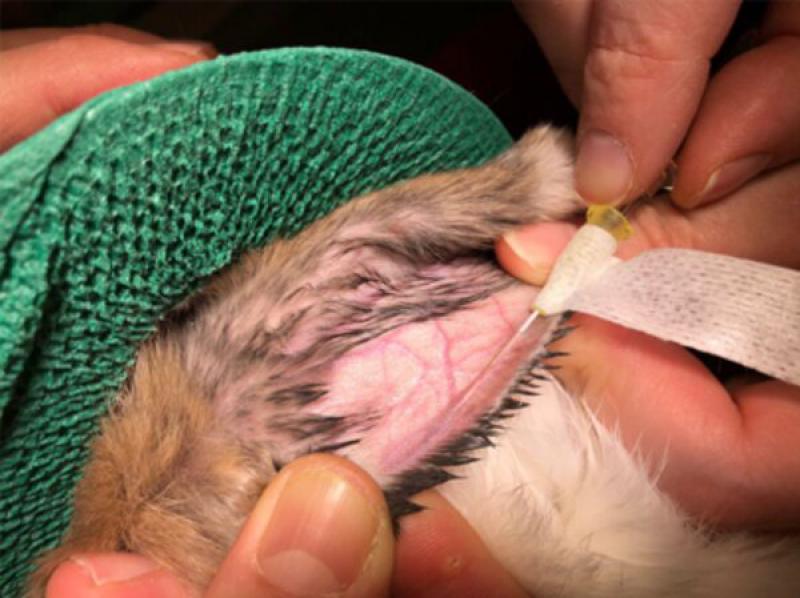
En los conejos el catéter intravenoso se coloca como primera opción en la vena marginal de la oreja (Figura 7); y si no es posible, en la vena cefálica. Si ninguna de estas venas está disponible, pueden considerarse otras venas periféricas como digital común del pie, safena lateral, yugular u otras.
En las cobayas y las chinchillas elegimos como primera opción la vena cefálica (Figuras 8 y 9) y, de no ser posible, la vena safena o digital común del pie.

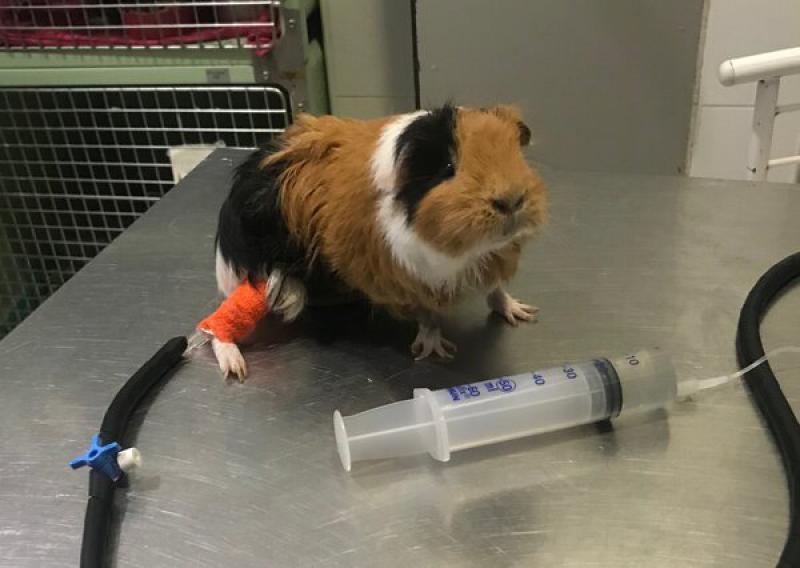
Precaucion con los sistemas de goteros
Tanto los conejos como los roedores suelen morder los extensores de suero y los cortan con sus afilados incisivos. Para proteger la vía de fluidoterapia es útil el uso de protectores helicoidales, que existen en el mercado para proteger o agrupar cables eléctricos.
- Preparación del campo quirúrgico: Se realiza de forma similar a otros mamíferos. La zona de la incisión se rasura con márgenes de unos 2 cm siempre que sea posible.
Para la asepsia se preparan gasas empapadas en alcohol 70º con clorhexidina al 0.05 %, alternando con gasas con clorhexidina al 0.05 %. La clorhexidina es algo menos irritante que el iodo y tiene la ventaja de tener mayor efecto antiséptico residual, ya que se fija a la queratina.
Se realizan un mínimo de 3 pasadas con cada solución o hasta que las gasas salgan completamente limpias y la última de alcohol con clorhexidina sin pasar gasa. Normalmente la piel de estos animales es mucho más limpia que la de un perro a excepción quizá de las cobayas que suelen presentar más suciedad y descamación en la piel. - Intubación: Se puede establecer como protocolo del centro la intubación a todos los conejos tras la inducción anestésica. La intubación endotraqueal en el conejo se realiza a ciegas y se realiza preferiblemente por el veterinario anestesista.
En cambio, se evita la intubación rutinaria de las cobayas y las chinchillas, debido a sus peculiaridades anatómicas. Estos animales poseen una tráquea pequeña con diámetro interno a penas superior a 2 mm y un paladar blando largo y fusionado en gran parte con la base de la lengua, dejando el denominado ostium palatum (orificio palatino). Este pequeño orificio no permite visualizar la laringe y dificulta mucho la intubación, salvo que se haga mediante endoscopia.
En caso de ser imprescindible la intubación (cirugías de tórax o cavidad nasal) se recurrirá a la intubación endoscópica para ver la glotis y se usará un tubo endotraqueal 2.0 mm acortado, para que se adapte mejor al tamaño del animal, e insertado sobre una óptica rígida de 1.9 mm.
No obstante, dado que las cobayas y las chinchillas son respiradores nasales obligados, el uso de mascarillas bien ajustadas permite la monitorización por capnografía nasal durante la anestesia e incluso la ventilación por presión positiva en caso de necesidad.
Una complicación frecuente de ventilación por presión positiva mediante mascarilla es la entrada del aire al estómago.
Cuidados postquirúrgicos
Alojamiento y toma de constantes: el paciente se dejará en la instalación diáfana, para evitar que se golpee accidentalmente en los primeros intentos de incorporarse. Se usarán empapadores reutilizables en el suelo y una toalla o manta que envuelva suavemente y sin presión al animal. Esta toalla o manta lo mantendrá recogido por si se mueve bruscamente y evita la hipotermia, otro gran riesgo de los animales pequeños, ya que al tener mayor superficie corporal en relación a su volumen, pierden calor más fácilmente. El riesgo de hipotermia debe controlarse especialmente durante y después de la anestesia. Al quedarse el animal inmóvil mientras sigue adormilado es fácil que se quede frío, especialmente si además está parcialmente rasurado.
También se debe comprobar que quedan secos.
Si se detecta que la temperatura corporal es baja, es conveniente proporcionar una fuente extra de calor, ya sea con un secador, una manta eléctrica o una bolsa de semillas calientes, teniendo siempre mucho cuidado de no quemar al animal. Algunos animales pueden requerir recuperación en incubadora.
El veterinario puede solicitar la toma de constantes vitales:
| Tabla 2. Frecuencias respiratorias y cardiacas normales en conejos, cobayas y chinchillas. |
| Especie | FR (rpm) | FC (ppm) | Temperatura (ºC) |
| Conejo (Oryctolagus cuniculus) | 30-60 | 180-300 | 38-39.5 |
| Cobaya (Cavia porcellus) | 40-100 | 220-310 | 37-39 |
| Chinchilla (Chinchilla lanígera) | 40-80 | 150-200 | 36.5-38 |
Vigilancia y procedimientos: el papel del ATV en este punto es especialmente importante.
Por un lado, debe vigilar que el paciente se recupere por completo y correctamente de la anestesia y, por otro, debe prevenir el riesgo de hipotermia y también vigilar el comportamiento del animal.
Dado que, en algunos centros los efectos de la anestesia se revierten por fármacos antagonistas al terminar el procedimiento quirúrgico, cabe esperar una recuperación rápida de la conciencia y ambulación normales.
Alimentación:
Lo ideal en estos animales es que muestren apetito de manera prácticamente inmediata (lógicamente no siempre es así y además algunos pueden haber presentado anorexia ya antes de la intervención). Una vez que se hayan pasado los efectos de la anestesia y el paciente esté consciente y activo, se le puede volver a poner la comida, agua y bandeja de aseo con sustrato en la instalación.
Se debe ofrecer una controlada variedad de alimento: heno, alguna otra planta henificada (diente de león, esparceta, tupinambo, etc.), pienso y verdura de hoja fresca. En caso de no mostrar apetito normal, debe comunicársele al veterinario para que prescriba pautas de nutrición e hidratación oral. El uso de papillas especiales para herbívoros son las más indicadas.
Algunos conejos o roedores pueden preferir beber soluciones de hidratación oral frente al agua normal. Ofrecer estas soluciones puede aumentar el consumo de líquido.
Por otro lado, es recomendable ofrecerles líquido tanto en bebederos de cuenco como de botella (ya que sus preferencias y experiencias previas pueden jugar un importante papel en el consumo de líquido).
La ingesta normal de líquido para estas especies es entre 100 y 150 ml/día. Lógicamente, si están recibiendo fluidoterapia, el consumo de agua puede disminuir. Por otro lado, consumen más agua cuando comen alimento seco (pienso, heno, etc.) que cuando comen alimento fresco (verdura de hoja).
Todos los herbívoros mastican meticulosamente lo que comen. En caso de estar contraindicada la masticación (procedimientos dentales, fracturas en el cráneo, etc.) puede ser necesaria la colocación de una sonda nasogástrica de 1 a 2.1 mm de diamétro.
Colocación de una sonda nasogástrica:

Para colocar una sonda nasogástrica se aplicarán unas gotas de lidocaína en la nariz y se medirá y marcará en la sonda la longitud desde la punta de la nariz hasta la primera costilla. Con la cabeza del animal sujeta y el cuello flexionado. Ventralmente se introducirá la sonda por una narina apuntando hacia el septo nasal medio. Se avanzará hasta el estómago (según la marca que se ha hecho)(Figura 10).
La correcta colocación se comprueba mediante suave aspiración y visualización del contenido gástrico en la sonda o, en caso de duda, mediante radiografía.
Control de heces y orina:
Además del consumo de alimento y líquido, se debe monitorizar la producción de heces y orina.
Estos animales defecan casi constantemente a lo largo del día. La producción de heces se considerará normal si supera 80 pellets/día. También se tendrá que observar el tamaño y forma de las mismas. Lo normal en estas especies es producir heces muy regulares en tamaño y con una forma característica.
El consumo de comida puede ser difícil de monitorizar de manera exacta en los conejos, sin embargo, la producción de heces es una forma más objetiva de valorar si la ingesta es adecuada.
En el caso de los conejos se debe recordar que, además de los pellets fecales secos (Figura 11), producen heces húmedas, llamadas cecotrofos una o dos veces al día (Figura 12).


Los cecotrofos son normalmente ingeridos por el conejo directamente del ano y son una fuente de reaprovechamiento de ciertos nutrientes muy importantes. Si se observa producción de cecotrofos que no han sido ingeridos, se debe registrar.
La producción normal de orina es entre 50 y 100 ml/día. Monitorizar la producción de orina puede ser difícil, ya que, especialmente los conejos, tienden a usar la bandeja de sustrato para orinar. Por este motivo es recomendable cambiar la bandeja al menos unas 3 veces al día.
Control del dolor:
La analgesia adecuada es fundamental para una buena recuperación. Por este motivo es importante también saber reconocer los signos de dolor en estos animales (Figuras 13 y 14).


Tanto los conejos como las cobayas y chinchillas muestran posturas y expresiones faciales de dolor, ojos entrecerrados, orejas pegadas, hocico puntiagudo con bigotes estirados hacia delante, postura encogida, temblores o sacudidas, inmovilidad y bruxismo (rechinar los dientes) suelen ser signos de dolor. El dolor puede ser causa de anorexia e hipomotilidad digestiva.
Tratamiento post quirúrgico:
Una vez finalizada la cirugía y recuperada la conciencia, se le administra al paciente analgesia y un fármaco procinético según prescripción veterinaria. Los fármacos comúnmente usados para analgesia post-quirúrgica son buprenorfina por vía intravenosa o subcutánea, fentanilo administrado mediante parches transdérmicos o lidocaína administrada mediante infusión a ritmo constante.
Dado el pequeño calibre de las venas de estos animales, es necesario recurrir a infusores o bombas de jeringa. Los goteos o las bombas de gravedad, comúnmente usadas en perros y gatos, no dan buen resultado en estos pacientes.
El uso de procinéticos está encaminado a paliar el efecto negativo sobre la motilidad del tubo digestivo.
Tanto los conejos como las cobayas y chinchillas son animales herbívoros fermentadores. La disminución del peristaltismo o motilidad digestiva tiene efectos negativos sobre el apetito y la salud de estos animales. Generalmente algunos protocolos describen el uso de la metoclopramida por vía subcutánea imediatamente después de la cirugía.
Conclusiones
El correcto cuidado perioperatorio es clave para la recuperación de los pequeños herbívoros.
Conocer sus peculiaridades anatómicas y fisiológicas es necesario para un correcto protocolo para aumentar la tasa de éxito de las cirugías realizadas en estos animales. En particular, se deben cuidar los siguientes puntos principales:
- Alojamiento con caseta y un compañero o elemento de consuelo para minimizar el estrés.
- Ofrecer alimento y líquido en variedad y cantidad correcta que fomente el consumo.
- Monitorización de producción de heces y orina es imprescindible para evaluar el correcto funcionamiento y la motilidad del sistema digestivo. En conejos se debe prestar atención tanto a las heces duras como a las blandas (cecotrofos).
- La hipotermia, el consumo disminuido de agua y alimento y la hipomotilidad digestiva son las complicaciones postoperatorias más comunes en conejos, cobayas y chinchillas.
- El correcto control del dolor y estrés es fundamental durante la recuperación. Es importante reconocer los signos de dolor y miedo que muestran típicamente estas especies.
- Por último, en animales que requieren fluidoterapia o medicación en infusión a ritmo constante, es importante proteger los extensores de suero para evitar que sean mordidos.
Referencias
- Ballard BM, Cheek R. Exotic Animal Medicine for the Veterinary Technician. Wiley Blackwell. 2003
- Meredith A, Lord B. BSAVA Manual of Rabbit Medicine. British Small Animal Veterinary Association. 2014
- Jimenez J, Domingo R, Crosta L, Martinez Silvestre A. Manual clínico de animales exóticos. Mutimédica Ediciones Veterinarias. 2009
- Montesinos A, Ardiaca M. Guía Terapéutica de Animales Exóticos. Multimédica Ediciones Veterinarias. 2017
 by Multimédica
by Multimédica