Las funciones del ATV en un laboratorio clínico
Resumen breve
El laboratorio clínico es un servicio de los centros veterinarios, en el cual se realizan analíticas de muestras biológicas para obtener un diagnóstico o llevar a cabo el seguimiento de una patología ya conocida. Es frecuente que los centros cuenten con un laboratorio propio. Disponer de esta área agiliza y facilita el tratamiento de los pacientes, ya que se consiguen resultados en cuestión de minutos. Las funciones del ATV en el laboratorio son conocer las muestras biológicas más habituales…Índice de contenidos
Resumen
El laboratorio clínico es un servicio de los centros veterinarios, en el cual se realizan analíticas de muestras biológicas para obtener un diagnóstico o llevar a cabo el seguimiento de una patología ya conocida. Es frecuente que los centros cuenten con un laboratorio propio. Disponer de esta área agiliza y facilita el tratamiento de los pacientes, ya que se consiguen resultados en cuestión de minutos.
Las funciones del ATV en el laboratorio son conocer las muestras biológicas más habituales tales como sangre, orina y heces, así como las menos comunes, como por ejemplo los líquidos orgánicos. También deben saber trabajar utilizando las técnicas adecuadas para cada muestra siguiendo los protocolos normalizados de trabajo. Desde que el veterinario decide que se requiere un estudio laboratorial hasta que llega el resultado a sus manos, todo corre a cargo del ATV.
Este artículo tiene como objetivo exponer las muestras y técnicas más habituales que se pueden encontrar en un centro veterinario, así como tratar el proceso analítico, resaltando los puntos más importantes para este perfil.
Introducción
El laboratorio clínico es un servicio dentro de los hospitales que tiene como objetivo analizar muestras biológicas con el fin de obtener unos resultados que aporten información sobre la salud del paciente.
Cada vez más centros cuentan con un laboratorio propio. Este tipo de laboratorios se denominan POCT (Point of care testing). Por definición, el POCT es aquel sistema analítico que se localiza muy cerca de los pacientes y que permite obtener una serie de resultados precisos en un breve lapso de tiempo. Las ventajas de contar con un laboratorio de estas características son, principalmente: proporcionar datos de manera rápida y una disponibilidad total, pudiendo ser utilizados 24 horas al día; de manera fácil e intuitiva debido a la simplicidad del diseño de los dispositivos.
El laboratorio es una de las áreas en las que, como ATVs, se pueden llevar a cabo más tareas sin la estricta supervisión de un veterinario. Sin embargo, es necesaria una formación específica y experiencia para poder asegurar unos resultados fiables siguiendo, sin excepción, los protocolos normalizados de trabajo.
Los protocolos normalizados de trabajo (PNT) son documentos que describen una secuencia objetiva que siempre debe repetirse, de modo que, si en algún momento ocurre un error, sea fácil descubrirlo y poder corregirlo. También proporcionan una absoluta seguridad a la hora de comparar resultados, ya sea en el mismo paciente en distintas fechas, o en estudios clínicos.
Los análisis habituales en la clínica son:
- Sangre: hemograma, frotis, bioquímica, serología (test rápidos). En las clínicas dónde se hagan transfusiones también se realizarán pruebas cruzadas (crossmatching), con el fin de garantizar un proceso seguro para el receptor.
- Orina: tiras bioquímicas, densidad urinaria y sedimento.
- Heces: análisis coproparasitológicos.
- Otras muestras: citologías, bioquímicas, recuentos celulares.
En cuanto a la bacteriología, algunas clínicas han comenzado a realizar cultivos, en lugar de enviarlos a laboratorios externos, sin embargo, no es una práctica recomendable salvo que se cuente con las instalaciones necesarias y un personal especializado, ya que se requieren unos conocimientos y destrezas muy específicas y concretas para poder obtener resultados certeros. En este caso, un resultado erróneo es más perjudicial que ningún resultado. Por este motivo, lo más indicado es recoger la muestra y enviarla a un laboratorio de referencia lo antes posible.
Conocer las funciones que debe desempeñar un ATV pasa por conocer el proceso analítico. El proceso comienza con la decisión del veterinario de extraer una muestra biológica, desde este instante hasta que los resultados estén en su mano de nuevo, todo forma parte de las competencias del ATV.
La solicitud analítica debe contar con la siguiente información:
- Nombre del paciente.
- Nombre y apellidos del propietario.
- Número de historia clínica o número de identificación.
- Muestra, técnica de extracción y pruebas solicitadas.
- Veterinario responsable.
- Tipo de petición (urgente o normal).
- Alteraciones en la extracción.
Una vez esta información es comunicada, se producirá la extracción de la muestra por parte de la persona responsable, ya sea ATV o veterinario.
- Extracción de sangre. La obtención de sangre es una competencia habitual de ATVs, siendo las venas de elección: cefálica, safena y yugular. La sangre será trasvasada rápidamente a los tubos elegidos, siguiendo el orden determinado por el PNT del laboratorio.
- Extracción de orina. La técnica más adecuada para conseguir unos resultados totalmente realistas, sin interferencias, es la cistocentesis. Será realizada por veterinarios con ayuda del ecógrafo.
- Obtención de heces. Las heces aportan mucha información al diagnóstico, no sólo sobre el estado del aparato digestivo en sí, sino también a la hora de advertir la presencia de patógenos, como parásitos o bacterias. Si bien pueden recogerse en el hospital, de forma habitual, serán los propietarios los encargados de su recogida.
- Extracción de líquidos orgánicos. Al igual que la orina, serán recogidos por veterinarios mediante punción ecoguiada.
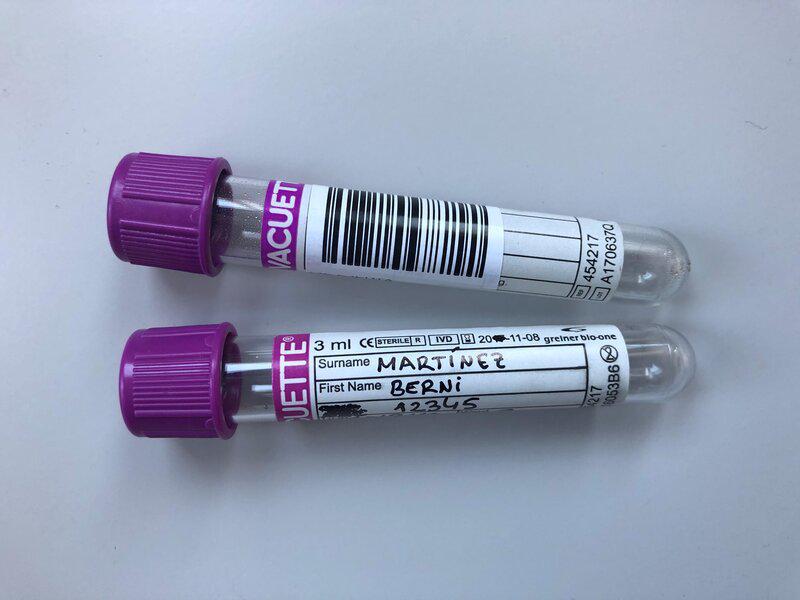
Inmediatamente, nada más conseguir la muestra, debe ser identificada de forma clara para diferenciarla de otras muestras, ya sea con una etiqueta adhesiva que lleve impreso un código de barras o rotulando el nombre del paciente. Tanto el rótulo como las etiquetas adhesivas siempre deben ponerse en el bote que contenga la muestra, nunca en la tapa ya que esta puede perderse, además, las etiquetas adhesivas se colocarán en vertical (Figura 1).
Si la muestra va a ser enviada a un laboratorio externo, deberá identificarse y cumplimentar la petición de análisis siguiendo las pautas de etiquetado, recogida, conservación y transporte, exigidas por el propio laboratorio, de forma rigurosa, para garantizar su viabilidad. De no ser así, la muestra no podrá ser procesada y el laboratorio solicitará una nueva muestra, por lo que se tendrá que repetir el proceso de extracción y envío, retrasando el resultado.
Los envíos a los laboratorios externos seguirán las normas de dicho laboratorio, sin embargo, el envío de muestras biológicas debe seguir siempre “la regla de los tres envases”. Por ejemplo, si se envía una sangre en EDTA, el recipiente primario (el bote de EDTA) se debe cerrar con una película termoplástica que impida derrames, además se envolverá con un material absorbente.
Este conjunto se introducirá en una bolsa sellada, que será el recipiente secundario y finalmente, en un sobre plastificado, es decir, el recipiente terciario. De esta forma, no solo se protege la muestra en sí sino, también a todas las personas que estén en contacto con ella, ya que nunca se debe olvidar que las muestras biológicas se consideran siempre potencialmente contagiosas.
Si, por el contrario, es una muestra que se va a analizar en el propio hospital, el ATV del laboratorio es el encargado de procesarla. Antes de comenzar la preparación, habrá que determinar si puede ser aceptada o hay que rechazarla. Se rechazarán, por ejemplo, las muestras coaguladas o en recipientes inadecuados, siendo imprescindible la obtención de una nueva muestra.
Cuando la muestra haya sido aceptada, el ATV debe prepararla para el análisis. En el caso de las sangres, dependiendo del estudio, se puede necesitar sangre entera, plasma o suero; estos dos últimos, se obtendrán tras la centrifugación. Mientras que la orina, se dividirá en dos alícuotas (partes proporcionales): una de ellas se centrifugará para el examen del sedimento; y la otra directamente se destinará al estudio fisicoquímico, es decir, la tira y la densidad.
Desde que el veterinario decide que va a haber un análisis hasta este instante, se denomina “fase preanalítica” y es la etapa en la que se concentran más errores (más del 80 %), por lo que es cuándo más atención se debe prestar. Los errores preanalíticos van desde confusiones a la hora de introducir los nombres de los pacientes, muestras defectuosas, conservación inadecuada hasta procedimientos erróneos o fallos del personal.
La siguiente fase, es la “fase analítica”, que es en la que la muestra se somete a las determinaciones solicitadas. En las clínicas veterinarias, la inmensa mayoría de los estudios analíticos son automáticos, mientras que los manuales se reservan a citologías, análisis coproparasitológicos y sedimentos urinarios. Los estudios son, con frecuencia, realizados por veterinarios, si bien es cierto que los ATVs con formación pueden interpretarlos igualmente; en el caso contrario, todos estos análisis corren a cargo del ATV hasta que llega el momento de la observación al microscopio.
Durante esta fase, es esencial no solo seguir estrictamente los protocolos (PNT) sino realizar calibraciones y controles de forma periódica a los dispositivos. Los errores de la fase analítica pasan por el mal estado de los equipos, el desgaste de reactivos o errores de dilución, y en el caso de muestras manuales, la falta de experiencia o destreza del personal que lo realiza.
Al terminar la prueba analítica, comienza la “fase postanalítica” se obtendrán unos resultados que deben ser aprobados por un ATV capacitado o por un veterinario. De tal modo que, si algún parámetro está alterado de una forma ilógica, se deberá repetir la prueba. Si, por el contrario, aun teniendo valores fuera de los rangos de referencia, tienen sentido, se entregarán al veterinario responsable. Se puede dar también la situación de que se obtengan “resultados de peligro”, que son aquellos valores que comprometen la salud del paciente de forma grave y urgente, como por ejemplo, unos valores muy elevados de potasio; si se da esta circunstancia se debe avisar inmediatamente al veterinario. En esta fase, los errores son, en su gran mayoría, fallos en la transcripción de los resultados a los historiales o informes.
Muestras biológicas y técnicas laboratoriales más habituales en un centro veterinario
Sangre
La sangre es la muestra biológica más frecuente que se ve en los centros veterinarios. Se trata de un líquido imprescindible para la vida que fluye por los vasos sanguíneos (sangre periférica); si bien es posible extraer muestra de sangre capilar y arterial, la sangre venosa es la de elección para estudiar el estado global del organismo. Los análisis que se realizan, de manera sistemática, son hemogramas y bioquímicas. El hemograma es un estudio básico de los elementos formes de la sangre, es decir, de las células y las plaquetas, tiene un carácter cuantitativo y cualitativo (Tabla 1). En relación a la serie roja, el parámetro más relevante es el hematocrito mientras que, en la serie blanca, la atención debe centrarse en la fórmula leucocitaria.
| Tabla 1 . Significado de los distintos parámetros del hemograma. |
| Serie | Parámetro | Significado | Definición |
| Serie roja | RBC | Recuento eritrocitos | Número de eritrocitos por microlitro |
| HTO | Hematocrito | Cantidad de eritrocitos en relación al volumen de sangre total, expresado en porcentaje | |
| HGB | Hemoglobina | Cantidad de hemoglobina total | |
| MCV | Volumen corpuscular medio | Tamaño medio de los eritrocitos | |
| MCH | Hemoglobina corpuscular media | Peso de la hemoglobina por eritrocito | |
| MCHC | Concentración de hemoglobina corpuscular media | Relación entre el peso de la hemoglobina y el tamaño de los eritrocitos | |
| RDW | Amplitud de distribución eritrocitaria | Coeficiente de variación en la distribución del tamaño de los eritrocitos. | |
| % RET | Porcentaje de reticulocitos | Porcentaje de eritrocitos jóvenes. | |
| RET | Recuento de reticulocitos | Número de eritrocitos jóvenes por microlitro. | |
| RET-HE | Hemoglobina en reticulocitos | Cantidad de hemoglobina en eritrocitos jóvenes. | |
| Serie blanca | WBC | Recuento de leucocitos | Número de leucocitos por microlitro. |
| % NEU | Porcentaje de neutrófilos | Fórmula leucocitaria. | |
| % LYM | Porcentaje de linfocitos | ||
| % MON | Porcentaje de monocitos | ||
| % EOS | Porcentaje de eosinófilos | ||
| % BAS | Porcentaje de basófilos | ||
| NEU | Recuento de neutrófilos | Número de neutrófilos por microlitro. | |
| LYM | Recuento de linfocitos | Número de linfocitos por microlitro. | |
| MON | Recuento de monocitos | Número de monocitos por microlitro. | |
| EOS | Recuento de eosinófilos | Número de eosinófilos por microlitro. | |
| BAS | Recuento de basófilos | Número de basófilos por microlitro. | |
| Serie plaquetaria | PLT | Recuento de plaquetas | Número de plaquetas por microlitro. |
| MPV | Volumen plaquetario medio | Tamaño medio de las plaquetas. | |
| PDW | Amplitud de distribución plaquetaria | Coeficiente de variación en la distribución del tamaño de las plaquetas. | |
| PCT | Plaquetocrito | Cantidad de plaquetas en relación al volumen de sangre total, expresado en porcentaje. | |
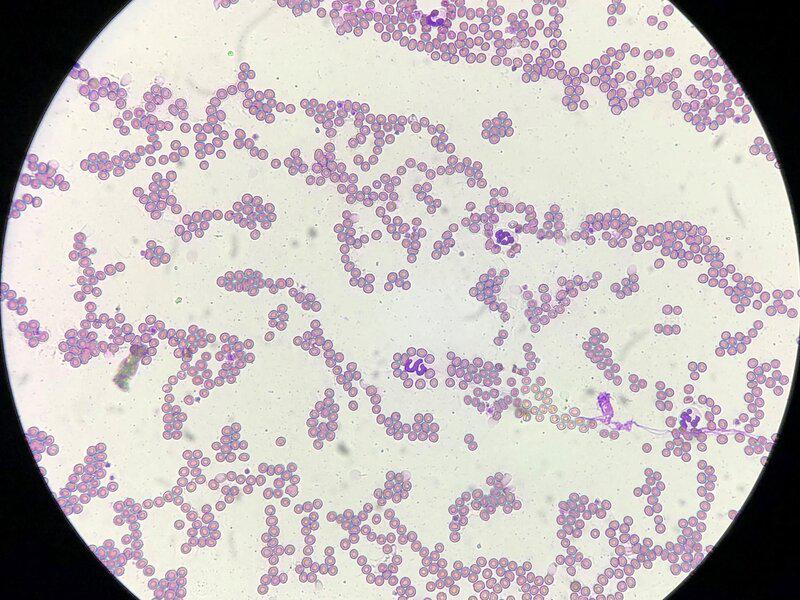
En numerosas ocasiones, el resultado del hemograma se debe contrastar con un examen microscópico de una extensión de sangre periférica, más conocido como “frotis”. Para realizar un frotis adecuado se debe usar sangre con EDTA, depositar una pequeña gota en un portaobjetos y, con otro porta, extenderlo en una capa fina y dejarlo secar al aire. Una vez esté completamente seco, se procede a la tinción. La más frecuente debido a su simplicidad y rapidez es la panóptica rápida o diff quick (Figura 2). Consta de tres reactivos: un fijador, un colorante ácido (eosina) y uno básico (azul de metileno). Se debe introducir en cada reactivo unos cinco segundos y, al terminar, aclarar con agua fría. Los tiempos de tinción pueden variar, dependerán de las preferencias de la persona que vaya a interpretarlo.
Por otro lado, la bioquímica sanguínea es un conjunto de determinaciones de sustancias presentes en la fracción líquida de la sangre: el plasma o suero como, por ejemplo, la glucosa o la creatinina. Estos parámetros son importantes para conocer la función hepática o renal, entre otras. De forma menos frecuente se realizan los estudios de coagulación, especialmente antes de cirugías.
Una de las funciones primordiales que debe tener un ATV en el laboratorio es velar por la seguridad y la buena conservación del material biológico, independientemente de la muestra que sea.
En el caso de la sangre, un fallo frecuente suele ser el hecho de no enrasar los tubos con la cantidad indicada. Por ejemplo; si se llena más, habrá demasiada sangre para el anticoagulante y este no podrá cumplir su cometido, por lo que aparecerá un coágulo que invalidará el resultado del hemograma o, si se va a realizar un frotis y se usa sangre de un tubo poco lleno, las células estarán deformadas por exceso de anticoagulante por lo que no se podrá apreciar su morfología real.
A la hora de extraer la sangre, es necesario conocer qué pruebas se van a realizar para poder elegir los tubos (Tabla 2). Aunque se da por hecho que es un código estandarizado, no es del todo así, sin embargo, los colores de los tapones dan información del anticoagulante que contienen (Figura 3). Al llegar a un lugar nuevo, se debe reconocer los tubos que se utilizan para evitar posibles confusiones.
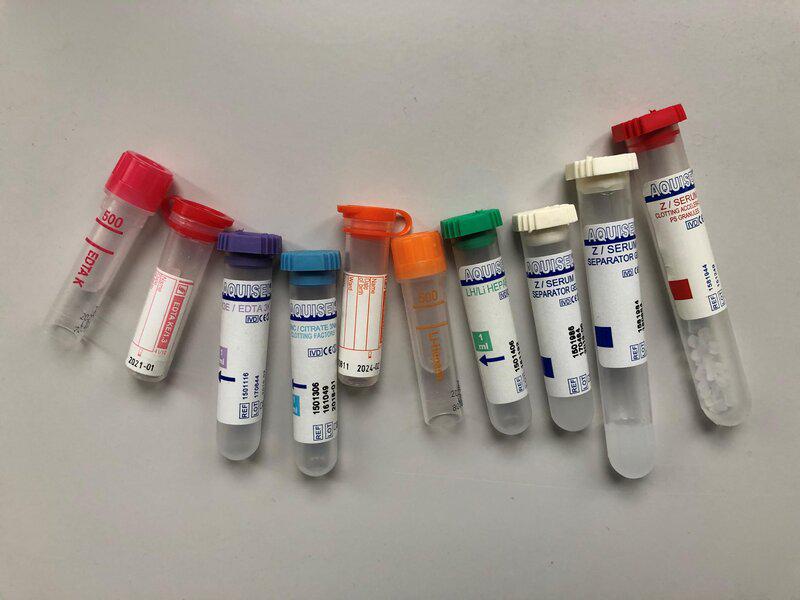
| Tabla 2 . Relación de tubos, anticoagulantes y muestras para análisis de sangre en mamíferos. |
| Color del tubo | Anticoagulante | Muestra obtenida | Estudios |
| Morado o rosa | EDTA tripotásico | Sangre entera | Hemogramas, citologías |
| Azul | Citrato sódico 3,2 % | Plasma o sangre entera | Pruebas de coagulación |
| Verde o naranja | Heparina de litio | Plasma | Bioquímica |
| Blanco | Ninguno, contiene un gel separador | Suero | Bioquímica especial |
| Rojo | Ninguno, contiene un activador de la coagulación | Suero | Bioquímica especial |
Habrá que prestar atención al estado del plasma o suero, dependiendo de la muestra que se utilice. Tanto el uno como el otro, son la fracción líquida de la sangre; la diferencia radica en que el suero surge una vez que se han consumido los factores de coagulación y ha aparecido el coágulo, mientras que el plasma, será el líquido que aparece si se utilizan anticoagulantes. Ambos tienden a ser de un color amarillo muy claro (aunque depende de la especie), prácticamente transparente; sin embargo, pueden tener otros colores, principalmente: blanco (exceso de lípidos), amarillo (exceso de bilirrubina) o rojo (presencia de hematíes).
También se llevan a cabo serologías, test rápidos, usando la sangre. Por ejemplo, en medicina felina, son frecuentes los test diagnósticos de FeLV/FIV que utilizan una de las variantes de la técnica ELISA de unión antígeno-anticuerpo.
Todos los análisis comentados anteriormente son realizados con sangre periférica. Otra muestra que, de forma excepcional, se puede obtener en un hospital veterinario es la médula ósea. Se utiliza para estudios medulares muy complejos, por lo que siempre se envía a un laboratorio externo. Si bien es necesario conocer cómo se procesa tras su extracción, dependerá del criterio del laboratorio o del hospital, por lo que se debe concretar un protocolo específico para esta muestra.
Orina
En las clínicas veterinarias, la segunda muestra más habitual es la orina. Se puede obtener de forma espontánea, por sondaje o por cistocentesis (técnica de preferencia para estudios laboratoriales).
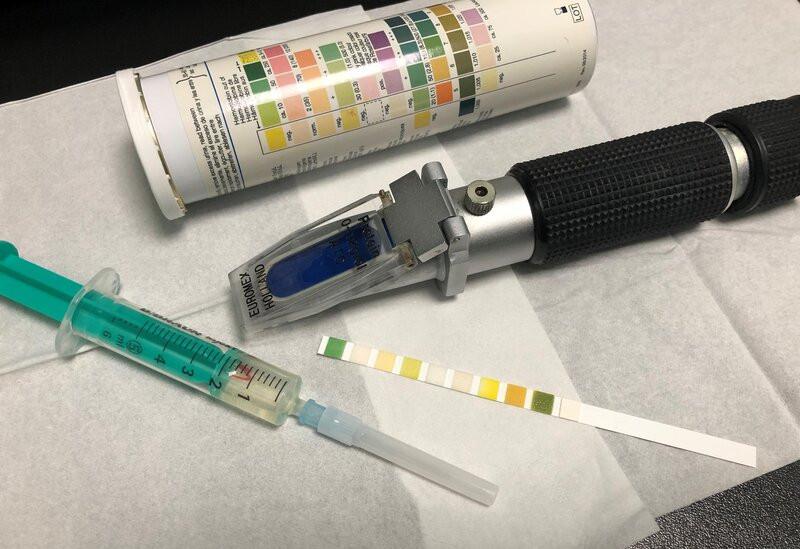
La orina se tiene que observar, en primer lugar, macroscópicamente, que será considerado el análisis físico, atendiendo a color, olor, turbidez y densidad urinaria (utilizando el refractómetro de Goldberg) además se realizará una tira reactiva, análisis químico, en la que se valorarán analitos bioquímicos como proteínas o la presencia de células como los eritrocitos, por ejemplo (Figura 4).
Tras esto, se comienza un estudio del sedimento que se obtiene después de la centrifugación de una cantidad determinada de orina. En el sedimento se suelen observar diversas sustancias, diferenciándolo en, sedimento activo si hay presencia de células, ya sean eritrocitos, leucocitos, bacterias o levaduras; o sedimento inactivo si hay proteínas, glucosa o cristales. Los cristales, dependen del pH, siendo los más frecuentes en orinas ácidas los de oxalato cálcico y, en orinas básicas, los de fosfato amónico magnésico (conocidos comúnmente como, estruvita) (Figura 5).
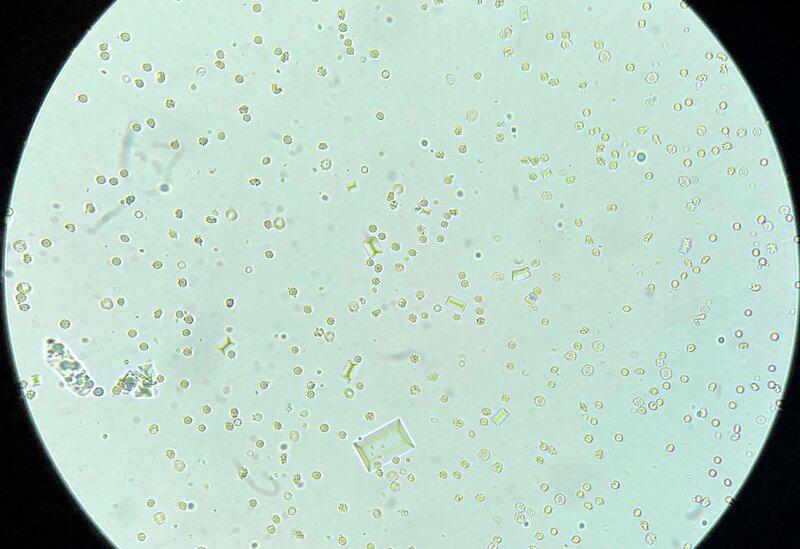
En el caso de que en la clínica se haga el ratio proteína/creatinina (UPC), se utilizará el sobrenadante que se deseche de la centrifugación del sedimento. Este estudio valora la función renal, es muy utilizado en gatos.
Heces
Las únicas muestras que son recogidas por los propietarios son las heces (a excepción de la orina, en situaciones muy específicas) por lo que, como ATVs, es muy importante conocer los criterios de recogida. Las heces destinadas a análisis coproparasitológicos deben ser de tres días consecutivos y almacenadas en frío. Mientras que, en otras ocasiones, como los test rápidos o para PCR de diarreas, es suficiente con una muestra de un único día.
Las técnicas para la observación de parásitos son muy variadas, las más frecuentes, por este orden son: examen directo, por flotación o por sedimentación.
El examen directo es el más sencillo, rápido y barato, por lo que saber prepararlo es conveniente de cara al diagnóstico.
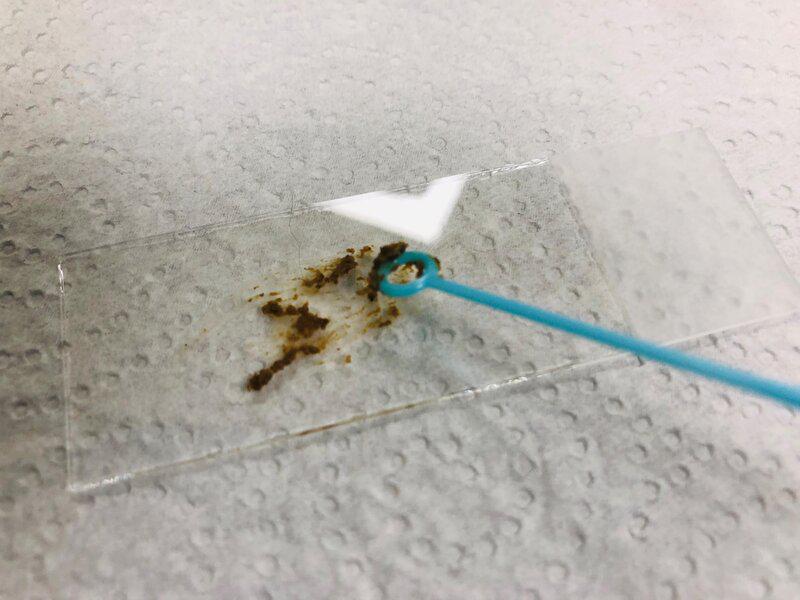
- Se necesita un portaobjetos y un cubreobjetos, un bastoncillo, suero salino, lugol de forma opcional y un microscopio.
- Con un bastoncillo o un asa de siembra, se coge una parte de la muestra, siempre de la zona que resulte más desagradable; aquella donde haya mucosidad, sangre, cambio de color o una franja más líquida.
- Se extiende la muestra por el portaobjetos (Figura 6).
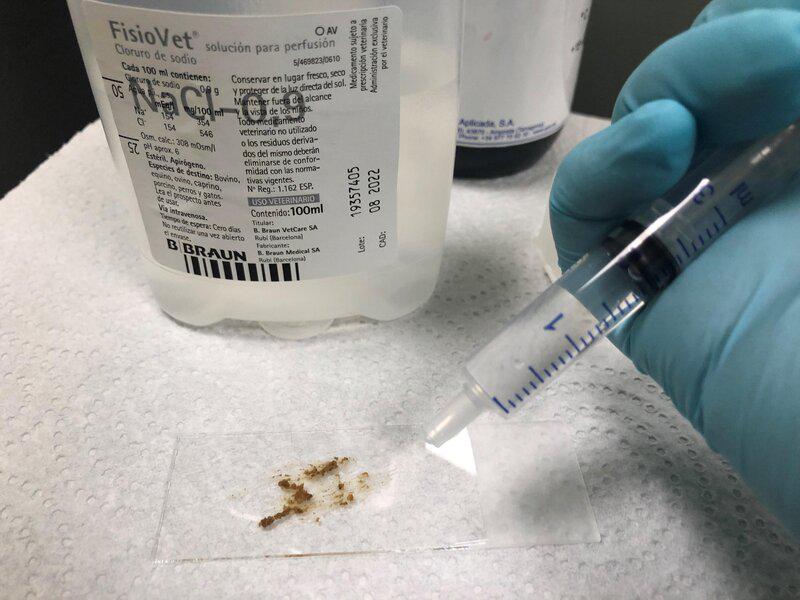
- Se añaden 2-3 gotas de suero salino, para disolver las heces (Figura 7).
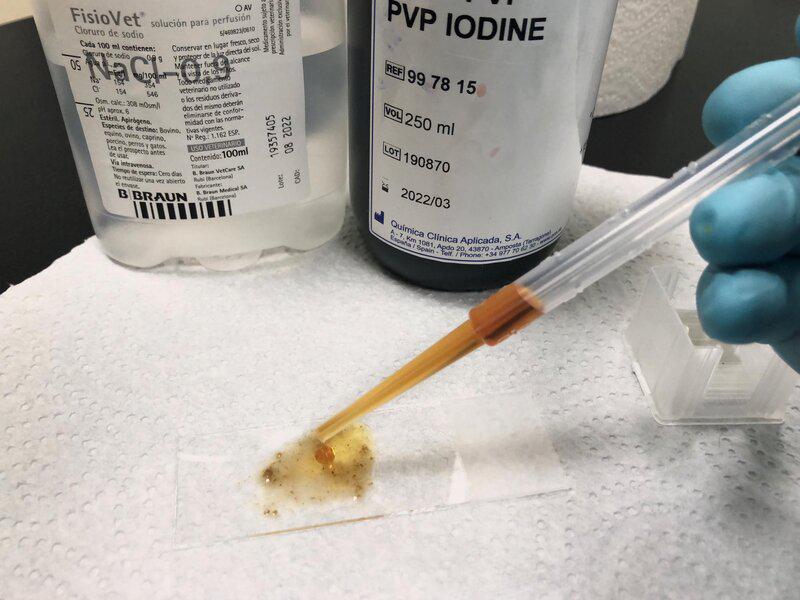
- Se agrega lugol para teñir la muestra (Figura 8).
- Se coloca un cubreobjetos y se observa, con objetivos del 10x y 40x (Figura 9).

Lo más adecuado (aunque en muchas ocasiones no es posible) es hacer el análisis lo antes posible para poder visualizar los parásitos recientes, por ejemplo, en el caso de Giardia spp. se podrán observar los trofozoitos (ejemplares adultos); si, por el contrario, se almacenan unos días en frío y se utilizan distintos químicos para el estudio, los trofozoitos morirán y tan solo se verán los quistes (formas jóvenes).
Además del estudio microscópico, también es importante atender al color de las heces, al olor y a la consistencia. Existe una categorización, la escala de Bristol, conocida comúnmente como, fecal score (FS), que clasifica las heces en siete grupos dependiendo de su consistencia:
FS1. Duras y secas, resulta incómodo expulsarlas y no dejan residuos. Suelen ser bolitas individuales.
FS2. Firmes y secas, forman una única figura segmentada. No dejan residuo o muy poco.
FS3. Firmes pero húmedas, dejan residuos pero mantienen la forma.
FS4. Húmedas, lisas y blandas pero con forma cilíndrica muy definida.
FS5. Muy húmedas, tienen forma poco definida. Dejan mucho residuo.
FS6. Pastosas, muy blandas y sin forma.
FS7. Líquida, sin textura.
Conocer el fecal score es importante no solo de cara al análisis de las heces sino, también, para el control de los pacientes hospitalizados, por ejemplo.

Líquidos orgánicos
Los líquidos orgánicos son: líquido pleural, peritoneal/ascítico, cefalorraquídeo, bilis, etc. (Figura 10). Es fácil verlos en los laboratorios de hospitales y en servicios de urgencias.
De forma habitual, se suelen realizar los siguientes exámenes: observación en fresco, citología del sedimento celular tras el centrifugado y, una parte, se envía a un laboratorio externo para los cultivos microbiológicos. En algunos casos, como el líquido peritoneal, también se realizan análisis bioquímicos, recuentos celulares o, incluso, pruebas diagnósticas como el test de Rivalta.
La muestra más delicada es el líquido cefalorraquídeo. Se trata de un líquido transparente y de consistencia similar al agua, puede presentar cambios de color debido a alteraciones. La citología y bioquímica (proteínas totales y glucosa) se deben analizar en el momento de la extracción, o antes de media hora; la razón es la baja concentración proteica que es la responsable de una rápida degeneración celular además de tratarse de un líquido poco estable. Para las demás determinaciones como las PCR o los cultivos, no es necesario procesarlo con tanta urgencia.
Muestras para citologías
Por último, se encuentra todo tipo de muestras que se destinen a un estudio citológico, agrupándose, esta vez, por técnicas. Las técnicas de diagnóstico en estas muestras son:

- Impronta. Se reservan para biopsias o citologías intraquirúrgicas, se realiza un corte en el tejido a examinar y se presiona el portaobjetos contra la superficie, de tal forma que se imprime sobre él. Es una técnica que se puede extrapolar a otras situaciones en las que las muestras son muy densas, en ese caso, se puede acompañar de una extensión por squash.
- Raspado. Se realiza un raspado utilizando una hoja de bisturí.
- Hisopado. En las áreas auriculares y otras zonas más sensibles, no es aconsejable el raspado, por lo que la muestra se obtiene utilizando una torunda/hisopo, que se presiona en el portaobjetos mientras se rota sobre él.
- PAAF. La punción y aspiración con aguja fina es la técnica más usada y con mayor valor diagnóstico, especialmente en neoplasias. Es una técnica con grandes ventajas, siempre realizada por veterinarios. El ATV debe conocer cómo se realiza la extensión del material aspirado, normalmente por squash, y realizar una tinción para la observación posterior (Figura 11).
- Lavado y cepillado. Para muestras del aparato respiratorio se realizan lavados broncoalveolares y cepillados de la mucosa, siempre bajo anestesia. Son procedimientos muy delicados por lo que la muestra es muy valiosa y hay que hacer las citologías con mucho cuidado de no desperdiciar muestra.
Otras muestras
Por último, otras muestras comunes son las de pelo, piel y oídos. Estas muestras se utilizan, principalmente, para observar si hay presencia de ectoparásitos y/o dermatofitos.
Las pruebas diagnósticas para este tipo de muestras dermatológicas son:
- Tricograma. Con unas pinzas se arrancan unos pequeños mechones de pelo y se depositan en un portaobjetos. Si van a destinarse a microbiología, se introducirán en un microtubo.
- Raspado. Lesiones superficiales, sobre todo en alteraciones planas, se utiliza una hoja de bisturí, vaselina o aceite, portaobjetos y cubreobjetos; es importante rasurar el pelo antes de realizar el raspado. Se puede usar no solo para lesiones, sino también para ectoparásitos como ácaros.
Si bien anteriormente se ha desaconsejado el hecho de realizar cultivos bacteriológicos en clínica debido a su complejidad, en el caso de los cultivos fúngicos no es así ya que son notablemente más sencillos de mantener. Se debe depositar el material (pelo, piel, uñas, etc.) que sea sospechoso de dermatofitosis en el medio de cultivo seleccionado. En la mayoría de los casos, el hongo crecerá en un período de 3 a 7 días; en el caso de ser negativo, no se puede desechar hasta las 3-4 semanas. Una vez haya crecido el dermatofito, deberá observarse al microscopio para su posterior identificación (Figura 12).
ATV en el laboratorio veterinario
A continuación, se puede obtener una perspectiva resumida de las principales funciones del ATV (Tabla 3):
| Tabla 3. Tabla-resumen de las principales funciones de un ATV en el laboratorio. |
| Fases del proceso analítico | |||||||||
| Preanalítica | Recepción y/o extracción de muestras. | ||||||||
| Procesamiento de muestras en la fase preanalítica. | |||||||||
| Preparación y envío de muestras a laboratorio externo. | |||||||||
| Analítica | Manejo de equipos y reactivos, mantenimientos, controles y calibraciones. | ||||||||
| Realización de técnicas manuales. | |||||||||
| Postanalítica | Validación de resultados verídicos, identificación de resultados erróneos y situaciones de peligro. | ||||||||
| Seguimiento de muestras enviadas a laboratorios externos. | |||||||||
| General | Orden y limpieza del laboratorio. | ||||||||
| Gestión adecuada de residuos. | |||||||||
| Control de estocaje. | |||||||||
Conclusiones
El laboratorio clínico es un servicio fundamental para el diagnóstico, tratamiento y seguimiento de patologías en el centro veterinario.
Es muy importante conocer las características de cada muestra biológica, así como los procedimientos de conservación y transporte, con el fin de asegurar su viabilidad.
El procesamiento de estas muestras y la realización de las determinaciones analíticas forman parte de las competencias de los ATVs, por lo que una formación especializada en esta área, así como la elección de perfiles profesionales específicos (técnicos de laboratorio formados en veterinaria) para desarrollar estas tareas, influirá positivamente en la obtención de resultados fiables que permitan al veterinario llegar al diagnóstico acertado.
Bibliografía
Juste de Santa-Ana, MC., Carretón Gómez E.; Fundamentos de análisis clínicos en animales de compañía; Multimédica Ediciones Veterinarias; 2015; Barcelona.
Mariano J., Morales A.; Atlas de hemocitología veterinaria (2º edición); Servet Editorial; 2009; Zaragoza.
Valenciano A., Cowell, RL., Rizzi TE., Tyler RE.; Atlas de urianálisis canino y felino; Multimédica Ediciones Veterinarias; 2018; Barcelona.
Engel Manchado J., García Guasch L.; Manual del ATV (2ª Edición); Multimédica Ediciones Veterinarias; 2019; Barcelona.
 by Multimédica
by Multimédica