Actualización en insuficiencia cardiaca congestiva: de la cardiología a la cardiología crítica
Resumen breve
La insuficiencia cardiaca aguda se caracteriza por el rápido desarrollo de signos asociados a una función cardiovascular anormal, pudiendo ocurrir con o sin cardiopatía previa. Las causas incluyen disfunción sistólica o diastólica, arritmias y desajustes de precarga o poscarga y, a menudo, es una condición que pone en riesgo la vida.Índice de contenidos
Introducción
La insuficiencia cardiaca aguda se caracteriza por el rápido desarrollo de signos asociados a una función cardiovascular anormal, pudiendo ocurrir con o sin cardiopatía previa. Las causas incluyen disfunción sistólica o diastólica, arritmias y desajustes de precarga o poscarga y, a menudo, es una condición que pone en riesgo la vida.
La insuficiencia cardiaca congestiva puede ser desencadenada por traumas, arritmias, sepsis, o ser la manifestación de una cardiopatía crónica, generalmente de cámaras izquierdas. En pequeños animales, la endocardiosis mitral es la enfermedad más común en perros, seguida por la cardiomiopatía dilatada y la cardiomiopatía hipertrófica en gatos.
El edema pulmonar cardiogénico, una complicación seria de la insuficiencia cardiaca, se produce cuando la presión del capilar pulmonar excede los 20-25 mmHg, llevando a la acumulación de líquido en los pulmones y generando una consecuente hipoxemia debido al ocupamiento alveolar por parte del líquido, como también producto de la derivación de flujo sanguíneo pulmonar a través de las regiones de los alveolos hipoventilados. Esta condición puede presentarse súbitamente, incluso en pacientes previamente asintomáticos, y resultar en disnea severa.
En humanos, la insuficiencia cardiaca aguda es causada en un 60-70 % de los casos por cardiopatía isquémica, especialmente en ancianos, mientras que en veterinaria, las enfermedades degenerativas y cardiomiopatías son las causas más comunes. Además, en medicina humana, alrededor del 45 % de los pacientes hospitalizados por insuficiencia cardiaca aguda son reingresados al menos una vez en 12 meses, mientras que en veterinaria no existen estadísticas claras al respecto.
Fisiopatología
La insuficiencia cardiaca congestiva corresponde a un síndrome heterogéneo, que presenta signos abruptos o progresión de la patología de base, lo cual requiere tratamiento urgente. Corresponde a un síndrome clínico cuya fisiopatología es compleja y, lo que es más importante, no se conoce por completo.
Desde la perspectiva fisiopatológica, la situacióna priories una disfunción cardiaca, lo cual incluye el daño miocárdico agudo, por ejemplo, disfunción miocárdica por sepsis, y la remodelación cardiaca.
Otro punto corresponde a la disfunción circulatoria sistémica y pulmonar (con la intervención de una disfunción endotelial), lo cual conduce finalmente a anomalías hemodinámicas agudas graves.
Su origen no es conocido por completo, pero se ha propuesto la intervención de varios fenómenos generalizados: activación neurohormonal, procesos inflamatorios, estrés oxidativo, entre otros. Se ha propuesto también la contribución de la disfunción de otros órganos como riñones o hígado. Los factores desencadenantes pueden ser la isquemia/hipoxia crónica, hipertensión, arritmias, comorbilidades no cardiacas, fármacos administrados, etc.
Regulación del flujo pulmonar
La fisiopatología de la formación del edema pulmonar es similar a la formación de edemas en cualquier tejido, como, por ejemplo, el subcutáneo.
Para evitar la edematización en el intersticio pulmonar y la posterior inundación al alveolo, el pulmón cuenta con diferentes mecanismos:
- Presión osmótica superior a la presión hidrostática del capilar pulmonar: las fuerzas hemodinámicas básicas opuestas son la presión capilar pulmonar (PCP) y la presión osmótica del plasma. En los pacientes sanos la presión de capilar pulmonar (PCP) oscila entre los 7 y los 12 mmHg, siendo la presión osmótica del plasma de 25 mmHg aproximadamente, por lo que esta fuerza tiende a retener el líquido dentro de los vasos sanguíneos.
- Tejido conjuntivo y barreras celulares relativamente impermeables a las proteínas plasmáticas: la presión hidrostática actúa a través del tejido conjuntivo y la barrera celular, que en circunstancias normales son relativamente impermeables a las proteínas plasmáticas, con la finalidad de evitar la fuga.
- Sistema linfático: el pulmón posee una extensa red linfática que puede aumentar su flujo hasta 5 a 6 veces cuando se encuentra con un exceso de líquido en el intersticio pulmonar.
Cuando los mecanismos normales para mantener el pulmón seco funcionan mal o están superados por un exceso de líquidos, el edema tiende a hacerse evidente.
Formación del edema pulmonar
Existen dos grandes formas fisiopatológicas capaces de generar edema pulmonar:
- Edema pulmonar producto del incremento de presión hidrostática (cardiogénico).
- Edema por aumento de la permeabilidad vascular (no cardiogénico, p. ej.: SDRA) (Figura 1).
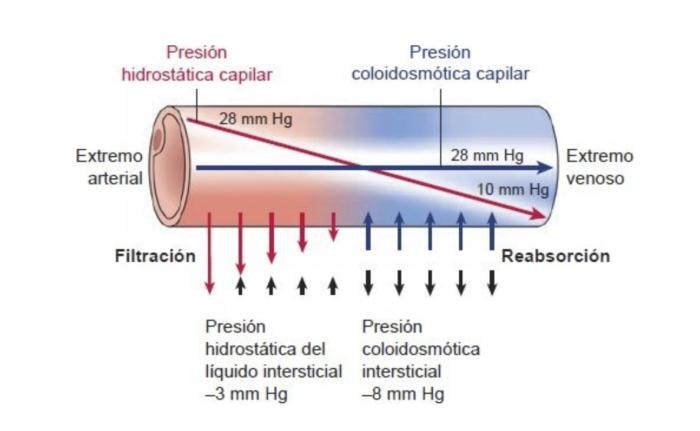
Figura 1. Esquema de equilibrio de Starling (equilibrio del intercambio de líquido entre capilar e intersticio). En condiciones normales, las fuerzas (presión hidrostática capilar, presión coloidosmótica intersticial y la presión hidrostática del intersticio) que controlan la salida de líquido del capilar (filtración) están casi equilibradas con las fuerzas (presión coloidosmótica capilar y presión coloidosmótica intersticial) que atraen de regreso el líquido al capilar (reabsorción).
Incremento de la presión capilar hidrostática pulmonar
Mayoritariamente asociada a un aumento de la presión del atrio izquierdo (insuficiencia cardiaca izquierda) y en menor medida, por una sobrecarga de volumen como un evento consecuente a una fluidoterapia excesiva. La extravasación de líquido desde el espacio intravascular hacia el intersticial y/o alveolar se produce a través de un endotelio vascular pulmonar íntegro.
Cuando la presión capilar pulmonar supera un límite o el umbral crítico, la extravasación de fluidos es tan significativa que sobrepasa la capacidad del sistema linfático de eliminar el trasudado y se genera el edema.
En primera instancia se acumula líquido en el intersticio, progresando hacia el espacio alveolar y, eventualmente, puede existir presencia de lesión de capilares, que pueden contribuir al edema al momento de aumentar la presión hidrostática, aunque no es un mecanismo prioritario para el desarrollo. En estos casos, se evidencia la naturaleza cero sanguinolenta y espumosa del edema en la mayoría de los casos de edema pulmonar cardiogénico.
Incremento de la permeabilidad vascular pulmonar
Consecuencia de lesiones que se provocan en la barrera microvascular pulmonar y/o en el epitelio vascular presente en los alvéolos.
El resultado es aún más complejo, puesto que se extravasan fluidos, hematíes y proteínas desde el espacio intravascular hacia el intersticial y/o alveolar, sin necesidad de que exista previamente un incremento de la presión hidrostática pulmonar.
Las causas principales que provocan este tipo de trastorno están asociadas a alteraciones provocadas por agentes químicos y/o procesos inflamatorios que, de manera primaria, generan un daño agudo en el parénquima pulmonar. Si la lesión, además de estar presente sobre el endotelio vascular capilar, afecta al epitelio de los alvéolos puede desarrollarse un paso directo al espacio intraalveolar.
Existen múltiples causas desencadenantes, y dentro de sus etiologías más comunes, destacan la neumonía, la contusión pulmonar, la sepsis, la pancreatitis, el politraumatismo, el edema pulmonar por transfusiones, la inhalación de humo o tóxicos, entre otras.
Signología y presentación clínica del paciente con edema pulmonar
La anamnesis es la clave para diferenciar la posible causa del edema pulmonar (cardiogénico, no cardiogénico, mixto); la consulta rápida sobre la presencia de una enfermedad cardiaca de base en tratamiento, la mención de un soplo cardiaco en su historial de visitas a la consulta veterinaria o incluso la presencia de eventos de tos aislados o que progresivamente se han vuelto más frecuentes son preguntas bastante útiles para generar una idea de cómo abordar al paciente que ingresa al servicio de urgencias por edema pulmonar.
La tos cardiogénica se define como la tos asociada con una enfermedad cardiaca, pero no necesariamente con insuficiencia cardiaca congestiva (edema pulmonar). Es importante recalcar que un paciente puede tener tos y cardiopatía, pero no necesariamente tiene relación.
La cardiomegalia con agrandamiento marcado del atrio izquierdo se ha descrito como una causa común de tos cardiogénica, pero la evidencia científica ha demostrado que la dilatación y la presión de la aurícula izquierda por sí solas son insuficientes para producir tos broncocompresiva, a menos que exista una enfermedad bronquial subyacente.
Patologías como el colapso traqueal, la bronquitis crónica y la broncomalacia son comunes en perros pequeños. Estas patologías favorecen el reflejo tusígeno y la presencia de cardiomegalia puede favorecer el reflejo tusígeno por compresión bronquial principal (en teoría). En perros medianos o grandes sin una afección descrita con tanta frecuencia, es probable que la tos esté asociada con una afección respiratoria como la bronconeumopatía crónica. La evidencia científica aún no ha demostrado una relación entre la tos y el edema pulmonar cardiogénico en perros con enfermedad mixomatosa de la válvula mitral. El líquido en los espacios alveolar e intersticial puede no causar tos, a menos que el volumen sea suficiente para invadir las vías respiratorias superiores (edema pulmonar fulminante) (Vídeo 1).
La tos de algunos perros mejora después de recibir diuréticos. Sin embargo, muchos pacientes pueden toser incluso resolviendo radiográfica o clínicamente el edema pulmonar según habla la evidencia, lo que nuevamente sugiere que su tos no se originó en las regiones bronquiolar o alveolar. La respuesta clínica positiva observada en algunos pacientes después de tomar furosemida se atribuye a posibles propiedades antiinflamatorias y antitusígenas de la furosemida. Si la tos no resuelve aun después de iniciar terapia cardiovascular, es lógico evaluar otros trastornos respiratorios concurrentes.
La tos, que suele ocurrir sola, sin ni disnea, es característica de la enfermedad respiratoria primaria. Es importante realizar pruebas de imagen complementarias como son el TAC, la broncoscopia o la fluoroscopia.
La compresión de las vías respiratorias también puede ser una característica de la enfermedad extraluminal, como la linfoadenopatía traqueobronquial, las masas mediastínicas y otros tipos de tumores torácicos.
La tos ya no debe considerarse un signo patognomónico de edema pulmonar si no está asociada a disnea. La intolerancia al ejercicio o la disnea/taquipnea son signos clínicos más específicos de insuficiencia cardiaca congestiva (Vídeo 2).
Vídeo 1. Tos en paciente con broncopatía: tos seca con arcada final, posiblemente asociada a bronconeumopatía.
Vídeo 2. Disnea y cianosis en paciente con insuficiencia cardiaca congestiva.
El avance de la disnea y la mayor colecta de líquido en el pulmón genera ortopnea para intentar mejorar el ingreso de aire a la vía aérea (Figura 2). En los casos donde la disnea ha sido sostenida y existe un grado de fatiga de los músculos respiratorios se logra evidenciar expresiones faciales de cansancio o agotamiento en pacientes felinos y caninos (Figura 3). En los casos más severos se puede evidenciar que los pacientes presentan esputo serosanguinolento al toser o al ser intubados (Vídeo 4), correspondiente a surfactante pulmonar (Figura 4).
Figura 2. Ortopnea asociada a insuficiencia cardiaca congestiva.

Figura 3. Fatiga respiratoria de paciente con edema pulmonar cardiogénico.
La ortopnea en los pacientes caninos primero se presencia con posición preferentemente de pie, con los codos en abducción, con cambios constantes de posición cuando el edema es muy severo. El decúbito lateral en el perro con disnea es un signo de insuficiencia respiratoria muy grave (Vídeo 3).
Vídeo 3. Progresión de ortopnea asociada a edema pulmonar en paciente con insuficiencia mitral severa en estado de insuficiencia cardiaca congestiva.
Figura 4. Surfactante pulmonar de paciente con edema pulmonar cardiogénico secundario a insuficiencia valvular mitral severa.
Vídeo 4. Surfactante pulmonar de paciente con edema pulmonar cardiogénico (post mortem).
Se debe considerar que, fisiológicamente, el edema pulmonar cardiogénico (intersticial o intersticioalveolar) se clasifica como disfunción tipo I, alteración que compromete el parénquima pulmonar y provoca hipoxemia con normo o hipocapnia, lo cual genera un desbalance V/Q (oxigenación/perfusión) decreciente predominantemente, lo que provocará que los criterios de perfusión clínica e instrumental se vean alterados, por ejemplo: cianosis y desaturación arterial de oxígeno.
Al momento de ocurrir el edema pulmonar observaremos aumento en la frecuencia respiratoria, la cual puede estar alterada en mayor o menor medida dependiendo de la severidad del edema. En los casos más severos conlleva cianosis, la cual representa hipoxia tisular e hipoperfusión del sitio donde se está realizando la medición, evidenciado en lengua, gingiva, mucosa ocular y/o vulvar o prepucial de color azulado (Figura 5).
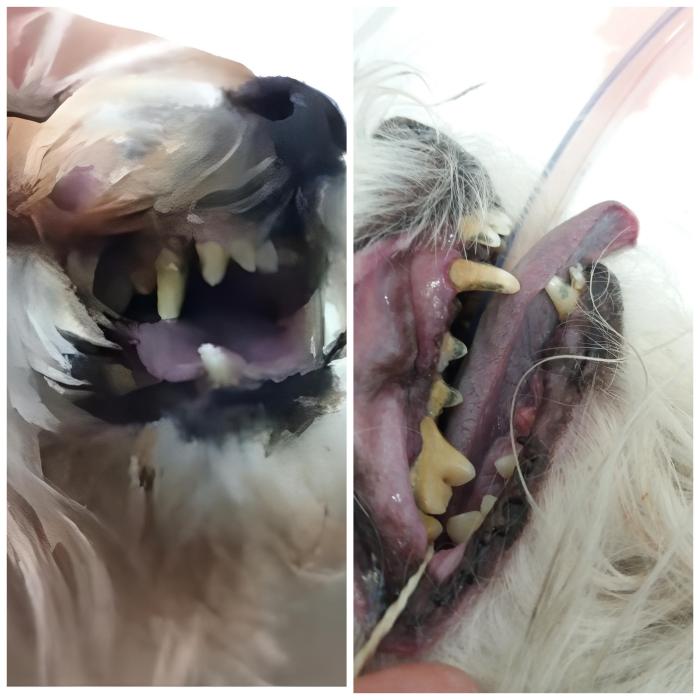
Figura 5. Cianosis que requiere intubación en paciente maltes en insuficiencia cardiaca congestiva.
La saturación de oxígeno puede encontrarse alterada o normal dependiendo de la gravedad del edema pulmonar; normalmente, en los pacientes que presentan edema pulmonar cardiogénico intersticial moderado a severo o alveolar, la saturación de oxígeno se encontrará bajo los 95 y 90 %.
La pulsioximetría posee alta sensibilidad para detectar la hipoxemia evidente por su alta correlación con la presión arterial de oxígeno en la zona más lineal de curva de disociación de la hemoglobina (Figura 6).
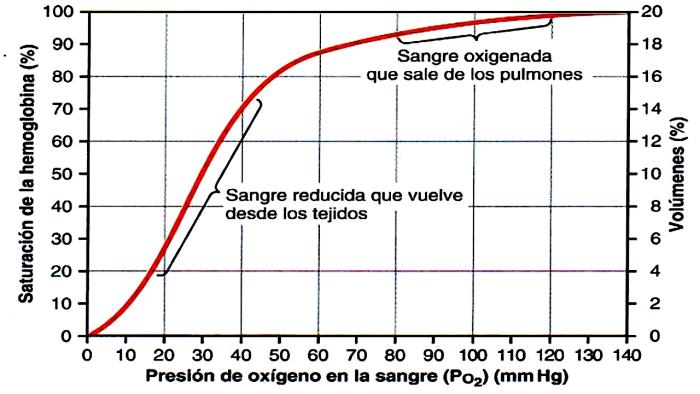
Figura 6. Curva de disociación de la hemoglobina (Hb); eje de las X corresponde a presión arterial de oxígeno (PO2) expresada en mmHg; eje de las Y la saturación de oxígeno (SaO2) expresado en %.
Para el diagnóstico de la hipoxemia fina se requiere idealmente medir gases arteriales, donde las presiones arteriales de oxígeno menores a 80 mmHg corresponden a un estado de hipoxemia y valores menores a 60 mmHg corresponden a hipoxemia severa. Con estos valores se puede establecer una relación con la fracción inspirada de oxígeno (FiO2) que se está aportando al paciente. En el caso de que el paciente no tenga ningún tipo de suplementación de oxígeno, la fracción inspirada corresponderá a la ambiental, es decir, un 21 % y dependiendo de cómo sea el sistema de suministro se estiman valores de FiO2 más altos (Tabla 1).
Podemos estimar que una saturación de oxígeno menor a 95 % tendría una equivalencia aproximada de presión arterial de oxígeno menor a 80 mmHg; y en los casos en que la saturación tenga un valor menor a 90 %, se puede estimar una presión arterial de oxígeno menor a 60 mmHg. Estos datos son útiles para poder establecer el nivel de gravedad de ingreso del paciente que consulta por edema pulmonar.
Considerando que en la clínica diaria no todos los centros veterinarios pueden obtener mediciones de gases en sangre, podemos realizar una estimación mediante la relación SaO2 y la FiO2 (SAFI) siendo de mucha ayuda para categorizar el grado de insuficiencia respiratoria.
| Parámetros PaFi | Compromiso pulmonar |
| >300 | Normal |
| 200-300 | Distrés respiratorio leve |
| 200-100 | Distrés respiratorio moderado |
| <100 | Distrés respiratorio severo |
| Parámetros SaFi | Compromiso pulmonar |
| >300 | Normal |
| 241-300 | Leve |
| 201-240 | Moderado |
| 151-200 | Severo |
| <150 | Muy severo |
Tabla 1. Comparación valores PaFi vs SaFi para la evaluación del compromiso pulmonar en pacientes con hipoxemia.
La saturación de oxígeno, aunque útil clínicamente, tiene limitaciones en situaciones como mucosas pigmentadas, hipotensión y desequilibrios ácido-base.
La hipoperfusión y el desequilibrio ventilación/perfusión (V/Q) pueden elevar el lactato a más de 2.5 mmol/l, indicando un intento del organismo de compensación ante hipoxemia al activar las vías de respiración anaeróbica. En pacientes con shock cardiogénico, la hiperlactatemia puede deberse tanto al desbalance oxigenación-perfusión como a una disminución del gasto cardiaco, o como respuesta a la hiperadrenergia.
La auscultación pulmonar es crucial, especialmente en pacientes sin diagnóstico previo de cardiopatía. Estertores húmedos o crepitaciones son indicativos de edema pulmonar, siendo la región perihiliar bronquial un área clave para identificarlo.
Diagnóstico
Radiografía
Aunque la radiografía de tórax proporciona información relevante, no es prioritaria en urgencias para pacientes hipoxémicos con ocupación pulmonar, debido a sus tiempos de proceso más largos y mayor dependencia operativa en comparación con la ecografía pulmonar. Requiere un paciente estabilizado y considerar su posición específica según la especie durante el examen. Es crucial minimizar el estrés y estar preparados para desaturaciones o necesidad de intubación.
En edema pulmonar cardiogénico, se busca un patrón alveolar perihiliar y cardiomegalia; en caso de un edema difuso, sin estas características, se considera ARDS, excepto en rupturas agudas de cuerda tendinosa, donde no hay aumento del tamaño cardiaco, pero sí de la presión intracavitaria del atrio izquierdo (Figura 7).
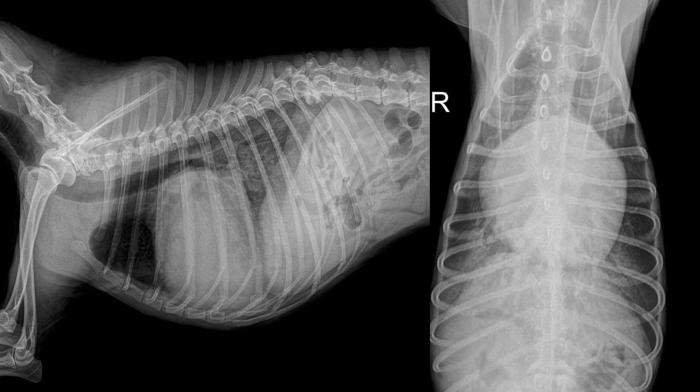
Figura 7. Radiografía de tórax de paciente LL y VD de paciente Yorkshire de 12 años con soplo 5/6 y sistólico regurgitante y tos. Se observa cardiomegalia, desplazamiento a dorsal de la tráquea, pérdida de la cintura cardiaca izquierda y edema pulmonar con patrón alveolar.
Ultrasonografía pleuropulmonar
La posición del transductor para la evaluación genera que la costilla se corte de manera transversal y, de este modo, obtener una imagen que demuestre el espacio intercostal que se está evaluando entre dos sombras acústicas generadas por la incapacidad que tienen las ondas de ultrasonido para atravesar las costillas (Figura 8).
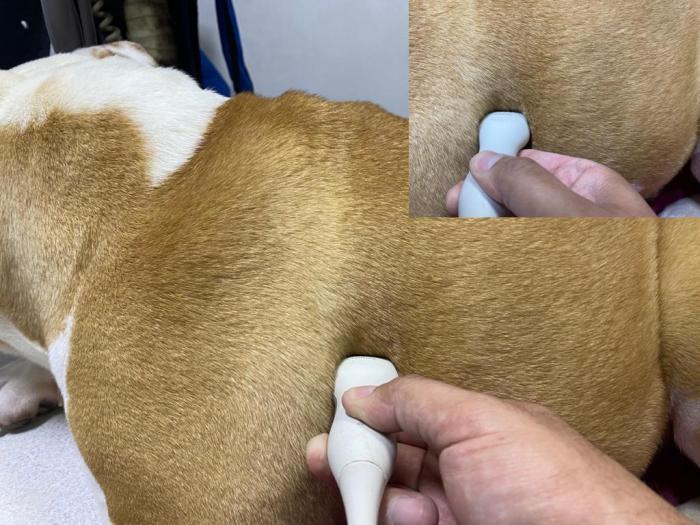
Figura 8. Posicionamiento del transductor para evaluación pulmonar mediante ultrasonografía.
Los signos característicos de un pulmón que se encuentra aireado y sin signos ocupacionales corresponden al signo de alas de murciélago (medicina humana) o signo de ojos de cocodrilo (medicina veterinaria), los cuales corresponden a la imagen obtenida de dos semicircunferencias anecónicas con un borde superior hiperecóico que son generadas por las costillas (Vídeo 5). En el espacio intercostal se evidencia una línea de mayor ecogenicidad que corresponde a la unión de las pleuras parietal y visceral en la zona de la imagen más cercana al transductor. Desde la línea pleural se proyectan líneas hiperecoicas (pero de una ecogenicidad menor) horizontales semicurvas, repetidas a través de la pantalla, equidistantes una de otra (misma distancia entre ellas) llamadas ondas A (Figura 9).
Vídeo 5. Signo de ojos de cocodrilo, presencia de deslizamiento pleural y presencia de líneas A.
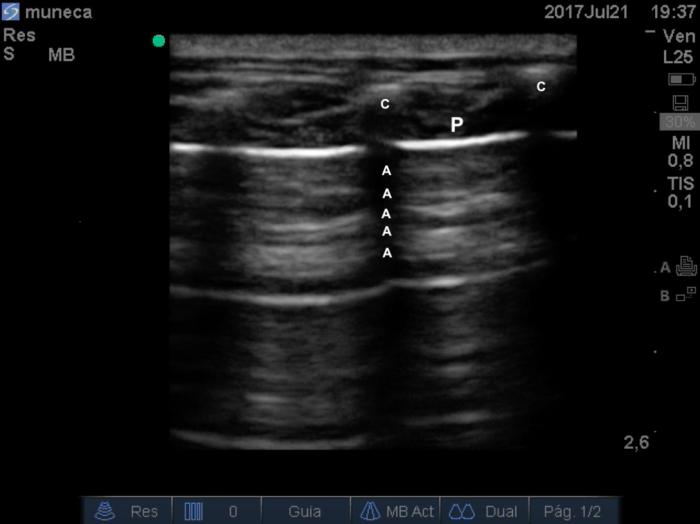
Figura 9. Ecografía pulmonar, signos de alas de murciélago o de ojos de cocodrilo: P: línea pleural, A: ondas a horizontales que corresponden a pulmón aireado, c: sombra acústica generada por las costillas.
Debemos observar la presencia de deslizamiento pleural en el modo bidimensional. La presencia del edema pulmonar tiene características ultrasonográficas bastante claras y difícilmente conducen a error por parte del operador, entregando una respuesta rápida. La importancia de realizar un buen examen ultrasonográfico se establece cuando se debe diferenciar el origen del edema pulmonar, donde puede tener etiología cardiogénica, no cardiogénica o mixta.
El signo característico del edema pulmonar es llamado onda B, línea B o cola de cometa pulmonar, caracterizada por ser una línea hiperecoica vertical que parten de la línea pleural anteriormente mencionada, desplazándose hasta el final de la pantalla y haciendo desaparecer las líneas A. La onda B corresponde a una interfase que se genera entre el aire del pulmón y el líquido del edema.
Si relacionamos la presencia de onda B como una unidad de edema, haciendo el ejercicio para comprender más fácil el concepto, a mayor cantidad de ondas B presentes en un paciente que se encuentra con dificultad respiratoria y donde se han diagnosticado la presencia de edema pulmonar, una cantidad abundante de ondas B se relacionarán con mayor extensión del edema, en comparación con alguna situación donde se presenten menos ondas B en la examinación (Vídeo 6). Por lo tanto, la presencia de más ondas B habla de mayor gravedad en la condición del paciente (Figura 10).
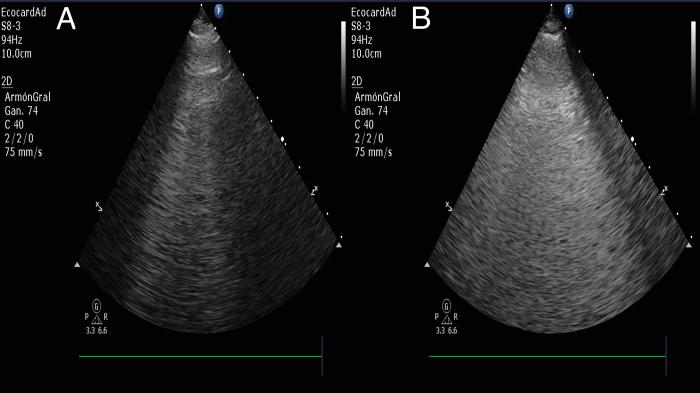
Figura 10. Comparación de la presencia de edema pulmonar cardiogénico leve (A), demostrado por pocas ondas B y severo (B), demostrando una cantidad de ondas B que hacen parecer una sola onda de gran tamaño.
Video 6. Edema pulmonar cardiogénico moderado mediante evaluación ultrasonográfica, se evidencia ondas hiperecoicas que se desplazan junto al movimiento pleural, atravesando la pantalla, haciendo desaparecer ondas A.
Un detalle importante en la inspección es la línea pleural en el paciente con edema pulmonar cardiogénico; normalmente no presentan características de lesiones inflamatorias, como un gran engrosamiento o alteraciones en la pleura, debido a que la causa del edema no es por factores inflamatorios, si no por el aumento de la presión hidrostática; por lo tanto, al momento de evidenciar líneas pleurales, engrosadas irregulares y/o escalonadas, podemos pensar en otro origen (Figura 11).
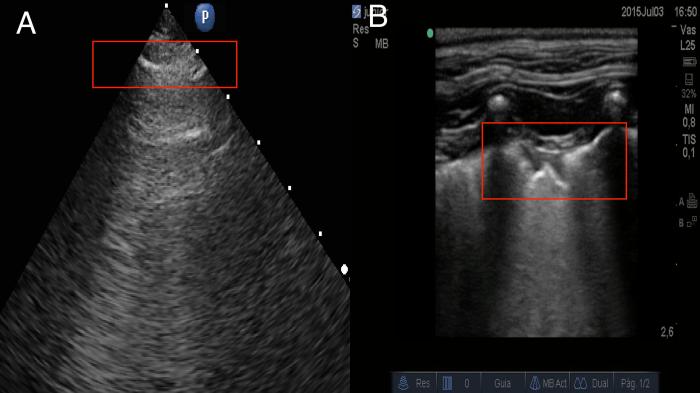
Figura 11. Comparación de pleura con edema pulmonar de origen cardiogénico (A) y pleura en caso de neumonía (B), se puede observar diferencias en la presencia de escalonamiento pleural e irregularidad pleural como características inflamatorias en el caso de un foco neumónico (B) (líneas pleurales demostradas en rectángulos rojos).
Existen estudios que mencionan que hasta el 20 % de los pacientes con edema pulmonar cardiogénico describen alteración pleural que hace referencia al engrosamiento pleural por edema pleural a causa del evento congestivo; pero no describen signos de desgarro pleural, escalonamiento o signos como hepatización (consolidación) pulmonar (Vídeo 7). Generalmente el engrosamiento pleural se reconoce como una línea pleural mayor a los 0.3 mm de espesor.
Video 7. Edema pulmonar no cardiogénico con características neumónicas de escalonamiento y desgarro pleural.
Ecocardiografía
Existen ciertas medidas ecocardiográficas, algunas más simples y otras que si requieren más experiencia en cuanto a la obtención de la imagen y a la interpretación de los valores obtenidos.
Existen ciertas características que nos ayudarán a diferenciar el origen del edema. Los puntos importantes para considerar en los pacientes sin antecedente de cardiopatía que nos pueda realizar alguna sugerencia, es una examinación ecocardiográfica rápida donde, dentro de los detalles más básicos, se recomienda la observación de la relación de la aorta con el atrio izquierdo.
Lo recomendado es realizar una evaluación primaria de aorta y atrio izquierdo, y considerar si se encuentra en un tamaño mayor en relación con la aorta solo con observarla, lo cual nos aporta información sobre remodelación cardiaca por sobrecarga de volumen en la cavidad atrial. Los valores sobre 1:1.5 se consideran como elevados (atriomegalia) (Figura 12).
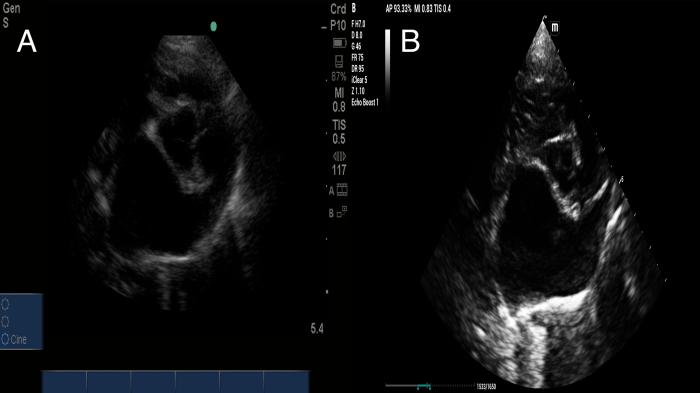
Figura 12. Relación aorta : atrio izquierdo alterada de manera moderada (A) y severa (B).
Las características de la válvula mitral también es una apreciación cualitativa que puede entregar gran ayuda para intentar predecir la posibilidad de que el origen del edema pulmonar corresponde a un evento congestivo. Velos valvulares con gran degeneración, algunos incluso sin lograr generar coaptación de velos, pueden hacer inferir mayor probabilidad de presión intraatrial y, de manera consecuente, mayor congestión a través de las venas pulmonares hacia el capilar pulmonar, generando aumento de su presión hidrostática (Vídeo 8).
Vídeo 8. Lesión valvular por degeneración mixomatosa, falta de coaptación y prolapso de velos valvulares.
Existen algunos casos en que los velos presentan características aneurismáticas y, en otros casos, se logra apreciar el movimiento de las cuerdas tendíneas en los casos de ruptura de estas mismas, predisponiendo al prolapso de los velos valvulares, entendiéndose como un signo de malignidad (Figura 13).
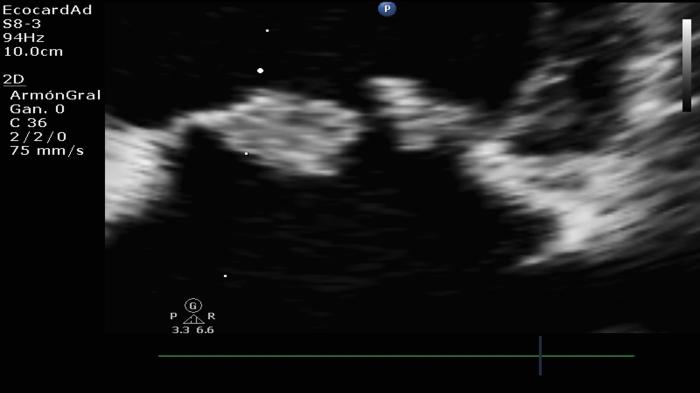
Figura 13. Lesión valvular por degeneración mixomatosa.
Otro indicador útil de congestión corresponde a la relación de la vena pulmonar con la rama derecha de la vena pulmonar, detalles anteriormente desarrollados en el capítulo. Una relación Vp/Ap >1.7 corresponde a un signo sugerente de congestión; y en caso de que se presente un paciente con edema pulmonar y con este dato, en conjunto con los otros anteriormente mencionados, podemos considerar la posibilidad de insuficiencia cardiaca congestiva para guiar nuestra terapia (Figura 14).
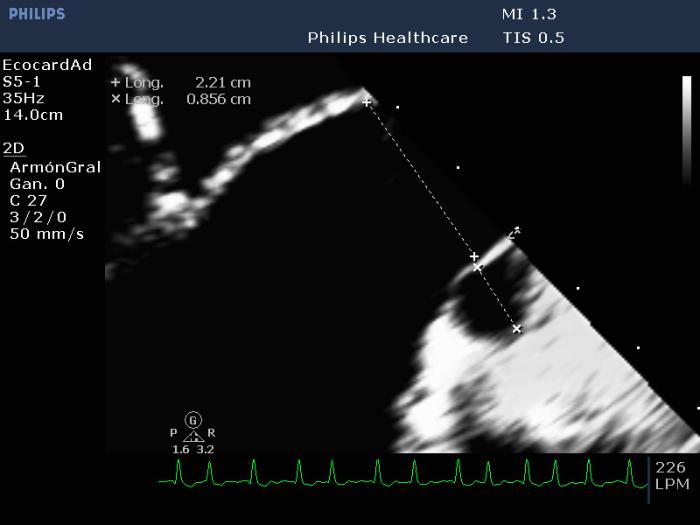
Figura 14. Relación Vp:Ap alterada en paciente con insuficiencia valvular mitral severa en estado de insuficiencia cardiaca congestiva.
Al momento de aplicar Doppler color, se puede evaluar en el atrio izquierdo la presencia de flujos de velocidades altas a contracorriente y que se vean reflejadas con colores turbulentos. Debido a que el reflujo viene con la velocidad otorgada por la contracción ventricular, superando así, el límite de Nyquist establecido por el PRF que en ese momento consideremos, se recomienda en cavidades cardiacas siempre ocupar un PRF mayor a 60 cm/s (Figura 15, Vídeo 9).
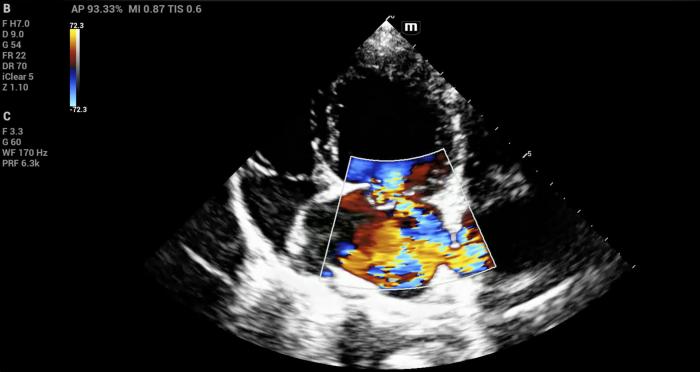
Figura 15. Reflujos mitral severo en paciente con endocardiosis mitral. Vista apical izquierda de 4 cámaras.
Vídeo 9. Insuficiencia valvular mitral severa demostrada en Doppler color y lesión valvular en 2D.
Así mismo, se puede establecer un factor de gravedad mediante la relación del jet de regurgitación mitral (JRM) y el área del atrio izquierdo (AAI) estimando el grado de regurgitación mitral.
- Relación JRM/AAI: < 30 % regurgitación leve.
- Relación JRM/AAI: 30-70 % regurgitación moderada.
- Relación JRM/AAI: > 70 % regurgitación severa.
Las mediciones hemodinámicas relacionadas con la función diastólica corresponden a:
- Velocidad de onda E: velocidades de llenado pasivo superiores a 120 cm/s, se consideran un factor de riesgo para la presencia cardiaca congestiva y se considera que mientras más alta sea la velocidad, más probable es la posibilidad de que un paciente que se presente al servicio de urgencia por disnea esté cursando por una condición de edema pulmonar cardiogénico (Figura 16).
- Relación E/A: según estudios en pacientes con insuficiencia mitral por degeneración mixomatosa y cardiomiopatía dilatada, los patrones de flujo diastólico del Doppler transmitral que más se presentan en pacientes que presentan insuficiencia cardiaca congestiva corresponden a los patrones de pseudonormalización y restrictivo. Lo anteriormente mencionado se explica debido a que estos patrones ya corresponden a grados de disfunción diastólica más avanzados y, a pesar de que la relación muchas veces se encuentre dentro de rangos normales, las velocidades de llenado ventricular se encuentran más altas de los límites considerados aceptables. Por lo tanto, el valor de velocidad de llenado pasivo, nuevamente, se considera como un factor determinante para la asociación del edema pulmonar con un origen cardiogénico (Figura 16).
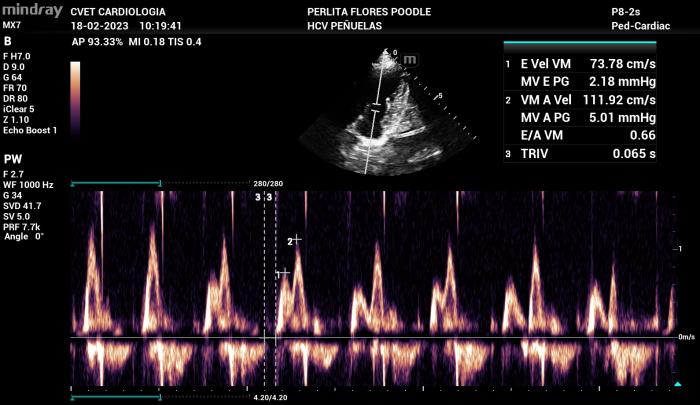
Figura 16. Tipos de flujo de Doppler transmitral con patrón de alteración en la relajación (A), Pseudonormalizado (B) y Restrictivo (C)
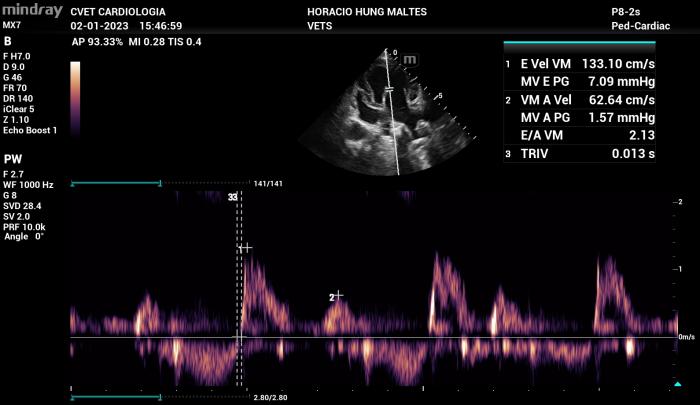
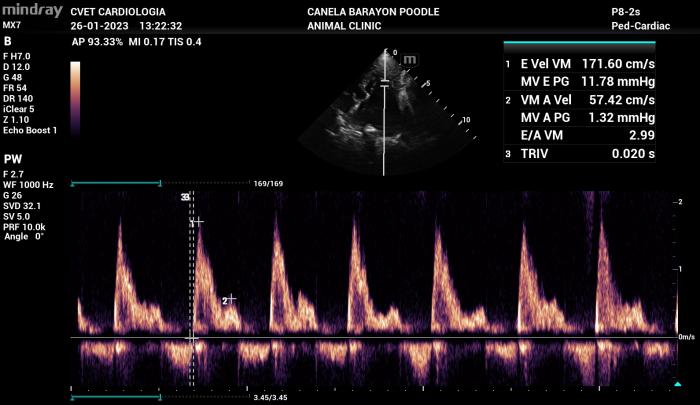
Existen condiciones menos frecuentes en las cuales el patrón de flujo transmitral parece ser sin alteración en la relajación (disfunción diastólica grado I, normalmente presente en pacientes leves o incluso pacientes sanos de edad avanzada) pero con altas velocidades de llenado pasivo y activo. En estos casos como se menciona en el párrafo anterior se debe considerar más determinante la velocidad de llenado pasivo por sobre el tipo de patrón de flujo (Figura 17).
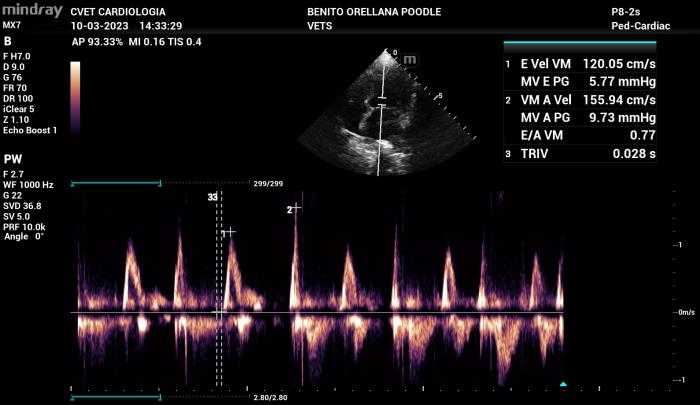
Figura 17. Alteración en la relajación con velocidades de llenado pasivo y activo anormales a lo generalmente encontrado en este patrón de flujo, se recomienda siempre analizar las velocidades de flujo diastólico por sobre el tipo de patrón de flujo de Doppler transmitral.
- Relación E/é: la relación entre Doppler del flujo transmitral y Doppler tisular del velo valvular es de gran ayuda para la estimación de la presión del capilar pulmonar. Valores de esta relación sobre 11.5 en insuficiencia mitral serán puntos de corte para la predicción del edema pulmonar cardiogénico (Figura 18).
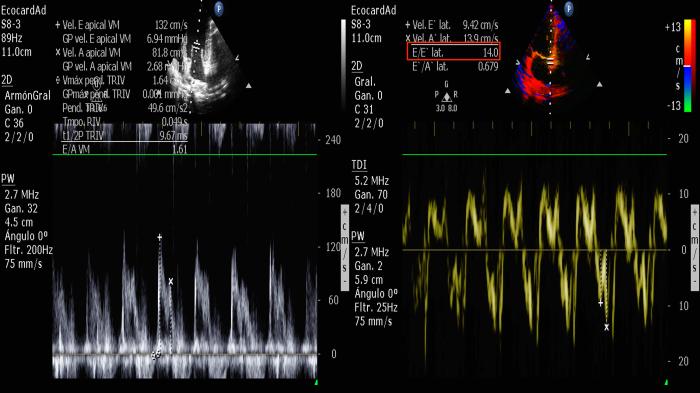
Figura 18. Relación E/é alterada, relación entre llenado pasivo y movimiento del anillo valvular lateral para establecer aproximación a disfunción diastólica.
- Relación E/TRIV: la relación de la onda E del flujo transmitral con el tiempo de relajación isovolumétrica (TRIV) pueden ser de ayuda también para estimar alteración de la relajación ventricular, disfunción diastólica y aumento en las presiones de llene del ventrículo izquierdo. Valores sobre 2.5 en insuficiencia mitral nos aporta información sobre predicción para presentar edema pulmonar cardiogénico.
Tratamiento
El tratamiento del edema pulmonar cardiogénico tiene por objetivo mejorar la hematosis y, como consecuencia, devolver al territorio capilar- arterial, una adecuada oxemia. Para esto es fundamental comprender que el tratamiento se encuentra dirigido por puntos esenciales:
- Disminuir la precarga mediante la utilización de fármacos que aumenten la capacitancia venosa como los venodilatadores y/o fármacos que reduzcan la volemia como los diuréticos.
- Mejorar la poscarga mediante el uso de vasodilatadores.
- Oxigenoterapia mediante sonda nasal, intubación orotraqueal, mascarilla o en ambiente enriquecido.
- Aplicación de ventilación a presión positiva especialmente de presión positiva al final de la expiración (PEEP) con el objeto de reclutar alveolos colapsados. De este modo, disminuir el shunt intrapulmonar con el propósito de mejorar la performance cardiovascular mediante las cualidades que representan el aumento de la presión intratorácica y de la presión pleural.
- Tratar la disfunción cardiovascular de base mediante la utilización de inotrópicos y/o vasopresores, manejo de la frecuencia cardiaca y del ritmo, lusitrópicos positivos y vasodilatadores ,entre otros.
- Remoción rápida del volumen circulante mediante ultrafiltración.
- Y, muy importante, disminuir la precarga mediante la utilización de fármacos que aumenten la capacitancia venosa como los venodilatadores y/o fármacos que reduzcan la volemia como los diuréticos.
La precarga, definida como la presión media de llenado sistémico, está directamente correlacionada con el volumen venoso y el grado de venodilatación o venoconstricción, y es independiente de la función cardiovascular.
En el edema pulmonar cardiogénico, donde las presiones de retorno están elevadas, se pueden reducir mediante diuréticos como la furosemida y drogas venodilatadoras como la nitroglicerina.
Es crucial evaluar si la disfunción cardiovascular está asociada a hipervolemia, especialmente en casos como la claudicación ventricular izquierda aguda por sepsis o en pacientes caninos con insuficiencia valvular mitral crónica y terapia diurética extrema, donde pueden presentar hipovolemia y edema pulmonar grave simultáneamente.
La furosemida en estos casos puede causar hipotensión, hipoperfusión, alteraciones electrolíticas y lesión renal aguda. La detección de volemia en pacientes cardiópatas es desafiante debido a la alteración de indicadores clásicos.
- Furosemida: la Furosemida es un diurético de asa que ejerce reducción de la precarga mediante dos efectos: el primero es a través de la depleción de volumen y el segundo por efectos venodilatadores directos. Utilizada por vía intravenosa ejerce efectos diuréticos entre 30 a 90 minutos, sin embargo en pacientes con hipoperfusión, como suele suceder en el paciente cardiópata agudo, estos tiempos pueden alargarse en extremo. Existe consenso de los beneficios de la furosemida en el paciente con edema pulmonar agudo cardiogénico hipervolémico, aplicada en una dosis de ataque entre 1- 6 mg/kg. Otra forma de entregarla es en infusión continua a dosis de 1 mg/kg/h precedido de una dosis de ataque, lo que permitiría mantener niveles plasmáticos continuos y por lo tanto un mayor efecto. Idealmente, debe monitorearse los electrolitos por la gran posibilidad de producir hiponatremia que al bajar la presión osmótica, paradojalmente, puede inducir edema por escape. La hipokalemia asociada puede inducir trastornos del ritmo, entre otros, y la hipocloremia puede provocar alcalosis metabólica con pH sobre 7.45 y bicarbonato sobre 26 mEq/l; sumado a hiperventilación (alcalosis mixta), el resultado puede ser complejo puesto que en pacientes con PH de 7.6, la alcalosis potencia los efectos vasoconstrictores de la adrenalina, aumentando la poscarga y, por consecuencia, disminuyendo el débito sistólico.
- Nitroglicerina: la nitroglicerina es un potente venodilatador y en menor grado arteriolodilatador que ejerce sus efectos mediante el incremento del GMP cíclico el cual sensibiliza al óxido nítrico, además de reducir el calcio sistólico. El efecto neto será una gran disminución de la precarga que fomentara la disminución del retorno venoso y de la precarga y en menor grado una disminución de la poscarga. Administrada por vía endovenosa en dosis 0.25 a 5 mcg/kg/min, ejerce una potente disminución de la precarga en tan solo minutos, la utilización de cremas o parches en pacientes en estado crítico es cuestionable debido a la hipoperfusión cutánea y consecuente irregular e impredecible respuesta, por lo que recomendamos según nuestra experiencia su administración por vía endovenosa. La reducción de la poscarga suele ser leve, sin embargo no debe utilizarse esta droga en casos de hipotensión. Realizar cualquier cambio en la poscarga, expresada preferentemente a través de la resistencia vascular sistémica, debe vigilar estrechamente la presión arterial primariamente ya que debe ser el primer objetivo de resucitación hemodinámico y la adición de un vasodilatador puede inducir o empeorar una hipotensión previa. La reducción de la poscarga en un paciente normotenso, se traduce en un aumento del débito sistólico y del gasto cardiaco, lo cual mejora la performance cardiovascular y disminuye la fracción regurgitante en pacientes con insuficiencia valvular mitral. Actualmente, el consenso de la ACVIM para el paciente mitral clase D expone la utilización de inhibidores de la enzima convertidora de angiotensina, inhibidores directos de la angiotensina II, bloqueadores de canales del calcio como amlodipino, pimobendan y antagonistas alfa 1 como la doxazosina, sin embargo, la vía oral puede ser una complicación en el paciente agudo por lo que nos referiremos al paciente agudo especialmente a la recomendación de la utilización del vasodilatador nitroprusiato de sodio (Figura 19).
- Nitroprusiato de sodio: es una droga con efectos vasodilatadores mixtos, con preferencia en el territorio arteriolar, por lo que produce una fuerte caída en la resistencia vascular sistémica y de la presión arterial. Su mecanismo de acción, al igual que la de cualquier nitrato, hace referencia a la acción del óxido nítrico provocada por la activación y formación de GMP cíclico y la inhibición de la fosfodiesterasa. La dosis en infusión continua es de 0.25 a 2 mcg/kg/min.
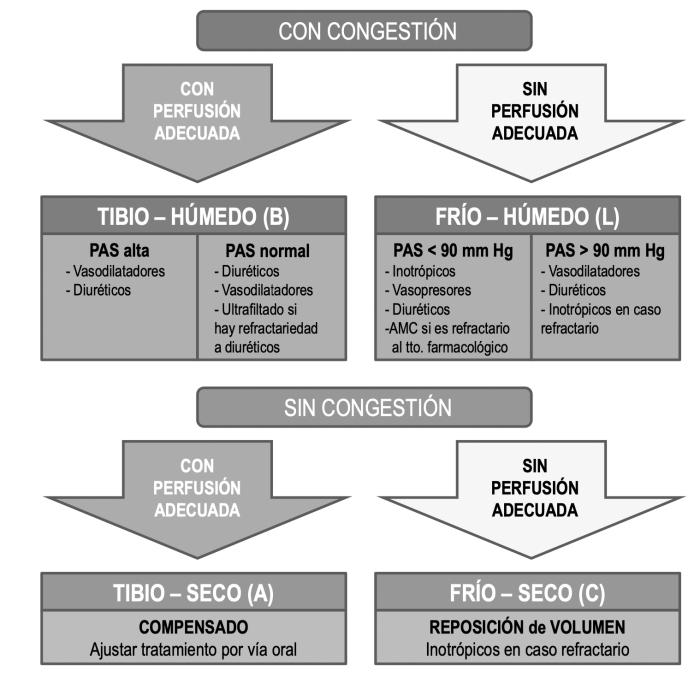
Figura 19. Algoritmo de recomendaciones de abordaje según diferentes perfiles hemodinámicos en insuficiencia cardiaca congestiva.
| Droga | Propósito | Dosis | Infusión contínua |
|---|---|---|---|
| Furosemida | Diurético | 1-6 mg/kg | 1 mg/kg/h |
| Nitroglicerina | Venodilatador (++), arteriodilatador (+) | - | 0.25-5 mcg/kg/min |
| Nitroprusiato de sodio | Venodilatador (+), arteriodilatador (++) | - | 0.25 a 2 mcg/kg/min |
Tabla 2. Drogas de tratamiento en paciente con edema pulmonar cardiogénico.
Oxigenoterapia mediante sonda nasal o en ambiente enriquecido
Existen diversas formas de entregar oxígeno y en consideración de los autores, la técnica del sondaje nasal a razón de 100 a 200 ml/kg/min no superando los 4 litros totales es una excelente forma de suplementar oxígenos alcanzando fracciones inspiradas de oxígeno entre el 30 y el 40 % (Figura 20).
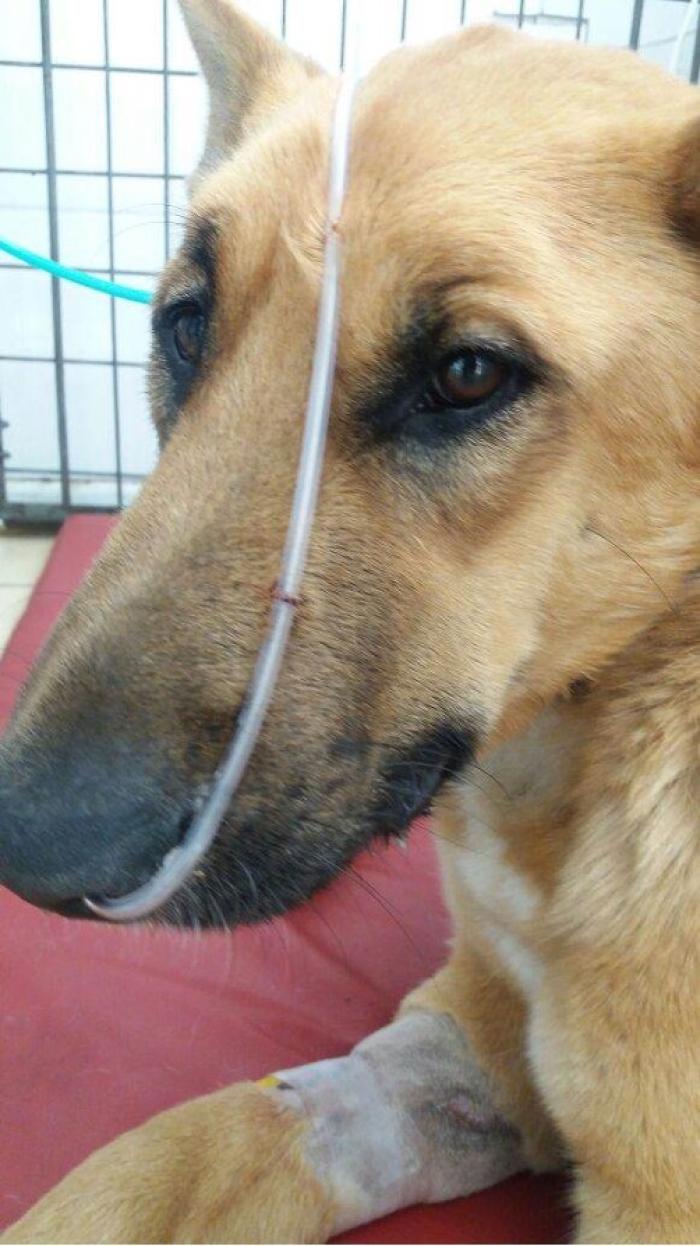
Figura 20. Suministración de oxigenoterapia mediante sondaje nasal.
Aplicación de ventilación a presión positiva, especialmente de presión positiva al final de la expiración (PEEP)
La indicación clásica para intubar y ventilar a un paciente incluye: la hipoxemia grave, la hipercapnia por insuficiencia respiratoria global tipo II, representada por una PaCO2 mayor a 50 mmHg provocada por fatiga muscular respiratoria y/o alteración grave de la conciencia. Sin embargo, en el contexto de un edema pulmonar agudo, se deben valorar ciertos aspectos fisiológicos, tanto pulmonares, como cardiovasculares, que ejerce la ventilación mecánica en estos pacientes (Figura 21).
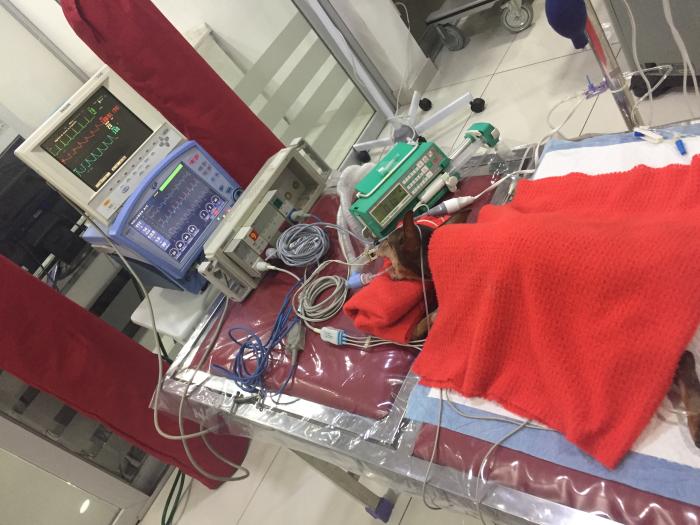
Figura 21. Paciente en ventilación mecánica como maniobra de soporte en edema pulmonar cardiogénico secundario a endocardiosis mitral severa.
En condiciones de edema pulmonar y dilución del surfactante pulmonar, aumentará la tensión superficial intraalveolar provocando una disminución del diámetro alveolar (ley de Laplace) y atelectasia, lo cual se traducirá en disminución de la capacidad residual funcional.
La PEEP, al aumentar la capacidad residual funcional, provocará reclutamiento de alveolos colapsados. Además, al mejorar la oxigenación, reducirá la vasoconstricción hipóxica provocada por el shunt pulmonar.
En la práctica clínica, la PEEP suele titularse mediante la medición de la compliance pulmonar, la PA:Fi, guiado por ecografía mediante la atenuación o desaparición de las ondas B pulmonares. Sin embargo, usualmente se utilizan valores entre 5 y 10 cm de H20 (Vídeo 10).
A
Vídeo 10. Maniobra de reclutamiento pulmonar en paciente canino, A: PEEP 0 hasta 5, inicialmente sin notar un gran cambio en la imagen pleuropulmonar ultrasonográfica, B: PEEP 0 hasta 10, se evidencia disminución y separación de las ondas, demostrando que el paciente requiere presiones positivas mayores para reclutar de manera más eficiente el alveolo.
B
Manejo inotrópico y vasopresor
El manejo de la presión arterial puede realizarse mediante el aumento del flujo (gasto cardiaco) o mediante el manejo de la resistencia (resistencia vascular sistémica). En el contexto del paciente en shock cardiogénico parece lógico actuar en pro del flujo por sobre la resistencia, ya que el aumento de esta última, merma al gasto cardiaco. Sin embargo, paradojalmente, el uso de inotrópicos como la dobutamina, la milrinona y el pimobendan, al poseer efectos vasodilatadores pueden decapitar la presión arterial, ya que el mecanismo per se para mantener la presión arterial puede estar sostenido por el aumento reflejo de la resistencia vascular que se produce en estos pacientes (Figura 22).
La clasificación actual de Forrester utilizada en medicina humana, que introducen las guías, es muy práctica para ser aplicada en medicina veterinaria:
- Caliente y húmedo (bien perfundido y congestivo), el patrón más frecuente.
- Frío y húmedo (hipoperfundido y congestivo).
- Frío y seco (hipoperfundido sin congestión).
- Caliente y seco (compensado, bien perfundido sin congestión).
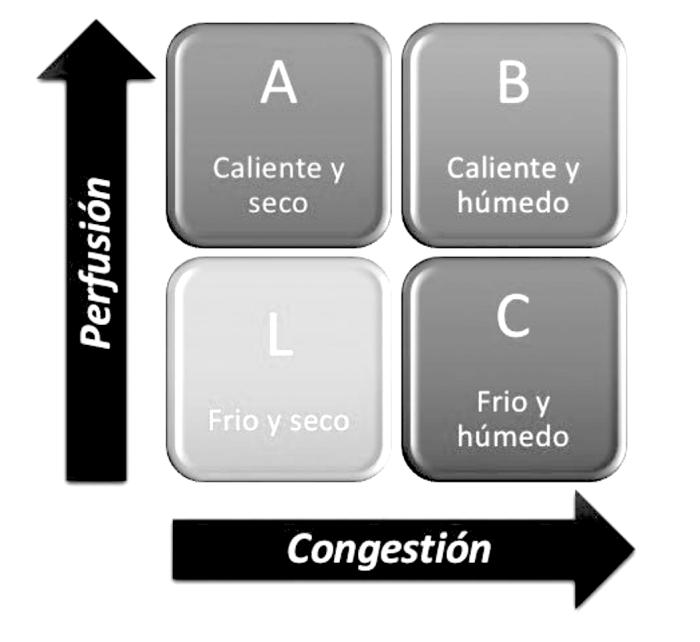
Figura 22. Esquema de diferenciación de los distintos perfiles hemodinámicos que se presentan en los pacientes que acuden por edema pulmonar cardiogénico
En cualquier paciente en falla cardiaca aguda e hipotensión que se presente con signos de resistencia vascular disminuida como lo son la congestión de mucosas, la disminución del tiempo de relleno capilar o el aumento de la temperatura, entre otras, se debe sospechar de un foco inflamatorio asociado ya que por definición el shock cardiogénico posee resistencias vasculares sistémicas aumentadas.
El uso de drogas que poseen efectos mixtos como la adrenalina y la dopamina aparecen como interesantes puesto que aumentan, tanto la resistencia como el gasto cardiaco, mediado por efectos alfa y beta adrenérgicos. Se debe evaluar la capacidad arritmogénica y de aumento del consumo miocárdico, ya que puede ser un problema.
En los casos que se deban rescatar la resistencia vascular y el gasto una combinación de noradrenalina y dobutamina sigue pareciendo muy atractiva.
| Droga | Contractilidad | Fc | Tono vasomotor | Dosis |
|---|---|---|---|---|
| Dobutamina | INC | INC | DEC | 5-20 mcg/kg/min IV |
| Dopamina | INC | INC | INC | 5-20 mcg/kg/min IV |
| Epinefrina | INC | INC | INC | 0.1-1 mcg/kg/min IV |
| Norepinefrina | INC | VAR | INC | 0.1-2 mcg/kg/min IV |
Tabla 3. Drogas de vasoactivas de tratamiento en paciente con edema pulmonar cardiogénico.
Remoción rápida del volumen circulante mediante ultrafiltración
La ultrafiltración puede ser un proceso continuo o intermitente que acompañe a la diálisis. Las ventajas incluyen: rescatar a pacientes que no han respondido a diuréticos, pacientes que no han respondido a ventilación mecánica, remoción isotónica de sangre, mejor output de sodio y ser coadyuvante de la función renal.
Bibliografía
- Atkins, C., Bonagura, J., Ettinger, S., Fox, P., Gordon, S., Haggstrom, J., Hamlin, R., Keene, B., Luis-Fuentes, V., & Stepien, R. (2009) Guidelines for the Diagnosis and Treatment of Canine Chronic Valvular Heart Disease. ACVIM Consensus Statement. Journal of Veterinary Internal Medicine, 23:1142–1150.
- Callerova, J., Skulec, R., Kucera, K., Knor, J., Merhaut, P., & Cerny, V. (2016). Circadian variation of cardiogenic pulmonary oedema. European Journal of Internal Medicine.
- Castagna, O., Gempp, E., Poyet, R., Schmid, B., Desruelle, A., Crunel,V., Maurin,A., Choppard, R., & MacIver, D. (2017). Cardiovascular Mechanisms of Extravascular Lung Water Accumulation in Divers. The American Journal of Cardiology.
- Cooper, L., Mentz, R., Stevens, S., Felker, G. M., Lombardi, C., Metra, M., Stevenson, L., O’Connor, C., Milano, C., Patel, C., Rogers, J. (2015). Hemodynamic Predictors of Heart Failure Morbidity and Mortality: Fluid or Flow?. Journal of Cardiac Failure.
- Cortellaro, F., Ceriani, E., Spinelli, M., Campanella, C., Bossi, I., Coen, D., Casazza, G., & Cogliati, C. (2016). Lung ultrasound for monitoring cardiogenic pulmonary edema. Internal and Emergency Medicine.
- Chetboul, V., & Tissier, R. (2012). Echocardiographic assessment of canine degenerative mitral valve disease. Journal of Veterinary Cardiology, 14, 127-148. Franco, R.P., Zacche, E., Camacho, R.R., Sousa, M.G., & Camacho, A.A. (2016). Determination of left atrial volume in healthy dogs and dogs with myxomatous mitral valve disease. Pesquisa Veterinária Brasileira, 36(8),743-748.
- Flores Dueñas, C.A.; Cordero Yañez, I.A.; González, R.M.; Herrera Ramírez, J.C.; Montaño Gómez, M.F.; Gaxiola Camacho, S.M.; García Reynoso, I.C. Translational Echocardiography: The Dog as a Clinical Research Model of Cardiac Dysfunction.Appl. Sci.2023,13, 4437. https://doi.org/10.3390/app13074437
- Hyung-Jin Park, Seok-Young Byun, Jun-Hyuk Choi, Jong-Bok Lee*, Kun-Ho Song and Kyoung-Won Seo (2016). Application of Extracorporeal Ultrafiltration Therapy Given to a Dog and a Cat with Pulmonary Edema and Renal Failure. Journal of Veterinary Clinics, 33(1): 34-38.
- Macintire, D., Drobatz, K., Haskins, S., & Saxon, W.D. (2012). MANUAL OF SMALL ANIMAL EMERGENCY AND CRITICAL CARE MEDICINE, Second Edition.
- Nicolle et al (2007). Azotemia and Glomerular Filtration Rate in Dogs with Chronic Valvular Disease. Journal of Veterinary Internal Medicine, 21:943- 949.
- Omar, H.R. (2014). Acute cardiogenic pulmonary edema with normal BNP: the value of repeat BNP testing, American Journal of Emergency Medicine.
- Sánchez Marteles M. & Urrutia, A. (2014). Formas de presentación de la insuficiencia cardíaca aguda: edema agudo de pulmón y shock cardiogénico. Medicina Clìnica, 142: 14-19.
- Schober, K.E., Stern, J.A,. DaCunha, D.N.Q.T, Pedraza-Toscano, A.M., Shemanski, D., & Hamlin, R.L.(2008). Estimation of Left Ventricular Filling Pressure by Doppler Echocardiography in Dogs with Pacing-Induced Heart Failure. Journal of Veterinary Internal Medicine, 22:578–585.
- Tomicic, V., Andresen, M., Romero, C., & Mercado M. (2002). Impacto hemodinámico de la presión positiva de fin de espiración (PEEP) durante la falla respiratoria grave: visión actual. Revista Médica de Chile, 130: 1419-1430
- Villalobos, S.J.A. & cols. Ventilación mecánica en pacientes con cardiopatía aguda (2011). Revista Mexicana de Cardiología, 22 (2), 96-100.
 by Multimédica
by Multimédica