¿Qué sabemos sobre la insuficiencia de corticosteroides relacionada con la enfermedad crítica (CIRCI) en pequeños animales?
Resumen breve
El síndrome de insuficiencia de corticosteroides relacionada con la enfermedad crítica (CIRCI), antes conocido como insuficiencia adrenal relativa, se define como una disfunción endocrinológica en pacientes críticamente enfermos, que resulta en una actividad de cortisol inadecuada para la gravedad de la enfermedad actual y conduce a un shock refractario al tratamiento con fluidoterapia y es un síndrome reconocido en medicina humana que se manifiesta en pacientes críticos con enfermedades graves…Índice de contenidos
Introducción
La insuficiencia de corticosteroides relacionada con la enfermedad crítica (Corticosteroid insuficiency related critical illness, CIRCI, por sus siglas en inglés), es una entidad reconocida en medicina humana1-3, descrita en paciente críticos. Se definió en 2008 como la actividad insuficiente de corticosteroides a nivel celular, con relación a la gravedad de la enfermedad del paciente4, manifestada por una insuficiente regulación de los factores de transcripción proinflamatorios mediada por los receptores de glucocorticoides2. Se produce en enfermedades graves y de curso agudo. Actualmente, el síndrome se reconoce por la presencia de hipotensión persistente (incapacidad de mantener la presión arterial sistólica > 90 mmHg o la presión arterial media > 65 mmHg) en pacientes normovolémicos, a pesar una fluidoterapia adecuada5-8 y de terapia adecuada con vasopresores1-3,9 (Figura 1), debido a inflamación sistémica producida por una causa infecciosa subyacente10. También se ha descrito en pacientes con enfermedades críticas de origen no séptico, como enfermedades cardiacas, cirugías, insuficiencia hepática, neumonía, síndrome de distrés respiratorio agudo, lesiones intracraneales, traumatismos, quemaduras y después de lesiones importantes2,3,11–16.
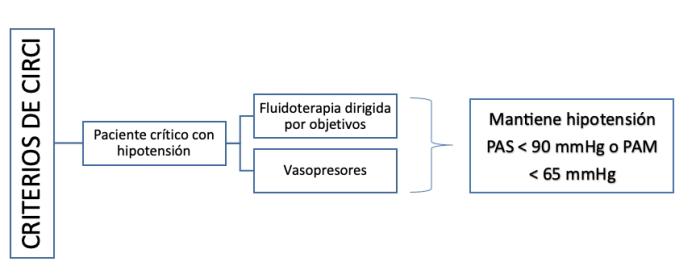
Figura 1. Criterios que definen la insuficiencia de corticosteroides relacionados con la enfermedad crítica.
Este síndrome se denominaba anteriormente insuficiencia adrenal relativa17,18, término en desuso ya que hay otros factores que contribuyen a la aparición de CIRCI además de las alteraciones adrenales. Las publicaciones de CIRCI en medicina veterinaria se limitan a casos individuales y evaluaciones del eje hipotálamo-hipófisis-adrenal en grupos reducidos de pacientes con enfermedades críticas9,19-22. En estos reportes, la evaluación del deterioro del eje hipotálamo-hipófisis-adrenal se basa en los valores del cortisol delta (diferencia entre la concentración antes y después de la administración de hormona adrenocorticótropa (ACTH))19-23. Las recomendaciones actuales en medicina humana no respaldan el uso de la prueba de estimulación de ACTH para identificar a los pacientes con CIRCI que requieren tratamiento con corticosteroides1-3. En su lugar, se sospecha CIRCI cuando la terapia con fluidos y el shock resistente a vasopresores responden a la administración de hidrocortisona2,22,24. Se desconoce si las recomendaciones clínicas para pacientes humanos con CIRCI pueden extrapolarse a medicina de pequeños animales.
Fisiopatología
El cortisol es una hormona liberada, en condiciones normales, por las glándulas adrenales en pequeñas cantidades. Los glucocorticoides (entre los que se encuentra el cortisol), se sintetizan a partir del colesterol. Tienen funciones homeostáticas en el organismo: supresión de la formación de osteoblastos25, gluconeogénesis en el hígado26, control de la respuesta de los linfocitos T en el sistema de defensa27, producción adecuada de catecolaminas, estabilización de membranas celulares y regulación de receptores adrenérgicos, entre otras. La concentración sérica de cortisol está determinada por el eje hipotálamo-hipófisis-adrenal, mediante una cascada hormonal y un sistema de retroalimentación negativo4,28 (Figura 2).
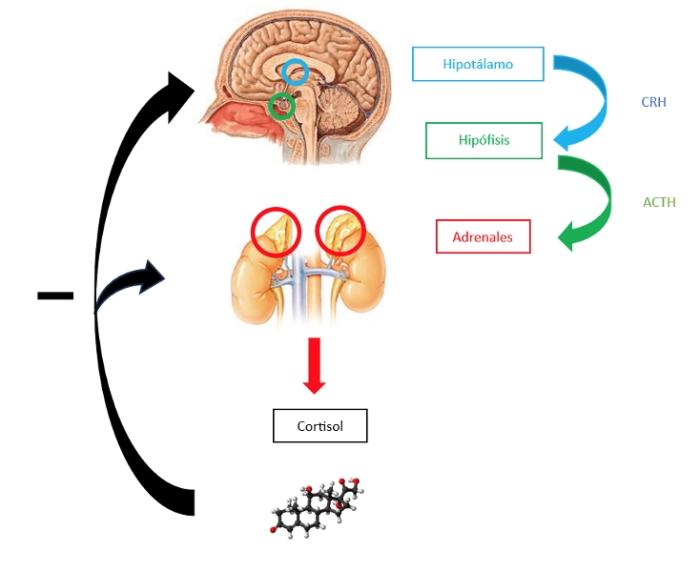
Figura 2. Eje hipotálamo-hipófisis-adrenales.
El hipotálamo produce la hormona liberadora de corticotropina (corticotropin-releasing hormone, CRH, por sus siglas en inglés), que estimula la liberación de hormona adrenocorticotropa (Adrenocorticotropic hormone, ACTH, por sus siglas en inglés) en la hipófisis anterior. El hipotálamo libera también vasopresina, que actúa de forma sinérgica junto con la CRH, para aumentar la secreción de ACTH. Esta última se distribuye por la circulación sanguínea, estimulando la zona fasciculada y reticular de las glándulas adrenales, que producen y liberan el cortisol4,28.
En periodos de estrés y en enfermedades críticas se producen cambios importantes en la función endocrina, liberándose cortisol en mayor cantidad. Esta liberación forma parte de la respuesta de estrés fisiológica y es proporcional a la enfermedad o al factor estresante, siendo esencial para mantener la homeostasis durante ese periodo29. El eje hipotálamo-hipófisis-adrenal responde al estrés físico o fisiológico liberando catecolaminas (epinefrina y norepinefrina) mediante activación del sistema nervioso simpático, que a su vez induce la liberación de CRH, vasopresina y ACTH, estimulando a las adrenales para una mayor liberación de cortisol1,30. Además, en tejidos inflamados o infectados, los mediadores de la inflamación estimulan directamente los nervios periféricos del sistema nervioso autónomo, que estimula la liberación de CRH, y también la corteza adrenal para aumentar la producción de cortisol, independientemente de la CRH/ACTH. La vida media del cortisol en estas circunstancias aumenta, por la disminución de su metabolismo1,30. Los estudios realizados tanto en medicina humana como en veterinaria describen gran variedad en la función adrenal en pacientes críticos29. Debido a los mecanismos mencionados, cuando el paciente sufre estrés fisiológico, al aumentar los niveles de cortisol, puede producirse hiperglucemia, resistencia a la insulina, disminución de la cantidad de proteína en el hueso y músculo, hiperlipidemia, infecciones o disminución de la ACTH31. Por el contrario, los niveles bajos de cortisol pueden conllevar hipoglucemia, aumento de la sensibilidad a la insulina, pérdida de peso, hipotensión, anorexia, fatiga y aumento de ACTH31.
En la circulación sanguínea, la mayor parte del cortisol se une a una globulina transportadora (corticosteroid-binding globulin, CBG por sus siglas en inglés), y a la albúmina29. El cortisol que no está unido a estas proteínas (cortisol libre), es biológicamente activo, ejerciendo su efecto sistémico en casi todos los tipos de células del cuerpo, mediante el receptor de glucocorticoides (GR). El complejo GR-cortisol, que se forma en el citoplasma de las células diana, entra al núcleo, afectando a la transcripción de múltiples genes, alterando la función celular32. En los tejidos inflamados, los neutrófilos liberan unas enzimas llamadas elastasas, que escinden el cortisol de la CBG en el lugar de la inflamación. Dentro de las células existen enzimas 11-βhidroxiesteroide deshidrogenasas (11β-HSD1/2), que regulan la conversión de cortisol activo a inactivo. Las citoquinas inflamatorias regulan la expresión de enzimas 11β-HSD, interviniendo también en la actividad local del cortisol29.
La fisiopatología subyacente de CIRCI parece ser una combinación entre alteraciones en la producción, transporte, metabolismo y respuesta tisular al cortisol, influenciado por otros factores que afecten al eje hipotálamo-hipófisis-adrenal (traumatismos, hemorragias, presencia de citoquinas, etc.)4,33:
- Algunos fármacos disminuyen la producción de cortisol:
- Etomidato: inhibe de forma reversible las enzimas 11-β hidroxilasa y 17-α hidroxilasa, impide la conversión del colesterol en cortisol. Este efecto persiste hasta 24 h tras media hora de la inyección intravenosa, pudiendo prolongarse más en pacientes que han recibido una infusión continua29,34.
- Opiáceos: la administración de forma aguda a pacientes sanos, la administración prolongada en pacientes con dolor crónico y la administración intravenosa intraoperatoria en pacientes quirúrgicos producen una supresión en las concentraciones de ACTH y/o cortisol. Los efectos sobre el hipotálamo y la hipófisis están mediados a través del receptores opioides . Pero, además, las glándulas adrenales presentan sitios específicos de unión a opiáceos, que pueden mediar en la inhibición directa de la secreción de cortisol35,36.
- Antidepresivos: los inhibidores de la recaptación de serotonina así como de norepinefrina estimulan de forma aguda la secreción de cortisol/ACTH; sin embargo, tanto la mirtazapina (no inhibe la recaptación de norepinefrina), como la trazodona (alfa-adrenérgico), inhiben de forma aguda la liberación de cortisol37.
- Propofol: se ha postulado que podría inhibir la secreción de cortisol por su unión a los receptores GABA-A en las adrenales, aunque distintos estudios clínicos muestran resultados contradictorios35,37-39.
- A pesar de los sistemas de retroalimentación positiva y negativa del eje hipotálamo-hipófisis-adrenales, en los enfermos críticos pueden aparecer concentraciones de cortisol total y libre elevadas con concentraciones bajas de ACTH40-42:
- Las citoquinas (entre ellas, la interleukina-1), endotelinas y otras moléculas aumentan la producción y liberación de cortisol en las adrenales, independientemente de las concentraciones de ACTH circulante40,41.
- La inflamación sistémica disminuye la síntesis hepática de las proteínas transportadoras de cortisol (albúmina y CBG)35,43, lo que contribuye al aumento del cortisol libre en circulación sistémica.
- Disminuye el metabolismo del cortisol en riñón e hígado en los pacientes críticos, aumentando también los niveles de cortisol libre44.
- La acidemia, hipertermia y la activación de los neutrófilos provocan cambios estructurales en la CBG, disminuyendo su afinidad por el cortisol45,46.
- Los tejidos diana pueden ser resistentes al cortisol, ya que la estructura y el número de GR se alteran en la sepsis47,48. La administración de corticoide exógeno pueden contribuir en la normalización del número y la función de los GR1,47.
- Las glándulas adrenales tienen unas reservas limitadas de cortisol, por lo que un aumento en las necesidades orgánicas implica un aumento de la producción en las adrenales. Pero en los pacientes sépticos los niveles de colesterol están disminuidos, lo que disminuirá asimismo la producción de cortisol49.
Síntomas clínicos
El síntoma clínico más frecuente en pacientes con shock y sospecha de CIRCI es la hipotensión resistente al tratamiento adecuado con fluidoterapia y vasopresores, posiblemente debido a que los glucocorticoides influyen en la función de los receptores adrenérgicos. Tanto en medicina humana como en veterinaria, los pacientes con respuesta anormal del cortisol a la ACTH tienen mayor probabilidad de fallecer que los que presentan una función normal del eje hipotálamo-hipófisis-adrenales, a igualdad de severidad de la enfermedad7,50-52. La administración de corticosteroides a dosis baja puede producir una mejoría más rápida en la presión arterial, comparado con el placebo5,8. En medicina veterinaria, se describe la retirada de vasopresores tras agregar corticosteroides al tratamiento de los pacientes críticos53-55.
No está claro si existen otras manifestaciones clínicas del CIRCI, aunque si existe un fallo adrenal, sería esperable la aparición de hallazgos típicos de crisis addisoniana2, como anormalidades a nivel neurológico, cardiovascular, digestivo y respiratorias, aunque es difícil distinguir si estas alteraciones pueden atribuirse a la enfermedad primaria que padezca el paciente o al CIRCI2.
Diagnóstico
A pesar de la existencia de guías que sugieren alteraciones en el CIRCI, no existen protocolos claros en cuanto al diagnóstico. En medicina humana, estos protocolos recomiendan utilizar el cortisol basal o la estimulación con ACTH2. Sin embargo, algunos estudios clínicos no encontraron relación entre los niveles de cortisol plasmático y el beneficio del tratamiento con hidrocortisona en el shock séptico resistente al tratamiento con vasopresores6,7. Además, las guías más recientes de la campaña Surviving Sepsis24, no menciona la medición del cortisol basal o la estimulación con ACTH previo a considerar el tratamiento con corticosteroides en el shock séptico. Se desconoce también la dosis individual de cada paciente según la severidad de la enfermedad, debido a que la relación entre el cortisol plasmático y la actividad del cortisol en los tejidos es desconocida.
Al igual que en humana, en medicina veterinaria se han sugerido las mediciones del cortisol basal, de ACTH y la estimulación con ACTH para diferenciar pacientes que puedan tener CIRCI. En un estudio se evaluó a los perros con respuesta inflamatoria sistémica secundaria a infección con un test de estimulación con ACTH, midiendo el cortisol basal y una hora tras la administración de 250 µg de ACTH. Los perros con un aumento de cortisol menor o igual a 3 µg/dl parecen más predispuestos a la hipotensión y tienen menores tasas de supervivencia, comparado con aquellos con aumento mayor de 3 µg/dl51. Otro estudio ha obtenido resultados similares en perros con sepsis, trauma severo y síndrome de dilatación-vólvulo gástrico50. En estudios más recientes, los perros con enfermedades críticas tienen valores de cortisol basal más altos que aquellos sin ninguna enfermedad23,56, mientras que los niveles de cortisol tras estimulación con ACTH no muestra diferencias significativas55. Además, los niveles de cortisol elevado constituyen un valor predictivo negativo en cuanto a la supervivencia23.
Los estudios realizados en gatos han utilizado el cortisol basal, la estimulación con ACTH y los valores de delta cortisol. Algunos autores sugieren que los gatos críticos tienen concentraciones de cortisol basal más elevadas que los gatos sanos57. En los estudios donde realizan la estimulación con ACTH, se administran 125 µg de ACTH sintética por gato57,58. Sugieren que los valores de delta cortisol en gatos sépticos son menores que en gatos no enfermos, pero no proporcionan un valor de corte exacto para CIRCI. Además, no parecen existir diferencias significativas en cortisol basal, cortisol posestimulación con ACTH y delta cortisol en los gatos supervivientes y en los fallecidos, o entre los sépticos y no sépticos57,58.
Debido a los estudios realizados en medicina humana y a los avances en la compresión de la fisiopatología del CIRCI, parece que los valores de cortisol en los pacientes caninos y felinos pueden representar marcadores de la severidad de la enfermedad más que un diagnóstico de CIRCI, por lo que no pueden realizarse por el momento recomendaciones de cómo realizar el diagnóstico. La Sociedad Europea de Endocrinología Veterinaria (European Society of Veterinary Endocrinology, ESVE por sus siglas en inglés), presenta dudas sobre la evidencia de la existencia del CIRCI, aunque sí que menciona que algunos pacientes críticos hipotensos, no responsivos a fluidoterapia ni a vasopresores, pueden beneficiarse de la administración de fármacos con actividad glucocorticoide59.
Tratamiento
En medicina humana, en pacientes con shock séptico que no responden a fluidoterapia (Tabla 1) ni a dosis intermedias-altas con vasopresores, las guías actuales de CIRCI2 recomiendan dosis bajas de hidrocortisona (< 400 mg/día/adulto) al menos durante 3 días.
| Parámetro | Objetivo |
|---|---|
| Frecuencia cardiaca | 80-140 lpm |
| Frecuencia respiratoria | 18-24 rpm |
| Pulso | Femoral y dorsal pedal palpable |
| Presión arterial sistólica | 100 – 120 mmHg |
| Presión arterial media | 70-80 mmHg |
| Lactato | < 2 mmol/l |
| Producción urinaria | > 1 ml/kg/h |
| Estado mental | Responsivo |
Tabla 1. Respuesta adecuada a la resucitación con fluidoterapia. Modificado de Surviving sepsis in veterinary medicine61.
Las guías Surviving Sepsis recomiendan dosis más bajas (200 mg/día/adulto)24. Sin embargo, ambas guías coinciden en la baja evidencia de estas recomendaciones. Suele administrarse la hidrocortisona dividiendo la dosis total de 200 mg/día/adulto en 4 bolos de 50 mg cada 6 horas, o bien administrando una infusión continua intravenosa de hidrocortisona de 10 mg/h, previa administración de un bolo de carga de 100 mg. Una vez establecido el tratamiento, algunos estudios sugieren mantener la dosis previamente establecida durante un máximo de 7 días7,8 o hasta la descarga de UCI8; otros estudios sugieren mantener la dosis de 200 mg/día/adulto durante 5 días, con una reducción paulatina durante los 6 días posteriores60.
Como ya se ha comentado, en medicina veterinaria existen evidencias limitadas sobre si los perros y gatos con enfermedades críticas e hipotensión persistente a pesar del tratamiento con fluidoterapia (Tabla 2) y vasopresores (Tabla 3), pueden verse beneficiados de la administración de corticosteroides a dosis bajas. Los estudios publicados en pacientes caninos no encuentran diferencias significativas en la supervivencia de perros con shock séptico tratados con hidrocortisona21,51, aunque ambos presentan un número limitado de casos. En estudios más antiguos, en pacientes con sospecha de CIRCI se describe en uso de hidrocortisona a dosis de 0.5 – 1 mg/kg/6 h en bolo IV51,54,55, o la dosis total diaria equivalente administrada en infusión continua.
| Tipo de fluido | Dosis | Características importantes | Ejemplos de fluidos |
|---|---|---|---|
| Cristaloide isotónico | Bolo: 10–20 ml/kg IV en 15 – 30 minutos. Dosis total de shock: 60 – 90 ml/kg en perros, 45- 60 ml/kg en gatos. | Redistribución rápida con efecto expansor de volumen de corta duración. Administrar con cuidado en pacientes con baja presión coloidosmótica y aumento de permeabilidad vascular por riesgo de edema pulmonar e intersticial | 0.9 % NaCl, Ringer Lactato, Isofundin, Plasmalyte 148, Normosol-R |
| Soluciones hipertónicas | 3- 5 ml/kg de una solución del 7 % - 7.5 % en 10 – 20 minutos | Monitorizar electrolitos, sobre todo el sodio. Precaución en hiponatremia crónica. Puede aumentar la depleción de volumen intersticial en pacientes deshidratados. Buena opción en resucitación de pequeño volumen, sobre todo en shock séptico, shock hemorrágico y traumatismo craneoencefálico | Concentraciones variables, aunque generalmente se utiliza el NaCl 7.5 % |
| Coloides sintéticos | Bolo de 2-5 ml/kg IV en 10-30 minutos. Dosis total de shock: - perros 10 – 20 ml/kg; gatos, 5 – 10 ml/kg | Expansor de volumen intravascular. Puede producir alteraciones de coagulación en grandes dosis. Descritas lesiones renales, sobre todo en pacientes con lesiones preexistentes | Hespan Hextend Pentaspan Vetstarch, Voluven, HydraVol Suspensión de comercialización en Europa en 2022 por el Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC). Mayor riesgo que beneficio en su uso |
| Derivados sanguíneos | Concentrado de glóbulos rojos y plasma fresco congelado: 10–20 ml/kg IV en 2- 4 horas. Sangre completa: 20–30 ml/kg IV en 2 – 4 horas | Determinar grupo sanguíneo. Monitorizar reacciones transfusionales durante su administración. Indicado en pacientes con shock hemorrágico agudo | Concentrado de glóbulos rojos canino y felino. Plasma fresco congelado canino y felino. Sangre completa canina y felina procedente de donantes |
Tabla 2. Resucitación con fluidos. Modificado de Silverstein, Small Animal Critical Care, Third Ed.62.
| Vasopresor | Dosis |
|---|---|
| Norepinefrina | 0.1–1 µg/kg/min IV |
| Epinefrina | 0.05–1 µg/kg/min IV |
| Vasopresina | 0.5–5 mU/kg/min IV |
| Dopamina | 5–15 µg/kg/min IV |
Tabla 3. Vasopresores más frecuentemente utilizados en infusión continua. Modificado de Silverstein, Small Animal Critical Care, Third Ed.63.
En el estudio más reciente21, administraron hidrocortisona a una dosis inicial de 1 mg/kg IV como bolo de carga, seguido de una infusión continua a dosis de 0.08 mg/kg/h (o 2 mg/kg/día), en pacientes en shock séptico con sospecha de CIRCI, que presentan puntuaciones mayores en escala de gravedad APPLE que aquellos pacientes en shock séptico pero sin sospecha de CIRCI. Se han publicado casos aislados de pacientes sépticos en los que, tras la administración de hidrocortisona, ha podido retirarse paulatinamente la administración de vasopresores53-55. En los pacientes en los que se comience la terapia con hidrocortisona, se aconseja continuar con ella en caso de que presenten mejoría en las 24 primeras horas de administrar el fármaco (Figura 3).
Figura 3. Paciente en shock séptico en tratamiento con fluidoterapia con cristaloides, coloides naturales, vasopresores e infusión continua con hidrocortisona.
Tampoco existen protocolos que indiquen la duración del tratamiento con hidrocortisona tras las primeras 24 h. Algunos estudios sugieren continuar con la dosis previamente descrita durante 3- 4 días y posteriormente realizar una disminución gradual de dosis durante otros 3 – 4 días9, o ir disminuyendo la dosis un 50 % cada 48 h53.
Bibliografía
1. Annane D, Pastores SM, Arlt W, Balk RA, Beishuizen A, Briegel J, et al. Critical illness-related corticosteroid insufficiency (CIRCI): a narrative review from a Multispecialty Task Force of the Society of Critical Care Medicine (SCCM) and the European Society of Intensive Care Medicine (ESICM). Intensive Care Medicine. 2017. 43: 1781–92.
2. Annane D, Pastores SM, Rochwerg B, Arlt W, Balk RA, Beishuizen A, et al. Guidelines for the diagnosis and management of critical illness-related corticosteroid insufficiency (CIRCI) in critically ill patients (Part I): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Intensive Care Medicine. 2017 Dec 1;43(12):1751–63.
3. Pastores SM, Annane D, Rochwerg B. Guidelines for the diagnosis and management of critical illness-related corticosteroid insufficiency (CIRCI) in critically ill patients (Part II): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Intensive Care Medicine. 2018 Apr 1;44(4):474–7.
4. Marik PE, Pastores SM, Annane D, Meduri GU, Sprung CL, Arlt W, et al. Recommendations for the diagnosis and management of corticosteroid insufficiency in critically ill adult patients: Consensus statements from an international task force by the American College of Critical Care Medicine. Critical Care Medicine. 2008;36(6):1937–49.
5. Annane D, Renault A, Brun-Buisson C, Megarbane B, Quenot JP, Siami S, et al. Hydrocortisone plus Fludrocortisone for Adults with Septic Shock. New England Journal of Medicine. 2018 Mar;378(9):809–18.
6. Sprung CL, Annane D, Moreno R, Freivogel K, Weiss YG, Benbenishty J, et al. Hydrocortisone Therapy for Patients with Septic Shock. New England journal of medicine. 2008;358(2):111–24. Available from: www.nejm.org
7. Annane D, Sébille V, Charpentier C, Bollaert PE, François B, Korach JM, et al. Effect of Treatment With Low Doses of Hydrocortisone and Fludrocortisone on Mortality in Patients With Septic Shock. Journal of the american medical association. 2002;288(7):862–71.
8. Venkatesh B, Finfer S, Cohen J, Rajbhandari D, Arabi Y, Bellomo R, et al. Adjunctive Glucocorticoid Therapy in Patients with Septic Shock. New England Journal of Medicine. 2018 Mar;378(9):797–808.
9. Creedon JMB. Controversies surrounding critical illness-related corticosteroid insufficiency in animals. Journal of Veterinary Emergency and Critical Care. 2015; 25: 107–112.
10. Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Chest. 1992 Jun;101(6):1644-55
11. Ducrocq N, Biferi P, Girerd N, Latar I, Lemoine S, Perez P, et al. Critical illness-related corticosteroid insufficiency in cardiogenic shock patients: Prevalence and prognostic role. Shock. 2018;50(4):408–13.
12. Sun W ping, Yuan G xiong, Hu Y juan, Liao L zhen, Fu L. Effect of low-dose glucocorticoid on corticosteroid insufficient patients with acute exacerbation of chronic obstructive pulmonary disease. World Journal Emergency Medicine. 2015;6(1):34.
13. Song JH, Kim JH, Lee SM, Lee J. Prognostic implication of adrenocortical response during the course of critical illness. Acute and Critical Care. 2019;34(1):38–45.
14. Piano S, Favaretto E, Tonon M, Antonelli G, Brocca A, Sticca A, et al. Including Relative Adrenal Insufficiency in Definition and Classification of Acute-on-Chronic Liver Failure. Clinical Gastroenterology and Hepatology. 2020 May 1;18(5):1188-1196.e3.
15. Yang Y, Liu L, Jiang D, Wang J, Ye Z, Ye J, et al. Critical illness-related corticosteroid insufficiency after multiple traumas: A multicenter, prospective cohort study. Journal of Trauma and Acute Care Surgery. 2014;76(6):1390–6.
16. Chen X, Chai Y, Wang SB, Wang JC, Yue SY, Jiang RC, et al. Risk factors for corticosteroid insufficiency during the sub-acute phase of acute traumatic brain injury. Neural Regeneration Research. 2020 Jul 1;15(7):1259–65.
17. Casares Vivas M, Raurich Puigdevall JM, Rota IA, Llompart Santamaría E, Juvé YJI. Shock séptico e insuficiencia suprarrenal relativa. Medicina Intensiva. 2003. 27 (8):525 – 530.
18. Teven S, Amberts WJL, Ruining AAB, Rank F, De H, Ong J. Corticosteroid therapy in severe illness. New England Journal of Medicine. 1997;337(18):1285–92.
19. Pierini A, Marchetti M, Favilla G, Gori E, Lippi G, Cecherrini G, et al. Critical illness-related corticosteroid insufficiency (CIRCI) in dogs with systemic inflammatory response syndrome (SIRS). Journal of Veterinary Internal Medicine. 2020 Jan 1; 34(1):339–530.
20. R Pisano SR, Howard J, Posthaus H, Kovacevic A, Yozova ID, Ivayla Yozova CD. Hydrocortisone therapy in a cat with vasopressor-refractory septic shock and suspected critical illness-related corticosteroid insufficiency Key Clinical Message. Clinical Case Report. 2017;5(7):1123–9.
21. Summers AM, Culler C, Yaxley PE, Guillaumin J. Retrospective evaluation of the use of hydrocortisone for treatment of suspected critical illness–related corticosteroid insufficiency (CIRCI) in dogs with septic shock (2010–2017): 47 cases. Journal of Veterinary Emergency and Critical Care. 2021 May 1;31(3):371–9.
22. Marchetti M, Pierini A, Favilla G, Marchetti V. Critical illness-related corticosteroid insufficiency in dogs with systemic inflammatory response syndrome: A pilot study in 21 dogs. Veterinary Journal. 2021 Jul 1;273.
23. Swales H, Batchelor D, O’Connell EM. Evaluation of serum cortisol concentration as a prognostic indicator for nonsurvival to hospital discharge in critically ill dogs. Journal Of The American Veterinary Medical Association. 2020;256(9):1034–40.
24. Laura Evans, Andrew Rhodes, Waleed Alhazzani, Massimo Antonelli, Craig M. Coopersmith, Craig French, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Critical Care Medicine. 2021;49(11). Available from: www.ccmjournal.org
25. Doga M, Bonadonna S, Giustina A. Glucocorticoids and bone: cellular, metabolic and endocrine effects. Vol. 3. 2004.
26. John K, Marino JS, Sanchez ER, Hinds TD. The glucocorticoid receptor: Cause of or cure for obesity? American Journal of Physiology - Endocrinology and Metabolism. American Physiological Society; 2016; 310:249–257.
27. Ashwell JD, Lu FWM, Vacchio MS. Glucocorticoids in T cell development and function. Annual review of immunology. 2000.18, 309–345.
28. Hinds JA, Sanchez ER. The Role of the Hypothalamus–Pituitary–Adrenal (HPA) Axis in Test-Induced Anxiety: Assessments, Physiological Responses, and Molecular Details. Stresses. 2022 Mar 14;2(1):146–55.
29. Vandewalle J, Libert C. Glucocorticoids in Sepsis: To Be or Not to Be. Frontiers in immunology. 2020. Jul 21:11:1318
30. Venkatesh B, Cohen J. Adrenocortical (dys)function in septic shock - A sick euadrenal state. Best Practice and Research: Clinical Endocrinology and Metabolism. 2011 Oct;25(5):719-33.
31. Kyrou I, Tsigos C. Stress hormones: physiological stress and regulation of metabolism. Current Opinion in Pharmacology. 2009 Dec;9(6):787-93.
32. Lu NZ, Cidlowski JA. Glucocorticoid receptor isoforms generate transcription specificity. Trends in Cell Biology. 2006 Jun;16(6):301-7.
33. Téblick A, Peeters B, Langouche L, Van den Berghe G. Adrenal function and dysfunction in critically ill patients. Nature Reviews Endocrinology. 2019 Jul;15(7):417-427.
34. Cuthbertson BH, Sprung CL, Annane D, Chevret S, Garfield M, Goodman S, et al. The effects of etomidate on adrenal responsiveness and mortality in patients with septic shock. Intensive Care Medicine. 2009 Nov;35(11):1868–76.
35. Peeters B, Güiza F, Boonen E, Meersseman P, Langouche L, Van den Berghe G. Drug-induced HPA axis alterations during acute critical illness: a multivariable association study. Clinical Endocrinology. 2017 Jan 1;86(1):26–36.
36. de Vries F, Bruin M, Lobatto DJ, Dekkers OM, Schoones JW, van Furth WR, et al. Opioids and their endocrine effects: A systematic review and meta-analysis. Journal of Clinical Endocrinology and Metabolism. 2020 Apr 1;105(4):1020–9.
37. Loche S, Cappa M, Ghizzoni L, Maghnie M, Savage MO. Central Nervous System-Acting Drugs Influencing Hypothalamic-Pituitary-Adrenal Axis Function. In: Pediatric Endocrinology. 2009, Vol. 17, chapter 108 – 120.
38. Rahardjo TM. Propofol Effect on Stress Response and Free Radicals in Patient during Surgery and Sedation Procedure. The Indonesian Biomedical Journal. 2015 Dec 1;7(3):147.
39. Sedighinejad A, Imantalab V, Mirmansouri A, Nabi BN, Tarbiat M, Sadeghi AM, et al. Comparing the effects of isoflurane-sufentanil anesthesia and propofol-sufentanil anesthesia on serum cortisol levels in open heart surgery with cardiopulmonary bypass. Anesthesia and Pain Medicine. 2016 Dec 1;6(6): e42066.
40. Peeters B, Meersseman P, Vander Perre S, Wouters PJ, Vanmarcke D, Debaveye Y, et al. Adrenocortical function during prolonged critical illness and beyond: a prospective observational study. Intensive Care Med. 2018 Oct 1;44(10):1720–9.
41. Boonen E, Vervenne H, Meersseman P, Andrew R, Mortier L, Declercq PE, et al. Reduced Cortisol Metabolism during Critical Illness. New England Journal of Medicine. 2013 Apr 18;368(16):1477–88.
42. Boonen E, Meersseman P, Vervenne H, Meyfroidt G, Guïza F, Wouters PJ, et al. Reduced nocturnal ACTH-driven cortisol secretion during critical illness. American Journal of Physiology, Endocrinology and Metabolism. 2014 Apr 15;306(8).
43. Vermes I, Beishuizent A, Hampsink RM, Haanen C. Dissociation of Plasma Adrenocorticotropin and Cortisol Levels in Critically Ill Patients: Possible Role of Endothelin and Atria1 Natriuretic Hormone. Journal of Clinical Endocrinology and Metabolism. 1995 Apr;80(4):1238-42.
44. Van Den Berghe G, Eblick AT, Gunst J. The hypothalamus-pituitary-adrenal axis in sepsis- and hyperinflammation-induced critical illness: Gaps in current knowledge and future translational research directions. EBioMedicine. 2022;84:104284.
45. Meyer EJ, Nenke MA, Rankin W, Lewis JG, Torpy DJ. Corticosteroid-Binding Globulin: A Review of Basic and Clinical Advances. Hormone and Metabolic Research. 2016 Jun;48(6):359-71.
46. Bae YJ, Kratzsch J. Corticosteroid-binding globulin: Modulating mechanisms of bioavailability of cortisol and its clinical implications. Best Practice and Research: Clinical Endocrinology and Metabolism. 2015 Oct;29(5):761-72.
47. Téblick A, Gunst J, Van Den Berghe G. Critical Illness-induced Corticosteroid Insufficiency: What It Is Not and What It Could Be. Journal of Clinical Endocrinology and Metabolism. 2022 Jul 1;107(7):2057–64.
48. Vassiliou AG, Floros G, Jahaj E, Stamogiannos G, Gennimata S, Vassiliadi DA, et al. Decreased glucocorticoid receptor expression during critical illness. European Journal of Clinical Investigation. 2019 Apr 1;49(4).
49. Annane D, Maxime V, Ibrahim F, Alvarez JC, Abe E, Boudou P. Diagnosis of adrenal insufficiency in severe sepsis and septic shock. American Journal of Respiratory and Critical Care Medicine. 2006 Dec 15;174(12):1319–26.
50. Martin LG, Groman RP, Daniel ;, Fletcher J, Behrend EN, Kemppainen RJ, et al. Pituitary-adrenal function in dogs with acute critical illness.Journal of the American Veterinary Medical Association. 2008.233(1), 87–95.
51. Burkitt JM, Haskins SC, Nelson RW, Kass PH. Relative Adrenal Insufficiency in Dogs with Sepsis. Journal of Veterinary Internal Medicine. 2007 Mar;21(2):226–31.
52. Annane D, Sébille V, Troché G, Raphaël JC, Gajdos P, Bellissant E. A 3-Level Prognostic Classification in Septic Shock Based on Cortisol Levels and Cortisol Response to Corticotropin. Journal Of The American Veterinary Medical Association. 2000 Feb 23;283(8):1038-45.
53. Pisano SRR, Howard J, Posthaus H, Kovacevic A, Yozova ID. Hydrocortisone therapy in a cat with vasopressor-refractory septic shock and suspected critical illness-related corticosteroid insufficiency. Clinical Case Report. 2017 Jul;5(7):1123–9.
54. Peyton JL, Burkitt JM. Critical illness-related corticosteroid insufficiency in a dog with septic shock: Case Report. Journal of Veterinary Emergency and Critical Care. 2009 Jun;19(3):262–8.
55. Durkan S, De Laforcade A, Rozanski E, Rush JE. Suspected relative adrenal insufficiency in a critically ill cat. Journal of Veterinary Emergency and Critical Care. 2007 Jun;17(2):197–201.
56. Jericó MM, Bento FM, Silva RD, Cardozo FB de S, Ponce F de G, Soila RM, et al. Adrenal function evaluation in critically ill dogs with low doses of synthetic ACTH. Brazilian Journal of Veterinary Research in Animal Science. 2020;57(2):1–7.
57. Prittie JE, Barton LJ, Peterson ME. Hypothalamo-pituitary-adrenal (HPA) axis function in critically ill cats. Journal of Veterinary Emergency and Critical Care. 2003;13(165).
58. Costello MF, Fletcher DJ, Silverstein DC. Adrenal insufficiency in feline sepsis. . In: Proceedings of the ACVECC postgraduate course 2006: sepsis in veterinary medicine. 2006. p. 41.
59. ESVE. Critical Illness-Related Corticosteroid Insufficiency (CIRCI). 2021 [cited 2023 Oct 18]. ALIVE Project. Available from: https://www.esve.org/alive/search.aspx
60. Gordon AC, Mason AJ, Thirunavukkarasu N, Perkins GD, Cecconi M, Cepkova M, et al. Effect of early vasopressin vs norepinephrine on kidney failure in patients with septic shock: The VANISH randomized clinical trial. Journal of the American Medical Association. 2016 Aug 2;316(5):509–18.
61. Balakrishnan A, Silverstein D. Shock Fluids and Fluid Challenge. In: Silverstein D, Hopper K, editors. Small Animal Critical Care Medicine. Third edition. Elsevier; 2023. p. 402–408.
62. Mittleman Boller E, Silverstein DC. Sepsis and Septic Shock. In: Silverstein D, Hopper K, editors. Small Animal Critical Care Medicine. Third edition. Elsevier; 2023. p. 519–526.
63. Montealegre-Golcher F. Surviving Sepsis in Veterinary Medicine [Internet]. Massachusetts; 2018 [cited 2023 Oct 18]. Available from: https://www.isvma.org/wp-content/uploads/2018/10/SurvivingsepsisinVeterinary-Medicine.pdf
 by Multimédica
by Multimédica