Defecto congénito del septo atrial y enfermedad mitral degenerativa crónica en una perra Yorkshire terrier
Resumen breve
Se presenta el caso de una perra Yorkshire terrier de 13.5 años con signos de fallo cardíaco congestivo derecho, secundario a un defecto del septo atrial (DSA) congénito y enfermedad degenerativa válvula mitral (EDVM), combinación de patologías escasamente descrita en la literatura.Índice de contenidos
Resumen
El defecto de septo atrial (DSA) es una patología poco frecuente en perros caracterizado por una comunicación entre los atrios a través de un defecto septal. Los DSA tienen un origen congénito en la mayoría de los casos, aunque también se han descrito DSA de tipo adquirido, por rotura del septo atrial en pacientes con enfermedad degenerativa de la válvula mitral (EDVM) o de tipo iatrogénico, mediante perforación septal para disminuir la presión en el atrio izquierdo y el edema pulmonar. El objetivo de este artículo es aportar los datos clínicos, tratamiento y evolución de una perra de edad avanzada con DSA y EDVM, una combinación de cardiopatías escasamente descrita en la literatura.
Se refirió a nuestro hospital una hembra castrada, Yorkshire terrier de 13.5 años de edad con ascitis e hiporexia, en tratamiento con furosemida y pimobendan y sin evolución favorable. Los datos del examen físico y métodos complementarios de exploración pusieron de manifiesto un DSA tipo ostium secundum amplio y EDVM junto con una taquicardia supraventricular sostenida muy rápida (300 lat/min) Tras el tratamiento estándar para fallo cardíaco congestivo y sotalol como antiarrítmico, mostró mejoría evidente pero la arritmia volvió a los 15 días, por lo que se sustituyó el sotalol por diltiazem. Un mes después, la perra permanece asintomática.
Introducción
Los defectos cardíacos congénitos representan el 1.6 % de las cardiopatías y, dentro ellos, la prevalencia de los defectos del septo atrial (DSA) se encuentra entre el 0.7 y 8.25 %1-3. El DSA se describe como una comunicación entre los dos atrios a través de un defecto en el septo interatrial4,5. Existen cuatro tipos de DSA5: a) DSA ostium primum se ubica en la parte más baja (apical) del septo y se origina a partir de una alteración en la fusión del septum primum y la almohadilla endocárdica; b) el DSA ostium secundum es el más común y se encuentra más dorsal, en la región de la fosa oval; c) el DSA tipo seno venoso se ubica en la parte superior del septo, cerca de la unión con la vena cava craneal; d) el defecto tipo seno coronario se origina a partir de una interrupción en la formación de la pared entre el seno coronario y el atrio izquierdo.
Los DSA pueden aparecer como malformación congénita aislada o coexistiendo con otros defectos tales como displasia de la válvula mitral y tricúspide1,2. En otras ocasiones, aunque menos frecuente, se han visto asociados a cardiopatías adquiridas tales como la enfermedad degenerativa de la válvula mitral (EDVM) y la cardiomiopatía dilatada (CMD)4,6,7.
En pacientes con DSA aislados el desvío sanguíneo se produce desde el atrio izquierdo, con mayor presión, hacia el derecho con menor presión. Sin embargo, la magnitud del flujo dependerá del tamaño del defecto, la relación entre la resistencia vascular pulmonar y la sistémica y la complianza entre los dos ventrículos4,5.
Cuando los defectos son de pequeño tamaño no suelen producir signos clínicos. En la exploración física no suele detectarse soplo debido al desvío sanguíneo ya que la diferencia de presión entre los atrios es baja y la turbulencia del flujo sanguíneo escasa; sin embargo, puede escucharse un soplo sistólico atribuido al incremento del flujo a través de la válvula pulmonar, a la insuficiencia tricúspide por dilatación de las cámaras derechas, o por el desarrollo de hipertensión pulmonar5. En algunos estudios se ha descrito que los signos clínicos aparecen más comúnmente en perros adultos asociados a patologías adquiridas que desestabilizan la hemodinámica del DSA y este se diagnostica como hallazgo incidental4,6,7. Si los defectos son amplios se observan signos clínicos de fallo cardíaco congestivo derecho, más comúnmente en perros adultos jóvenes, debido a la remodelación del ventrículo derecho y a la hipertensión pulmonar4,5.
Aunque el DSA es una patología congénita, también se han descrito algunos casos de DSA adquiridos por rotura del septo interatrial secundaria a un aumento de la presión en el atrio izquierdo en perros con EDVM6. Asimismo, se han descrito los DSA de tipo iatrógenico, es decir la creación de un DSA temporal, para reducir la presión del atrio izquierdo en pacientes humanos con estenosis de la válvula mitral8. El mismo procedimiento se ha descrito en perros con EDVM y fallo cardíaco congestivo izquierdo recurrente, observándose la resolución del edema pulmonar en aquellos pacientes en los que el defecto creado permanecía abierto durante el tiempo de estudio9.
El objetivo de este caso es presentar los hallazgos clínicos, los resultados de los exámenes complementarios, el tratamiento y la evolución de una perra Yorkshire terrier con DSA congénito y EMDC.
Caso clínico
Una perra Yorkshire terrier, castrada de 13.5 años de edad y 3.2 kg de peso es referida al Servicio de Cardiorrespiratorio para una valoración cardiológica debido a la presencia ascitis, taquicardia, decaimiento e hiporexia de cinco días de evolución. Se encontraba en tratamiento con furosemida (1.5 mg/kg/12 h) y pimobendan (0.2 mg/kg/12 h), sin evolución favorable.
Lo más destacado del examen físico ha sido lo siguiente: la perra presenta una reducida condición corporal (ICC 2/5), distensión abdominal moderada, mucosas ligeramente pálidas, tiempo de relleno capilar < 2 s y frecuencia respiratoria de 32 respiraciones/min; la auscultación pulmonar era normal y la auscultación cardíaca mostró un ritmo regular con marcada taquicardia difícil de contar (> 250 latidos/min). El pulso femoral era muy débil, simétrico y sincrónico con el latido cardíaco. La exploración del abdomen puso de manifiesto que la distensión abdominal era secundaria a la presencia de líquido.
Con base en estos datos, el diagnóstico presuntivo que se consideró, considerando la edad, signos clínicos y examen físico de la perra fue de fallo cardíaco congestivo derecho, sin excluir otras causas de ascitis tales como afección hepática, renal o neoplasia abdominal. Los exámenes complementarios seleccionados en primer lugar fueron electrocardiograma, examen ecocardiográfico, ecografía abdominal y hematología y bioquímica sanguíneas.
El electrocardiograma (ECG) puso de manifiesto una taquicardia supraventricular sostenida de complejos estrechos, sin ondas P visibles, con un ritmo regular y una frecuencia ventricular de 300 latidos/minuto (Figura 1). La maniobra vagal realizada no mostró cambios en el trazado del ECG, aunque no hubo buena tolerancia por parte del animal.
Lo más destacado del examen ecocardiográfico fue lo siguiente: mediante el modo 2D se observó dilatación severa de las cavidades derechas y del atrio izquierdo mientras que el ventrículo izquierdo aparecía reducido de tamaño (Figura 2). Las hojas de la válvula mitral aparecían engrosadas y con prolapso valvular leve, mientras que las hojas de la válvula tricúspide mostraban coaptación incompleta. Asimismo, se visualizó un defecto del septo atrial de tipo ostium secundum de 6 mm (ver Figura 2). El modo M mostró movimiento sistólico anterior del septo ventricular (Figura 3).
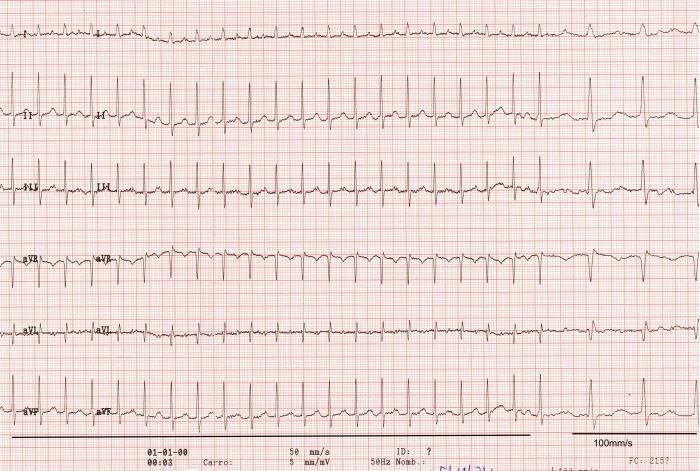
Figura 1. Electrocardiograma de 6 derivaciones obtenido en decúbito lateral derecho el día de la primera visita, mostrando una taquiarritmia supraventricular sostenida a 300 lat/min de frecuencia ventricular instantánea donde no se pueden identificar las ondas P. 50 mm/s; 0.5 cm = 1 mV; en la parte de la derecha se puede observar un trazado a 100 mm/s y 0.5 mm = 1 mV.
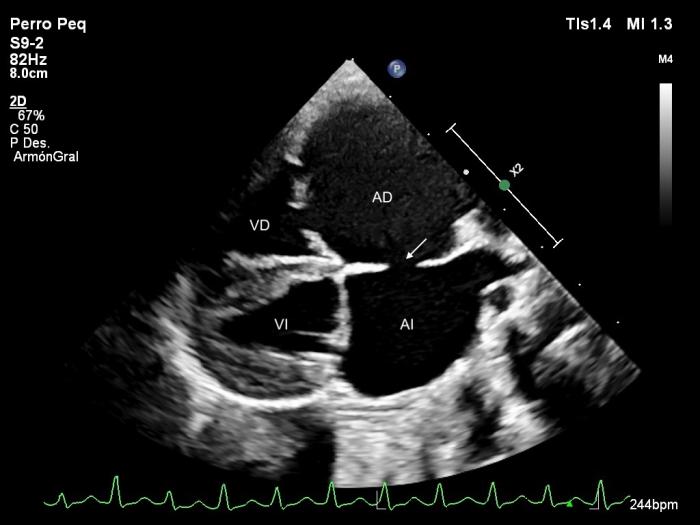
Figura 2. Ecocardiograma 2D, obtenido mediante acceso paraesternal derecho de eje largo, 4 cámaras donde se observa dilatación importante de los dos atrios, un defecto del septo atrial tipo ostium secundum (flecha) y leve prolapso de la válvula mitral. AD, atrio derecho; AI, atrio izquierdo; VD, ventrículo derecho; VI, ventrículo izquierdo.
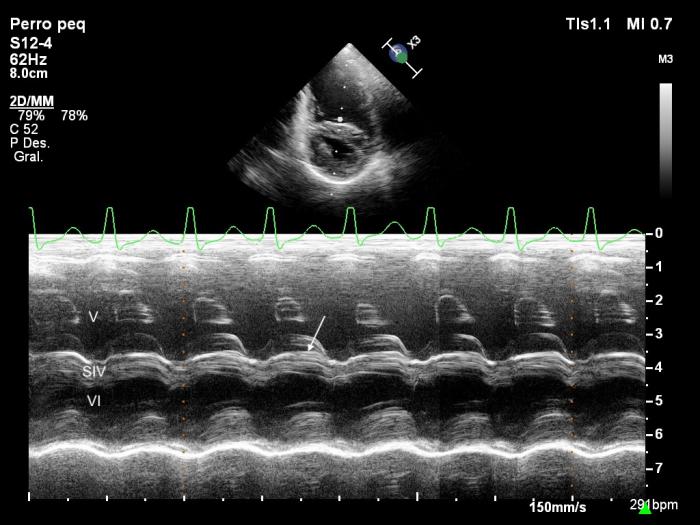
Figura 3. Ecocardiograma modo M, obtenido mediante acceso paraesternal derecho de eje corto, nivel ventricular, donde se observa dilatación del ventrículo derecho (VD), movimiento sistólico anterior del septo ventricular (SIV) (flecha) y reducido tamaño del ventrículo izquierdo (VI).
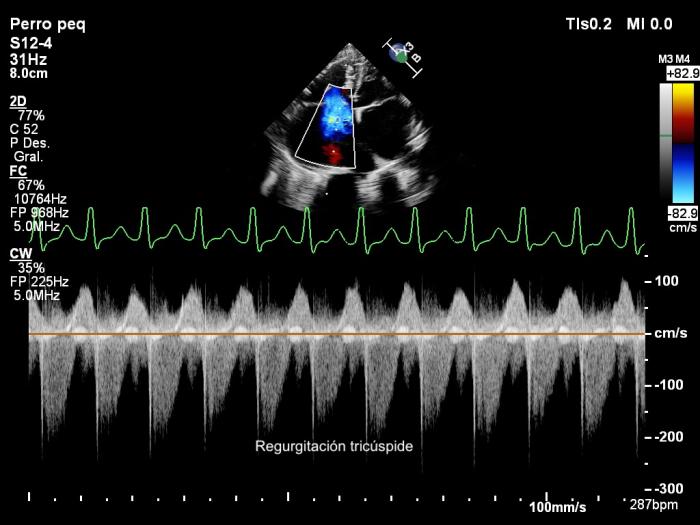
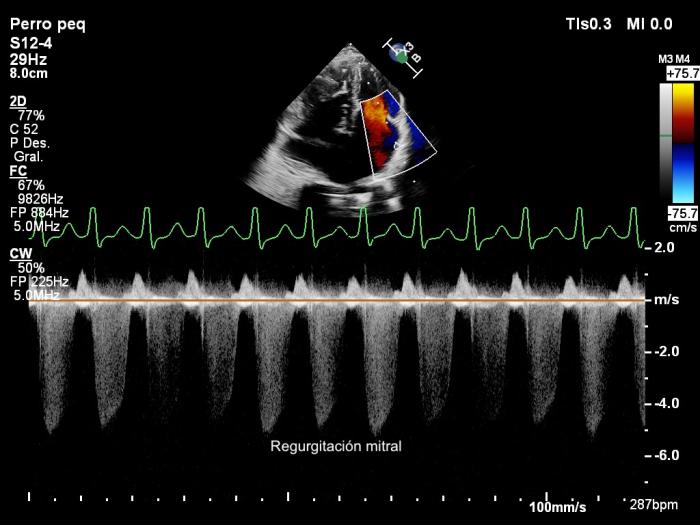
Mediante el Doppler color y espectral se puso de manifiesto una regurgitación mitral moderada, regurgitación tricúspide severa (Figura 4) y un flujo bidireccional a través del defecto septal con dos picos de velocidad, uno sistólico y otro diastólico (Figura 5). Los valores de los parámetros ecocardiográficos se encuentran en la Tabla 1.
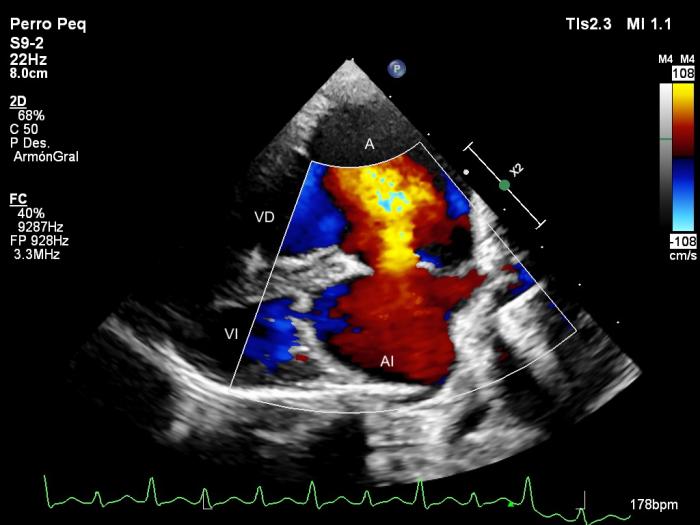
Figura 4. Ecocardiogramas Doppler (A) color y (B, C) espectral obtenidas mediante acceso paraesternal izquierdo apical de 4 cámaras mostrando dilatación severa de las cavidades derechas, regurgitación tricúspide (A, B) y mitral (A, C) y un flujo desde el atrio derecho (AD) hacia el izquierdo (AI) a través del defecto septal. VD, ventrículo derecho; VI, ventrículo izquierdo.
| Parámetros ecocardiográficos | Visita 1 | Visita 2 | Valores de referencia |
|---|---|---|---|
| Peso (kg) | 3.200 | 3.100 | - |
| FC (lat/min) | 300 | 156 | 73 (42-190)20 |
| VId | 1.66 | 1.71 | 2.1 (1.8-2.6)21 |
| VIs | 1.44 | 0.99 | 1.3 (1.0-1.8)21 |
| VIdN | 1.16 | 1.23 | 1.42 (1.17-1.67)22 |
| VIsN | 0.90 | 0.62 | 0.74 (0.45-0.96)22 |
| FA (%) | 11.4 | 41.6 | 31.4 (20.2-56.9)22 |
| AI/AO | 2.37 | 2.22 | 1.42 (0.92-1.70)22 |
| AD/AAo | 3.70 | 3.20 | 1.51 (0.97-2.07)22 |
| VD/AAo | 2.59 | 2.2 | 1.10 (0.72-1.62)22 |
| Vmáx AP (m/s) ITV (cm) | 0.56 5.2 | 52.4 6.01 | 1.06 0.87-1.34)24 |
| Vmáx Ao (m/s) IVT (cm) | 0.72 4.43 | 0.62 5.48 | 1.15 (0.92-1.50)24 |
| Qp/QS | 1.18 | 1.10 | 1.0 (0.71-1.29)25 |
| E mitral Vmáx (m/s) | 0.80 Fusión de ambos picos E y A | 0.85 | 0.74(0.57-0.95)24 |
| A mitral Vmáx (m/s) | 0.80 Fusión de ambos picos E y A | 0.47 | 0.46 (0.28-0.76)24 |
| E/A mitral | 1.7 | 1.8 | < 2.024 |
| TAPSE/Ao | 0.38 | 0.55 | 0.80 (0.47-1.20)23 |
| Vmáx RM (m/s) GPD (mmHg) | 5.0 100 | 5.0 100 | - |
| Vmáx RT (m/s) GPD (mmHg) | 2 16 | 2 16 | - |
| DSA flujos -Sistólico (m/s) -Diastólico 1 (m/s) -Diastólico 2 (m/s) | 1.84 1.86 | 2.37 1.34 1.11 | - |
Tabla 1. Parámetros ecocardiográficos de la paciente en la primera visita y a las 72 h tras instaurar el tratamiento. FC, frecuencia cardíaca; VId, VIs, dimensión ventrículo izquierdo diastólica y sistólica, respectivamente; VIdN, VIsN diámetro ventrículo Izquierdo diastólico y sistólico respectivamente, normalizados al peso corporal; AI/Ao, ratio atrio izquierdo/aorta; AD/AAo, ratio dimensión atrio derecho 4 cámaras/anillo aórtico; VD/AAo, ratio dimensión ventrículo derecho/anillo aórtico; ITV, integral velocidad tiempo; DSA, defecto del septo atrial; Qp/Qs; ratio flujo sanguíneo pulmonar/flujo sanguíneo aórtico; GPD, gradiente de presión Doppler; TAPSE, excursión sistólica del plano del anillo tricúspide.
A nivel abdominal se observó moderada cantidad de líquido libre sin otras alteraciones evidentes. El análisis del líquido ascítico fue compatible con un trasudado modificado. La hematología y bioquímica sanguíneas solamente mostraron ligera elevación de la urea (60 mg/d; rango de referencia de nuestro laboratorio < 50 mg/dl) con valores de creatinina y electrolitos normales.
El diagnóstico definitivo fue de insuficiencia cardíaca congestiva derecha secundaria a defecto del septo atrial coexistiendo con enfermedad mitral degenerativa crónica.
Se instauró tratamiento médico ambulatorio con furosemida subcutánea (1 mg/kg/12 h) tres días, benaceprilo (0.4 mg/kg/24 h) PO, espironolactona (3 mg/kg/24 h) PO, pimobendan (0.3 mg/kg/12 h) PO y sotalol (1 mg/kg/8 h) PO.
A las 72 h de haber instaurado el tratamiento se revisó al animal, destacando la tutora una evolución favorable respecto al tamaño del abdomen y a su actividad, aunque persistía la hiporexia y había presentado algún episodio de náuseas. En la exploración física se observó reducción de la distensión abdominal y patrón respiratorio normal (24 rpm). La auscultación cardíaca reveló un ritmo regular, frecuencia cardíaca de 156 latidos/minuto y un soplo pansistólico grado IV/VI con punto de máxima intensidad sobre el área apical izquierda (foco mitral) y otro en el hemitórax derecho con intensidad III/VI con punto de máxima intensidad sobre el foco tricúspide. Se repitió el ECG, mostrando un ritmo sinusal con frecuencia cardíaca de 150 latidos/minuto de frecuencia instantánea y valores de ondas e intervalos dentro del rango de referencia (Figura 6).
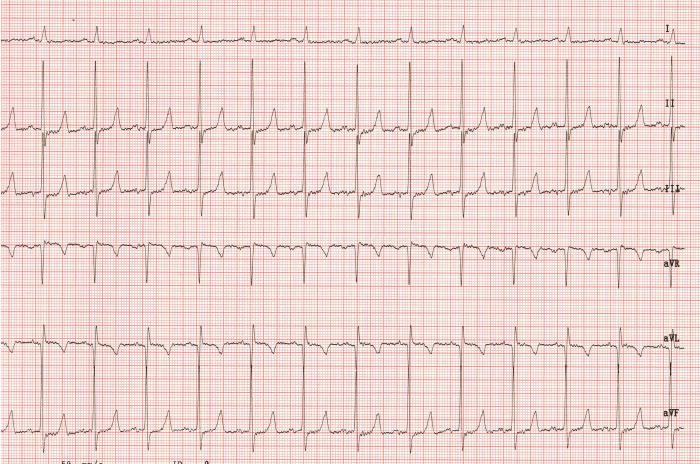
Figura 6. Electrocardiograma de 6 derivaciones, obtenido en decúbito lateral derecho tres días después de iniciar el tratamiento, mostrando un ritmo sinusal a 156 lat/min de frecuencia cardíaca. 50 mm/s, 1 cm = 1 mV.
En las radiografías de tórax se apreció un desplazamiento dorsal de la tráquea, una cardiomegalia marcada (tamaño cardíaco VHS = 13.2 unidades vertebrales (uv), rango < 10.6 uv10 con aumento marcado de la silueta de las cavidades derechas; no se han observado alteraciones a nivel del mediastino, los bronquios y el campo pulmonar (Figura 7). El examen ecocardiográfico mostró, respecto a la primera visita, movimiento normal del septo ventricular (ausencia del movimiento sistólico anterior), leve disminución de los atrios y aumento de las velocidades de los flujos de salida ventriculares (Tabla 1) y contraste espontáneo en el atrio derecho (Figura 8, Vídeo 1).
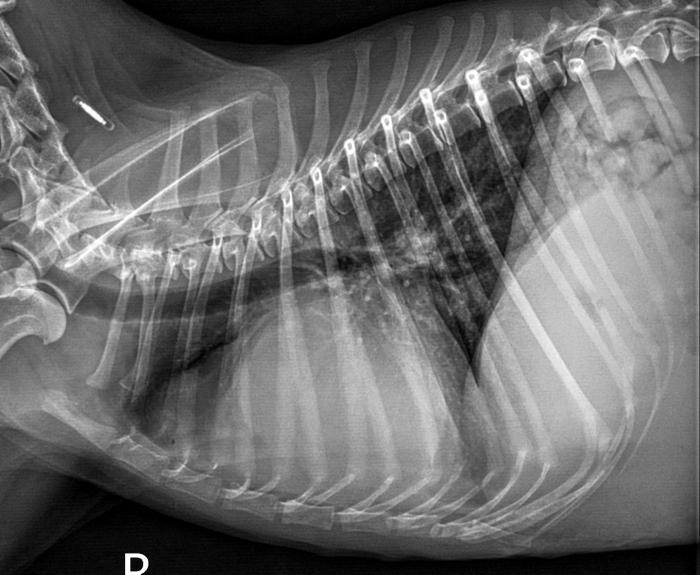
Figura 7. Radiografías torácicas, proyecciones (A) lateral derecha y (B) dorsoventral, obtenidas tres días después de iniciar el tratamiento de la perra. Se observa desplazamiento dorsal de la tráquea y cardiomegalia global, más importante de las cavidades derechas; asimismo, se observa incrementada la silueta de a aurícula izquierda. No se observan alteraciones destacables en el campo pulmonar.
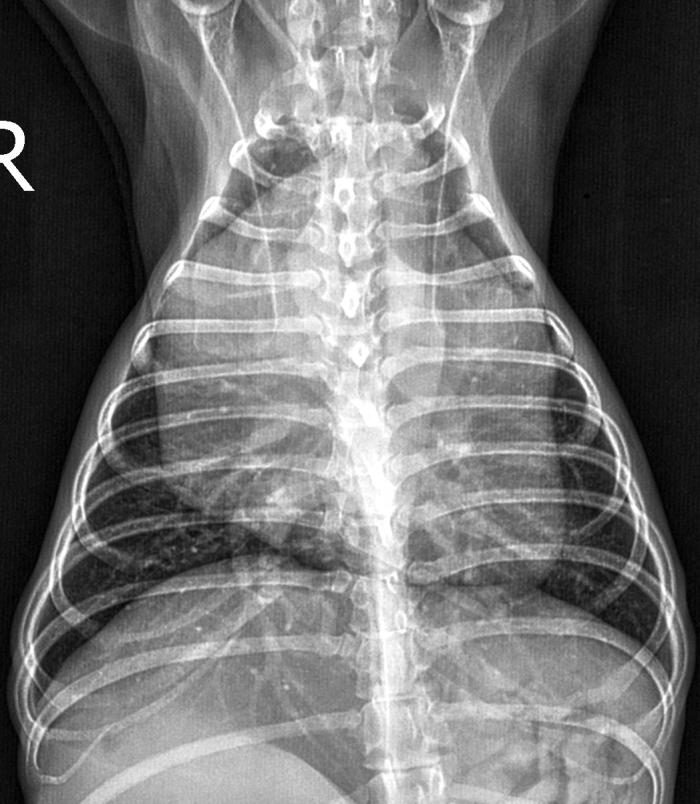
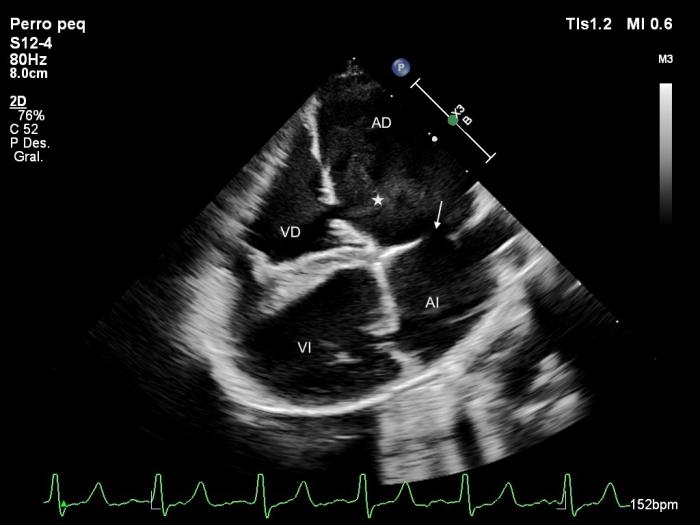
Figura 8. Ecocardiograma 2D, obtenido mediante acceso paraesternal derecho de eje largo, 4 cámaras donde se observa dilatación importante de los dos atrios, un defecto del septo atrial tipo ostium secundum (flecha), leve prolapso de la válvula mitral y contraste espontáneo en el AD (*).
Vídeo 1. Se observan lo mismos hallazgos que en la Figura 8 y especialmente el contraste espontáneo en movimiento en el atrio derecho (AD). AI, atrio izquierdo; VD, ventrículo derecho, VI, ventrículo izquierdo.
Con base en la evolución clínica, se prescribió la misma pauta de tratamiento salvo la furosemida que se pasó a la vía oral, a dosis de 1 mg/kg/8 h y se añadió clopidogrel, como antitrombótico, a dosis de 18.75 mg totales cada 24 h VO.
A los 10 días la perra presentó recidiva de la ascitis y de la taquicardia supraventricular; al realizar una maniobra vagal presionando el seno carotídeo, la arritmia cesó momentáneamente, apareciendo un ritmo sinusal. En base a ello se sustituyó el sotalol por diltiazem a dosis de 0.5 mg/kg/8 h y se incrementó la dosis de furosemida a 1.5 mg/kg/8 h. El resto de los fármacos se mantuvieron a las mismas dosis. Un mes después, la perra está asintomática, ha mejorado el apetito y presenta ritmo sinusal en el ECG.
Discusión y conclusiones
En este artículo se presenta un caso clínico caracterizado por fallo cardíaco congestivo derecho secundario a un DSA congénito y EDVM, patologías que, en el conocimiento de las autoras, solamente se ha descrito un caso en la literatura7.
Los DSA pueden ser de tipo congénito o adquirido, ambos muy infrecuentes en perros4-6. Los de tipo congénito no ocasionan signos clínicos en la mayor parte de los casos, de modo que su diagnóstico se realiza de forma incidental durante exploraciones rutinarias o por otras afecciones4,5; cuando aparecen síntomas, suelen observarse en animales adultos jóvenes y corresponden a fallo cardíaco derecho, complicado en algunos casos con hipertensión pulmonar debido al incremento del flujo sanguíneo hacia los pulmones5. En la literatura se han descrito dos casos clínicos similares, en los que como en este caso, fueron perros de edad avanzada con cardiopatías adquiridas (uno EDMV y otro CMD) en los que se observó también un DSA de tipo ostium secundum y se presentaron con FCCD4,7.
Aunque podría dudarse de la naturaleza congénita o adquirida del DSA en los dos pacientes descritos y también en nuestro caso, al no disponer de exámenes ecocardiográficos previos, parece poco probable que el defecto fuese debido a rotura septal ya que se observó mayor tamaño del atrio derecho que del izquierdo, un defecto septal amplio y no se han indicado episodios de edema pulmonar previos que justifiquen una rotura del septo interatrial4,7.
Mientras que no se ha descrito predisposición en perros para los DSA congénitos, la EMDC aparece de forma predominante en perros de raza pequeña y edad avanzada11. Aunque pueden afectarse ambas válvulas atrioventriculares los signos clínicos generalmente corresponden a bajo gasto cardíaco y al fallo cardíaco congestivo izquierdo con edema pulmonar (intolerancia al ejercicio, taquipnea, tos, etc.)11. En este caso, la ascitis ha sido el primer signo clínico, no indicando el tutor de la perra signos previos de edema pulmonar. A medida que se desarrollaba la enfermedad mitral y se incrementaba la elevación de la presión en el atrio izquierdo, paralelamente se aumentaba el volumen de flujo a través del defecto septal hacia el atrio derecho con menor presión, ocasionando aumento de presión en el mismo y también aumento de la presión hidrostática en la circulación sistémica, responsables del fallo cardíaco congestivo derecho4,7.
En la literatura se han descrito también los DSA de tipo iatrogénico con fines terapéuticos, tanto en humana como en perros8,9. En niños con estenosis mitral es una práctica habitual la creación de DSA, de forma temporal, mediante perforación del septo atrial, para reducir la presión del atrio izquierdo con el objetivo de disminuir la congestión venosa y el edema pulmonar. Mientras la función y la distensibilidad del ventrículo derecho no se vean afectadas, el DSA proporciona una vía alternativa para mantener a los pacientes asintomáticos8 hasta el momento de la cirugía.Asimismo, en un artículo en perros con EDVM y fallo cardíaco congestivo izquierdo recurrente, se describe este procedimiento, observándose completa mejoría del edema pulmonar en aquellos animales en los que el defecto septal creado permanecía abierto durante el tiempo del estudio9.
La ecocardiografía es la técnica de elección para el diagnóstico de las alteraciones estructurales cardíacas, tanto congénitas como adquiridas, así como para la evaluación de las consecuencias hemodinámicas derivadas de ellas5,12. En este caso clínico se puso de manifiesto una gran dilatación de las cavidades derechas y atrio izquierdo, un defecto del septo atrial amplio de tipo ostium secundum (6 mm) y signos de engrosamiento y prolapso de la válvula mitral, junto con regurgitación de ambas válvulas atrioventriculares, datos compatibles con EDVM. En los perros con DSA adquirido, descritos en la literatura, el tamaño de la comunicación era menor (alrededor de 1.5 mm)6 que, en el caso descrito aquí, por lo que este hecho apoya nuestra hipótesis de que en esta perra el DSA sería de tipo congénito.
En pacientes con dilatación atrial derecha o izquierda, secundarias a DSA o EMDC se han descrito varios tipos de arritmias en estadios avanzados. Las más frecuentes son las taquiarritmias supraventriculares tales como extrasístoles supraventriculares, flutter/fibrilación atrial, taquicardia atrial focal, taquicardia atrioventricular nodal de reentrada y taquicardia atrioventricular de reentrada, ya sean sostenidas o paroxísticas5,13,14. La perra de este caso clínico presentó al diagnóstico una taquiarritmia supraventricular sostenida, de complejos estrechos, regular y muy rápida (300 latidos/min), difícil de determinar su origen sin estudio electrofisiológico intracavitario. En perros de tamaño mediano y grande con EMDC es frecuente la aparición de fibrilación atrial debido al incremento del tamaño atrial, hecho infrecuente en perros de raza pequeña14. Asimismo, en pacientes con DSA amplios se han descrito varios tipos de arritmias supraventriculares4,13, por lo que es probable que la taquiarritmia de este caso clínico haya sido debida a la dilatación tan marcada del atrio derecho. La aparición de arritmias muy rápidas complica y empeora los signos clínicos de los pacientes ya que la diástole es muy corta y el volumen de eyección sistólico disminuye mucho, por lo que el tratamiento para terminar la arritmia o reducir la frecuencia ventricular son fundamentales14. La elección del sotalol como agente antiarrítmico (clase III) en este caso clínico fue en base a sus propiedades como bloqueante de los canales del potasio y como ß-bloqueante no selectivo, al no poder determinar exactamente el origen de la misma. Sin embargo, al recidivar la arritmia y responder a la maniobra vagal se consideró un posible origen en el nódulo atrioventricular, sustituyendo el sotalol por el diltiazem (clase IV) bloqueante de los canales del calcio que disminuye la velocidad de conducción atrioventricular, con resultado favorable en esta perra ya que el ritmo se convirtió a sinusal.
El contraste espontáneo observado en el atrio derecho, mediante ecocardiografía, en este caso clínico no se ha descrito frecuentemente en perros, siendo más común en gatos con cardiomiopatías15. Según la triada de Virchow puede ser debido a estasis sanguíneo, daño endotelial o un estado de hipercoagulabilidad. En este caso clínico, la taquiarritmia supraventricular, junto con la dilatación del atrio derecho serían factores predisponentes para su desarrollo16. La administración de agentes antitrombóticos como el clopidogrel o anticoagulantes como el rivaroxabán se utilizan para prevenir la formación de trombos y el riesgo de tromboembolismo pulmonar17.
El tratamiento de los pacientes con DSA aislado amplio consiste en el cierre del mismo mediante terapia intervencionista (p. ej.: dispositivo Amplatzer) con buenos resultados en los pacientes en los que se ha conseguido determinar adecuadamente el tamaño del defecto18,19. En los casos en lo que ha permanecido un flujo residual, no han sido hemodinámicamente importantes18. En este caso clínico no se ha valorado el cierre del defecto debido a la edad avanzada, la marcada remodelación de las cavidades cardíacas y al riesgo de la aparición de edema pulmonar, ya que es probable que no se haya producido una adecuada remodelación de las cavidades izquierdas debido al defecto septal que permitía el paso de flujo sanguíneo a través del defecto, impidiendo el edema pulmonar. Es por ello por lo que se optó por el tratamiento médico estándar basado en furosemida, IECA, espironolactona, pimobendan, terapia antiarrítmica y clopidogrel como antitrombótico. Inicialmente, se pautó la furosemida vía SC en base a la deficiente absorción intestinal en casos de congestión venosa sistémica, pasando a la vía oral cuando la ascitis se redujo.
A pesar de la evolución clínica favorable, consideramos que el pronóstico de esta perra es reservado-grave con base en la deficiente condición física, a la arritmia que puede recidivar y a la remodelación cardíaca tan severa que presenta.
En conclusión, los datos clínicos y la evolución de este caso indican que los DSA congénitos aislados pueden ser bien tolerados durante muchos años y que cuando se presentan de forma conjunta con EDVM protegen frente al desarrollo del FCCI, siendo la ascitis el principal signo clínico.
Bibliografía
1.Oliveira P, Domenech O, Silva J, Vannini S, Bussadori R, Bussadori C. Retrospective Review of Congenital Heart Disease in 976 Dogs. J Vet Intern Med 2011;25:477-483.
2.Lucina SB, Sarraff AP, Wolf M, Silva V, Sousa MG, Froes TR. Congenital Heart Disease in Dogs: A Retrospective Study of 95 Cases. Top Companion Anim Med 2021:43:100505.
3.Chetboul V, Charles V, Nicolle A, Carlos Sampedrano C, Gouni V, Pouchelon JL. Retrospective Study of 156 Atrial Septal Defects in Dogs and Cats (2001–2005). J Vet Med A Physiol Pathol Clin Med2006;53:179-84.
4.Gugliemi C, Diana A, Pietra M, Cipone M. Atrial septal defect in five dogs. J Small Anim Pract 2002;43: 317-322.
5.Bussadori C. Congenital Cardiovascular Diseases with a Systemic-to-pulmonary Shunt. En: Bussadori C (ed). Texbook of Cardiovascultar Medicine in Dogs and Cats. Textbook of Cardiovascular medicine in dogs and cats. Edra Publisingh US LCC, Florida 2023, pp 447-554.
6.Peddle G, Buchanan J. Acquired atrial septal defects secondary to rupture of the atrial septum in dogs with degenerative mitral valve disease. J Vet Cardiol 2010;12:129-134.
7.Cavalcanti G, Tatibana L, Varaschin M, Araújo R, Costa Val A. Atrial septal defect in an elderly dog. Arq Bras Med Vet Zootec 2011;63:503-507.
8.Shah S, Waxman S, Gaasch W. The impact of an Atrial Septa Defect on Hemodynamics in Patients with Heart Failure. US Cardiol Rev 2017;11:1-2.
9.Allen J, Phipps K, Llamas A, Barrett K. Left atrial decompression as a palliative minimally invasive treatment for congestive heart failure caused by myxomatous mitral valve disease in dogs: 17 cases (2018–2019). J Am Vet Med Assoc 2021; 258:638-647.
10.Buchanan JW. Vertebral scale system to measure heart size in radiographs Vet Clin North Am Small Anim Pract2000;30:379-93.
11.Ljungvall I, Häggström J. Myxomatous valvular disease. En: Bussadori C (ed). Texbook of Cardiovasculta medicine in dogs and cats. Edra Publisingh US LCC, Florida, 2023, pp 311-317.
12.Saunders AB. Key considerations in the approach to congenital heart disease in dogs and cats. J Small Anim Pract 2021;62:613-623.
13.Jacquemart E, Bessière F, Combes N. Incidence, Risk Factors, and Outcomes of Atrial Arrhythmias in Adult Patients with Atrioventricular Septal Defect. JACC: Clin Electrophysiol 2022;8:331-340.
14.Guglielmini C, Goncalves Sousa M, Baron Toaldo M, Valente C, Bentivoglio V, Mazzoldi C, Bergamin I, Drigo M, Poser H. Prevalence and risk factors for atrial fibrillation indogswith myxomatousmitralvalvedisease. J Vet Intern Med. 2020;34:2223-2231.
15.Lo ST, Walker AL, Georges CJ, Li RH, Stern JA. Dual therapy with clopidogrel and rivaroxaban incatswiththromboembolicdisease. J Feline Med Surg. 2022;24:277-283.
16.Bagot CN, Arya R. Virchowand histriad: a question of attribution. Br J Haematol. 2008;143:180-90.
17. Uchida M, Ohmi A, Fujiwara R, Fukushima K, Doi A, Azuma K, Tsujimoto H Treatment withrivaroxabanand monitoring of coagulation profiles in twodogswith venous thromboembolism. J Vet Med Sci 2020 24;82:1271-1276.
18.Gordon SG, Miller MW, Roland RM, Saunders AB, Achen SE, Drourr LT, Nelson DA. Transcatheter atrial septal defect closure with the Amplatzer atrial ocluder in 13 dogs: short- and mid-term outcome. J Vet Intern Med. 2009;23:995-1002.
19.Shelden A, Wesselowski S, Gordon SG, Saunders AB Transcatheterclosureof a smallatrialseptaldefectwith an Amplatzer patent foramen ovale occluder in a working dog with cyanosis and exercise intolerance at high altitude. J Vet Cardiol. 2017;19:523-529.
20.Lamb AP, Meurs KM,Hamlin RL. Correlation of heart rate to body weight in apparently normal dogs J Vet Cardiol.2010;12:107-10.
21.Cornell CC, Kittleson MD, Della Torre P, Häggström J, Lombard CW, Pedersen HD, Vollmar A, Wey A. Allometricscalingof M-mode cardiac measurements in normal adult dogs.J Vet Intern Med. 2004;18:311-21.
22.Visser LC, Ciccozzi MM, Sintov DJ, SharpeAN. Echocardiographic quantitation of left heart size and function in122 healthy dogs: A prospective study proposing reference intervals and assessing repeatability. J Vet Intern Med 2019;33:1909–1920.
23.Sankisov JN, Visser LC, Davis K, Boon JA, Ross ES, Laws AC. Two-dimensional echocardiographic right heart ratios for assessment of right heart size in dogs: Reference intervals and reproducibility. J Vet Intern Med. 2024;38:3005-3015.
24.Bonagura JD, Miller MW, Darke PGG. Doppler Echocardiography: I Pulsed-Wave and Continuous-Wave Examinations Vet Clin North Am 1998;28:1325-59.
25.Serres F,Chetboul V,Tissier R,Gouni V,Desmyter A,Carlos Sampedrano C, Pouchelon JL. Quantification of pulmonary to systemic flow ratio by a Doppler echocardiographic method in the normal dog: Repeatability, reproducibility, and reference ranges J Vet Cardiol.2009;11:23-9.
 by Multimédica
by Multimédica
