Manejo terapeútico del fallo cardíaco congestivo en un perro con displasia mitral y bloqueo atrioventricular de tercer grado
Resumen breve
Paciente canino, cruce de Border collie de 20 kg de peso, macho castrado y de 4 años presentado para el diagnóstico de una posible enfermedad cardíaca sospechada por su veterinario habitual tras sufrir un episodio de disnea y taquipnea con respuesta positiva a furosemida. El manejo del FCC izquierdo en estos casos puede requerir de una terapia multimodal, basada tanto en drogas, como en procedimientos quirúrgicos como la implantación de un marcapasos.Índice de contenidos
Caso clínico
Paciente canino, cruce de Border collie de 20 kg de peso, macho castrado y de 4 años.
Se presentó al autor para el diagnóstico de una posible enfermedad cardíaca sospechada por su veterinario habitual tras sufrir un episodio de disnea y taquipnea con respuesta positiva a furosemida. En su infancia se había identificado un soplo cardíaco, que persistió en la edad adulta, pero no había sido investigado. Hasta este episodio de disnea, el paciente ejercitaba sin dificultades y no había presentado ningún otro signo clínico. Se encontraba correctamente vacunado y desparasitado. Había residido en España, y posteriormente en Escocia, Reino Unido.
En el examen físico se observaron mucosas rosadas y tiempo de relleno capilar (TRC) inferior a 2 segundos. Patrón respiratorio normal con frecuencia respiratoria de 16 respiraciones por minuto (rpm), bajo tratamiento con furosemida 1 mg/kg/12 h (Libeo® 40, Ceva). Soplo cardíaco apical izquierdo, sistólico, grado III/VI. Ritmo regular, con frecuencia de 120 lpm con pulso femoral fuerte y coincidente con el latido cardíaco. Sonidos pulmonares normales. El resto del examen físico fue normal.
El propietario aportó dos radiografías torácicas tomadas por su veterinario habitual (Figura 1A-B). En ellas se observó cardiomegalia izquierda, dilatación de las venas lobares y un aumento de la densidad en la región perihiliar, con patrón intersticial, compatible con edema pulmonar cardiogénico.
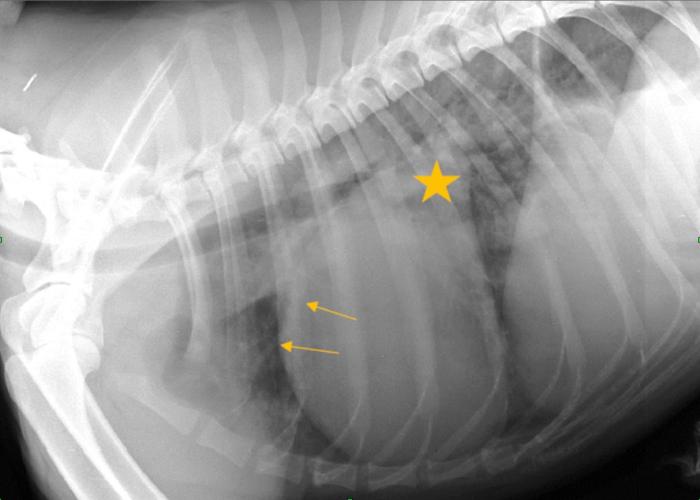
Figura 1. (A) Radiografía laterolateral izquierda. Se observa un atrio izquierdo muy dilatado (estrella), con un aumento de la densidad con patrón intersticial en la región perihiliar pulmonar y marcada dilatación de las venas pulmonares lobares (flechas). (B) Radiografía dorsoventral. Se observa marcada cardiomegalia izquierda y dilatación de las venas lobares. El patrón intersticial en los campos pulmonares es más obvio que en la vista laterolateral, aunque los valores de exposición no son los idóneos (radiografía subexpuesta).
El protocolo diagnóstico adicional incluyó:
- Medida no invasiva de la presión arterial por método Doppler en la extremidad anterior derecha: presión sistémica sistólica: 140 mmHg.
- Ecocardiografía: severa dilatación del atrio izquierdo (Figuras 2 y 3) y la orejuela izquierda (Figuras 4 y 5). Válvula mitral con valvas asimétricas y movimiento anómalo. La coaptación era imperfecta, con severo prolapso. La apertura también era anormal, con morfología en palo de hockey (Figura 6, ver Figura 4). El ventrículo izquierdo se mostró levemente dilatado, con una dilatación muy asimétrica respecto a la del atrio izquierdo (ver Figura 5), otorgando al corazón un aspecto de tapón de botella de champán. La función sistólica era apropiada. El flujo de salida en ambos tractos de salida era laminar y con velocidad pico en rango fisiológico. Las medidas ecocardiográficas principales se encuentran resumidas en la Tabla 1. El electrocardiograma contemporáneo no logró identificar ondas P de manera consistente.
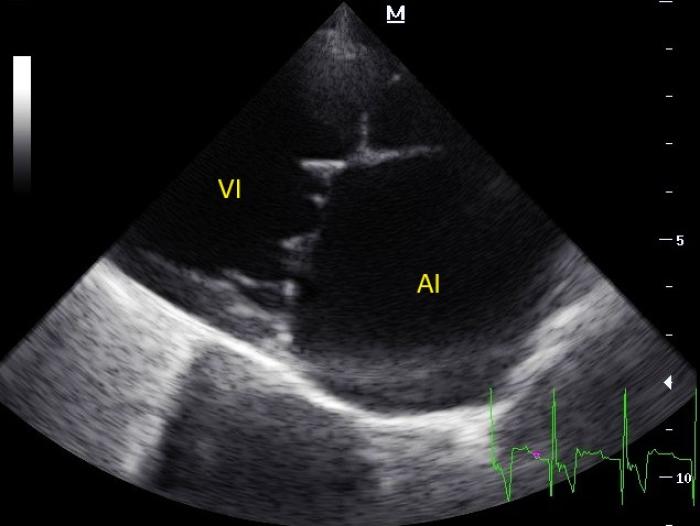
Figura 2. Vista paraesternal derecha eje largo 4 cámaras. Se observa severa dilatación del atrio izquierdo (AI). VI: ventrículo izquierdo.
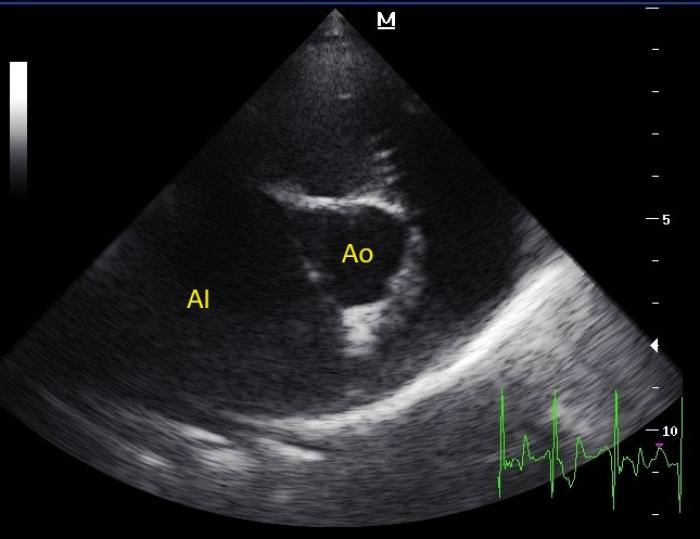
Figura 3. Vista paraesternal derecha eje corto optimizada para atrio izquierdo (AI). Se observa severa dilatación del atrio izquierdo (AI). Ao: aorta.
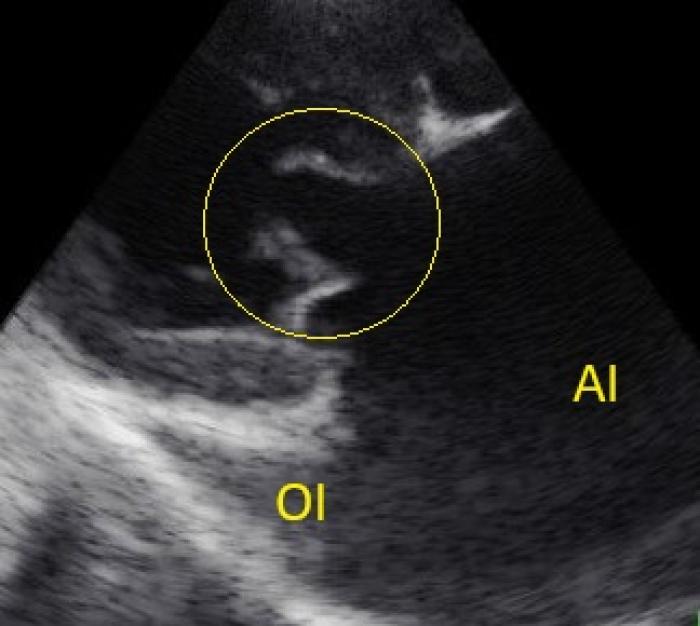
Figura 4. Vista paraesternal derecha eje largo 4 cámaras optimizada para el atrio izquierdo (AI), donde se observa la severa dilatación de la orejuela izquierda (OI). Las valvas de la válvula mitral presentan una morfología anómala, con apertura en morfología de palo de hockey (elipse amarilla).
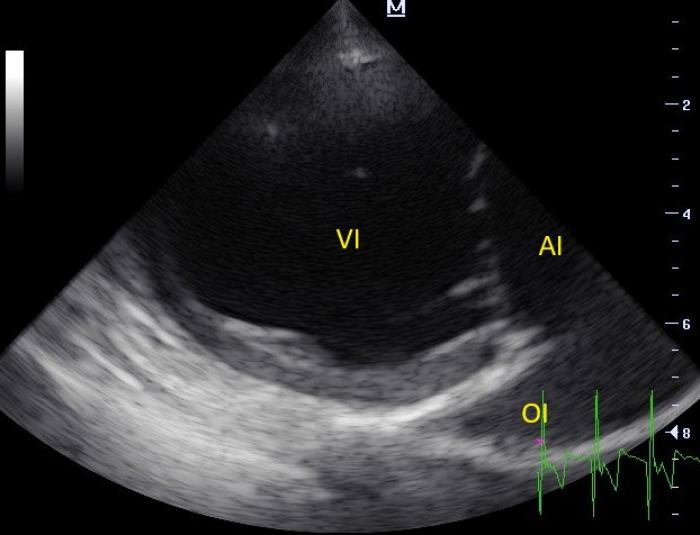
Figura 5. Vista paraesternal derecha eje largo 4 cámaras optimizada para el ventrículo izquierdo (VI). Se observa severa dilatación del atrio izquierdo (AI) y leve dilatación del VI. OI (orejuela izquierda).
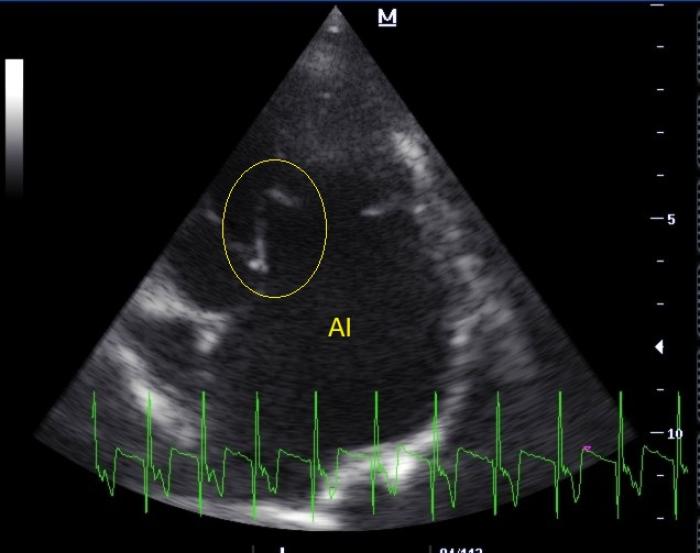
Figura 6. Vista paraesternal izquierda apical 4 cámaras. La válvula mitral presenta morfología de palo de hockey en su apertura, particularmente en la valva septal (elipse amarilla).
| Paciente | Referencia | |
|---|---|---|
| Ratio aurícula/aorta (LA/Ao) | 2.4 | <1.5 |
| Diámetro mayor del atrio izquierdo (LA major) | 64 mm | |
| Ratio diámetro mayor /aorta 5 cámaras (LA major/Ao) | 3.7 | <2.5 |
| Diámetro ventricular izquierdo diastólico normalizado (LVIDdN) | 1.8 | <1.7 |
| Fracción de eyección (FE) | 68 % | >50 % |
| Fracción de acortamiento (FA) | 37 % | >30 % |
| Velocidad máxima onda E (Emax) | 1.5 | <1 m/s |
| Ratio onda E/tiempo relajación isovolúmica (E/IVRT) | 2.7 | <2.5 |
Tabla 1.
- Electrocardiograma (ECG): mostró un ritmo regular de complejos QRS de duración y morfología normal a una frecuencia de 110 latidos por minuto (lpm). La distribución de las ondas P era independiente de los complejos QRS, no cumpliéndose el ratio P:QRS de 1:1. Las ondas P podían visualizarse previas al QRS, posteriores al mismo o incluidas en él (Figura 7), con marcada variabilidad en la duración del intervalo PR. El intervalo RR, así como el intervalo PP eran regulares, siendo aproximadamente el RR de 55 milisegundos (ms) y el PP de 65 ms. En raras ocasiones el ritmo regular se veía interrumpido por complejos prematuros de duración y morfología normales, clasificados como extrasístoles supraventriculares. Se diagnosticó una disociación atrioventricular.
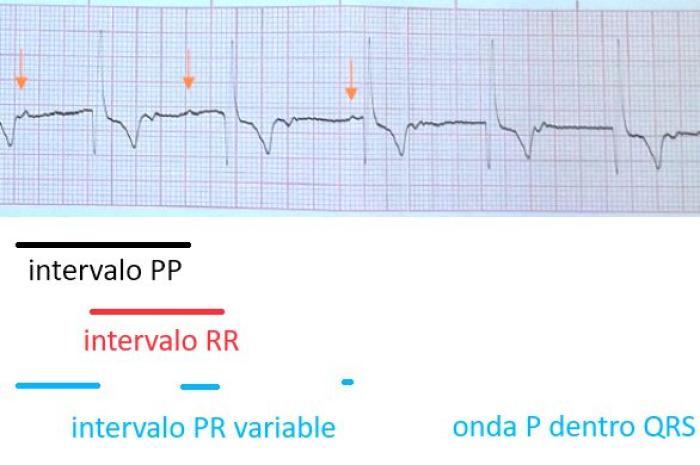
Figura 7. ECG en derivación II a 50 mm/s y 10 mm/mV. La onda P (flechas) presenta un intervalo PR variable, mostrándose cada vez más próxima al QRS hasta quedar incluida en él y ser por tanto no visible. Los intervalos PP (frecuencia atrial) y RR (frecuencia ventricular) son estables.
Tras estas pruebas se diagnosticó una displasia mitral con componente mayoritariamente insuficiente en fallo cardíaco congestivo (FCC) izquierdo, y con presencia de disociación atrioventricular. Dada la severa dilatación atrial se consideró un alto riesgo de progresión a fibrilación atrial.
Se inició tratamiento médico con pimobendán (0.3 mg/kg/12 h, Vetmedin®, Boehringer Ingelheim), furosemida (1 mg/kg Furosemida Almus), benazepril (0.25 mg/kg/24 h, Cardalis®, Ceva) y espironolactona (2 mg/kg/24 h, Cardalis®, Ceva).
Se solicitó al propietario que monitorizara la frecuencia respiratoria en reposo y se programó una revisión en un mes.
Tras un mes de tratamiento, el propietario refirió una frecuencia respiratoria en reposo siempre por debajo del umbral de 30 rpm. Sin embargo, había observado un marcado deterioro en la capacidad de ejercicio del animal, que evitaba el ejercicio intenso y solicitaba descansos durante los paseos rutinarios.
Se realizó como revisión:
- Exploración física: se observó una marcada bradicardia, con una frecuencia de 40 lpm. Las mucosas eran rosadas, el TRC<2 segundos y los pulsos fuertes y sincrónicos con el latido cardíaco, por lo que se consideró que no había un compromiso cardiovascular inmediato.
- Medida no invasiva de la presión arterial de control: 110 mmHg, que supone un descenso de 30 mmHg respecto a la medida anterior, un mes antes.
- Electrocardiograma de control: ritmo de escape ventricular polimórfico a 50 lpm (Figura 8) completamente disociado de un ritmo regular de ondas P a 150 lpm, con ratio P:QRS de 3:1. Intervalo PP de 36 ms e intervalo RR de 112ms. Se diagnóstico un bloqueo atrioventricular de tercer grado.
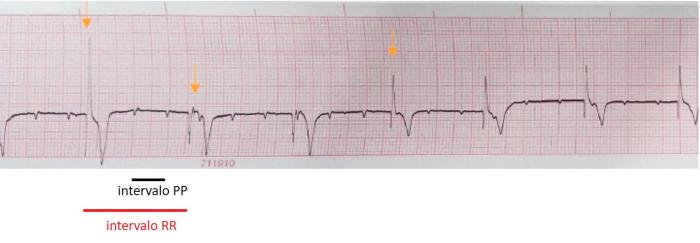
Figura 8. ECG en derivación II a 25 mm/s y 10 mm/mV. Se observan ondas P no conducidas, con una completa disociación del complejo QRS. La frecuencia atrial es de 150 lpm, mientras que la frecuencia ventricular es de 50 lpm. El ritmo de escape ventricular presenta polimorfismo (flechas naranjas señalan las 3 morfologías diferentes identificadas).
- Analítica sanguínea: bioquímica y electrolitos en rango normal, excepto muy leve incremento de la urea 10.6 (Ref.: 2.5-9.6 mmol/l).
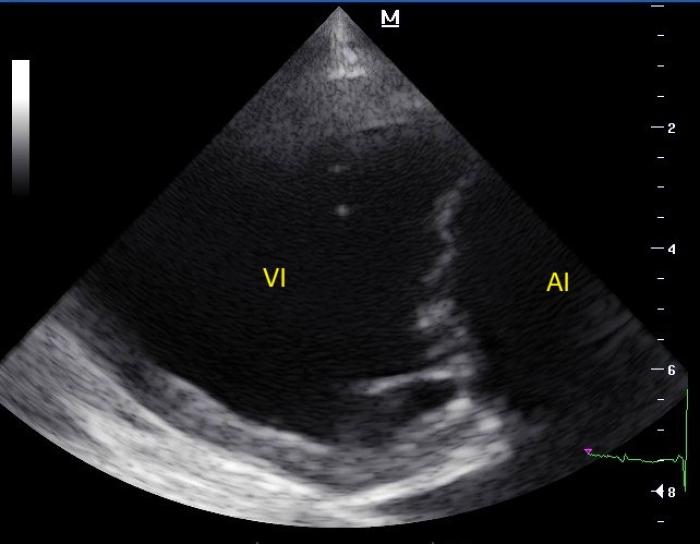
- Ecocardiografía de control: dilatación aún más severa del atrio izquierdo (Figura 9A) y aumento de las presiones de llenado intracardíacas, secundarios a bradicardia patológica. El ventrículo izquierdo mostraba una mayor dilatación (Figura 9B), aunque seguía estando notablemente menos dilatado que el atrio. Los valores ecocardiográficos en el momento de la presentación y la revisión se resumen en la Tabla 2.
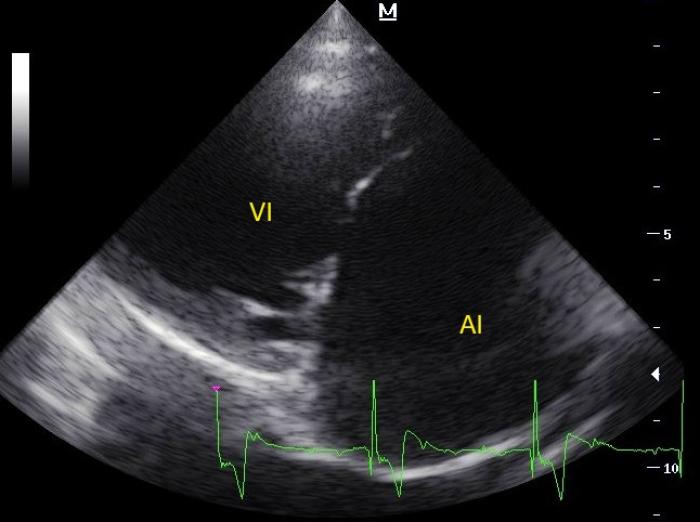
Figura 9. (A) Vista paraesternal derecha eje largo 4 cámaras en ecocardiografía de revisión. Se observa muy severa dilatación del atrio izquierdo (AI). VI: ventrículo izquierdo. (B) Vista paraesternal derecha eje largo 4 cámaras optimizada para el ventrículo izquierdo (VI) en ecocardiografía de revisión. Se observa severa dilatación del atrio izquierdo (AI) y moderada dilatación del VI.
| Presentación | Referencia | |
|---|---|---|
| LA/Ao | 2.4 | 2.5 |
| LA major | 64 mm | 70 mm |
| LA major/Ao | 3.8 | 4.1 |
| LVIDdN | 1.8 | 1.9 |
| FE | 68 % | 71 % |
| FA | 37 % | 42 % |
| Emax | 1.5 m/s | 2.3 m/s |
| E/IVRT | 2.7 | 4.2 |
Tabla 2.
Se discutió con el propietario un pronóstico reservado, y la posibilidad de una recurrencia del fallo cardíaco congestivo debido a la bradicardia. Esta bradicardia solo podía ser tratada de forma eficaz mediante la implantación de un marcapasos. Dados los cambios anatómicos observados en el corazón, el procedimiento quirúrgico sería arriesgado (animal clasificado como ASA III) y el tiempo de supervivencia posterior estaría condicionado por la presencia de FCC preexistente secundario a una alteración anatómica congénita.
En cuanto al tratamiento médico, se redujo la dosis de espironolactona y benazepril al 50 % de la dosis inicial, manteniéndose la furosemida y pimobendán a las dosis iniciales.
El propietario decidió seguir adelante con la implantación de un marcapasos, para lo que se remitió a la universidad de Glasgow. Durante el procedimiento se insertó a través de la vena yugular derecha un electrodo bipolar de fijación pasiva en el ventrículo derecho. Este electrodo se conectó a un generador de impulsos que se acomodó en un bolsillo subcutáneo en el lado derecho del cuello y se programó a 70 lpm en modo VVI (estimulación ventricular con inhibición). El procedimiento se desarrolló sin complicaciones. Se revisó al paciente en una semana, habiéndose desarrollado un leve seroma alrededor del generador de impulsos. Se aplicó un suave vendaje alrededor del cuello y se recomendó restringir el ejercicio de forma más estricta. El seroma se reabsorbió sin más intervención.
Una vez implantado el marcapasos, las dosis de benazepril y espironolactona se elevaron de nuevo a la dosis inicial. Se continuó el pimobendán y la furosemida sin cambios.
Se perdió seguimiento del caso por cambio de centro de trabajo del autor, pero en el último seguimiento conocido, seis meses después de la implantación del marcapasos, el paciente se encontraba asintomático en esta medicación y su marcapasos estaba programado a 70 lpm en modo estimulación ventricular con inhibición con frecuencia responsiva al movimiento (VVIR mode) con rango de 70 a 140 lpm.
Discusión
La displasia mitral es una enfermedad congénita poco frecuente en la población canina1. Consiste en un desarrollo embriológico defectuoso del aparato valvular mitral, lo que puede resultar en insuficiencia, estenosis o ambas2,3. Su diagnóstico se basa en la observación del aparato valvular mediante ecocardiografía en modo 2D, lo que permite identificar algunas características típicas como la apertura en forma de palo de hockey o la asimetría de las valvas, ambas presentes en este paciente. La historia clínica y exploración física también colaboran a su diagnóstico, dado que este paciente fue diagnosticado de un soplo a una edad muy temprana, sugiriendo una patología congénita.
La fisiopatología de la displasia mitral varía según las lesiones presentes. En caso de haber fundamentalmente un componente insuficiente, como en este caso, se comporta de forma muy similar a la enfermedad valvular degenerativa crónica, con progresiva sobrecarga de volumen de las cámaras izquierdas y eventualmente el desarrollo de FCC izquierdo4. La presencia de edema pulmonar en este paciente se diagnosticó mediante la exploración física y la radiografía torácica, que es el gold standard5. Una vez se estableció el diagnóstico, se trató al paciente siguiendo las recomendaciones para el tratamiento de FCC secundario a enfermedad valvular degenerativa crónica6.
En el momento del diagnóstico se realizó un electrocardiograma que reveló la presencia de disociación atrioventricular, que consiste en la activación de atrios y ventrículos por dos marcapasos independientes a frecuencias similares7. En este caso las ondas P se observaron precediendo al complejo QRS, posteriores al mismo o no fueron visibles, presumiblemente por estar incluidas dentro del QRS. La duración y morfología de los complejos QRS estaban dentro de los rangos de normalidad, por lo que se consideró que partían de la región de la unión atrioventricular. Este ritmo ha sido descrito en animales asintomáticos, pero también en pacientes en FCC. Se cree que el ritmo en sí mismo no tiene repercusión hemodinámica significativa y por tanto no se administró ninguna terapia antiarrítmica. Cuando el paciente fue revisado se detectó una marcada bradicardia en la exploración física. La realización de un electrocardiograma reveló una bradicardia severa (50 lpm) con disociación atrioventricular completa y marcada diferencia entre la frecuencia de las ondas P (150 lpm) y complejos QRS (50 lpm), que presentaban morfología aberrante y duración prolongada, indicando un origen ventricular, y dado el polimorfismo, de distintas regiones ventriculares. Se diagnosticó entonces un bloqueo atrioventricular de tercer grado. Es posible que este ritmo se desarrollara de forma independiente o bien que el paciente ya presentara este bloqueo atrioventricular de tercer grado en el momento del diagnóstico inicial. En ese momento, el animal tendría un ritmo de escape de frecuencia elevada al proceder de la unión atrioventricular. Esto puede deducirse por la morfología y duración de los complejos QRS, que estaba dentro de la normalidad. Ninguna intervención terapéutica hubiera sido necesaria en aquel momento, pues la frecuencia ventricular era adecuada. Sin embargo, puede deducirse que, en algún momento durante el mes transcurrido, se produjo un desplazamiento del foco marcapasos hacia porciones más ventrales del ventrículo, que solo fue capaz de generar un ritmo de escape a 50 lpm. En este momento, el paciente mostró claros signos de intolerancia al ejercicio, y el ritmo pudo claramente identificarse como un bloqueo atrioventricular de tercer grado.
La presión arterial en la revisión fue 30 mmHg más baja de la medida inicial. Esto fue muy probablemente consecuencia de la bradicardia, pero también es posible que el tratamiento médico prescrito con un inhibidor de la enzima convertidora de angiotensina y un antagonista de la aldosterona colaboraran en la bajada de la presión8. Por tanto, aunque estas drogas se han demostrado muy seguras9, se decidió reducir la dosis para asegurar una buena perfusión renal y la estabilidad de la presión arterial. Sin embargo, esta reducción de la dosis podía aumentar el riesgo de recidiva del FCC, dado que la revisión ecocardiográfica, mostró una elevación de las presiones de llenado, que puede ser indicativa de estar más próximos al desarrollo de FCC10,11.
Los valores electrolíticos y parámetros renales no mostraron alteraciones significativas, por lo que se decidió mantener la dosis de furosemida. No se elevó la dosis para no colaborar más a la hipotensión, y debido a que el paciente no mostraba signos clínicos de FCC activo.
Se discutió con el propietario que el tratamiento médico sería a largo plazo insuficiente, y la única opción adicional era la implantación de un marcapasos12. Adicionalmente a las consideraciones anestésicas, también había un lado ético en la decisión de implantar el marcapasos. Este paciente ya se encontraba en FCC por otra patología, no tratable quirúrgicamente, y por tanto su esperanza de vida era corta, aun con la implantación de este dispositivo. Esto se discutió con el propietario y se decidió seguir adelante con la intervención.
La implantación de marcapasos es un procedimiento relativamente sencillo y común en centros de referencia13. Sin embargo, comparado con medicina humana, el número de pacientes es muy limitado, y eso hace difícil llegar a conclusiones claras de cuál es el mejor dispositivo y método de estimulación. La implantación de un electrodo bipolar en el ventrículo derecho es el método más frecuente en medicina veterinaria, con alto porcentaje de éxito y una baja prevalencia de complicaciones13. En este caso, el riesgo de complicaciones era más elevado por dos motivos: la presencia de FCC y los severos cambios en la anatomía cardíaca, siendo posible provocar una perforación del septo interatrial. Sin embargo, el paciente superó el procedimiento sin complicaciones intraoperatorias. El desarrollo de seroma alrededor del generador de impulsos se considera una complicación menor13 y en este caso no requirió de mayor intervención que aplicar un suave vendaje.
Se desprende de este caso que las alteraciones anatómicas en enfermedades congénitas pueden afectar tanto a estructuras fibrosas y musculares, como a tejido conductivo, dando lugar a alteraciones eléctricas así como a la propia anatomía del corazón. Adicionalmente, puede afirmarse que el manejo del FCC izquierdo en estos casos puede requerir de una terapia multimodal, basada tanto en drogas, como en procedimientos quirúrgicos como la implantación de un marcapasos.
Bibliografía
- Schrope DP. Prevalence of congenital heart disease in 76,301 mixed-breed dogs and 57,025 mixed-breed cats. J Vet Cardiol. 2015;17(3):192–202.
- Boon J. Veterinary echocardiography. Segunda edición. 2011. Wiley-Blackwell, Iowa, USA.
- Litu SK, Tilley LP. Malformation of the canine mitral valve complex. Journal American Veterinary Medical Association. 1975; 15;167(6):465-71
- Borgarelli, M. and Haggstrom, J. Canine Degenerative Myxomatous Mitral Valve Disease: Natural History, Clinical Presentation and Therapy. Veterinary Clinics North America Small Animal Practice. 2010;40(4), 651-63.
- Balbarini A, Limbruno U, Bertoli D et al. Evaluation of pulmonary vascular pressures in cardiac patients: the role of the chestroentgenogram. J thoracic imaging1991; 6: 62-68
- Keene BW, Atkins CE, Bonagura JD,et al. ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. Journal Veterinary Internal Medicine. 2019; 33: 1127– 1140.
- Perego M, Ramera L, Santilli RA. Isorhythmic atrioventricular dissociation in Labrador retrievers. Journal of Veterinary Internal Medicine. 2012; 26 (2)320-325
- Ishibashi T, Tatebe S, Mitomi A, et al. Hemodynamic effects of benazepril, an angiotensin-converting enzyme inhibitor, as studied in conscious normotensive dogs. Cardiovascular Drugs Therapy. 1991; 5(3):635-41
- Lefebvre HP, Ollivier E, Atkins CE, et al. Safety of spironolactone in dogs with chronic heart failure because of degenerative valvular disease: a population-based, longitudinal study. Journal Veterinary Internal Medicine. 2013; 27(5):1083-91
- Schober KE, Stern JA, DaCunha DN, et al. Estimation of left ventricular filling pressure by Doppler echocardiography in dogs with pacing-induced heart failure. Journal Veterinary Internal Medicine. 2008. 22(3):578-85
- Schober KE, Hart TM, Stern JA, et al. Detection of congestive heart failure in dogs by Doppler echocardiography. Journal Veterinary Internal Medicine. 2010. 24(6):1358-68
- Santilli RA, Giacomazzi F, Porteiro Vázquez DM, et al. Indications for permanent pacing in dogs and cats. Journal Veterinary Cardiology. 2019; 22:20-39.
- Noszczyk-Nowak A, Michałek M, Kapturska K, et al. Retrospective Analysis of Indications and Complications Related to Implantation of Permanent Pacemaker: 25 Years of Experience in 31 Dogs. Journal Veterinary Research.2019; 22;63(1):133-140
 by Multimédica
by Multimédica