¿Mi paciente sufre de una cardiomiopatía hipertrófica clásica?
Resumen breve
La CMH es una entidad clínica asociada a un mal pronóstico en los casos donde los felinos ya presentan sintomatología clínica. Es de vital importancia realizar un diferencial con el EMT y otras patologías que se presentan con fenotipo hipertrófico que se asocian a un mejor pronóstico. Se presentan tres casos clínicos de felinos jóvenes con fenotipo de cardiomiopatía hipertrófica que, si bien comparten elementos clave, presentan particularidades.Índice de contenidos

Introducción
De las enfermedades miocárdicas en gatos, la cardiomiopatía hipertrófica (CMH) es la más común. Esta se define como un engrosamiento del miocardio sin una causa sistémica o cardíaca que la provoque1-3. Se han establecido diferentes valores predictivos de mal pronóstico en esta patología que incluyen una edad de presentación avanzada, incremento del tamaño del atrio izquierdo y su disfunción sistólica, engrosamiento extremo del ventrículo izquierdo, presencia de signos de insuficiencia cardíaca congestiva (ICC) o tromboembolismo arterial, disfunción sistólica del ventrículo izquierdo, presencia de zonas hipocinéticas y delgadas e incremento de la troponina I circulante (cTnI > 0.7 ng/dl)3-5.
Durante la última década, se ha hecho hincapié en publicar información sobre una condición cardíaca que se asemeja fenotípicamente a la CMH, donde los gatos suelen presentarse con síntomas cardíacos parecidos pero cuyo pronóstico difiere mucho de esta. Se trata del engrosamiento miocárdico transitorio (EMT)6-15. Suele afectar a gatos jóvenes y, en muchos casos, se identifica un evento previo relacionado. Dichos animales presentan un miocárdico engrosado (grosor del ventrículo izquierdo al final de la diástole > 6 mm) y dilatación atrial. La mayoría, muestran insuficiencia cardíaca congestiva, aunque se ha descrito también la presencia de tromboembolismos aórticos14,15. De manera similar, se ha descrito una forma particular de insuficiencia cardíaca congestiva secundaria a la administración de corticosteroides16. En ambos casos, los hallazgos cardíacos, requieren de intervención médica durante un tiempo. La particularidad de esta entidad patológica es que se trata de alteraciones reversibles y, a corto plazo, tanto los hallazgos cardíacos como los cambios ecocardiográficos y/o las alteraciones de los biomarcadores, se normalizan. A continuación, se presentan tres casos clínicos de felinos jóvenes con fenotipo de cardiomiopatía hipertrófica que, si bien comparten elementos clave, presentan particularidades.
Caso 1
Un gato macho no castrado, raza Bengalí, de 1 año y 5 kg, fue atendido en el Hospital Veterinari Costa Brava por debilidad del tercio posterior. Mayoritariamente, habitaba en el exterior de la vivienda familiar y se lo encontraron prostrado al lado de la carretera dos días antes de la visita. Estaba correctamente vacunado y desparasitado. El motivo de la debilidad/cojera fue identificado como fractura traumática de la cabeza del fémur izquierda. Dado la sospecha de politraumatismo, se descartaron otras lesiones mediante ecografía y estudio radiológico y fue ingresado, en observación, con analgesia y con fluidoterapia a volumen mantenimiento. Las analíticas preanestésicas fueron compatibles con la normalidad y la prueba de leucemia e inmunodeficiencia víricas felinas, negativa.
El motivo de la consulta cardiológica fue la detección, a las 24 horas, de un soplo sistólico 3/6 con PMI paraesternal. Teniendo en cuenta que el dolor se valoró como controlado, la tensión sanguínea dentro del rango normal, la analítica no mostraba alteraciones significativas y el paciente estaba normohidratado, se realizó una ecocardiografía. Esta mostró incremento del grosor diastólico tanto de la pared septal como de la pared libre del ventrículo izquierdo [6.5 y 6.8 mm (RR < 6)] (Figura 1). También, se valoró un engrosamiento focal de la parte proximal de la pared septal por la inserción de una cuerda tendinosa (DUST, por sus siglas en inglés). No se observó un incremento del tamaño del atrio izquierdo (Figura 2).Mediante Doppler, se apreció un movimiento sistólico anterior de la válvula mitral que provocaba una leve insuficiencia mitral, un movimiento anterior de la cuerda tendinosa (Figura 3) y una turbulencia e incremento de velocidad del flujo aórtico con una morfología de daga (Figura 4).
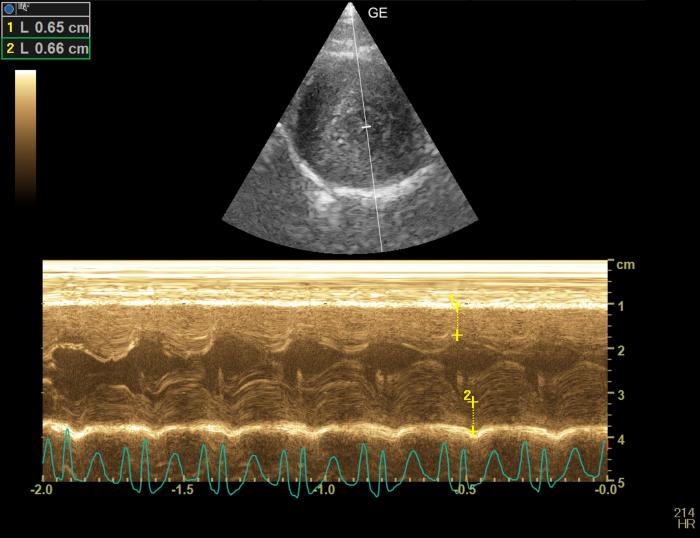
Figura 1. Ecocardiografía en Modo M . Corte paraesternal derecho, en eje corto, optimizado a nivel del ventrículo izquierdo. Medidas diastólicas de la pared del ventriculo izquierdo con incremento tanto del grosor de la pared libre como la del septo interventricular (RR < 6 mm).
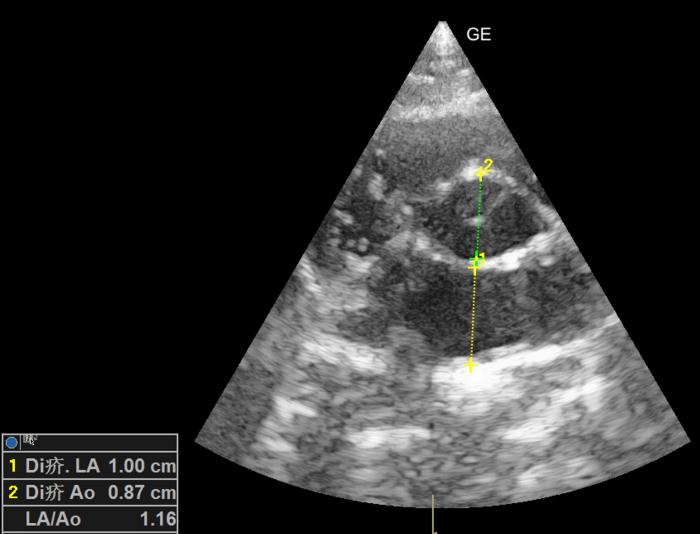
Figura 2. Corte paraesternal derecho en eje corto optimizado para valorar la ratio atrio izquierdo:aorta (Ai/Ao). No se aprecia dilatación del atrio izquierdo.
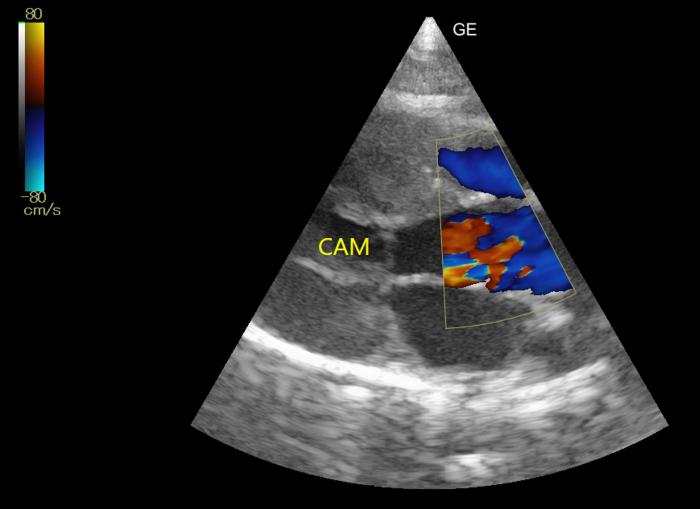
Figura 3. Corte paraesternal derecho, en eje largo, de cinco cámaras. Presencia de movimiento anterior sistólico de la cuerda tendinosa o CAM.
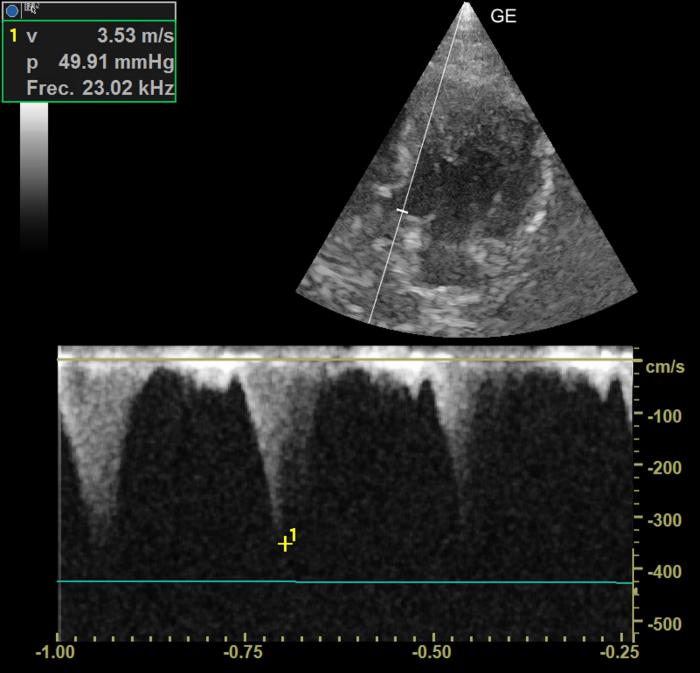
Figura 4. Registro de Doppler continuo a nivel del tracto de salida del ventrículo izquierdo. Morfología de daga e incremento de la velocidad de salida del flujo de eyección aórtico por obstrucción dinámica del tracto de salida del ventrículo izquierdo.
Se procedió a la medición de los niveles séricos de troponina I y se controló el tamaño atrial diariamente. Dado que el valor de troponina I fue de 15.67 ng/ml (RR < 0.06) y, pese que el tamaño atrial no se alteró, se decidió no intervenir quirúrgicamente al paciente y manejar la cojera con medicación. Se prescribió un control farmacológico multimodal del dolor mediante la combinación de un antiinflamatorio no esteroideo (meloxicam 0.05 mg/kg/24 h PO) y buprenorfina oral a dosis de 0.03 mg/kg/6 h PO y posteriormente cada 8 h, y reposo con estímulos ambientales para controlar los niveles de estrés. A las tres semanas, el grosor miocárdico y los niveles de troponinas se normalizaron (Figura 5).
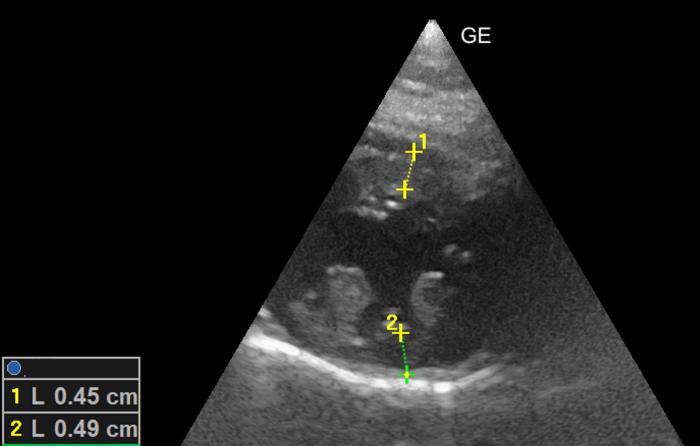
Figura 5. Corte paraesternal derecho, en eje corto, optimizado a nivel del ventrículo izquierdo. Valoración bidimensional del grosor diastólico con normalización de las medidas (RR < 6 mm).
Caso 2
Un gato macho castrado, de raza British blue, 5 años y 4.2 kg, fue atendido por taquipnea y disnea agudas. Su estilo de vida era estrictamente en el interior de un piso y se encontraba correctamente desparasitado y vacunado. En su historia clínica, destacaban cuadros leves y autolimitantes de colitis una o dos veces al año. De forma más reciente, presentó un cuadro de dermatitis facial pruriginosa que se resolvió mediante la aplicación, en otro centro veterinario, de dos inyecciones (acetato de metilprednisolona y cefovecina) hacía una semana. Además, durante las últimas 36 horas, el animal había estado solo en la vivienda familiar.
En el examen físico general, el animal se mostraba alerta, presentando una buena condición corporal, estaba normohidratado, normotenso (PAS > 100 mmHg) pero con la temperatura ligeramente baja (37.5 ºC RR > 38 ºC). Presentaba una taquipnea de 140 rpm, un patrón de disnea espiratoria con la boca abierta y se auscultaron crepitaciones en ambos hemitórax. Se aplicó una dosis de butorfanol y oxigenoterapia. Posteriormente, tras mejorar del patrón y frecuencia respiratoria, se realizó una ecografía torácica rápida:
- Pulmonar: exceso de líneas B.
- Cardíaca: dilatación atrial grave con sospecha de hipertrofia cardíaca.
Se procedió a la administración de furosemida a dosis de 2 mg/kg inicialmente y 1 mg/kg/h hasta obtener una disminución de la frecuencia respiratoria a 50-60 rpm. En ese momento, se redujo la frecuencia de administración a cada 4 horas. Paralelamente, se administró pimobendan a dosis de 0.2 mg/kg/12 h PO. En cuanto se consideró que el paciente estaba estable, se realizó una analítica sanguínea completa y se cursaron niveles séricos de troponina I en un laboratorio externo:
- Leucocitosis neutrofílica.
- Leve incremento de urea y glucosa.
- cTnI: 11.2 ng/ml (RR < 0.06).
A las 12 horas, aproximadamente, se realizó una ecocardiografía completa donde se apreciaron los siguientes hallazgos:
- Engrosamiento diastólico de la pared libre del ventrículo izquierdo (7.1) y pared septal (6.2) (RR < 6 mm) (Figura 6).
- Disminución del tamaño atrial respecto el día anterior [LAD 18 mm (RR < 16 mm) y Ai/Ao: 1.75 (RR: 1.6)] (Figura 7 y 8).
- Presencia de leve cantidad de líquido pleural y de líneas B (Figura 9).
- e/E, EA y IVRT compatibles con presiones de llenado altas.
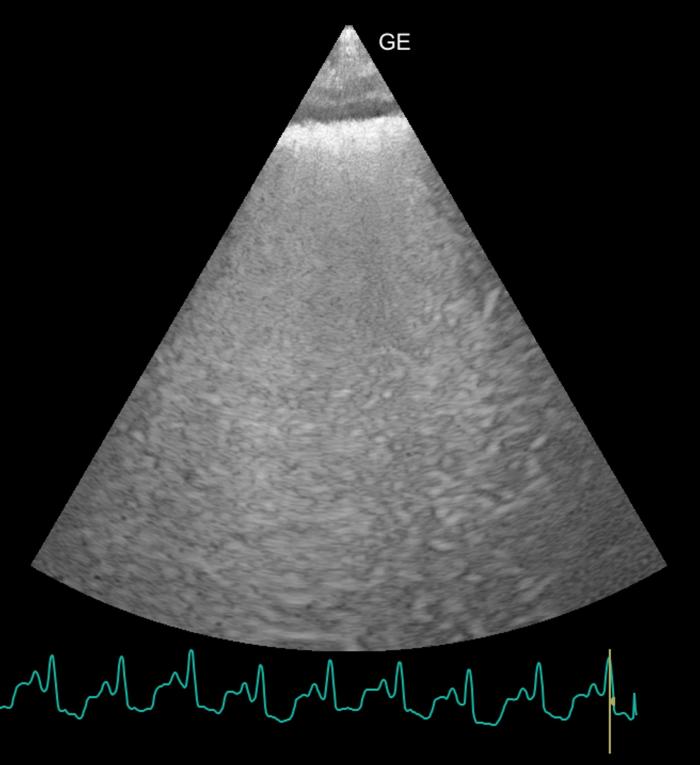
Figura 6. Ecografia transtorácica focalizada en los pulmones. Presencia de numerosas lineas B dando el aspecto conocido como pulmón blanco.
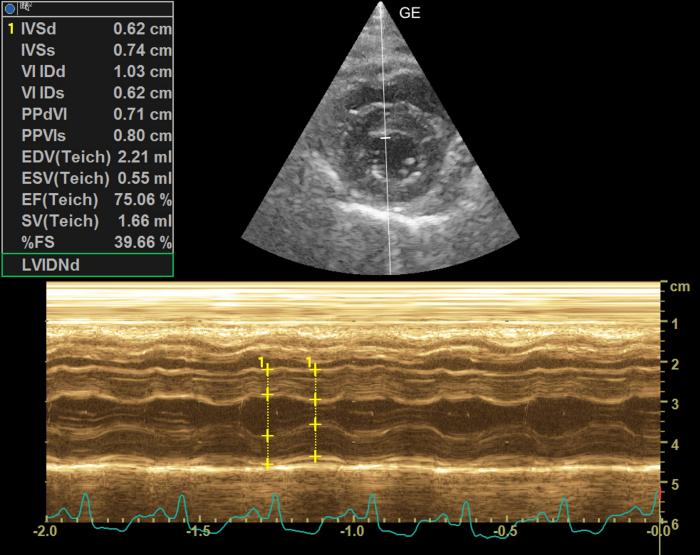
Figura 7. Modo M del corte transversal del ventriculo izquierdo. Medidas diastólicas del grosor de la pared del ventrículo izquierdo. Incremento tanto de la pared libre como la septal (RR < 6 mm).
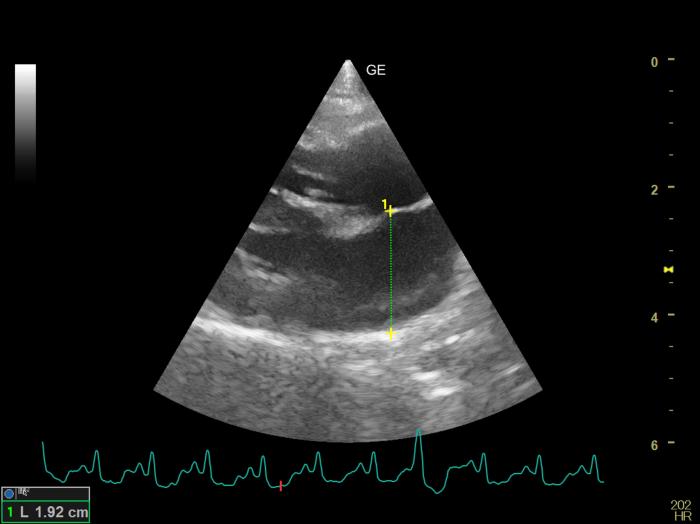
Figura 8. Corte paraesternal derecho en eje largo de 4 cámaras. Medida del diámetro del atrio izquierdo (LAD) en telesístole. Se observa una extrasístole ventricular en el 7º complejo del electrocardiograma.
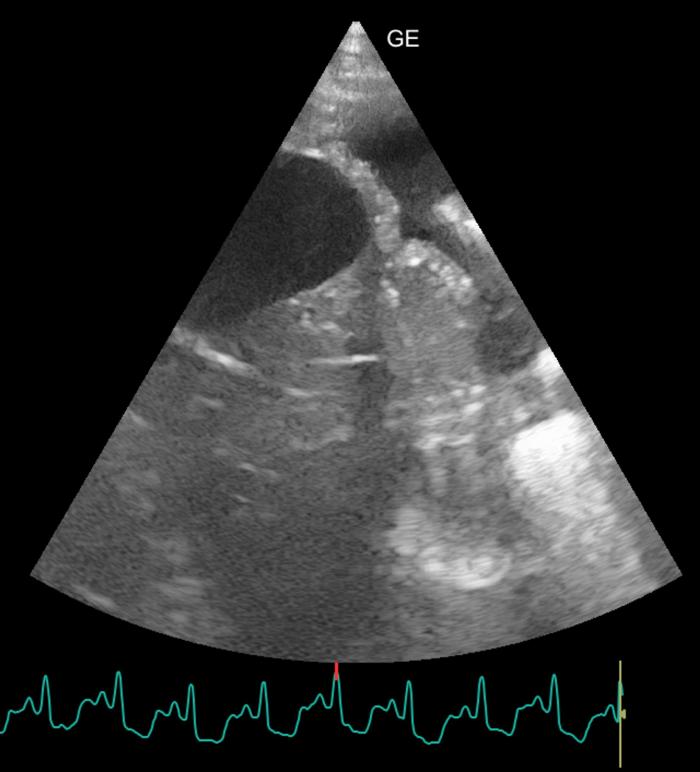
Figura 9. Presencia de derrame pleural durante la ecografía pulmonar.
Dado que la frecuencia respiratoria (monitorizada cada 2 horas) se mantuvo entre 40-43 rpm, se redujo la frecuencia de furosemida a cada 8 horas y se realizó un control analítico, el cual mostró una hipopotasemia moderada de 3.3 mEq/l (RR > 3.7), por lo que se añadió espironolactona (1 mg/kg/12 h) y gluconato de potasio (Kaminox 2 ml/12 h PO). Debido a que durante las siguientes horas no se normalizó la kalemia y el paciente mostraba hiporexia, se administró cloruro potásico mediante sueroterapia suplementada a una velocidad de infusión muy baja.
A las 72 horas, tras apreciarse una clara mejoría clínica y una normalización de las analíticas, se dio de alta recomendando la siguiente pauta de administración oral: furosemida 1 mg/kg/12 h, pimobendan 0.2 mg/kg/12 h y espironolactona (1 mg/kg/12 h). A la semana, se retiró toda medicación excepto la furosemida (0.5 mg/kg/12 h) dado el leve incremento del tamaño atrial (LAD 17 mm y AI/Ao: 1.65). Se realizó una visita de revisión al mes del alta. En esta, se detectó una normalización del grosor ventricular (pared libre del ventrículo izquierdo en diástole 5.5 (RR < 6 mm) y una mejoría significativa de la cTnI a 0.11 ng/dl (RR < 0.06) por lo que se decidió retirar la furosemida completamente. Durante los siguientes dos meses, se realizaron seguimientos telefónicos en los que los tutores no reportaron ningún signo clínico (Figura 10).
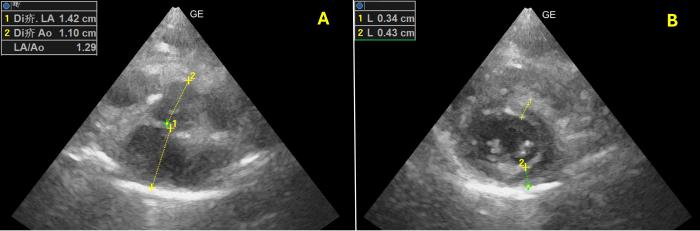
Figura 10. Ecocardiografía bidimensional. Corte paraesternal derecho en eje corto optimizado para la (A) aurícula izquierda y para el (B) ventrículo izquierdo. Normalización de las dimensiones tanto de la ratio Ai:Ao como del grosor del ventrículo izquierdo en telediástole.
Caso 3
Un gato macho castrado, raza British blue, de 2 años y 4.5 kg, fue atendido de urgencia por paraparesia no ambulatoria. En su historia clínica, destacaba el diagnóstico previo de un defecto del septo interventricular sin presencia de remodelación cardíaca cuando el animal tenía un año. Su estilo de vida era estrictamente en el interior de un piso, se encontraba correctamente desparasitado y vacunado. Durante los últimos 10 días, sus tutores se encontraban de viaje y el animal estaba solo en casa y un cuidador le alimentaba una vez al día.
En el examen físico, el animal se valoró como normotenso y normohidratado. No obstante, se apreció disminución de la temperatura rectal [37 ºC (RR > 38)], taquipnea (84 rpm) con auscultación de crepitaciones en ambos hemitórax, taquicardia (250 lpm), presencia de un soplo sistólico de 3/6 con PMI esternal y ritmo de galope. Neurológicamente, se identificó una paraparesia ambulatoria. En la valoración de las extremidades posteriores, no se detectaron pulsos femorales, pero sí leve rigidez de la musculatura gastrocnemia, un lecho ungueal liliáceo y los cojinetes más pálidos y fríos que en las extremidades anteriores. Se administró analgesia (buprenorfina 0.03 mg/kg IM), heparina fragmentada (100 UI/kg SC), diuresis (furosemida 2 mg/kg SC) y oxigenoterapia. Debido a una mejoría clínica parcial, al cabo de una hora, se realizó una ecografía rápida torácica donde se identificó:
- Pulmones: presencia excesiva de líneas B en varios campos pulmonares.
- Corazón: dilatación atrial severa (Figura 11).
- Engrosamiento severo de la pared del ventrículo izquierdo al final de la diástole (Figura 12).
- Presencia de movimiento anterior sistólico de la válvula mitral (Figura 13).
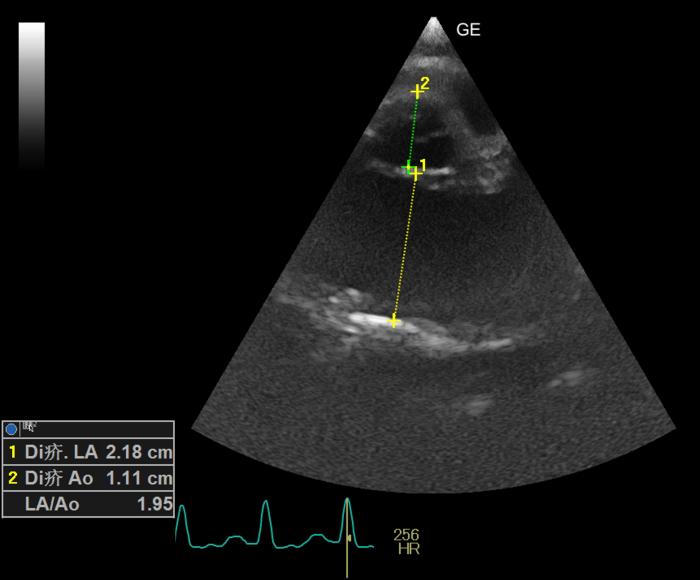
Figura 11. Corte paraesternal derecho, en eje corto, optimizado a nivel de aurícula izquierda. Ratio AI:Ao incrementado severamente (RR < 1.6).
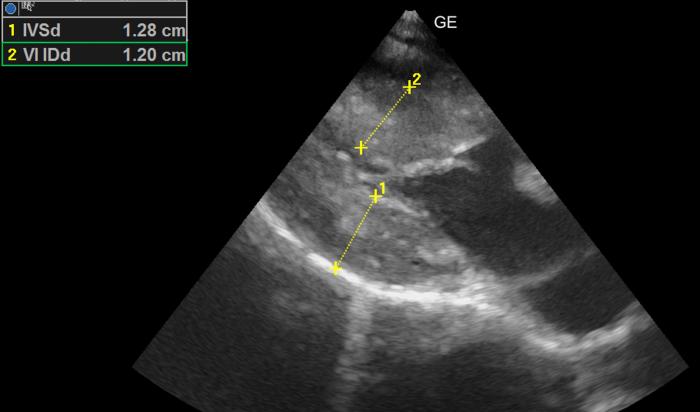
Figura 12. Corte paraesternal derecho, en eje largo, de 4 cámaras. Grosor diastólico aumentado severamente (RR < 6 mm).
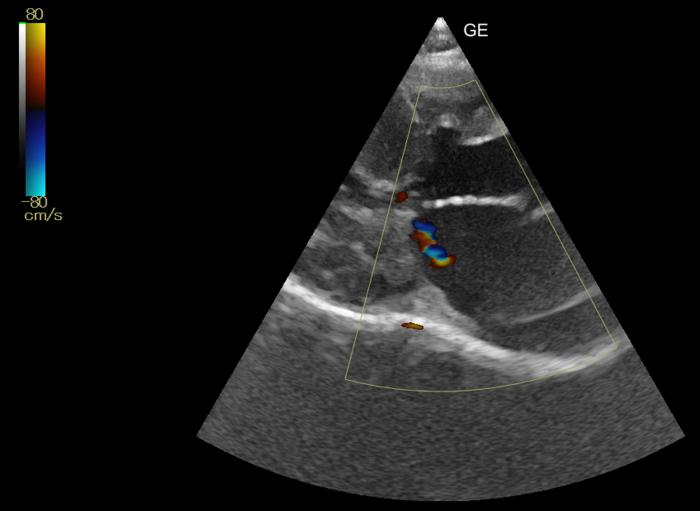
Figura 13. Corte paraesternal derecho en eje largo de 5 cámaras. Insuficiencia en la válvula mitral de poco volumen, asociada a movimiento sistólico anterior de la válvula mitral.
Los niveles séricos de lactato de las extremidades posteriores (8 ng/dl) eran significativamente más elevados que el valor sistémico (2.4 ng/dl) al igual que la glicemia media posterior (65 ng/ml) era inferior a la sistémica (310 ng/dl).
Se estableció un diagnóstico presuntivo de edema pulmonar cardiogénico y tromboembolismo aórtico secundarios a una cardiomiopatía de fenotipo hipertrófico. Se informó a los tutores que, dentro de los diferenciales de dicha hipertrofia, se incluían: cardiomiopatía hipertrófica, miocarditis/EMT, coexistencia del defecto ventricular con otra patología cardíaca no diagnosticada previamente (p. ej.: estenosis mitral o (sub)aórtica) o infiltración miocárdica neoplásica. Las enfermedades hormonales, la hipertensión y la pseudohipertrofia por deshidratación se consideraron poco probables por la edad y la historia clínica del paciente. A la analítica general (hemograma, bioquímica general y electrolitos con resultados dentro de rango (excepto la hiperglicemia y hiperlactemia), se añadieron: la prueba de inmunodeficiencia y leucemia (negativos) y el valor de cTnI [23 ng/dl (RR < 0.06)].
Se continuó el tratamiento mediante clopidogrel (inicialmente 75 mg y, luego, 18.75 mg orales diarios), heparina fragmentada (dalteparina sódica2500 UI/0.2 ml: 100 U/kg/12 h SC), buprenorfina (0.03 mg/kg/6 h SC), pimobendan (0.2 mg/kg/12 h PO). En cuanto a la diuresis, después del bolo inicial se repitieron dos bolos de 1 mg/kg separados de 4 horas y luego, dada la mejoría en frecuencia y calidad respiratoria, se pautó 1 mg/kg/6 h.
A las 24 horas del ingreso, se realizan controles de peso (pérdida de 300 gramos), radiológico (no evidencias de cambios pulmonares o congestión venosa) y de valores renales y electrolíticos [ligera azotemia (creatinina 2 (RR < 1.9) e hipopotasemia 3.3 mEq/L (RR > 3.6)] por lo que se disminuyó la frecuencia a cada 8 horas y se añadió Kaminox y espironolactona (1 mg/kg/12 h) al tratamiento. Dada la mejoría en el dolor, se redujo la buprenorfina a cada 8 horas. Ecográficamente, se observó la presencia de un tromboembolismo en aurícula izquierda (Figura 14). Se confirmó la presencia de un defecto del septo interventricular y se descartaron patologías estenóticas del tracto de salida del ventrículo izquierdo (flujo transmitral y aórtico dentro del rango de la normalidad) (Figura 15). Se identificó una pequeña insuficiencia mitral debido al movimiento sistólico anterior de dicha válvula.
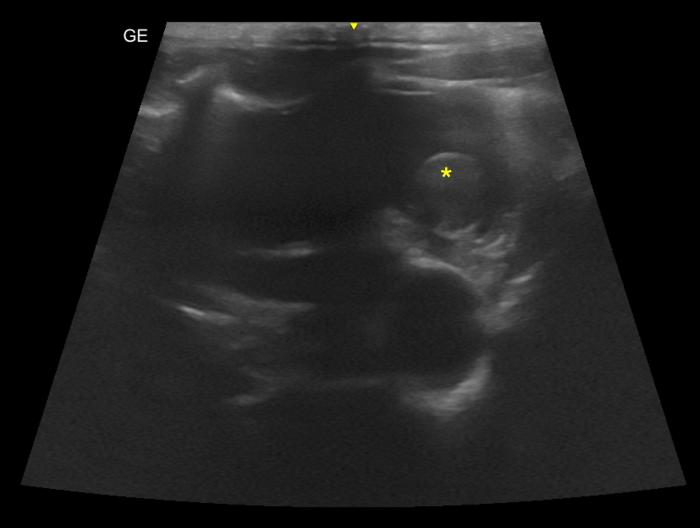
Figura 14. Corte paraesternal izquierdo craneal optimizado para la visualización de la aurícula izquierda. Se observa tanto señal de humo como la presencia de un tromboémbolo.
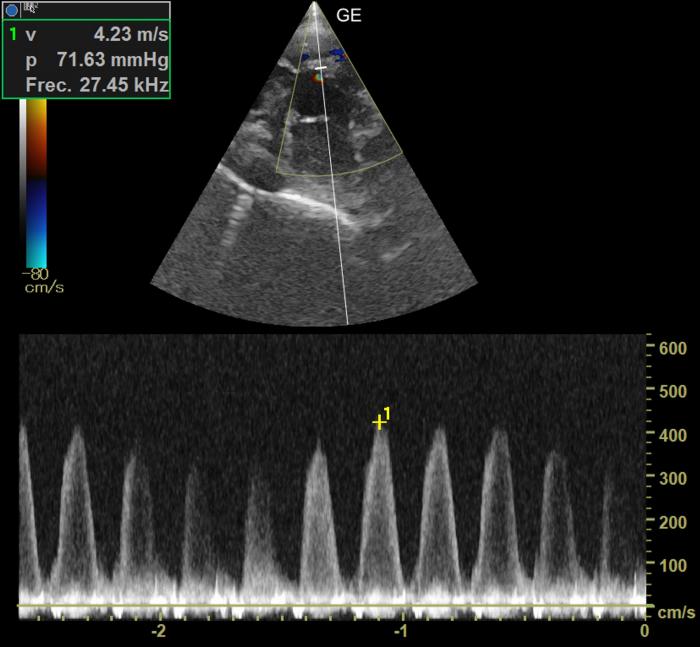
Figura 15. Corte paraesternal derecho en eje corto optimizado para la visualización del defecto del septo ventricular. Doppler continuo del flujo izquierda -derecha en el defecto del septo ventricular.
A las 72 horas se dio de alta con rivaroxabán (0.5mg/kg/24 h), clopidogrel (18.75 mg/24 h), pimobendan (0.2 mg/kg/12 h), espironolactona (1 mg/kg/24 h) y benazepril (0.3 mg/kg/24 h).
A los pocos días, el animal se presentó con signos de paraparesia no ambulatoria y shock cardiogénico de bajo gasto y los tutores decidieron la eutanasia humanitaria.
Discusión
La cardiomiopatía hipertrófica es la enfermedad miocárdica del gato más común con una prevalencia del alrededor del 15 % de los gatos1-3. De estos gatos, aproximadamente, un tercio muestran signos clínicos de tipo cardíaco y su pronóstico es, generalmente, malo3-5. De aquí el interés por sacar a la luz un grupo de gatos, cuyo fenotipo ecocardiográfico es similar, pero con un pronóstico aparentemente mejor. En 2018, Matos et al. y posteriormente Romito et al. en 2023, realizaron una búsqueda bibliográfica de felinos jóvenes con signos clínicos de insuficiencia cardíaca congestiva con características similares:
- Edad joven.
- Evento previo.
- Cambios ecográficos iniciales compatibles con un fenotipo hipertrófico.
- Troponinas significativamente elevadas.
- Resolución de los cambios ecográficos y normalización (o mejoría) de los niveles de troponinas.
Mucho antes, en el 2004, Smith et al, describieron una serie de 12 gatos con engrosamiento transitorio y fallo congestivo secundarios a la administración de corticoesteroides. A diferencia de los felinos con EMT, estos tenían una media de edad mayor y no se dispone de los valores de troponina de dichos gatos. En algunos, se sospechó una patología miocárdica previa debido a la existencia de cambios ecográficos durante el seguimiento. En relación con estos gatos, Matos et al. destacaron dos datos interesantes. Primeramente, apuntan que el motivo de la administración de corticosteroides en estos pacientes podría ser considerado un evento predisponente similar a sus gatos con EMT. Y, segundo, que los casos con CMH e ICC secundaria a la administración de corticosteroides podrían tener mejor pronóstico que los gatos con ICC y CMH sin dicha administración farmacológica.
La fisiopatología del EMT no se comprende con exactitud, pero se ha establecido una similitud con respecto al edema miocárdico que ocurre en humanos en casos de miocarditis donde también se produce engrosamiento transitorio del miocardio6,7. En veterinaria, se han postulado causas o eventos antecedentes tanto infecciosos (por ejemplo, virus de la inmunodeficiencia felina, bartonelosis y toxoplasmosis o sepsis) como no infecciosos (anestesia o cirugías previas)8-14. Los tres casos aquí presentados, comparten características con aquellos descritos en la bibliografía, pero con ciertas particularidades que nos gustaría discutir.
En el primer caso, se trata de un animal sin síntomas de insuficiencia cardíaca. Si bien el 100 % de los felinos descritos en Matos et al. presentaban signos cardíacos, Romito et al. ya describieron que en 2 de los 27, no presentaban dicha sintomatología. No obstante, la presencia de un soplo sistólico, como en nuestro caso, se ha reportado en el 33-37 % de los animales en dichos estudios.
Teniendo en cuenta que las anestesias y cirugías se han incluido como antecedentes en casos de EMT, y que el paciente presentaba elevación de troponinas y engrosamiento miocárdico en fase final diastólica, se optó por no proceder a la operación traumatológica. En cuanto a los diagnósticos diferenciales más allá del EMT, se estableció el traumatismo torácico (y miocárdico) directo con o sin una enfermedad miocárdica preexistente. No obstante, teniendo en cuenta la corta edad del animal y la falta de evidencias de la implicación torácica (radiografías torácicas y electrocardiograma), se consideró como menos probable.
Cuando comparamos el segundo caso con los 12 casos descritos por Smith et al, de felinos que presentaron ICC secundariamente a la administración de esteroides, lo primero que nos llama la atención es su edad. En su estudio, solamente 3 de los animales eran menores de 6 años. De estos, dos recibieron acetato de metilprednisolona por sospecha de dermatitis alérgica como en nuestro paciente. La segunda particularidad de nuestro caso es la disposición de los niveles de troponinas, los cuales apuntan a un daño miocárdico agudo. Una explicación a este hallazgo podría ser un evento previo traumático durante las 36 horas que el animal quedó solo en la vivienda (o el estrés causado por este hecho). Otra explicación que apuntan tanto Matos et al. como Romito et al., son las reacciones de sensibilidad farmacológica descritas en la bibliografía humana. En nuestra especie, la resonancia magnética cardíaca, pero sobre todo la biopsia miocárdica, resulta de gran utilidad para determinar y describir mejor la fisiopatología en estos casos.
Finalmente, nuestro tercer paciente parece, a priori, un caso clásico de un animal con alta carga genética de predisposición a CMH con diferentes signos asociados a un mal pronóstico3-5:
- Incremento del tamaño del atrio izquierdo y su disfunción sistólica.
- Engrosamiento extremo del ventrículo izquierdo (grosor > 9 mm).
- Presencia de signos clínicos típicos de insuficiencia cardíaca congestiva (ICC).
- Tromboembolismo arterial (TEA).
- Disfunción sistólica del ventrículo izquierdo y presencia de zonas hipoquinéticas.
- Incremento de la troponina I circulante (> 0.7 ng/dl).
Tras haber fallecido el paciente se recibieron los resultados de los niveles de cTnI, los cuales se situaban en 23 ng/ml, un valor muy elevado, que refuerza la sospecha de EMT. Según la bibliografía veterinaria, se has descrito niveles de cTNI elevadas en otros casos. Hertzch et al y Herndon et al, con troponinas más elevadas en casos de coexistencia de CMH y tromboemboslismo arterial17,18 (Hertzsc: media de 6.4 y un máximo de 11; y Herndon dos casos de 2.98 y 109 ng/ml). Pelander et al, durante una evaluación de las cTNI en felinos críticos, describieron valores superiores en gatos con alteraciones cardíacas estructurales, independientemente del motivo de ingreso, sugiriendo una mayor susceptibilidad a la lesión miocárdica en casos de patología preexistente19. Además, según las referencias bibliográficas reportadas acerca de EMT, Romito et al excluyeron los animales con tromboembolismo arterialy Matos et al, solamente describieron tromboembolismo aórtico en los casos de CMH y no en los de EMT4; finalmente Vollmar et al describen un caso de EMT con tromboembolismo aórtico con niveles de troponinas solamente en 2.28ng/ml (RR < 0.04 ng/ml)15. En consecuencia, se genera la siguiente pregunta: ¿por qué podríamos obtener valores tan elevados de troponinas en casos de fenotipo hipertrófico que no fuera EMT y tromboembolismo aórtico? Una explicación seria la sospecha de una reacción cruzada de la isoforma de troponina cardíaca I con la isoforma de troponina musculoesquelética descrita en la bibliografía humana20. Otra explicación sería la coexistencia con un tromboembolismo coronario, afectando la irrigación miocárdica directamente. Finalmente, fijándonos en la medicina humana, en casos de embolismo pulmonar agudo y por el efecto sobre el corazón derecho, se produce una elevación de cTNI que, además, es usada como factor pronóstico21,22. Teniendo en cuenta que nuestro paciente presenta un tromboembolismo en la aorta abdominal, una trombosis en aurícula izquierda y distrés respiratorio, estos serían claros diferenciales junto con el EMT.
No obstante, si este paciente sufría realmente de EMT, nos hace cuestionar si los indicadores de mal pronóstico en casos de CMH podrían ser aplicables en casos de EMT que, generalmente, suelen ir asociados a un muy buen pronóstico, aunque no dejan de ser animales con una disfunción sistólica y diastólica periagudas. Si esta afirmación es aceptada, es posible que existan algunos casos de felinos jóvenes con mortalidad asociada a CMH que en realidad sean casos graves de EMT.
Conclusiones
La CMH es una entidad clínica asociada a un mal pronóstico en los casos donde los felinos ya presentan sintomatología clínica. Es de vital importancia realizar un diferencial con el EMT y otras patologías que se presentan con fenotipo hipertrófico que se asocian a un mejor pronóstico. Esto es especialmente relevante cuando se trata de animales jóvenes con un evento previo detonante y troponinas elevadas. Estos animales se pueden diagnosticar una vez presentados los signos clínicos de fallo cardíaco (ICC o tromboembolismo aórtico), pero también se debería tener en cuenta esos gatos que presentan o desarrollan cambios en el examen físico siendo el soplo uno de los más frecuentes.
Sería interesante, en el futuro, el estudio del comportamiento de la cTNI en casos de tromboembolismo arterial felino con o sin cardiomiopatía asociada.
Paralelamente y pensando en nuestro tercer caso, sería interesante buscar si, en los casos más graves de EMT, podrían usarse los indicadores de mal pronóstico propios de la CMH.
Bibliografía
- Paige CE, Abbott JA, Elvinger F, et al.; Prevalence of cardiomyopathy in apparently healthy cats; J Am Vet Med Assoc 2009; 234:1398–403.
- Payne JR, Brodbelt DC, Luis Fuentes V; Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study); J Vet Cardiol; 2015;17:244–57.
- Jose Novo Matos, Jessie Rose Payn; Predicting Development of Hypertrophic Cardiomyopathy and Disease Outcomes in Cats; Veterinary Clinics of North America: Small Animal Practice; 2023; Vol 53;6: 1277-1292.
- Payne JR, Borgeat K, Connolly DJ, Boswood A, Dennis S, Wagner T, Menaut P, Maerz I, Evans D, Simons VE, Brodbelt DC, Luis Fuentes V; Prognostic indicators in cats with hypertrophic cardiomyopathy; J Vet Intern Med; 2013; 27:1427-1436.
- Borgeat K, Sherwood K, Payne JR, Payne JR, Luis Fuentes V, Connolly DJ. Plasma cardiac troponin I concentration and cardiac death in cats with hypertrophic cardiomyopathy. J Vet Intern Med. 2014;28:1731–1737.
- J.NovoMatos, N.Pereira,T.Glaus,L.Wilkie,K.Borgeat,J.Loureiro, J.Silva,V.Law,A.Kranjc,D.J.Connolly,V.Luis Fuentes ; Transient myocardial thickening in cats associated with heart failure; J Vet Intern Med; 20187; 32:48-56.
- Romito G, Elmi A, Guglielmini C et al.; Transient myocardial thickening: a retrospective analysis on etiological, clinical, laboratory, therapeutic, and outcome findings in 27 cats;J Vet Cardiol; 2023;50, 51-62.
- V.M.Rolim,R.A.Casagrande,A.T.B.Wouters,D.Driemeier,S.P.Pavarini; Myocarditis caused by feline immunodeficiency virus in five cats with hypertrophic cardiomyopathy; J Comp Path; 2016;154:3-8
- K.E.Simpson,B.C.Devine,D.Gunn-Moore; Suspected toxoplasma-associated myocarditis in a cat; J Feline Med Surg; 2005; 7:203-208.
- A.Matsuu,T.Kanda,A.Sugiyama,T.Murase,Y.Hikasa; Mitral stenosis with bacterial myocarditis in a cat; J Vet Med Sci,2007; 69:1171-1174.
- J.L.Joseph,E.M.Oxford,R.A.Santilli; Transient myocardial thickening in aBartonella henselae-positive cat; J Vet Cardiol; 2018; 20:198-203.
- M.A.Ernandes,A.M.Cantoni,F.Armando,A.Corradi,L.Ressel,A.Tambori; Feline coronavirus-associated myocarditis in a domestic longhair cat. JFMS Open Rep; 2019; 5.
- G.Romito,F.Fracassi,M.Cipone; Transient myocardial thickening associated with acute myocardial injury and congestive heart failure in twoToxoplasma gondii-positive cats; JFMS Open Rep; 2022; 8.
- A.N.Sharpe,C.T.Gunther-Harrington,S.E.Epstein,R.H.L.Li,J.A.Stern; Cats with thermal burn injuries from California wildfires show echocardiographic evidence of myocardial thickening and intracardiac thrombi; Sci Rep; 2020;10(1):2648
- Vollmar C, Mitropoulou A, Hassdenteufel E, Hildebrandt N, Schneider M; Arterial thromboembolism in a cat with transient myocardial thickening. J Vet Cardiol; 2024; 52:14-18.
- S.A.Smith,A.H.Tobias,D.M.Fine,K.A.Jacob,T.Ployngam; Corticosteroid-associated congestive heart failure in 12 cats; Intern J Appl Res Vet Med,; 2004; 2:159-170
- Hertzsch S, Roos A, Wess G; Evaluation of a sensitive cardiac troponin I assay as a screening test for the diagnosis of hypertrophic cardiomyopathy in cats. J Vet Intern Med; 2019;33:1242-1250.
- Herndon WE, Kittleson MD, Sanderson K, Drobatz KJ, Clifford CA, Gelzer A, Summerfield NJ, Linde A, Sleeper MM; Cardiac troponin I in feline hypertrophic cardiomyopathy. J Vet Intern Med. 2002 Sep-Oct;16(5):558-64.
- Pelander L, Bach MBT, Ljungvall I, Willesen JL, Koch J, Dreimanis K, Telling A, Damsgard RM, Ohlsson Å, Häggström J, Langhorn R; Evaluation of cardiac troponin I as a predictor of death in critically ill cats; J Vet Intern Med. 2023 Mar;37(2):403-411.
- Chaulin AM; False-Positive Causes in Serum Cardiac Troponin Levels; J Clin Med Res; 2022 Feb;14(2):80-87.
- El-Menyar, A., Asim, M., Nabir, S., Ahmed, M., Al-Thani, H; Implications of elevated cardiac troponin in patients presenting with acute pulmonary embolism: an observational study; Journal of Thoracic Disease; 2019; 11,8
- Kim SJ, Kim MH, Lee KM, Kim TH, Choi SY, Son MK, Park JW, Serebruany; VL. Troponin I and D-Dimer for Discriminating Acute Pulmonary Thromboembolism from Myocardial Infarction; Cardiology; 2017;136(4):222-227
 by Multimédica
by Multimédica
