Tromboembolismo aórtico felino no-cardiogénico
Resumen breve
El tromboembolismo aórtico felino (TAF) representa una situación de urgencia médica potencialmente mortal. Un émbolo viaja desde el sitio de origen hasta una arteria, a la que puede obstruir total o parcialmente, afectando la circulación sanguínea directa e indirectamente mediante la vasoconstricción de los vasos colaterales1.Índice de contenidos

Introducción
El tromboembolismo aórtico felino (TAF) representa una situación de urgencia médica potencialmente mortal. Un émbolo viaja desde el sitio de origen hasta una arteria, a la que puede obstruir total o parcialmente, afectando la circulación sanguínea directa e indirectamente mediante la vasoconstricción de los vasos colaterales1.
Las cardiomiopatías felinas y, particularmente, el fenotipo de cardiomiopatía hipertrófica, se encuentran sobrerrepresentadas como enfermedades predisponentes. Raramente, como en el caso que nos ocupa, el origen del TAF no es cardíaco. Éste puede ser de etiología neoplásica, hormonal o deberse a situaciones inflamatorias o infecciosas a nivel sistémico e incluso, en algunas ocasiones, puede no encontrarse ninguna causa aparente (idiopáticos). 1,2,3,4
Los signos clínicos más evidentes son la paresis o parálisis de las extremidades afectadas y la manifestación de un dolor intenso. Además, se puede observar: rigidez muscular, cojinetes pálidos o cianóticos, pulso débil o ausente, taquipnea e hipotermia1,2,6,8.
El pronóstico suele ser de reservado a grave dependiendo de la enfermedad subyacente. Los objetivos terapéuticos serán el control del dolor, la prevención de la formación de nuevos tromboémbolos y la facilitación de la reperfusión, controlando las potenciales complicaciones de la misma1,2,6,8,12,2,13.
Caso clínico
Un gato macho, de vida indoor, raza común europeo y de 7 años de edad, fue atendido de urgencia en el Hospital Veterinari Costa Brava debido a una paraparesia no ambulatoria de aparición aguda. El animal había sido adoptado de una colonia a los 8 meses de edad y había seguido una correcta pauta vacunal y de desparasitación. En su historia clínica, destacaban dos episodios similares pero autolimitantes. El primero, ocurrió unos 4 meses antes, afectó a una sola extremidad y evolucionó favorablemente a lo largo de 3-4 días. El último, ocurrió unos días antes. En dicho episodio, los propietarios acudieron a otro centro veterinario, pero el animal no presentaba signos evidentes en el momento de la consulta, siendo diagnosticado de osteoartrosis una vez realizado un estudio radiológico. Recibía condroprotectores desde entonces.
En el examen físico, el paciente evidenciaba una buena condición corporal, con un peso de 5,6 kg y un buen grado de hidratación. No obstante, se mostraba agitado, vocalizaba más de lo normal, presentaba taquipnea (60 respiraciones por minuto (rpm); rango de referencia (RR): 20-40 rpm) y taquicardia (230 latidos por minuto (lpm); RR: 160-200 lpm). Las mucosas estaban levemente pálidas pero con un tiempo de llenado capilar normal.
Presentaba hipotermia de 35,5ºC (RR <38ºC) y su presión arterial sistólica era de 102 mmHg (RR 100-150 mmHg). Al examinar el tercio posterior, las extremidades se percibieron frías y dolorosas al tacto, presentando rigidez de los músculos gastrocnemio y tibial craneal. Los pulsos femorales eran imperceptibles en ambas extremidades traseras. Los cojinetes plantares y la vasculatura ungueal eran de coloración liliácea en comparación con las extremidades anteriores (Figura 1 y 2). Presentaba, además, déficit propioceptivo con una disminución de los reflejos en ambas extremidades posteriores (neurona motora inferior).
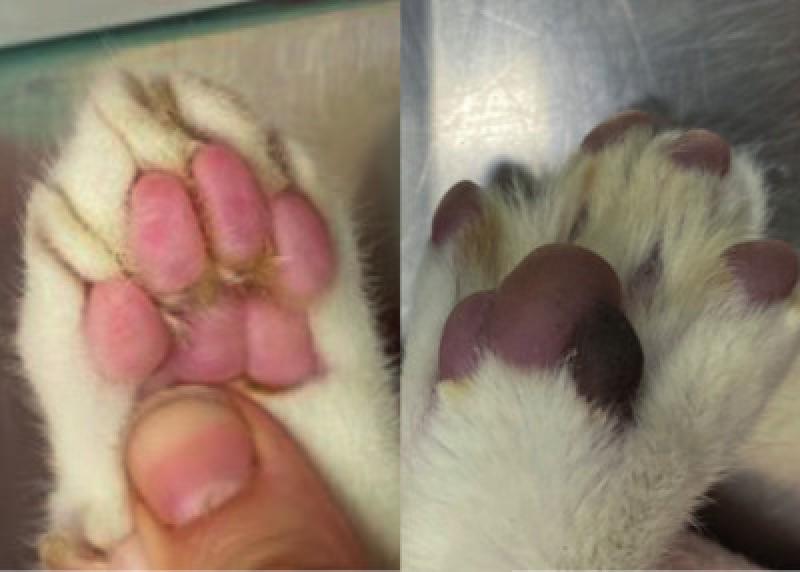
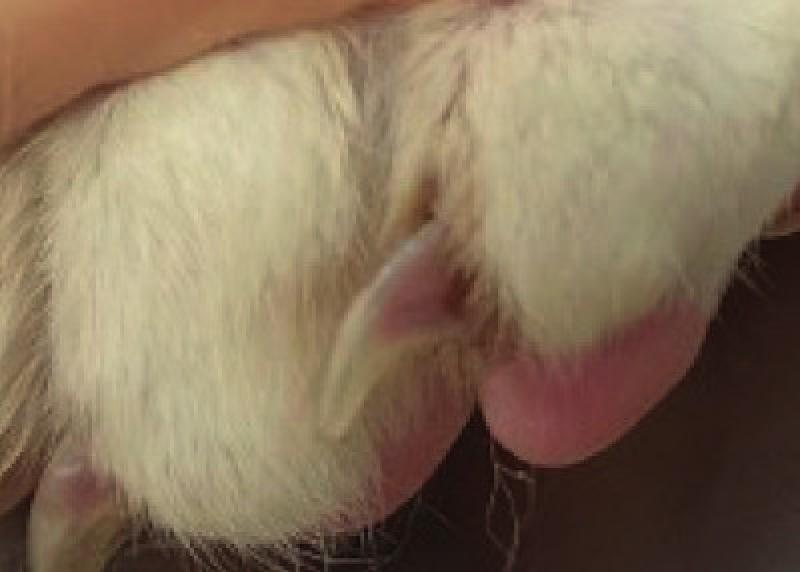
Desde el punto de vista analítico, tanto el hemograma como el panel bioquímico general y los electrolitos se encontraron dentro del intervalo de normalidad. Se realizó el test de leucemia e inmunodeficiencia víricas felinas siendo ambos negativos. Los niveles de T4 eran normales; 1,4 (RR Idexx©1-4,7 µg/dL).
Seguidamente, se procedió a comparar los niveles de lactato y glucosa sistémicos con los de las extremidades afectadas, confirmando un problema de perfusión en estas (Tabla 1).
| Tabla 1. Comparación de los niveles de lactato y glucosa de las extremidades afectadas. |
| Parámetro | Extremidad posterior derecha | Extremidad posterior izquierda | Sistémico |
| Lactato (mmol/L) | 9,5 | 10,5 | 2,7 |
| Glucosa (mg/dL) | 65 | 57 | 154 |
Se estableció un diagnóstico presuntivo de tromboembolismo aórtico felino en ausencia de una enfermedad cardíaca coexistente. El pronóstico se determinó como de reservado a malo debido a la presencia de hipotermia1.
Se procedió a su ingreso para la monitorización intensiva de las constantes vitales, la presión arterial y el electrocardiograma. Para el control del dolor, se le administró fentanilo. Primeramente, en bolo de 2,5 g/kg administrado por vía intravenosa y, posteriormente, en CRI (dosis: 5 µg/kg/h). A continuación, se instauró una terapia combinada con dalteparina, una heparina de bajo peso molecular (Fragmin© 2500UI/0,2ml: 75 UI/kg subcutáneo cada 6h) y clopidogrel (Plavix© 18,75mg/gato oralmente cada 24h, excepto la primera dosis, que fue del doble). Como fluidoterapia, se eligió una solución isotónica electrolíticamente balanceada (Isofundin®), suplementada con 20 mEq/L de cloruro potásico a velocidad de infusión de mantenimiento. Se ofreció al animal un ambiente rico en oxígeno y con la temperatura controlada.
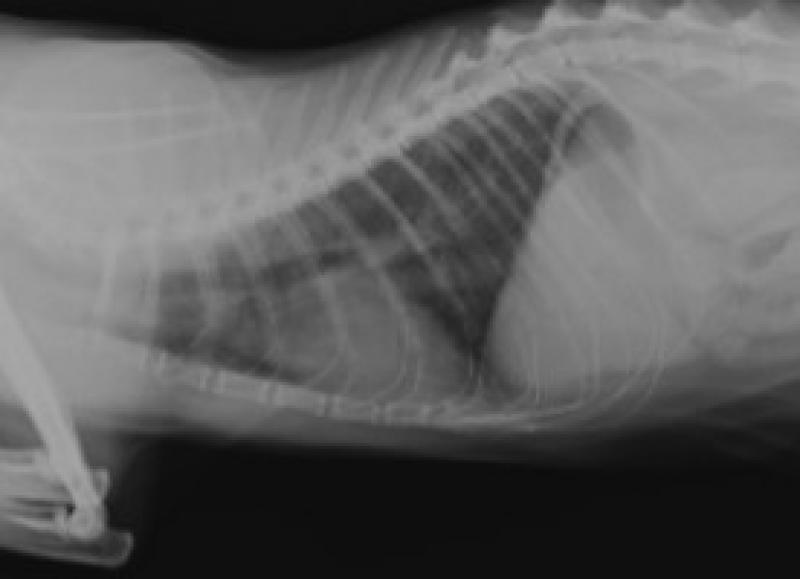
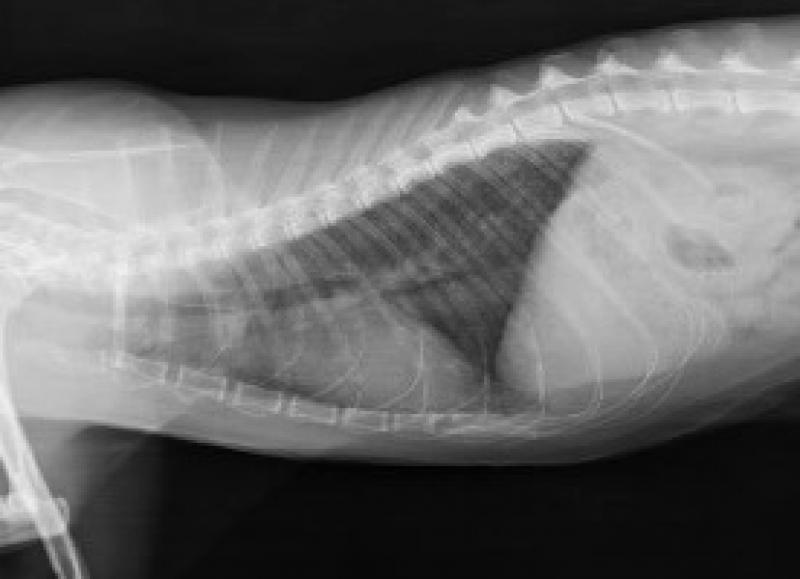
Una vez estabilizado el paciente, se realizaron pruebas de imagen. En la proyección laterolateral derecha de las radiografías obtenidas, se identificó un patrón broncointersticial generalizado, siendo este más acusado a nivel caudo-dorsal (Figura 3). Además, se observó un cayado aórtico prominente. La proyección ventrodorsal mostraba una afectación simétrica de los lóbulos pulmonares (Figura 4). Se estableció un diagnóstico diferencial de enfermedad inflamatoria-infecciosa (parasitaria, vírica o bacteriana), neoplásica, vascular/tromboembólica y, menos probable, congestiva o degenerativa.
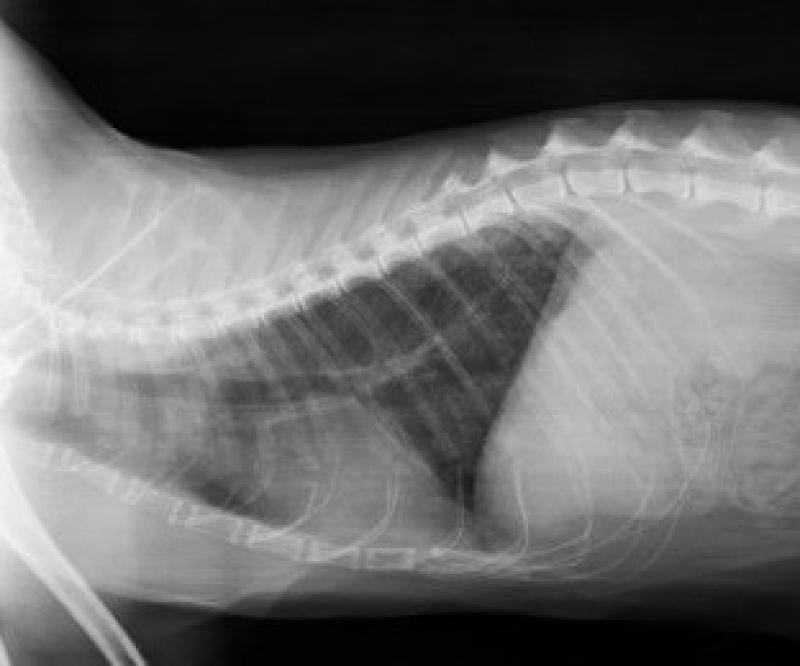
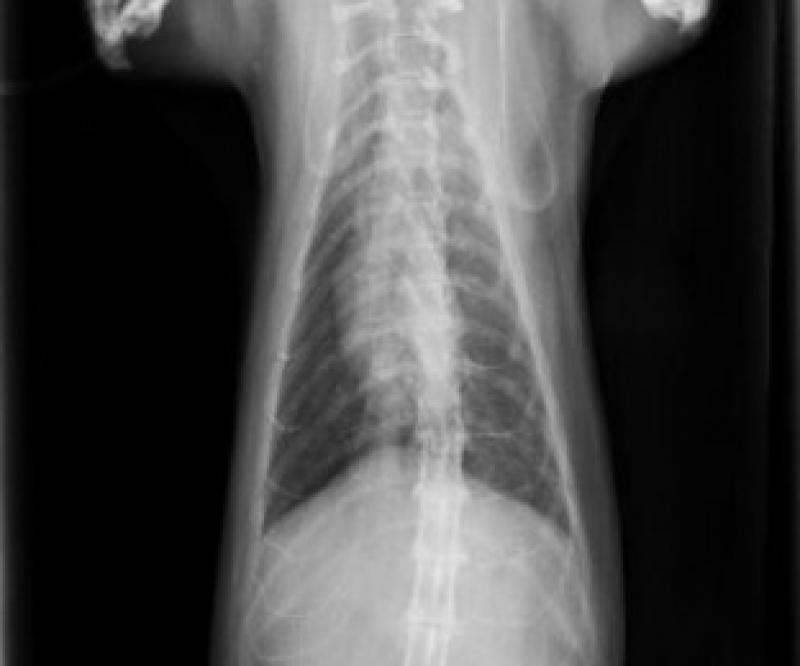
Por otro lado, durante la ecografía abdominal, se observó una alteración en la arquitectura normal de la pared del intestino delgado, compatible con un proceso inflamatorio erosivo, neoplásico o isquémico como causas más probables (Figura 5). Dicho proceso estaba asociado a una reacción peritoneal focal. También se identificó la presencia de una lesión hiperecogénica en la bifurcación aórtica compatible con un tromboémbolo, hecho que confirmó el diagnostico presuntivo (Figura 6).
Posteriormente, la ecocardiografía transtorácica no reveló ningún cambio significativo. Pese a la posible alteración en la proyección radiográfica de la aorta, no se identificaron cambios en esta durante el estudio ecográfico.
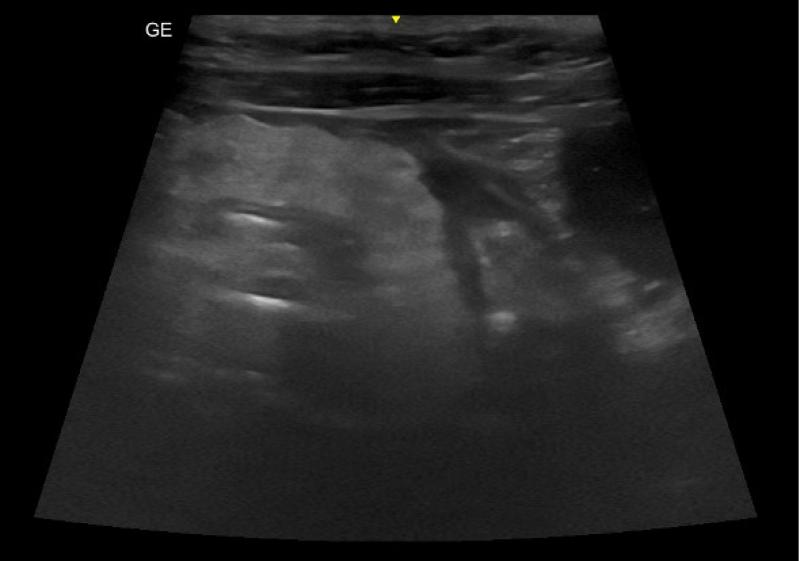
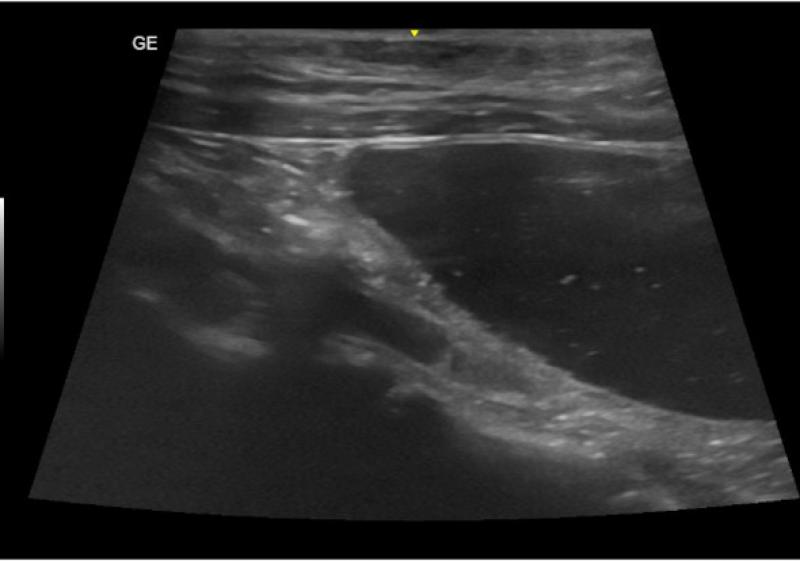
A las 12 horas del ingreso, la paraparesia no ambulatoria había evolucionado a ambulatoria y los valores de lactato de las extremidades fueron de 3 mmol/L (EPD) y 4,1 mmol/L (EPI) . La coloración de los cojinetes se percibía más rosada pero la ungueal, era aún cianótica. Dichas alteraciones, incluidos los niveles de lactato de las extremidades, se normalizaron a las 48 horas del ingreso. Los niveles de potasio, rigurosa y regularmente evaluados, estuvieron siempre dentro del rango de normalidad. Debido a la mejoría del dolor, se valoró bajar paulatinamente la dosis de fentanilo y, finalmente, sustituirla por buprenorfina.
Pese a no presentar signos respiratorios en el momento de la hospitalización, ni, según los propietarios, en ninguna etapa previa de su vida, se tuvo en cuenta el patrón pulmonar. Paralelamente al tratamiento establecido, se descartó la presencia de antígenos de Dirofilaria spp. (Idexx laboratorios) y de parásitos pulmonares mediante la técnica de Baerman en heces. Aun así, se le aplicó tópicamente la combinación de fipronil, metopreno, eprinomectina y praziquantel (Broadline©)5 y oralmente, fenbendazol (Panacur© 50mg/kg cada 24 horas durante 10 días.
En el momento del alta (96 horas post-ingreso), el animal presentaba monoparesia ambulatoria de la extremidad posterior izquierda con molestias a la palpación muscular pero sin cambios de coloración de los cojinetes ni de la vasculatura ungueal.
Pese a no identificar una causa concreta de la formación del tromboémbolo y en ausencia de un problema cardíaco subyacente, debido a la preexistencia de episodios similares, se pronosticó un riesgo real de recurrencia. Consecuentemente, se recomendó un tratamiento preventivo con clopidogrel 18,75 mg totales SID y rivaroxaban. Debido al coste económico de este último, los propietarios prefirieron inyectar heparina 70 UI/kg por vía subcutánea inicialmente cada 12 horas durante 7 días y una vez al día durante otra semana. Debido a la presencia de molestias residuales, se administró también buprenorfina 0,1 mg/kg PO cada 8 horas. Su frecuencia de administración fue disminuyéndose a lo largo de dos semanas, cuando el animal ya no precisó de más tratamiento analgésico.
A los 2 días del alta, el animal acudió de nuevo por vómitos. Se aplicó maropitant (Cerenia©) y se recomendó administrar el clopidogrel junto con la comida en vez de en ayunas como lo estaban haciendo6.
Se realizaron controles al mes y a los 3 meses, sin evolución del patrón pulmonar a nivel radiológico (Figuras 7 y 8) ni reaparición de signos vasculares, ni de ningún otro tipo.
Discusión
El tromboembolismo arterial es una condición médica grave y, muchas veces, se presenta como primer signo clínico de la enfermedad subyacente. La oclusión aguda de la arteria aorta distal puede afectar una, o más frecuentemente, las dos extremidades posteriores. Esto provoca, de forma aguda, su paresis o parálisis debido a una neuromiopatía isquémica1,2,6. También pueden verse afectados otros sitios diana como son las arterias mesentéricas, encefálicas o renales.
Su diagnóstico presuntivo se obtiene a partir del cuadro clínico. Si, como en nuestro caso, el trombo se localiza en la trifurcación aórtica, se suelen identificar cinco características clínicas: dolor, palidez, parálisis, poiquilotermia y ausencia de pulso2. La hipotermia se ha asociado con un peor pronóstico1. Dicho diagnóstico puede confirmarse, aunque no siempre, mediante la visualización del tromboémbolo en la ecografía abdominal.
Además, mediante las pruebas laboratoriales se puede confirmar la presencia de un elevado metabolismo anaerobio en las extremidades afectadas. Los niveles de lactato en dichas extremidades suelen ser superiores, y la glicemia inferior respecto a la circulación sistémica y a las extremidades proximales a la lesión isquémica7. El origen de la azotemia es, generalmente, prerenal, pero también puede deberse a un tromboembolismo renal. La hiperglicemia puede estar también presente, así como otros cambios analíticos relacionados con las enzimas con componente muscular1,2. Los niveles de T4 deberían ser comprobados en gatos geriátricos como factor predisponente descrito1,2,5. Asimismo, es de importancia monitorizar los niveles de potasio durante el proceso de reperfusión, ya que la hiperpotasemia es una complicación grave y potencialmente mortal. El valor del dímeros D puede estar incrementado, pero sus valores son variables en el gato y las pruebas de coagulación suelen ser normales1,2.
El inicio temprano del tratamiento, así como un control de la analgesia y del ambiente con temperatura y oxígeno adecuados, son factores de pronóstico positivo1,8. Al tratarse de un proceso muy doloroso en el que los animales pueden presentar fácilmente signos de mala perfusión sistémica, se eligió como terapia analgésica el fentanilo en infusión continua, ya que aporta una buena analgesia y su dosis resulta fácilmente ajustable a la evaluación de las constantes vitales, el electrocardiograma y la presión sistémica.
Los tratamientos de eliminación del tromboémbolo, ya sea mediante fármacos trombolíticos o exéresis quirúrgica, están asociados con mortalidades elevadas1,2,6. Por lo tanto, el tratamiento que se implantó fue conservador. Este se basó en evitar la extensión del tromboémbolo presente y a la formación de nuevos. Se optó por el uso del clopidogrel, ya que ha demostrado una eficacia superior respecto al ácido acetilsalicílico (Aspirina©)6. Se decidió combinarlo con dalteparina cada 6 horas, contrariamente a las 12 horas recomendadas por algunos autores2. Dicha decisión fue tomada debido a que las heparinas de bajo peso molecular y, particularmente, la dalteparina, tienen tiempos cortos de eliminación9,10,11. Una vez en casa, se decidió continuar con el tratamiento preventivo dada la recurrencia de eventos trombóticos y la sospecha de tromboembolismos sistémicos (mesentérico). En cuanto a los fármacos elegidos, se propuso la combinación de clopidogrel con rivaroxaban, por ser aparentemente superior a otras12. Por motivos económicos, no se introdujo el rivaroxaban en ese momento y se decidió usar heparina inyectada en vez de aspirina, debido a la gran dificultad para medicar oralmente al animal.
Actualmente, el paciente recibe solamente clopidogrel, a pesar de haberse recomendado la terapia dual en repetidas ocasiones. La fisiopatología de la formación de tromboembolismos se basa en la existencia de uno o varios componentes de la conocida tríada de Virchow, que incluye: daño endotelial, estasis sanguíneo y estado de hipercoagulabilidad1,3,13
En la mayoría de las ocasiones, la aparición del TAF está asociada a una patología cardíaca subyacente, particularmente la cardiomiopatía hipertrófica. De aquí surge el especial interés por el caso que nos ocupa. En un estudio de 127 casos felinos, menos del 30% de las causas eran no-cardíacas, incluyendo los casos de hipertiroidismo que pueden presentar fenotipo hipertrófico1,13. Por otro lado, dentro de las causas no-cardíacas, 6 gatos presentaban procesos neoplásicos (particularmente de pulmón). En este caso, el émbolo puede ser verdadero o estar formado de células tumorales que se desplazan desde el tumor4. Finalmente, en 3 animales (de 127) no se identificó la causa pese las pruebas realizadas (idiopáticos). En otro estudio, centrado únicamente en las causas no cardiogénicas, en un 33% de los 48 animales estudiados, no se pudo establecer el origen del tromboembolismo3.
Como posibles orígenes de la situación tromboembólica de nuestro paciente, nos centramos en las alteraciones observadas a nivel intestinal y pulmonar. En ambos casos, se establecieron como diagnósticos diferenciales más probables el inflamatorio-infeccioso, el neoplásico y el isquémico/tromboembólico. La lesión agresiva intestinal se identificó como secundaria a un proceso isquémico (tromboembolismo mesentérico) debido a su rápida resolución (24 horas). Por otro lado, en el diagnóstico de la lesión pulmonar difusa, se descartaron en primera instancia, los parásitos pulmonares. Pese a que la técnica de Baerman es el “gold standard” en el diagnóstico de parásitos pulmonares, es habitual encontrarse con falsos negativos5,14. En consecuencia, se procedió a su tratamiento tanto oralmente como tópicamente. En cuanto a la filariosis, aunque un resultado negativo en la prueba de antígenos no descarta la enfermedad, el hecho de que la región geográfica de hábitat tenga baja prevalencia, la convierte en una opción poco probable15,16. Además, se realizó un seguimiento sintomatológico y radiográfico al mes y a los 3 meses del alta sin cambios significativos. Esto, sumado al hecho de que el animal había presentado el primer episodio 4 meses antes de la consulta y 7 meses desde la última revisión, confiere en altamente improbable la existencia de una neoplasia pulmonar maligna asintomática y no progresiva y, asimismo, de una enfermedad inflamatoria.
Por consiguiente, se identificó la tendencia tromboembólica de nuestro animal como de origen idiopático, aunque podría deberse a una alteración en la base genética de los mecanismos de coagulación, tal y como han propuesto otros autores3.
Bibliografía
- Smith SA, Tobias AH, Jacob KA, Fine DM and Grumbles PL. Arterial thromboembolism in cats: acute crisis in 127 cases (1992–2001) and long- term management with low-dose aspirin in 24 cases. J Vet Intern Med 2003; 17: 73–83.
- Fuentes, V. L.Arterial Thromboembolism: Risks, realities and a rational first-line approach. J Fel Med Su 2012; 14(7): 459–470
- Mittleman, E, Luff, J, Drobatz, K., Costello, M., Syring, R and VanWInkle, T. Feline non-cardiogenic thromboembolic disease: a retrospective study of 48 cases (1991-2002). J Vet Emerg Crit Care 2004; 14: 1-17.
- Rachael L. Currao, Nicole J. Buote, Andrea B. Flory, Serena M. Liu. Mesenteric Vascular Thrombosis Associated with Disseminated Abdominal Visceral Hemangiosarcoma in a Cat.J Am Anim Hosp Assoc. November 2011; 47 (6): 168–172
- Giannelli A, BriantiE, Varcasia A, Colella V, Tamponi C, Di Paola G, Knaus M , Halos L et al. Efficacy of Broadline spot-on against Aelurostrongylus abstrusus and Troglostrongylus brevior lungworsms in naturally infected cats from Italy. Vet Parisitol. 2015; 209 (3-4):273-7.
- Hogan DF, Fox PR, Jacob K, Keene B, Laste NJ, Rosenthal S, Sederquist K, Weng HY. Secondary prevention of cardiogenic arterial thromboembolism in the cat: The doublé-blind, randomized, positive-controlled feline arterial thromboembolism; clopidogrel vs aspirin trial (FAT CAT). J Vet Cardiol. 2015; 17 Suppl 1:S306-17.
- Klainbart, S., Kelmer, E., Vidmayer, B., Bdolah-Abram, T., Segev, G., Aroch, I.Peripheral and Central Venous Blood Glucose Concentrations in Dogs and Cats with Acute Arterial Thromboembolism. J Vet Int Med 2014; 28(5): 1513–1519
- Hassan, Marwa H., Abu-Seida, Ashraf M., Torad, Faisal A. T, Hassan, Elham A.Feline aortic thromboembolism: Presentation, diagnosis, and treatment outcomes of 15 cats. Op Vet J 2020; 10(3), 340–346.
- Smith CE, Rozanski EA, Freeman LM, Brown DJ, Goodman JS and Rush JE. Use of low molecular weight heparin in cats: 57 cases (1999–2003). J Am Vet Med Assoc 2004; 225: 1237–1241.
- Mischke R., Schmitt J., Wolken S, Böhm C, Wolf P, Kietzmann M.Pharmacokinetics of the low molecular weight heparin dalteparin in cats Vet J 2012; 192(3): 299-303.
- Blais, MC, Bianco D, Goggs R, Lynch A M, Palmer L, Ralph, A, Sharp Cl R. Consensus on the Rational Use of Antithrombotics in Veterinary Critical Care (CURATIVE): Domain 3-Defining antithrombotic protocols. J Vet Emerg Crit Care 2019; 29(1): 60–74.
- Lo ST, Walker AL, Georges CJ, Li RH, Stern JA. Dual therapy with clopidogrel and rivaroxaban in cats with thromboembolic disease.Journal of Feline Medicine and Surgery 2021;
- Smith SA, Tobias AH.Smith SA, et al. Feline arterial thromboembolism: an update.Vet Clin North Am Small Anim Pract. 2004;34(5):1245-71
- Elsheikha HM, Schnyder M, Traversa D, Di Cesare A, Wright I, Lacher DW. Updates on feline aelurostrongylosis and research priorities for the next decade.Parasit Vectors. 2016; 9(1):389.
- Tahir D, Davoust B, Parola P (2019) Vector-borne nematode diseases in pets and humans in the Mediterranean Basin: An update, Veterinary World, 12(10): 1630-1643.
- Sandra Noack, John Harrington, Douglas S. Carithers, Ronald Kaminsky, Paul M. Selzer. Heartworm disease – Overview, intervention, and industry perspective, International Journal for Parasitology: Drugs and Drug Resistance 2021; 16: 65–89.
 by Multimédica
by Multimédica