Miocarditis traumática penetrante aguda en una perra
Resumen breve
La miocarditis es una inflamación del miocardio que puede ser de origen infeccioso o no. Este caso describe una miocarditis aguda secundaria a un trauma penetrante en una Podenco de cinco años. Después de recibir un disparo de escopeta, presentó heridas penetrantes en diversas áreas del cuerpo.Índice de contenidos

Resumen
La miocarditis es una inflamación del miocardio que puede ser de origen infeccioso o no. Este caso describe una miocarditis aguda secundaria a un trauma penetrante en una Podenco de cinco años. Después de recibir un disparo de escopeta, presentó heridas penetrantes en diversas áreas del cuerpo. La paciente se presentó con signos de shock compensado, hemotórax, hemoabdomen, arritmia ventricular, analítica general sin alteraciones y niveles elevados de cTnI. Se estableció un diagnóstico de daño multiorgánico, incluyendo pleuritis, miocarditis, neumonitis y peritonitis biliar. El tratamiento hospitalario incluyó fluidoterapia, analgesia, antibioterapia y, drenaje torácico y abdominal. La paciente mostró una mejora progresiva y fue dada de alta después de 12 días. La miocarditis traumática es un diagnóstico infrecuente, con evidencia directa de trauma y consecuencias sobre el miocardio. Aunque escasamente documentada, este tipo de miocarditis podría ser común en perros utilizados para la caza u otros fines que les predispongan a traumatismos severos. Sin embargo, el daño puede ser reversible y no causar disfunción a largo plazo. En este caso, la paciente se recuperó completamente.
Introducción
La miocarditis se define como inflamación del miocardio en ausencia de isquemia que resulta en daño a los cardiomiocitos y disfunción cardiaca1,2. Es una enfermedad cardiaca con diagnóstico presuntivo en la mayoría de los casos, ya que un diagnóstico definitivo requiere de realización de una biopsia miocárdica (técnica no ampliamente disponible y con riesgos asociados).
Dependiendo de la etiología, la miocarditis puede tener varios patrones histopatológicos identificables, pero rara vez se puede determinar su causa directa. Puede tener un origen infeccioso y no infeccioso. Entre las causas infecciosas se incluyen virus (parvovirus, principalmente; virus del Nilo occidental y otros), agentes protozoarios (Trypanosoma, Toxoplasma, Hepatozoon, Babesia, Leishmania), bacterias (Staphylococcus, Streptococcus, Citrobacter, Bartonella, Borrelia), agentes fúngicos (Coccidioides, Cryptococcus, Aspergillus), helmintos (Toxocara)1,3-5. Los agentes infecciosos pueden causar cambios agudos o crónicos a través de: (1) la infiltración directa de células inflamatorias, (2) la acción de las toxinas liberadas o (3) la respuesta inmune de tipo retardado. Este último conduce a un proceso inflamatorio secundario como resultado del daño de la estructura del músculo cardiaco. Las miocarditis no infecciosas pueden ser secundarias a fármacos, tóxicos, inflamación sistémica y agentes físicos (traumáticas). Las causas traumáticas pueden aparecer como consecuencia de un trauma torácico cerrado o penetrante, pero están escasamente descritas en la literatura. La serie de casos en perros más grande publicada hasta ahora (64 con diagnóstico ante mortem y 137 post mortem) las más frecuentes fueron infecciosas (bacterianas) y no incluyó ningún caso de miocarditis traumática2.
El cuadro clínico de las miocarditis es diverso y puede incluir tanto alteraciones del ritmo como, a veces, cambios tardíos que se asemejan a la miocardiopatía dilatada (CMD)6. En un estudio de una serie de casos (64 con diagnóstico ante mortem) los signos más frecuentes fueron hiporexia (70 %) y debilidad (69 %) y al examen físico, fiebre (21 %) y soplo (19 %)2. Generalmente, el diagnóstico se considera presuntivo teniendo en cuenta un aumento del valor de troponina I (cTnI, biomarcador indicativo de daño miocárdico), la clínica del paciente (arritmias y cambios ecocardiográficos) y la sospecha de diagnóstico causal se establece mediante pruebas diagnósticas serológicas o directas/antigénicas/PCRs5,7. Obtener un diagnóstico definitivo ante mortem requiere de la realización de biopsias endomiocárdicas o examen histopatológico post mortem2,8,9.
Por el contrario, el diagnóstico clínico alcanza mayor solidez en casos como el aquí descrito, en los que hay una causa traumática reportada y la aparición de signos es simultánea a la presentación del paciente. El presente caso describe la presentación clínica y evolución de una miocarditis aguda secundaria a un traumatismo penetrante.
Caso clínico
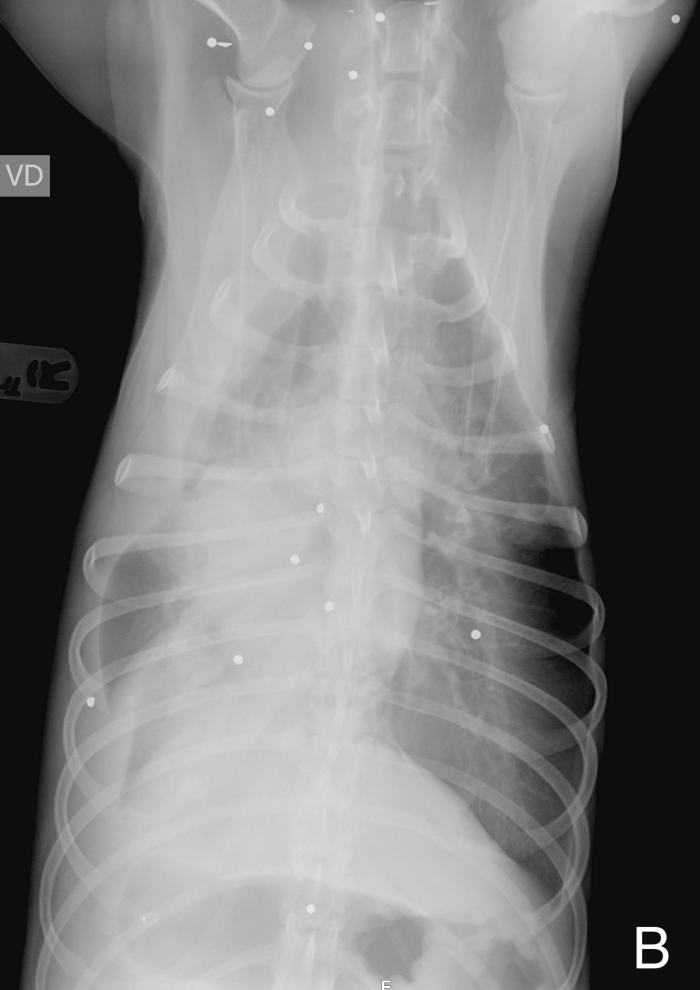
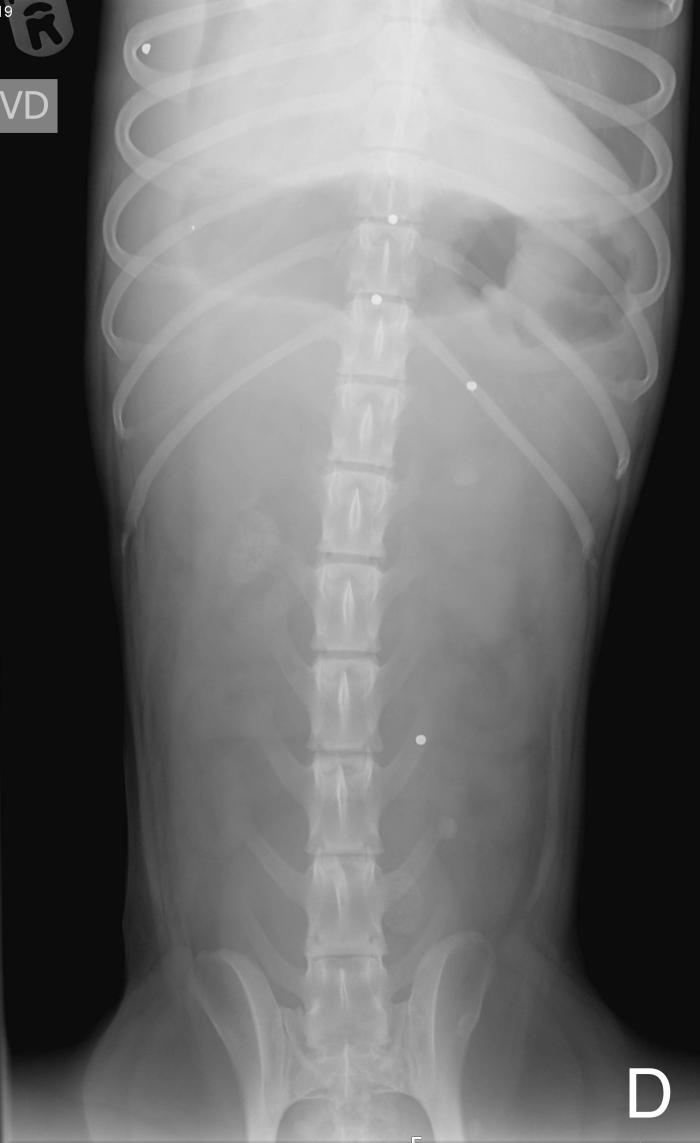
Una perra de raza Podenco andaluz, hembra entera de 5 años y 16 kg, correctamente vacunada y desparasitada, sin enfermedades previas relevantes, fue atendida de urgencia tras haber recibido accidentalmente el impacto de un disparo de escopeta de caza (cartucho de plomos). El alcance se produjo por el lado derecho de la paciente mostrando heridas penetrantes en múltiples áreas de extremidades, abdomen y tórax. Esto es debido a que este tipo de disparos produce una dispersión en racimo de múltiples bolas de plomo. La evaluación clínica inicial incluyó examen físico, medición de presión arterial, hematología, bioquímica, radiografías de tórax y abdomen. La paciente presentaba estado mental estuporoso, con mucosas pálidas, pulsos firmes, taquicardia (160 ppm) y taquipnea (64 rpm) con patrón superficial y signos de dolor generalizado. Los sonidos cardiacos estaban ligeramente atenuados pero el ritmo era regular y no se identificó soplo. Las presiones arteriales estaban en rango (119-90-65 mmHg, sistólica-media-diastólica). Radiográficamente, se identificaron múltiples proyectiles, varios de ellos intrabdominales e intratorácicos, efusión pleural y abdominal (Figura 1).
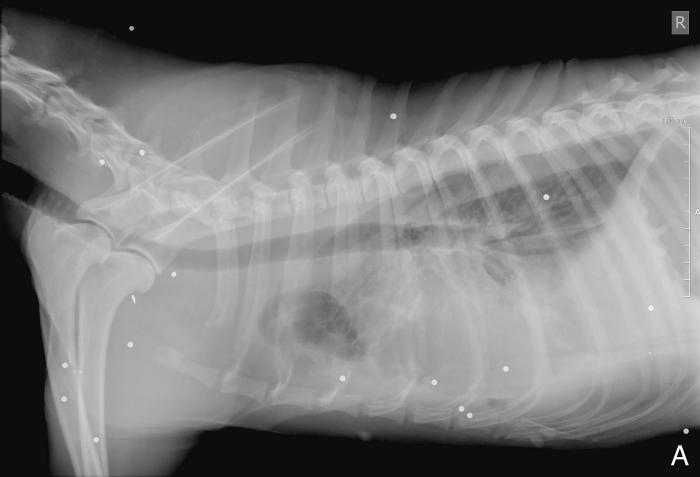
Figura 1. Radiografías (A, B) torácicas y (B, C) abdominales, (A, C) laterales derechas y (B, D) ventrodorsales de la perra en el momento de la presentación inicial en las que se aprecian la multitud de pequeñas estructuras esféricas de opacidad metal correspondientes a los perdigones. Se observa presencia de efusión pleural en hemitórax derecho que provoca la retracción de los márgenes pulmonares y obscurece la silueta cardiaca y la porción ventral y derecha del diafragma. A nivel abdominal se visualiza aumento de la opacidad de forma difusa con pérdida de diferenciación de serosas abdominales especialmente a nivel de abdomen craneal.

Se concluyó la presencia de shock compensado con hemotórax y hemoabdomen. La paciente fue hospitalizada y se instauró un tratamiento mediante la administración intravenosa de dos bolos de resucitación con cristaloides, seguido de fluidoterapia con Ringer lactato a velocidad de mantenimiento + 5 % de deshidratación, metadona (0.2 mg/kg cada 4 h), cefalexina (22 mg/kg cada 8 h), marbofloxacino (2 mg/kg cada 24 h), ampicilina (22 mg/kg cada 8 h), metronidazol (10 mg/kg cada 12 h) y etamsilato (1 ml/10 kg). Se realizó drenaje toracoabdominal obteniendo (tórax 150 ml, abdomen 210 ml) líquido de aspecto hemático, cuyo estudio evidenció un 12 % de hematocrito y 6 mg/dl de proteínas.
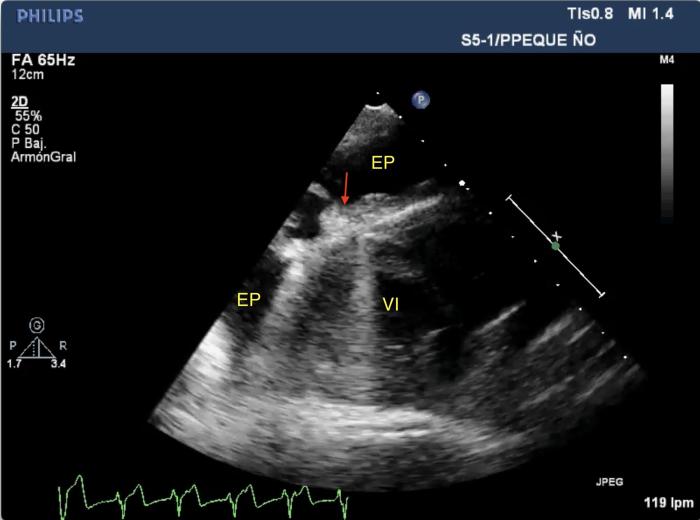
A las 12 h tras el ingreso, las constantes vitales se encontraban estables. Se identificó la presencia de alteración del ritmo cardiaco, persistencia de taquipnea y distrés respiratorio por lo que se realizó una evaluación cardiorrespiratoria, incluyendo ecocardiografía, electrocardiografía y determinación de cTnI. Ecográficamente se identificó la presencia de efusión pleural abundante con restos de fibrina adheridos a la pleura parietal y sospecha de pleuritis (engrosamiento pleural) y al pericardio (Figura 2).
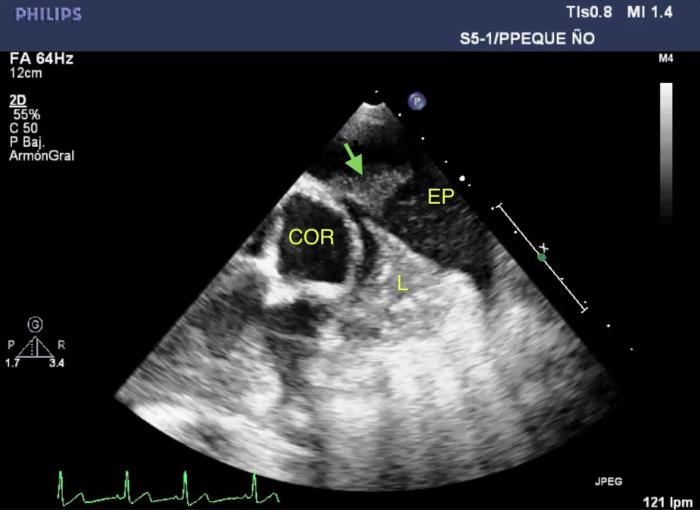
Figura 2. (A, B) Imágenes de la ecografía torácica mostrando efusión pleural (EP), restos de fibrina en pleura (fecha verde) o adheridos al epicardio (flecha roja). Se observa también el extremo de un lóbulo pulmonar atelectásico (L). El ECG en la imagen (B) muestra una salva de ritmo idioventricular acelerado y artefacto en cometa por la presencia de 2 proyectiles. COR, corazón; VI, ventrículo izquierdo.
Sobre el epicardio del área apical del ventrículo derecho se identificó una estructura fuertemente hiperecogénica que producía artefacto en cola de cometa, compatible con uno de los proyectiles (Figura 3).
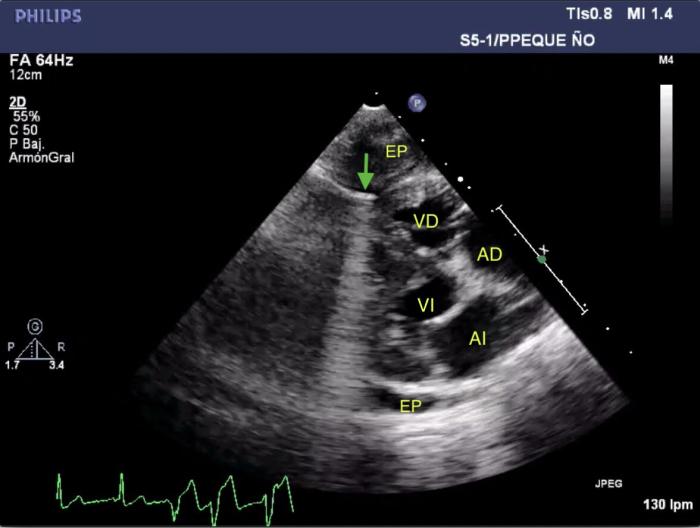
Figura 3 (A, B). Imágenes ecocardiográficas obtenidas por el acceso lateral derecho en (A) longitudinal y (B) transversal en modo BD mostrando la presencia de estructuras hiperecogénicas (flecha verde) que producen artefacto en forma de cola de cometa situados en el epicardio apical del ventrículo derecho (VD). En la imagen A se aprecia transición del ritmo sinusal a ritmo idioventricular. VI, ventrículo izquierdo; AI, atrio izquierdo; AD, atrio derecho; EP, efusión pleural.
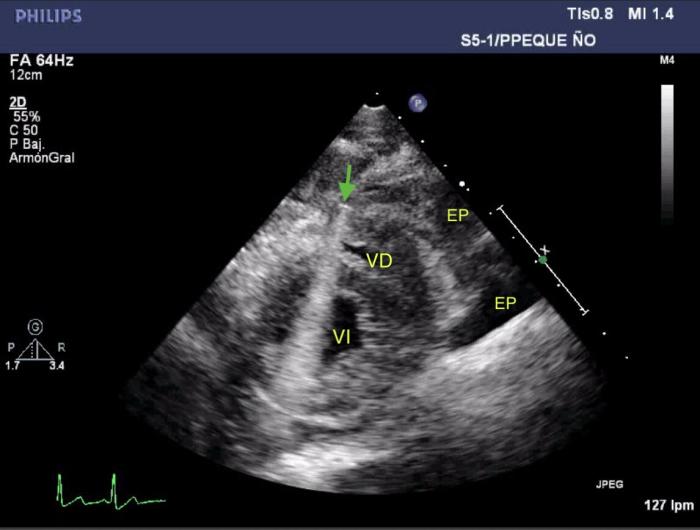
Durante la monitorización electrocardiográfica simultánea al examen ecocardiográfico, la paciente presentaba extrasístoles/complejos ventriculares prematuros monomórficos negativas aisladas o en series (dobletes, tripletes y episodios de ritmo idioventricular acelerado) (Figura 2 y 3). A nivel ecocardiográfico no se observaron anomalías a nivel estructural o funcional. Tanto el grosor de las paredes como los parámetros de función sistólica y diastólica estaban dentro de rango (Figura 4).
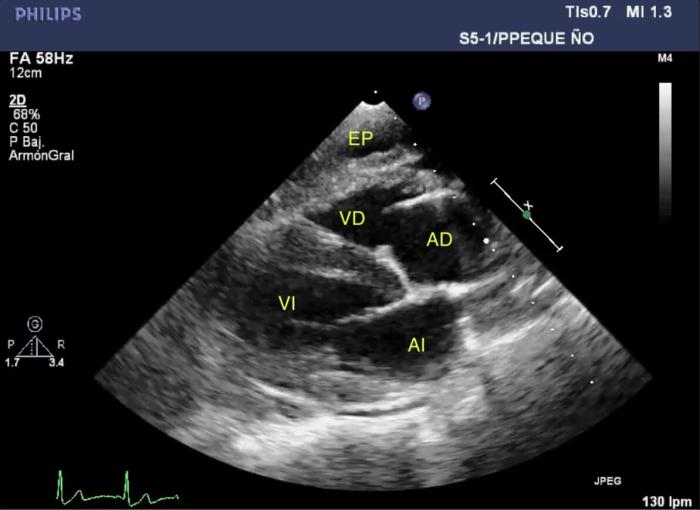
Figura 4. Imágenes ecocardiográficas obtenidas por el acceso lateral derecho en (A) longitudinal y (B) transversal en modo BD mostrando aspecto de paredes y cavidades y relación de tamaño normales. En la imagen (B) se aprecia transición del ritmo sinusal a ritmo idioventricular. VD, ventrículo derecho; VI, ventrículo izquierdo; AI, atrio izquierdo; AD, atrio derecho.

El valor de cTnI era de 29.5 ng/ml (rango referencia <0.05 ng/ml). La ecografía abdominal reveló una vesícula biliar prácticamente vacía con pared hiperecogénica, irregular y engrosada, junto con una abundante efusión peritoneal, grasa mesentérica aumentada de ecogenicidad y peritoneo reactivo. Se realizó una nueva abdominocentesis, extrayéndose 1.250 ml, de coloración fuertemente marrón-amarillenta (Figura 5).

Figura 5. Aspecto del líquido extraído tras drenaje abdominal mediante abdominocentesis.
El análisis del líquido pleural era compatible con exudado hemorrágico, y el abdominal presentaba alta concentración de bilirrubina (37.19 mg/dl), siendo compatible con exudado biliar.
Se estableció un diagnóstico final de daño multiorgánico penetrante con pleuritis, miocarditis y neumonitis, así como peritonitis biliar por traumatismo/laceración de las vías biliares. A pesar de que una peritonitis biliar se considera una urgencia quirúrgica, teniendo en cuenta la situación de la paciente, los riesgos anestésicos, y tras la discusión con su tutor, se decidió optar por un tratamiento conservador inicialmente. La paciente se trató hospitalariamente mediante fluidoterapia, analgesia, antibioterapia, drenaje toracoabdominal a demanda y reposo estricto. La efusión pleural se resolvió por completo a los 6 días constatando normalización progresiva del patrón pulmonar (Figura 6).
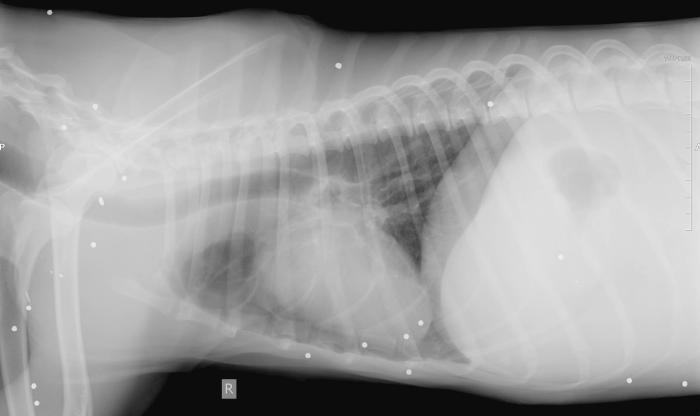
Figura 6. Radiografías torácicas (A) lateral derecha y (B) ventrodorsal a los 6 días de recibir el impacto, en las que se aprecia la resolución de la efusión pleural.

El ritmo cardiaco se normalizó 48 h tras la evaluación inicial de cardiología y la monitorización mediante cTnI (9 días tras el traumatismo) mostró una reducción significativa, siendo compatible con una evolución favorable del daño miocárdico (cTnI 0.11 ng/ml, ref <0.05 ng/ml).
En cuanto a la peritonitis biliar, a pesar del tratamiento no invasivo mediante drenajes intermitentes, presentaba recurrencia, por lo que cuando la paciente se consideró estable para llevar a cabo una anestesia general se optó por realizar una laparotomía exploratoria (sin evidencia de puntos de fuga biliar). Se realizaron múltiples lavados peritoneales y se colocó un sistema de drenaje Jackson-Pratt, que fue retirado 48 h tras la colocación sin presentar recurrencia de exudado biliar. La paciente presentó una clara mejoría clínica y fue dada de alta tras 12 días de hospitalización. Se realizó seguimiento telefónico a las 2 semanas (el tutor declinó la revisión presencial) y se constató la vuelta completa del animal a su funcionalidad normal. A los 5 años (fecha de redacción de este escrito) se repitió el contacto telefónico y el tutor de la paciente refirió que seguía asintomática y con rendimiento funcional completo.
Discusión
La miocarditis es uno de los diagnósticos más desafiantes en cardiología de pequeños animales. El trastorno rara vez se reconoce clínicamente, la prevalencia en perros y gatos se desconoce y probablemente, se subestima, aunque se reportó un diagnóstico histopatológico de miocarditis en el 1.5 % de los perros en un estudio de necropsia retrospectiva10. La fisiopatología de la miocarditis viral en particular no se comprende bien y la presentación y el curso clínico son variables. Además, hasta hace poco no existía una clasificación clínica y patológica utilizada de manera uniforme, y todos los tratamientos específicos actuales son empíricos y controvertidos1,3,4. Un estudio reciente realizado en una serie de perros con miocarditis ante mortem (64) y post mortem (137) propuso un esquema de aplicación de criterios diagnósticos semejante a los criterios de Duke utilizados para la endocarditis bacteriana, basándose en criterios mayores y menores2. La miocarditis traumática es, probablemente, una excepción a esta norma ya que la constatación de un evento traumático con consecuencias directas objetivables sobre el miocardio puede constituir evidencias suficientes para sostener el diagnóstico. El presente caso corresponde a una paciente joven y sana que sufre un evento traumático penetrante con evidencia radiográfica y ecográfica de proyectiles en epicardio, eventos arrítmicos y elevación severa de cTnI, por lo que se llega a un diagnóstico clínico de miocarditis traumática aguda.
Las miocarditis “clásicas” se consideran principalmente secundarias a agentes infecciosos (virus, bacterias, protozoos, hongos), fármacos (antraciclinas), tóxicos y enfermedades sistémicas. Asumiendo grandes diferencias entre ellas y grandes lagunas sobre el conocimiento exacto de su fisiopatología, se acepta que en el desarrollo de la enfermedad se suceden varias fases (aguda, subaguda, crónica) de duración y severidad muy variable en las que el daño miocárdico se instaura tanto por acción directa del agente causal como por fenómenos inflamatorios, isquémicos y apoptóticos1. Las fases tempranas pueden generar eventos arrítmicos en el contexto de otros signos sistémicos en general o de otros sistemas orgánicos en particular dependiendo del agente en sí. En estos contextos, el padecimiento de miocarditis puede pasar desapercibido, pudiendo incluso ser completamente subclínico. Pero probablemente la enfermedad sigue su curso en forma de inflamación crónica, ciclos repetitivos de lesión y reparación del miocardio, apoptosis, espasmo microvascular coronario y efectos autoinmunes. Estas respuestas pueden provocar una lesión miocárdica continua y una evolución lenta hacia CMD e insuficiencia cardiaca. Esto puede ocurrir incluso después de muchos años, y algunos casos de CMD idiopática en perros y gatos pueden representar una miocarditis viral previa no reconocida.
Nuevamente es posible que la miocarditis traumática pueda no seguir este esquema fisiopatológico y conducir a una reparación completa sin secuelas, como se sospecha en este caso clínico. No obstante, no se dispone de datos publicados en la literatura sobre seguimiento a largo plazo de miocarditis traumáticas en perros por lo que no es posible asegurar que a largo plazo los individuos que la padecen puedan o no estar predispuestos a secuelas crónicas como el padecimiento de un fenotipo de CMD. La pronta desaparición de los eventos arrítmicos y retorno a la normalidad de los niveles de troponina cardiaca y del nivel funcional global de la paciente como perro de caza, hacen pensar que, en el presente caso clínico, la recuperación cardiaca tras la miocarditis pudo ser completa y rápida.
Aunque no existan datos epidemiológicos específicos publicados, es lógico pensar que debe ser frecuente la presencia de este tipo de miocarditis asociadas a eventos similares, sobre todo en perros que se utilizan para la caza. Es probable que sean también frecuentes en otro tipo de traumas como atropellos, caídas y traumatismos torácicos contusos severos en general. Sin embargo, la literatura específica al respecto es muy escasa y, por tanto, no está bien caracterizada. Se encuentran referencias a que la disfunción miocárdica asociada es una consecuencia infrecuente y casi siempre reversible, no ocasionando daño o disfunción a largo plazo1. En el presente caso, no se evidenciaron alteraciones en los parámetros ecocardiográficos, la arritmia desapareció en pocos días, la troponina se redujo significativamente en el control realizado a los 9 días y la paciente retornó por completo a su nivel funcional superadas el resto de las lesiones.
El plomo es especialmente peligroso porque puede acumularse en el cuerpo con el tiempo y afectar a varios sistemas, incluido el sistema nervioso, renal, cardiovascular y reproductivo. El saturnismo, también conocido como intoxicación por plomo, es una enfermedad causada por la exposición prolongada o repetida al plomo, un metal pesado tóxico11-13. Las fuentes comunes de exposición al plomo incluyen la pintura a base de plomo en edificios antiguos, el agua contaminada, el polvo y los suelos contaminados. En personas, también ciertas profesiones que implican el manejo de plomo, como la fabricación de baterías y la fundición de metales. Existen antecedentes de intoxicaciones por plomo asociadas a proyectiles retenidos en humanos11,12. En perros, se ha detectado riesgo de intoxicación cuando son alimentados de manera continuada con parte de piezas de caza que contienen proyectiles de plomo13. La intoxicación no se desarrolla por igual en todos los individuos y ocurre generalmente de forma muy demorada. La mayoría de los casos descritos en personas en los que se retienen proyectiles no son tratados para prevenir la absorción del plomo. Cabe esperar que se desarrollen cambios fibróticos en torno al proyectil y quede alojado de manera inerte11,12. Ciertas variaciones individuales o la aparición de algunas enfermedades que determinen estados hipermetabólicos podrían predisponer a algunos individuos a una mayor absorción y la aparición de síntomas de intoxicación.
En humanos, los síntomas clínicos son la base para el diagnóstico de intoxicación por plomo. Pueden variar desde leves, como dolores de cabeza y fatiga, hasta graves, como daño cerebral, convulsiones y coma. Entre los más comunes se encuentran dolor abdominal inexplicable, neuropatía motora en las extremidades, nefropatía, poliartralgia y trastornos neurológicos. El borde de Burton, una línea oscura entre la base de los dientes y las encías es uno de los signos clínicos más sugerentes del envenenamiento por plomo11,12. En perros, la intoxicación por plomo puede afectar igualmente a múltiples sistemas orgánicos e inducir signos muy variados, destacando los gastrointestinales, neurológicos y renales13. En el presente caso, se planteó realizar cirugía para la extracción de los proyectiles, pero la gravedad del estado inicial del paciente y restricciones económicas posteriores llevaron a descartarlo. El uso de quelantes de plomo no se recomendó, ya que no es un abordaje estandarizado. La recuperación funcional global de la paciente fue completa en pocas semanas tras el alta y 5 años después la paciente no ha manifestado síntomas atribuibles a intoxicación por plomo.
En conclusión, la miocarditis aguda traumática en perros es un diagnóstico desafiante pero identificable ante un trauma penetrante con evidencia de proyectiles y alteraciones cardiacas. Este caso clínico demuestra que, con un manejo adecuado, la recuperación puede ser completa y sin secuelas a largo plazo. La pronta resolución de arritmias y normalización de troponina I sugieren una reparación miocárdica efectiva tras el evento traumático.
Bibliografía
- Janus I, Noszczyk-Nowak A, Nowak M, et al. Myocarditis in dogs: etiology, clinical and histopathological features (11 cases: 2007-2013). Ir Vet J. 2014 Dec 24;67(1):28.
- Lakhdhir S, Viall A, Alloway E, Keene B, Baumgartner K, Ward J. Clinical presentation, cardiovascular findings, etiology, and outcome of myocarditis in dogs: 64 cases with presumptive antemortem diagnosis (26 confirmed postmortem) and 137 cases with postmortem diagnosis only (2004-2017). J Vet Cardiol. 2020 Aug;30:44-56. doi: 10.1016/j.jvc.2020.05.003. Epub 2020 May 29. PMID: 32668360; PMCID: PMC7256493.
- Schober KE. Myocarditis. En: Bonagura JD, Twedt DC. Kirk’s Current Veterinary Therapy XV. Saunders Elsevier 2014. Web Chapter 63, e303-e308.
- Molesan A, Goodman L, Ford J, et al. The Causes of Canine Myocarditis and Myocardial Fibrosis Are Elusive by Targeted Molecular Testing: Retrospective Analysis and Literature Review. Vet Pathol. 2019 Sep;56(5):761-777.
- Casamián-Sorrosal D, Barrera-Chacón R, Fonfara S, Belinchón-Lorenzo S, Gómez-Gordo L, Galapero-Arroyo J, et al. Association of myocardial parasitic load with cardiac biomarkers and other selected variables in 10 dogs with advanced canine leishmaniasis. Vet Rec. 2021;189:e198.
- Guedes PMM, Veloso VM, Afonso LCC, Caliari MV, Carneiro CM, Diniz LF, Marques-da-Silva EA, Caldas IS, Do Valle Matta MA, Souza SM, Lana M, Chiari E, Galvao LMC, Bahia MT: Development of chronic cardiomyopathy in canine Chagas disease correlates with high IFN- γ, TNF-α, and low IL-10 production during the acute infection phase. Vet Immunol Immunop. 2009, 130: 43-52. 10.1016/j.vetimm.2009.01.004.
- Oyama MA, Sisson DD: Cardiac troponin-I concentration in dogs with cardiac disease. J Vet Intern Med. 2004, 18: 797-799. 10.1111/j.1939-1676.2004.tb02624.x.
- Church WM, Sisson DD, Oyama MA, Zachary JF: Third degree atrioventricular block and sudden death secondary to acute myocarditis in a dog. J Vet Cardiol. 2007, 9: 53-57. 10.1016/j.jvc.2006.08.002.
- Kaneshige T, Machida N, Nakao S, Doiguchi O, Katsuda S, Yamane Y: Complete atrioventricular block associated with lymphocytic myocarditis of the atrioventricular node in two young adult dogs. J Comp Path. 2007, 137: 146-150. 10.1016/j.jcpa.2007.05.006.
- Schober KE. Myocarditis. In: Kirk’s Current Veterinary Therapy XIV. St. Louis: Saunders Elsevier; 2009. p. 804e8.
- Magos L. Lead poisoning from retained lead projectiles. A critical review of case reports. Hum Exp Toxicol. 1994 Nov;13(11):735-42. doi: 10.1177/096032719401301101. PMID: 7857692.
- Gerstner Garcés JB, Manotas Artuz RI. Secondary lead poisoning a projectile housed in the human body. Colombia Médica 2012; 43(3): 230-234.
- Høgåsen HR, Ørnsrud R, Knutsen HK, Bernhoft A. Lead intoxication in dogs: risk assessment of feeding dogs trimmings of lead-shot game. BMC Vet Res. 2016 Jul 25;12(1):152. doi: 10.1186/s12917-016-0771-z. PMID: 27457446; PMCID: PMC4960786.
 by Multimédica
by Multimédica