Valores normales de NT-proBNP en perros sanos de distinta edad, sexo y talla
Resumen breve
El objetivo de este estudio fue analizar la asociación entre la concentración de NT-proBNP y edad, sexo y talla en perros sanos. La concentración de NT-proBNP es afectada por la edad y el sexo, pero no por la talla, estas diferencias deben considerarse en condiciones de salud y enfermedad.Índice de contenidos
Resumen
Los péptidos natriuréticos participan en el control de la homeostasis cardiovascular y renal. El objetivo de este estudio fue analizar la asociación entre la concentración de NT-proBNP y edad, sexo y talla en perros sanos. La muestra consistió en 159 caninos –80 machos y 79 hembras, 80 menores de 7 años y 79 mayores de 7 años, 53 de talla pequeña (<12 kg)– 53 de talla mediana (12-25 kg) –53 de talla grande (>25 kg)– con condición corporal 2.5-3.5 (score de 1-5). Se consideraron perros sanos a los que presentaron exploración clínica y estudios complementarios –presión arterial sistémica, electrocardiografía, radiología torácica, ecocardiografía, hematología y bioquímica sérica– dentro de parámetros normales. El análisis estadístico se realizó mediante un software público R&R Commander (Rcmdr), versión i386-3.0.1. La concentración media de NT-proBNP fue 260.28 pmol/l ± 135.48 pmol/l. Se observaron diferencias significativas para sexo (machos: 281.31 pmol/l ± 144.84, hembras: 238.99 pmol/l ± 123.52, p = 0.0392) y edad (<7 años: 235.19 pmol/l ± 119.72, >7 años: 285.69 pmol/l ± 146.97, p = 0.0124), pero no para talla (<12 kg: 235.78 pmol/l ± 129.18, 12-25 kg: 281.85 pmol/l ± 134.34, >25 kg: 263.21 pmol/l ± 142.46, p = 0.183). La concentración de NT-proBNP es afectada por la edad y el sexo, pero no por la talla, estas diferencias deben considerarse en condiciones de salud y enfermedad.
Introducción
Las enfermedades cardíacas representan el 11.3 % de las patologías presentes en perros1, correspondiendo 65-70 % a patologías valvulares, 15-20 % a miocárdicas y el resto a otras cardiopatías2. En las últimas décadas, se ha prestado especial atención a la utilización de biomarcadores para evaluar el estado y funcionamiento del aparato cardiovascular3. Los péptidos natriuréticos son una familia de hormonas4, que juegan un importante rol en la regulación de la homeostasis cardiovascular y renal5, a partir de su actividad vasodilatadora, natriurética, antagonista del sistema renina angiotensina aldosterona6-8, lusinotrópica e inhibitoria de la fibrosis miocárdica9. El primero en ser descubierto10 y secuenciado11fue el péptido natriurético atrial (ANP). Los restantes miembros, péptido natriurético tipo B (BNP) y tipo C (CNP), fueron caracterizados en 198912 y en 199013, respectivamente. BNP, originalmente descubierto en tejido cerebral porcino14, es sintetizado y liberado, tanto por miocitos atriales como ventriculares, sin un proceso de almacenamiento extenso15-17. Luego de su síntesis, es liberado a la circulación como una prohormona glicosilada18 de 108 aminoácidos denominada proBNP19,20. Esta, seguidamente, es dividida en dos fragmentos por una proteasa sérica21, ubicada en la membrana de los miocitos cardíacos22, la fracción carboxilo terminal no glicosilada de 32 aminoácidos, biológicamente activa, denominada C-BNP23,24y un fragmento amino terminal no glicosilado residual25 de 76 aminoácidos, inactivo, denominado NT-proBNP26-28. BNP es liberado por el tejido cardíaco en respuesta a incrementos en el estrés parietal, primariamente a nivel ventricular29. Aumentos marcados, como los que se observan en perros con insuficiencia cardíaca crónica, son provocados por el incremento de la síntesis proteica a partir de una mayor regulación génica30. La síntesis y secreción de BNP se incrementa, de esta forma, en respuesta a fuerzas hemodinámicas como las que se generan a partir de la sobrecarga de volumen y/o presión que soportan las cámaras ventriculares, principalmente31. Los niveles circulantes de BNP se correlacionan positivamente con la severidad de la insuficiencia cardíaca32 y proporcionan un sensible biomarcador para el diagnóstico, seguimiento y pronóstico de la insuficiencia cardíaca24,33,34,35. La determinación de las concentraciones circulantes de los péptidos natriuréticos se considera parte de los análisis que se realizan para diagnosticar enfermedades cardíacas en el hombre. Teniendo presente que las patologías cardíacas crónicas representan más del 95 % de las afecciones cardiológicas en perros, no cabe duda de que los biomarcadores deben formar parte de los estudios complementarios de diagnóstico. Por esta razón, se han desarrollado pruebas caninas y felinas específicas36, tanto para los fragmentos activos como residuales de los péptidos ANP37 y BNP38 y se encuentran disponibles comercialmente. Un hallazgo común, en las distintas investigaciones analizadas, es la variabilidad en la concentración observada, caracterizada por una amplitud de rango significativa. Los valores de corte son eficaces para distinguir entre perros sanos de pacientes asintomáticos y con signos clínicos de insuficiencia cardíaca39-41. Sin embargo, entre los grupos A y B42, específicamente B1, se encuentra una proporción no menor de falsos positivos y negativos43-46. Esta variabilidad puede obedecer a causas raciales47-52 o, a otros factores como edad, sexo, talla, estado reproductivo, etc.53-56. En relación con estas últimas, varios ensayos no hallaron ninguna correlación con la concentración de NT-proBNP, tanto en perros con enfermedad cardíaca como en sanos37,38,57-63. Sí, en cambio, observaron diferencias entre caninos de raza pura y mestizos, estando, la concentración de NT-proBNP más elevada en los primeros3,64. Otros estudios, en cambio, si hallaron diferencias en relación con edad y sexo65,66, observando que los perros machos presentaban niveles ¼ más elevados que las hembras, al igual que los mayores de 8 años respecto a los menores de 8 años de edad55,67-69. Por último, también se observa una amplia variabilidad individual y semanal en las concentraciones de NT-proBNP en perros sanos58 y en aquellos perros que realizan actividad física, provocando en algunos casos elevaciones por encima del rango normal52. Los hallazgos descriptos podrían deberse a que en los estudios realizados se han utilizado poblaciones muy heterogéneas y de pequeño tamaño, en los grupos correspondientes a los animales sanos, las cuales pudiesen ser responsables de la variabilidad encontrada. En este marco, el objetivo fue estudiar la asociación entre la concentración de NT-proBNP y la edad, sexo y talla, en una muestra de perros sanos.
Materiales y métodos
Se estudiaron 159 perros sanos, 80 machos y 79 hembras, 80 menores de 7 años y 79 mayores de 7 años, 53 de talla pequeña y peso menor de 12 kg –53 de talla mediana y peso entre 12 y 25 kg– 53 de talla grande y peso mayor de 25 kg, 107 enteros y 52 castrados. Todos los animales utilizados contaron con el consentimiento de su tutor responsable. Los perros se dividieron en 12 grupos según sexo, edad y talla. La condición corporal de cada perro se estableció, a los fines de su inclusión, entre 2.5 y 3.5, escala de 1 a 5. La selección de los animales, para establecer la condición de perro sano, se realizó a partir de un examen clínico y estudios complementarios de diagnóstico dentro de los parámetros normales (radiología de tórax, ecocardiografía convencional y Doppler, electrocardiografía, medición de presión arterial no invasiva, hemograma, bioquímica analítica y urianálisis). La determinación de la concentración de NT-proBNP se realizó mediante un Kit ELISA en sándwich canino específico (Marca USCN® Life Science Inc. –Catálogo: E90485Ca– Canis familiaris: Canine/Dog). Los valores obtenidos fueron expresados en pmol/l, unidad internacionalmente utilizada para la determinación de la concentración sérica de esta molécula, sobre la base de un peso molecular de NT-proBNP de 8.500 g/mol (8.5 KDa) y un factor de conversión de 8.5 pg/ml = 1 pmol/l (37.169). Para la realización de la técnica se siguieron estrictamente las indicaciones recomendadas por el fabricante en el manual de instrucciones y cada una de las determinaciones se realizó por duplicado. Se utilizó el suero conservado a -20 ºC durante un periodo máximo de 10 meses. El cálculo de la concentración final de cada grupo se obtuvo promediando los resultados obtenidos.Se realizó un análisis estadístico analítico, aplicando modelos de asociación, para evaluar la relación entre la concentración sérica del NT-proBNP y la edad, sexo y talla. Estos análisis se realizaron mediante un software de dominio público: R & R Commander (R cmdr) versión i386-3.0.1. La Tabla 1 muestra las características constitutivas de los 12 grupos incluidos en el ensayo.
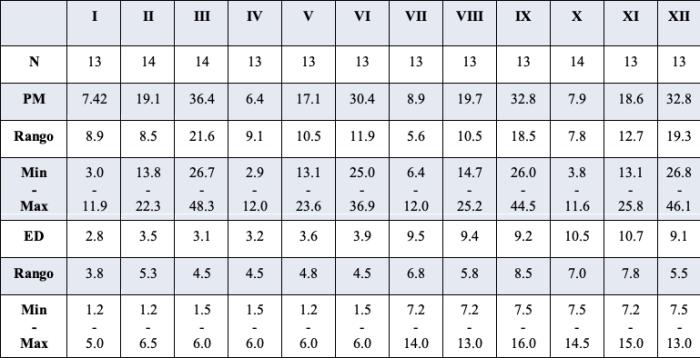
Tabla 1. Edad, sexo y talla de c/u de los 12 grupos incluidos en el estudio.
N. Número de individuos por grupo. PM. Peso promedio. ED: Edad Promedio. Min - Max: Valores mínimos y máximos. I, II, III, VII, VIII y IX. Hembras. IV, V, VI, X, XI y XII. Machos.
Resultados
La concentración de NT-proBNP presentó, para toda la muestra, una media 260.28 pmol/l, con una desviación estándar de ± 135.48 pmol/l y valores mínimos de 42.16 pmol/l y máximo de 603.71 pmol/l (Figura 1).
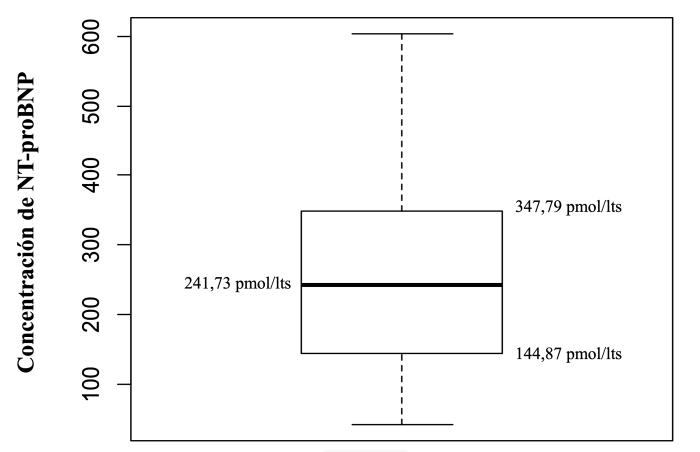
Figura 1. Diagrama de caja que muestra la distribución levemente asimétrica de la variable hacia los límites superiores, la ausencia de valores atípicos.
La concentración media de NT-proBNP, según sexo, para las hembras fue de 238.99 pmol/l, con una desviación estándar de ± 123.52 pmol/l y valores mínimos de 66.55 pmol/l y máximo de 587.74 pmol/l. En tanto que, para los machos, la media fue de 281.31 pmol/l, con una desviación estándar de ± 144.84 pmol/l y valores mínimos de 42.16 pmol/l y máximo de 603.71 pmol/l (Figura 2).
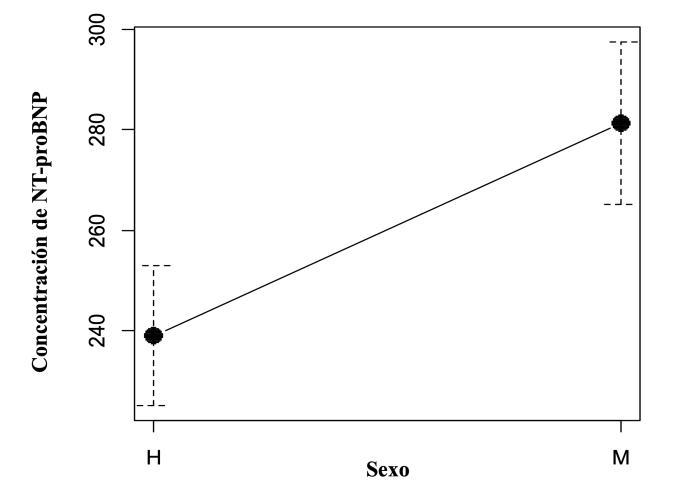
Figura 2. Plot para medias que muestra las diferencias presentes en la concentración de NT-proBNP para el grupo de hembras y machos.
La concentración media de NT-proBNP, según edad, para los perros menores de 7 años fue de 235.19 pmol/l, con una desviación estándar de ± 119.72 pmol/l y valores mínimos de 72.06 pmol/l y máximo de 575.89 pmol/l. En tanto que, para los mayores de 7 años, la media fue de 285.69 pmol/l, con una desviación estándar de ± 146.97 pmol/l y valores mínimos de 42.16 pmol/l y máximo de 603.71 pmol/l (Figura 3).
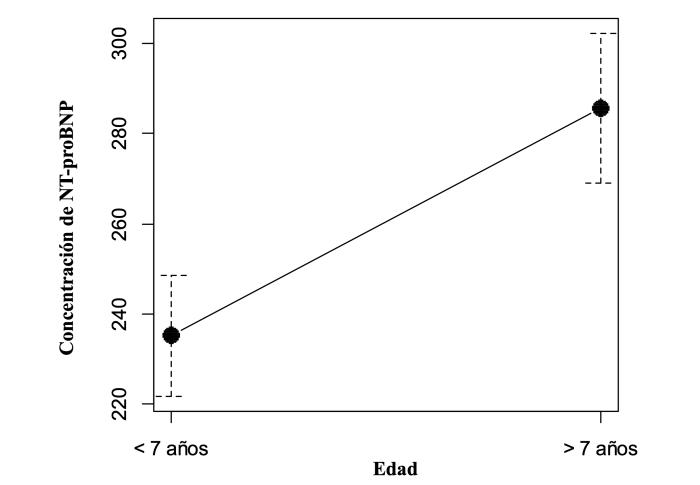
Figura 3. Plot para medias que muestra las diferencias presentes en la concentración de NT-proBNP para el grupo de perros menores de 7 años y mayores de 7 años.
La concentración media de NT-proBNP, según talla para los perros menores de 12 kg fue de 235.78 pmol/l, con una desviación estándar de ± 129.18 pmol/l y valores mínimo de 42.16 pmol/l y máximo de 587.74 pmol/l; para perros entre 12 y 25 kg la media fue de 281.85 pmol/l, con una desviación estándar de ± 134.34 pmol/l y valores mínimo de 44.83 pmol/l y máximo de 575.89 pmol/l; y para perros mayores de 25 kg la media fue de 263.21 pmol/l, con una desviación estándar de ± 142.46 pmol/l y valores mínimo de 49.81 pmol/l y máximo de 603.81 pmol/l (Figura 4).
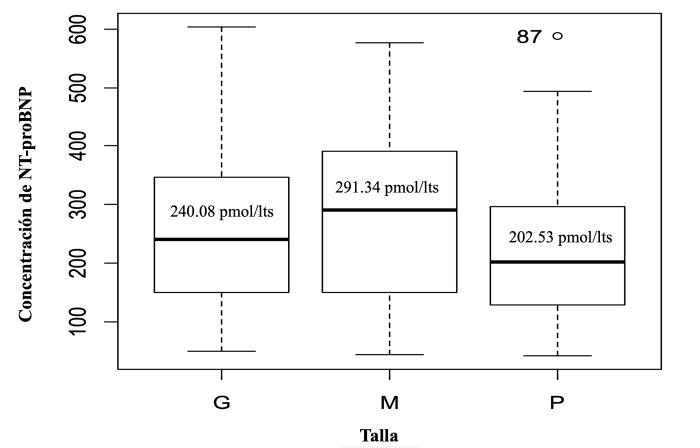
Figura 4. Diagrama de cajas que muestra la homogeneidad de varianzas entre los tres grupos analizados y la presencia de 1 valor atípico en la muestra de caninos menores de 12 kg. Se exponen los valores de la mediana de cada grupo.
Las concentraciones de NT-proBNP, para los 12 grupos de perros analizados, se presentan como media, desviación estándar y valores mínimos y máximos (Tabla 2). La Figura 5 permite evidenciar la distribución irregular que presentan los valores hallados en los grupos evaluados.
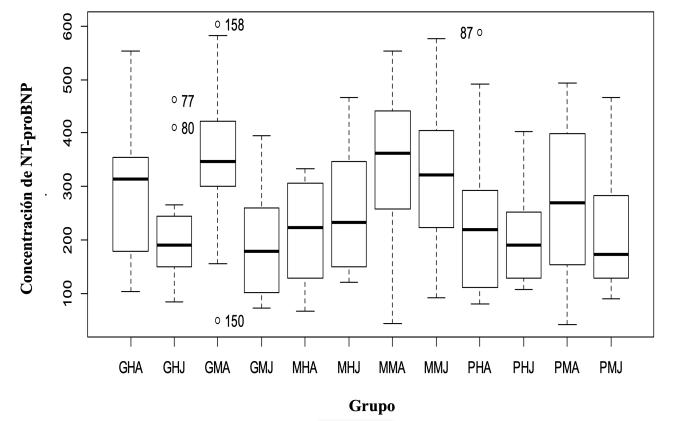
Figura 5. Diagrama de cajas para los 12 grupos incluidos en el ensayo.
Abreviaturas: G = perros talla grande con peso mayor a 25 kg; M = perros talla mediana con peso entre 12 y 25 kg; P = perros talla pequeña con peso menor a 12 kg; H = sexo hembra; M = sexo macho; J = perros edad menor de 7 años y A = perros edad mayor de 7 años. Se observan la homocedasticidad de varianzas (Levene’s Test p = 0.718) y la presencia de valores atípicos en algunos de los grupos.
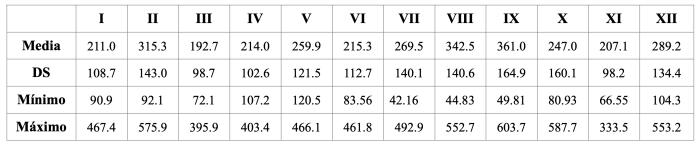
Tabla 2. Concentraciones de NT-proBNP correspondientes a los 12 grupos incluidos en el ensayo.
DS: Desviación estándar. Los valores son expresados en pmol/l. I, II, III, VII, VIII y IX. Hembras. IV, V, VI, X, XI y XII. Machos.
La concentración media para perros de raza pura fue 251.58 pmol/l, con una desviación estándar de ± 136.19 pmol/l y valores mínimo y máximo de 44.83 pmol/l y 603.71 pmol/l. En tanto que, para perros sin raza indefinida o mestizos, la media de NT-proBNP fue de 266.78 pmol/l, con una desviación estándar de ± 136.09 pmol/l y valores mínimo y máximo de 42.16 pmol/l y 575.89 pmol/l (Figura 6).
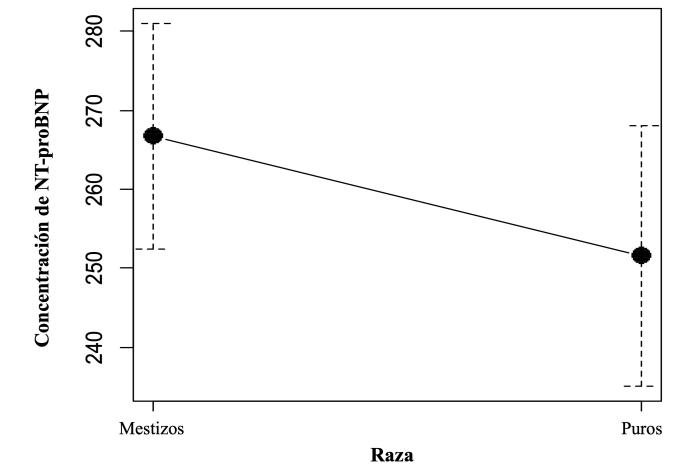
Figura 6. Plot para comparación de medias de las concentraciones de NT-proBNP entre perros de raza pura y mestizos o sin raza definida (p = 0.487).
La concentración de NT-proBNP presentó diferencias estadísticamente significativas respecto a sexo (p = 0.0392) y a edad (p = 0.0124), pero no respecto a la talla del animal (p = 0.183), sobre la base de un análisis de varianza individual.El análisis de varianza para múltiples factores mostró que no se presentan diferencias estadísticamente significativas para las combinaciones sexo/edad (p = 0.107), sexo/talla (p = 0.189) y edad/sexo/talla (p = 0.765), como se observa en las Figuras 7 y 8.
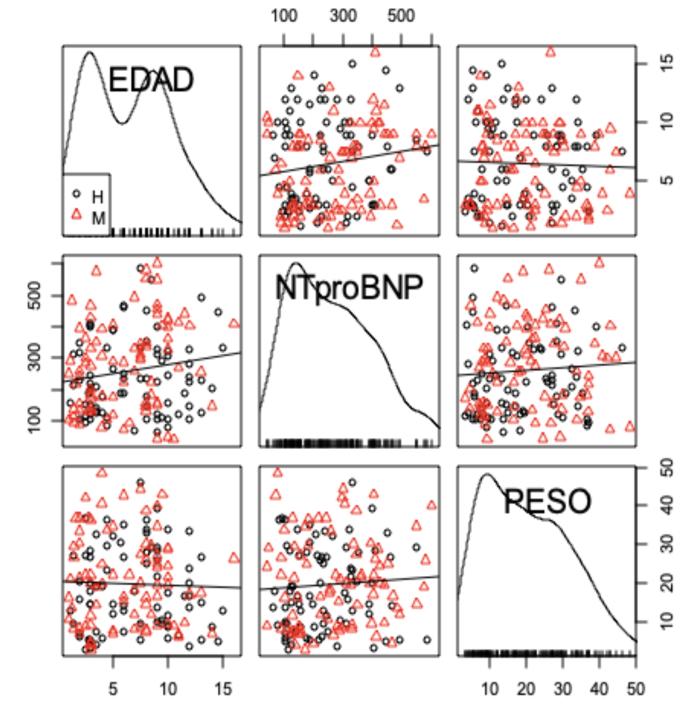
Figura 7. Diagrama de matriz de dispersión que asocia las variables concentración de NT-proBNP/sexo a las variables edad y talla.
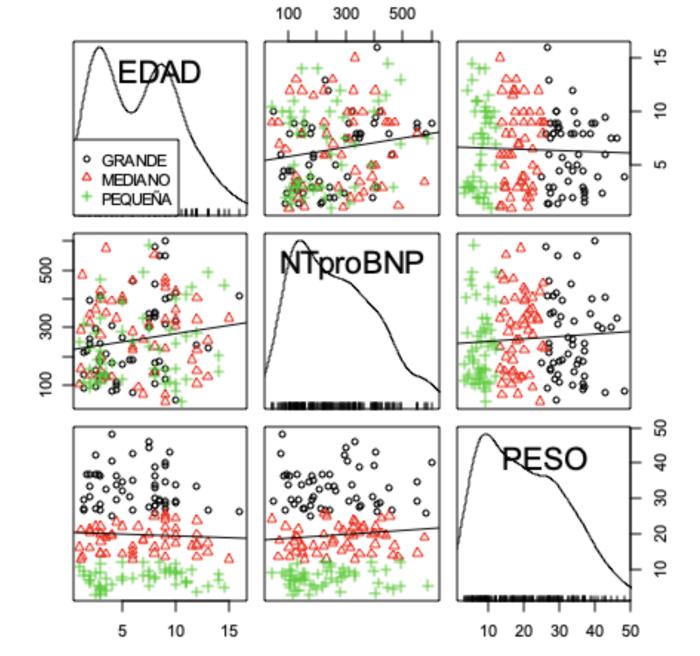
Figura 8. Diagrama de matriz de dispersión que asocia las variables concentración de NT-proBNP/talla a las variables edad y sexo.
El análisis realizado muestra que, además de aumentar la concentración sérica de NT-proBNP con la edad (perros mayores de 7 años presentan concentraciones séricas más altas) y el sexo (machos presentan concentraciones séricas mayores que las hembras), la concentración sérica aumenta con la edad y el incremento de la talla, analizados como variables relacionadas (p = 0.030). El análisis de varianza para los 12 grupos muestra diferencias estadísticamente muy significativas (p = 0.0062), puntualmente, entre perros machos menores de 7 años de más de 25 kg de peso y perros machos mayores de 7 años de más de 25 kg de peso (Figura 9). En contraste, entre el resto de los grupos evaluados a partir de un análisis múltiple de comparación de medias (Tukey Contrasts), no se obtuvieron diferencias estadísticamente significativas (p > 0.05).
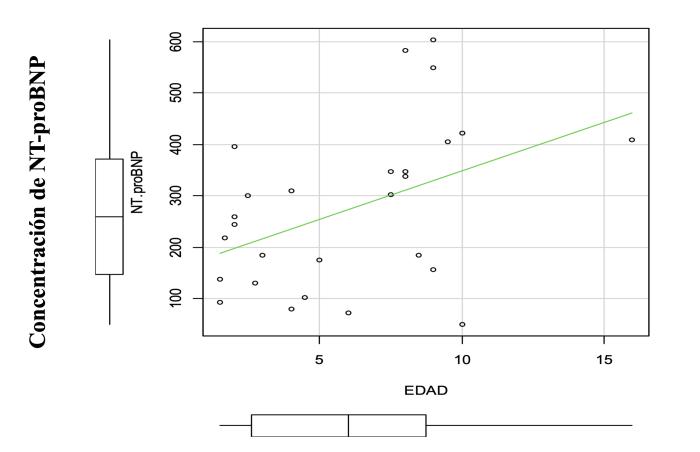
Figura 9. Diagrama de dispersión para la variable concentración de NT-proBNP y edad en perros machos mayores de 25 kg de peso.
Discusión
En el presente trabajo, la concentración de NT-proBNP fue determinada en 159 perros sanos, utilizando estrictos criterios de inclusión, con la finalidad de minimizar causas de variabilidad previas a la determinación. A pesar de estas precauciones, NT-proBNP presentó un coeficiente de variación del 52 %, de forma similar a lo observado por otros investigadores, con una muestra inferior35,43,48,51,58,64. El rango más amplio se presentó en perros machos mayores de 25 kg, observándose diferencias significativas asociadas a la interacción sexo por talla.
La concentración media determinada en este estudio fue similar a las observadas por otros investigadores3,41,55,56,59. Sin embargo, los valores máximos no se corresponden y se solapan, con los valores de corte establecidos por algunas marcas comercialmente disponibles. En este sentido, el 58 % de los perros sanos analizados tuvieron una concentración media de NT-proBNP superior a 210 pmol/l (valor de corte de la prueba ELISA VetSign® Canine CardioScreen, Guildhay Ltd., Biomedica, Vienna) y un 9 % presentaron un valor superior a 445 pmol/l (valor de corte de la prueba ELISA Canine specific IDEXX®). Asimismo, el valor máximo hallado en este trabajo fue similar al observado por otros investigadores3,41, pero ligeramente inferior a otros39.
La concentración de NT-proBNP presentó diferencias estadísticamente significativas asociadas a sexo y edad, de manera similar a estudios multicéntricos realizados en humanos, en muestras de 2000 y 5000 pacientes53,54,65,66. A diferencia de estos trabajos y de otras investigaciones en perros61,68, donde la concentración de NT-proBNP se presentó más elevada en mujeres y hembras caninas, respectivamente; en este ensayo, fueron los perros machos los que evidenciaron una concentración más alta. En ambas especies, por su parte, es la población de adultos gerontes y perros mayores de 7 años, respectivamente, los que mostraron concentraciones de NT-proBNP más elevadas que los pacientes jóvenes, al igual que en el presente estudio. A pesar de esta similitud y de observarse diferencias estadísticamente significativas, las mismas no representan la magnitud observada en pacientes humanos, en los cuales se evidencian variaciones entre 2 y 3 veces en la concentración a favor de los adultos gerontes, respecto a las poblaciones jóvenes. En este estudio solo se demostró un aumento del 30 % en la concentración, a favor de los caninos mayores de 7 años.
En investigaciones realizadas por Misbach et al. (2013), no observaron diferencias significativas asociadas a la edad61. Este hallazgo, no concordante con nuestros resultados, podría atribuirse a que los perros adultos en ese ensayo, no presentaron una edad mayor de 8 años, en comparación con una edad media de 9.75 años (rango 7.2 y 16 años), de nuestro trabajo. Esta última afirmación, muestra similitud con los resultados de Wess et al. (2011), cuando demostró que en perros Doberman Pinscher sanos la concentración de NT-proBNP incrementaba significativamente cuando superaban los 8 años69. A pesar de estas observaciones, los resultados presentados en distintas investigaciones, tanto en el grupo control de perros sanos como de enfermos, respecto a las variables constitutivas sexo y edad, muestran resultados muy dispares44,46. Un importante número de trabajos no observan diferencias significativas asociadas a estas variables, tanto en perros de raza pura como en animales mestizos, a pesar de observar una tendencia a presentarse más incrementada en la población de adultos gerontes3,37,45,57,59,60,62,63,67. Por su parte, las diferencias estadísticamente significativas observadas en este trabajo, como en otros con hallazgos similares, se pueden corresponder con un muestreo homogéneo y al tamaño de muestra utilizado.
La talla no se asoció a variaciones en la concentración de NT-proBNP en la muestra analizada. Todos los perros incluidos presentaron una condición corporal entre 2.5 a 3.5 puntos, score que se consideró como prerrequisito. Sin embargo, esta situación puede entenderse como una limitación, ya que no permite evaluar si la concentración de NT-proBNP, en una población de perros sanos que tenga una condición corporal enmarcada en un rango más amplio, presentará variaciones estadísticamente significativas asociadas al efecto de la grasa corporal, como se ha observado en otras investigaciones59,68.
En conclusión, podemos afirmar que la concentración de NT-proBNP en perros sanos muestra variaciones asociadas al sexo, considerándose mayor en los machos, y a la edad, encontrándose más elevada en perros mayores de 7 años. Ambas variables deben ser consideradas al realizar la interpretación de la concentración de NT-proBNP, tanto en pacientes sanos como enfermos, pero se requiere de un mayor número de trabajos para determinar los factores de ajuste a partir del uso de las distintas marcas comerciales presentes en el mercado veterinario.
Bibliografía
- Luginbühl H, Detweiler DK. Cardiovascular lesions in dogs. An New York Acad Sci 1965;127:517-540.
- Detweiler DK, Patterson DF. The prevalence and types of cardiovascular disease in dogs. Ann New York Acad Sci 1965;127:481-516.
- Oyama MA, Fox PR, Rush JE, et al. Clinical utility of serum N-terminal pro-B-type natriuretic peptide concentration for identifying cardiac disease in dogs and assessing disease severity. J Am Med Assoc 2008;232:1496-1503.
- Wilkins MR, Redondo J, Brown LA. The natriuretic-peptide family. Lancet 1997;349:1307-1310.
- Levin ER, Gardner DG, Samson WK. Natriuretic Peptides. New Eng J Med 1998;339:321-328.
- Turk JR. Physiologic and patophysiologic effects of natriuretic peptides and their implications in cardiopulmonary disease. J Am Vet Med Assoc 2000;216:1970-1976.
- Sisson DD, Oyama MA, Solter PF. Plasma levels of ANP, BNP, epinephrine, norepinephrine, serum aldosterone, and plasma rennin activity in healthy cats and cats with myocardial disease. J Vet Intern Med 2003;17:483-486.
- Boerrigter G, Burnett JC Jr. Recent advances in natriuretic peptides in congestive heart failure. Expert Opin Investig Drugs 2004;13:643-652.
- Tamura N, Ogawa Y, Chusho H, et al. Cardiac fibrosis in mice lacking brain natriuretic peptide. Proc Natl Acad Sci USA 2000;97:4239-4244.
- De Bold AJ. Tissue fractionation studies on the relationship between an atrial natriuretic factor and specific atrial granules. Can J Physiol Pharm 1982;60:324-330.
- Oikawa S, Imai M, Ueno A, et al. Cloning and sequence analysis of polypeptide. Nature 1984;309:724-726.
- Saito Y, Nakao K, Itho H, et al. Brain natriuretic peptide is a novel cardiac hormone. Biochem Biophys Res Commun 1989;158:360-368.
- Sudoh T, Minamino N, Kangawa K, Matsuo H. C-type natriuretic peptide (CNP): a new member of natriuretic peptide familiy identified in porcine brain. Biochem Biophys Res Commun 1990;168:863-870.
- Sudoh T, Kangawa K, Minamino N, Matsuo H. A new natriuretic peptide in porcine brain. Nature 1988;332:78-81.
- Mukoyama M, Nakao K, Hosoda K, et al. Brain natriuretic peptide as a novel cardiac hormone in humans: evidence for an exquisite dual natriuretic peptide system, atrial natriuretic peptide and brain natriuretic peptide. J Clin Invest 1991;87:1402-1412.
- Magga J, Vuolteenabo O, Tokola H, et al. Involvement of transcriptional and posttranscriptional mechanisms in cardiac overload-induced increase of B-type natriuretic peptide gene expression. Circ Res 1997;81:694-702.
- Asano K, Masuda K, Okumura M, et al. Plasma atrial and brain natriuretic peptide levels in dogs with congestive heart failure. J Vet Med Sci 1999;61:523-529.
- Schellenberger U, O´Rear J, Guzzetta A, et al. The precursor to B-type natriuretic peptide is an O-linked glycoprotein. Arch Biochem Biophys 2006;451:160-166.
- Giuliani I, Rieunier F, Larue C, et al. Assay for measurement of intact B-type natriuretic peptide prohormona in blood. Clin Chem 2006;52:1054-1061.
- Liang F, O´Rear J, Schellenberger U, et al. Evidence for functional heterogeneity of circulating B-type natriuretic peptide. J Am Coll Cardiol 2007;49:1071-1078.
- Yan W, Wu F, Morser J, Wu Q. Corin, a transmembrane cardiac serine protease, acts as pro-atrial natriuretic peptide-converting enzyme. Proc Natl Acad Sci USA 2000;97:8525:8529.
- Hooper JD, Scarman AL, Clarke BE, et al. Localization of the mosaic transmembrane serine protease corin to heart myocytes. Eur J Biochem 2000;267;6931-6937.
- Seilhamer JJ, Arfsten A, Miller JA, et al. Human and canine gene homologs of porcine brain natriuretic peptide. Biochem Biophys Res Commun 1989;165:650-658.
- Goetze JP. Biochemistry of pro-B-type natriuretic peptide-derived peptides: the endocrine heart revisited. Clin Chem 2004;50:1503-1510.
- Schellenberg S, Grenacher B, Kaufmann K, et al. Analytical validation of commerdial immunoassays for the measurement of cardiovascular peptides in the dog. Vet J 2008;178:85-90.
- Shimizu H, Masuta K, Aono K, et al. Molecular forms of human brain natriuretic peptide in plasma. Clin Chim Acta 2002;316:129-135.
- Maack T, Suzuki M, Almeida FA, et al. Physiological role of silent receptors of atrial natriurético factor. Science 1987;238:675-678.
- Hogenhuis J, Voors AA, Jaarsma T, et al. Anemia and renal dysfunction are independently associated with BNP and Nt-proBNP levels in patients with heart failure. Eur J Heart Fail 2007;9:787-794.
- Roncon-Albuquerque R, Vasconcelos M, Lourenco AP, et al. Acute changes of biventricular gene expression in volume and right ventricular pressure overload. Life Sci 2006;78:2633-2642.
- Moro C, Berlan M. Cardiovascular and metabolic effects of natriuretic peptides. Fundam Clin Pharmacol 2006;20:41-49.
- Ma KK, Banas K, de Bolt AJ. Determinants of inducible brain natriuretic peptide promoter activity. Regul Pept 2005;128:169-176.
- Rodeheffer RJ. Measuring plasma B-type natriuretic peptide in heart failure. J Am Coll Cardiol 2004;44:740-749.
- Berger R, Huelsman M, Strecker K, et al. B-type natriuretic peptide predicts sudden death in patients with chronic heart failure. Circulation 2002;105:2392-2397.
- Oyama MA, Sisson DD, Solter PF. Prospective screening for occult cardiomyopathy in dogs by measurement of plasma atrial natriuretic peptide, B-type natriuretic peptide, and cardiac troponin-I concentrations. Am J Vet Res 2007;68:42-47.
- Schmidt MK, Reynolds CA, Estrada AH, et al. Effect of azotemia on serum N-terminal pro BNP concentration in dogs with normal cardiac function: A pilot study. J Vet Cardiol 2009;11:81-86.
- Biondo AW, Liu ZL, Wiedmeyer CE, et al. Genomic sequence and cardiac expression of atrial natriuretic peptide in cats. Am J Vet Res 2002;63:236-240.
- Boswood A, Dukes-MacEwan J, Loureiro J, et al. The diagnostic accuracy of different natriuretic peptide in the investigation of canine cardiac disease. J Small Anim Pract 2008;49:26-32.
- Lainchbury JG, Burnnett JC Jr, Meyer D, et al. Effects of natriuretic peptides on load and myocardial function in normal and heart failure dogs. Am J Physiol Heart Circ Physiol 2000;278:33-40.
- Mattin MJ, Brodbelt DC, Church DB, Boswood A. Factors associated with disease progression in dogs with presumed preclinical degenerative mitral valve disease attendingprimary care veterinary practices in the United Kingdom. J Vet Med 2019;33:445e54.
- Borgarelli M, Ferasin L, Lamb K, et al. The predictive value of clinical, radiographic, echocardiographic variables and cardiac biomarkers for assessing risk of the onset of heart failure or cardiac death in dogs with preclinical myxomatous mitral valve disease enrolled in the DELAY study. Journal of Veterinary Cardiology 2021;36:77-88.
- Chanmongkolpanit K, Riengvirodkij N, Channgam P, Kaenchan P, et al. How accurate are NT-proBNP, ANP, and cTnI levels in diagnosing dogs with myxomatous mitral valve disease? Open Veterinary Journal2024;14(6):1426-1441
- Keene BW, Atkins CE, Bonagura JD, Fox PR, et al. ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. J. Vet. Intern. Med. 2019;33:1127–1140.
- Chetboul V, Serres F, Tissier R, et al. Association of plasma N-terminal pro-B-type natriuretic peptide concentration with mitral regurgitation severity and outcome in dogs with asymptomatic degenerative mitral valve disease. J Vet Intern Med 2009;23:984-994.
- Winter RL, Saunders AB, Gordon SG, Buch JS and Miller MW. Biologic variability of N-terminal pro-brain natriuretic peptide in healthy dogs and dogs with myxomatous mitral valve disease. J. Vet. Cardiol. 2017;19(2):124-131.
- Mangkhang K, Punyapornwithaya V, Tankaew P, Pongkan W, Chattipakorn N, Boonyapakorn C. Plasma humanin as a prognostic biomarker for canine myxomatous mitral valvedisease: a comparison with plasma NT-roBNP. Polish Journal of Veterinary Sciences 2018;21(4):673–680.
- Ogawa M, Hori Y, Kanno N, Iwasa N, et al. Comparison of N-terminal pro-atrial natriuretic peptide and three cardiac biomarkers for discriminatory ability of clinical stage in dogs with myxomatous mitral valve disease. J. Vet. Med. Sci. 2021;83(4):705–715
- Häggström J, Meadows J, Olsen LH, et al. Results from the canine LUPA project. Proceedings of the 22th ECVIM-CA Congress. 2012. p. 149-152.
- Cunningham SM, Rush JE, Freeman LM. Systemic inflammation and endothelial dysfunction in dogs with congestive heart failure. J Vet Intern Med 2012;26:547-557.
- Sjöstrand K, Wess G, Ljungvall I, Haggstron J, et al. Breed differences in natriuretic peptides in healthy dogs. J. Vet.Intern. Med. 2014;28:451-457.
- Couto KM, Iazbik MC, Marin LM, Zaldivar-Lopez S, et al. Plasma N-terminal pro-B-type natriuretic peptide concentration in healthy retired racing greyhounds. Vet.Clin. Pathol. 2015;44(3):405-409.
- Gomart S, Allaway D, Harrison M, Dickson D, et al. Long-term biological variability and the generation of a new reference interval for plasma N-terminal pro-B-type natriuretic peptide in Labrador retrievers. Journal of Small Animal Practice 2020;61:368–373.
- Ivasovic F, Matos M, Wyler M, Glaus TM. Effects of Breed, Exercise, and a Two-Month Training Period on NT-proBNP-Levels in Athletic Dogs. Animals 2023;13(16):1-14.
- Loke I, Squire JB, Davies JE, et al. Reference ranges for natriurético peptides for diagnostic use are depended to age, gender and heart rate. Eur J Heart Fail 2003;5:599-606.
- Raymond I, Groenning BA, Hildebrandt, et al. The influence of age, sex and other variables on the plasma level of N-terminal pro brain natriuretic peptide in a large sample of the general population. Heart 2003;89:745-751.
- Takemura N, Toda N, Miyagawa Y, et al. Evaluation of Plasma N-Terminal Pro-Brain natriuretic Peptide (NT-proBNP) Concentrations in Dogs with Mitral Valve Insufficiency. J Vet Med Sci 2009;71(7):925-929.
- Singletary GE, Morris NA, Lynne O´Sullivan SG, et al. Prospective Evaluation of NT-proBNP Assay to Detect Occult Dilated Cardiomyoathy and Predict Survival in Doberman Pinschers. J Vet Intern Med 2012;26:1330-1336.
- Eriksson AS, Jarvinen AK, Eklund KK, et al. Effect of age and body weight on neurohumoral variables in healthy Cavalier King Charles Spaniels. Am J Vet Res 2001;62:1818-1824.
- Kellihan HB, Oyama MA, Reynolds CA, Stepien RL. Weekly variability of plasma and serum Nt-proBNP measurements in normal dogs. J Vet Cardiol 2009;11:96-97.
- Tarnow I, Olsen LH, Kvart C, et al. Predictive value of natriuretic peptide in dogs with mitral valve disease. Vet J 2009;180:95-201.
- Ettinger SJ, Farace G, Forney SD, et al. Evaluation of plasma N-terminal pro-B-type natriuretic peptide concentrations in dogs with and without cardiac disease. J Am Vet Med Assoc 2012;240:171-180.
- Misbach C, Chetboul V, Concordet D, et al. Basal plasma concentrations of N-terminal pro-B-type natriuretic peptide in clinically healtly adult small size dogs: Effect of body weight, age, gender and breed, and reference intervals. Res Vet Sci 2013;95:879-885.
- Brennan C, Gunasekaran T, Sanders RA. Evaluation of plasma N-terminal pro-B-type natriuretic peptide levels in healthy North American Salukis with normal echocardiographic measurements. PLoS ONE 2022;17(1):e0260079.
- Galizzi A, Dossi G, Pocar P, Borromeo V, Locatelli C. Plasma N-terminal pro-B-type natriuretic peptide and urinary aldosterone-to-creatinine ratio in healthy Chihuahuas. BMC Veterinary Research 2024;20:501
- Hezzell MJ, Boswood A, Chang YM, et al. The combined prognostic potential of serum high-sensitivity cardiac troponin I and N-terminal pro-B-type natriureic peptide concentrations in dogs with degenerative mitral valve disease. J Vet Intern Med 2012;26:302-311.
- Redfield MM, Rodeheffer RJ, Jacobsen SJ, et al. Plasma Brain Natriuretic Peptide Concentration Impact of Age and Gender. J Am Coll Cardiol 2002;40(5):976-982.
- Koch AM, Rauh M, Zinc S, et al. Decreasing ratio of plasma N-terminal pro-B-type natriuretic peptide and B-type natriuretic peptide according to age. Acta Paediatr 2006;95:805-809.
- De Francesco TC, Rush JE, Rozanski EA, et al. Prospective Clinical Evaluaction of an ELISA B-Type Natriuretic Peptide Assay in the Diagnosis of Congestive Heart Failure in Dogs Presenting with Cough or Dyspnea. J Vet Intern Med 2007;21:243-250.
- Wolf J, Gerlach N, Weber K, et al. The diagnostic relevance of NT-proBNP and proANP 31-67 measurements in staging of myxomatous mitral valve diasease in dogs. Vet Clin Pathol 2013;42:196-206.
- Wess G, Butz V, Mahling M, Hartmann K. Evaluation of the N-terminal pro-B-type natriurético peptide as a diagnostic marker of various stages of cardiomyopathy in Doberman Pinscher. Am J Vet Res 2011;72:642-649.
 by Multimédica
by Multimédica