Hematuria renal idiopática: manejo en pequeños animales
Resumen breve
En los últimos años los avances a nivel de las distintas técnicas quirúrgicas, así como en el desarrollo de equipos para poderlas llevar a cabo, han permitido el desarrollo de procedimientos urológicos mínimamente invasivos, solos o combinados con cirugía convencional, para el manejo terapéutico de la hematuria renal idiopática en pequeños animales.Índice de contenidos

Introducción
La hematuria es la presencia de un número anormal de glóbulos rojos en la orina, describiéndose una presentación microscópica o macroscópica. La hematuria microscópica se caracteriza por una pequeña cantidad de glóbulos rojos en la orina y solo es visible durante el examen microscópico del sedimento urinario. Por su parte, la hematuria macroscópica ocurre cuando la cantidad de sangre en la orina es de magnitud suficiente como para ser visible a simple vista, pudiendo adquirir la orina un color rosado, rojo o marrón oscuro, e incluso contener coágulos de sangre.
La hematuria renal idiopática, o hematuria esencial benigna, es una causa rara de pérdida de sangre crónica, que en ciertos casos puede llegar a ser potencialmente grave. Esta afección generalmente produce una hematuria que puede ser intermitente y puede ser progresiva o no, que no se encuentra asociada a traumatismos, nefrolitos, neoplasias, coagulopatía, hipertensión u otras causas incluidas en el diagnóstico diferencial de la hematuria con origen la vía urinaria superior (Tabla 1).
|
Tabla 1. Patologías asociadas a hematuria con origen la vía urinaria superior en pequeños animales.
Aunque el primer reporte en humanos es de 1959, en el que se describió un pequeño hemangioma del riñón como etiología de un cuadro de hematuria renal, en medicina veterinaria se han notificado algunos casos de forma esporádica, datando las primeras descripciones de principios de la década de 1980.
Aunque tanto la especie canina como la felina pueden verse afectadas por patologías renales y ureterales que pueden ocasionar cuadros de hematuria, en el pasado muchas de estas solo eran tratables de forma invasiva, p. ej., mediante nefrectomía. Aun así, en los últimos años los avances a nivel de las distintas técnicas quirúrgicas, así como en el desarrollo de equipos para poderlas llevar a cabo, han permitido el desarrollo de procedimientos urológicos mínimamente invasivos, solos o combinados con cirugía convencional, para el manejo terapéutico de la hematuria renal idiopática en pequeños animales.
Presentación clínica
Por lo general la hematuria renal idiopática, o hematuria esencial benigna se presenta principalmente en perros jóvenes de razas grandes, aunque cabe destacar que también se describe en perros geriátricos, así como en razas más pequeñas, e incluso en la especie felina, sin haberse demostrado la existencia de predilección sexual (Figura 1).
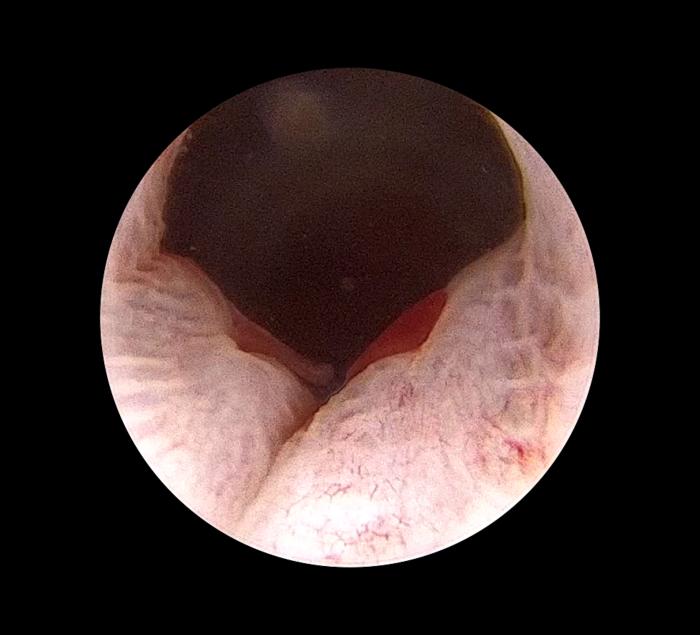
Figura 1. Hematuria renal bilateral en paciente felino.
Se caracteriza por un cuadro de hematuria crónica, a menudo macroscópica, tanto unilateral como bilateral, que generalmente no está asociada con anomalías hematológicas o radiológicas. Además, el sangrado puede provocar la formación de coágulos en la pelvis renal, el uréter o la vejiga, con posible obstrucción del tracto urinario en casos extremos (Figura 2).
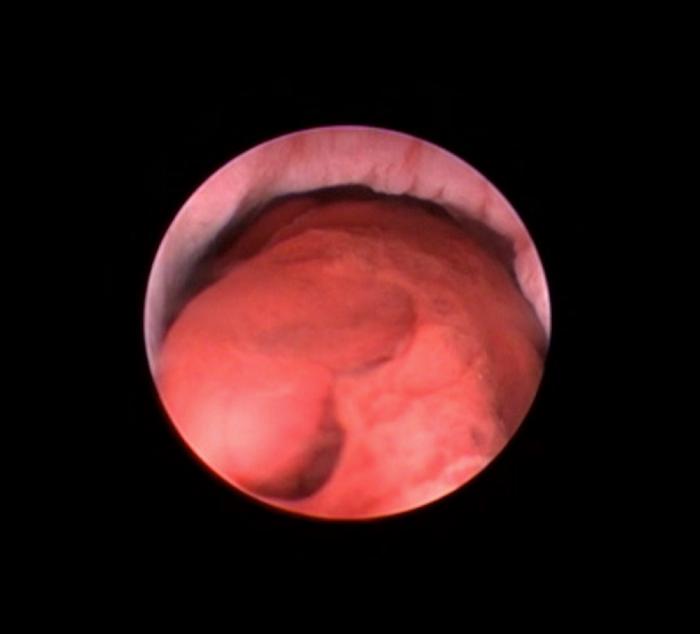
Figura 2. Coágulo responsable de la obstrucción parcial del esfínter uretral interno en paciente canino.
En los seres humanos, las anomalías vasculares renales, como los hemangiomas, los angiomas papilares y las roturas venosas suelen ser la causa de la hematuria renal, habiendo sido descritas también en pequeños animales. Aunque el curso a largo plazo parece ser benigno, los episodios frecuentes de hematuria pueden provocar anemia por deficiencia de hierro, cólico ureteral y obstrucciones ureterales y/o uretrales.
Diagnóstico
La existencia de un cuadro clínico de hematuria macroscópica, hematuria microscópica persistente o recurrente, así como de un episodio único de hematuria microscópica asociada con otros hallazgos anormales (p. ej., estranguria, polaquiuria) es una indicación para la realización de pruebas diagnósticas para determinar el origen de la hematuria.
Cabe recordar que el momento de la hematuria macroscópica durante la micción puede ayudar a acotar la localización anatómica del origen del cuadro de hematuria. La presencia de sangre durante la primera fracción de la orina, o incluso independientemente de la orina, tiende a estar asociada con enfermedades de la uretra, próstata, o del tracto genital, mientras que la hematuria durante la fase final de la micción sugiere una lesión focal en la región ventral o ventrolateral de la vejiga. Además de los trastornos de la vejiga urinaria, se puede observar hematuria durante la fase final de la micción en pacientes con hematuria renal intermitente. Por su parte, la hematuria que ocurre durante toda la micción puede estar asociada con coagulopatías o a trastornos renales, ureterales o vesicales, especialmente en lesiones de distribución difusa a nivel de la mucosa vesical. También es posible que se produzca hematuria total como consecuencia de trastornos graves de la uretra o la próstata que provocan el reflujo de sangre hacia la vejiga urinaria.
El diagnóstico de la hematuria renal idiopática o hematuria esencial benigna requiere de la visualización directa del jet ureteral a nivel del orificio ureteral, principalmente mediante exploración endoscópica del trígono vesical durante la uretrocistoscopia (Figura 3).
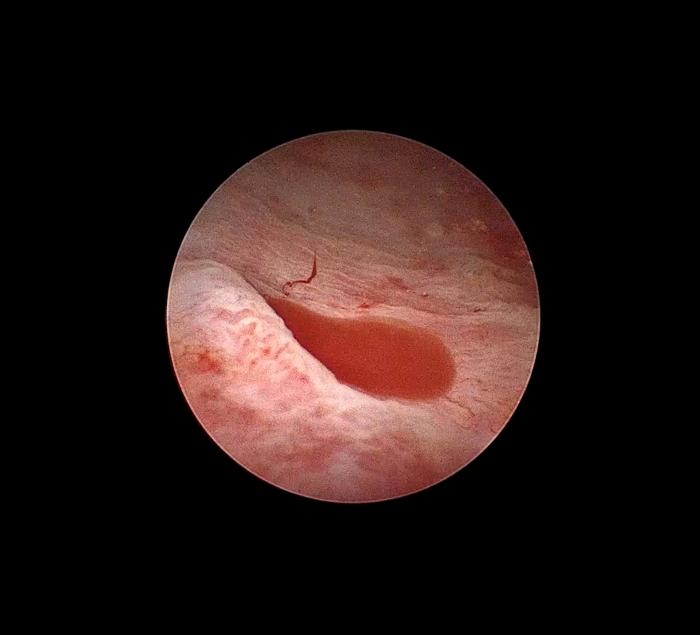
Figura 3. Hematuria renal unilateral derecha en paciente canino.
Debido al sangrado intermitente en algunos casos, la exploración endoscópica puede revelar jets de orina macroscópicamente normales si no hay sangrado activo en el momento de la exploración. En estos casos, la endoscopia debe repetirse tan pronto como el propietario identifique la recidiva del cuadro de hematuria macroscópica. Es por ello que en medicina humana se ha llegado a recomendar la realización de una actividad física extenuante antes de la exploración endoscópica del trígono vesical, con el fin de incrementar la probabilidad de detectar hemorragia en pacientes sin hematuria macroscópica.
Aunque la exploración endoscópica del trígono vesical es el método de diagnóstico de elección para determinar la existencia de hematuria renal idiopática, o hematuria esencial benigna en pequeños animales, determinando incluso si se trata de un cuadro uni o bilateral, el desarrollo de ureteroscopios de menor diámetro ha permitido que se pueda llegar a realizar la identificación de la lesión a nivel de la pelvis renal en aquellos casos en los que el diámetro ureteral permita el paso de este tipo de equipos. Aun así, y debido al pequeño tamaño del uréter canino (0.5-2.0 mm) y felino (0.3-0.4 mm) generalmente no se adapta fácilmente a un ureteroscopio sin dilatación manual o pasiva, esto se puede lograr de manera suficiente en algunos pacientes mediante la implantación de un stent ureteral de forma de temporal, durante las semanas previas a la exploración endoscópica de la pelvis renal, a través de una ureteroscopia retrógrada.
Manejo médico
En los últimos años se han descrito diferentes alternativas en cuanto al manejo médico de la hematuria renal idiopática o hematuria esencial benigna, basándose tanto en la administración de inhibidores de la enzima convertidora de angiotensina (IECA), bloqueantes de los receptores de angiotensina (BRA), agentes antifibrinolíticos como el ácido tranexámico, así como el ácido aminocaproico o Yunnan Baiyao.
Los inhibidores de la enzima convertidora de angiotensina (IECA), así como los bloqueantes de los receptores de angiotensina (BRA) se utilizan comúnmente para el manejo de la proteinuria glomerular, actuando de forma preferencial mediante la dilatación de la arteriola glomerular eferente y consecuente reduciendo la presión intraglomerular.
Se han descrito que más del 40 % de los perros tratados con IECA o BRA alcanzan la resolución de la hematuria macroscópica y microscópica, aunque también se ha defendido que la existencia de cuadros de hematuria renal idiopática, o hematuria esencial benigna autolimitantes, lo que plantea la posibilidad de que la mejora espontánea también pueda ocurrir en algunos casos esporádicos.
El grupo de trabajo de Kortum y colaboradores comparó en 2021 el manejo médico de la hematuria renal idiopática, o hematuria esencial benigna en la especie canina con IECA o BRA, con los resultados obtenidos por el grupo de trabajo de Berent y colaboradores en 2013, mediante su manejo con escleroterapia con povidona yodada y nitrato de plata. De dicha comparación se demostró que el tratamiento médico sugerido por el grupo de trabajo de Kortum y colaboradores duplicaba la tasa de respuesta positiva en los pacientes tratados con IECA o BRA respecto a los manejados con escleroterapia. Esto sugiere que el manejo médico de la hematuria renal idiopática, o hematuria esencial benigna merece más atención dentro de las distintas opciones terapéuticas a tener en cuenta.
Manejo mínimamente invasivo
Escleroterapia
La escleroterapia consiste en la instilación tópica de sustancias para conseguir la cauterización de la lesión sangrante en el interior de la pelvis renal. Los agentes esclerosantes que se suelen emplear son el nitrato de plata y/o la povidona yodada. El nitrato de plata coagula la proteína celular produciendo una escara; mientras que povidona yodada tiene un efecto oxidativo y de granulación sobre el tejido. Cuando se emplean juntos se puede desarrollar un efecto de quimiocauterización sinérgico. Por este motivo, el protocolo inicial de escleroterapia descrito en la especie canina defiende la instilación seriada de estas dos soluciones. No obstante, otros trabajos posteriores han empleado tan solo nitrato de plata o povidona yodada por separado y con éxito; aunque el número de casos descritos es limitado.
Así, la escleroterapia es la técnica de elección para el tratamiento de la hematuria esencial benigna cuando el tratamiento médico descrito previamente no tiene un resultado satisfactorio. Se trata de un procedimiento mínimamente invasivo que se puede llevar a cabo mediante abordaje endourológico, con guía cistoscópica y fluoroscópica, por lo que es posible realizarlo en pacientes de todos los tamaños. La tasa de éxito descrita oscila en torno al 85 %, con resolución de la hematuria macroscópica dentro de los 7 primeros días tras el tratamiento. Una de las principales complicaciones que puede suceder es el daño de la pared ureteral por estas sustancias abrasivas, con el consiguiente riesgo de provocar una perforación ureteral u obstrucción por ureteritis, edema o estenosis ureteral. Por este motivo, durante la instilación de los agentes esclerosantes, resulta fundamental emplear un balón a nivel de la unión pieloureteral, con el objetivo de evitar el contacto de las soluciones con la pared ureteral.
Además, de este modo, se optimiza el contacto del agente con la mucosa pélvica, maximizando el efecto de coagulación sobre la misma. Otra medida fundamental para reducir el riesgo de daño ureteral es implantar un catéter ureteral doble jota durante unas 2-4 semanas tras la realización del procedimiento. Esto es debido a que los catéteres ureterales favorecen la cicatrización de las lesiones del uréter; pero a su vez, inducen una dilatación pasiva del mismo. De este modo, se reduce la aparición de estenosis y el uréter queda preparado para una intervención posterior (p. ej., ureteroscopia con electrocauterio) si este primer abordaje fracasa.
Para realizar el procedimiento, los pacientes se preparan para una uretrocistoscopia convencional. Para ello, se lleva a cabo el rasurado y la antisepsia quirúrgica de la región perivulvar en las hembras y prepucial en los machos. En cualquier caso, se procede a realizar una sutura en bolsa de tabaco alrededor del esfínter anal y se instaura la correspondiente profilaxis antibiótica. Las hembras se posicionan en decúbito dorsal con su extremo caudal al borde de la mesa y se lleva a cabo una uretrocistoscopia transuretral rígida (óptica de 1.9 mm; 2.7 mm o 4 mm, 30º y canal de trabajo; o bien cistoscopio integrado). Los machos de la especie canina, por su parte, pueden posicionarse en decúbito dorsal o ligeramente oblicuo, con el riñón a intervenir en posición superior, para realizar una uretrocistoscopia flexible (endoscopio flexible de 7.5-8.1 F de diámetro con canal de trabajo). Se recomienda realizar la irrigación durante la cistoscopia con dextrosa al 5 %, en lugar de suero salino fisiológico, ya que previene la lisis de los glóbulos rojos presentes en la orina y mejora la visualización. Una vez en el trígono vesical, se identifica cada orificio ureteral y se explora durante al menos 30 segundos para poder valorar varios jets ureterales y confirmar el lado afectado. En este momento, se inserta a través del canal de trabajo del endoscopio una guía hidrofílica (0.018-0.038”; con mayor frecuencia 0.035”) y se cateteriza el orificio ureteral a intervenir.
Bajo control fluoroscópico, la guía se avanza por el uréter hasta que queda alojada en el interior de la pelvis renal (Figura 4).
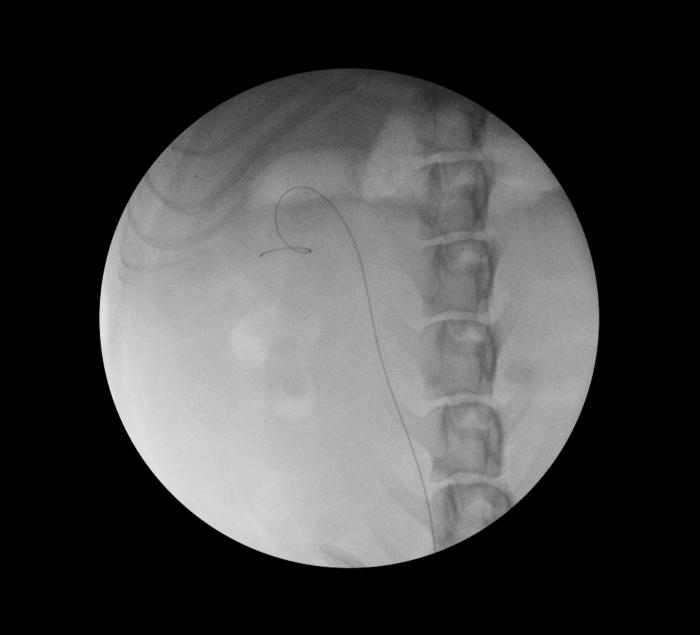
Figura 4. Monitorización fluoroscópica de la guía hidrofílica a nivel de pelvis renal.
Coaxialmente a la guía, se inserta un catéter ureteral (3-5 F) hasta uréter proximal, se retira la guía hidrofílica y se extrae una muestra de orina de orina para cultivo microbiológico. Acto seguido, se confirma la ausencia de otras lesiones en el tracto urinario superior, mediante una ureteropielografía retrógrada, con contraste yodado al 50 % (Figura 5).
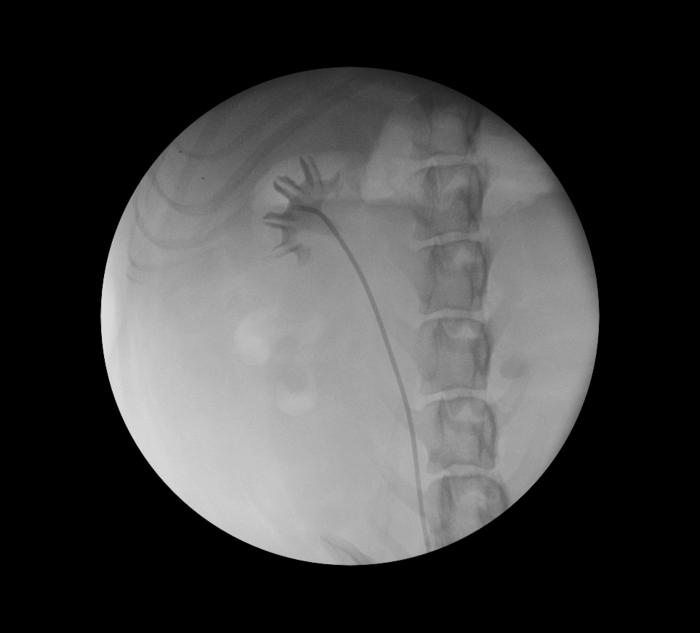
Figura 5. Ureteropielografía mediante control fluoroscópico.
Se deja que todo el contraste se vacíe mediante un drenaje pasivo y el peristaltismo ureteral. En este momento, se introduce nuevamente la guía hidrofílica hasta la pelvis renal y se sustituye el catéter ureteral por un catéter-balón (catéter 3-5 F, balón 2-8 mm) . El catéter-balón se aloja en uréter proximal y se instila aire o agua destilada estéril en su interior, posicionando al paciente en Trendelenburg.
En este momento, y con el balón ocluyendo el uréter, se retira la guía hidrofílica y se procede a determinar el volumen de la pelvis renal, mediante la administración gradual de contraste yodado al 50 % hasta que se consigue una opacificación completa de todos los recesos papilares, pero sin provocar sobredistensión de la pelvis renal. Este volumen será el empleado para cada una de las instilaciones de las soluciones esclerosantes. La primera de ellas consiste en una mezcla de 1 parte de povidona yodada al 5 %, 1 parte de contraste yodado y 3 partes de dextrosa al 5 %, realizando dos instilaciones de esta mezcla, introduciendo en cada una de ellas el volumen determinado previamente durante, al menos, unos 10-20 minutos (Figura 6).
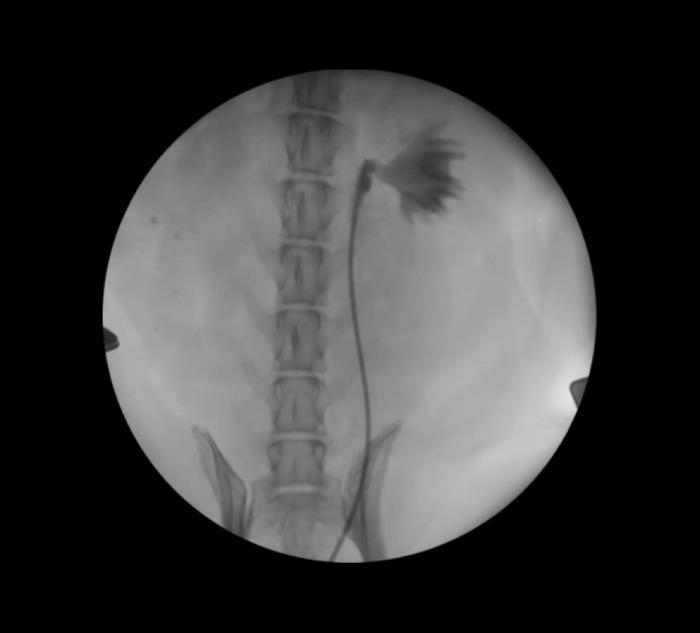
Figura 6. Instilación de solución esclerosante bajo control fluoroscópico.
Trascurrido este tiempo, se vacía mediante drenaje pasivo a través del canal del catéter balón. Cabe destacar que una vez se ha comprobado la ausencia de contraste en la pelvis renal, es recomendable vaciar el balón durante unos 10 minutos para evitar isquemia de la pared ureteral. Con el balón nuevamente insuflado y ocluyendo el uréter, se procede a completar otras dos instilaciones del volumen calculado con anterioridad, en este caso, con una solución de nitrato de plata estéril al 0.5-1 %, durante otros 10-20 minutos cada una de ellas. El nitrato de plata no se debe mezclar con contraste para evitar la precipitación de las sales que podrían inducir una posterior obstrucción ureteral. Al igual que con la primera solución, transcurrido el tiempo de contacto, el vaciado se consigue mediante drenaje pasivo a través del catéter.
Una vez se ha recuperado todo el volumen introducido en la pelvis renal, se vacía el balón ureteral, se posiciona nuevamente al paciente en posición neutral, deshaciendo el Trendelenburg, verificandola ausencia de lesiones en la vía urinaria superior mediante una ureteropielografía retrógrada con contraste yodado al 50 %, que se permite drenar hasta vejiga de la orina a través del peristaltismo ureteral. En este momento, a través de catéter se introduce la guía hidrofílica hasta pelvis renal y el catéter-balón se retira para alojar una catéter ureteral doble jota. Si no hay complicaciones, el catéter se puede retirar en 2-4 semanas.
Ureteroscopia con electrocauterio
La ureteroscopia con coagulación térmica de la lesión sangrante representa la técnica de elección en medicina humana, con una tasa de éxito que supera el 90 %. No obstante, el reducido diámetro ureteral limita este abordaje en la especie canina y lo imposibilita en la felina. Por este motivo, la ureteroscopia con electrocauterio es la alternativa a considerar cuando el tratamiento médico y la escleroterapia no han conseguido resultados favorables clínicamente.
La ureteroscopia retrógrada se puede llevar a cabo con un ureteroscopio rígido o flexible de unos 7.5-8 F de diámetro en perros > 20 kg. En pacientes de menor tamaño, es posible emplear ureteroscopios pediátricos o sistemas miniperc, ambos semirrígidos de unos 4.5-5 F de diámetro (Figura 7).

Figura 7. Ureteroscopios pediátricos de 4.8 F (izquierda) y telescopado de 4.5-6.5 F (derecha).
A pesar del tamaño reducido de estos equipos, la ureteroscopia retrógrada habitualmente requiere que el uréter haya sido preparado previamente mediante la disposición de un catéter ureteral doble J. Esto es debido a que el catéter induce una dilatación pasiva del diámetro ureteral a partir de las 3-6 semanas de su disposición, pero además consigue un tono más laxo de su musculatura, por lo que la técnica se puede llevar a cabo de manera más segura.
Para realizar el procedimiento en las hembras, se completa una uretrocistoscopia transuretral rígida como se ha descrito previamente y se cateteriza el orificio ureteral con una guía hidrofílica de tamaño apropiado hasta alojarla a nivel de la pelvis renal. Es recomendable, emplear dos guías hidrofílicas, una de seguridad que permanece en su posición durante toda la intervención y una segunda guía sobre la que se hace avanzar el ureteroscopio de manera coaxial a la misma (Figura 8).
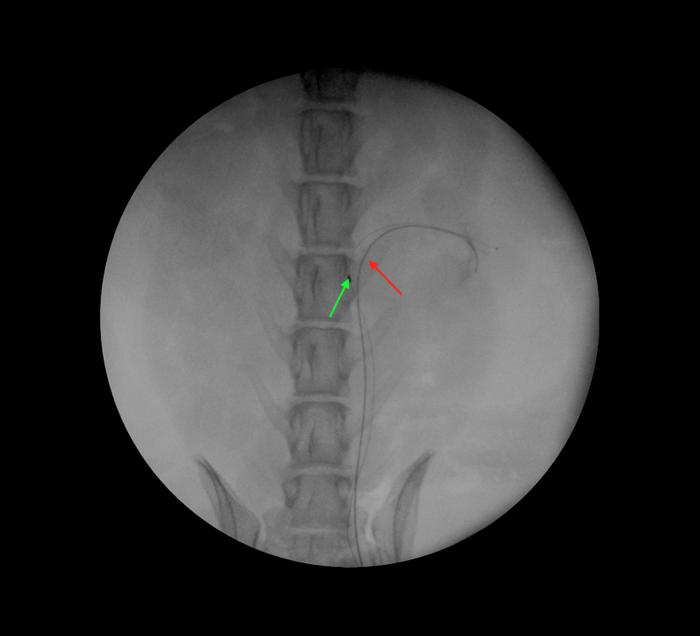
Figura 8. Control fluoroscópico del empleo de dos guías hidrofílicas para el acceso endoscópico retrógrado. La guía de seguridad de 0.035" permanece en la pelvis renal durante todo el procedimiento (flecha roja); mientras que el ureteroscopio se avanza sobre la guía de 0.018 (flecha verde).
Durante todo el procedimiento, la irrigación de fluido se realiza de manera manual, para evitar la sobredistención y daño renal. Es posible emplear una dilución al 25 % de contraste yodado para monitorizar fluoroscópicamente que no hay sobredistención renal durante la ureteroscopia (Figura 9).
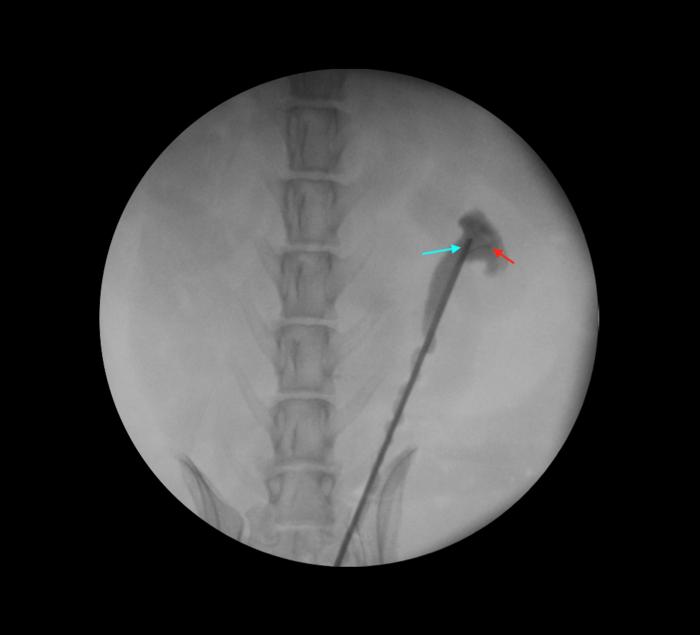
Figura 9. Control fluoroscópico del ureteroscopio a nivel de la pelvis renal (flecha azul), manteniendo la guía de seguridad en su localización inicial (flecha roja).
Una vez que el endoscopio se encuentra en el interior de la pelvis renal, se procede a explorar cada receso papilar para encontrar el origen del sangrado. La manipulación a este nivel debe ser cuidadosa para evitar iatrogenias como perforación o incluso avulsión del uréter. Si la pelvis renal no está dilatada, la exploración puede verse reducida, ya que el ángulo de la pelvis renal puede limitar el acceso del endoscopio hacia el polo inferior, incluso cuando se emplea un endoscopio flexible (Figura 10).
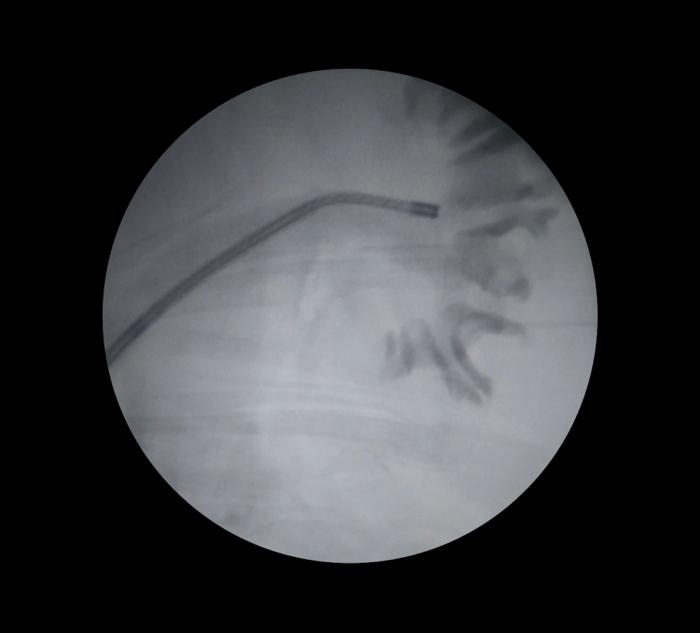
Figura 10. Control fluoroscópico del acceso retrógrado a pelvis renal con ureteroscopio flexible.
Si es posible identificar la lesión sangrante, se procede a introducir por el canal de trabajo del ureteroscopio una fibra láser (diodo/Ho-YAG/Tulio) o bien de electrocoagulación para la cauterización de la misma.
Completado el procedimiento, se realiza una ureteropielografía de contraste, para verificar la ausencia de extravasación de contraste y se procede a retirar el endoscopio de manera progresiva para explorar la mucosa ureteral y confirmar la ausencia de lesiones. Durante la retirada del ureteroscopio, se debe prestar especial atención a mantener la guía de seguridad alojada a nivel de la pelvis renal. Así, una vez completada la intervención, esta guía se emplea para colocar un catéter ureteral doble jota, que se podrá retirar entre 3-9 semanas, en función de las lesiones evidenciadas durante la retirada del endoscopio.
Por su parte, en los machos de la especie canina, la flexura peneana imposibilita la ureteroscopia retrógrada. En estos casos, se puede recurrir a efectuar un abordaje perineal o bien una cistoscopia guiada por cistotomía.
Embolización arterial renal selectiva
El tercer método intervencionista para el tratamiento de la hematuria esencial benigna es la embolización arterial selectiva. Se trata de una técnica escasamente descrita como indicación de esta afección y cuyo fundamento subyace en la oclusión de la rama arterial que origina el sangrado. Debido a que el intervencionismo vascular conlleva mayor invasividad; así como una tasa de complicaciones más grave, este procedimiento queda relegado a aquellos casos refractarios al tratamiento médico, escleroterapia y que no se haya podido completar la ureteroscopia para la cauterización de la lesión sangrante.
Al igual que en las técnicas anteriores, este procedimiento comienza mediante la identificación del orificio ureteral afectado por el sangrado ya que, durante la realización del procedimiento, se llevará a cabo una monitorización de la respuesta a dicho manejo mediante control endoscópico a nivel del trígono vesical. Posteriormente se procede a realizar el acceso vascular arterial, siendo la arteria femoral de elección sobre el carotídeo por reducir el riesgo de tromboembolismo cerebral. El acceso vascular arterial puede conseguirse de manera percutánea o realizando una disección abierta de la arteria femoral, lo que permite un mejor control del sangrado al concluir el procedimiento. Una vez la arterial femoral está expuesta, se implanta un introductor vascular de diámetro adecuado al paciente mediante técnica de Seldinger. Es en este momento cuando se introduce una guía hidrofílica curva (p. ej., 0,035”) montada sobre un catéter angiográfico cuyo extremo se orienta hacia el riñón ipsilateral al sangrado. Se avanza la guía y el catéter sobre la aorta hasta la altura de la arteria renal. A este nivel, se introduce la guía hidrofílica en la rama principal de la arteria renal y se avanza el catéter sobre la guía. La guía se retira y se procede a realizar una angiografía selectiva, poniendo de manifiesto la anatomía arterial intrarrenal ipsilateral al sangrado (Figura 11).
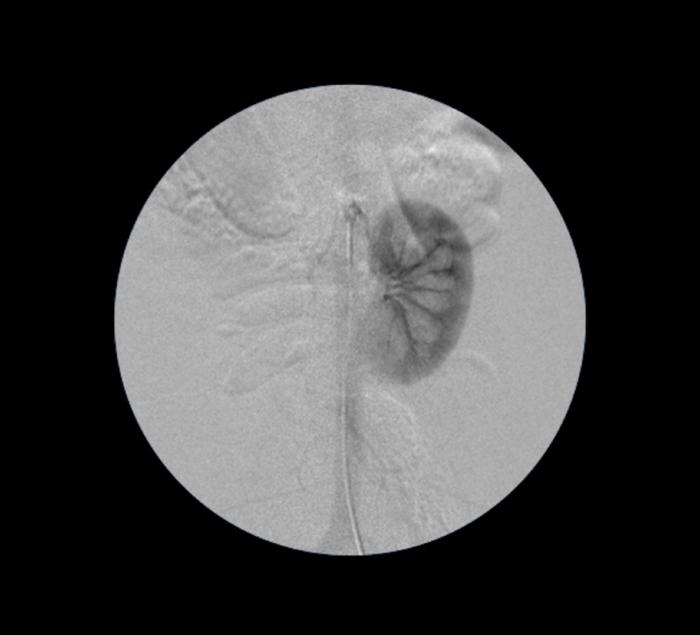
Figura 11. Angiografía selectiva del riñón izquierdo en paciente canino.
Empleando el modo substracción, se procede a la cateterización supraselectiva de cada una de las ramas arteriales (3 dorsales y 3 ventrales), llevando a cabo una oclusión con balón de cada una de ellas. Durante la oclusión de cada rama, el endoscopista debe llevar a cabo la monitorización del jet ureteral, ya que cuando la oclusión de una rama arterial provoca el cese del sangrado, se considera este el origen de la hematuria y se procede a su embolización mediante agentes embolizantes (p. ej., microesferas) o mediante coils.
Control posquirúrgico
Después del procedimiento se debe instaurar antibioterapia profiláctica durante al menos 10 días y analgesia a demanda. En aquellos pacientes donde se ha detectado una lesión ureteral, p. ej. edema, erosión o inflamación, puede resultar de utilidad el tratamiento con corticoesteroides a dosis antiinflamatoria durante las siguientes 24 horas. Asimismo, y ante la existencia de signos de obstrucción ureteral, aun siendo parcial y con el catéter doble jota, se recomienda tratamiento con antagonistas alfa-1 (p. ej., tamsulosina).
Aunque en muchos casos el procedimiento puede ser de carácter ambulatorio, los autores recomiendan la hospitalización del paciente durante las primeras 24 horas, con el fin de monitorizar la evolución de la hematuria y administrar tratamiento de soporte para la posible obstrucción ureteral que los coágulos de sangre pudiesen ocasionar.
El seguimiento posterior se basa en la realización de urianálisis que incluyan urocultivo, hemograma, perfil bioquímico de funcionalidad renal y control ecográfíco a las 24 horas y cada 2 semanas mientras esté implantado el catéter ureteral doble J. Una vez retirado, se recomienda que este seguimiento se lleve a cabo a los 2 meses y posteriormente cada 3 meses durante el primer año.
Discusión
La hematuria renal idiopática o hematuria esencial benigna en pequeños animales es una afección poco frecuente que cursa con un sangrado constante o intermitente en la vía urinaria superior, cuyo mayor riesgo es el desarrollo de cuadros de anemias graves e incluso el desarrollo de una obstrucción ureteral o uretral secundaria a coágulos sanguíneos.
Dicha hematuria no está relacionada con la presencia de otras alteraciones como traumatismos, neoplasias o litiasis. Por ello, su diagnóstico se establece descartando otras posibles causas sistémicas y locales de hematuria. En este sentido, la cistoscopia juega un papel fundamental ya que identifica que el sangrado proviene de la vía urinaria superior y es capaz también de identificar el lado afectado.
Aunque el manejo médico de la hematuria renal idiopática, o hematuria esencial benigna merece más atención dentro de las distintas opciones terapéuticas a tener en cuenta, cabe destacar que entre un 20-30 % de los pacientes tienen una presentación bilateral en el momento del diagnóstico, pero en los casos unilaterales, estos pueden evolucionar hacia el riñón contralateral. Es por ello que la nefrectomía no está indicada como manejo de primera elección en los casos de hematuria renal idiopática o hematuria esencial benigna en pequeños animales, salvo en situaciones críticas, ya que la nefrectomía del riñón afectado no descarta que pueda desarrollarse un cuadro de hematuria renal en el riñón contralateral.
Bibliografía recomendada
- Adelman LB, Bartges J, Whittemore JC. Povidone iodine sclerotherapy for treatment of idiopathic renal hematuria in two dogs. Journal of the American Veterinary Medical Association, 2017;250(2): 205–10.
- Berent A. (2015). Interventional treatment of idiopathic renal hematuria.Veterinary Image‐Guided Interventions, 301-308.
- Berent A. New techniques on the horizon: Interventional radiology and interventional endoscopy of the urinary tract (‘endourology’Journal of feline medicine and surgery, 2014; 16(1):51–65.
- Berent AC, Weisse CW, Branter E, et al. Endoscopic-guided sclerotherapy for renal-sparing treatment of idiopathic renal hematuria in dogs: 6 cases (2010– 2012). Journal of the American Veterinary Medical Association, 2013;242(11):1556–63.
- Berent, A.C. (2015). Interventional urology: endourology in small animal veterinary medicine.Veterinary Clinics: Small Animal Practice,45(4), 825-855.
- Berent, A.C. (2016). Interventional radiology of the urinary tract.Veterinary Clinics: Small Animal Practice,46(3), 567-596.
- Di Cicco MF, Fetzer T, Secoura PL, et al. Management of bilateral idiopathic renal hematuria in a dog with silver nitrate. The Canadian Veterinary Journal,2013;54(8):761–4.
- Forrester, S. D. (2004). Diagnostic approach to hematuria in dogs and cats.Veterinary Clinics: Small Animal Practice,34(4), 849-866.
- Gallagher, A. (2018). Interventional radiology and interventional endoscopy in treatment of nephroureteral disease in the dog and cat.Veterinary Clinics: Small Animal Practice,48(5), 843-862.
- Hawthorne J, deHaan J, Goring R, et al. Recurrent urethral obstruction secondary to idiopathic renal hematuria in a puppy. Journal of the American Animal Hospital Association, 1998;34(6): 511–4.
- Heilmann RM, Thieman-Mankin KM, Cook AK. Bilateral renal sclerotherapy as a treatment option in a mixed breed male dog with idiopathic renal haematuria. Tierarztliche Praxis. Ausgabe K, Kleintiere/heimtiere, 2015;43(4):253–9.
- Hitt, ME, Straw, RC, Lattimer, JC, Shaw, DP, Weide, KD, & Smith, C. (1985). Idiopathic hematuria of unilateral renal origin in a dog.Journal of the American Veterinary Medical Association,187(12), 1371-1373.
- Holt, PE, Lucke, VM, Pearson, H. (1987). Idiopathic renal haemorrhage in the dog.Journal of Small Animal Practice,28(4), 253-263.
- Kortum, AJ, Bazelle, J, Gomez Selgas, A, Kent, ACC, Williams, TL, Herrtage, ME. (2021). A retrospective study of canine idiopathic renal haematuria: clinical findings and outcome following medical treatment.
- Mishina M, Watanabe T, Yugeta N, et al. Idiopathic renal hematuria in a dog; the usefulness of a method of partial occlusion of the renal artery. Journal of veterinary medical science 1997; 59(4):293–8.
- Stone, EA, DeNovo, RC, Rawlings, C.A. (1983). Massive hematuria of nontraumatic renal origin in dogs.Journal of the American Veterinary Medical Association,183(8), 868-871.
 by Multimédica
by Multimédica