Parálisis laríngea en perros
Resumen breve
La parálisis laríngea, en particular en su forma adquirida, puede representar una manifestación de una enfermedad neurológica sistémica subyacente. Su diagnóstico y tratamiento requieren un enfoque multidisciplinario, orientado a mejorar tanto el pronóstico como la calidad de vida del animal afectado.Índice de contenidos
Introducción
La parálisis laríngea se caracteriza por un fallo completo o parcial en la capacidad de los cartílagos aritenoides y de las cuerdas vocales para realizar la abducción durante la inspiración del paciente1. Esta enfermedad es consecuencia de una disfunción del músculo cricoaritenoideo dorsal o de las estructuras que inervan la laringe como el nervio laríngeo recurrente, el nervio vago y/o el núcleo ambiguo de la médula1. Esta alteración provoca una obstrucción de la vía aérea superior, lo que da lugar a disnea de una intensidad variable, y en algunos casos graves, puede llegar a comprometer la vida del paciente. Aunque la parálisis laríngea también se ha descrito en el paciente felino, su incidencia es mucho menor en comparación con el paciente canino1.
Anatomía laríngea
La laringe en perros se encuentra suspendida en posición ventral al cráneo mediante el aparato hioideo. Está formada por cinco cartílagos principales: cartílago epiglótico (entrada de la laringe y actúa como barrera durante la deglución); cartílago tiroides (forma las paredes laterales y ventrales); cartílago cricoides (situado en la zona más caudal y en forma de anillo); y por último los aritenoides (son pares y se sitúan craneal al cricoides, controla el movimiento de las cuerdas vocales). Cada aritenoides dispone de un proceso muscular donde se inserta el músculo cricoaritenoideo dorsal (cuyo origen es el cartílago cricoides), un proceso corniculado situado en la zona más caudal del cartílago, un proceso cuneiforme en la zona más rostral del aritenoides y el proceso vocal donde se inserta el músculo vocal (originario en el cartílago tiroides). La abertura delimitada por los cartílagos aritenoides y las cuerdas vocales, se denomina rima glottidis, la cual permite el paso del flujo de aire hacia la tráquea2.
La musculatura laríngea tiene un papel clave en la regulación del diámetro de la rima glottidis. Su funcionamiento es esencial en la regulación del flujo de aire, la protección de las vías respiratorias inferiores frente a la aspiración del contenido alimenticio durante la deglución, y el control de la vocalización y ladrido Se divide en dos grandes grupos: músculos dilatadores (responsables de la abducción) y músculos constrictores (implicados en la aducción)2.
De entre los músculos laríngeos, el aritenoideo dorsal es el más relevante a nivel fisiológico y quirúrgico, ya que tiene la mayor responsabilidad en la apertura de la rima glottidis. La contracción de este músculo produce una rotación y abducción de los cartílagos aritenoideos, además de desplazar lateralmente las cuerdas vocales2.
La inervación de la laringe en perros está principalmente a cargo de dos nervios, ambos procedentes del nervio vago o X par craneal. El nervio laríngeo craneal inerva el músculo cricotiroideo; además es probable que inerve las papilas gustativas de la epiglotis y de la mucosa de la laringe ya que los receptores encontrados en estas estructuras son los que inician el cierre de la epiglotis durante la deglución. Por otra parte, encontramos el nervio laríngeo caudal, que procede del nervio laríngeo recurrente y este a su vez del nervio vago. Es el encargado de la función motora de todos los músculos intrínsecos de la laringe a excepción del músculo cricotiroideo3,4.
Etiología
La parálisis laríngea es una afección respiratoria que puede presentarse de forma unilateral o bilateral. Se han descrito tanto formas congénitas como adquiridas, estas últimas son las más frecuentes y afectan sobre todo a perros de razas grandes y gigantes mayores de 9 años3. En los perros de edad avanzada, la parálisis laríngea suele estar causada por una polineuropatía progresiva generalizada3. Presenta una incidencia de 2 a 3 veces superior en machos en comparación con hembras1.
Parálisis laríngea congénita
Se han identificado formas congénitas de parálisis laríngea asociadas a ciertas razas, como Boyero de Flandes, Husky siberiano, Bull terrier y Pastor alemán de pelaje blanco. En el caso del Boyero de Flandes, se ha descrito un patrón autosómico dominante que provoca alteraciones del núcleo ambiguo y degeneración de los nervios laríngeos recurrentes. En el Husky siberiano y Malamute de Alaska se sospecha de predisposición hereditaria, mientras que en el Husky de Alaska se sospecha de un patrón de herencia autosómico recesivo3.
Además, se ha relacionado polineuropatías juveniles hereditarias con aparición de parálisis laríngea en varias razas. En el caso del Rottweiler, el Black russian terrier y el Bóxer, se ha identificado polineuropatía degenerativa de inicio temprano que combina alteraciones oculares (como cataratas, miosis o microftalmia) con parálisis laríngea, de tal manera que se categoriza como un síndrome caracterizado por la coexistencia de ambas patologías5-7. Por otro lado, en razas como el Dálmata, Leonberger, Montaña de los Pirineos, Malamute de Alaska y Greyhound, se ha observado una polineuropatía degenerativa juvenil asociada a la parálisis laríngea, pero sin la presencia de las mencionadas alteraciones oftalmológicas. Asimismo, se ha descrito una polineuropatía de inicio temprano en el American Staffordshire terrier, caracterizada por debilidad locomotora y signos respiratorios, incluidos parálisis laríngea y, en raros casos, megaesófago. Esta enfermedad tiene una edad de presentación que oscila entre 1 y 6 meses en el 85 % de los casos estudiados. El pronóstico de esta patología en esta raza en particular es favorable en comparación con las razas anteriormente citadas, ya que la enfermedad presenta un curso más lento y los pacientes tienen una buena calidad de vida, sobre todo cuando se realiza tratamiento quirúrgico de la parálisis laríngea8.
Parálisis laríngea adquirida
En la mayoría de los casos, la etiología no puede ser identificada, por lo que la parálisis laríngea se clasifica como idiopática. Estudios recientes sugieren que esta forma adquirida puede ser una manifestación inicial de una polineuropatía progresiva generalizada, actualmente denominada GOLPP (por las siglas en inglés de geriatric-onset laryngeal paralysis polyneuropathy). Se ha observado que numerosos perros diagnosticados con parálisis laríngea adquirida idiopática desarrollan signos neurológicos sistémicos dentro del primer año posterior al diagnóstico, lo que es coherente con una neuropatía generalizada de carácter progresivo. Entre las primeras alteraciones observadas en la progresión de esta enfermedad, destaca la disfunción esofágica y el megaesófago9.
La parálisis laríngea adquirida es más común en Labrador retriever, aunque también afecta a Golden retriever, San Bernardos y Spaniel de Bretaña, entre otras razas. Las causas más frecuentes se deben al daño en los nervios laríngeos recurrentes o músculos laríngeos intrínsecos provocado por polineuropatías, traumatismos (como heridas penetrantes o estrangulamiento), traumatismos iatrogénicos quirúrgicos en cirugía cervical (tiroides, tráquea, cervical, torácica) o por presencia de masas intratorácicas o extratorácicas que afecten a la zona cervical.
Entre las principales etiologías descritas, se encuentran las endocrinopatías, las enfermedades inmunomediadas, las infecciones, las polimiopatías inflamatorias y el lupus eritematoso, cada una con características distintivas por lo que es necesario una evaluación clínica y diagnóstica3.Entre las endocrinopatías más comunes se encuentran el hipotiroidismo, y el hipoadrenocorticismo o enfermedad de Addison. Entre las enfermedades inmunomediadas destaca la miastenia gravis, caracterizada por la producción de autoanticuerpos contra los receptores de acetilcolina, lo que da lugar a una debilidad muscular progresiva. En el caso del lupus eritematoso sistémico, puede originar miositis y neuropatías secundarias debido al daño inflamatorio multisistémico. Las infecciones pueden causar patologías neuromusculares afectando los nervios periféricos y músculos, o a través de mecanismos inmunomediados. Por último, las polimiopatías inflamatorias, que engloban una variedad de enfermedades musculares inflamatorias de origen diverso, también conllevan debilidad muscular3.
Diagnóstico
Los perros con esta enfermedad suelen presentarse en fases tempranas con estridor, intolerancia al ejercicio, cambios en el ladrido y tos leve. La aparición de náuseas y arcadas es muy común, sobre todo cuando comen y beben. Estos síntomas en primeras fases de enfermedad son leves y suele darse en caso de parálisis unilateral. En casos graves, puede haber disnea, cianosis, síncope y disfagia, además de debilidad en las extremidades posteriores. La progresión clínica varía entre individuos, pero los síntomas tienden a empeorar con el ejercicio intenso o la exposición a altas temperaturas. Es frecuente que esta enfermedad pueda ser confundida con un golpe de calor por altas temperatura. Al inicio de la enfermedad suele ser habitual que sea unilateral1,3,4.
Para establecer el diagnóstico preciso, es imprescindible llevar a cabo un examen físico completo y exhaustivo. Destacamos la auscultación pulmonar para valorar si el paciente presenta neumonía o ruidos inspiratorios compatibles con obstrucción de vías respiratorias altas. A su vez, dado que estos pacientes suelen presentar comorbilidades, es imprescindible llevar a cabo pruebas diagnósticas adicionales para detectarlas previo a la realización de cualquier procedimiento3,4.
Es fundamental realizar una exploración neurológica completa, ya que los pacientes pueden presentar polineuropatías concomitantes. Esto incluye valorar la presencia de disfunción esofágica o megaesófago, que predisponen a neumonías por aspiración como consecuencia de la disfunción laríngea (se aconseja realizar radiografías torácicas simples y de contraste). Además, es importante valorar la atrofia muscular o signos neurológicos periféricos como déficits propioceptivos y reflejos espinales además de la evaluación de los pares craneales3,4.
Para descartar endocrinopatías, como el hipotiroidismo o el hipoadrenocorticismo que podrían estar relacionadas con el cuadro clínico, se recomienda realizar un hemograma y una bioquímica completa (que incluyan medición de iones sanguíneos), así como pruebas de funcionalidad endocrina (T4 y TSH, T4 libre por diálisis de equilibrio, estimulación con ACTH). La presencia de leucocitosis neutrofílica puede ser indicador de neumonía por aspiración. En casos que se sospeche de miastenia gravis se aconseja realizar análisis de anticuerpos para los receptores de acetilcolina3,4.
Los estudios radiológicos de tórax en estos pacientes permitirán confirmar o descartar la presencia neumonía y/o de megaesófago, como ya se ha mencionado. Además, en los casos más graves, puede producirse un edema pulmonar de origen no cardiogénico, secundario a la obstrucción de las vías respiratorias superiores. En razas predispuestas, debe considerarse el colapso traqueal, ya que se estima que más de un 33 % de los perros con parálisis laríngea también presentan esta enfermedad que puede observarse en una radiografía simple o en estudios dinámicos. La ecografía y/o la tomografía computarizada, puede ser de utilidad para complementar el diagnóstico en busca de otras comorbilidades asociadas3,4.
Para confirmar el diagnóstico de parálisis laríngea, la prueba de elección es la exploración mediante laringoscopía bajo sedación. Durante el procedimiento, se observa que los cartílagos aritenoides permanecen en posición paramediana durante la inspiración, lo que resulta en una obstrucción parcial de las vías respiratorias superiores. De forma adicional, se evalúan hallazgos secundarios como pueden ser la presencia de edema laríngeo y laxitud de las cuerdas vocales4. También se puede observar el movimiento paradójico de los cartílagos aritenoides. Este fenómeno ocurre durante la inspiración debido a la falta de tono muscular en los músculos laríngeos, originando un desplazamiento medial de los cartílagos aritenoides. Este desplazamiento se genera por la presión negativa intraglótica creada por el esfuerzo inspiratorio incrementado del paciente. Durante la espiración, los cartílagos regresan pasivamente a su posición original, lo que puede generar la falsa impresión de un movimiento normal de los aritenoides al ser evaluados1,4.
En lo que respecta al procedimiento anestésico usado para evaluar a un paciente que presenta una posible parálisis laríngeas bajo sedación se han propuesto distintos protocolos empleando diferentes agentes inductores como el propofol o la alfaxalona entre otros. Agentes como la alfaxalona se relacionan a una menor inhibición respiratoria que el propofol. Además, el uso de premedicación anestésica mejora significativamente la eficacia de la evaluación laríngea, independientemente del agente inductor utilizado. Por esta razón no se recomienda utilizar solo agentes inductores sin una premedicación previa, ya que esto podría afectar los resultados del diagnóstico y la estabilidad anestésica del paciente durante la evaluación de la laringoscopia3. Algunos estudios recomiendan la administración intravenosa de doxapram durante la evaluación de pacientes con sospecha de parálisis laríngea, ya que actúa estimulando el centro respiratorio, incrementando tanto el esfuerzo como la frecuencia respiratoria, lo cual favorece una mejor visualización de la movilidad laríngea y facilita el diagnóstico de la parálisis laríngea4,10. Debido a los riesgos de síncopes y posible edema pulmonar, los autores no utilizan este fármaco y utilizan de preferencia la evaluación bajo un plano anestésico muy superficial.
Tratamiento
Tratamiento médico. Manejo y estabilización de emergencia
En casos de obstrucción respiratoria aguda el manejo inicial incluye la administración de oxigenoterapia, corticosteroides (dexametasona 0.05-0.2 mg/kg/día IM, IV o SC cada 12 o 24 horas o prednisolona 0.5 mg/kg/12-24 h IM, IV o PO cada 24 horas) y sedantes con el objetivo de estabilizar al paciente y reducir la inflamación de las vías respiratorias superiores. Sin embargo, si estas medidas no logran mejorar la ventilación puede ser necesaria la realización de una traqueostomía temporal. Este procedimiento, aunque es eficaz en estas determinadas situaciones está asociado a un numerosas complicaciones importantes (hasta un 86 %) como obstrucción, desplazamiento del tubo o neumonía por aspiración11. En casos críticos, cuando la obstrucción compromete gravemente la ventilación y la oxigenación, se debe de considerar la intubación endotraqueal bajo anestesia general, lo que permite reducir la hipertermia del paciente (agudizada por la descompensación respiratoria), y mejorar la ventilación y oxigenación1.
En situaciones de urgencia, se han descrito otras técnicas alternativas como la lateralización percutánea del aritenoides, que permite mejorar de forma temporal la obstrucción laríngea en pacientes críticos12. Otra opción sería la utilización de stents laríngeos de forma temporal hasta que el paciente pueda ser intervenirse quirúrgicamente una vez estabilizado13,14.
En casos leves, normalmente parálisis unilaterales estables con mínima afectación respiratoria y sintomatología leve, los autores optan en ocasiones por un tratamiento médico conservador que evite las posibles complicaciones de la cirugía, revisiones periódicas y realizar cirugía una cuando los síntomas aumentan. Este enfoque incluye la pérdida de peso, reducción de situaciones estresantes, evitar la exposición a altas temperaturas y utilización puntual de antiinflamatorios para aliviar la inflamación laríngea. Aunque este manejo puede ser suficiente en etapas iniciales, en la mayoría de los pacientes los síntomas progresan, coincidiendo generalmente con la afectación bilateral, lo que requiere que se opte en esos casos por un tratamiento quirúrgico1,3,4.
Tratamiento quirúrgico
El tratamiento quirúrgico está indicado en pacientes con parálisis laríngea que presentan signos de disnea moderada a grave. El objetivo de la intervención quirúrgica es el de ensanchar la rima glottidis para reducir la resistencia de las vías respiratorias y mejor el flujo de aire a través de la laringe, minimizando al mismo tiempo el riesgo de aspiración de alimentos o saliva3. Se han descrito numerosas técnicas quirúrgicas como lateralización del cartílago aritenoideo, ya sea unilateral o bilateral (esta última únicamente utilizada en casos extremos debido al alto porcentaje de complicaciones asociadas), y las aritenoidectomías combinadas con cordectomía ventricular, que buscan mejorar la apertura de la rima glottidis. También se consideran otras técnicas como la traqueostomía permanente en casos graves, la reinervación laríngea para restaurar la función muscular, los stents laríngeos ya mencionados (como soporte temporal), y la lateralización aritenoidea mediante abordaje percutáneo1,3,4.
Lateralización unilateral cricoaritenoidea
Se considera el tratamiento de referencia para la parálisis laríngea, también denominada tie back, técnica que utilizan los autores. Esta técnica, consiste en realizar una lateralización del cartílago aritenoides para aumentar la rima glottidis. La realización bilateral se evita debido al aumento significativo del riesgo de complicaciones, sobre todo la neumonía por aspiración. Existen diferentes abordajes descritos para esta técnica; el abordaje lateral es el más frecuentemente utilizado, ya que resulta más sencillo en comparación con el abordaje ventral, y facilita una mejor visualización y acceso a las estructuras quirúrgicas implicadas1,4.
La colocación del paciente es importante desde el punto de vista técnico. Dado que la técnica implica el paso de la sutura desde el cricoides (caudal) hacia el proceso muscular del aritenoides (craneal), los cirujanos diestros prefieren ejecutarla en el lado izquierdo del paciente colocado en decúbito lateral derecho, ya que esta posición facilita el movimiento de la sutura de derecha a izquierda. Para optimizar el abordaje quirúrgico, resulta fundamental elevar el cuello del paciente utilizando toallas u otros soportes que proporcionen una posición más cómoda y estable durante el procedimiento. La realización de un protocolo quirúrgico sobre todo en zonas quirúrgicas complejas como es la laringe ofrece una mayor seguridad y obtención de buenos resultados1,3.
El procedimiento quirúrgico comienza con una incisión en la piel de aproximadamente 2-3 cm, ampliándose lo necesario para garantizar una buena visualización. Esta incisión se realiza caudal a la bifurcación de la vena yugular, ventral a esta, sobre el área correspondiente al borde dorsal del cartílago tiroides. A continuación, se disecciona el platisma cutáneo, avanzando craneal al músculo parotídeo auricular hasta la visualización del borde dorsal del cartílago tiroides. Se realiza una incisión en el borde dorsal del músculo tirofaríngeo, los autores recomiendan realizando una buena palpación para que la incisión sea lo más pequeña posible y evitar incidir el musculo cricofaríngeo y esófago. Posteriormente, se expone la región laríngea al desplazar lateralmente el cartílago tiroides. En esta etapa, algunos autores recomiendan colocar una sutura de tracción en el cartílago tiroides para facilitar la manipulación (Figura 1)1,3,4. En función de las preferencias del cirujano, se puede realizar la desarticulación cricotiroidea, los autores no la realizan ya que no suele ser necesaria y podría reducir la estabilidad laríngea, afectando el área de la rima glottidis. Para localizar correctamente el músculo cricoaritenoideo dorsal se debe bajar la mucosa, procurando no entrar en la luz de la laringe; en caso de entrar se puede realizar una sutura con material de pequeño calibre. La articulación cricoaritenoidea se debe de desarticular ligeramente y poder exponer las estructuras para realizar la sutura, aunque no es estrictamente necesaria. Con el mismo objetivo se puede reseccionar el músculo cricoaritenoideo dorsal, que suele estar atrofiado debido a la propia enfermedad (Figura 2), los autores consideran seccionarlo por la porción media, así se puede traccionar del mismo y evitar sujetar el cartílago aritenoides con la pinza que se puede dañar fácilmente.
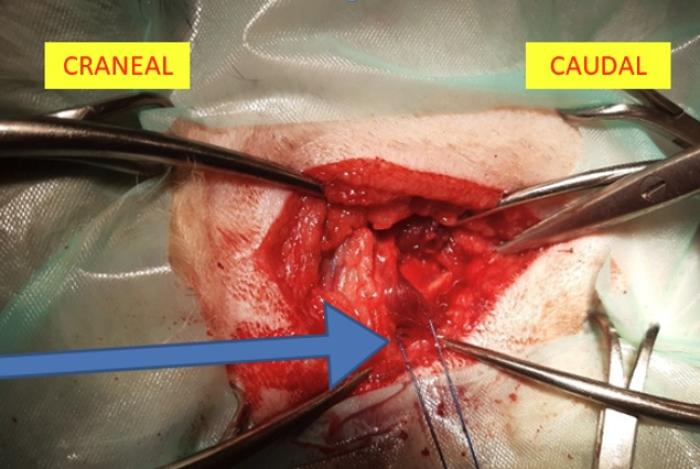
Figura 1. Colocación de sutura de tracción en el cartílago tiroides (imagen cortesía de Dr.Gustavo Ortiz Díez).
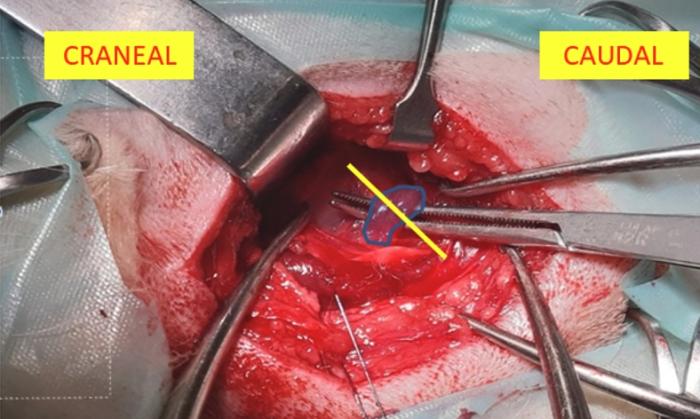
Figura 2. Localización del músculo aritenoideo dorsal (sombreado azul) e incisión del mismo mediante electrobisturí monopolar (dirección de la incisión marcado con línea amarilla (imagen cortesía del Dr.Gustavo Ortiz Díez).
La sutura utilizada es no absorbible con materiales como el propileno y con aguja tipo redonda otuppercut(punta redonda y cuerpo triangular, que facilita el paso de la sutura). Los autores prefieren latuppercutdebido a que con la aguja redonda puede ser difícil el paso de la sutura del cartílago cricoides por su gran dureza; se evita la aguja triangular debido a la fragilidad del cartílago aritenoides que podría dañarse con este tipo de aguja. La dirección de la sutura es clave, se debe pasar por el borde caudodorsal del cartílago cricoides (Figura 3), y dirigirse en dirección medio lateral por el proceso muscular del cartílago aritenoides, replicando así la función que realiza el músculo cricoaritenoideo dorsal. La sutura se anuda con nudo de cirujano o nudo corredizo, siendo el corredizo de elección por los autores gracias a que se puede aplicar una tensión correcta en una zona pequeña y de difícil manejo para anudar un nudo simple (Figura 4A-B).
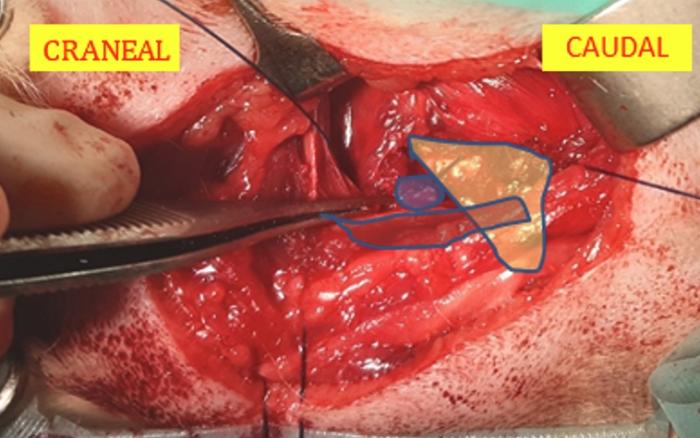
Figura 3. Paso de la sutura desde el borde caudodorsal del cartílago cricoides (en amarillo) hasta el proceso muscular del cartílago aritenoides (en azul) (se dispone en naranja el cartílago tiroides) (imagen cortesía del Dr. Gustavo Ortiz Díez).
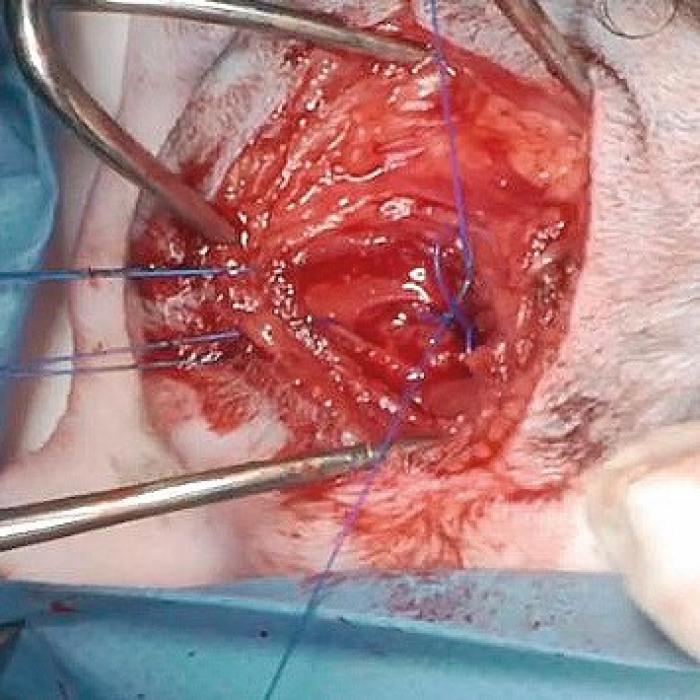
Figura 4A-B. Anudado de la sutura (imagen cortesía del Dr. Gustavo Ortiz Díez).
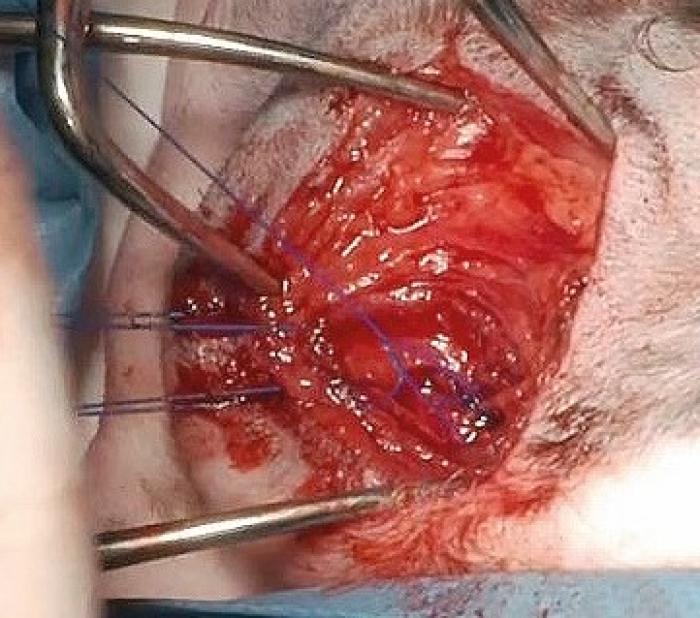
Algunos autores prefieren la utilización de dos suturas como la descrita anteriormente dispuestas en paralelo (Figura 5)1,3,4. Finalmente se realiza un cierre por planos empezando con el cierre del músculo tirofaríngeo con patrón simple o discontinuo con sutura reabsorbible 3/0 (p. ej.: polidioxanona). A continuación, se cierra con un patrón continuo (de preferencia) o discontinuo el platisma cutáneo, subcutáneo y piel.
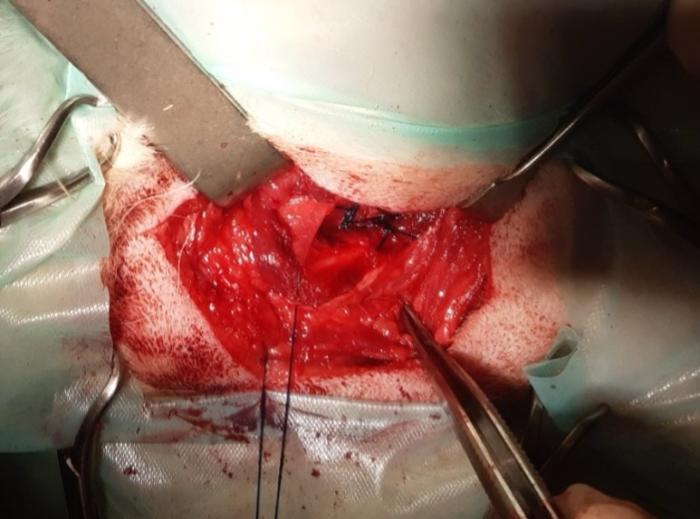
Figura 5. Dos suturas colocadas y puestas en paralelo (imagen cortesía del Dr. Gustavo Ortiz Díez).
Se deben considerar algunas recomendaciones prácticas y elementos fundamentales que favorecen la correcta ejecución de la técnica quirúrgica, con el objetivo de mejorar los resultados obtenidos. Conviene analizar una buena localización de la anatomía del abordaje estableciendo como lugar de incisión caudal a la división de la vena yugular en la rama linguofacial y maxilar, ventral a la vena yugular. En algunos estudios se considera la realización con un abordaje mínimamente invasivo ya sea mediante la incisión de únicamente un 25 % de la longitud del músculo tirofaríngeo junto a la no desarticulación cricotiroidea, pudiendo dejar intacto tanto el músculo cricoaritenoideo dorsal incluso del músculo cricofaríngeo18. La sutura de tracción del cartílago tiroides facilita la visualización durante la etapa del paso de la sutura entre cricoides y aritenoides, además también se recomienda tener en cuenta el tipo de sutura empleada (de preferencia tuppercut). En la mayoría de los casos se describe la realización de una única sutura cricoaritenoidea, los autores realizan una doble sutura paralela con la misma orientación que la indicada anteriormente como refuerzo. Además, los autores se ayudan del mango del bisturí o de un elevador del periostio colocado en la zona caudal del cricoides para elevarlo siendo más fácil la colocación de la sutura.
La tensión aplicada durante el cierre de la sutura es un elemento clave para lograr una lateralización adecuada del cartílago aritenoideo ya que permite ampliar el área de la rima glottidis sin dar lugar a una abducción excesiva que pueda aumentar el riesgo de neumonía por aspiración. Algunos estudios describen la posibilidad del uso de laringoscopia asistida durante el procedimiento quirúrgico en el momento de proceder a anudar las suturas15,16. Un estudio realizado en cadáveres, determinó que la tensión de la sutura juega un papel importante en la reducción de la presión de las vías respiratorias. Sin embargo, aunque la medición precisa de esta tensión es valiosa en un contexto experimental, su aplicación práctica en casos clínicos resulta poco viable17.
Otras intervenciones
Se han descrito otro tipo de intervenciones mínimamente invasivas para la lateralización del aritenoides. Entre ellas el abordaje percutáneo, este procedimiento se ha descrito en estudios cadavéricos, pero en estudios clínicos se ha observado como complicación mayor la inflamación laríngea y la baja duración de la apertura de la rima glottidis. Esta técnica podría considerarse para la estabilización ante una urgencia y posteriormente realizar otro tipo de cirugía como la lateralización cricoaritenoidea. Las investigaciones futuras deberían de centrarse en determinar el lugar óptico para colocar la sutura, para evitar estas complicaciones y valorar si es una opción válida de manera permanente12,19. Por otra parte, la colocación de stents laríngeos también se ha considerado en ciertos casos como método permanente en casos que el propietario no quería someter a una intervención quirúrgica, sin embargo, son necesarias futuras investigaciones para poder determinar su utilización. Actualmente son un método interesante a la hora de la estabilización urgente de los pacientes con sintomatología grave14.
Otro conjunto de intervenciones de uso menos frecuente son la realización de laringectomías. Dentro de este grupo destaca la realización de ventriculocordectomía bilateral, basada en la resección bilateral de cuerdas vocales, que puede realizarse junto a la resección de apófisis cuneiformes y corniculadas. El abordaje puede ser oral o mediante laringectomía ventral, siendo este último el más recomendado. Por otro lado, también cabe mencionar técnicas como la laringofisura encastillada, reinervación de musculatura laríngea y traqueostomía temporal/permanente1. Además, también se ha utilizado el láser diodo y CO2 para la realización de aritenoidectomías parciales1.
Complicaciones
Entre los factores preoperatorios que incrementan el riesgo de complicaciones a largo plazo se encuentran la disfunción esofágica preexistente, la progresión de signos neurológicos, la realización previa de una traqueostomía temporal, y la presencia de enfermedades neoplásicas3. Entre las complicaciones intraquirúrgicas se incluyen: hemorragia, laceración esofágica, laceración y/o fractura del cartílago. En el caso de la fractura o laceración de cartílago pequeña se debe valorar la realización de la cirugía en el lado contralateral, además de retirar el tejido desvitalizado o lacerado en caso de grandes defectos. Si se producen pequeñas laceraciones esofágicas, se deben suturar cuidadosamente20.
Otra de las posibles complicaciones descritas es el fracaso funcional de la cirugía de lateralización de aritenoides, ya sea por rotura del cartílago aritenoides o de la dehiscencia de sutura, la cual tiene un mayor riesgo de desarrollarse en torno a la 2ª y 3ª semana posquirúrgica4.
Complicaciones posoperatorias
Las principales complicaciones posoperatorias descritas incluyen la formación de seroma, la aparición de edema, y la presencia de tos y/o arcadas. También pueden persistir signos como disnea o estridor, así como alteraciones en la vocalización y el ladrido. En el 33 % de los casos los signos persisten entre ellos estridor y disnea1. Los cambios en la vocalización y el ladrido se consideran una secuela común tras la lateralización de aritenoides. Es clave informar a los tutores de forma previa sobre la posibilidad de que esta alteración ocurra, y que a su vez esta no requiere tratamiento específico y no afecta la calidad de vida del paciente. Principalmente se origina debido a las modificaciones morfológicas en las cuerdas vocales derivadas del procedimiento quirúrgico20.
Sin embargo, la complicación más peligrosa es el desarrollo de neumonía por aspiración, que representa un riesgo significativo para la salud del paciente y requiere una atención y manejo cuidadosos en el posoperatorio1,3. La neumonía por aspiración es considerada una de las complicaciones más relevantes, presente en torno a un 8 al 30 % según diferentes estudios.3,4,20 Se establece con mayor frecuencia durante las primeras semanas posquirúrgicas. Algunos de los factores de riesgo para desarrollar neumonía por aspiración son la existencia previa o posterior a la cirugía de megaesófago, la realización previa de traqueostomía temporal, y la administración de opioides posteriormente a la cirugía21. Los autores no consideran la utilización de los opioides para evitar el riesgo de neumonía por aspiración y evitan en la mayoría de los casos el hacer traqueostomías temporales, como ya se comentó con anterioridad. La preexistencia de neumonía por aspiración no se ha asociado como factor de riesgo. Existe controversia entre autores sobre la eficacia de la metoclopramida en la prevención de las neumonías por aspiración, debido a su efecto antiemético y procinético22. Los autores la utilizan debido a las pocas reacciones extrapiramidales, su bajo coste y fácil administración; a una dosis de 0.25-0.5 mg/kg/8 h de hidrocloruro de metoclopramida durante el primer mes.
Manejo ambulatorio
A la hora de plantear el alta hospitalaria del paciente, debe haber recuperado el reflejo de deglución. Según un estudio, el manejo ambulatorio de perros con parálisis laríngea tratados con lateralización unilateral electiva de aritenoides es un método adecuado para el manejo posoperatorio, sin diferencias en las tasas de complicaciones o mortalidad con respecto a pacientes hospitalizados23. Aun así, actualmente todavía se requieren estudios prospectivos adicionales con protocolos estandarizados de cirugía, sedación y antieméticos para establecer un protocolo más completo.
Tras la cirugía de parálisis laríngea, se recomienda a los tutores tomar ciertas precauciones para garantizar el bienestar del paciente. Es importante evitar el uso de collares y optar por un arnés, ya que esto previene la presión en el cuello y reduce el riesgo de complicaciones. La alimentación debe adaptarse, evitar alimentos secos o polvorientos que puedan ser más propensos a ser aspirados. Se aconseja ofrecer comida húmeda moldeada en forma de albóndigas para facilitar la deglución, en especial durante las primeras 2 a 4 semanas posteriores a la cirugía, ya que se ha observado que este tipo de dieta podría ayudar a minimizar el riesgo de neumonía por aspiración, e incluso esta pauta alimenticia puede adoptarse como una medida a largo plazo, dado que el riesgo de neumonía por aspiración puede mantenerse de por vida. En caso de tener acceso exclusivamente a pienso es recomendable evitar los piensos con exceso de polvo, o valorar la posibilidad de gelificar el alimento.
Además, es fundamental proteger al animal del estrés térmico, evitando la exposición a altas temperaturas, ya que los pacientes sometidos a cirugía de lateralización aún presentan cierto grado de compromiso en las vías respiratorias superiores. Por último, se debe vigilar al animal de manera continua para detectar cualquier signo de neumonía por aspiración, tomando medidas rápidas en caso de ser necesario. Estas recomendaciones son esenciales para reducir riesgos y favorecer una recuperación óptima.
Pronóstico
En torno al 90 % de los tutores ven incrementada la calidad de vida a lo largo del primer año tras la cirugía. Las tasas de supervivencia a 1 año son de 93.6 %, a 2 años de 89.1 %, a 3 años de 84.4 % y a 4 años de 75.2 %. En los perros que desarrollaron neumonía por aspiración la tasa de supervivencia fue en un periodo de 1 año de 83.1 %, en 2 años 63.7 %, en 3 años 51.5 % y en 4 años 25.8 %3. A su vez, se debe tener en cuenta, que una gran parte de los pacientes (alrededor de un 70 %) desarrollan signos neurológicos al año de ser diagnosticado de parálisis laríngea9.
Conclusiones
La parálisis laríngea, en particular en su forma adquirida, puede representar una manifestación de una enfermedad neurológica sistémica subyacente. Su diagnóstico y tratamiento requieren un enfoque multidisciplinario, orientado a mejorar tanto el pronóstico como la calidad de vida del animal afectado. Entre las técnicas quirúrgicas descritas, la lateralización unilateral de aritenoides izquierdo, se considera la técnica de elección en la mayoría de los casos, ya que permite lograr una apertura adecuada de la rima glotis para mejorar el flujo de aire, y minimiza al mismo tiempo el riesgo de neumonía por aspiración. Además, la estabilización del paciente de forma previa al procedimiento y un manejo postoperatorio cuidadoso con unas correctas pautas alimentarias son aspectos fundamentales para alcanzar los mejores resultados clínicos y reducir las complicaciones asociadas.
Bibliografía
- Monnet E, Tobias KM. Larynx. In: Tobias KM, Johnston SA, editors. Veterinary surgery small animal. St. Louis (MO): Elsevier; 2012. p. 1724.
- Hermanson, J.W, de Lahunta, A. (2021). Millers anatomy of the dog (5a ed.) Saunders.
- MacPhail C. M. (2020). Laryngeal Disease in Dogs and Cats: An Update. The Veterinary clinics of North America. Small animal practice, 50(2), 295–310.
- Monnet E. (2016). Surgical Treatment of Laryngeal Paralysis. The Veterinary clinics of North America. Small animal practice, 46(4), 709–717.
- Mahony, O. M., Knowles, K. E., Braund, K. G., Averill, D. R., Jr, & Frimberger, A. E. (1998). Laryngeal paralysis-polyneuropathy complex in young Rottweilers. Journal of veterinary internal medicine, 12(5), 330–337.
- Mhlanga-Mutangadura, T., Johnson, G. S., Schnabel, R. D., Taylor, J. F., Johnson, G. C., Katz, M. L., Shelton, G. D., Lever, T. E., Giuliano, E., Granger, N., Shomper, J., & O'Brien, D. P. (2016). A mutation in the Warburg syndrome gene, RAB3GAP1, causes a similar syndrome with polyneuropathy and neuronal vacuolation in Black Russian Terrier dogs. Neurobiology of disease, 86, 75–85.
- Mhlanga-Mutangadura, T., Johnson, G. S., Ashwini, A., Shelton, G. D., Wennogle, S. A., Johnson, G. C., Kuroki, K., & O'Brien, D. P. (2016). A Homozygous RAB3GAP1:c.743delC Mutation in Rottweilers with Neuronal Vacuolation and Spinocerebellar Degeneration. Journal of veterinary internal medicine, 30(3), 813–818.
- Vandenberghe, H., Escriou, C., Rosati, M., Porcarelli, L., Recio Caride, A., Añor, S., Gandini, G., Corlazzoli, D., Thibaud, J. L., Matiasek, K., & Blot, S. (2018). Juvenile-onset polyneuropathy in American Staffordshire Terriers. Journal of veterinary internal medicine, 32(6), 2003–2012.
- Stanley, B. J., Hauptman, J. G., Fritz, M. C., Rosenstein, D. S., & Kinns, J. (2010). Esophageal dysfunction in dogs with idiopathic laryngeal paralysis: a controlled cohort study. Veterinary surgery : VS, 39(2), 139–149.
- Radkey, D. I., Hardie, R. J., & Smith, L. J. (2018). Comparison of the effects of alfaxalone and propofol with acepromazine, butorphanol and/or doxapram on laryngeal motion and quality of examination in dogs. Veterinary anaesthesia and analgesia, 45(3), 241–249.
- Nicholson, I., & Baines, S. (2012). Complications associated with temporary tracheostomy tubes in 42 dogs (1998 to 2007). The Journal of small animal practice, 53(2), 108–114.
- Hardie R. J. (2016). Translaryngeal percutaneous arytenoid lateralization technique in a canine cadaveric study. Journal of veterinary emergency and critical care (San Antonio, Tex. : 2001), 26(5), 659–663. https://doi.org/10.1111/vec.12514
- Ricart, M. C., Rodríguez, S. M., & Duré, R. M. (2020). Laryngeal stent for acute and chronic respiratory distress in seven dogs with laryngeal paralysis. Open veterinary journal, 10(1), 4–10.
- Théron, M. L., & Lahuerta-Smith, T. (2022). Laryngeal silicone stent as a treatment option for laryngeal paralysis in dogs: a preliminary study of 6 cases. Journal of veterinary science, 23(4), e58.
- Weinstein, J., & Weisman, D. (2010). Intraoperative evaluation of the larynx following unilateral arytenoid lateralization for acquired idiopathic laryngeal paralysis in dogs. Journal of the American Animal Hospital Association, 46(4), 241–248.
- Cuddy, L. C., Case, J. B., Ellison, G. W., & Covey, J. L. (2013). Video-assisted unilateral cricoarytenoid laryngoplasty in 14 dogs with bilateral idiopathic laryngeal paralysis. The veterinary quarterly, 33(4), 181–185.
- Wignall, J. R., & Baines, S. J. (2012). Effects of unilateral arytenoid lateralization technique and suture tension on airway pressure in the larynx of canine cadavers. American journal of veterinary research, 73(6), 917–924.
- Von Pfeil, D. J., Edwards, M. R., & Déjardin, L. M. (2014). Less invasive unilateral arytenoid lateralization: a modified technique for treatment of idiopathic laryngeal paralysis in dogs: technique description and outcome. Veterinary surgery : VS, 43(6), 704–711.
- Sample, S. J., Hardie, R. J., Stein, J., & Webb, J. (2018). Evaluation of Translaryngeal Percutaneous Arytenoid Lateralization (TPAL) in dogs with experimentally created laryngeal paralysis. Research in veterinary science, 117, 239–245.
- Griffon, D. J., & Hamaide, A. (Eds.). (2016). Complications in Small Animal Surgery. 178-184.
- Wilson, D., & Monnet, E. (2016). Risk factors for the development of aspiration pneumonia after unilateral arytenoid lateralization in dogs with laryngeal paralysis: 232 cases (1987-2012). Journal of the American Veterinary Medical Association, 248(2), 188–194.
- Kempf, J., Lewis, F., Reusch, C. E., & Kook, P. H. (2014). High-resolution manometric evaluation of the effects of cisapride and metoclopramide hydrochloride administered orally on lower esophageal sphincter pressure in awake dogs.American journal of veterinary research,75(4), 361–366. https://doi.org/10.2460/ajvr.75.4.361
- Shubert, M. P., & Ganjei, J. B. (2023). Outcome following elective unilateral arytenoid lateralization performed in an outpatient manner is comparable to hospitalization for dogs with laryngeal paralysis. Journal of the American Veterinary Medical Association, 261(9), 1–6.
 by Multimédica
by Multimédica
