La reanimación hipotensiva en el manejo del 11 hemoperitoneo agudo no traumático en perros debido a neoplasia esplénica. Caso clínico
Resumen breve
El hemoperitoneo o hemoadomen, como también se le conoce comúnmente en la literatura médica, se define como la acumulación patológica de sangre en la cavidad peritoneal. El hemoadomen agudo no traumático debido a la ruptura de una masa esplénica de origen vascular (p. ej., hemangiosarcoma) es una presentación relativamente común en pacientes caninos de mediana edad y geriátricos1. Clínicamente, muchos de estos pacientes se presentan con colapso circulatorio como resultado de una hipovolemia…Índice de contenidos

Introducción
El hemoperitoneo o hemoadomen, como también se le conoce comúnmente en la literatura médica, se define como la acumulación patológica de sangre en la cavidad peritoneal. El hemoadomen agudo no traumático debido a la ruptura de una masa esplénica de origen vascular (p. ej., hemangiosarcoma) es una presentación relativamente común en pacientes caninos de mediana edad y geriátricos1. Clínicamente, muchos de estos pacientes se presentan con colapso circulatorio como resultado de una hipovolemia severa que conduce a un shock cardiovascular. Esta cascada de eventos invariablemente puede resultar fatal para el paciente si no se toman las medidas oportunas y apropiadas2. Por lo tanto, la estabilización prequirúrgica de estos pacientes es de suma importancia para mantener una perfusión y oxigenación tisular adecuada y por consiguiente un desempeño quirúrgico exitoso3,4.
La reanimación hipotensiva es un término utilizado para describir la administración de cantidades relativamente pequeñas de fluidos a pacientes con hemorragia confirmada o presuntiva para mantener una presión arterial normal baja y así evitar la exacerbación de la misma. Este informe clínico describe el uso de estrategias de reanimación hipotensiva en el manejo del sangrado abdominal continuo debido a la ruptura de una neoplasia.
Caso clínico
Historia
Se presenta en nuestra consulta una paciente canina de raza Cocker Spaniel de 8 años de edad, hembra, castrada, de 16 kg de peso corporal, colapsada y con una distensión abdominal muy marcada.
Evaluación y estabilización inicial de la paciente
Evaluación primaria y examen clínico:
En la encuesta inicial se realizó una evaluación por sistemas y órganos principales. El paciente parecía estar consciente y respirando espontáneamente aunque no ambulatorio. Las mucosas estaban pálidas y el tiempo de llenado capilar (TLLC) prolongado a 3 segundos. Los pulsos femorales eran débiles y los pulsos metatarsianos estaban completamente ausentes. Una vez que se estableció que el paciente estaba razonablemente estable y se administró oxígeno por flujo, se realizó el resto del examen físico. La auscultación cardíaca reveló taquicardia con una frecuencia cardíaca (FC) de 180 latidos por minuto. La auscultación pulmonar fue normal con una frecuencia respiratoria (RR) normal de 30 respiraciones por minuto y sin ruidos respiratorios anormales en los pulmones. A la palpación, el abdomen estaba distendido y la percusión abdominal reveló una onda de líquido distintiva. La presencia o ausencia de masas intraabdominales fue difícil de evaluar solo por palpación debido a la gran cantidad de líquido. La temperatura rectal estaba dentro del rango normal de 38,2 centígrados Celsius. En este punto se realizó una venopunción yugular y se extrajo sangre para una base de datos mínima que incluye sangre para un hemograma completo y un perfil bioquímico (Tabla 1). También se realizó una paracentesis abdominal eco guiada.
Diagnóstico
Los diferenciales más comunes para el sangrado intraperitoneal no relacionado con trauma en el perro incluyen: ruptura neoplásica, torsión esplénica (Figura 1) o hepática y trastornos de la coagulación10. Sin embargo, en base a los hallazgos clínicos, la historia y los signos, el diagnóstico presuntivo parecía favorecer ruptura de neoplasia.
| Tabla 1. Tabla 1. Hemograma y perfil bioquímico. |
| Parámetros | Valores | Unidad | Rango |
| Leucocitos totales | 35.0 Elevado | x109/l | 6.0-15.0 |
| Hemoglobina | 9.9 | g/dl | 12.0-18.0 |
| HCT | 30.5 | % | 37.0-55.0 |
| MCHC | 32.5 | g/dl | 30.0-36.9 |
| Granulocitos | 32.4 Elevado | x109/l | 3.3-12.0 |
| L/M | 2.6 | x109/l | 1.1-6.3 |
| Plaquetas | 172 Bajo | x109/l | 175-500 |
| Calcio | 2.52 | mmol/l | 1.98-300 |
| Proteínas totales | 50.0 | g/l | 54.0-77.0 |
| Albúmina | 31.0 | g/l | 22.0-39.0 |
| Globulinas | 24.0 | g/l | 25.0-45.0 |
| Fósforo | 1.48 | mmol/l | 0.81-2.19 |
| Urea | 5.0 | mmol/l | 2.5-9.6 |
| Creatinina | 94 | umol/l | 44-159 |
| Bilirrubina total | 2.0 | umol/l | 0.0-15.0 |
| ALP 23-212 | 50 | u/l | 23-212 |
| ALT 10-100 | 23 | u/l | 10-100 |
| Ácidos biliares | 8.0 | umol/l | 0.0-10.0 |
| Colesterol | 5.56 | mmol/l | 2.84-8.27 |
| Amilasa | 1342 | u/l | 500-1500 |
| Glucosa | 6.53 | mmol/l | 3.89-7.94 |
| Grupo sanguíneo | DEA 1.1 Positivo | ||
La base de datos inicial muestra un hematocrito (HCT) bajo de 30,5 % (37,0-55,0) con una concentración de hemoglobina baja de 9,9 g/dl (12,0-18,0) y sólidos totales (TS) de 50 g/l (52,0- 82,0). El recuento de plaquetas se redujo ligeramente a 172 x 109 (175-500), sin embargo, parecía normal en la evaluación del frotis de sangre. Además, el recuento de glóbulos blancos se eleva a 35 x 109/l (6,9-16,9). Es más probable que este aumento se deba a una inflamación leve, malignidad o hemorragia en lugar de una infección per se, ya que no hubo evidencia de toxicidad o desviación a la izquierda en la evaluación del frotis de sangre periférica.
Aparentemente, se aspiró un líquido sanguíneo seroso por paracentesis abdominal. El líquido mostró un HCT de 40 % y TS de 42 %. Estos resultados apoyaron el diagnóstico presuntivo de hemoperitoneo.
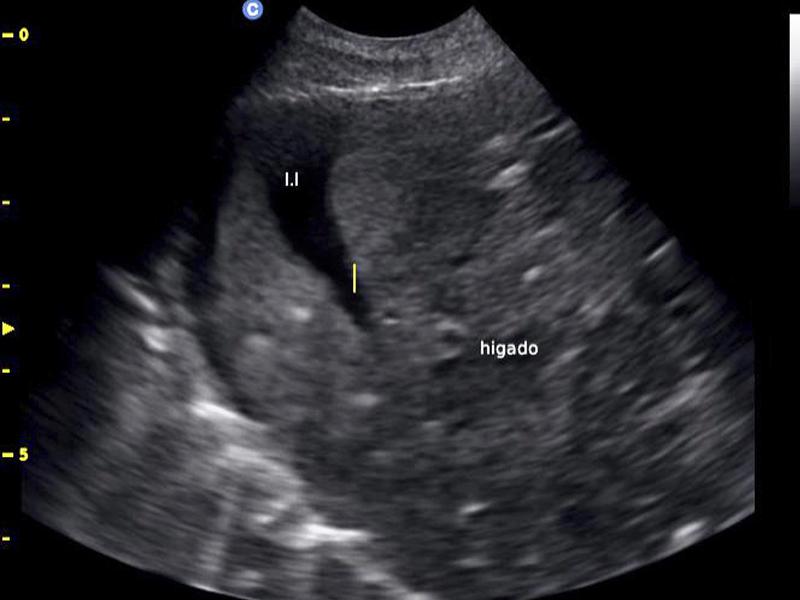
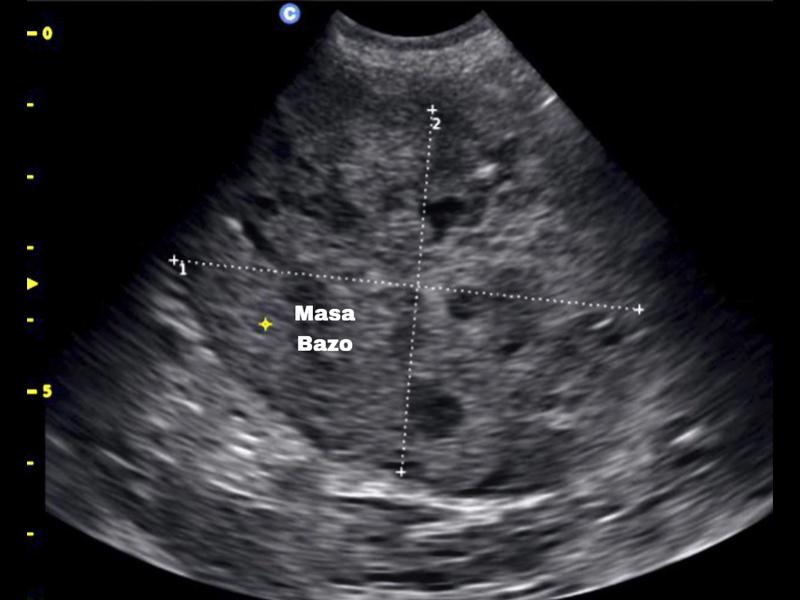
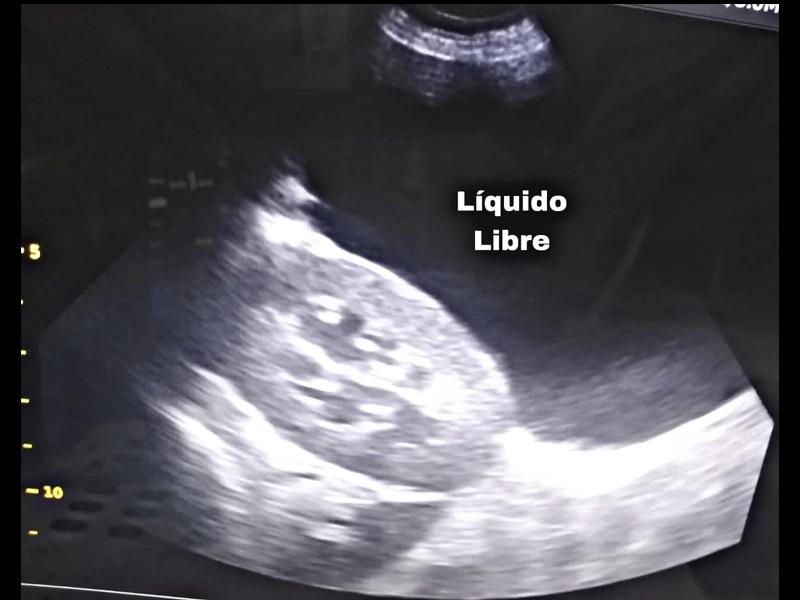
Se indicó una evaluación de la coagulación principalmente para descartar toxicidades por rodenticidas como la causa del sangrado abdominal, pero también para anticipar cualquier contraindicación para la cirugía. Esto se logró mediante la realización de una prueba de tiempo de coagulación de sangre total (WBCT) y la interpretación de un frotis de sangre periférica. El WBCT se realizó agregando 1 ml de sangre completa a 2 tubos de vidrio que se inclinaron suavemente cada 30 segundos hasta que se formó un coágulo. El tiempo medio de coagulación fue normal a los cuatro minutos y medio. Tanto el número de leucocitos como el de trombocitos parecían adecuados en la evaluación del frotis de sangre periférica. Dado que no se observó evidencia de coagulopatía en estas pruebas, no se indicó un estudio de coagulación más completo. Los resultados completos de CBC y bioquímica se encuentran en la tabla 1.Se estableció el diagnóstico definitivo de hemoperitoneo por rotura de neoplasia mediante evaluación ecográfica abdominal. El examen ultrasónico reveló una gran cantidad de líquido peritoneal libre anecoico con una neoplasia distintiva que se originaba en el bazo (Figuras 2-5).
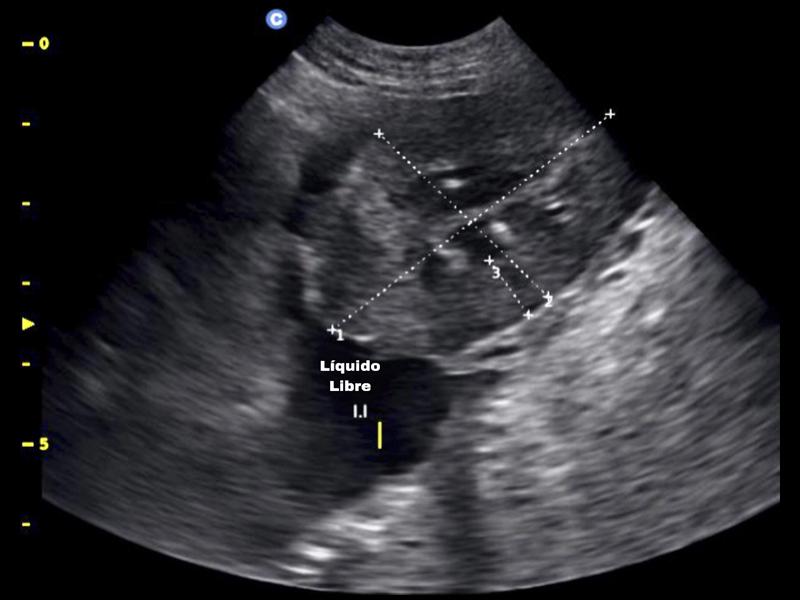

Estabilización prequirúrgica
Como la evaluación inicial mostró signos de hipoperfusión sistémica, se requirieron acciones inmediatas para brindar apoyo circulatorio antes de realizar más diagnósticos. La estabilización del paciente incluyó suplemento de oxígeno por mascarilla. Se estableció un acceso vascular funcional mediante la colocación de un catéter sobre aguja calibre 19 (catéter radiopaco Jelko®: Smith Medicals) en ambas venas cefálicas. Inicialmente, se administró un bolo de 410 ml de solución de Hartmann (Aqupharm® 11: Animalcare Ltd) y 205 ml de hidroxietilalmidón (Hemohes 6 % Ecobag®: B. Braun Melsungen AG). A esto le siguió una infusión de solución de Hartmann a una velocidad de 2 ml/kg/h y Hemohes a una velocidad de infusión continua de 1 ml/kg/h. La analgesia inicial se proporcionó mediante una inyección intramuscular de 20,5 mg de sulfato de morfina (sulfato de morfina BP 10 mg/ml: Martindale Pharmaceuticals-0,5 mg/kg). El monitoreo incluyó la medición frecuente de la frecuencia cardiaca (FC), frecuencia respiratoria (FR), color de las membranas mucosas (MM), tiempo de llenado capilar (TLLC) y la presión arterial.
Cirugía
Para asegurar un diagnóstico de tejido y para detener la hemorragia en curso, se recomendó una cirugía exploratoria. La inducción anestésica se logró con midazolan (hipnovel® 10 mg/2 ml Roche Products Ltd- 0,2 mg/kg) seguida 20 segundos después de una inyección intravenosa lenta de propofol (Propoclear® Injection 10 mg/ml: Fort Dodge Animal Health-5 mg/kg) titulado y por efecto. La anestesia general se mantuvo con isoflurano (Isocare™: Animalcare Ltd) en oxígeno, administrado a través de un tubo endotraqueal con manguito de 18,6 mm en un circuito circular. Se administró amoxicilina-ácido clavulánico (Augmentin®: GlaxoSmithKline 20 mg/kg IV) antes de la inducción y se repitió cada dos horas en el intraoperatorio.
Se colocó al paciente en decúbito dorsal y se rasuró el abdomen con una hoja de cuchilla número 40 para realizar una laparotomía exploratoria de rutina. La piel se preparó asépticamente usando clorhexidina al 4% (Hibiscrub™: Regent Medical).
Luego se realizó una incisión abdominal en la línea media ventral desde el cartílago xifoides hasta el pubis para una exploración abdominal completa, pero sin penetrar el peritoneo. Una incisión punzante suficiente para colocar una sonda de succión de tipo poole fue introducida para evacuar el contenido abdominal y evitar derrame y una descompensación del paciente. Una vez logrado esto, la celiotomía fue completada con amputación del ligamento falciforme y esponjas de laparotomía fueron colocadas en la pared abdominal para proteger la misma de daños por la colocación de los separadores autoestáticos de tipo Balfour (Figura 6).
Durante la exploración se encontró una masa abdominal que cubría al menos las tres cuartas partes del bazo con numerosas adherencias omentales y neovascularización activa (Figura 7). En un intento por extirpar el bazo lo más rápido posible, se identificaron la arteria y la vena esplénicas, se pinzaron y se sujetaron con clipadoras de tipo hemoclip medium large (Surgical clip Applier Hemoclip, Weck) cuidando que el páncreas no se incluyera inadvertidamente en la clipadura. Posteriormente, los vasos gastroepiploico izquierdo y los vasos gástricos cortos se identificaron cerca del fondo del estómago, se pinzaron y se cliparon doblemente como se describió anteriormente. A continuación, se colocaron pinzas hemostáticas de Kelly a través del epiplón para incidir entre ellas y extraer rápidamente el bazo. Todos los vasos omentales significativos restantes se ligaron finalmente y se rompieron las adherencias. Una vez controlada la hemorragia se realizó lavado de abdomen y última exploración abdominal. El cierre abdominal fue rutinario. La línea alba se cerró con patrón continuo simple utilizando un monofilamento sintético absorbible, polidioxanona (PDS®II: Ethicon, Johnson & Johnson Intl). La piel se cerró con grapas utilizando una grapadora de piel desechable (Precise TM Vista Skin Stapler: 3M Health Care D41453Neuss, Alemania). El paciente se recuperó de la cirugía sin incidentes y fue trasladado a la unidad de cuidados intensivos para un mayor control y estabilización.
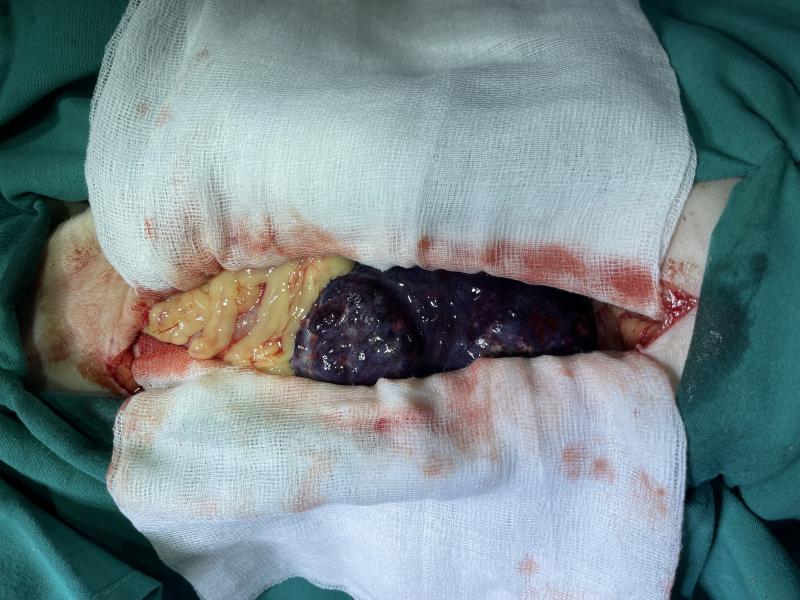
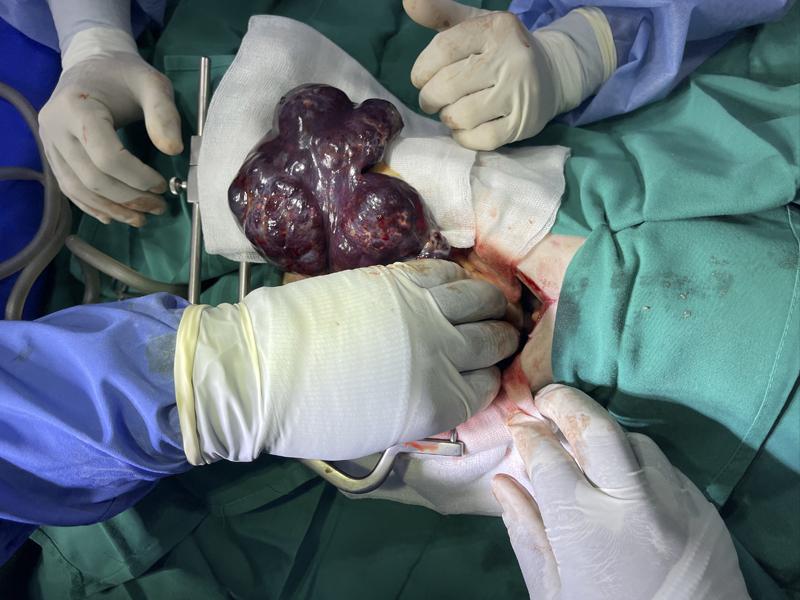
Estabilización post cirugía
En el postoperatorio inmediato el paciente se encontraba hipotenso con una presión arterial sistólica de 59 mmHg. Las membranas mucosas estaban pálidas y el TLLC de 2 segundos y los pulsos femoral y metatarsiano estaban ausentes. El HCT fue del 14 % y la frecuencia cardiaca de 180 latidos por minuto. Se requirió una transfusión de sangre para brindar apoyo circulatorio y mejorar la capacidad de transporte de oxígeno. La presencia de hipovolemia sin evidencia de cogulopatía concurrente hizo que los glóbulos rojos concentrados fueran ideales para este propósito. Se extrajo sangre y se realizó la tipificación sanguínea utilizando un kit de tipificación canina Alvedia (Alvedia DME: Alice Veterinary Diagnostics, Lyon, Francia). El tipo de sangre era DEA1.1 Positivo. La transfusión se inició lentamente usando concentrados de glóbulos rojos caninos (BCP0003 PRBC DEA1.1-POSITIVO: Pet Blood BankServices Ltd) simultáneamente con una infusión intravenosa de cloruro de sodio al 0,9 % (Aquapharm® 1: Animalcare Ltd) a través del equipo de administración de sangre “Y” en una tasa de 80 ml/h. En las primeras 2 horas, el paciente fue monitoreado de cerca para detectar reacciones a la transfusión.
No se documentó ninguna reacción durante la administración de sangre y se observó una mejora lenta pero progresiva en todos los signos vitales y la presión arterial (Tabla 2).
| Tabla 2. Monitoreo de la transfusión sanguínea en el tiempo. |
| Parámetros | Pre-Tx | 10 min | 20 min | 30 min | 1 hr | 2hr | 3hr | 4hr |
| Ritmo (ml/hr) | 80 ml/ L | 80 ml/ L | 80 ml/ L | 80 ml/ L | 80 ml/ L | 120ml/L | 120ml/L | 60ml/L |
| Color MM | Pálidas | Pálidas | Pálidas | Rosadas | Rosadas | Rosadas | Rosadas | Rosadas |
| Temperatura Celsius | 36.3 | 35.7 | 35.8 | 36.2 | 36.5 | 37.2 | 37.5 | 38.1 |
| Presión arterial sistólica | 59 | 68 | 74 | 78 | 91 | 91 | 100 | 120 |
| SPO2 | 94 % | 97 % | 99 % | - | 99 % | - | - | - |
| PCV | 14 % | - | - | - | - | - | - | 27 % |
| Pulso / min | 180 | 152 | 158 | 142 | 136 | 140 | 140 | 142 |
Se logró una mayor analgesia postoperatoria con la administración intramuscular de 20 mcg/kg de buprenorfina (inyección multidosis Vetergesic®: Alstoe Animal Health) cada 8 horas. Después de 24 horas el paciente se recuperó sin incidentes y fue dado de alta a su domicilio.
Discusión
Desde principios de los años 70, el uso de reanimación agresiva con fluidos, seguida de cirugía rápida para el manejo de pacientes humanos hipovolémicos con trauma, ha sido una práctica estándar1,2.
Por muchos años esta práctica se ha extrapolado y adoptado a nuestros pacientes veterinarios. En la actualidad, no hay ensayos clínicos controlados publicados en la literatura que respalden la efectividad de la reanimación hídrica agresiva temprana en el sentido de que se basa en modelos experimentales tempranos que no se aproximan al paciente que sangra activamente. Por otro lado, algunos autores creen firmemente que la administración de grandes volúmenes de fluidos intravenosos puede tener efectos perjudiciales sobre el estado hemostático de los pacientes con hemorragia1,2. Esto parece deberse al hecho de que algunos pacientes desarrollan una coagulopatía por dilución que invariablemente exacerba la hemorragia5. Además, la administración agresiva de fluidos dará como resultado un aumento de la presión de perfusión mientras disminuye la viscosidad de la sangre, lo que lleva al desalojo de los coágulos de sangre formados previamente.
La estrategia de resucitación hipotensiva busca un balance entre el soporte circulatorio requerido para mantener funcionando los órganos principales y la necesidad de disminuir el riesgo de una elevación precipitada de la presión hidrostática intravascular, previniendo así la disrupción de coágulos a priory6. En resumen, mediante un manejo cuidadoso de los fluidos (principalmente cristaloides y coloides)7, el clínico busca mantener una presión arterial media entre 60 y 70 mmHg. A esta presión arterial el flujo renal y cerebral son mantenidos por autorregulación siempre y cuando no haya trauma concurrente en el aparato renal o cerebro.
Los estudios experimentales en animales han demostrado un aumento en la supervivencia cuando se emplearon estrategias de fluidos de reanimación hipotensiva7. Por ejemplo, Mapstone y colaboradores llevaron a cabo una revisión sistemática de 9 ensayos con modelos animales de hemorragia no controlada que compararon la reanimación hipotensiva con los métodos tradicionales de reanimación8. Este concluyó que la reanimación hipotensiva reduce el riesgo de muerte en todos los estudios evaluados. Un estudio anterior sugiere que la reanimación hipotensiva se puede mantener hasta 2 horas en perros antes de que se produzcan daños irreversibles en los órganos9.
Conclusión
Este informe clínico parece corroborar que las estrategias de fluidoterapia de reanimación hipotensiva se pueden utilizar con éxito en el tratamiento de la hemorragia incontrolada en curso debido a la ruptura de una neoplasia. Inicialmente, los cristaloides y los coloides son los expansores de volumen de elección, mientras que la sangre y los productos sanguíneos se reservan para los pacientes con mayor inestabilidad hemodinámica.
Bibliografia
- Aronshn MG, Dubiel B, Roberts B, Powers BE. Prognosis for acute nontraumatic hemoperitoneum in the dog: a retrospective analysis of 60 cases (2003-2006).J Am Anim Hosp Assoc. 2009 Mar-Apr; 45(2):72-7.
- Herold LV, Devey JJ, Kirby R, et al. Clinical evaluation, and management of hemoperitoneum in dogs. J Vet Emerg Crit Care 2008;18(1):40-53.
- Hall K, Drobatz K. Volume Resuscitation in the Acutely Hemorrhaging Patient: Historic Use to Current Applications. Front Vet Sci. 2021 Jul 29;8:638104
- Hatoum O, Bashenko, Y, Hirsh M, et al. Continuous fluid resuscitation and splenectomy for treatment of uncontrolled hemorrhagic shock after massive splenic injury. J Trauma 2002;52(2):253-257.
- Thompson P, Strandenes G. The history of fluid resuscitation for bleeding. In: Spinella P, editor. Damage Control Resuscitation. Cham: Springer; (2020).
- Abelson AL, O'Toole TE, Johnston A, Respess M, de Laforcade AM. Hypoperfusion and acute traumatic coagulopathy in severely traumatized canine patients. J Vet Emerg Crit Care. (2013) 23:395
- Varela JE, Cohn SM, Diaz I, et al. Splanchnic perfusion during delayed, hypotensive, or aggressive fluid resuscitation from uncontrolled hemorrhage. Shock 2003;20(5):476-480.
- Rudloff E, Kirby R. Colloid and crystalloid resuscitation. Vet Clin North Am Small Anim Pract 2001;31(6):1207-1229.
- Mapstone J, Roberts I, Evans P. Fluid resuscitation strategies: a systematic review of animal trials. J Trauma 2003;55(3):571-589.
- Roche-e-Silva M, Poli de Figueiredo LF. Small volume hypertonic resuscitation of circulatory shock. Clinics (Sao Paulo)2005;60(2):159-172.
 by Multimédica
by Multimédica